ส่วนผสมของแก๊ส ความจุความร้อนของก๊าซ เชื้อเพลิง ส่วนผสมของก๊าซ และความจุความร้อน
1.3. สมการก๊าซในอุดมคติของสถานะ
รูปแบบของสมการสถานะ (1.1) สำหรับสารจริงค่อนข้างซับซ้อน
ในเรื่องนี้ แบบจำลองทางกายภาพแบบง่ายของชิ้นงานที่ใช้ในอุณหพลศาสตร์
สำหรับของไหลทำงานในสถานะก๊าซ รุ่นแรกที่ง่ายที่สุดและเป็นในอดีตคือ ก๊าซในอุดมคติ. ก๊าซในอุดมคติคือก๊าซที่ไม่มีแรงของปฏิสัมพันธ์ระหว่างโมเลกุล (แรงดึงดูดและแรงผลัก) และโมเลกุลเองก็ถูกพิจารณาว่า จุดวัสดุ. ก๊าซในอุดมคติเชื่อฟัง สมการไคลเปอรอง– เมนเดเลเยฟ
ที่ไหน มคือมวลของก๊าซในระบบ μ คือมวลโมลาร์ของก๊าซ Rμ = 8314 J/(kmol K) คือค่าคงที่ของแก๊สสากล ซึ่งไม่ขึ้นกับชนิดของก๊าซหรือเงื่อนไขของการมีอยู่ของมัน สมการสถานะ (1.2) ได้มาจากการรวมกัน กฎหมายบอยล์-มาริออตต์และ เกย์ Lussacโดยคำนึงถึง กฎของอโวกาโดร.
มวลกราม μ = ม/น, kg/mol คือมวลของสารที่ถ่ายในจำนวนหนึ่งโมล 1 โมลเป็นหน่วยของปริมาณของสารที่มีอนุภาคคาร์บอนมากถึง 12 กรัม ปริมาณของสาร– n = N/N อาไฝที่ไหน นู๋คือจำนวนอนุภาค (อะตอม โมเลกุล) นู๋ อา ≈ 6.02 10 23 - จำนวนอะตอมในคาร์บอน 12 กรัม ( เบอร์ของอโวกาโดร). ตัวเลข μ = MR 10 -3 โดยที่ Mr คือน้ำหนักโมเลกุลสัมพัทธ์ของสาร ( แท็บ เมนเดเลเยฟ) (เช่น =2 กก./กม.)
ในแง่เฉพาะ (เช่น สำหรับก๊าซ 1 กิโลกรัม) สมการ (1.2) จะมีรูปแบบ
ที่ไหน R– ค่าคงที่แก๊สจำเพาะ J/(kg K)
ให้เราอธิบายความหมายทางกายภาพของค่าคงที่ก๊าซจำเพาะ R. สำหรับสมการสถานะแรก (1.2) จะถูกเขียนเป็น สำหรับสถานะที่สองที่ความดันเท่ากัน - ลบสมการแรกออกจากสมการที่สองแล้วพบว่า นั่นคือ ค่าคงที่ของก๊าซจำเพาะคืองานที่ทำโดยแก๊ส 1 กิโลกรัมเมื่อได้รับความร้อน 1 องศาที่ความดันคงที่
ข้อมูลการทดลองแสดงให้เห็นว่าก๊าซจริงยิ่งเข้าใกล้ก๊าซในอุดมคติมากเท่าไร ความหนาแน่นของก๊าซก็จะยิ่งต่ำลงเท่านั้น กล่าวอีกนัยหนึ่ง ด้วยปริมาตรของก๊าซที่ลดลงซึ่งเกิดจากความดันที่เพิ่มขึ้นหรืออุณหภูมิที่ลดลง ก๊าซใด ๆ จะทำให้คุณสมบัติของก๊าซในอุดมคติเบี่ยงเบนไปจากเดิมมากขึ้นเรื่อยๆ ดังนั้นภายใต้แนวคิดของ "ก๊าซในอุดมคติ" จึงพอดีกับก๊าซจริงทั้งหมดที่อุณหภูมิสูงและความดันต่ำ
1.4. มิกซ์ ก๊าซในอุดมคติ
ในทางปฏิบัติ สารทำงานมักจะเป็นส่วนผสมของก๊าซที่เป็นเนื้อเดียวกัน (เช่น อากาศ) ซึ่งแต่ละชนิดถือได้ว่าอยู่ในอุดมคติและไม่เข้าสู่ ปฏิกริยาเคมี.
ส่วนผสมดังกล่าวยังเป็นก๊าซในอุดมคติและเป็นไปตามสมการสถานะ (1.2) สำหรับส่วนผสม
ที่ไหน R=R μ / μ คือค่าคงที่ของแก๊สของของผสม ไมโคร คือมวลโมลาร์เฉลี่ย (ปรากฏ) ของของผสม(ค่าตามเงื่อนไขที่อ้างถึงก๊าซตัวแทนที่เป็นเนื้อเดียวกัน ซึ่งจำนวนโมเลกุลและมวลรวมจะเท่ากับจำนวนโมเลกุลและมวลของสารผสม)
มวลของของผสมเท่ากับมวลของส่วนประกอบทั้งหมด
กฎหลักที่กำหนดพฤติกรรมของส่วนผสมของก๊าซคือ กฎของดัลตัน:
แก๊สแต่ละตัวมีพฤติกรรมในส่วนผสมของแก๊สราวกับว่าอยู่คนเดียวที่อุณหภูมิของส่วนผสมนั้นใช้ปริมาตรทั้งหมดของส่วนผสม
ก๊าซแต่ละชนิดที่เข้าสู่ส่วนผสมของก๊าซจะมีความดันเท่ากันกับที่มันจะเกิดขึ้นหากเพียงคนเดียวครอบครองปริมาตรทั้งหมดของส่วนผสมของก๊าซ
ดังนั้นค่า R(แรงดันส่วนผสมสัมบูรณ์) ถูกกำหนดเป็น
ที่ไหน R ผม – ความดันบางส่วน ผมองค์ประกอบ th นั่นคือ ความกดดันที่จะ ผมส่วนประกอบ ถ้าเพียงอย่างเดียวครอบครองปริมาตรทั้งหมดของส่วนผสมที่อุณหภูมิเดียวกัน ()
องค์ประกอบของส่วนผสมถูกกำหนดโดยมวลหรือเศษส่วนของโมลของส่วนประกอบที่เป็นส่วนประกอบของของผสม เช่นเดียวกับเศษส่วนปริมาตร (ความเข้มข้น)
เศษส่วนมวลคืออัตราส่วนของมวลของก๊าซแต่ละชนิดต่อมวลรวมของของผสม: .
สมการ (1.3) หมายความว่า
เศษส่วนปริมาตรเรียกว่าอัตราส่วน ปริมาณบางส่วน(ปริมาตรที่ก๊าซจะครอบครองหากความดันและอุณหภูมิเท่ากับความดันและอุณหภูมิของส่วนผสมของก๊าซ กล่าวคือ) กับปริมาตรรวมของส่วนผสมของก๊าซ: . จากคำจำกัดความของแรงดันและปริมาตรบางส่วนและความคงตัวของอุณหภูมิ มีดังนี้
![]() (1.5)
(1.5)
เมื่อสรุปความเท่าเทียมกันสุดท้ายของส่วนประกอบทั้งหมดของส่วนผสม เราได้รับ นั่นคือ ผลรวมของปริมาตรบางส่วนของก๊าซที่ประกอบเป็นส่วนผสมนั้นเท่ากับปริมาตรของส่วนผสมของก๊าซ
ผลรวมของเศษส่วนปริมาตรเท่ากับหนึ่ง:
เศษส่วนไฝส่วนประกอบเรียกว่าอัตราส่วนของปริมาณสารของก๊าซแต่ละชนิด น ผม ต่อปริมาณสารของส่วนผสมของก๊าซ น. จากความสัมพันธ์และ กฎของอโวกาโดร(ในปริมาตรที่เท่ากันของก๊าซในอุดมคติที่แตกต่างกันที่อุณหภูมิเท่ากันและความดันเท่ากัน จำนวนของโมเลกุลที่เท่ากันจะถูกปิดล้อม กล่าวคือ) ดังนี้:
เหล่านั้น. การระบุส่วนผสมด้วยเศษส่วนโมลจะเท่ากับการระบุเศษส่วนของปริมาตร
เศษส่วนมวลและปริมาตรสัมพันธ์กันด้วยอัตราส่วน:
![]() .
.
ถ้าส่วนผสมถูกกำหนดโดยเศษส่วนมวล ก ผมจากนั้นจึงคำนวณค่าคงที่แก๊สของของผสมและมวลโมลาร์ของของผสมดังนี้
![]()
![]()
ถ้าให้ส่วนผสมเป็นเศษส่วนปริมาตร r ผมแล้วสูตรคำนวณมวลโมลาร์ของของผสมและค่าคงที่แก๊สของของผสมมีดังนี้
![]() (1.6)
(1.6)
ความดันบางส่วนและปริมาตรของก๊าซถูกกำหนดโดย กฎของบอยล์–แมริออท(ที่อุณหภูมิของแก๊สคงที่ ผลิตภัณฑ์ของแรงดันแก๊สและปริมาตรจะเป็นค่าคงที่ กล่าวคือ):
![]() .
.
คำถามทดสอบ
International System of Units (SI) และหน่วยฐาน
พารามิเตอร์ทางอุณหพลศาสตร์พื้นฐานและขนาด
สภาวะสมดุลของระบบอุณหพลศาสตร์หมายถึงอะไร?
แนวคิดของสภาวะสมดุลและสภาวะที่ไม่สมดุล
สมการสถานะของระบบคืออะไร?
การตีความทางเรขาคณิตของสถานะของระบบ กระบวนการทางอุณหพลศาสตร์
ก๊าซในอุดมคติคืออะไร? แก๊สในอุดมคติกับของจริงต่างกันอย่างไร?
ค่าคงที่ของแก๊สคืออะไร? ความหมายทางกายภาพ มิติ และวิธีการนิยาม
2. ความจุความร้อน
ข้อความของความร้อนถึงร่างกายที่ทำงานในกระบวนการใด ๆ ทำให้เกิดการเปลี่ยนแปลงในสถานะและโดยทั่วไปจะมาพร้อมกับการเปลี่ยนแปลงของอุณหภูมิ การเปลี่ยนแปลงของอุณหภูมิรวมถึงพารามิเตอร์อื่น ๆ ของสถานะของของไหลทำงานไม่ได้ขึ้นอยู่กับประเภทของกระบวนการ แต่ขึ้นอยู่กับการเริ่มต้น ( 1 ) และสุดท้าย ( 2 ) กล่าวคือ (สำหรับกระบวนการพื้นฐาน การเปลี่ยนแปลงในพารามิเตอร์จะถูกแทนที่ด้วยส่วนต่าง)
อัตราส่วนปริมาณความร้อน δ Qต่อร่างกายถึงการเปลี่ยนแปลงของอุณหภูมิร่างกาย dTในกระบวนการทางอุณหพลศาสตร์เบื้องต้นเรียกว่า ความจุความร้อนที่แท้จริงร่างกายในกระบวนการนี้:
ตัวห้อยในที่นี้บ่งชี้ว่าความจุความร้อน เช่น ความร้อน ขึ้นอยู่กับธรรมชาติของกระบวนการ นอกจากนี้ ความจุความร้อนขึ้นอยู่กับปริมาณของร่างกายและสถานะทางอุณหพลศาสตร์ ควรสังเกตด้วยว่าในกระบวนการนี้องค์ประกอบทางเคมีของร่างกายไม่เปลี่ยนแปลงไม่มีการเปลี่ยนแปลงของสารจากสถานะการรวมตัวเป็นอีกสถานะหนึ่งไม่มีการละลายของส่วนประกอบ ฯลฯ
ขึ้นอยู่กับหน่วยเลือกปริมาณของสาร ความจุความร้อนจำเพาะของมวล ปริมาตร และโมลาร์จะแตกต่างกัน:
แนวคิดเรื่องความจุความร้อนมวลมักใช้ในทางปฏิบัติ
2.1. ความจุความร้อนที่แท้จริงและเฉลี่ย
ความจุความร้อนของสารจริงไม่ใช่ค่าคงที่ มันเปลี่ยนแปลงไปตามอุณหภูมิและการพึ่งพาอาศัยกันนี้มีความสำคัญมาก (รูปที่ 2.1)
ปริมาณความร้อนในกระบวนการคำนวณโดยสูตร
วิธีการต่อไปนี้ใช้เพื่อกำหนดค่านี้:
จากผลการทดลอง การพึ่งพาความจุความร้อนต่ออุณหภูมิจะแสดงเป็นพหุนามโดยประมาณ
สัมประสิทธิ์การประมาณอยู่ที่ไหน ค่าสัมประสิทธิ์เหล่านี้มีอยู่ในเอกสารอ้างอิง แล้ว
ในการคำนวณเชิงปฏิบัติในช่วงอุณหภูมิ t 1 , t 2 ความจุความร้อนถือเป็นค่าคงที่เท่ากับ
เรียกว่า ความจุความร้อนเฉลี่ยในช่วงเวลานี้ ตรงกันข้ามกับความจุความร้อนจริงที่แนะนำใน (2.1) ข้อมูลอ้างอิงให้ความจุความร้อนเฉลี่ยตั้งแต่ 0 ถึงอุณหภูมิคงที่ tได้รับเชิงประจักษ์ กล่าวคือ
ความจุความร้อนเฉลี่ยในช่วงอุณหภูมิ t 1 , t 2 ตามข้อมูลอ้างอิงเหล่านี้สามารถคำนวณได้โดยสูตร
แล้ว ปริมาณจำเพาะความร้อนในกระบวนการถูกกำหนดเป็น
2.2. ความจุความร้อนไอโซคอริกและไอโซบาริก
มีความสำคัญอย่างยิ่งในอุณหพลศาสตร์
isochoricความจุความร้อน
เท่ากับอัตราส่วนของปริมาณความร้อนในกระบวนการที่ปริมาตรคงที่ต่อการเปลี่ยนแปลงของอุณหภูมิร่างกาย
isobaricความจุความร้อน
เท่ากับอัตราส่วนของปริมาณความร้อนในกระบวนการที่ความดันคงที่ต่อการเปลี่ยนแปลงของอุณหภูมิร่างกาย
ในการคำนวณทางความร้อนจะใช้ตารางที่แสดงค่าตัวเลขที่ได้จากการทดลองสำหรับความจุความร้อนไอโซบาริกและไอโซโคริกจำเพาะสำหรับสารต่างๆ ขึ้นอยู่กับอุณหภูมิ
2.3. ความจุความร้อนของแก๊สผสม
ในการคำนวณ มักจะจำเป็นต้องจัดการกับส่วนผสมของก๊าซ และความจุความร้อนจะแสดงในตารางสำหรับก๊าซแต่ละชนิดเท่านั้น
ถ้าส่วนผสมของก๊าซถูกกำหนดโดยเศษส่วนมวล ก ผมจากนั้นความจุความร้อนมวลจำเพาะของส่วนผสมจะถูกกำหนดโดยสูตร
![]()
ถ้าให้ส่วนผสมของก๊าซเป็นเศษส่วนปริมาตร r ผมจากนั้นความจุความร้อนเชิงปริมาตรจำเพาะของส่วนผสมจะถูกกำหนดโดยสูตร
![]()
คำถามทดสอบ
เขียนหน่วยความจุความร้อนจำเพาะ
แนวคิดของความจุความร้อนเฉลี่ยถูกนำมาใช้อย่างไร?
3. กฎการอนุรักษ์และการเปลี่ยนแปลงพลังงาน
แนวคิดเรื่องพลังงานเกี่ยวข้องกับการเคลื่อนที่ของสสาร
พลังงานมีได้หลายรูปแบบ เช่น งานเครื่องกล ความร้อน พลังงานเคมี พลังงานสนามไฟฟ้าและสนามแม่เหล็ก
ในกระบวนการทางอุณหพลศาสตร์ ปฏิสัมพันธ์ของสิ่งแวดล้อมและระบบเทอร์โมไดนามิกแบบปิดนั้นกระทำโดยการแลกเปลี่ยนพลังงานในรูปของความร้อนและงานทางกล
3.1. กำลังภายใน
สภาพแวดล้อมใด ๆ มีระยะขอบบ้าง กำลังภายในยู(J) ซึ่งในอุณหพลศาสตร์ทางเทคนิคแสดงเป็นผลรวมของพลังงานจลน์และพลังงานศักย์ของโมเลกุลและอะตอมของตัวกลาง พลังงานจลน์ของอนุภาคเหล่านี้ถูกกำหนดโดยความเร็วและมวลของอนุภาค ในขณะที่พลังงานศักย์ถูกกำหนดโดยแรงของปฏิกิริยาระหว่างอนุภาคเหล่านี้ ซึ่งขึ้นอยู่กับตำแหน่งสัมพัทธ์ของพวกมัน พลังงานภายในของระบบคือพลังงานที่มีอยู่ในระบบเอง ซึ่งหมายความว่าพลังงานภายในสามารถระบุสถานะของร่างกายพร้อมกับปริมาณ R, วี, ตู่.
พลังงานภายในมีคุณสมบัติการเติมคือ พลังงานภายในของระบบที่ซับซ้อนเท่ากับผลรวมของพลังงานภายในของส่วนประกอบต่างๆ:
พลังงานภายในของสาร 1 กิโลกรัม เรียกว่า พลังงานภายในจำเพาะ ยู= ยู/ ม (เจ/กก.).
สำหรับการใช้งานทางเทคนิคส่วนใหญ่ของอุณหพลศาสตร์ ค่าสัมบูรณ์ไม่สำคัญ ยูและการเปลี่ยนแปลงในค่านี้ ดังนั้น คำจำกัดความเชิงปริมาณของพลังงานภายในของระบบที่เป็นเนื้อเดียวกันจึงมักถูกกำหนดโดยคำนึงถึงสถานะมาตรฐานที่เลือกตามอัตภาพ
3.2. กฎการอนุรักษ์พลังงานในอุณหพลศาสตร์
ในการดำเนินการตามกระบวนการทางอุณหพลศาสตร์ ระบบปิดจะโต้ตอบกับสภาพแวดล้อมภายนอก (วัตถุภายนอกและทุ่งนา) เช่น แลกเปลี่ยนพลังงาน ในอุณหพลศาสตร์ทางเทคนิค พิจารณาการถ่ายเทพลังงานสองประเภท - โดยการถ่ายเทความร้อนและโดยการทำงานทางกล
การถ่ายเทความร้อนเกิดขึ้นระหว่างวัตถุที่มีอุณหภูมิต่างกันและนำมาสัมผัสกัน หรือระหว่างวัตถุที่มีอุณหภูมิต่างกัน ซึ่งอยู่ห่างไกลกันโดยใช้คลื่นแม่เหล็กไฟฟ้า ( รังสีความร้อน). ออกอากาศ ความอบอุ่นเกิดขึ้นที่ระดับโมเลกุล (จุลภาค) โดยไม่มีการเคลื่อนไหวของร่างกายที่มองเห็นได้
การถ่ายโอนพลังงานในรูปของงานเกิดขึ้นกับการเคลื่อนไหวของร่างกายทั้งหมดหรือบางส่วนในอวกาศ ด้วยวิธีนี้ ร่างกายจะเคลื่อนที่ในสนามแรงหรือเปลี่ยนปริมาตรภายใต้อิทธิพลของแรงกดดันจากภายนอก ทำงานเป็นรูปแบบการถ่ายเทพลังงานแบบมหภาค
ควรสังเกตว่าความร้อนและการทำงานไม่เหมือนกับพลังงานของร่างกายไม่ใช่หน้าที่ของสถานะ แต่ขึ้นอยู่กับประเภทของกระบวนการกำหนดกระบวนการนี้เช่น เป็นหน้าที่ของกระบวนการเอง
การทดลองและการสังเกตจำนวนมากนำไปสู่การค้นพบกฎพื้นฐานของธรรมชาติ - กฎการอนุรักษ์พลังงาน: พลังงานในธรรมชาติไม่ได้เกิดขึ้นจากความว่างเปล่าและไม่หายไปหรือ ปริมาณพลังงานไม่เปลี่ยนแปลง เปลี่ยนจากรูปแบบหนึ่งเป็นอีกรูปแบบหนึ่งเท่านั้นหรือ
ที่ไหน Qคือความร้อนที่เกี่ยวข้องกับกระบวนการ หลี่- งานที่ทำ; . อีคือการเปลี่ยนแปลงพลังงานของระบบ ที่นี่และด้านล่าง เราตกลงที่จะพิจารณา:
งาน เชิงบวกถ้างานนี้ทำโดยหน่วยงานและ เชิงลบ, หากงานเสร็จสิ้นบนเนื้อความการทำงานของระบบ
ความร้อนที่จ่ายให้กับร่างกาย เชิงบวก, และผู้ที่ได้รับการจัดสรร - เชิงลบ
นอกจากนี้ การเปลี่ยนแปลงในพารามิเตอร์สถานะใด ๆ ในกระบวนการสุดท้ายจะแสดงด้วยสัญลักษณ์ Δ (เดลต้า) และในกระบวนการเบื้องต้น - d(ส่วนต่างของพารามิเตอร์ที่เกี่ยวข้อง) สำหรับกระบวนการทางเทอร์โมไดนามิกที่จำกัดใดๆ การเปลี่ยนแปลงในพารามิเตอร์สถานะ (ความดัน อุณหภูมิ พลังงานภายใน เอนทาลปี เอนโทรปี ฯลฯ) ไม่ได้ขึ้นอยู่กับประเภทของกระบวนการ แต่จะกำหนดโดยสถานะเริ่มต้นและสถานะสุดท้าย
โดยทั่วไป ระบบอุณหพลศาสตร์มีพลังงานภายใน ยู, พลังงานจลน์ (ในทางอุณหพลศาสตร์ถือว่าระบบเคลื่อนที่ด้วยความเร็วทั้งหมด) w) – mw 2 /2 ศักยภาพ - mgz (zคือความสูงที่ระบบตั้งอยู่) การเปลี่ยนแปลงของพลังงานทั้งหมดในกระบวนการ 1 –2 สามารถจินตนาการได้ดังนี้:
งานที่ทำในกระบวนการนี้คือผลรวมของงาน หลี่เกี่ยวกับการเปลี่ยนแปลงปริมาตรของของไหลทำงานของระบบ (งานเปลี่ยนรูป) งาน หลี่ dv เกี่ยวกับการเคลื่อนที่ของระบบในอวกาศ งานด้านเทคนิค L เหล่านั้น (เมื่อเคลื่อนย้ายระบบในอุปกรณ์ทางเทคนิคต่างๆ เช่น ในเครื่องยนต์ หม้อไอน้ำ คอมเพรสเซอร์ ฯลฯ) ทำงานกับแรงเสียดทาน หลี่ tr:
L \u003d L เกี่ยวกับ + L dv + L เหล่านั้น + L tr
ความร้อนที่เกี่ยวข้องกับกระบวนการคือผลรวมของความร้อน Qภายนอกที่เกี่ยวข้องกับการแลกเปลี่ยนกับสภาพแวดล้อมภายนอกและความร้อนของแรงเสียดทาน Q tr:
Q = Qภายนอก + Qท.
ระบุว่า Q tr = หลี่ tr (การทดลองหลายครั้งแสดงให้เห็นว่างานของการไหลที่ใช้ไปในการเอาชนะแรงเสียดทานจะถูกแปลงเป็นความร้อนที่รับรู้โดยการไหลอย่างสมบูรณ์) กฎการอนุรักษ์พลังงานในอุณหพลศาสตร์สำหรับสารที่เป็นเนื้อเดียวกันทำงาน 1 กิโลกรัม (กล่าวคือในค่ามวลจำเพาะ ) ในขั้นตอนเบื้องต้นสามารถเขียนได้ :
![]() , (3.1)
, (3.1)
(ละเว้นดัชนีภายนอกเนื่องจากไม่จำเป็น)
ควรเน้นว่าทางด้านขวาของ (3.1) ใต้เครื่องหมายของดิฟเฟอเรนเชียลคือหน้าที่ของรัฐ และส่วนที่เหลือคือปริมาณที่ขึ้นอยู่กับธรรมชาติของกระบวนการทางอุณหพลศาสตร์ เนื่องจากงานและความร้อนเป็นหน้าที่ของกระบวนการ และไม่ใช่หน้าที่ของสถานะ เครื่องหมาย δ หมายถึงเฉพาะข้อเท็จจริงว่าในกระบวนการเบื้องต้น ปริมาณที่ตามมานั้นมีค่าน้อยที่สุดตามอำเภอใจ และไม่เพิ่มฟังก์ชันเฉพาะใดๆ ดังนั้น δ qและ δ l-ระดับประถมศึกษา (เช่น สอดคล้องกับการเปลี่ยนแปลงเล็กน้อยในสถานะของระบบ) ปริมาณความร้อนและการทำงาน
หากระบบอุณหพลศาสตร์ไม่เปลี่ยนตำแหน่งในอวกาศและงานประเภทเดียวคืองานที่เกี่ยวข้องกับการเปลี่ยนแปลงปริมาตรของระบบ สมการ (3.1) จะอยู่ในรูปแบบที่ง่ายกว่า:
งาน δ lเกี่ยวกับ จะดำเนินการกับแรงของแรงดันภายนอกจากนั้นปริมาตรของของไหลทำงานจะขยายตัวหรือในทางกลับกันสภาพแวดล้อมภายนอกทำงานบนร่างกายโดยบีบอัด สำหรับกระบวนการสมดุล เมื่อความดันของตัวกลางเท่ากับความดันในของไหลทำงาน งานนี้คำนวณเป็น Rdv, ที่ไหน วีคือปริมาตรจำเพาะของสารทำงาน
สมการ
เรียกว่า กฎข้อที่หนึ่งของอุณหพลศาสตร์: ความร้อนที่จ่ายให้กับระบบเทอร์โมไดนามิกแบบปิดที่เหลือใช้เพื่อเปลี่ยนพลังงานภายในของระบบและในการทำงานเพื่อเปลี่ยนปริมาตรของระบบ. ความสัมพันธ์ที่สมดุล (3.2) เรียกอีกอย่างว่าการบรรยาย บนวรรณกรรมเชิงทฤษฎี 1. บาร็อค: ...
L.A. Eliseeva © Federal State Budgetary Institution of Science State ห้องสมุดวิทยาศาสตร์และเทคนิคสาธารณะแห่งสาขาไซบีเรียของ Russian Academy of Sciences, 2013
ตัวชี้เดินสุ่ม / A.N. โบโรดิน, I. A. อิบราจิมอฟ; ภายใต้... 241. Dorogokupets P.I. อุณหพลศาสตร์แร่ธาตุและสมดุลแร่ธาตุ ... แคตตาล็อก: compendium การบรรยาย บนหลักสูตร "อ้างอิง ... รัฐ เทคนิคมหาวิทยาลัย. ชุด, เทคนิคศาสตร์. - ...
N. V. Basova [และอื่น ๆ ]; ed. N.V. Basova. Rostov ไม่มี: Phoenix, 2008
หนังสือเรียนหลักสูตร) เขียนโดย D.T. เรื่องย่อ การบรรยาย บนคณิตศาสตร์ชั้นสูง [ข้อความ]: ... เทคนิค อุณหพลศาสตร์ Rudobashta, S.P. วิศวกรรมความร้อน [ข้อความ]: ตำราเรียนสำหรับนักเรียน มหาวิทยาลัยที่กำลังศึกษาอยู่ บน... 2551. - 204 น. สิบ โบโรดิน, I.F. ระบบอัตโนมัติของกระบวนการทางเทคโนโลยี...
รายชื่อผลงานทางวิทยาศาสตร์ของกระทรวงการคลัง ประจำปี 2551 - 1 มิถุนายน 2556 (1)
เอกสาร... "วิธีการวิจัยเอ็กซ์เรย์" บรรยาย บนเนื้องอกวิทยาทางคลินิก อัลมาตี...แห่งกฎข้อที่สอง อุณหพลศาสตร์» 2-International... และ การตรวจสอบโดยผู้เชี่ยวชาญ เทคนิคการเตรียมองค์กรด้านการดูแลสุขภาพ ... นักวิชาการของ Russian Academy of Medical Sciences Yu.I. โบโรดิน, บิชเคก, 2552, หน้า. ...
ในทางปฏิบัติทางวิศวกรรม เรามักจะไม่ต้องจัดการกับก๊าซที่เป็นเนื้อเดียวกัน แต่กับของผสมของก๊าซที่ไม่เกี่ยวข้องทางเคมี ตัวอย่างของส่วนผสมของก๊าซ ได้แก่ อากาศในบรรยากาศ ก๊าซธรรมชาติ ผลิตภัณฑ์ที่เป็นก๊าซจากการเผาไหม้เชื้อเพลิง เป็นต้น
สำหรับส่วนผสมของแก๊ส ให้เป็นไปตามข้อกำหนดต่อไปนี้
1. ก๊าซแต่ละชนิดที่เข้าสู่ส่วนผสมมีอุณหภูมิ เท่ากับอุณหภูมิสารผสม
2. ก๊าซใด ๆ ที่รวมอยู่ในส่วนผสมจะกระจายไปทั่วปริมาตรของส่วนผสม ดังนั้นปริมาตรของก๊าซแต่ละชนิดจึงเท่ากับปริมาตรของส่วนผสมทั้งหมด
3. ก๊าซแต่ละชนิดที่รวมอยู่ในส่วนผสมนั้นเป็นไปตามสมการสถานะของตนเอง
4. ส่วนผสมทั้งหมดเป็นเหมือนก๊าซใหม่และเป็นไปตามสมการสถานะของตัวเอง
การศึกษาส่วนผสมของก๊าซเป็นไปตามกฎของดาลตัน โดยที่อุณหภูมิคงที่ ความดันของส่วนผสมจะเท่ากับผลรวมของแรงดันบางส่วนของก๊าซที่รวมอยู่ในส่วนผสม:
โดยที่ p cm คือความดันของส่วนผสม
pi - ความดันบางส่วนของก๊าซ i-th ที่รวมอยู่ในส่วนผสม
n คือจำนวนก๊าซที่รวมอยู่ในส่วนผสม
ความดันบางส่วนคือความดันที่ก๊าซที่เข้าสู่ส่วนผสมจะเกิดขึ้นหากใช้ปริมาตรทั้งหมดของส่วนผสมที่อุณหภูมิเดียวกัน
วิธีการตั้งค่าส่วนผสมของแก๊ส
องค์ประกอบของส่วนผสมก๊าซสามารถระบุได้ด้วยมวล ปริมาตร และเศษส่วนโมล
เศษส่วนมวล. เศษส่วนมวลของก๊าซใดๆ ที่รวมอยู่ในส่วนผสมคืออัตราส่วนของมวลของก๊าซนี้ต่อมวลของส่วนผสม
ม. 1 \u003d ม. 1 / ม. ซม.; ม. 2 \u003d ม 2 / ม. ซม.; ...........; m n \u003d M n / M ซม.
โดยที่ ม. 1 , ม. 2 , ..., ม. น. - เศษส่วนมวลของก๊าซ;
M 1 , M 2 , ... , M n - มวลของก๊าซแต่ละตัว;
M cm คือมวลของส่วนผสม
ง่ายที่จะเห็นว่า  และ
และ  (100%).
(100%).
ปริมาณหุ้นเศษส่วนของปริมาตรของก๊าซใดๆ ที่รวมอยู่ในส่วนผสมคืออัตราส่วนของปริมาตรที่ลดลง (บางส่วน) ของก๊าซนี้ต่อปริมาตรของส่วนผสม
r 1 \u003d V 1 / V ซม.; r 2 \u003d V 2 / V ซม.; ........., r n = V n / V cm;
โดยที่ V 1 , V 2 , ..., V n - ปริมาณก๊าซที่ลดลง
V cm คือปริมาตรของส่วนผสม
r 1 , r 2 , ..., r n - เศษส่วนของปริมาตรของก๊าซ
ปริมาณที่ลดลงคือปริมาตรของก๊าซภายใต้สภาวะของส่วนผสม (ที่อุณหภูมิและความดันของส่วนผสม)
ปริมาตรที่ลดลงสามารถแสดงได้ดังนี้: หากก๊าซทั้งหมดยกเว้นก๊าซหนึ่งถูกนำออกจากถังที่มีส่วนผสมของ และก๊าซที่เหลือถูกบีบอัดไปที่ความดันของส่วนผสมในขณะที่รักษาอุณหภูมิ ปริมาตรของก๊าซจะลดลงหรือบางส่วน
สามารถพิสูจน์ได้ว่าปริมาตรของส่วนผสมจะเท่ากับผลรวมของปริมาณก๊าซที่ลดลง
 (100%).
(100%).
เศษส่วนโมลเศษส่วนโมลของก๊าซใดๆ ที่รวมอยู่ในส่วนผสมคืออัตราส่วนของจำนวนกิโลโมลของก๊าซนี้ต่อจำนวนกิโลโมลของของผสม
r 1 \u003d n 1 / n ซม.; r 2 \u003d n 2 / n ซม.; ........., r n \u003d n n / n cm,
โดยที่ r 1 , r 2 , ..., r n - โมลเศษส่วนของก๊าซ
n cm คือจำนวนกิโลโมลของส่วนผสม
n 1 , n 2 , ..., nn คือจำนวนกิโลโมลของก๊าซ
การระบุส่วนผสมด้วยเศษส่วนโมลจะเหมือนกับการระบุส่วนผสมด้วยเศษส่วนปริมาตร กล่าวคือ เศษส่วนโมลาร์และปริมาตรมีค่าตัวเลขเท่ากันสำหรับก๊าซแต่ละชนิดที่รวมอยู่ในส่วนผสม
ก๊าซคงที่และน้ำหนักโมเลกุลปรากฏ (เฉลี่ย) ของส่วนผสมในการคำนวณค่าคงที่ของส่วนผสมของแก๊สโดยเศษส่วนของมวล เราเขียนสมการสถานะ:
สำหรับผสม
p cm × V cm = M cm R cm T; (1.9)
สำหรับก๊าซ
 .
(1.10)
.
(1.10)
เรารวมส่วนซ้ายและขวาของสมการ (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
เพราะ  ,
,
แล้ว p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
สมการ (1.9) และ (1.11) หมายความว่า
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) ต.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
หรือ  ,
(1.12)
,
(1.12)
โดยที่ R cm คือค่าคงที่แก๊สของของผสม
เนื่องจากค่าคงที่แก๊สของแก๊ส i-th
R ผม = 8314 / ม. ผม ,
จากนั้นสมการ (1.12) จะถูกเขียนใหม่ดังนี้:
 .
(1.13)
.
(1.13)
เมื่อกำหนดพารามิเตอร์ของส่วนผสมของแก๊ส จะสะดวกที่จะใช้ค่าตามเงื่อนไขที่เรียกว่าน้ำหนักโมเลกุลที่ชัดเจน (เฉลี่ย) ของส่วนผสมของแก๊ส แนวคิดเรื่องน้ำหนักโมเลกุลที่ชัดเจนของของผสมช่วยให้เราพิจารณาตามอัตภาพว่าของผสมนั้นเป็นก๊าซที่เป็นเนื้อเดียวกัน ซึ่งทำให้การคำนวณง่ายขึ้นอย่างมาก
สำหรับก๊าซที่แยกจากกัน นิพจน์
โดยการเปรียบเทียบ สำหรับส่วนผสม เราสามารถเขียน
ม. ซม. R ซม. = 8314, (1.14)
โดยที่ m cm คือน้ำหนักโมเลกุลที่ชัดเจนของของผสม
จากสมการ (1.14) โดยใช้นิพจน์ (1.12) และ (1.13) เราได้รับ
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
การโต้เถียงด้วยวิธีนี้ เราสามารถหาสูตรการคำนวณ R cm และ m cm ผ่านเศษส่วนปริมาตร สูตรสำหรับแปลงเศษส่วนมวลเป็นเศษส่วนปริมาตร และในทางกลับกัน เศษส่วนปริมาตรเป็นเศษส่วนมวล สูตรสำหรับคำนวณปริมาตรจำเพาะของส่วนผสม u cm และ ความหนาแน่นของส่วนผสม r ซม. ผ่านเศษส่วนของมวลและปริมาตร และสุดท้ายคือ สูตรสำหรับคำนวณความดันบางส่วนของก๊าซที่รวมอยู่ในส่วนผสม ผ่านเศษส่วนปริมาตรและมวล เรานำเสนอสูตรเหล่านี้โดยไม่มีที่มาในตาราง
สูตรคำนวณส่วนผสมของแก๊ส
|
การกำหนดองค์ประกอบของส่วนผสม |
ถ่ายโอนจากองค์ประกอบหนึ่งไปอีกองค์ประกอบหนึ่ง |
ความหนาแน่นและปริมาตรจำเพาะของส่วนผสม |
น้ำหนักโมเลกุลที่เห็นได้ชัดของของผสม |
ค่าคงที่ส่วนผสมของแก๊ส |
ความดันบางส่วน |
|
เศษส่วนมวล |
|
|
|
|
|
|
เศษส่วนปริมาตร |
|
|
|
|
|
ความจุความร้อนของก๊าซ
ความจุความร้อนของร่างกายคือปริมาณความร้อนที่ต้องการเพื่อให้ความร้อนหรือทำให้ร่างกายเย็นลง 1 K ความจุความร้อนของหน่วยปริมาณของสารเรียกว่าความจุความร้อนจำเพาะ
ดังนั้น ความจุความร้อนจำเพาะของสารคือปริมาณความร้อนที่ต้องส่งหรือลบออกจากหน่วยของสารเพื่อเปลี่ยนอุณหภูมิ 1 K ในกระบวนการนี้
เนื่องจากจะมีการพิจารณาเฉพาะความจุความร้อนจำเพาะในสิ่งต่อไปนี้ เราจะอ้างถึงความจุความร้อนจำเพาะอย่างง่าย ๆ ว่าความจุความร้อน
ปริมาณก๊าซสามารถหาได้จากมวล ปริมาตร และจำนวนกิโลโมล ควรสังเกตว่าเมื่อตั้งค่าปริมาตรก๊าซ ปริมาตรนี้จะถูกทำให้อยู่ในสภาวะปกติและวัดเป็นลูกบาศก์เมตรปกติ (นาโนเมตร 3)
ขึ้นอยู่กับวิธีการกำหนดปริมาณของก๊าซความจุความร้อนดังต่อไปนี้มีความโดดเด่น:
c - ความจุความร้อนมวล J / (กก. × K);
c¢ - ความจุความร้อนปริมาตร, J / (นาโนเมตร 3 × K);
c m - ความจุความร้อนกราม J / (kmol × K)
ระหว่างความจุความร้อนเหล่านี้มีความสัมพันธ์ดังต่อไปนี้:
c = c m / m; ด้วย m = ด้วย × m;
с¢ = с m / 22.4; ด้วย m = s¢ × 22.4,
จากที่นี่  ; s¢ = s × r n,
; s¢ = s × r n,
โดยที่ u n และ r n - ปริมาตรและความหนาแน่นจำเพาะภายใต้สภาวะปกติ
ความจุความร้อนไอโซคอริกและไอโซบาริก
ปริมาณความร้อนที่จ่ายให้กับของไหลทำงานขึ้นอยู่กับคุณสมบัติของกระบวนการทางอุณหพลศาสตร์ ความจุความร้อนสองประเภทมีความสำคัญในทางปฏิบัติขึ้นอยู่กับกระบวนการทางอุณหพลศาสตร์: ไอโซโคริกและไอโซบาริก
ความจุความร้อนที่ u = const isochoric
c u - ความจุความร้อนไอโซโคริกมวล
ค¢ ยูคือความจุความร้อนไอโซโคริกเชิงปริมาตร
c m ยูคือ ความจุความร้อนของโมลาร์ไอโซโคริก
ความจุความร้อนที่ p = const คือ isobaric
c p - ความจุความร้อนไอโซบาริกมวล
c¢ р - ความจุความร้อนไอโซบาริกเชิงปริมาตร
c m p - ความจุความร้อนของโมลาร์ไอโซบาริก
ด้วยการเปลี่ยนแปลงของอุณหภูมิในกระบวนการเดียวกันที่ p = const ความร้อนจะถูกใช้ไปมากกว่าในกระบวนการที่ u = const สิ่งนี้อธิบายได้จากข้อเท็จจริงที่ว่าที่ u = const ความร้อนที่ส่งไปยังร่างกายนั้นใช้ไปเพื่อการเปลี่ยนแปลงพลังงานภายในเท่านั้น ในขณะที่ที่ p = const ความร้อนนั้นถูกใช้ไปทั้งเพื่อเพิ่มพลังงานภายในและในการทำงานของการขยายตัว ความแตกต่างระหว่างความจุความร้อนมวลไอโซบาริกและความจุไอโซโคริกมวลตามสมการเมเยอร์
c p - c ยู=ร. (1.17)
ถ้าด้านซ้ายและขวาของสมการ (1.17) คูณด้วยมวลกิโลโมล m เราก็จะได้
c m p - c m ยู= 8314 J/(kmol×K) (1.18)
ในอุณหพลศาสตร์และการใช้งาน อัตราส่วนของความจุความร้อนแบบไอโซบาริกและไอโซโคริกมีความสำคัญอย่างยิ่ง:
 ,
(1.19)
,
(1.19)
โดยที่ k คือเลขชี้กำลังอะเดียแบติก
การคำนวณแสดงให้เห็นว่าสำหรับก๊าซโมโนโทมิก k » 1.67 ก๊าซไดอะตอมมิก k » 1.4 และก๊าซไตรอะตอมมิก k » 1.29
ง่ายที่จะเห็นว่าค่า ถึงขึ้นอยู่กับอุณหภูมิ อันที่จริงมันมาจากสมการ (1.17) และ (1.19) ว่า
 ,
(1.20)
,
(1.20)
และจากสมการ (1.18) และ (1.19)
 .
(1.21)
.
(1.21)
เนื่องจากความจุความร้อนเพิ่มขึ้นตามอุณหภูมิของก๊าซที่เพิ่มขึ้น ค่าของ k จะลดลง ใกล้เอกภาพ แต่ยังคงมากกว่าค่าเดิมเสมอ
เมื่อทราบค่าของ k เราสามารถกำหนดค่าความจุความร้อนที่สอดคล้องกันได้ ตัวอย่างเช่น จากสมการ (1.20) เรามี
 ,
(1.22)
,
(1.22)
และตั้งแต่ ด้วย p = k × s ยูแล้วเราจะได้
 .
(1.23)
.
(1.23)
ในทำนองเดียวกัน สำหรับความจุความร้อนกราม จากสมการ (1.21) เราได้รับ
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
ความจุความร้อนเฉลี่ยและจริง
ความจุความร้อนของก๊าซขึ้นอยู่กับอุณหภูมิและความดันในระดับหนึ่ง การพึ่งพาความจุความร้อนต่อแรงดันนั้นน้อยและมักถูกละเลยในการคำนวณส่วนใหญ่ การพึ่งพาความจุความร้อนต่ออุณหภูมิมีความสำคัญและต้องนำมาพิจารณาด้วย การพึ่งพาอาศัยกันนี้แสดงได้ค่อนข้างแม่นยำโดยสมการ
ค = เป็ + ใน t + et 2 , (1.26)
ที่ไหน, ในและ e คือค่าคงที่สำหรับก๊าซที่กำหนด
บ่อยครั้งในการคำนวณทางวิศวกรรมความร้อน การพึ่งพาแบบไม่เชิงเส้น (1.26) จะถูกแทนที่ด้วยเส้นตรง:
ค = เป็ + ในที (1.27)
|
หากเราสร้างกราฟการพึ่งพาความจุความร้อนต่ออุณหภูมิตามสมการ (1.26) ก็จะเป็นการพึ่งพาแบบโค้ง (รูปที่ 1.4) ดังแสดงในรูป ค่าอุณหภูมิแต่ละค่ามีค่าความจุความร้อนของตัวเอง ซึ่งเรียกกันทั่วไปว่าความจุความร้อนจริง ทางคณิตศาสตร์ นิพจน์สำหรับความจุความร้อนจริงเขียนได้ดังนี้:
|
|
|
|
ดังนั้น ความจุความร้อนที่แท้จริงคืออัตราส่วนของความร้อน dq จำนวนเล็กน้อยต่อการเปลี่ยนแปลงอุณหภูมิ dt เพียงเล็กน้อย ความจุความร้อนที่แท้จริงคือความจุความร้อนของก๊าซที่อุณหภูมิที่กำหนด ในรูป 1.4 ความจุความร้อนที่แท้จริงที่อุณหภูมิ t 1 แสดงด้วย t1 และแสดงเป็นส่วนที่ 1-4 ที่อุณหภูมิ t 2 - กับ t2 และแสดงเป็นส่วน 2-3 จากสมการ (1.28) เราจะได้ dq=cdt. (1.29) ในการคำนวณเชิงปฏิบัติ เรามักจะกำหนด ปริมาณความร้อนที่การเปลี่ยนแปลงขั้นสุดท้าย |
อุณหภูมิ. เป็นที่แน่ชัดว่าปริมาณความร้อน q ซึ่งรายงานเป็นหน่วยปริมาณของสารเมื่อถูกทำให้ร้อนตั้งแต่ t 1 ถึง t 2 สามารถหาได้โดยการรวม (1.29) จาก t 1 ถึง t 2
 .
(1.30)
.
(1.30)
ในรูปกราฟ อินทิกรัล (1.30) แสดงโดยพื้นที่ 4-1-2-3 หากในนิพจน์ (1.30) เราแทนค่าความจุความร้อนจริงตามการพึ่งพาเชิงเส้น (1.27) เราจะได้
 (1.31)
(1.31)
ที่ไหน  - ความจุความร้อนเฉลี่ยในช่วงอุณหภูมิตั้งแต่ t 1 ถึง t 2
- ความจุความร้อนเฉลี่ยในช่วงอุณหภูมิตั้งแต่ t 1 ถึง t 2
 ,
(1.32)
,
(1.32)
ดังนั้นความจุความร้อนเฉลี่ยคืออัตราส่วนของปริมาณความร้อนสุดท้าย q ต่อการเปลี่ยนแปลงอุณหภูมิสุดท้าย t 2 - t 1:
 .
(1.33)
.
(1.33)
หากบนพื้นฐานของ 4-3 (รูปที่ 1.4) สี่เหลี่ยมผืนผ้า 4-1¢-2¢-3 ถูกสร้างขึ้นโดยมีขนาดเท่ากับรูปที่ 4-1-2-3 ความสูงของสี่เหลี่ยมผืนผ้านี้จะ เท่ากับความจุความร้อนเฉลี่ย โดยที่  อยู่ในช่วงอุณหภูมิ t 1 - t 2 .
อยู่ในช่วงอุณหภูมิ t 1 - t 2 .
โดยปกติ ค่าความจุความร้อนเฉลี่ยจะแสดงในตารางคุณสมบัติทางอุณหพลศาสตร์ของสาร อย่างไรก็ตาม เพื่อลดปริมาณของตารางเหล่านี้ พวกเขาให้ค่าความจุความร้อนเฉลี่ยที่กำหนดในช่วงอุณหภูมิจาก 0 ° C ถึง t ° C
หากจำเป็นต้องคำนวณค่าความจุความร้อนเฉลี่ยในช่วงอุณหภูมิที่กำหนด t 1 - t 2 สามารถทำได้ดังนี้
พื้นที่ 0a14 ใต้เส้นโค้ง c \u003d f (t) (รูปที่ 1.4) สอดคล้องกับปริมาณความร้อน q 1 ที่จำเป็นในการเพิ่มอุณหภูมิก๊าซจาก 0 ° C ถึง t 1 ° C

ในทำนองเดียวกัน พื้นที่ 0a23 สอดคล้องกับ q 2 เมื่ออุณหภูมิเพิ่มขึ้นจาก 0 o C เป็น t 2 o C:

ดังนั้น q \u003d q 2 - q 1 (พื้นที่ 4123) สามารถแสดงเป็น
![]() (1.34)
(1.34)
แทนค่าของ q ตาม (1.34) เป็นนิพจน์ (1.33) เราได้สูตรสำหรับความจุความร้อนเฉลี่ยในช่วงอุณหภูมิใดๆ:
 .
(1.35)
.
(1.35)
ดังนั้น ความจุความร้อนเฉลี่ยสามารถคำนวณได้จากความจุความร้อนเฉลี่ยแบบตารางโดยใช้สมการ (1.35) นอกจากนี้ เรายังได้รับการพึ่งพาแบบไม่เชิงเส้น c = f(t) คุณยังสามารถหาความจุความร้อนเฉลี่ยได้โดยใช้สมการ (1.32) โดยใช้ความสัมพันธ์เชิงเส้น ค่า a และ ในในสมการ (1.32) สำหรับก๊าซต่าง ๆ มีให้ในวรรณคดี
ปริมาณความร้อนที่จ่ายหรือนำออกจากของไหลทำงานสามารถคำนวณได้โดยใช้สมการใดก็ได้:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
ที่ไหน 

 - ตามลำดับ มวลเฉลี่ย ปริมาตร และความจุความร้อนกราม; M คือมวลของก๊าซ n คือจำนวนกิโลโมลของก๊าซ V n - ปริมาตรของก๊าซภายใต้สภาวะปกติ
- ตามลำดับ มวลเฉลี่ย ปริมาตร และความจุความร้อนกราม; M คือมวลของก๊าซ n คือจำนวนกิโลโมลของก๊าซ V n - ปริมาตรของก๊าซภายใต้สภาวะปกติ
ปริมาตรของก๊าซ V n สามารถหาได้ดังนี้ เมื่อเขียนสมการสถานะสำหรับเงื่อนไขที่กำหนด: pV = MRT และสำหรับเงื่อนไขปกติ: p n V n = MRT n เราถือว่าสมการที่สองเป็นสมการแรก:
 ,
,
จากที่นี่  .
(1.39)
.
(1.39)
ความจุความร้อนของแก๊สผสม
ความจุความร้อนของส่วนผสมก๊าซสามารถคำนวณได้หากระบุองค์ประกอบของส่วนผสมและทราบความจุความร้อนของส่วนประกอบที่รวมอยู่ในส่วนผสมนั้น
ในการให้ความร้อนแก่ส่วนผสมของมวล M ซม. โดย 1 K อุณหภูมิของส่วนประกอบแต่ละส่วนจะต้องเพิ่มขึ้น 1 K ด้วย ในเวลาเดียวกัน ปริมาณความร้อนเท่ากับ c ผม M ผม ถูกใช้เพื่อให้ความร้อนส่วนประกอบที่ i ของส่วนผสมที่มีมวล М ผม . สำหรับส่วนผสมทั้งหมด ปริมาณความร้อน  ,
,
โดยที่ c i และ c cm คือความจุความร้อนมวลของส่วนประกอบที่ i และของผสม
หารนิพจน์สุดท้ายด้วย M cm เราได้รับสูตรการคำนวณสำหรับความจุความร้อนมวลของส่วนผสม:
 ,
(1.40)
,
(1.40)
โดยที่ m i คือเศษส่วนมวลขององค์ประกอบที่ i
ในทำนองเดียวกัน เราพบความจุความร้อนเชิงปริมาตร c¢ cm และความจุความร้อนของโมลาร์ c·m cm ซม. ของส่วนผสม:
 (1.41)
(1.41)
โดยที่ c¢ ผม - ความจุความร้อนเชิงปริมาตรของส่วนประกอบที่ i, r ผม - เศษส่วนปริมาตรของส่วนประกอบที่ i
 ,
(1.42)
,
(1.42)
โดยที่ c m i คือความจุความร้อนกรามของส่วนประกอบที่ i
ri - ไฝ (ปริมาตร) เศษส่วนขององค์ประกอบที่ i
ในเครื่องยนต์ความร้อน (เครื่องจักร) สารทำงานเป็นส่วนผสมของก๊าซต่างๆ หากส่วนประกอบของส่วนผสมไม่ทำปฏิกิริยาเคมีซึ่งกันและกัน และส่วนประกอบแต่ละส่วนเป็นไปตามสมการของแคลเปอรอง แสดงว่าส่วนผสมดังกล่าวเป็นก๊าซในอุดมคติ
ในการคำนวณส่วนผสม จำเป็นต้องกำหนด μ cm - มวลโมลาร์เฉลี่ยและ R c m - ค่าคงที่ก๊าซจำเพาะของส่วนผสม ในการตรวจสอบนั้น จำเป็นต้องทราบองค์ประกอบของส่วนผสม กล่าวคือ ส่วนประกอบใดและในปริมาณใดที่ก่อให้เกิดส่วนผสมนี้ พารามิเตอร์แต่ละองค์ประกอบที่รวมอยู่ในส่วนผสมนั้นมีอะไรบ้าง
ส่วนประกอบแต่ละส่วนของของผสมมีลักษณะเหมือนไม่มีก๊าซอื่นอยู่ในส่วนผสม ใช้ปริมาตรทั้งหมดที่มีอยู่ซึ่งของผสมตั้งอยู่ ตามสมการของสถานะของตัวเอง และออกแรงกดบางส่วนที่เรียกว่าบนผนัง ในขณะที่อุณหภูมิ ของส่วนผสมทั้งหมดจะเท่ากันและเท่ากับอุณหภูมิของส่วนผสม
ตามกฎของดาลตัน ความดันของของผสม P เท่ากับผลรวมของแรงดันบางส่วนของส่วนประกอบแต่ละชิ้นที่รวมอยู่ในของผสม:
โดยที่ n คือจำนวนของส่วนประกอบผสม
ตามกฎของ Amag ปริมาตรของส่วนผสม V เท่ากับผลรวมของปริมาตรบางส่วนของส่วนประกอบแต่ละอย่างรวมอยู่ในส่วนผสมที่อุณหภูมิและความดันของส่วนผสม:
 , (1.21)
, (1.21)
ที่ไหน - ปริมาตรบางส่วน m 3; V- ปริมาตรของส่วนผสม m 3
องค์ประกอบของส่วนผสมถูกกำหนดโดยปริมาตร (โมลาร์) หรือเศษส่วนมวล
เศษส่วนปริมาตรขององค์ประกอบที่ iคืออัตราส่วนของปริมาตรบางส่วนของส่วนประกอบต่อปริมาตรของส่วนผสม กล่าวคือ ผลรวมของเศษส่วนของปริมาตรของส่วนประกอบของส่วนผสมคือ 1 กล่าวคือ . หากระบุค่าเป็น % ผลรวมจะเท่ากับ 100%
เศษส่วนโมลขององค์ประกอบที่ i n iคืออัตราส่วนของจำนวนกิโลโมลขององค์ประกอบ N ผม ต่อจำนวนกิโลโมลของส่วนผสม N นั่นคือโดยที่ ![]() , , กล่าวคือ จำนวนกิโลโมลของแต่ละส่วนประกอบและของผสมทั้งหมดเท่ากับอัตราส่วนของส่วนประกอบที่เกี่ยวข้องและของผสมโดยรวมต่อปริมาตรที่ใช้โดยหนึ่งกิโลโมล
, , กล่าวคือ จำนวนกิโลโมลของแต่ละส่วนประกอบและของผสมทั้งหมดเท่ากับอัตราส่วนของส่วนประกอบที่เกี่ยวข้องและของผสมโดยรวมต่อปริมาตรที่ใช้โดยหนึ่งกิโลโมล
เมื่อพิจารณาว่าก๊าซในอุดมคติภายใต้สภาวะเดียวกันมีปริมาตรเป็นกิโลโมลเท่ากัน จากนั้นหลังจากการแทนที่เราจะได้: เช่น สำหรับก๊าซในอุดมคติ เศษส่วนโมลาร์และปริมาตรจะเท่ากัน
เศษส่วนมวลขององค์ประกอบที่ iคืออัตราส่วนของมวลของส่วนประกอบต่อมวลของของผสม: , ตามมาด้วยว่ามวลของของผสมจะเท่ากับผลรวมของมวลของส่วนประกอบ และผลรวมของเศษส่วนของมวลของส่วนประกอบจะเท่ากัน ถึง 1 (หรือ 100%)
การแปลงเศษส่วนปริมาตรเป็นเศษส่วนมวลและในทางกลับกันจะขึ้นอยู่กับอัตราส่วนต่อไปนี้:
![]() ,
,
โดยที่ ρ = μ / 22.4, kg / m 3
ตามมาด้วยว่าเศษส่วนมวลขององค์ประกอบ i-th จะถูกกำหนดจากความสัมพันธ์:
 ,
,
โดยที่ความหนาแน่นของส่วนผสม kg / m 3 คือเศษส่วนของปริมาตรของส่วนประกอบที่ i
ในอนาคตสามารถกำหนดได้โดยใช้เศษส่วนปริมาตร
 .
.
ความหนาแน่นส่วนผสมสำหรับเศษส่วนปริมาตรหาได้จากอัตราส่วน
 , ที่ไหน
, ที่ไหน  , (1.22)
, (1.22)
 .
.
ความดันบางส่วนถูกกำหนดโดยสูตร:
![]() หรือ
หรือ  (1.23)
(1.23)
สมการสถานะของส่วนประกอบและของผสมทั้งหมดมีรูปแบบดังนี้
![]() ;
;
![]() ,
,
ดังนั้นหลังจากการแปลงเราได้รับสำหรับ มโหฬารหุ้น
 ,
,  . (1.24)
. (1.24)
ความหนาแน่นและปริมาตรจำเพาะของของผสมสำหรับ มโหฬารแบ่งปัน:
;  . (1.25)
. (1.25)
ในการคำนวณแรงดันบางส่วนจะใช้สูตร:
 . (1.26)
. (1.26)
การแปลงเศษส่วนมวลเป็นเศษส่วนปริมาตรดำเนินการตามสูตร:
 .
.
เมื่อพิจารณาความจุความร้อนของส่วนผสมของก๊าซ ถือว่าเพื่อให้ความร้อน (เย็น) ส่วนผสมของก๊าซ จำเป็นต้องให้ความร้อน (เย็น) ส่วนประกอบแต่ละส่วนของส่วนผสม
โดยที่ Q i =M i c i ∆t คือความร้อนที่ใช้ในการเปลี่ยนอุณหภูมิของส่วนประกอบที่ i-th ของส่วนผสม c i คือความจุความร้อนมวลของส่วนประกอบที่ i-th ของส่วนผสม
ความจุความร้อนของส่วนผสมคำนวณจากอัตราส่วน (หากส่วนผสมกำหนดโดยเศษส่วนมวล)
 ในทำนองเดียวกัน
ในทำนองเดียวกัน  . (1.28)
. (1.28)
ความจุความร้อนเชิงโมลาร์และปริมาตรสำหรับของผสมที่กำหนดโดยเศษส่วนปริมาตรถูกกำหนดโดย
 ;
;  ;
;
 ;
; 
ตัวอย่าง 1.5อากาศแห้งโดยมวลประกอบด้วย g O2 \u003d ออกซิเจน 23.3% และ g N 2 \u003d ไนโตรเจน 76.6% กำหนดองค์ประกอบของอากาศตามปริมาตร (r O2 และ r N 2) และค่าคงที่ก๊าซของส่วนผสม
วิธีการแก้.
1. จากตารางที่ 1 เราหา kg/kmol และ kg/kmol
2. กำหนดเศษส่วนของปริมาตรของออกซิเจนและไนโตรเจน:
1. ค่าคงที่ของก๊าซในอากาศ (ของผสม) ถูกกำหนดโดยสูตร:
 , J/กก. K
, J/กก. K
ตัวอย่าง 1.6. กำหนดปริมาณความร้อนที่ต้องใช้ในการให้ความร้อนแก่ส่วนผสมของแก๊สที่มีมวล M = 2 กก. ที่ P = const ซึ่งประกอบด้วย% โดยน้ำหนัก: , , , , เมื่ออุณหภูมิเปลี่ยนจาก t 1 =900 ° C เป็น t 2 = 1200 ° ค.
วิธีการแก้:
1. กำหนดความจุความร้อนมวลเฉลี่ยของส่วนประกอบที่ประกอบเป็นส่วนผสมของก๊าซที่ P=const และ t 1 =900 o C (จาก P2):
1.0258 กิโลจูล/กก. เค; =1.1045 กิโลจูล/กิโลกรัมเค;
1.1078 กิโลจูล/กก. เค; =2.1097 กิโลจูล/กิโลกรัมเค;
2. เรากำหนดความจุความร้อนมวลเฉลี่ยของส่วนประกอบที่ประกอบเป็นส่วนผสมของก๊าซที่ P=const และ t 1 =1200 o C (จาก P2):
1.0509 กิโลจูล/กก. เค; =1.153 กิโลจูล/กิโลกรัมเค;
1.1359 กิโลจูล/กก. เค; =2.2106 กิโลจูล/กิโลกรัมเค;
3. เรากำหนดความจุความร้อนมวลเฉลี่ยของส่วนผสมสำหรับช่วงอุณหภูมิ: t 2 \u003d 1200 ° C และ t 1 \u003d 900 ° C:
4. ปริมาณความร้อนสำหรับให้ความร้อน 2 กก. ของส่วนผสมที่ P=const:
กฎข้อที่หนึ่งของอุณหพลศาสตร์สร้างความสัมพันธ์เชิงปริมาณระหว่างการเปลี่ยนแปลงในพลังงานภายในของระบบและงานทางกลที่กระทำต่อแรงของแรงดันภายนอกของสิ่งแวดล้อมอันเป็นผลมาจากการจ่ายความร้อนไปยังของไหลทำงาน
สำหรับระบบเทอร์โมไดนามิกแบบปิด สมการของกฎข้อที่หนึ่งมีรูปแบบ
ความร้อนที่ส่งไปยังสารทำงาน (หรือระบบ) ถูกใช้เพื่อเพิ่มพลังงานภายใน (dU) เนื่องจากอุณหภูมิของร่างกายเพิ่มขึ้นและเพื่อทำงานภายนอก (dL) เนื่องจากการขยายตัวของสารทำงานและการเพิ่มขึ้นของ ปริมาณ.
กฎข้อแรกสามารถเขียนเป็น dH=dq+VdP=dq-dL 0 ,
โดยที่ dL 0 \u003d VdP - งานพื้นฐานของการเปลี่ยนแปลงแรงดันเรียกว่างานภายนอก (ทางเทคนิค) ที่มีประโยชน์
dU คือการเปลี่ยนแปลงพลังงานภายในของของไหลทำงาน (ระบบ) ซึ่งรวมถึงพลังงานของการเคลื่อนที่เชิงความร้อนของโมเลกุล (การแปล การหมุน และการสั่นสะเทือน) และพลังงานศักย์ของปฏิกิริยาของโมเลกุล
เนื่องจากการเปลี่ยนแปลงของระบบจากสถานะหนึ่งไปอีกสถานะหนึ่งเกิดขึ้นจากการจ่ายความร้อน ดังนั้น ของไหลทำงานจึงร้อนขึ้นและอุณหภูมิของมันสูงขึ้นโดย dT และปริมาตรเพิ่มขึ้นทีละ dV
อุณหภูมิร่างกายที่เพิ่มขึ้นทำให้พลังงานจลน์ของอนุภาคเพิ่มขึ้น และปริมาณร่างกายที่เพิ่มขึ้นนำไปสู่การเปลี่ยนแปลงพลังงานศักย์ของอนุภาค เป็นผลให้พลังงานภายในของร่างกายเพิ่มขึ้นโดย dU ดังนั้นพลังงานภายใน U เป็นหน้าที่ของสถานะของร่างกายและสามารถแสดงเป็นฟังก์ชันของพารามิเตอร์อิสระสองตัว U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T). การเปลี่ยนแปลงของพลังงานภายในในกระบวนการทางอุณหพลศาสตร์ถูกกำหนดโดยสถานะเริ่มต้น (U 1) และขั้นสุดท้าย (U 2) เท่านั้น กล่าวคือ
ในรูปแบบดิฟเฟอเรนเชียล การเปลี่ยนแปลงของพลังงานภายในจะถูกเขียนขึ้น
ก) เป็นฟังก์ชันของปริมาตรและอุณหภูมิจำเพาะ

b) เป็นหน้าที่ของอุณหภูมิตั้งแต่ , แล้ว
สำหรับการคำนวณในทางปฏิบัติซึ่งจำเป็นต้องคำนึงถึงการเปลี่ยนแปลงของ C v กับอุณหภูมิ มีสูตรเชิงประจักษ์และตารางพลังงานภายในจำเพาะ (มักเป็นฟันกราม) สำหรับก๊าซในอุดมคติ พลังงานภายในโมลาร์ของส่วนผสม U m ถูกกำหนดโดยสูตร
 , เจ/กมล
, เจ/กมล
สำหรับส่วนผสมที่กำหนดโดยเศษส่วนมวล ทางนี้ กำลังภายในมี คุณสมบัติของระบบและกำหนดลักษณะของระบบ.
เอนทัลปีเป็นฟังก์ชันสถานะความร้อนที่แนะนำโดย Kamerling-Onnes (ผู้ชนะ รางวัลโนเบล, 1913) ซึ่งเป็นผลรวมของพลังงานภายในของระบบ U และผลิตภัณฑ์ของความดันของระบบ P และปริมาตร V
เนื่องจากปริมาณที่รวมอยู่ในนั้นเป็นฟังก์ชันของรัฐดังนั้น H จึงเป็นฟังก์ชันสถานะเช่น H \u003d f 1 (P, V); H=f 2 (V,T); H=f 3 (P, T).
การเปลี่ยนแปลงของเอนทาลปี dH ในกระบวนการทางอุณหพลศาสตร์ใดๆ ถูกกำหนดโดยสถานะ H 1 เริ่มต้นและสถานะ H 2 สุดท้าย และไม่ขึ้นอยู่กับธรรมชาติของกระบวนการ หากระบบมีสาร 1 กิโลกรัม จะใช้เอนทาลปีจำเพาะ J/kg
สำหรับก๊าซในอุดมคติ สมการอนุพันธ์จะมีรูปแบบดังนี้
ดังนั้น เอนทาลปีจำเพาะถูกกำหนดโดยสูตร
สมการของกฎข้อที่หนึ่งของอุณหพลศาสตร์คือ dq=dU+Pdυ เมื่องานประเภทเดียวคืองานขยาย Pdυ=d(Pυ)-adP จากนั้น dq=d(U+Pυ)-adP ดังนั้น
งานปฏิบัติ№ 2
หัวข้อ: ความจุความร้อน เอนทาลปี ส่วนผสมของก๊าซในอุดมคติ พลังงานภายใน งาน กระบวนการทางอุณหพลศาสตร์
วัตถุประสงค์ของงาน: การรวมความรู้ที่ได้รับระหว่างการฝึกอบรมเชิงทฤษฎี การได้มาซึ่งทักษะในการดำเนินการคำนวณทางวิศวกรรมความร้อน
ฉัน.คำจำกัดความ สูตร และสมการพื้นฐาน
1. ส่วนผสมของก๊าซในอุดมคติ
ส่วนผสมของแก๊สเป็นส่วนผสมทางกลของก๊าซหลายชนิดที่ไม่มีปฏิกิริยาทางเคมีระหว่างกัน ก๊าซแต่ละชนิดในส่วนผสมเรียกว่าส่วนประกอบก๊าซ มีลักษณะเหมือนไม่มีก๊าซอื่นๆ อยู่ในส่วนผสม กล่าวคือ กระจายอย่างสม่ำเสมอทั่วส่วนผสม ความดันที่กระทำโดยก๊าซแต่ละชนิดของส่วนผสมบนผนังของถังบรรจุเรียกว่าแรงดันบางส่วน กฎพื้นฐานสำหรับของผสมของก๊าซในอุดมคติคือกฎของดาลตัน ซึ่งความดันของของผสมจะเท่ากับผลรวมของแรงดันบางส่วนของก๊าซที่ก่อตัวเป็นส่วนผสม:
2. พลังงานภายใน
พลังงานภายในร่างกายเป็นการรวมกันของพลังงานจลน์ของการเคลื่อนที่ของอนุภาคขนาดเล็กที่ประกอบเป็นร่างกายและพลังงานศักย์ของพวกมัน ปฏิสัมพันธ์ที่กำหนดไว้ แรงดึงดูดหรือแรงผลักซึ่งกันและกัน เป็นไปไม่ได้ที่จะกำหนดค่าสัมบูรณ์ของพลังงานภายใน ดังนั้นในการคำนวณทางอุณหพลศาสตร์ มันไม่ใช่ค่าสัมบูรณ์ของพลังงานภายในที่คำนวณได้ แต่เป็นการเปลี่ยนแปลง กล่าวคือ
![]() หรือ
หรือ ![]()
โดยที่ U 1 และ U 2 - พลังงานภายในของสถานะเริ่มต้นและขั้นสุดท้ายของของไหลทำงาน (แก๊ส)
คุณ 1 และ 2 - เต้น พลังงานภายในของสถานะเริ่มต้นและขั้นสุดท้ายของของไหลทำงาน
จากนี้ไปการเปลี่ยนแปลงของพลังงานภายในไม่ได้ขึ้นอยู่กับธรรมชาติและเส้นทางของกระบวนการ แต่ถูกกำหนดโดยสถานะของของไหลในการทำงานที่จุดเริ่มต้นและจุดสิ้นสุดของกระบวนการของการเปลี่ยนแปลง
คุณสมบัติของก๊าซในอุดมคติคือการไม่มีแรงของปฏิกิริยาของโมเลกุลในนั้น และด้วยเหตุนี้จึงไม่มีพลังงานศักย์ภายใน กล่าวคือ U n \u003d 0 และ U „ \u003d 0 ดังนั้นพลังงานภายในของก๊าซในอุดมคติ:
U=U k =f(T) unu u=uk =f(T).
ฮ.งานแก๊ส.
ในอุณหพลศาสตร์การเปลี่ยนแปลงใด ๆ ในสถานะของของไหลทำงานอันเป็นผลมาจากการแลกเปลี่ยนพลังงานกับ สิ่งแวดล้อมเรียกว่ากระบวนการ ในกรณีนี้ พารามิเตอร์หลักของตัวทำงานจะเปลี่ยนไป:
การเปลี่ยนความร้อนเป็นงานกลสัมพันธ์กับกระบวนการเปลี่ยนสถานะของของไหลทำงาน กระบวนการเปลี่ยนสถานะของก๊าซอาจเป็นกระบวนการขยายและหดตัว สำหรับมวลโดยพลการของก๊าซ M (กก.) งานจะเท่ากับ:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
โดยที่ l \u003d p (v 2 -v 1) J / kg คืองานของแก๊ส 1 กก. หรืองานเฉพาะ
4. ก๊าซเอนทาลปี
เอนทัลปีเป็นพารามิเตอร์ที่กำหนดลักษณะพลังงานศักย์ของการเชื่อมต่อของของไหลทำงาน (แก๊ส) กับสิ่งแวดล้อม เอนทาลปีและเอนทาลปีจำเพาะ:
ฉัน \u003d U + pV, J และฉัน ฉัน \u003d และ + pv, J / kg
5. ความจุความร้อน
ความจุความร้อนจำเพาะคือปริมาณความร้อนที่ต้องจ่ายให้กับก๊าซ 1 กิโลกรัมเพื่อให้ความร้อน 1 ° C ในช่วงอุณหภูมิที่กำหนด
ความจุความร้อนจำเพาะคือ มวล ปริมาตร และกิโลโมล มีการเชื่อมต่อระหว่างความจุความร้อนมวล C ปริมาตร C และกิโลโมล C:
 ;
; 
โดยที่ Vo 22.4 m 3 / kmol - เต้น ปริมาณก๊าซภายใต้สภาวะปกติ
มวล ud. ความจุความร้อนของส่วนผสมก๊าซ:

ปริมาตร ความร้อนจำเพาะส่วนผสมของแก๊ส:

ความร้อนจำเพาะกิโลโมลาร์ของส่วนผสมก๊าซ:

6. สมการหาปริมาณความร้อน
ปริมาณความร้อนที่จ่ายออกหรือถ่ายโดยของไหลทำงาน (แก๊ส) สามารถกำหนดได้โดยสมการ:
Q \u003d M C m (t 2 -t 1), J หรือ Q \u003d VC (t-t), J โดยที่ M และ V คือน้ำหนักหรือปริมาตรของก๊าซ kg หรือ m 3;
t u t - อุณหภูมิของแก๊สในตอนท้ายและตอนต้นของกระบวนการ° C;
C และ C - บีตเฉลี่ยมวลและปริมาตร ความจุความร้อนของแก๊ส
ที่ t cp \u003d J / kgK หรือ J / m 3 K
7. กฎข้อที่หนึ่งของอุณหพลศาสตร์
กฎหมายฉบับนี้พิจารณาถึงการเปลี่ยนแปลงของความร้อนและงานทางกล ตามกฎหมายนี้ ความร้อนจะถูกแปลงเป็นงานเครื่องกล และในทางกลับกัน งานเครื่องกลเป็นความร้อนในปริมาณที่เท่ากันอย่างเคร่งครัด สมการสมมูลความร้อนและงานมีรูปแบบดังนี้
โดยคำนึงถึงหลักการสมมูลของความร้อนและการทำงาน สมการสมดุลความร้อนสำหรับมวลก๊าซตามอำเภอใจ:
Q \u003d U + L และ q \u003d u + l \u003d u -u + l
การแก้ปัญหาII
งาน #1 (#1)
อากาศแห้งในบรรยากาศมีองค์ประกอบมวลโดยประมาณดังต่อไปนี้: g 02 = 23.2%, g N 2 = 76.8%
กำหนดองค์ประกอบปริมาตรของอากาศ ค่าคงที่ของก๊าซ น้ำหนักโมเลกุลปรากฏ ความดันบางส่วนของออกซิเจนและไนโตรเจน ถ้าอากาศเป็น P = 101325 Pa โดยใช้บารอมิเตอร์
ฉันกำหนดองค์ประกอบปริมาตรของอากาศ:
 ;
; ;
;
โดยที่ r คือเศษส่วนมวล
m คือน้ำหนักโมเลกุลสัมพัทธ์
g คือเศษส่วนของปริมาตร
ม.อากาศ =m O2 r O2 +m N2 r N2 = 32 0.209 + 28 0.7908=6.688+22.14=28.83;

 ;
;
โดยที่ R 0 คือค่าคงที่ของแก๊ส
ฉันกำหนดความดันบางส่วนของก๊าซต่างๆ:
P O 2 \u003d P cm r O2 \u003d 101325 0.209 \u003d 21176.9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0.7908 \u003d 80127.81 (Pa);
โดยที่ P O 2 , P N 2 - ความดันบางส่วน;
P cm คือความดันของส่วนผสม
งาน #2 (#2)
เรือถูกแบ่งโดยพาร์ติชั่นเป็น 2 ส่วนโดยปริมาตรคือ V 1 =1.5 ม. 3 และ V 2 =1.0 ม. 3 . ส่วนแรกของปริมาตร V 1 ประกอบด้วย CO 2 ที่ P 1 =0.5 MPa และ t 1 =30°C; ส่วนที่สองของปริมาตร V 2 มี O 2 ที่ P 2 =0.2 MPa และ t 2 =57°C กำหนดมวลและเศษส่วนของปริมาตรของ CO 2 และ O 2 น้ำหนักโมเลกุลที่ชัดเจนของของผสมและค่าคงที่ของแก๊สหลังจากแยกส่วนออกและกระบวนการผสมเสร็จสิ้น
ฉันกำหนดค่าคงที่ของแก๊สแต่ละตัว:
ในการทำเช่นนี้ ฉันจะกำหนดน้ำหนักโมเลกุลสัมพัทธ์: m (CO 2) \u003d 32 + 12 \u003d 44; ม.(O 2)=32;

 ;
;
![]()
 ;
;
จากสมการคุณลักษณะของ Klaiperon ฉันกำหนดมวลของก๊าซ:
 (กิโลกรัม);
(กิโลกรัม);
 (กิโลกรัม);
(กิโลกรัม);
ฉันกำหนดเศษส่วนมวล:


ฉันกำหนดเศษส่วนปริมาตร:


กำหนดน้ำหนักโมเลกุลที่ชัดเจนของอากาศ:
ม.อากาศ \u003d ม. O2 r O 2 + ม. CO2 r CO2 \u003d 32 0.21 + 44 0.79 \u003d 6.72 + 34.74 \u003d 41.48;
ฉันกำหนดค่าคงที่ของก๊าซแต่ละรายการสำหรับอากาศ (R):

 ;
;
งาน #3 (#6)
ในภาชนะที่มีปริมาตร 300 ลิตรมีออกซิเจนที่ความดัน P 1 \u003d 0.2 MPa และ t 1 \u003d 20 0 C ต้องให้ความร้อนเท่าใดเพื่อให้อุณหภูมิออกซิเจนเพิ่มขึ้นเป็น เสื้อ 2 \u003d 300 0 C ? จะเกิดแรงกดดันอะไรในเรือ? สำหรับการคำนวณ ให้ใช้ความร้อนจำเพาะเชิงปริมาตรเฉลี่ยของออกซิเจนที่ n.o. C 02 \u003d 0.935 
ตามกฎของชาร์ลส์ ฉันกำหนดแรงกดดันสุดท้ายของกระบวนการ:
;  (ป๊า);
(ป๊า);
โดยที่ P, T คือพารามิเตอร์ของแก๊ส
ฉันกำหนดค่าคงที่ของก๊าซแต่ละตัวสำหรับออกซิเจน (R):

 ;
;
เนื่องจากกระบวนการเป็นแบบ isochoric ฉันจึงกำหนดปริมาณความร้อนที่ต้องจัดหาตามสูตรที่เหมาะสม: Q v \u003d M C cv (T 2 -T 1) สำหรับสิ่งนี้ ตามสมการคุณลักษณะของ Claiperon ฉันจึงกำหนดมวล ของแก๊ส
 (กิโลกรัม); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J)
(กิโลกรัม); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J)
งาน #4 (#7)
ต้องใช้ความร้อนเท่าใดเพื่อให้ความร้อนของอากาศ 2m 3 ที่แรงดันเกินคงที่ P เช่น \u003d 0.2 MPa จากอุณหภูมิ 100 0 C ถึงอุณหภูมิ 500 0 C ในกรณีนี้อากาศจะทำอะไรได้บ้าง สำหรับการคำนวณ ใช้: ความดันบรรยากาศ P ที่ \u003d 0.1 MPa ความจุความร้อนไอโซบาริกมวลเฉลี่ยของอากาศ C pm \u003d 1.022  ; คำนวณค่าคงที่ของก๊าซโดยคำนึงถึงน้ำหนักโมเลกุลที่ชัดเจนของอากาศ M อากาศ =29.
; คำนวณค่าคงที่ของก๊าซโดยคำนึงถึงน้ำหนักโมเลกุลที่ชัดเจนของอากาศ M อากาศ =29.
ฉันกำหนดค่าคงที่ของก๊าซแต่ละตัวสำหรับอากาศ:

 ;
;
ความดันสัมบูรณ์เท่ากับผลรวมของส่วนเกินและบรรยากาศ P=P est + พี ณ. =0.1+0.2=0.3 MPa
 (กิโลกรัม);
(กิโลกรัม);
เนื่องจากกระบวนการเป็นแบบ isobaric ฉันจึงกำหนด Q และ L ตามสูตรที่เกี่ยวข้อง:
ตามกฎหมาย Gay-Lussac ฉันกำหนดปริมาณสุดท้าย:
 ม. 3;
ม. 3;
Q \u003d M C pm (T 2 -T 1) \u003d 5.56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2.15 \u003d 645000 (J)
งาน #5 (#8)
มีอากาศอยู่ในกระบอกสูบที่ความดัน P=0.5 MPa และอุณหภูมิ t 1 =400 0 C ความร้อนจะถูกกำจัดออกจากอากาศที่ P=const ดังนั้นเมื่อสิ้นสุดกระบวนการ อุณหภูมิ t 2 =0 0 C จะเท่ากับ ชุด ปริมาตรของกระบอกสูบที่มีอากาศ V 1 \u003d 400 l
กำหนดปริมาณความร้อนที่ระบายออก ปริมาตรสุดท้าย การเปลี่ยนแปลงของพลังงานภายใน และการทำงานที่สมบูรณ์แบบของการบีบอัด C pm =1.028  .
.
เนื่องจากกระบวนการเป็นแบบ isobaric ดังนั้นตามกฎหมาย Gay-Lussac ฉันจึงกำหนดปริมาตรสุดท้าย:
 ม. 3;
ม. 3;
จากสมการคุณลักษณะของ Klaiperon ฉันกำหนดมวลของก๊าซ:
จากปัญหาก่อนหน้านี้ R=286.7 
 (กิโลกรัม);
(กิโลกรัม);
ฉันกำหนดปริมาณความร้อนที่ปล่อยออกมา:
Q=MC pm (T 2 -T 1)=1.03 1028 (273-673)=-423536 (J);
ฉันกำหนดปริมาณงานที่ใช้ไป:
L=P (V 2 -V 1)= 500,000 (0.16-0.4)=-120,000 (J);
จากสมการที่กำหนดปริมาณทั้งหมด ฉันกำหนดการเปลี่ยนแปลงของปริมาณพลังงานภายใน:
![]() ; (จ)
; (จ)
ปัญหา #6 (#9)
อากาศที่มีปริมาตร V 1 =0.02 m3 ที่ความดัน P 1 =1.1 MPa และ t 1 =25 s จะขยายตัวในกระบอกสูบที่มีลูกสูบเคลื่อนที่ได้เป็นแรงดัน P 2 =0.11 MPa ค้นหาปริมาตรสุดท้าย V 2 อุณหภูมิสุดท้าย เสื้อ 2 งานที่ทำโดยอากาศ และความร้อนที่จ่าย หากเกิดการขยายตัวในกระบอกสูบ:
ก) isothermally
b) อะเดียแบติกกับเลขชี้กำลังอะเดียแบติก k=1.4
c) polytropic ที่มีดัชนี polytropic n=1.3
กระบวนการไอโซเทอร์มอล:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0.02 1.1 / 0.11 \u003d 0.2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1.1 10 6 0.02Ln(0.2/0.02)=22000J
กระบวนการอะเดียแบติก:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0.02 / (0.11 / 1.1) 1 / 1.4 \u003d 0.1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0.11 / 1.1) 1.4-1 / 1.4 298 \u003d 20.32k
C v \u003d 727.4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1)=2.0275 10 6 J
กระบวนการโพลีทรอปิก:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0.02 / (0.11 / 1.1) 1 / 1.3 \u003d 0.118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0.11 / 1.1) 1.3-1 / 1.3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118)=30000J
Q=(k-n/k-1) l M=((1.4-1.3)/(1.4-1)) 30000=7500J
วรรณกรรม:
1. พลังงาน, มอสโก, 2518.
2. Litvin A.M. "รากฐานทางทฤษฎีของวิศวกรรมความร้อน" สำนักพิมพ์ "พลังงาน" มอสโก 2512
3. Tugunov P.I. , Samsonov A.A. “ พื้นฐานของวิศวกรรมความร้อน, เครื่องยนต์ความร้อนและโรงไฟฟ้าพลังไอน้ำ”, สำนักพิมพ์ Nedra, มอสโก, 1970
4. Krutov V.I. "วิศวกรรมความร้อน" สำนักพิมพ์ "วิศวกรรม" มอสโก 2529
ส่วนผสมของแก๊ส. ความจุความร้อนของก๊าซ
ส่วนผสมของก๊าซเป็นที่เข้าใจกันว่าเป็นส่วนผสมทางกลของก๊าซหลายชนิดที่ไม่มีปฏิกิริยาทางเคมีระหว่างกัน ส่วนผสมของก๊าซอุดมคติเป็นไปตามกฎหมายทั้งหมดที่เกี่ยวข้องกับ ก๊าซในอุดมคติ. องค์ประกอบของส่วนผสมก๊าซถูกกำหนดโดยปริมาณของก๊าซแต่ละชนิดที่รวมอยู่ในส่วนผสม และสามารถระบุได้ด้วยเศษส่วนของมวลหรือปริมาตร:
โดยที่มวลของส่วนประกอบ -th คือปริมาตรของส่วนประกอบ -th และ คือมวลและปริมาตรของส่วนผสมทั้งหมดตามลำดับ
เห็นได้ชัดว่า
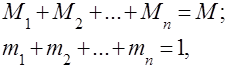
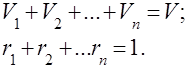
เพื่อความสะดวกในการแก้ปัญหาเชิงปฏิบัติเกี่ยวกับส่วนผสมของแก๊ส แนวคิดเรื่องน้ำหนักโมเลกุลที่เห็นได้ชัดของส่วนผสมของแก๊สจึงถูกนำมาใช้ ซึ่งเป็นมวลเฉลี่ยของน้ำหนักโมเลกุลจริงของส่วนประกอบแต่ละส่วนของของผสม
สมการสถานะสำหรับส่วนผสมของก๊าซมีรูปแบบดังนี้
ส่วนผสมของแก๊สขึ้นอยู่กับแนวคิดของค่าคงที่แก๊สสากล
ความสัมพันธ์ระหว่างความดันของส่วนผสมของแก๊สกับความดันบางส่วนของส่วนประกอบแต่ละส่วนรวมอยู่ในส่วนผสมนั้นถูกกำหนดโดยกฎของดาลตัน:
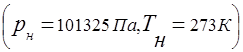
1 ก๊าซมีมวลแตกต่างกันขึ้นอยู่กับความดันและอุณหภูมิ ในเรื่องนี้ ความจุความร้อนเชิงปริมาตรมักจะอ้างถึงมวลของก๊าซที่อยู่ใน 1 เสมอภายใต้สภาวะปกติ ในกรณีนี้ ปริมาตร 1 kmole ของก๊าซต่างๆ คือ 22.4 / kmol และค่าคงที่ของแก๊สสากลคือ . ขึ้นอยู่กับวิธีการจ่ายความร้อนให้กับแก๊ส ความจุความร้อนแบบไอโซบาริกและไอโซโคริกขึ้นอยู่กับวิธีการจ่ายความร้อน อัตราส่วนของปริมาณเหล่านี้เรียกว่าเลขชี้กำลังอะเดียแบติก
ความจุความร้อนและยังสัมพันธ์กันโดยความสัมพันธ์เมเยอร์
ปริมาณความร้อนที่ต้องใช้ในกระบวนการให้ความร้อนก๊าซ 1 กิโลกรัมในช่วงอุณหภูมิตั้งแต่ ถึง ถูกกำหนดโดยสูตร:
โดยที่ และ คือ ความจุความร้อนเฉลี่ยภายใน 0°- และ 0°- ตามลำดับ
หาก (กก.) หรือ () ก๊าซมีส่วนร่วมในกระบวนการดังนั้น
ความจุความร้อนของส่วนผสมก๊าซควรกำหนดโดยสูตร:
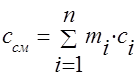
มวล - ;
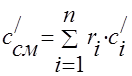
ปริมาตร -;
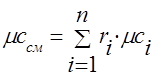
ฟันกราม - .
ในการใช้ความร้อนของก๊าซที่เป็นผลิตภัณฑ์จากการเผาไหม้เชื้อเพลิงในหม้อไอน้ำ จะมีการติดตั้งเครื่องทำความร้อนของอากาศที่จำเป็นสำหรับการเผาไหม้เชื้อเพลิงในท่อก๊าซของส่วนหลัง (รูปที่ 1) ก๊าซที่ออกจากหม้อไอน้ำจะเข้าสู่ฮีตเตอร์อากาศด้วยอุณหภูมิและถูกทำให้เย็นลงโดยปล่อยความร้อนออกไปในอากาศสูงถึง ในท่อก๊าซของหน่วยหม้อไอน้ำ ภายใต้อิทธิพลของการทำงานของเครื่องกำจัดควัน ความดันจะถูกตั้งค่าต่ำกว่าบรรยากาศเล็กน้อย อากาศในฮีตเตอร์อากาศถูกทำให้ร้อนจากอุณหภูมิถึงอุณหภูมิ
ก๊าซไอเสีย
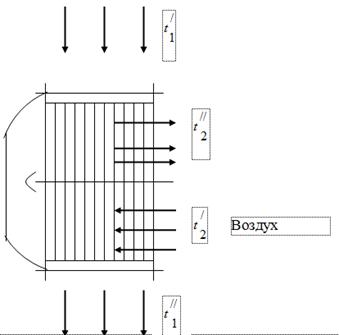
เมื่อทำการทดสอบหน่วยหม้อไอน้ำ ได้รับข้อมูลต่อไปนี้:
อุณหภูมิของก๊าซที่ทางเข้าไปยังเครื่องทำความร้อนอากาศ = 450 °C
อุณหภูมิของก๊าซที่ทางออกของเครื่องทำความร้อนอากาศ = 150 ° C
อุณหภูมิอากาศที่ทางเข้าไปยังเครื่องทำความร้อนอากาศ = 26 ° C
อุณหภูมิอากาศที่ทางออกของเครื่องทำความร้อนอากาศ = 260 ° C
องค์ประกอบเชิงปริมาตรของก๊าซไอเสีย - = 11.5%; = 6.5%; = 17.2%; = 64.8%
ปริมาณการใช้ก๊าซต่อชั่วโมงอยู่ที่ 50 ·/ชม.
ดูดฝุ่นในท่อแก๊ส - น้ำ 15 มม. ศิลปะ.
ความดันบรรยากาศ 760 mm Hg. ศิลปะ.
กำหนด:
น้ำหนักโมเลกุลที่ชัดเจนของก๊าซไอเสีย
ค่าคงที่ก๊าซไอเสีย
เศษส่วนของน้ำหนัก (มวล) ของส่วนประกอบแต่ละชิ้นที่ประกอบเป็นก๊าซไอเสีย
แรงดันบางส่วนของส่วนประกอบ:
การไหลของอากาศรายชั่วโมง
สมมติว่าความร้อนทั้งหมดที่ปล่อยออกมาจากก๊าซนั้นถูกอากาศดูดเข้าไป
การพึ่งพาความจุความร้อนต่ออุณหภูมิถือเป็นเส้นโค้ง
1. น้ำหนักโมเลกุลที่เห็นได้ชัดของก๊าซไอเสีย
0.115 44 + 0.065 18 + 0.172 32 + 0.648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. ค่าคงที่ก๊าซไอเสีย
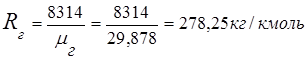
3. เศษส่วนมวลส่วนประกอบแก๊ส
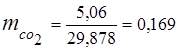
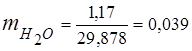
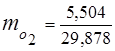
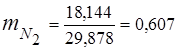
4. แรงกดดันบางส่วนของส่วนประกอบ
ผลลัพธ์ของการคำนวณจะถูกป้อนในตาราง
|
ตัวเลือก |
ส่วนผสมของแก๊ส |
|||
|
|
||||
|
|
||||
|
|
5. ปริมาณการใช้อากาศรายชั่วโมง
ปริมาณการใช้อากาศคำนวณจากสมการสมดุลความร้อนของเครื่องทำความร้อนอากาศ
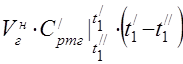
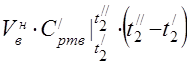
ความจุความร้อนกรามเฉลี่ยที่ 450 °C
ความจุความร้อนจำเพาะเฉลี่ยของส่วนประกอบในช่วงอุณหภูมิ 0 ... 450 ° C













 .
(1.28)
.
(1.28)