ความจุความร้อนของไฮโดรเจนซัลไฟด์ ณ อุณหภูมิต่างๆ ความจุความร้อนจำเพาะของก๊าซธรรมชาติ
ไม่เฉพาะเจาะจง แต่ความจุทางความร้อนรวม ตามความรู้สึกทางกายภาพที่ยอมรับกันโดยทั่วไป คือความสามารถของสารในการทำให้ร้อนขึ้น อย่างน้อยนั่นคือสิ่งที่ตำราเกี่ยวกับฟิสิกส์ความร้อนบอกเรา - นี้ คำนิยามคลาสสิกความจุความร้อน(ถ้อยคำที่ถูกต้อง). อันที่จริง นี่เป็นคุณสมบัติทางกายภาพที่น่าสนใจ เรารู้จักกันน้อยในชีวิตประจำวัน "ด้านของเหรียญ" ปรากฎว่าเมื่อได้รับความร้อนจากภายนอก (ความร้อน, การอุ่นเครื่อง) สารทั้งหมดจะไม่ตอบสนองต่อความร้อนเท่า ๆ กัน ( พลังงานความร้อน) และความร้อนขึ้นต่างกัน ความสามารถ GAS ที่มาจากธรรมชาติใช้เป็นเชื้อเพลิงรับ รับ รักษา และสะสม (สะสม) พลังงานความร้อน เรียกว่าความจุความร้อนของก๊าซธรรมชาติที่ติดไฟได้. และตัวเธอเอง ความจุความร้อนของมีเทนเป็นลักษณะทางกายภาพที่อธิบายคุณสมบัติทางอุณหฟิสิกส์ของเชื้อเพลิงก๊าซ ในเวลาเดียวกัน ในด้านการใช้งานที่แตกต่างกัน ขึ้นอยู่กับกรณีปฏิบัติเฉพาะ สิ่งหนึ่งที่อาจกลายเป็นสิ่งสำคัญสำหรับเรา ตัวอย่างเช่น: ความสามารถของสารที่จะรับ อบอุ่นหรือความสามารถในการสะสม พลังงานความร้อนหรือ "พรสวรรค์" ที่จะรักษามันไว้ อย่างไรก็ตาม แม้จะมีความแตกต่างบ้าง ในแง่กายภาพ เราจะอธิบายคุณสมบัติที่เราต้องการ ความจุความร้อนของมีเทน.
อุปสรรคเล็กๆ น้อยๆ แต่ "น่ารังเกียจ" ของธรรมชาติพื้นฐานคือความสามารถในการทำให้ร้อนขึ้น - ความจุความร้อนของมีเทนเกี่ยวข้องโดยตรงไม่เพียง องค์ประกอบทางเคมีโครงสร้างโมเลกุลของสาร แต่ยังรวมถึงปริมาณ (น้ำหนัก มวล ปริมาตร) เนื่องจากการเชื่อมต่อที่ "ไม่พึงประสงค์" ดังกล่าวนายพล ความจุความร้อนของมีเทนกลายเป็นลักษณะทางกายภาพของสารที่ไม่สะดวกเกินไป เนื่องจากพารามิเตอร์ที่วัดค่าได้หนึ่งค่าจะอธิบายถึง "สองสิ่งที่แตกต่างกัน" ในเวลาเดียวกัน คือลักษณะจริงๆ คุณสมบัติทางความร้อนของก๊าซธรรมชาติอย่างไรก็ตาม "ผ่าน" ยังคำนึงถึงปริมาณของมันด้วย ก่อตัวเป็นคุณลักษณะเฉพาะชนิดหนึ่งซึ่งฟิสิกส์ความร้อน "สูง" และปริมาณสสาร "ซ้ำซาก" (ในกรณีของเรา: เชื้อเพลิงก๊าซ) เชื่อมต่อกันโดยอัตโนมัติ
เหตุใดเราจึงต้องการลักษณะทางอุณหพลศาสตร์ซึ่งมีการติดตาม "จิตใจที่ไม่เพียงพอ" อย่างชัดเจน จากมุมมองทางฟิสิกส์ ผลรวม ความจุความร้อนของมีเทน(ด้วยวิธีที่เงอะงะที่สุด) ไม่เพียง แต่พยายามอธิบายปริมาณพลังงานความร้อนที่สามารถสะสมในเชื้อเพลิงก๊าซ แต่ยัง "แจ้งให้เราทราบ" เกี่ยวกับปริมาณด้วย ก๊าซธรรมชาติที่เผาไหม้ได้. มันกลับกลายเป็นความไร้สาระและไม่ชัดเจน เข้าใจได้ มั่นคงและถูกต้อง ลักษณะทางความร้อนของมีเทน. แทนที่จะเป็นค่าคงที่ที่เป็นประโยชน์ซึ่งเหมาะสำหรับการใช้งานจริง การคำนวณทางเทอร์โมฟิสิกส์เราได้รับพารามิเตอร์ลอยตัวซึ่งเป็นผลรวม (อินทิกรัล) ของปริมาณความร้อนที่ได้รับ ก๊าซธรรมชาติและมวลหรือปริมาตรของมีเทน
แน่นอนขอบคุณสำหรับ "ความกระตือรือร้น" แต่ปริมาณ ก๊าซเชื้อเพลิงธรรมชาติฉันสามารถวัดตัวเองได้ ได้รับผลลัพธ์ในรูปแบบ "มนุษย์" ที่สะดวกกว่ามาก ปริมาณ ก๊าซธรรมชาติที่เผาไหม้ได้ฉันไม่ต้องการ "แยก" ด้วยวิธีการทางคณิตศาสตร์และการคำนวณโดยใช้สูตรที่ซับซ้อนจากทั่วไป ความจุความร้อนของมีเทนที่อุณหภูมิต่างๆ กัน แต่หาน้ำหนัก (มวล) เป็นกรัม (g, g), กิโลกรัม (kg), ตัน (ตัน), ลูกบาศก์ (ลูกบาศก์เมตร, ลูกบาศก์เมตร, ลบ.ม.), ลิตร (l) หรือ มิลลิลิตร (มล. ). โดยเฉพาะอย่างยิ่งตั้งแต่ คนฉลาดนานมาแล้วมีเครื่องมือวัดที่เหมาะกับวัตถุประสงค์เหล่านี้ ตัวอย่างเช่น เครื่องชั่งหรืออุปกรณ์อื่นๆ
โดยเฉพาะอย่างยิ่ง "ลักษณะการลอยตัวที่น่ารำคาญ" ของพารามิเตอร์: ทั่วไป ความจุความร้อนของ GAS ที่เกิดขึ้นตามธรรมชาติ. "อารมณ์" ที่ไม่คงที่และเปลี่ยนแปลงของเขา เมื่อเปลี่ยน "ขนาดหรือปริมาณการให้บริการ" ความจุความร้อนของก๊าซธรรมชาติ ณ อุณหภูมิต่างๆเปลี่ยนแปลงทันที ส่วนผสมของก๊าซที่ติดไฟได้มากขึ้น ปริมาณทางกายภาพ ค่าสัมบูรณ์ ความจุความร้อนของมีเทน- เพิ่มขึ้น ปริมาณส่วนผสมของก๊าซที่ติดไฟได้น้อยลง ค่า ความจุความร้อนของมีเทนลดลง “เสื่อมเสีย” บ้าง เมิน! กล่าวอีกนัยหนึ่ง สิ่งที่เรา "มี" ไม่สามารถถือเป็นคำอธิบายที่คงที่ได้ในทางใดทางหนึ่ง ลักษณะทางอุณหพลศาสตร์ของก๊าซธรรมชาติที่อุณหภูมิต่างๆ. และเป็นที่พึงปรารถนาสำหรับเราที่จะ "มี" ค่าสัมประสิทธิ์คงที่ที่เข้าใจได้ ซึ่งเป็นพารามิเตอร์อ้างอิงที่แสดงลักษณะเฉพาะ คุณสมบัติทางความร้อนเชื้อเพลิงก๊าซ โดยไม่มี "การอ้างอิง" ถึงปริมาณก๊าซมีเทน (น้ำหนัก มวล ปริมาตร) จะทำอย่างไร?
นี่คือที่มาของวิธีการง่ายๆ แต่ "เป็นวิทยาศาสตร์มาก" เพื่อช่วยเหลือเรา ไม่ใช่แค่ปลัดอำเภอเท่านั้น "อู๊ด. - เจาะจง", ก่อน ปริมาณทางกายภาพแต่เพื่อการแก้ปัญหาที่หรูหราที่เกี่ยวข้องกับการยกเว้นจำนวนของเรื่องจากการพิจารณา โดยธรรมชาติแล้วพารามิเตอร์ "อึดอัดฟุ่มเฟือย": มวลหรือปริมาตร ก๊าซธรรมชาติที่เผาไหม้ได้เป็นไปไม่ได้อย่างแน่นอนที่จะออกกฎ อย่างน้อยก็ด้วยเหตุผลที่ว่าหากไม่มีปริมาณก๊าซมีเทน ก็จะไม่มี “หัวข้อสนทนา” นั่นเอง และสารที่ควรจะเป็น ดังนั้นเราจึงเลือกมาตรฐานที่มีเงื่อนไขของมวลหรือปริมาตรซึ่งถือได้ว่าเป็นหน่วยที่เหมาะสมสำหรับการกำหนดค่าของสัมประสิทธิ์ "C" ที่เราต้องการ สำหรับ น้ำหนักเชื้อเพลิงก๊าซธรรมชาติหน่วยมวลของก๊าซมีเทนซึ่งสะดวกในการใช้งานจริงกลายเป็น 1 กิโลกรัม (กก.)
ตอนนี้เรา เราทำให้ก๊าซธรรมชาติหนึ่งกิโลกรัมร้อนขึ้น 1 องศา และปริมาณความร้อน (พลังงานความร้อน)เราต้องร้อน ส่วนผสมของแก๊สหนึ่งองศา - นี่คือพารามิเตอร์ทางกายภาพที่ถูกต้องของเรา ค่าสัมประสิทธิ์ "C"ค่อนข้างครบถ้วนและชัดเจนอธิบายถึงหนึ่งในนั้น คุณสมบัติทางความร้อนของก๊าซธรรมชาติที่อุณหภูมิต่างๆ. โปรดทราบว่าตอนนี้เรากำลังจัดการกับคำอธิบายลักษณะ คุณสมบัติทางกายภาพสาร แต่ไม่พยายาม "แจ้งให้เราทราบเพิ่มเติม" เกี่ยวกับปริมาณของมัน สะดวกสบาย? ไม่มีคำพูด มันเป็นเรื่องที่แตกต่างไปจากเดิมอย่างสิ้นเชิง อย่างไรก็ตามตอนนี้เราไม่ได้พูดถึงเรื่องทั่วไป ความจุความร้อนของมีเทน. ทุกอย่างเปลี่ยนไปแล้ว. นี่คือความร้อนเฉพาะของก๊าซธรรมชาติซึ่งบางครั้งเรียกอีกชื่อหนึ่งว่า ยังไง? ใหญ่มาก ความจุความร้อนของก๊าซธรรมชาติที่ติดไฟได้. เฉพาะ (ud.) และมวล (m.) - ในกรณีนี้: คำพ้องความหมายหมายถึงสิ่งที่เราต้องการ ค่าสัมประสิทธิ์ "C".
ตารางที่ 1 ค่าสัมประสิทธิ์: ความจุความร้อนจำเพาะของก๊าซธรรมชาติ (sp.) ความจุทางความร้อนมวลของก๊าซธรรมชาติที่ติดไฟได้ ข้อมูลอ้างอิง.
ใส่เพียงแค่ความจุความร้อน กับร่างกายเรียกว่าปริมาณความร้อนที่ต้องเสียไป กระบวนการนี้เพื่อให้ร่างกายร้อนขึ้นหนึ่งองศา: .
โดยปกติแล้ว ความจุความร้อนจะอ้างอิงถึงหน่วยของปริมาณของสาร และขึ้นอยู่กับหน่วยที่เลือก
ความจุความร้อนมวลจำเพาะ กับอ้างถึงก๊าซ 1 กิโลกรัม J/(kgK);
ความจุความร้อนเชิงปริมาตรจำเพาะ กับ´, หมายถึงปริมาณของก๊าซที่บรรจุในปริมาตร 1 ม. 3 ภายใต้สภาวะปกติ, J / (ม. 3 K);
ความจุความร้อนจำเพาะของโมลาร์ μ กับ, อ้างอิงถึงหนึ่งกิโลโมล J / (kmolK)
ความสัมพันธ์ระหว่างความจุความร้อนจำเพาะถูกกำหนดโดยความสัมพันธ์ที่ชัดเจน:
กับ= μ กับ/μ; กับ´= กับρ n. (2.13)
โดยที่ ρ n คือความหนาแน่นของก๊าซภายใต้สภาวะปกติ
การเปลี่ยนแปลงของอุณหภูมิร่างกายโดยมีปริมาณความร้อนเท่ากันขึ้นอยู่กับธรรมชาติของกระบวนการที่เกิดขึ้น ความจุความร้อนเป็นหน้าที่ของกระบวนการ. ซึ่งหมายความว่าของไหลทำงานชนิดเดียวกันนั้นต้องการปริมาณความร้อนที่แตกต่างกันเพื่อให้ความร้อน 1 K ทั้งนี้ขึ้นอยู่กับกระบวนการ ขนาดที่เป็นตัวเลข กับแปรผันตั้งแต่ + ∞ ถึง – ∞
ในการคำนวณทางอุณหพลศาสตร์ ความสำคัญอย่างยิ่งมี:
ความจุความร้อนที่ความดันคงที่
กับพี = δ ถามหน้า/ ดีที, (2.14)
ถาม p , นำเข้าสู่ร่างกายในกระบวนการที่ความดันคงที่, สู่การเปลี่ยนแปลงของอุณหภูมิของร่างกาย ดีที;
ความจุความร้อนที่ปริมาตรคงที่
กับ โวลต์ = δ ถาม โวลต์ /ดีที, (2.15)
เท่ากับอัตราส่วนของปริมาณความร้อน δ ถาม โวลต์, นำเข้าสู่ร่างกายในกระบวนการที่ปริมาตรคงที่, สู่การเปลี่ยนแปลงของอุณหภูมิร่างกาย ดีที.
ตามกฎข้อที่หนึ่งของอุณหพลศาสตร์สำหรับระบบปิด δ ถาม = ดู่ + พีดีวี.
โดยคำนึงถึงความจริงที่ว่า 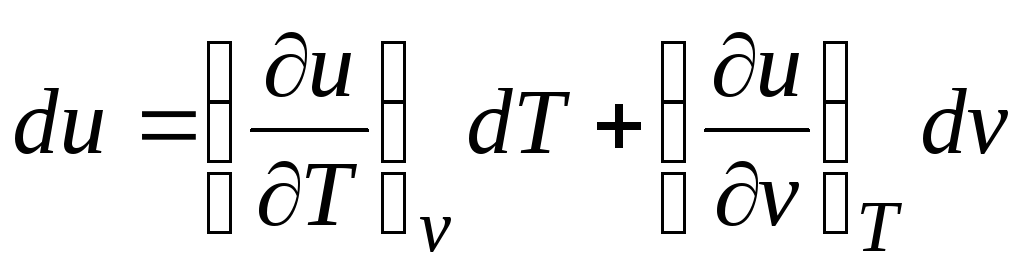 (ความสัมพันธ์ (2.1))
(ความสัมพันธ์ (2.1))
Δ ถาม = (∂ยู/∂ต) โวลต์ ดีที + [(∂ยู/∂โวลต์) ต + หน้า]ดีวี. (2.16)
สำหรับกระบวนการไอโซโคริก ( โวลต์=const) สมการนี้อยู่ในรูปแบบ 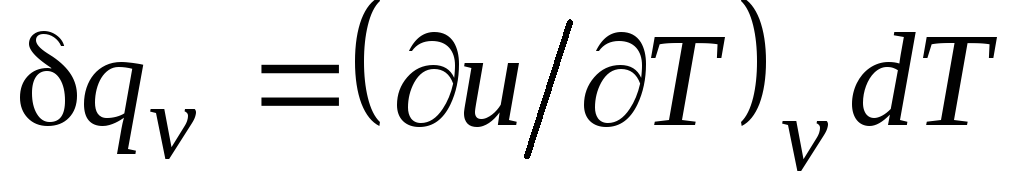 และโดยคำนึงถึง (2.15) เราได้รับสิ่งนั้น
และโดยคำนึงถึง (2.15) เราได้รับสิ่งนั้น
ค โวลต์ = (∂ยู/∂ต) โวลต์ . (2.17)
สำหรับก๊าซในอุดมคติ
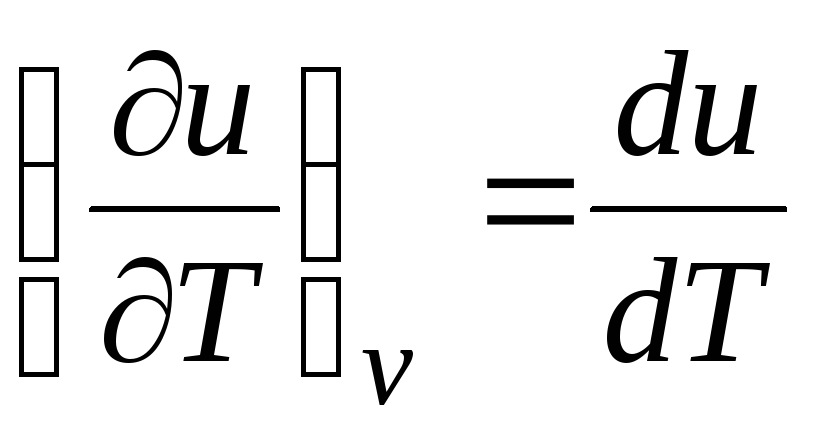 (สมการ 2.2) ดังนั้น
(สมการ 2.2) ดังนั้น
ค โวลต์ = ดู่/ดีที. (2.18)
สำหรับกระบวนการไอโซบาริก ( ร=const) จากสมการ (2.16) และ (2.14) ที่เราได้รับ
คพี = (∂ ยู/∂ต) โวลต์ + [(∂ยู/∂โวลต์) ต + หน้า](ดีวี/ดีที) หน้า
เนื่องจากพลังงานภายใน ก๊าซในอุดมคติถูกกำหนดโดยอุณหภูมิเท่านั้นและไม่ขึ้นอยู่กับปริมาตรเฉพาะ
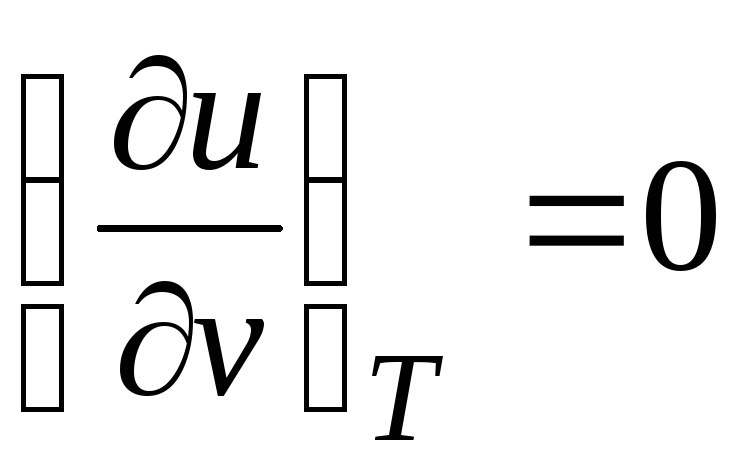 .
(2.19)
.
(2.19)
จากสมการ Clapeyron (1.4) พีวี
= RT(1.3) ดังนี้ 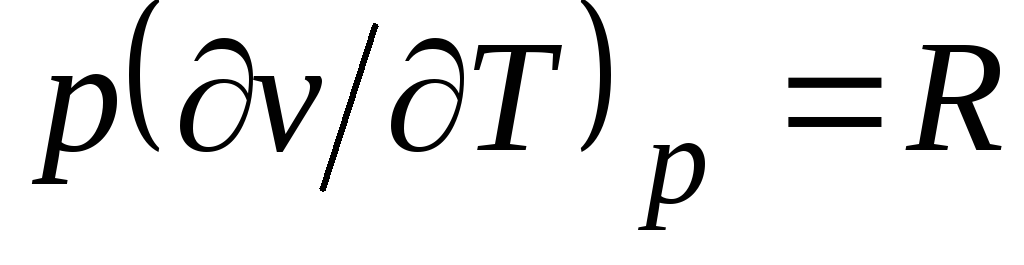 , ที่ไหน
, ที่ไหน
คพี= กับ โวลต์ + ร. (2.20)
ความสัมพันธ์ (2.20) เรียกว่าสมการของเมเยอร์ และเป็นหนึ่งในสมการหลักในอุณหพลศาสตร์ทางเทคนิคของก๊าซในอุดมคติ
กำลังดำเนินการ โวลต์\u003d const ความร้อนที่จ่ายให้กับแก๊สจะเปลี่ยนพลังงานภายในเท่านั้น ในขณะที่ในกระบวนการ p \u003d const ความร้อนจะถูกใช้ทั้งเพื่อเพิ่มพลังงานภายในและเพื่อดำเนินการขยายตัว นั่นเป็นเหตุผล คพี มากขึ้น กับ v โดยจำนวนงานนี้
สูตร ![]() กำหนดความจุความร้อนที่แท้จริงที่เรียกว่านั่นคือค่าของความจุความร้อนที่อุณหภูมิที่กำหนด ในทางปฏิบัติ ความจุความร้อนถูกนำมาใช้กันอย่างแพร่หลายในการคำนวณปริมาณความร้อน ถาม 12 ที่ต้องใช้เพื่อทำให้ร่างกายร้อนขึ้นจากอุณหภูมิเดียว ( ที 1) ไปที่อื่น ( ที 2) (หรือซึ่งจะปล่อยออกมาเมื่อเย็นตัวจาก ที 2 ถึง ที 1).
กำหนดความจุความร้อนที่แท้จริงที่เรียกว่านั่นคือค่าของความจุความร้อนที่อุณหภูมิที่กำหนด ในทางปฏิบัติ ความจุความร้อนถูกนำมาใช้กันอย่างแพร่หลายในการคำนวณปริมาณความร้อน ถาม 12 ที่ต้องใช้เพื่อทำให้ร่างกายร้อนขึ้นจากอุณหภูมิเดียว ( ที 1) ไปที่อื่น ( ที 2) (หรือซึ่งจะปล่อยออกมาเมื่อเย็นตัวจาก ที 2 ถึง ที 1).
หากความจุความร้อนไม่เปลี่ยนแปลงในช่วงอุณหภูมิที่ระบุ
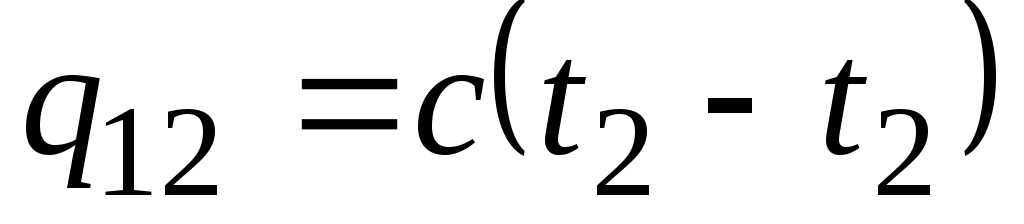 , กิโลจูล/กก. และ
, กิโลจูล/กก. และ 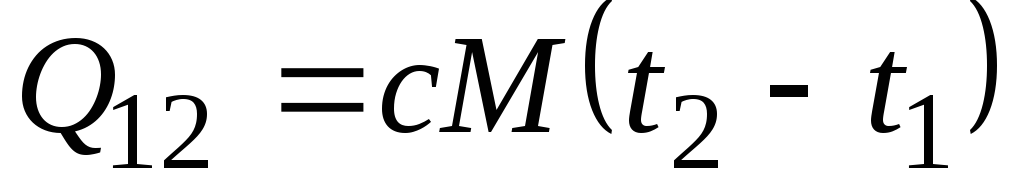 , กิโลจูล (2.21)
, กิโลจูล (2.21)
สูตรนี้สามารถใช้สำหรับการคำนวณโดยประมาณ (ไม่แม่นยำมาก) ตัวอย่างเช่น ความจุความร้อนจำเพาะของน้ำที่อุณหภูมิห้องคือ 4.187 kJ/(kgC) และอากาศ 1 kJ/(kgC) เนื่องจากความจุความร้อนของสารเกือบทั้งหมดเปลี่ยนแปลง (ส่วนใหญ่มักจะเพิ่มขึ้น) เมื่ออุณหภูมิเพิ่มขึ้นจึงจำเป็นต้องใช้สูตรอย่างเคร่งครัด
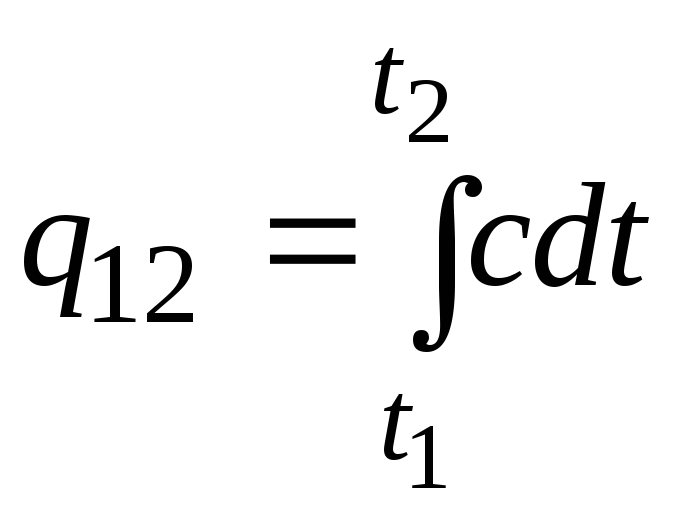 .
(2.21ก)
.
(2.21ก)
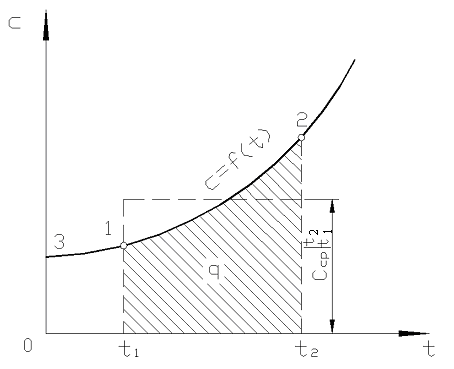
บนมะเดื่อ 2.2 แมกนิจูด ถาม 12 แสดงเป็นพื้นที่แรเงา ดูเหมือนว่าวิธีที่ง่ายที่สุดโดยใช้ทฤษฎีบทค่าเฉลี่ยคือการเขียน
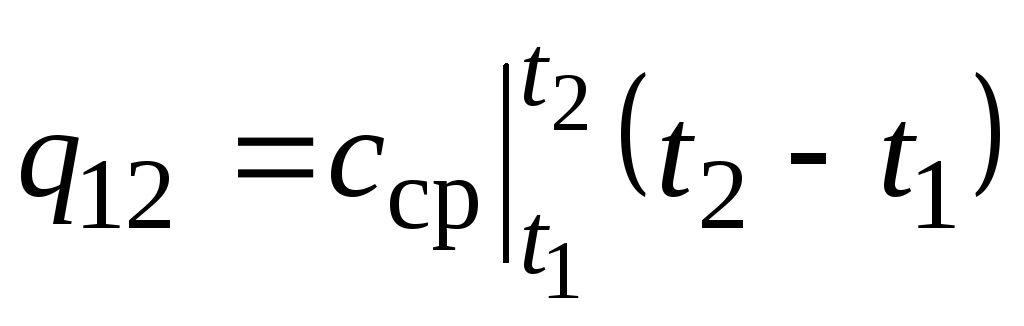 ,
(2.22)
,
(2.22)
ที่ไหน 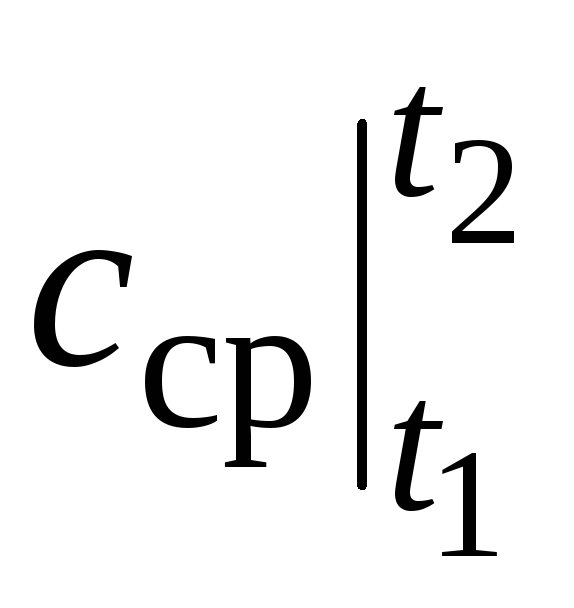 คือความจุความร้อนเฉลี่ยในช่วงอุณหภูมิ ที 1 …ที 2 .
คือความจุความร้อนเฉลี่ยในช่วงอุณหภูมิ ที 1 …ที 2 .
ข้าว. 2.2. ขึ้นอยู่กับความจุความร้อนที่แท้จริงกับอุณหภูมิ
อย่างไรก็ตาม สำหรับการคำนวณจริง สัญกรณ์ดังกล่าวไม่สะดวกมาก เนื่องจากเลือกความจุความร้อนจากตาราง และ  ขึ้นอยู่กับวิธีการ ที 1 และ จาก ที 2. ตารางฟังก์ชันที่มีสองอาร์กิวเมนต์จะยุ่งยากมาก
ขึ้นอยู่กับวิธีการ ที 1 และ จาก ที 2. ตารางฟังก์ชันที่มีสองอาร์กิวเมนต์จะยุ่งยากมาก
ในทางปฏิบัติให้ดำเนินการดังนี้ ปริมาณความร้อนที่ต้องการแสดงเป็นความแตกต่างระหว่างปริมาณที่ต้องการเพื่อให้ความร้อนแก่ร่างกายตั้งแต่ 0 Сถึงอุณหภูมิ ที 2 และ ที 1 ตามลำดับ (รูปที่ 2.2)
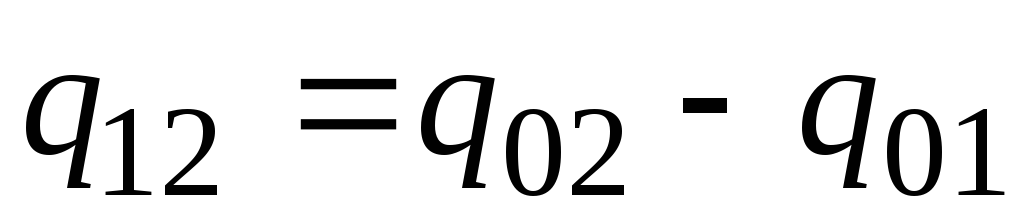 . (2.23)
. (2.23)
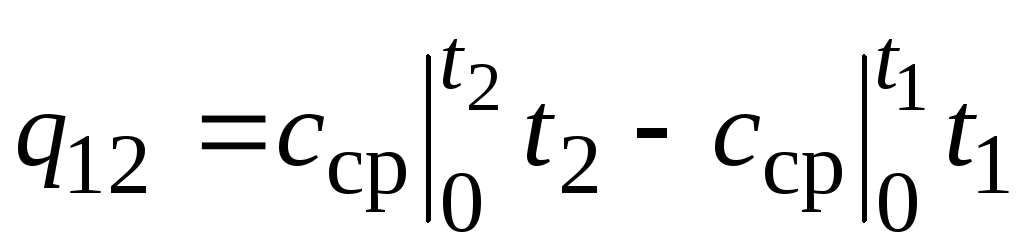 ,
(2.24)
,
(2.24)
ที่ไหน  - ความจุความร้อนเฉลี่ยในช่วงอุณหภูมิ 0… ทีค.
- ความจุความร้อนเฉลี่ยในช่วงอุณหภูมิ 0… ทีค.
ค่าของความจุความร้อนเฉลี่ย  สำหรับสารที่กำหนด (และกระบวนการที่กำหนด เช่น กับ รหรือ ค โวลต์) ขึ้นอยู่กับอุณหภูมิเดียวเท่านั้น ที. เป็นความจุความร้อนที่กำหนดในตารางทั้งหมดภายใต้ชื่อ "ค่าเฉลี่ย" ที่พูดมาก็จริงสำหรับ กับ
(กับ รและ ค โวลต์) เช่นเดียวกับสำหรับ กับ และ กับ. ตัวอย่างเช่น ตารางด้านล่างแสดงความจุความร้อนเทียบกับอุณหภูมิของก๊าซทั่วไปบางชนิด ควรเน้นว่าในสูตร (2.24) อุณหภูมิจะถูกแทนที่ด้วยองศาเซลเซียส
สำหรับสารที่กำหนด (และกระบวนการที่กำหนด เช่น กับ รหรือ ค โวลต์) ขึ้นอยู่กับอุณหภูมิเดียวเท่านั้น ที. เป็นความจุความร้อนที่กำหนดในตารางทั้งหมดภายใต้ชื่อ "ค่าเฉลี่ย" ที่พูดมาก็จริงสำหรับ กับ
(กับ รและ ค โวลต์) เช่นเดียวกับสำหรับ กับ และ กับ. ตัวอย่างเช่น ตารางด้านล่างแสดงความจุความร้อนเทียบกับอุณหภูมิของก๊าซทั่วไปบางชนิด ควรเน้นว่าในสูตร (2.24) อุณหภูมิจะถูกแทนที่ด้วยองศาเซลเซียส
ความจุความร้อนเฉลี่ยต่อโมลาร์ของก๊าซต่างๆ ที่ ร=const
(อ้างอิงจาก MP Vukalovich, V.A. Kirillin, V.N. Timofeev)
|
ที, ค |
กับ ร, กิโลจูล/(kmolK) |
|||||||
|
N 2 บรรยากาศ | ||||||||
ในตารางนี้ ค่า กับ p ให้ผ่าน 100 С เนื่องจากอุณหภูมิไม่เปลี่ยนแปลงมากนักจึงสามารถหาค่ากลางได้โดยการอนุมานเชิงเส้น จำวิธีการนี้ทำ มีค่าฟังก์ชันแบบตาราง ย
= ฉ(x) ที่ 1 (เมื่อ เอ็กซ์= เอ็กซ์ 1) และ ที่ 2 (เมื่อ เอ็กซ์= เอ็กซ์ 2). ค่าฟังก์ชัน ที่(เอ็กซ์) ที่ เอ็กซ์ 1 <เอ็กซ์<เอ็กซ์ 2 เท่ากับ 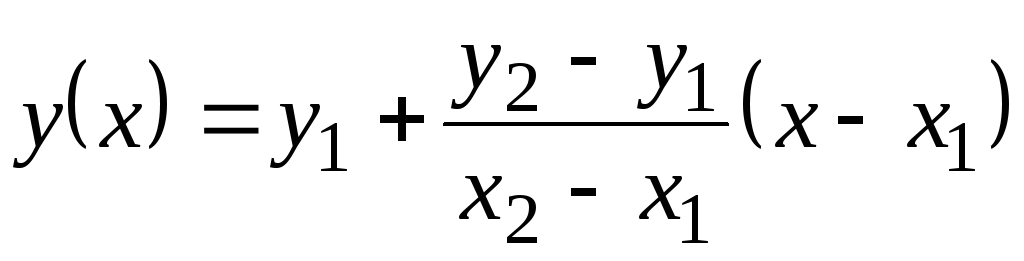 . สูตรนี้เป็นจริงทั้งสำหรับฟังก์ชันที่เพิ่มขึ้นแบบโมโนโทนิก (เมื่อ ที่ 2 >ที่ 1) และสำหรับการลดลงแบบโมโนโทนิก ( ที่ 2 <ที่ 1); ในกรณีนี้ เศษส่วนจะเป็นลบเนื่องจาก เอ็กซ์ 2 > เอ็กซ์ 1 เสมอ
. สูตรนี้เป็นจริงทั้งสำหรับฟังก์ชันที่เพิ่มขึ้นแบบโมโนโทนิก (เมื่อ ที่ 2 >ที่ 1) และสำหรับการลดลงแบบโมโนโทนิก ( ที่ 2 <ที่ 1); ในกรณีนี้ เศษส่วนจะเป็นลบเนื่องจาก เอ็กซ์ 2 > เอ็กซ์ 1 เสมอ
ตารางแสดงค่าการนำความร้อนของก๊าซขึ้นอยู่กับอุณหภูมิและความดัน
ค่าการนำความร้อนแสดงไว้สำหรับอุณหภูมิในช่วงตั้งแต่ 20 K (-253 °C) ถึง 1500 K (1227 °C) และความดันตั้งแต่ 1 ถึง 1,000 บรรยากาศ
โต๊ะ ให้ค่าการนำความร้อนของก๊าซต่อไปนี้: , , ฟรีออน-14 CF 4 , เอทิลีน C 2 H 4 . หน่วยของการนำความร้อนคือ W/(m deg)
ควรสังเกตว่า การนำความร้อนของก๊าซจะเพิ่มขึ้นตามอุณหภูมิและความดันที่เพิ่มขึ้น. ตัวอย่างเช่น ค่าการนำความร้อนของก๊าซแอมโมเนียที่อุณหภูมิห้องและความดันบรรยากาศปกติคือ 0.024 W / (m deg) และเมื่อได้รับความร้อน 300 องศา ค่าการนำความร้อนจะเพิ่มขึ้นเป็นค่า 0.067 W / (m deg) หากความดันของก๊าซนี้เพิ่มขึ้นถึง 300 บรรยากาศ ค่าการนำความร้อนจะยิ่งสูงขึ้น และจะมีค่า 0.108 W / (m deg)
หมายเหตุ ระวัง! ค่าการนำความร้อนในตารางแสดงด้วยปัจจัย 10 3 . อย่าลืมหารด้วย 1,000!
การนำความร้อนของก๊าซอนินทรีย์ขึ้นอยู่กับอุณหภูมิ
ตารางแสดงค่าการนำความร้อนของก๊าซอนินทรีย์ขึ้นอยู่กับอุณหภูมิที่ความดันบรรยากาศปกติ ค่าการนำความร้อนของก๊าซจะแสดงที่อุณหภูมิตั้งแต่ 80 ถึง 1,500 K (-193 ... 1227 ° C)
ตารางแสดงค่าการนำความร้อนของก๊าซต่อไปนี้: ไนตรัสออกไซด์ N 2 O, ซัลเฟอร์เฮกซาฟลูออไรด์ SF 6, ไนตริกออกไซด์ NO, ไฮโดรเจนซัลไฟด์ H 2 S, แอมโมเนีย NH 3, ซัลเฟอร์ไดออกไซด์ SO 2, ไอน้ำ H 2 O, คาร์บอนไดออกไซด์ CO 2 , ไอน้ำหนัก D 2 O , อากาศ
ควรสังเกตว่า ค่าการนำความร้อนของก๊าซอนินทรีย์จะเพิ่มขึ้นตามอุณหภูมิของก๊าซที่เพิ่มขึ้น
หมายเหตุ: ค่าการนำความร้อนของก๊าซในตารางแสดงด้วยปัจจัย 10 3 . อย่าลืมหารด้วย 1,000!
การนำความร้อนของก๊าซอินทรีย์เป็นฟังก์ชันของอุณหภูมิ
ตารางแสดงค่าการนำความร้อนของก๊าซอินทรีย์และไอระเหยของของเหลวบางชนิดขึ้นอยู่กับอุณหภูมิที่ความดันบรรยากาศปกติ ค่าการนำความร้อนของก๊าซแสดงไว้ในตารางในช่วงอุณหภูมิตั้งแต่ 120 ถึง 800 เค
มีค่าการนำความร้อนของก๊าซอินทรีย์และของเหลวต่อไปนี้:อะซิโตน CH 3 COCH 3, ออกเทน C 8 H 18, เพนเทน C 5 H 12, บิวเทน C 4 H 10, เฮกเซน C 6 H 14, โพรพิลีน C 3 H 6, เฮปเทน C 7 H 16, อะมิลแอลกอฮอล์ C 5 H 11 OH, ไซลีน C 8 H 10, ไอโซโพรพิลแอลกอฮอล์ C 2 H 7 OH, มีเทน CH 4, เมทิลแอลกอฮอล์ CH 3 OH, คาร์บอนเตตระคลอไรด์ CCl 4, ไซโคลเฮกเซน C 6 H 12, อีเทน C 2 H 6, คาร์บอนเตตระฟลูออไรด์ CF 4, ฟรีออน-11 CFCl 3, เอทิลคลอไรด์ C 2 H 5 Cl, ฟรีออน-12 CF 2 Cl 2, เอทิลีน C 2 H 4, ฟรีออน-13 CF 3 Cl, เอทิลฟอร์เมต HCOOC 2 H 5, ฟรีออน-21 CHFCl 2, ไดเอทิลอีเทอร์ (C 2 H 5 ) 2O.
ดังจะเห็นได้จากตาราง ค่าการนำความร้อนของก๊าซอินทรีย์ก็เพิ่มขึ้นตามอุณหภูมิของก๊าซที่เพิ่มขึ้นเช่นกัน.
ระวัง! ค่าการนำความร้อนในตารางแสดงด้วยปัจจัย 10 3 . อย่าลืมหารด้วย 1,000!ตัวอย่างเช่น ค่าการนำความร้อนของไออะซิโตนที่อุณหภูมิ 400 K (127°C) คือ 0.0204 W/(m deg)
