ทฤษฎีโมเลกุล-จลนศาสตร์ของก๊าซในอุดมคติ
เธอรู้รึเปล่า,
การทดลองทางความคิดคืออะไร การทดลองเกดันเคน?
เป็นการฝึกฝนที่ไม่มีอยู่จริง เป็นประสบการณ์นอกโลก จินตนาการถึงสิ่งที่ไม่มีอยู่จริง การทดลองทางความคิดก็เหมือนฝันกลางวัน พวกเขาให้กำเนิดสัตว์ประหลาด ต่างจากการทดลองทางกายภาพ ซึ่งเป็นการทดสอบสมมุติฐานเชิงทดลอง "การทดลองทางความคิด" แทนที่การทดสอบเชิงทดลองด้วยข้อสรุปที่ต้องการและยังไม่ได้ทดสอบอย่างน่าอัศจรรย์ โดยจัดการกับโครงสร้างเชิงตรรกะที่ละเมิดตรรกะด้วยตัวมันเองโดยใช้สถานที่ที่ไม่ผ่านการพิสูจน์ตามที่พิสูจน์แล้ว กล่าวคือโดย การแทน. ดังนั้นงานหลักของผู้สมัครของ "การทดลองทางความคิด" คือการหลอกลวงผู้ฟังหรือผู้อ่านโดยแทนที่การทดลองทางกายภาพจริงด้วย "ตุ๊กตา" ของเขา - การให้เหตุผลแบบสมมติในการทัณฑ์บนโดยไม่ต้องมีการตรวจสอบทางกายภาพ
การเติมฟิสิกส์ด้วยจินตภาพ "การทดลองทางความคิด" ได้นำไปสู่ภาพที่ไร้สาระ เหนือจริง และสับสนในโลก นักวิจัยตัวจริงต้องแยกแยะ "เครื่องห่อหุ้ม" ดังกล่าวออกจากค่าจริง
นักสัมพัทธภาพและนักคิดบวกแย้งว่า "การทดลองทางความคิด" เป็นเครื่องมือที่มีประโยชน์มากสำหรับการทดสอบทฤษฎี (ซึ่งเกิดขึ้นในจิตใจของเราด้วย) เพื่อความสม่ำเสมอ ในการนี้พวกเขาหลอกลวงผู้คนเนื่องจากการตรวจสอบใด ๆ สามารถทำได้โดยแหล่งที่เป็นอิสระจากวัตถุของการตรวจสอบเท่านั้น ผู้สมัครสมมติฐานเองไม่สามารถทดสอบคำแถลงของตนเองได้ เนื่องจากเหตุผลสำหรับคำชี้แจงนี้เองคือผู้ยื่นคำร้องไม่มีความขัดแย้งปรากฏให้เห็นในแถลงการณ์
เราเห็นสิ่งนี้ในตัวอย่างของ SRT และ GTR ซึ่งได้กลายเป็นศาสนาประเภทหนึ่งที่ควบคุมวิทยาศาสตร์และ ความคิดเห็นของประชาชน. ไม่มีข้อเท็จจริงใดที่ขัดกับสูตรของไอน์สไตน์: "ถ้าข้อเท็จจริงไม่สอดคล้องกับทฤษฎี ให้เปลี่ยนข้อเท็จจริง" (ในอีกเวอร์ชันหนึ่ง "ข้อเท็จจริงไม่สอดคล้องกับทฤษฎีหรือไม่ - แย่กว่านั้นมากสำหรับข้อเท็จจริง ")
สูงสุดที่ "การทดลองทางความคิด" สามารถอ้างได้เป็นเพียงความสอดคล้องภายในของสมมติฐานภายในกรอบของผู้สมัครเอง ซึ่งมักจะไม่เป็นความจริงเลย ตรรกะ การปฏิบัติตามหลักปฏิบัติไม่ได้ตรวจสอบสิ่งนี้ การทดสอบจริงสามารถทำได้ในการทดลองทางกายภาพเท่านั้น
การทดลองคือการทดลอง เพราะไม่ใช่การปรับแต่งความคิด แต่เป็นการทดสอบความคิด ความคิดที่สม่ำเสมอในตัวเองไม่สามารถทดสอบตัวเองได้ สิ่งนี้ได้รับการพิสูจน์โดย Kurt Gödel
ในก๊าซที่หายาก ระยะห่างระหว่างโมเลกุลจะมากกว่าขนาดของมันหลายเท่า ในกรณีนี้ ปฏิกิริยาระหว่างโมเลกุลจะน้อยมาก และพลังงานจลน์ของโมเลกุลมีมากกว่าพลังงานศักย์ของการปฏิสัมพันธ์ของพวกมันมาก
เพื่ออธิบายคุณสมบัติของสารในสถานะก๊าซ แทนที่จะใช้ก๊าซจริง จะใช้แบบจำลองทางกายภาพของสารนั้น ซึ่งเป็นก๊าซในอุดมคติ โมเดลถือว่า:
ระยะห่างระหว่างโมเลกุลมากกว่าเส้นผ่านศูนย์กลางเล็กน้อย
โมเลกุลเป็นลูกบอลยืดหยุ่น
ไม่มีแรงดึงดูดระหว่างโมเลกุล
เมื่อโมเลกุลชนกันและกับผนังของภาชนะ แรงผลักจะกระทำ
การเคลื่อนที่ของโมเลกุลเป็นไปตามกฎของกลศาสตร์
สมการพื้นฐานสำหรับก๊าซในอุดมคติ mkt:
สมการพื้นฐานของ MKT ทำให้สามารถคำนวณความดันของแก๊สได้หากทราบมวลของโมเลกุล ค่าเฉลี่ยของกำลังสองของความเร็ว และความเข้มข้นของโมเลกุล
แรงดันแก๊สในอุดมคติอยู่ในความจริงที่ว่าโมเลกุลที่ชนกับผนังของเรือมีปฏิสัมพันธ์กับพวกมันตามกฎของกลศาสตร์ในฐานะวัตถุยืดหยุ่น เมื่อโมเลกุลชนกับผนังของหลอดเลือด การฉายภาพของความเร็ว v x ของเวกเตอร์ความเร็วบนแกน OX ซึ่งตั้งฉากกับผนังจะเปลี่ยนเครื่องหมายเป็นตรงกันข้าม แต่ยังคงคงที่ในค่าสัมบูรณ์ ดังนั้น เนื่องจากการชนกันของโมเลกุลกับผนัง การฉายภาพโมเมนตัมบนแกน OX จึงเปลี่ยนจาก mv 1x = -mv x เป็น mv 2x =mv x . การเปลี่ยนแปลงโมเมนตัมของโมเลกุลเมื่อชนกับผนังทำให้เกิดแรง F 1 กระทำต่อมันจากด้านข้างของกำแพง การเปลี่ยนแปลงโมเมนตัมของโมเลกุลเท่ากับโมเมนตัมของแรงนี้:
ในระหว่างการชน ตามกฎข้อที่สามของนิวตัน โมเลกุลจะกระทำกับกำแพงด้วยแรง F 2 เท่ากับค่าสัมบูรณ์ของแรง F 1 และพุ่งไปในทางตรงข้าม
มีหลายโมเลกุล และแต่ละโมเลกุลจะให้โมเมนตัมเดียวกันกับผนังเมื่อชนกัน ในวินาทีนั้นพวกมันส่งแรงกระตุ้น 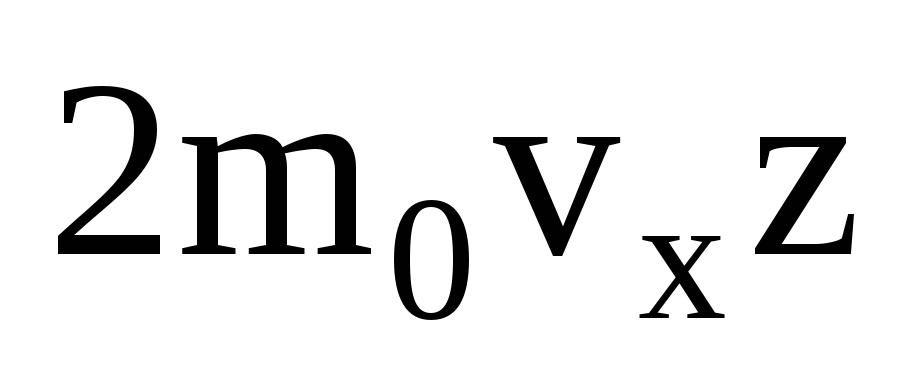 โดยที่ z คือจำนวนการชนของโมเลกุลทั้งหมดกับผนังซึ่งเป็นสัดส่วนกับความเข้มข้นของโมเลกุลในแก๊ส ความเร็วของโมเลกุล และพื้นที่ผิวของผนัง:
โดยที่ z คือจำนวนการชนของโมเลกุลทั้งหมดกับผนังซึ่งเป็นสัดส่วนกับความเข้มข้นของโมเลกุลในแก๊ส ความเร็วของโมเลกุล และพื้นที่ผิวของผนัง: 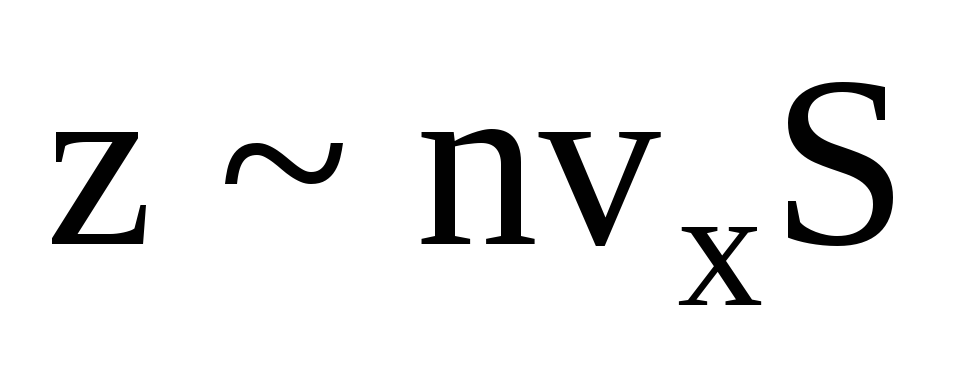 . โมเลกุลเพียงครึ่งเดียวเท่านั้นที่เคลื่อนที่ไปทางผนัง ส่วนที่เหลือเคลื่อนที่ไปในทิศทางตรงกันข้าม:
. โมเลกุลเพียงครึ่งเดียวเท่านั้นที่เคลื่อนที่ไปทางผนัง ส่วนที่เหลือเคลื่อนที่ไปในทิศทางตรงกันข้าม: 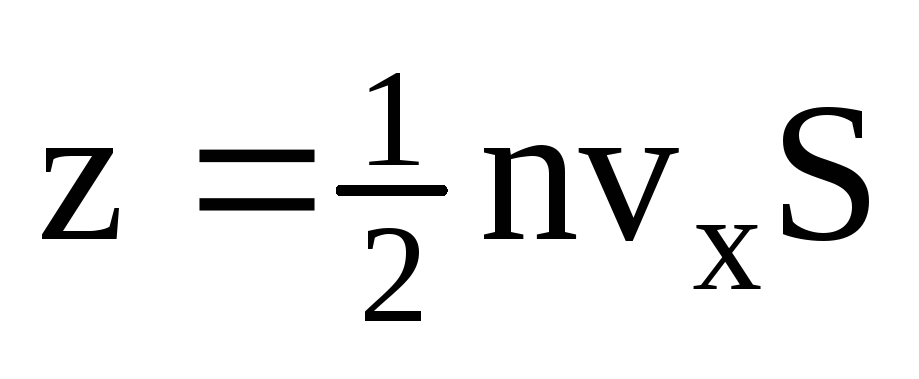 . จากนั้นโมเมนตัมทั้งหมดก็โอนไปที่กำแพงใน 1 วินาที:
. จากนั้นโมเมนตัมทั้งหมดก็โอนไปที่กำแพงใน 1 วินาที: 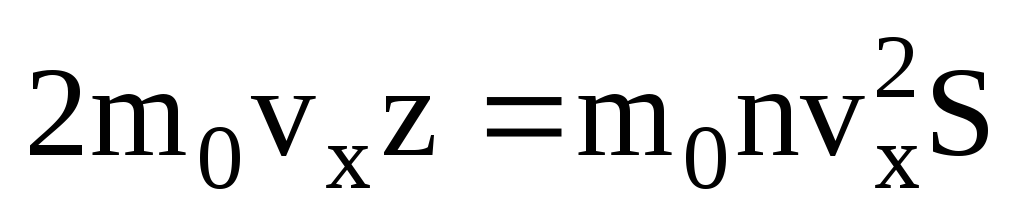 . ตามกฎข้อที่สองของนิวตัน การเปลี่ยนแปลงโมเมนตัมของร่างกายต่อหน่วยเวลาจะเท่ากับแรงที่กระทำต่อวัตถุนั้น:
. ตามกฎข้อที่สองของนิวตัน การเปลี่ยนแปลงโมเมนตัมของร่างกายต่อหน่วยเวลาจะเท่ากับแรงที่กระทำต่อวัตถุนั้น:
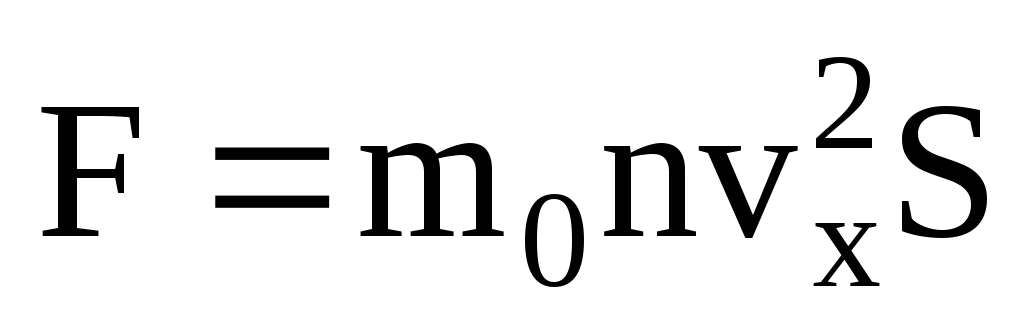
เนื่องจากไม่ใช่ทุกโมเลกุลจะมีความเร็วเท่ากัน แรงที่กระทำต่อผนังจะเป็นสัดส่วนกับกำลังสองเฉลี่ยของความเร็ว เนื่องจากโมเลกุลเคลื่อนที่ไปในทุกทิศทาง ค่าเฉลี่ยของกำลังสองของการคาดคะเนความเร็วจึงเท่ากัน ดังนั้น ค่าเฉลี่ยกำลังสองของการฉายความเร็วคือ: 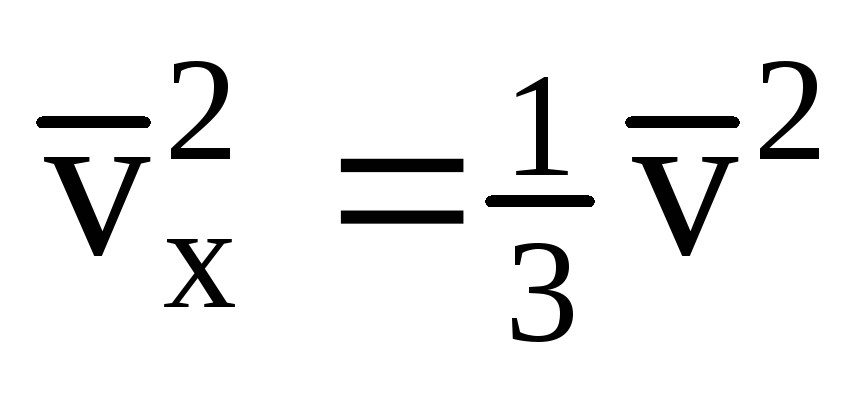 ;
;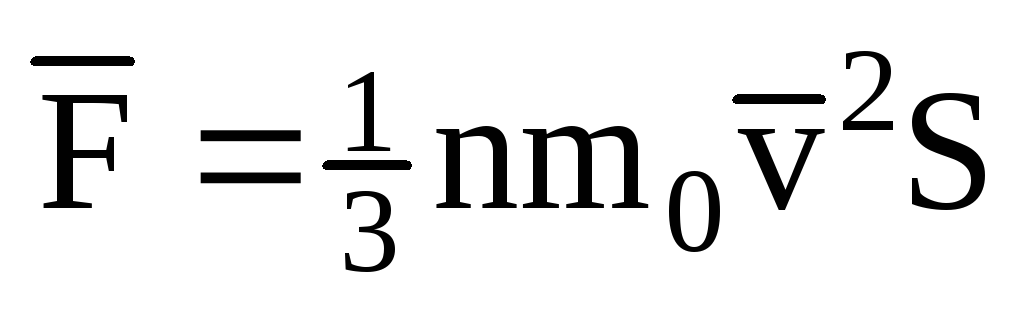 . จากนั้นความดันของก๊าซบนผนังของภาชนะคือ:
. จากนั้นความดันของก๊าซบนผนังของภาชนะคือ:
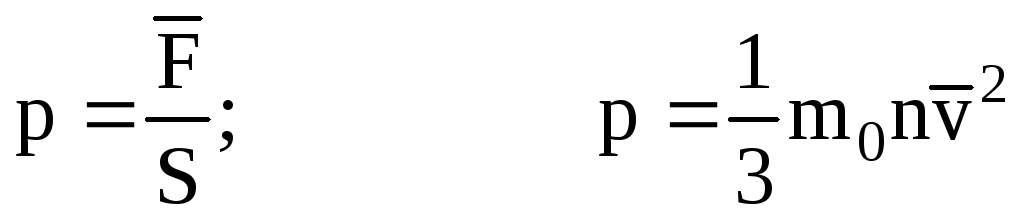 - สมการพื้นฐานของ MKT
- สมการพื้นฐานของ MKT
แสดงถึงค่าเฉลี่ยของพลังงานจลน์ของการเคลื่อนที่เชิงแปลของโมเลกุล ก๊าซในอุดมคติ:
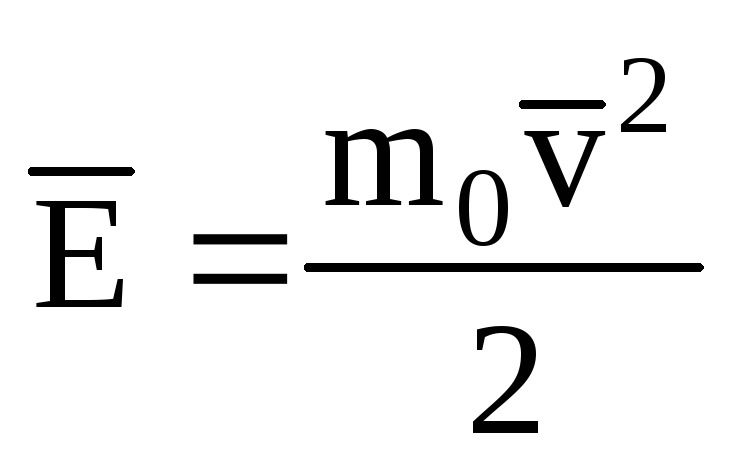 , เราได้รับ
, เราได้รับ
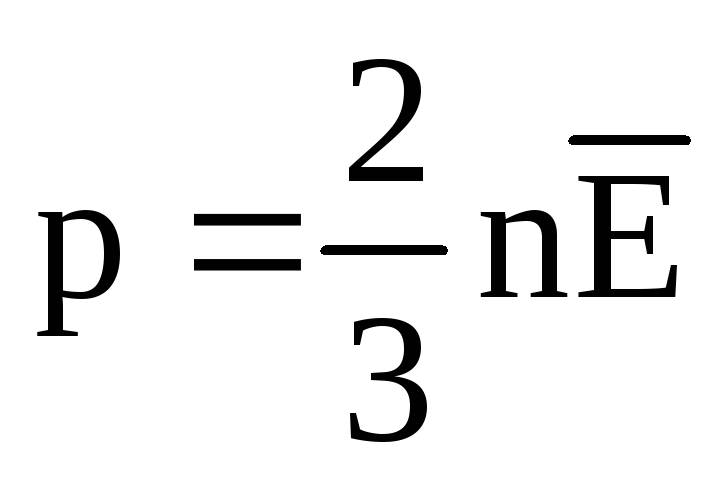
อุณหภูมิและการวัด:
สมการ MKT พื้นฐานสำหรับก๊าซในอุดมคติเกี่ยวข้องกับพารามิเตอร์ขนาดมหภาคที่วัดได้ง่าย - ความดัน - กับพารามิเตอร์ก๊าซขนาดเล็ก เช่น พลังงานจลน์เฉลี่ยและความเข้มข้นของโมเลกุล แต่เมื่อวัดเฉพาะความดันแล้ว เราไม่สามารถหาค่าเฉลี่ยของพลังงานจลน์ของโมเลกุลแยกจากกัน หรือความเข้มข้นของพวกมัน ดังนั้น ในการหาค่าพารามิเตอร์ด้วยกล้องจุลทรรศน์ของก๊าซ จำเป็นต้องมีการวัดปริมาณทางกายภาพอื่นๆ ที่เกี่ยวข้องกับพลังงานจลน์เฉลี่ยของโมเลกุล ค่านี้คือ อุณหภูมิ.
วัตถุที่มีขนาดมหึมาหรือกลุ่มของวัตถุที่มีขนาดมหึมาภายใต้สภาวะภายนอกคงที่ จะผ่านเข้าสู่สภาวะสมดุลทางความร้อนโดยธรรมชาติ สมดุลความร้อน -นี่คือสถานะที่พารามิเตอร์มหภาคทั้งหมดยังคงไม่เปลี่ยนแปลงเป็นเวลานานโดยพลการ
อุณหภูมิแสดงถึงสภาวะสมดุลทางความร้อนของระบบร่างกาย: ร่างกายทั้งหมดของระบบที่อยู่ในสมดุลความร้อนซึ่งกันและกันมีอุณหภูมิเท่ากัน.
ในการวัดอุณหภูมิ คุณสามารถใช้การเปลี่ยนแปลงในปริมาณมหภาคขึ้นอยู่กับอุณหภูมิ: ปริมาตร ความดัน ความต้านทานไฟฟ้า ฯลฯ
ในทางปฏิบัติส่วนใหญ่มักใช้การพึ่งพาปริมาตรของของเหลว (ปรอทหรือแอลกอฮอล์) กับอุณหภูมิ เมื่อทำการปรับเทียบเทอร์โมมิเตอร์ อุณหภูมิของน้ำแข็งละลายมักจะถูกนำมาใช้เป็นจุดอ้างอิง (0) จุดคงที่ที่สอง (100) คือจุดเดือดของน้ำที่ความดันบรรยากาศปกติ (ระดับเซลเซียส) เนื่องจากของเหลวต่าง ๆ จะขยายตัวแตกต่างกันเมื่อถูกความร้อน มาตราส่วนที่สร้างขึ้นนั้นจะขึ้นอยู่กับคุณสมบัติของของเหลวที่ให้มาในระดับหนึ่ง แน่นอนว่า 0 และ 100°C จะจับคู่กับเทอร์โมมิเตอร์ทั้งหมด แต่ 50°C จะไม่ตรงกัน
ต่างจากของเหลว ก๊าซที่เกิดจากการทำให้บริสุทธิ์ทั้งหมดขยายตัวในลักษณะเดียวกันเมื่อถูกความร้อนและเปลี่ยนความดันในลักษณะเดียวกันเมื่ออุณหภูมิเปลี่ยนแปลง ดังนั้นในฟิสิกส์เพื่อสร้างมาตราส่วนอุณหภูมิที่มีเหตุผลจึงใช้การเปลี่ยนแปลงความดันของก๊าซหายากจำนวนหนึ่งที่ปริมาตรคงที่หรือการเปลี่ยนแปลงปริมาตรของก๊าซที่ความดันคงที่ มาตราส่วนนี้บางครั้งเรียกว่า มาตราส่วนอุณหภูมิก๊าซในอุดมคติ.
ที่สมดุลทางความร้อน พลังงานจลน์เฉลี่ยของการเคลื่อนที่เชิงแปลของโมเลกุลของก๊าซทั้งหมดจะเท่ากัน ความดันเป็นสัดส่วนโดยตรงกับพลังงานจลน์เฉลี่ยของการเคลื่อนที่เชิงแปลของโมเลกุล: 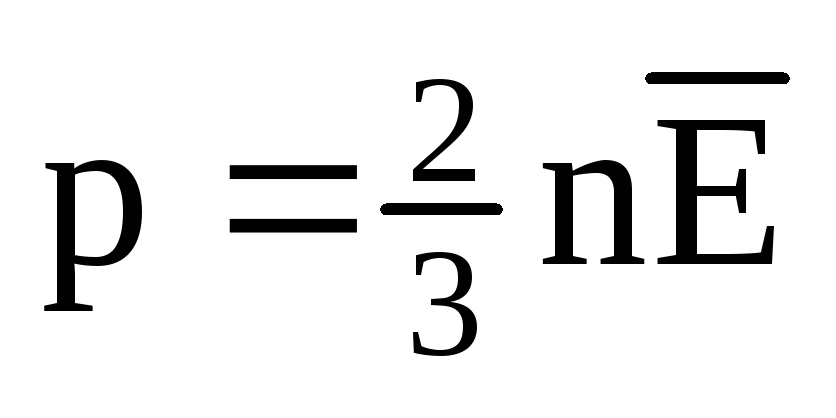 . ที่สมดุลทางความร้อน หากความดันของก๊าซในมวลและปริมาตรที่กำหนดคงที่ พลังงานจลน์เฉลี่ยของโมเลกุลก๊าซจะต้องมีค่าที่กำหนดไว้อย่างเคร่งครัด เช่น อุณหภูมิ เพราะ
. ที่สมดุลทางความร้อน หากความดันของก๊าซในมวลและปริมาตรที่กำหนดคงที่ พลังงานจลน์เฉลี่ยของโมเลกุลก๊าซจะต้องมีค่าที่กำหนดไว้อย่างเคร่งครัด เช่น อุณหภูมิ เพราะ 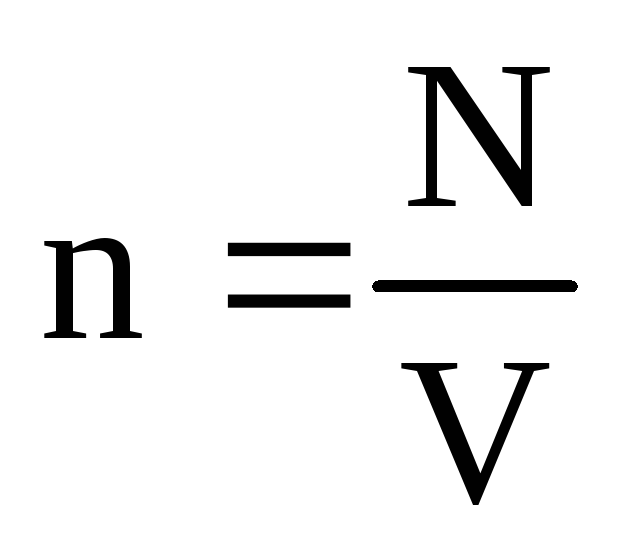 , แล้ว
, แล้ว 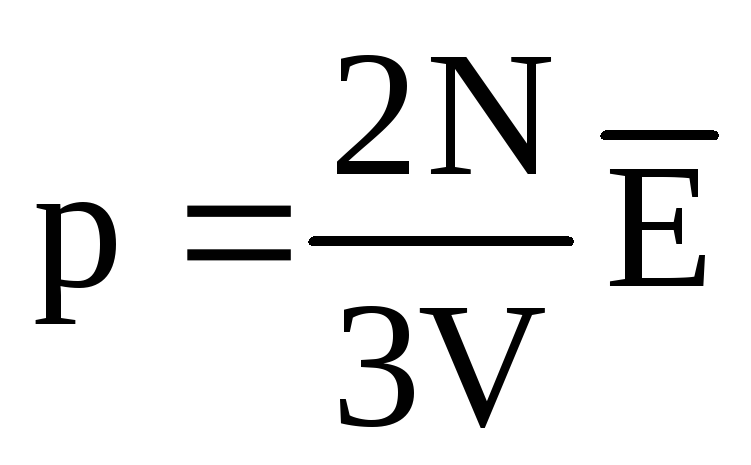 , หรือ
, หรือ 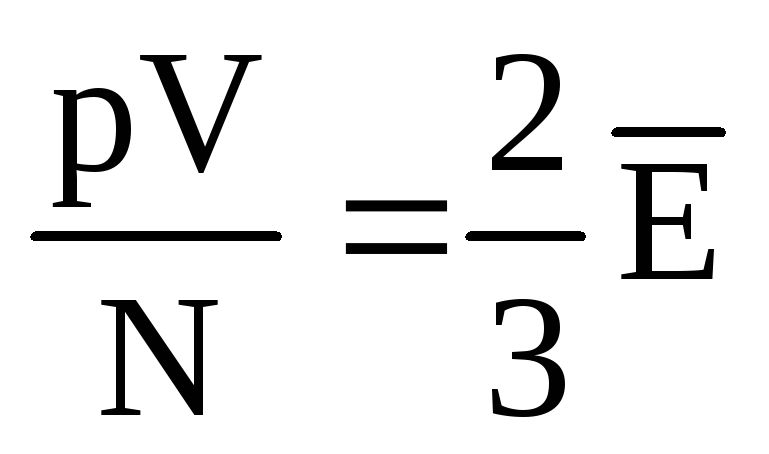 .
.
หมายถึง 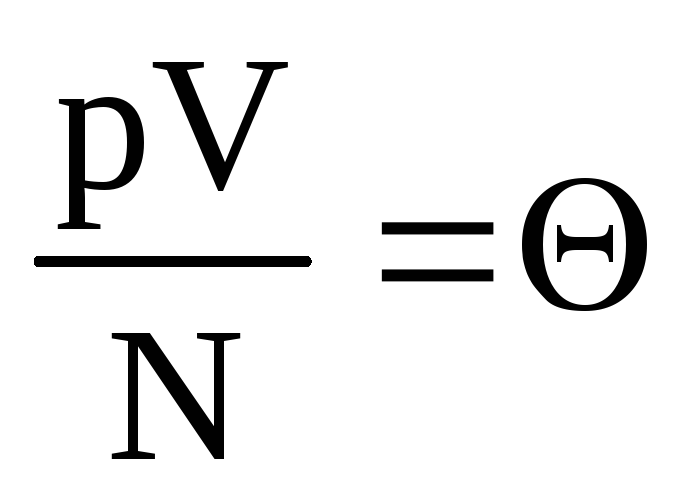 . ค่า
. ค่า  เพิ่มขึ้นตามอุณหภูมิและไม่ขึ้นกับสิ่งอื่นใดนอกจากอุณหภูมิ ดังนั้นจึงถือได้ว่าเป็นการวัดอุณหภูมิตามธรรมชาติ
เพิ่มขึ้นตามอุณหภูมิและไม่ขึ้นกับสิ่งอื่นใดนอกจากอุณหภูมิ ดังนั้นจึงถือได้ว่าเป็นการวัดอุณหภูมิตามธรรมชาติ
ทฤษฎีจลนพลศาสตร์ระดับโมเลกุลอธิบายพฤติกรรมและคุณสมบัติของวัตถุในอุดมคติพิเศษที่เรียกว่า ก๊าซในอุดมคติ. แบบจำลองทางกายภาพนี้ขึ้นอยู่กับโครงสร้างโมเลกุลของสสาร การสร้างทฤษฎีโมเลกุลเกี่ยวข้องกับงานของ R. Clausius, J. Maxwell, D. Joule และ L. Boltzmann
แก๊สในอุดมคติ. ทฤษฎีโมเลกุล-จลนศาสตร์ของแก๊สอุดมคติ สร้างขึ้นบนสมมติฐานดังต่อไปนี้:
อะตอมและโมเลกุลสามารถเห็นได้เป็น จุดวัสดุซึ่งเคลื่อนที่ต่อเนื่อง
ปริมาตรที่แท้จริงของโมเลกุลของก๊าซนั้นเล็กน้อยมากเมื่อเทียบกับปริมาตรของถัง
อะตอมและโมเลกุลทั้งหมดมีความแตกต่างกัน กล่าวคือ ตามหลักการแล้วสามารถติดตามการเคลื่อนที่ของแต่ละอนุภาคได้
ก่อนการชนกันของโมเลกุลก๊าซระหว่างพวกมัน ไม่มีแรงปฏิสัมพันธ์ และการชนกันของโมเลกุลระหว่างตัวมันเองกับผนังของเรือจะถือว่ายืดหยุ่นอย่างยิ่ง
การเคลื่อนที่ของแต่ละอะตอมหรือโมเลกุลของแก๊สอธิบายโดยกฎของกลศาสตร์คลาสสิก
กฎหมายที่ได้รับสำหรับก๊าซในอุดมคติสามารถใช้ในการศึกษาก๊าซจริงได้ ด้วยเหตุนี้ แบบจำลองการทดลองของก๊าซในอุดมคติจึงถูกสร้างขึ้น ซึ่งคุณสมบัติของก๊าซจริงจะใกล้เคียงกับก๊าซในอุดมคติ (เช่น ที่ความดันต่ำและอุณหภูมิสูง)
กฎของแก๊สในอุดมคติ
กฎหมายบอยล์-มาริออตต์:
สำหรับมวลของก๊าซที่อุณหภูมิคงที่ ผลคูณของความดันก๊าซและปริมาตรของก๊าซจะเป็นค่าคงที่: pV = const , (1.1)
ที่ ตู่ = const , m = const .
เส้นโค้งแสดงความสัมพันธ์ระหว่างปริมาณ Rและ วีกำหนดคุณสมบัติของสารที่อุณหภูมิคงที่ เรียกว่า ไอโซเทอร์ม นี่คือไฮเปอร์โบลา (รูปที่ 1.1.) และกระบวนการที่ดำเนินการที่อุณหภูมิคงที่เรียกว่าไอโซเทอร์มอล
กฎของเกย์-ลูสแซก:
ปริมาตรของมวลก๊าซที่กำหนดที่ความดันคงที่แปรผันตามอุณหภูมิ
วี = ว 0 (1 + t ) ที่ P = const , m = const . (1.2)

พี = พี 0 (1 + t ) ที่ V = const , m = const . (1.3)
ในสมการ (1.2) และ (1.3) อุณหภูมิจะแสดงในระดับเซลเซียสความดันและปริมาตร - at
0 Сในขณะที่
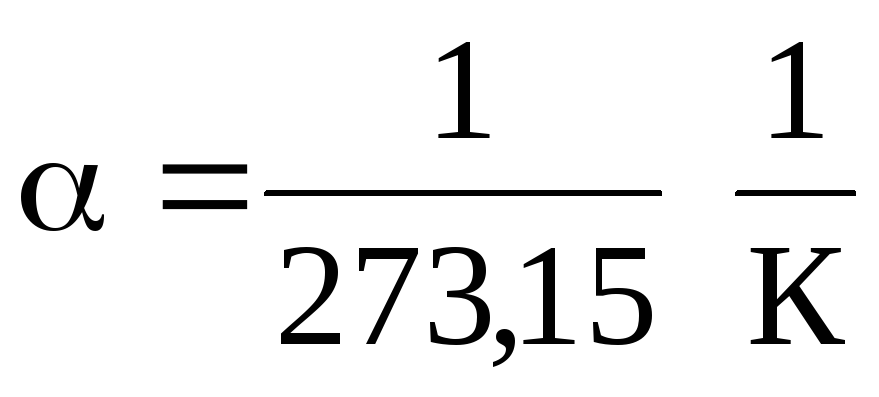 .
.
กระบวนการที่เกิดขึ้นที่ความดันคงที่เรียกว่า isobaricมันสามารถแสดงเป็นฟังก์ชันเชิงเส้น (รูปที่ 1.2.)
กระบวนการที่เกิดขึ้นที่ปริมาตรคงที่เรียกว่า isochoric(รูปที่ 1.3.)
ตามมาจากสมการ (1.2) และ (1.3) ที่ไอโซบาร์และไอโซคอร์ตัดกับแกนอุณหภูมิที่จุด เสื้อ =1/ \u003d - 273.15 С . ถ้าเราย้ายจุดกำเนิดมาที่จุดนี้ เราก็จะเลื่อนไปยังมาตราส่วนเคลวิน
แนะนำเป็นสูตร (1.2) และ (1.3) อุณหภูมิทางอุณหพลศาสตร์กฎของ Gay-Lussac สามารถให้รูปแบบที่สะดวกกว่า:
วี = วี 0 (1+t) = = วี 0 = =วี 0 ตู่;
พี = พี 0 (1+t) = พี 0 = พี 0 ตู่;
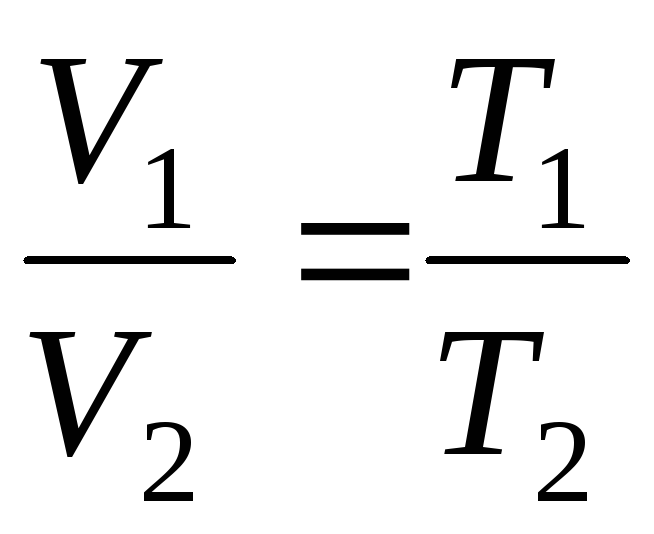 ที่
p=const, m=const
;
(1.4)
ที่
p=const, m=const
;
(1.4)
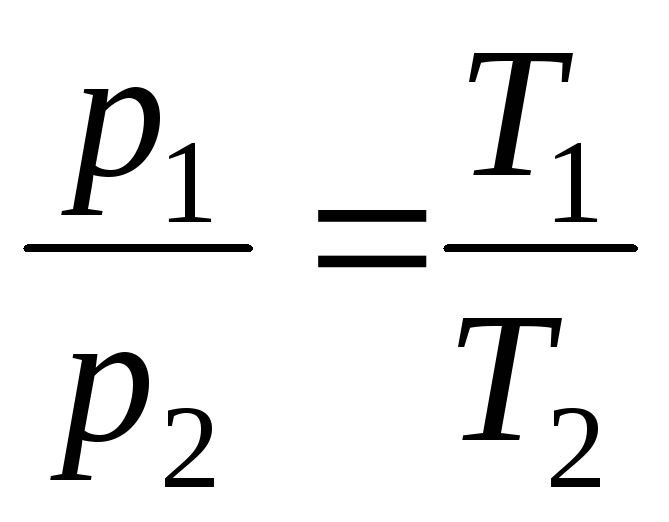 ที่ V = const, m = const
,
(1.5)
ที่ V = const, m = const
,
(1.5)
โดยที่ดัชนี 1 และ 2 หมายถึงรัฐใด ๆ ที่อยู่บนไอโซบาร์หรือไอโซคอร์เดียวกัน .
กฎของอโวกาโดร:
โมลของก๊าซใด ๆ ที่อุณหภูมิและความดันเท่ากันมีปริมาตรเท่ากัน
ภายใต้สภาวะปกติ ปริมาตรนี้จะเท่ากับ วี,0 \u003d 22.4110 -3 ม. 3 / โมล . ตามคำนิยาม ในหนึ่งโมล สารต่างๆมีจำนวนโมเลกุลเท่ากัน เท่ากับ คงที่ Avogadro:นู๋ อา = 6,02210 23 โมล -1 .
กฎของดาลตัน:
แรงดันส่วนผสม ก๊าซในอุดมคติเท่ากับผลรวมของแรงกดดันบางส่วน R 1 , R 2 , R 3 … R n, ก๊าซที่รวมอยู่ในนั้น:
p = p 1 + พี 2 + R 3 + …+ พี น .
ความดันบางส่วน – นี่คือ ความดันที่ก๊าซในองค์ประกอบจะผลิต ส่วนผสมของแก๊สถ้ามันครอบครองปริมาตรเท่ากับปริมาตรของส่วนผสมที่อุณหภูมิเท่ากัน
สมการก๊าซในอุดมคติของสถานะ
(สมการ Claeyron-Mendeleev)
มีความสัมพันธ์ที่ชัดเจนระหว่างอุณหภูมิ ปริมาตร และความดัน ความสัมพันธ์นี้สามารถแสดงได้ด้วยการพึ่งพาฟังก์ชัน:
ฉ(p, V, T)= 0.
ในทางกลับกัน ตัวแปรแต่ละตัว ( พี วี t) เป็นฟังก์ชันของตัวแปรอีกสองตัว ชนิดของการพึ่งพาอาศัยกันตามหน้าที่สำหรับแต่ละสถานะเฟสของสาร (ของแข็ง ของเหลว ก๊าซ) พบได้ในการทดลอง นี่เป็นกระบวนการที่ต้องใช้ความพยายามอย่างมาก และสมการของสถานะได้รับการกำหนดขึ้นสำหรับก๊าซที่อยู่ในสถานะแรร์ไฟด์เท่านั้น และอยู่ในรูปแบบโดยประมาณสำหรับก๊าซอัดบางประเภท สำหรับสารที่ไม่อยู่ในสถานะก๊าซ ปัญหานี้ยังไม่ได้รับการแก้ไข
นักฟิสิกส์ชาวฝรั่งเศส B. Clapeyron นำ สมการก๊าซอุดมคติของรัฐโดยการรวมกฎของ Boyle-Mariotte, Gay-Lussac, Charles:
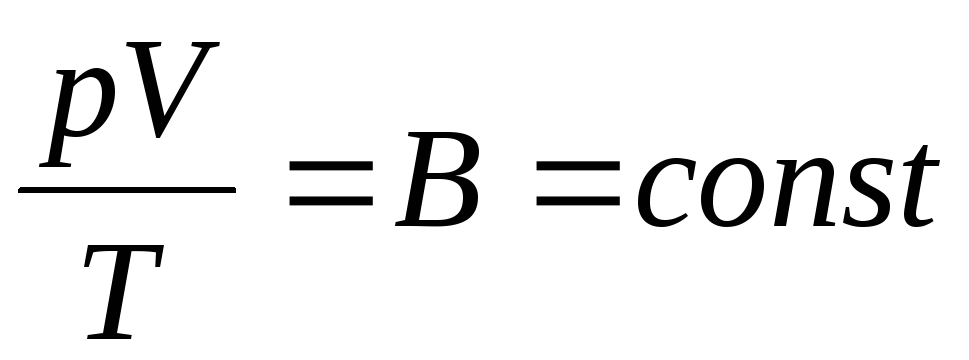 . (1.6)
. (1.6)
นิพจน์ (1.6) คือสมการ Clapeyron โดยที่ ที่คือค่าคงที่ของแก๊ส มันแตกต่างกันสำหรับก๊าซที่แตกต่างกัน
ดี. Mendeleev รวมสมการของ Clapeyron กับกฎของ Avogadro โดยอ้างอิงสมการ (1.6) ถึงหนึ่งโมลและใช้ปริมาตรโมลาร์ วี. ตามกฎของอโวกาโดรก็เช่นเดียวกัน Rและ ตู่โมลของก๊าซทั้งหมดมีปริมาตรโมลาร์เท่ากัน วี .
.
ดังนั้น ค่าคงที่ ที่จะเหมือนกันสำหรับก๊าซในอุดมคติทั้งหมด ค่าคงที่นี้มักจะแสดงแทน Rและเท่ากับ R=
8,31
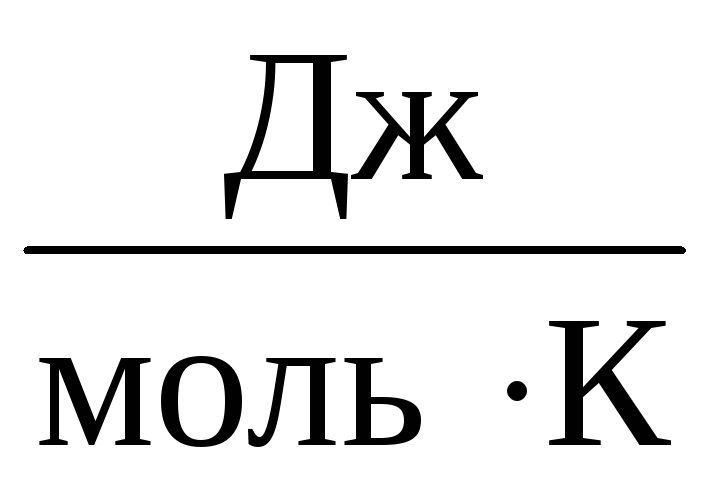 .
.
สมการ Clapeyron-Mendeleev มีรูปแบบดังนี้
พี วี . = อาร์ ทู.
จากสมการ (1.7) ของก๊าซหนึ่งโมล สามารถไปที่ ไปยังสมการ Clapeyron-Mendeleev สำหรับมวลของก๊าซโดยพลการ:
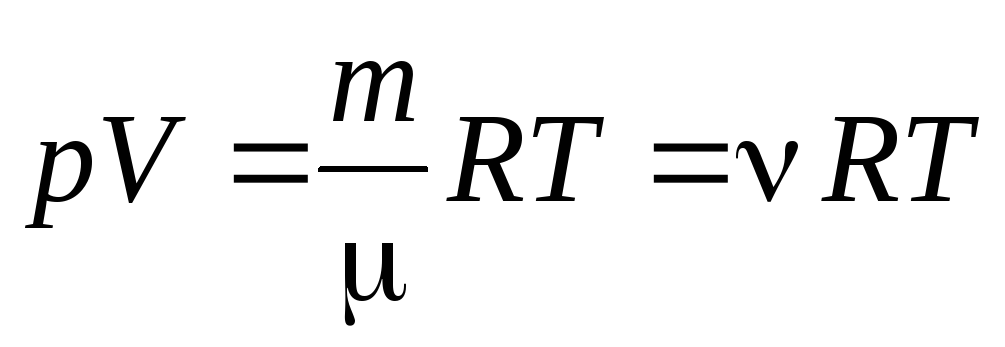 , (1.7)
, (1.7)
ที่ไหน
–
มวลกราม
(มวลสารหนึ่งโมล กิโลกรัม/โมล); ม
มวลของก๊าซ
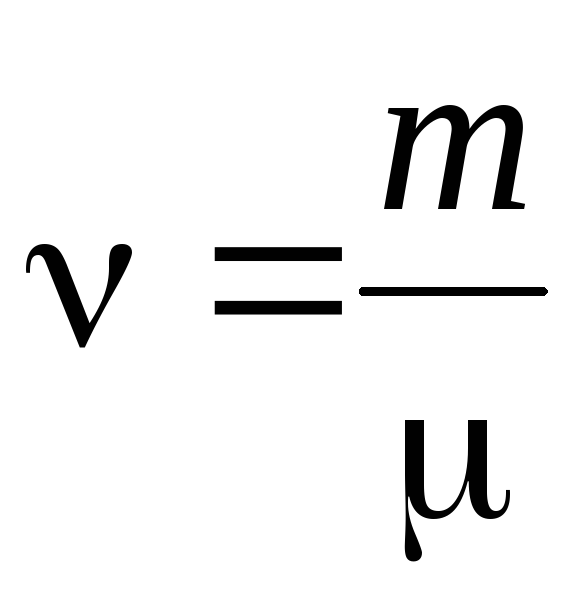 - จำนวนเรื่อง .
- จำนวนเรื่อง .
บ่อยครั้งที่มีการใช้สมการสถานะก๊าซในอุดมคติอีกรูปแบบหนึ่งแนะนำ ค่าคงที่ของ Boltzmann: 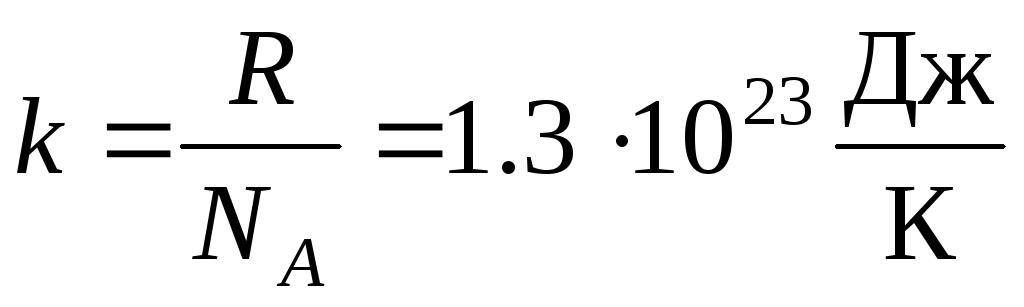 .
.
จากนั้นสมการ (1.7) จะมีลักษณะดังนี้:
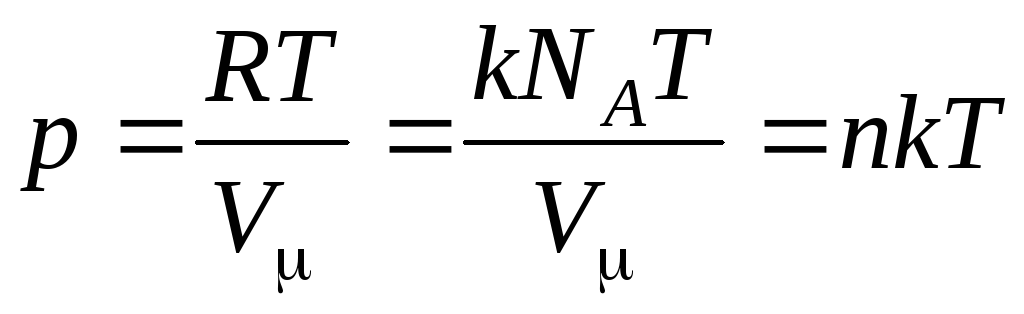 ,
(1.8)
,
(1.8)
ที่ไหน
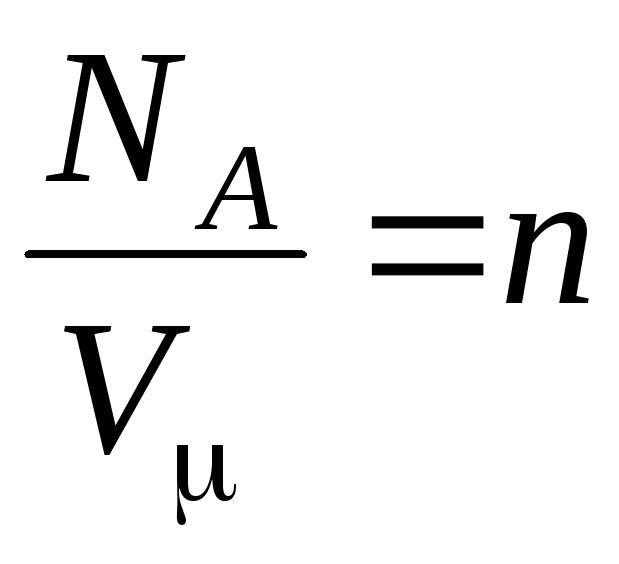 –
ความเข้มข้นของโมเลกุล (จำนวนโมเลกุลต่อหน่วยปริมาตร) จากนิพจน์นี้ ความดันของก๊าซในอุดมคติเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมเลกุลหรือความหนาแน่นของก๊าซ ที่อุณหภูมิและความดันเท่ากัน ก๊าซทั้งหมดมีจำนวนโมเลกุลต่อหน่วยปริมาตรเท่ากัน จำนวนโมเลกุลที่มีอยู่ใน 1 m 3 ภายใต้สภาวะปกติเรียกว่า
หมายเลข Loschmidt:
–
ความเข้มข้นของโมเลกุล (จำนวนโมเลกุลต่อหน่วยปริมาตร) จากนิพจน์นี้ ความดันของก๊าซในอุดมคติเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมเลกุลหรือความหนาแน่นของก๊าซ ที่อุณหภูมิและความดันเท่ากัน ก๊าซทั้งหมดมีจำนวนโมเลกุลต่อหน่วยปริมาตรเท่ากัน จำนวนโมเลกุลที่มีอยู่ใน 1 m 3 ภายใต้สภาวะปกติเรียกว่า
หมายเลข Loschmidt:
นู๋ หลี่ = 2.68 10 25 ม. -3.
สมการพื้นฐานของจลนพลศาสตร์โมเลกุล
ทฤษฎีของก๊าซในอุดมคติ
งานที่สำคัญที่สุด ทฤษฎีจลนศาสตร์ของก๊าซคือการคำนวณทางทฤษฎีของความดันของก๊าซในอุดมคติ ตามแนวคิดจลนพลศาสตร์ระดับโมเลกุล สมการพื้นฐานของทฤษฎีจลนพลศาสตร์ระดับโมเลกุลของก๊าซในอุดมคติได้มาจากการใช้ วิธีการทางสถิติ.
สันนิษฐานว่าโมเลกุลของแก๊สเคลื่อนที่แบบสุ่ม จำนวนของการชนกันระหว่างโมเลกุลของแก๊สนั้นน้อยมากเมื่อเทียบกับจำนวนการกระแทกที่ผนังของถังบรรจุ และการชนกันเหล่านี้มีความยืดหยุ่นอย่างยิ่ง บนฝาผนังเรือบางพื้นที่เบื้องต้น สและคำนวณความดันที่โมเลกุลของแก๊สจะกระทำต่อบริเวณนี้
จำเป็นต้องคำนึงถึงความจริงที่ว่าโมเลกุลสามารถเคลื่อนที่ไปยังไซต์ได้ในมุมต่างๆ และสามารถมีได้ ความเร็วต่างๆซึ่งสามารถเปลี่ยนแปลงได้กับการชนแต่ละครั้ง ในการคำนวณทางทฤษฎี การเคลื่อนที่แบบโกลาหลของโมเลกุลถูกทำให้เป็นอุดมคติ พวกมันจะถูกแทนที่ด้วยการเคลื่อนที่ตามทิศทางที่ตั้งฉากกันสามทิศทาง
หากเราพิจารณาภาชนะในรูปของลูกบาศก์ซึ่ง นู๋โมเลกุลของแก๊สใน 6 ทิศทาง สังเกตได้ง่ายว่า ณ เวลาใดๆ 1/3 ของจำนวนโมเลกุลทั้งหมดเคลื่อนที่ไปตามแต่ละโมเลกุล และครึ่งหนึ่งของโมเลกุล (นั่นคือ 1/6 ของจำนวนโมเลกุลทั้งหมด) จะเคลื่อนที่เข้า ทิศทางเดียวและครึ่งหลัง (เช่น 1/6) - ไปในทิศทางตรงกันข้าม ในการชนกันแต่ละครั้ง โมเลกุลแต่ละตัวจะเคลื่อนที่ในแนวตั้งฉากกับไซต์ สะท้อน ถ่ายโอนโมเมนตัมไปยังโมเลกุลนั้น ในขณะที่โมเมนตัม (โมเมนตัม) ของมันเปลี่ยนแปลงไปตามปริมาณ
R 1 =ม 0 วี – (– ม 0 วี) = 2 ม 0 วี.
จำนวนผลกระทบของโมเลกุลที่เคลื่อนที่ไปในทิศทางที่กำหนดบนไซต์จะเท่ากับ: นู๋ = 1/6 น สวีt. เมื่อชนกับแท่น โมเลกุลเหล่านี้จะถ่ายโอนโมเมนตัมไปที่แท่น
พี= นู๋ พี 1 =2 ม 0 วีนสวีt= m 0 วี 2 นสt,
ที่ไหน นคือความเข้มข้นของโมเลกุล จากนั้นความดันที่ก๊าซออกสู่ผนังของภาชนะจะเท่ากับ:
พี = 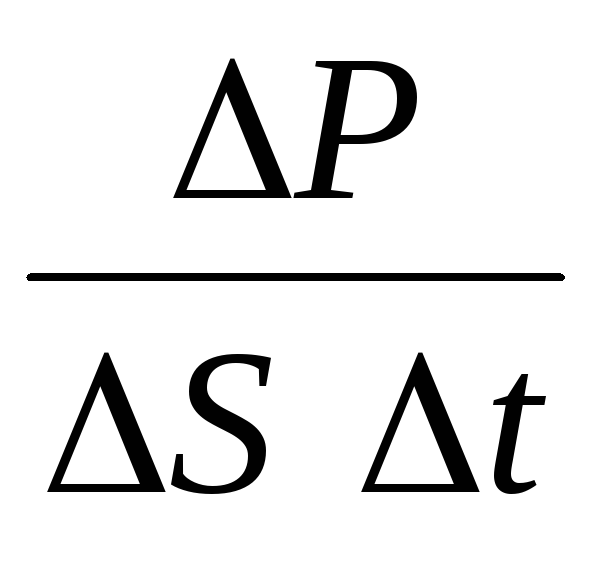 =
นาโนเมตร 0
วี 2
.
(1.9)
=
นาโนเมตร 0
วี 2
.
(1.9)
อย่างไรก็ตาม โมเลกุลของแก๊สเคลื่อนที่ด้วยความเร็วที่ต่างกัน: วี 1 , วี 2 , …,วี นจึงต้องหาค่าเฉลี่ยความเร็ว ผลรวมของกำลังสองของความเร็วของโมเลกุลของแก๊ส หารด้วยจำนวน กำหนดความเร็วกำลังสองของค่าเฉลี่ยราก:
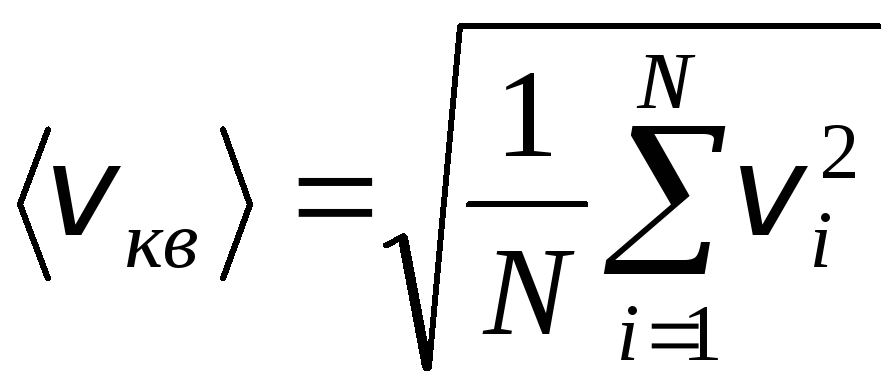 .
.
สมการ (1.9) จะอยู่ในรูปแบบ:
![]() (1.10)
(1.10)
นิพจน์ (1.10) เรียกว่า สมการพื้นฐานของทฤษฎีจลนพลศาสตร์ระดับโมเลกุลก๊าซในอุดมคติ
ระบุว่า 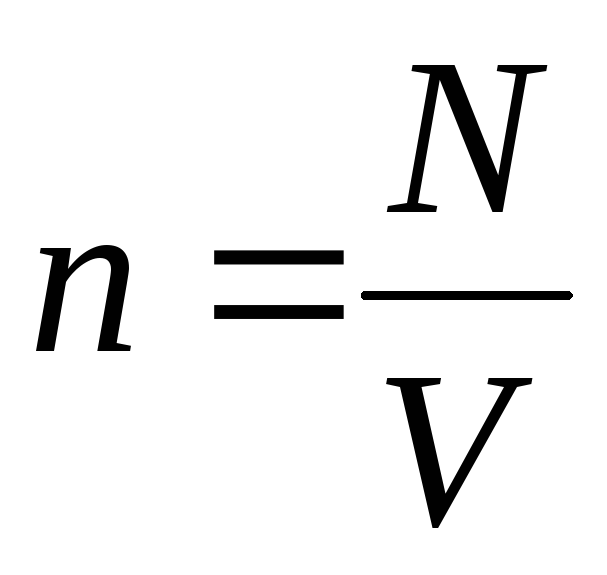 , เราได้รับ:
, เราได้รับ:
พีวี = N 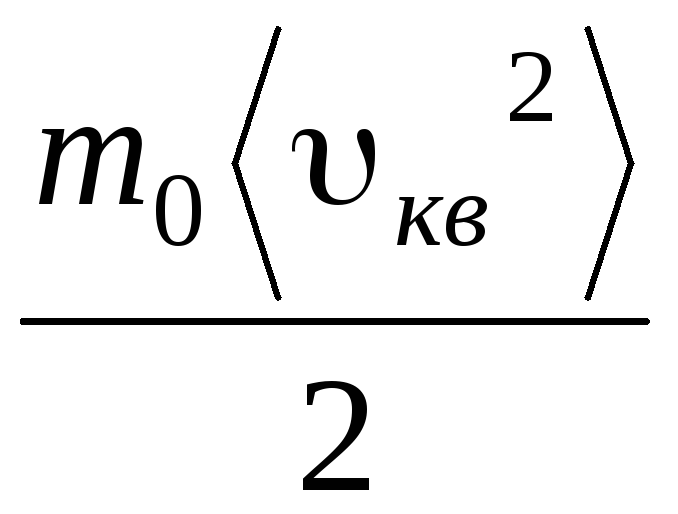 =E,
(1.11)
=E,
(1.11)
ที่ไหน อีคือพลังงานจลน์ทั้งหมดของการเคลื่อนที่เชิงแปลของโมเลกุลแก๊สทั้งหมด ดังนั้นความดันแก๊สจึงเป็นสัดส่วนโดยตรงกับพลังงานจลน์ของการเคลื่อนที่เชิงแปลของโมเลกุลแก๊ส
สำหรับก๊าซหนึ่งโมล ม = และสมการ Clapeyron-Mendeleev มีรูปแบบดังต่อไปนี้:
พี วี . = R T,
และเนื่องมาจาก (1.11) ว่า พี วี . = วี ตร. 2 , เราได้รับ:
RT= วี ตร. 2 .
ดังนั้นความเร็วรูต-ค่าเฉลี่ย-กำลังสองของโมเลกุลแก๊สจึงเท่ากับ
วี
ตร.
=
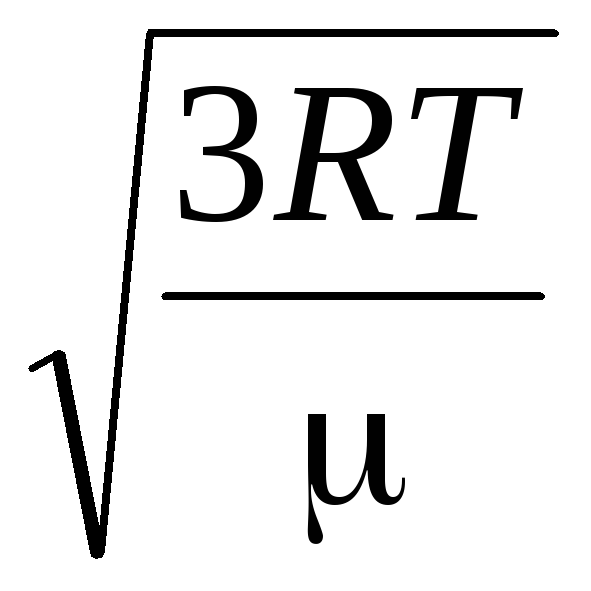 =
=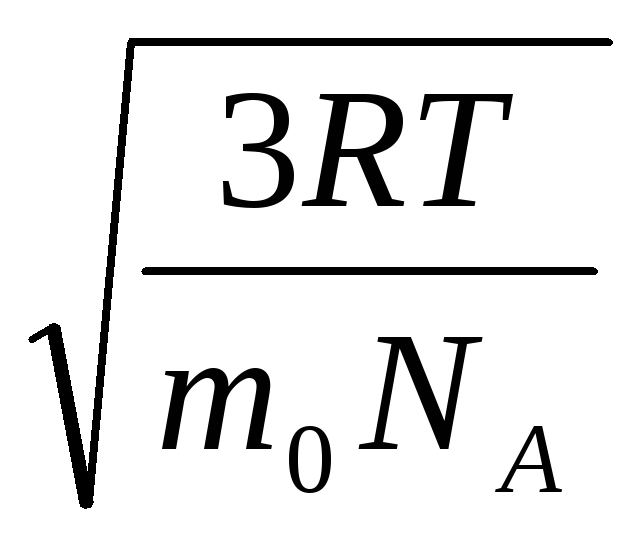 =
= ,
,
ที่ไหน k = R/นู๋ อา = 1.3810 -23 เจ/เค – ค่าคงที่ของโบลต์ซมันน์ จากที่นี่คุณจะพบความเร็วกำลังสองเฉลี่ยของโมเลกุลออกซิเจนที่อุณหภูมิห้อง - 480 m/s, ไฮโดรเจน - 1900 m/s
ความหมายโมเลกุลจลนศาสตร์ของอุณหภูมิ
อุณหภูมิเป็นตัววัดเชิงปริมาณว่าร่างกายร้อนแค่ไหน เพื่อชี้แจงความหมายทางกายภาพของอุณหภูมิอุณหพลศาสตร์สัมบูรณ์ ตู่ลองเปรียบเทียบสมการพื้นฐานของทฤษฎีโมเลกุล-จลนศาสตร์ของก๊าซ (1.14) กับสมการ Clapeyron-Mendeleev พีวี = ร.ท.
เมื่อเทียบส่วนที่ถูกต้องของสมการเหล่านี้ เราจะหาค่าเฉลี่ยของพลังงานจลน์ 0 ของหนึ่งโมเลกุล ( = นู๋/นู๋ อา , k=R/นู๋ อา):
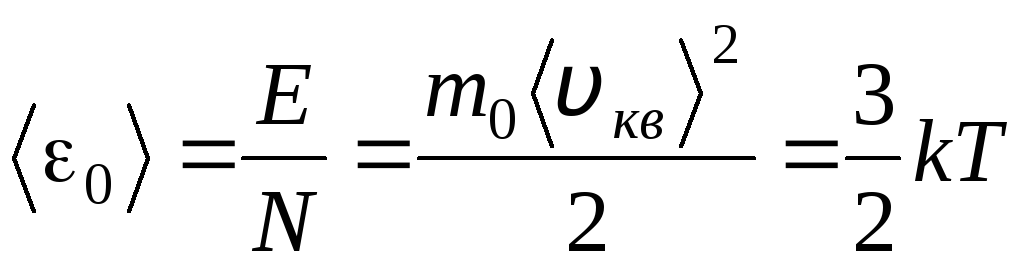 .
.
ข้อสรุปที่สำคัญที่สุดของทฤษฎีจลนพลศาสตร์ระดับโมเลกุลตามมาจากสมการนี้: พลังงานจลน์เฉลี่ยของการเคลื่อนที่เชิงแปลของหนึ่งโมเลกุลของก๊าซในอุดมคตินั้นขึ้นอยู่กับอุณหภูมิเท่านั้น ในขณะที่มันเป็นสัดส่วนโดยตรงกับอุณหภูมิทางอุณหพลศาสตร์ ดังนั้นมาตราส่วนอุณหภูมิทางอุณหพลศาสตร์จึงได้มาซึ่งความหมายทางกายภาพโดยตรง: at ตู่= 0 พลังงานจลน์ของโมเลกุลก๊าซในอุดมคติเป็นศูนย์ ดังนั้น ตามทฤษฎีนี้ การเคลื่อนที่เชิงแปลของโมเลกุลแก๊สจะหยุดลงและความดันจะเท่ากับศูนย์
ทฤษฎีสมบัติสมดุลของก๊าซในอุดมคติ
จำนวนองศาอิสระของโมเลกุล. ทฤษฎีโมเลกุล-จลนศาสตร์ของก๊าซในอุดมคตินำไปสู่ผลลัพธ์ที่สำคัญมาก: โมเลกุลของแก๊สเคลื่อนที่แบบสุ่ม และพลังงานจลน์เฉลี่ยของการเคลื่อนที่เชิงแปลของโมเลกุลถูกกำหนดโดยอุณหภูมิเท่านั้น
พลังงานจลน์ของการเคลื่อนที่ของโมเลกุลไม่ได้ถูกทำให้หมดโดยพลังงานจลน์ พลังงานเคลื่อนที่ไปข้างหน้า: ยังประกอบด้วยจลนศาสตร์ พลังงาน การหมุนและ ความผันผวนโมเลกุล ในการคำนวณพลังงานที่จะเข้าสู่การเคลื่อนที่ของโมเลกุลทุกประเภท จำเป็นต้องกำหนด จำนวนองศาอิสระ.
ภายใต้ จำนวนองศาอิสระ (ผม) ของร่างกายโดยนัย จำนวนพิกัดอิสระที่ต้องป้อนเพื่อกำหนดตำแหน่งของร่างกายในอวกาศ
ชม  ตัวอย่างเช่น จุดวัตถุมีระดับความเป็นอิสระสามระดับ เนื่องจากตำแหน่งในอวกาศถูกกำหนดโดยสามพิกัด: x, yและ z. ดังนั้น โมเลกุล monatomic จึงมีอิสระในการเคลื่อนที่แบบแปลนสามระดับ
ตัวอย่างเช่น จุดวัตถุมีระดับความเป็นอิสระสามระดับ เนื่องจากตำแหน่งในอวกาศถูกกำหนดโดยสามพิกัด: x, yและ z. ดังนั้น โมเลกุล monatomic จึงมีอิสระในการเคลื่อนที่แบบแปลนสามระดับ
ดี 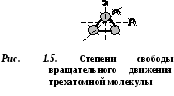 โมเลกุล buchatomic มีอิสระ 5 องศา (รูปที่ 1.4): อิสระในการเคลื่อนที่แบบแปลน 3 องศา และอิสระในการเคลื่อนที่แบบหมุน 2 องศา
โมเลกุล buchatomic มีอิสระ 5 องศา (รูปที่ 1.4): อิสระในการเคลื่อนที่แบบแปลน 3 องศา และอิสระในการเคลื่อนที่แบบหมุน 2 องศา
โมเลกุลของอะตอมตั้งแต่สามอะตอมขึ้นไปมีองศาอิสระ 6 องศา: อิสระ 3 องศาของการเคลื่อนที่เชิงแปลและอิสระในการเคลื่อนที่แบบหมุน 3 องศา (รูปที่ 1.5)
โมเลกุลของแก๊สแต่ละโมเลกุลมีจำนวนองศาอิสระที่แน่นอน ซึ่งสามในนั้นสอดคล้องกับการเคลื่อนที่เชิงการแปลของมัน
ระเบียบว่าด้วยการกระจายพลังงานที่เท่าเทียมกัน
โดยองศาของเสรีภาพ
สมมติฐานพื้นฐานของทฤษฎีโมเลกุล-จลนศาสตร์ของก๊าซคือสมมติฐานของการสุ่มที่สมบูรณ์ในการเคลื่อนที่ของโมเลกุล สิ่งนี้ใช้ได้กับทั้งการเคลื่อนที่แบบสั่นและแบบหมุน ไม่ใช่แค่การแปล สันนิษฐานว่าทุกทิศทางของการเคลื่อนที่ของโมเลกุลในก๊าซมีความน่าจะเป็นเท่ากัน ดังนั้นจึงสามารถสันนิษฐานได้ว่าโดยเฉลี่ยแล้วในแต่ละระดับของอิสระของโมเลกุลจะมีพลังงานในปริมาณเท่ากัน - นี่คือตำแหน่งในการแบ่งส่วนของพลังงานให้เท่ากันเหนือระดับความเป็นอิสระ พลังงานต่อหนึ่งระดับความเป็นอิสระของโมเลกุลคือ:
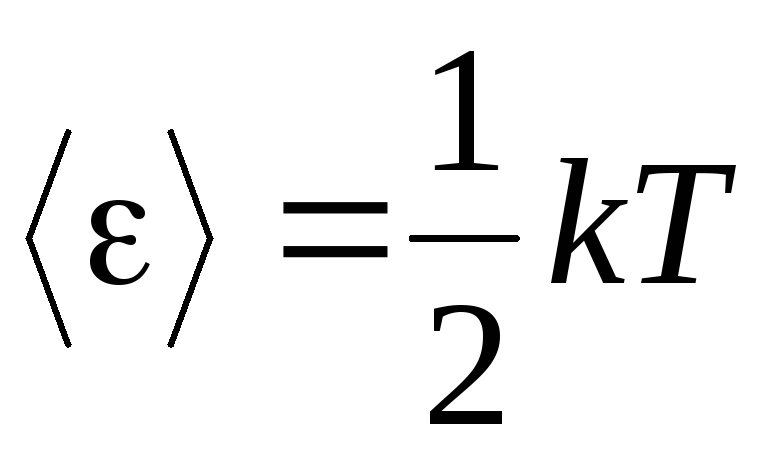 . (1.12)
. (1.12)
ถ้าโมเลกุลมี ผมองศาของเสรีภาพ โดยเฉลี่ยแล้วสำหรับแต่ละระดับของอิสรภาพ:
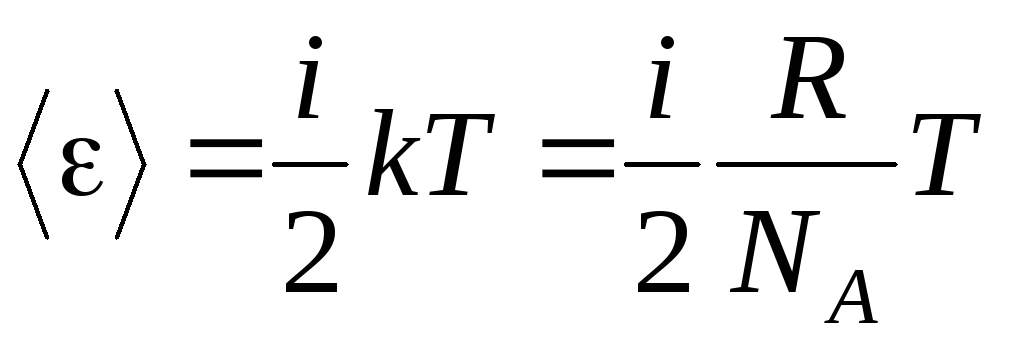 .
(1.13)
.
(1.13)
พลังงานภายในของก๊าซอุดมคติ
หากเราระบุแหล่งที่มาทั้งหมดของพลังงานภายในของก๊าซเป็นหนึ่งโมล เราก็จะได้ค่าของมันโดยการคูณ ด้วยจำนวนอะโวกาโดร:
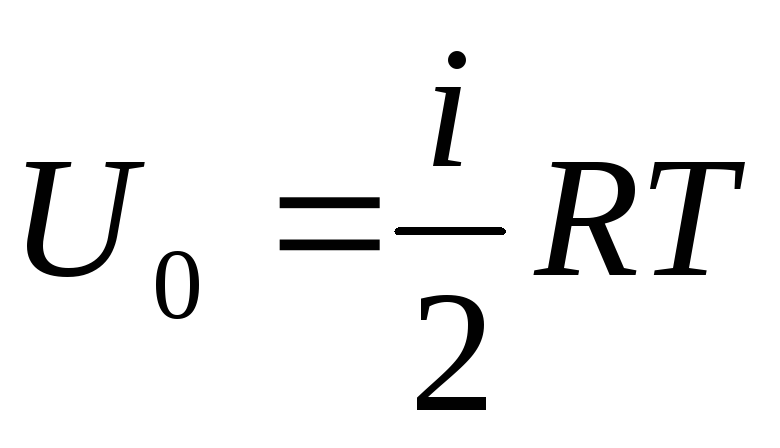 .
(1.14)
.
(1.14)
ตามนั้นพลังงานภายในของหนึ่งโมลของก๊าซในอุดมคติขึ้นอยู่กับอุณหภูมิและจำนวนองศาอิสระของโมเลกุลก๊าซเท่านั้น
การกระจาย Maxwell และ Boltzmann
การกระจายโมเลกุลของก๊าซในอุดมคติในแง่ของความเร็วและพลังงานของการเคลื่อนที่เชิงความร้อน (การกระจายแมกซ์เวลล์) ที่อุณหภูมิของแก๊สคงที่ จะถือว่าทุกทิศทางของการเคลื่อนที่ของโมเลกุลมีความน่าจะเป็นเท่ากัน ในกรณีนี้ ความเร็วราก-ค่าเฉลี่ย-กำลังสองของแต่ละโมเลกุลจะคงที่และเท่ากับ
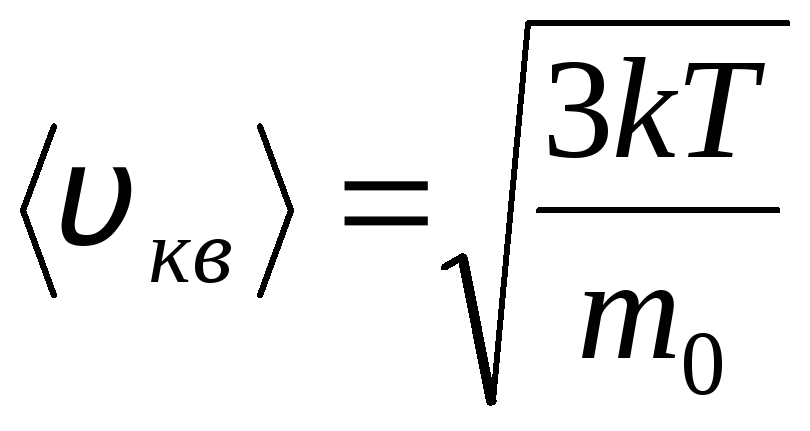 .
.
สิ่งนี้อธิบายได้จากข้อเท็จจริงที่ว่าในก๊าซอุดมคติซึ่งอยู่ในสภาวะสมดุลจะมีการกำหนดการกระจายความเร็วคงที่ของโมเลกุลที่ไม่เปลี่ยนแปลงตามเวลา การแจกแจงนี้อยู่ภายใต้กฎหมายสถิติบางประการ ซึ่งทางทฤษฎีได้มาจากเจ. แม็กซ์เวลล์ กฎของแมกซ์เวลล์อธิบายโดยฟังก์ชัน
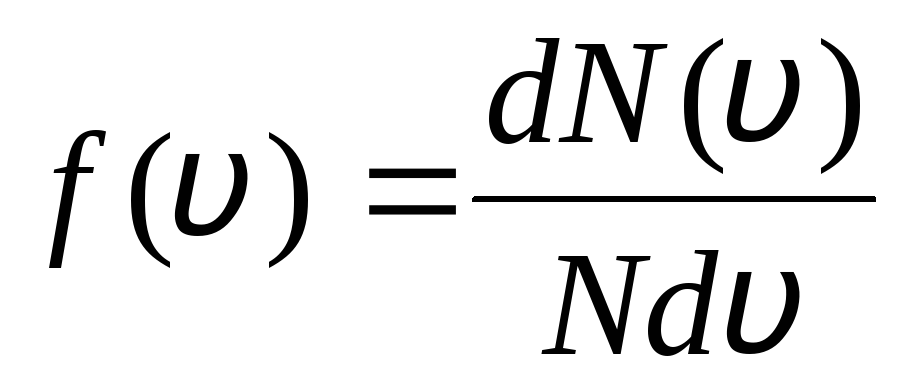 ,
,
นั่นคือหน้าที่ ฉ(วี) กำหนดจำนวนสัมพัทธ์ของโมเลกุล  ซึ่งความเร็วอยู่ในช่วงจาก วี
ก่อน วี+dวี. โดยใช้วิธีการของทฤษฎีความน่าจะเป็น Maxwell พบว่า กฎการกระจายโมเลกุลของก๊าซอุดมคติในแง่ของความเร็ว:
ซึ่งความเร็วอยู่ในช่วงจาก วี
ก่อน วี+dวี. โดยใช้วิธีการของทฤษฎีความน่าจะเป็น Maxwell พบว่า กฎการกระจายโมเลกุลของก๊าซอุดมคติในแง่ของความเร็ว:
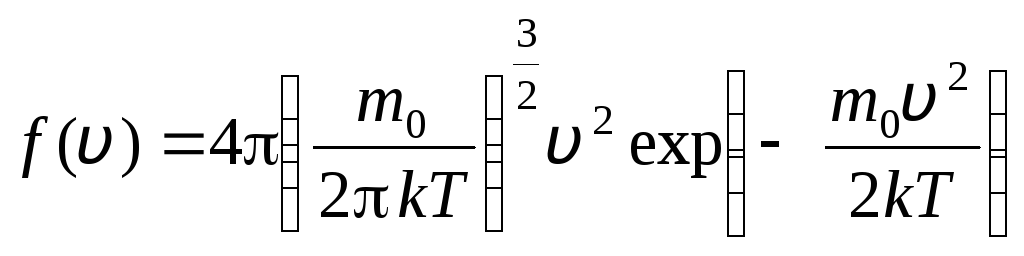 . (1.15)
. (1.15)
ฟังก์ชันการกระจายจะแสดงเป็นภาพกราฟิกในรูปที่ 1.6. พื้นที่ที่ล้อมรอบด้วยเส้นโค้งการกระจายและแกน x เท่ากับหนึ่ง ซึ่งหมายความว่าฟังก์ชัน ฉ(วี) เป็นไปตามเงื่อนไขการทำให้เป็นมาตรฐาน:
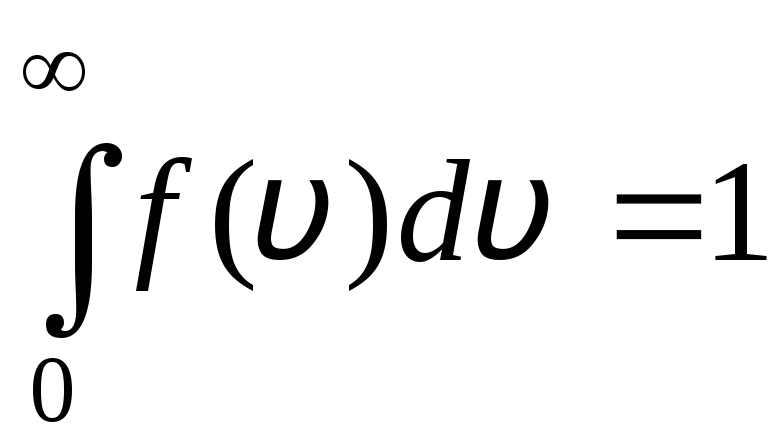 .
.
จาก  ความเร็วที่ฟังก์ชันการกระจายของโมเลกุลก๊าซในอุดมคติในแง่ของความเร็ว ฉ(วี) สูงสุดเรียกว่า เป็นไปได้มากที่สุด
ความเร็ว
วี บี .
ความเร็วที่ฟังก์ชันการกระจายของโมเลกุลก๊าซในอุดมคติในแง่ของความเร็ว ฉ(วี) สูงสุดเรียกว่า เป็นไปได้มากที่สุด
ความเร็ว
วี บี .
ค่านิยม วี = 0 และ วี = สอดคล้องกับค่าต่ำสุดของนิพจน์ (1.15) ความเร็วที่น่าจะเป็นมากที่สุดสามารถพบได้โดยการสร้างความแตกต่างของนิพจน์ (1.23) และเท่ากับศูนย์:
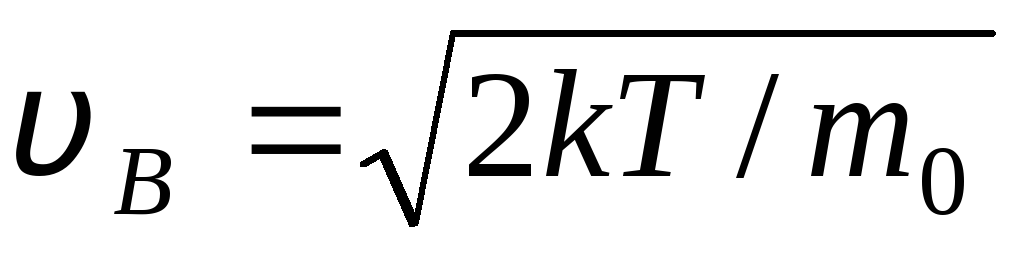 =
=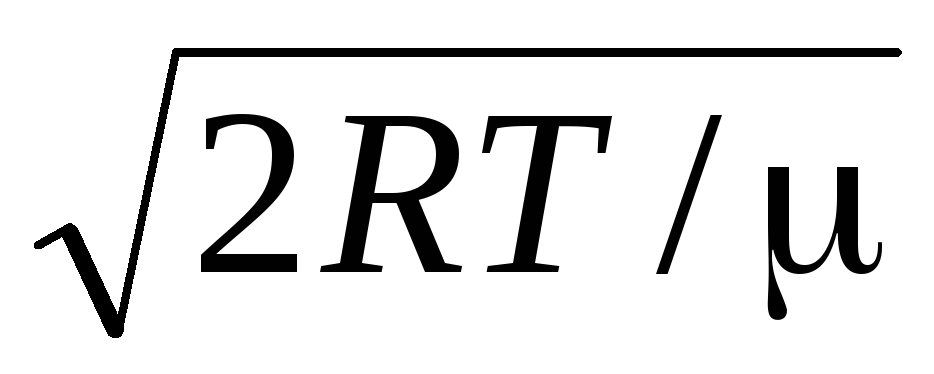 =
1,41
=
1,41
เมื่ออุณหภูมิเพิ่มขึ้น ฟังก์ชันสูงสุดจะเลื่อนไปทางขวา (รูปที่ 1.6) นั่นคือเมื่ออุณหภูมิเพิ่มขึ้น ความเร็วที่น่าจะเป็นไปได้มากที่สุดก็เพิ่มขึ้นเช่นกัน อย่างไรก็ตาม พื้นที่ที่ล้อมรอบด้วยเส้นโค้งยังคงไม่เปลี่ยนแปลง ควรสังเกตว่าในก๊าซและที่อุณหภูมิต่ำจะมีโมเลกุลจำนวนน้อยที่เคลื่อนที่ด้วยความเร็วสูงอยู่เสมอ การปรากฏตัวของโมเลกุล "ร้อน" ดังกล่าวมี สำคัญมากในหลายกระบวนการ
ความเร็วเฉลี่ยเลขคณิตโมเลกุลถูกกำหนดโดยสูตร
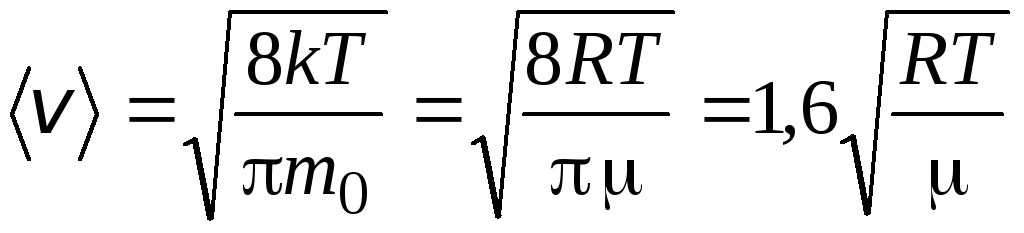 .
.
รูตหมายถึงความเร็วกำลังสอง
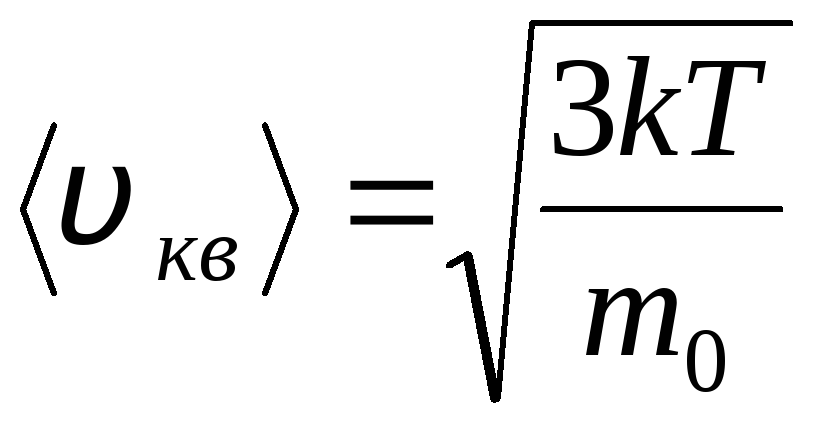 =
1,73
=
1,73 .
.
อัตราส่วนของความเร็วเหล่านี้ไม่ได้ขึ้นอยู่กับอุณหภูมิหรือชนิดของก๊าซ
ฟังก์ชันการกระจายของโมเลกุลโดยพลังงานการเคลื่อนที่ด้วยความร้อน. ฟังก์ชันนี้หาได้จากการแทนที่ค่าของพลังงานจลน์แทนความเร็วลงในสมการการกระจายของโมเลกุล (1.15):
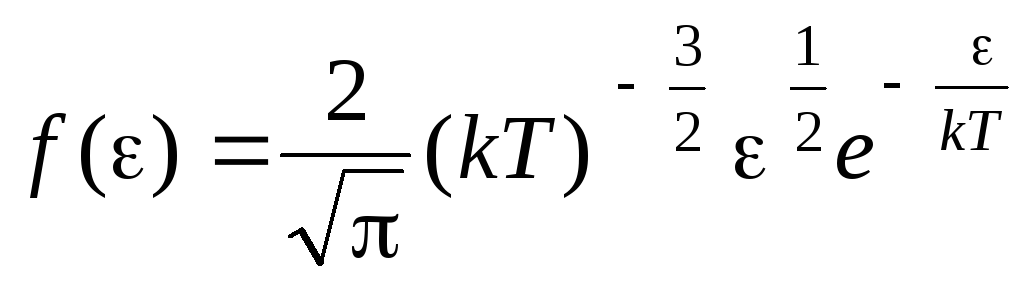 .
.
ได้บูรณาการการแสดงออกเหนือค่าพลังงานจาก  ก่อน
ก่อน 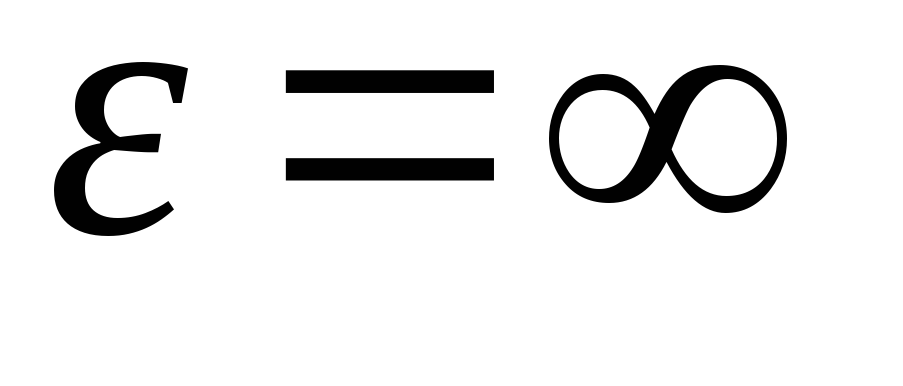
 , เราได้รับ พลังงานจลน์เฉลี่ยโมเลกุลของก๊าซในอุดมคติ:
, เราได้รับ พลังงานจลน์เฉลี่ยโมเลกุลของก๊าซในอุดมคติ:
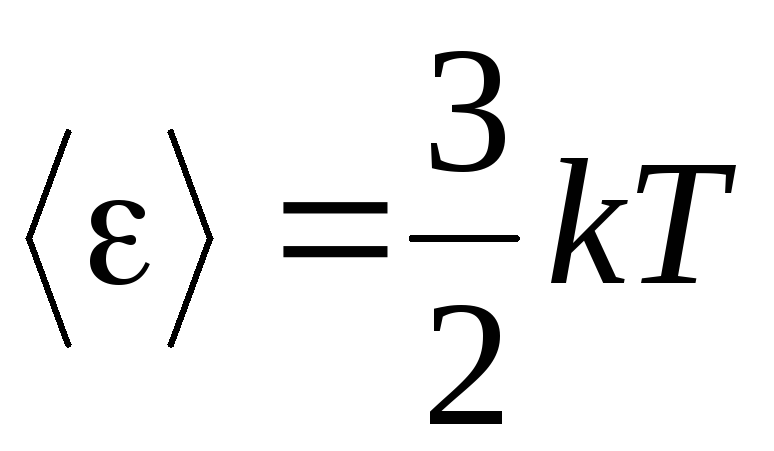 .
.
สูตรความกดอากาศ การกระจายของ Boltzmann เมื่อได้สมการพื้นฐานของทฤษฎีจลนพลศาสตร์ของแก๊สและการกระจายตัวของโมเลกุลของแมกซ์เวลล์ด้วยความเร็ว สันนิษฐานว่าโมเลกุลของก๊าซในอุดมคติไม่ได้รับผลกระทบจากแรงภายนอก ดังนั้นโมเลกุลจะกระจายอย่างสม่ำเสมอทั่วทั้งปริมาตร อย่างไรก็ตาม โมเลกุลของก๊าซใดๆ อยู่ในสนามโน้มถ่วงของโลก เมื่อได้มาซึ่งกฎของการพึ่งพาแรงกดบนความสูง จะถือว่าสนามโน้มถ่วงมีความสม่ำเสมอ อุณหภูมิคงที่ และมวลของโมเลกุลทั้งหมดจะเท่ากัน:
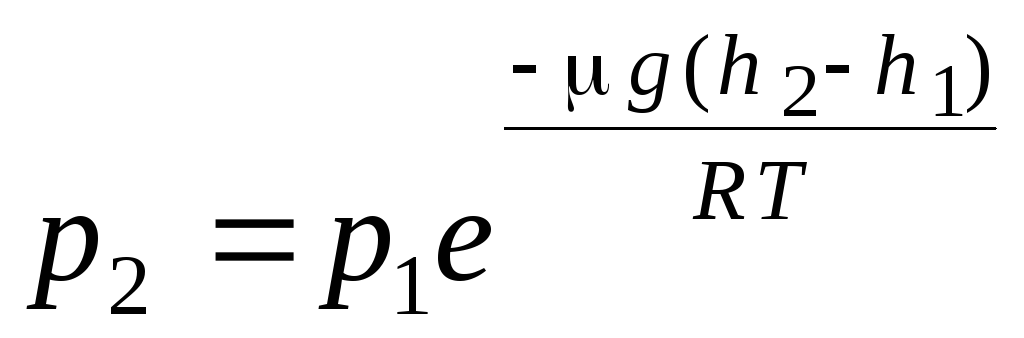 . (1.16)
. (1.16)
นิพจน์ (1.16) เรียกว่า สูตรความกดอากาศ. ช่วยให้คุณค้นหาความกดอากาศขึ้นอยู่กับระดับความสูง หรือโดยการวัดความดัน คุณสามารถค้นหาระดับความสูงได้ เพราะ ชม. 1 คือความสูงเหนือระดับน้ำทะเล ซึ่งถือว่าความดันปกติ จากนั้นนิพจน์สามารถปรับเปลี่ยนได้:
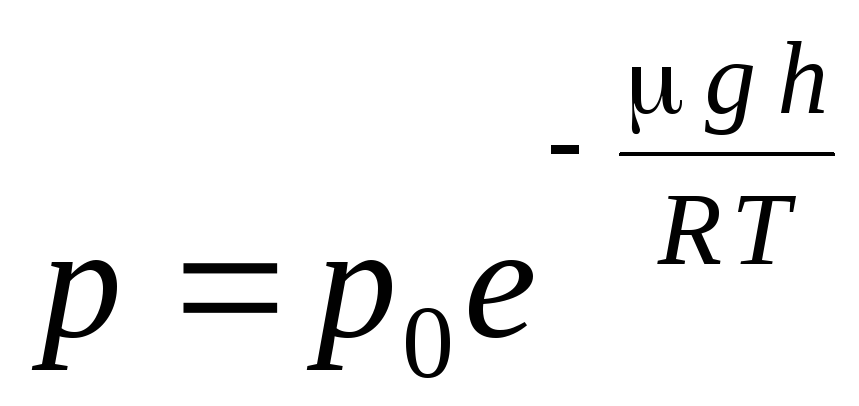 .
.
สูตรความกดอากาศสามารถแปลงได้โดยใช้นิพจน์ p = nkT:
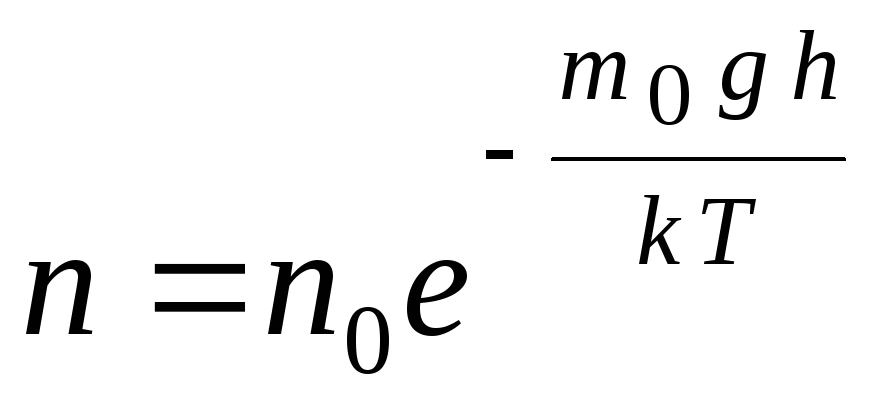 ,
,
จี  เดอ น
–
ความเข้มข้นของโมเลกุลที่ระดับความสูง ชม.,
ม 0
gh=พี–
พลังงานศักย์ของโมเลกุลในสนามโน้มถ่วง ที่อุณหภูมิคงที่ ความหนาแน่นของก๊าซจะมากขึ้นเมื่อพลังงานศักย์ของโมเลกุลต่ำกว่า กฎของการลดจำนวนอนุภาคต่อหน่วยปริมาตรที่มีความสูงจะมีลักษณะดังแสดงในรูปที่ 1.7.
เดอ น
–
ความเข้มข้นของโมเลกุลที่ระดับความสูง ชม.,
ม 0
gh=พี–
พลังงานศักย์ของโมเลกุลในสนามโน้มถ่วง ที่อุณหภูมิคงที่ ความหนาแน่นของก๊าซจะมากขึ้นเมื่อพลังงานศักย์ของโมเลกุลต่ำกว่า กฎของการลดจำนวนอนุภาคต่อหน่วยปริมาตรที่มีความสูงจะมีลักษณะดังแสดงในรูปที่ 1.7.
สำหรับฟิลด์ศักยภาพภายนอกตามอำเภอใจ เราเขียนนิพจน์ทั่วไปต่อไปนี้
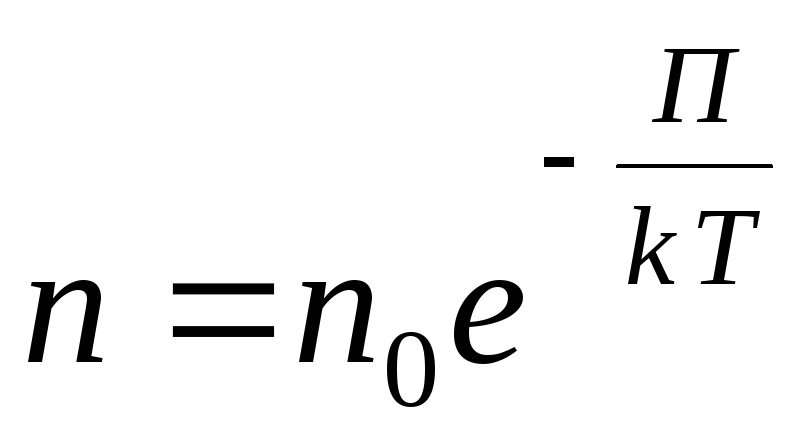 ,
,
