gaz karışımları. Gazların ısı kapasitesi. Yakıt, gaz karışımları ve ısı kapasitesi
1.3. İdeal gaz hal denklemi
Gerçek maddeler için durum denklemlerinin formu (1.1) oldukça karmaşıktır.
Bu bağlamda, termodinamikte çalışan gövdelerin basitleştirilmiş fiziksel modelleri kullanılmaktadır.
Gaz halindeki çalışma akışkanları için en basit ve tarihsel olarak ilk model Ideal gaz. İdeal bir gaz, moleküller arası etkileşim kuvvetlerinin (çekim ve itme) olmadığı ve moleküllerin kendilerinin aşağıdaki gibi kabul edildiği bir gazdır. maddi noktalar. İdeal bir gaz itaat eder Claiperon denklemi– Mendeleyev
Nerede M sistemdeki gazın kütlesi; μ, gazın molar kütlesidir; Rμ = 8314 J/(kmol K), gazın türüne veya varoluş koşullarına bağlı olmayan evrensel gaz sabitidir. Durum denklemi (1.2) birleştirilerek elde edilir Boyle-Mariotte yasaları Ve Eşcinsel Lussac hesaba katarak Avogadro yasası.
Molar kütle μ = m/N, kg/mol, bir maddenin bir mol miktarında alınan kütlesidir. 1 mol 12 gram karbon kadar parçacık içeren bir maddenin miktarının birimidir. Madde miktarı– n = Yok A, köstebek, nerede N parçacıkların sayısıdır (atomlar, moleküller), N A ≈ 6.02 10 23 - 12 gram karbondaki atom sayısı ( Avogadro'nun numarası). sayısal olarak = Мr 10 -3 , burada Mr, maddenin bağıl moleküler ağırlığıdır ( sekme. Mendeleyev) (örneğin: =2 kg/kmol).
Belirli terimlerle (yani 1 kg gaz için), denklem (1.2) şu şekilde olacaktır:
Nerede R– özgül gaz sabiti, J/(kg K).
Spesifik gaz sabitinin fiziksel anlamını açıklayalım R. Denklem (1.2) birinci durum için, aynı basınçtaki ikinci durum için - olarak yazılacaktır. Birinci denklemi ikinci denklemden çıkarın ve şunu bulun, yani Özgül gaz sabiti, 1 kg gazın sabit basınçta 1 derece ısıtıldığında yaptığı iştir.
Deneysel veriler, gerçek bir gazın ideale ne kadar yakınsa, yoğunluğunun o kadar düşük olduğunu göstermektedir. Başka bir deyişle, basınçtaki artış veya sıcaklıktaki düşüş nedeniyle belirli bir gaz miktarının hacminde bir azalma ile, herhangi bir gaz ideal bir gazın özelliklerinden giderek daha fazla sapma verecektir. Böylece, "ideal gaz" kavramı altında, yüksek sıcaklık ve düşük basınçtaki tüm gerçek gazlar uygundur.
1.4. Karışımlar ideal gazlar
Uygulamada, çalışma sıvısı genellikle her biri ideal olarak kabul edilebilecek ve atmosfere girmeyen homojen gazların (örneğin hava) bir karışımıdır. kimyasal reaksiyonlar.
Böyle bir karışım aynı zamanda ideal bir gazdır ve karışım için durum denklemine (1.2) uyar.
Nerede R=R μ / μ, karışımın gaz sabitidir; mikro karışımın ortalama (görünen) molar kütlesidir(Molekül sayısının ve toplam kütlenin molekül sayısına ve karışımın kütlesine eşit olduğu homojen bir temsili gaza atıfta bulunan koşullu bir değer).
Karışımın kütlesi, onu oluşturan tüm bileşenlerin kütlesine eşittir.
Bir gaz karışımının davranışını belirleyen ana yasa, dalton yasası:
Her bir gaz, bir gaz karışımında, karışımın sıcaklığında tek başına karışımın tüm hacmini kaplıyormuş gibi davranır,
gaz karışımına giren her bir gaz, gaz karışımının tüm hacmini tek başına işgal etmesi durumunda sahip olacağı basınçla aynı basınca sahiptir.
dolayısıyla değer R(mutlak karışım basıncı) şu şekilde tanımlanır:
Nerede R Ben – kısmi basıncı Ben inci bileşen, yani olacak baskı Ben inci bileşen, aynı sıcaklıkta () karışımın tüm hacmini tek başına kaplıyorsa.
Karışımın bileşimi, karışımı oluşturan bileşenlerin kütle veya mol kesirlerinin yanı sıra hacim kesirleriyle (konsantrasyonlar) verilir.
kütle kesri her bir gazın kütlesinin, karışımın toplam kütlesine oranıdır: .
Denklem (1.3), .
Hacim fraksiyonu oran denir kısmi hacim(basıncı ve sıcaklığı gaz karışımının basıncına ve sıcaklığına eşit olsaydı gazın kaplayacağı hacim, yani) gaz karışımının toplam hacmine: . Kısmi basınç ve hacim tanımlarından ve sıcaklığın sabitliğinden şu şekildedir:
![]() (1.5)
(1.5)
Karışımın tüm bileşenleri üzerindeki son eşitliği toplayarak elde ederiz , yani. karışımı oluşturan gazların kısmi hacimlerinin toplamı, gaz karışımının hacmine eşittir.
Hacim kesirlerinin toplamı bire eşittir: .
mol kesri bileşen, her bir gazın madde miktarının oranı olarak adlandırılır N Ben gaz karışımındaki madde miktarına N. ilişkilerden ve ve Avogadro yasası(aynı sıcaklıklarda ve aynı basınçlarda eşit hacimde farklı ideal gazlarda, eşit sayıda molekül çevrelenir, yani):
onlar. Bir karışımı mol kesirleriyle belirtmek, hacim kesirlerini belirtmekle eşdeğerdir.
Kütle ve hacim fraksiyonları şu oranla ilişkilidir:
![]() .
.
Karışım kütle kesirleri ile verilirse G Ben, daha sonra karışımın gaz sabiti ve karışımın molar kütlesi aşağıdaki gibi hesaplanır:
![]()
![]()
Karışım hacim kesirleri ile verilirse R Ben, o zaman karışımın molar kütlesini ve karışımın gaz sabitini hesaplama formülleri aşağıdaki gibidir:
![]() (1.6)
(1.6)
Gazların kısmi basınçları ve hacimleri şu şekilde belirlenir: Boyle Kanunu–marriot(sabit bir gaz sıcaklığında, gaz basıncının ve hacminin ürünü sabit bir değerdir, yani):
![]() .
.
Kontrol soruları
Uluslararası Birimler Sistemi (SI) ve temel birimleri.
Temel termodinamik parametreler ve boyutları.
Bir termodinamik sistemin denge durumu ile kastedilen nedir?
Denge kavramı ve denge dışı durumlar.
Bir sistemin durum denklemi nedir?
Sistemin durumunun geometrik yorumu, termodinamik süreç.
İdeal gaz nedir? İdeal gaz ile gerçek gaz arasındaki fark nedir?
Gaz sabiti nedir? Fiziksel anlamı, boyutu ve tanımlama yöntemleri.
2. Isı kapasitesi
Herhangi bir işlemde çalışan gövdeye ısı mesajı, durumunda bir değişikliğe neden olur ve genel durumda, sıcaklıkta bir değişiklik eşlik eder. Çalışma sıvısının durumunun diğer herhangi bir parametresinin yanı sıra sıcaklıktaki değişiklik, işlemin türüne bağlı değildir, ancak başlangıcına bağlıdır ( 1 ) ve son ( 2 ) durumları, yani (temel bir süreç için, bir parametredeki değişikliğin yerini onun diferansiyeli alır).
Isı miktarının oranı δ Q vücut sıcaklığındaki bir değişiklik vücuda iletilir dT temel bir termodinamik süreçte denir gerçek ısı kapasitesi Bu süreçteki organlar:
Buradaki alt simge, ısı kapasitesinin, ısı gibi, sürecin doğasına bağlı olduğu gerçeğini gösterir. Ayrıca ısı kapasitesi cismin miktarına ve termodinamik durumuna bağlıdır. Ayrıca, bu süreçte vücudun kimyasal bileşiminin değişmediği, bir maddenin bir topaklanma durumundan diğerine geçişi olmadığı, bileşenlerin çözünmediği vb.
Bir maddenin seçilen miktar birimine bağlı olarak, kütle, hacim ve molar özgül ısı kapasiteleri ayırt edilir:
Kütle ısı kapasitesi kavramı pratikte en sık kullanılır.
2.1. Gerçek ve ortalama ısı kapasitesi
Gerçek bir maddenin ısı kapasitesi sabit bir değer değildir. Sıcaklıkla değişir ve bu bağımlılık çok önemli olabilir (Şekil 2.1).
Spesifik işlem ısısı miktarı formülle hesaplanır.
Bu değeri belirlemek için aşağıdaki yöntemler kullanılır:
deneyin sonuçlarına göre, ısı kapasitesinin sıcaklığa bağımlılığı bir yaklaşım polinomu olarak temsil edilir.
yaklaşıklık katsayıları nerede. Bu katsayılar referans literatürde verilmiştir. Daha sonra
sıcaklık aralığında pratik hesaplamalarda T 1 , T 2 ısı kapasitesi, şuna eşit sabit bir değer olarak kabul edilir:
isminde ortalama ısı kapasitesi(2.1)'de tanıtılan gerçek ısı kapasitesinin aksine bu aralıkta. Referans verileri, 0'dan sabit sıcaklığa kadar ortalama ısı kapasitelerini verir T ampirik olarak elde edildi, yani
Sıcaklık aralığında ortalama ısı kapasitesi T 1 , T 2 bu referans verilere göre formül ile hesaplanabilir
Daha sonra belirli miktar proses ısısı şu şekilde tanımlanır:
2.2. İzokorik ve izobarik ısı kapasiteleri
Termodinamikte büyük önem taşırlar.
izokorikısı kapasitesi
sabit bir hacimde işlemdeki ısı miktarının vücut sıcaklığındaki değişime oranına eşittir,
izobarikısı kapasitesi
sabit basınçta işlemdeki ısı miktarının vücut sıcaklığındaki değişime oranına eşittir.
Termoteknik hesaplamalarda, sıcaklığa bağlı olarak çeşitli maddeler için belirli izobarik ve izokorik ısı kapasiteleri için deneysel olarak elde edilen sayısal değerleri gösteren tablolar kullanılır.
2.3. Gaz karışımlarının ısı kapasitesi
Hesaplamalarda genellikle gaz karışımlarıyla uğraşmak gerekir ve ısı kapasiteleri tablolarda yalnızca tek tek gazlar için verilir.
Gazların karışımı kütle kesirleri ile verilirse G Ben, daha sonra karışımın özgül kütle ısı kapasiteleri formüllerle belirlenir.
![]()
Gazların karışımı hacim kesirleri ile verilirse R Ben, daha sonra karışımın özgül hacimsel ısı kapasiteleri formüllerle belirlenir.
![]()
Kontrol soruları
Özgül ısı kapasitesinin birimlerini yazınız.
Ortalama ısı kapasitesi kavramı nasıl tanıtıldı?
3. Enerjinin korunumu ve dönüşümü yasası
Enerji kavramı, maddenin hareketi ile ilişkilidir.
Enerji birçok biçimde olabilir - mekanik iş, ısı, kimyasal enerji, elektrik ve manyetik alanların enerjisi.
Termodinamik bir süreçte, çevre ile kapalı bir termodinamik sistemin etkileşimi, ısı ve mekanik iş şeklinde enerji alışverişi ile gerçekleştirilir.
3.1. İçsel enerji
Herhangi bir ortamın biraz marjı vardır içsel enerjisen(J), teknik termodinamikte ortamın moleküllerinin ve atomlarının kinetik ve potansiyel enerjilerinin toplamı olarak temsil edilir. Bu parçacıkların kinetik enerjisi, hızları ve kütleleri tarafından belirlenirken, potansiyel enerjileri, göreceli konumlarına bağlı olarak aralarındaki etkileşim kuvvetleri tarafından belirlenir. Bir sistemin iç enerjisi, sistemin kendisinde bulunan enerjidir. Bu, iç enerjinin, miktarlarla birlikte vücudun durumunu karakterize edebileceği anlamına gelir. R, V, T.
İç enerji, toplama özelliğine sahiptir, yani. karmaşık bir sistemin iç enerjisi, onu oluşturan parçaların iç enerjilerinin toplamına eşittir:
1 kg maddenin iç enerjisine denir. özgül iç enerji sen= sen/ M (J/kg).
Termodinamiğin çoğu teknik uygulaması için önemli olan mutlak değer değildir. sen ve bu değerdeki değişiklik. Bu nedenle, homojen bir sistemin iç enerjisinin nicel tanımı, genellikle geleneksel olarak seçilmiş bazı standart durumlara göre belirlenir.
3.2. Termodinamiğin enerjinin korunumu yasası
Termodinamik bir işlem gerçekleştiren kapalı bir sistem, dış çevre (dış cisimler ve alanlar) ile etkileşime girer, yani. enerji alışverişi yapar. Teknik termodinamikte, iki tür enerji transferi göz önünde bulundurulur - ısıyı aktararak ve mekanik iş yaparak.
Isı transferi, farklı sıcaklıklardaki ve temas ettirilen cisimler arasında veya birbirinden uzakta bulunan farklı sıcaklıklardaki cisimler arasında elektromanyetik dalgalar aracılığıyla gerçekleşir ( termal radyasyon). Yayın sıcaklık cisimlerin görünür hareketi olmadan moleküler (mikrofiziksel) seviyede gerçekleşir.
Enerjinin iş şeklinde transferi, tüm vücudun veya bir kısmının uzayda hareketi ile gerçekleşir. Bu yöntemle vücut ya bir kuvvet alanı içinde hareket eder ya da dış basıncın etkisi altında hacmini değiştirir. İş enerji transferinin makrofiziksel bir şeklidir.
Isı ve işin, bir vücudun enerjisinden farklı olarak, durumunun işlevleri olmadığı, ancak sürecin türüne bağlı olduğu, bu süreci belirlediği belirtilmelidir, yani. sürecin kendisinin işlevleridir.
Çok sayıda deney ve gözlem, temel bir doğa yasasının - enerjinin korunumu yasasının - keşfedilmesine yol açtı: Doğadaki enerji yoktan var olmaz ve yok olmaz, veya enerji miktarı değişmez, yalnızca bir biçimden diğerine değişir, veya
Nerede Q sürece dahil olan ısıdır; L- yapılan iş; Δ e sistemin enerjisindeki değişimdir. Burada ve aşağıda, şunları dikkate almayı kabul ediyoruz:
iş pozitif bu iş çalışma organı tarafından yapılırsa ve olumsuz, sistemin çalışan gövdesi üzerinde çalışma yapılıyorsa;
vücuda verilen ısı pozitif ve ayrılan - olumsuz
ek olarak, son süreçteki herhangi bir durum parametresindeki değişiklik, Δ (delta) sembolü ile ve temel süreçte - ile gösterilecektir. D(karşılık gelen parametrenin farkı). Herhangi bir sonlu termodinamik süreç için, durum parametresindeki (basınç, sıcaklık, iç enerji, entalpi, entropi vb.) değişiklik, işlemin türüne bağlı değildir, ancak başlangıç ve son durumlar tarafından belirlenir.
Genel olarak, bir termodinamik sistemin bir iç enerjisi vardır. sen, kinetik enerji (termodinamikte, sistem bir bütün olarak kabul edilir ve bir hızda hareket eder) w) – mw 2/2, potansiyel - mgz (z sistemin bulunduğu yüksekliktir). Süreçteki toplam enerjideki değişim 1 –2 olarak hayal edilebilir:
Bu süreçte yapılan iş, işin toplamıdır. L yaklaşık, sistemin çalışma sıvısının hacmindeki bir değişiklikle ilişkili (deformasyon işi), iş L sistemin uzaydaki hareketi üzerine dv, teknik çalışma L olanlar (sistemi çeşitli teknik cihazlarda, örneğin bir motorda, buhar kazanında, kompresörde vb. hareket ettirirken), sürtünme kuvvetlerine karşı çalışırlar L tr:
L \u003d L yaklaşık + L dv + L bunlar + L tr.
İşlemde yer alan ısı, ısının toplamıdır. Q dış, dış çevre ile değiş tokuşta yer alan ve sürtünme ısısı Q tr:
Q = Q harici + Q tr.
Verilen Q tr = L tr (çok sayıda deney, sürtünmenin üstesinden gelmek için harcanan akışın işinin tamamen akış tarafından algılanan ısıya dönüştürüldüğünü göstermiştir), termodinamikte 1 kg çalışan homojen bir madde için enerjinin korunumu yasası (yani, belirli kütle değerlerinde) ) temel bir süreçte yazılabilir:
![]() , (3.1)
, (3.1)
(gereksiz olduğu için harici dizin çıkarılmıştır).
(3.1)'in sağ tarafında diferansiyelin işaretinin altında durum fonksiyonlarının olduğu ve geri kalanının termodinamik sürecin doğasına bağlı olan nicelikler olduğu vurgulanmalıdır. İş ve ısı durum fonksiyonları değil, süreç fonksiyonları olduklarından, δ işareti yalnızca temel bir süreçte onu takip eden niceliklerin herhangi bir özel fonksiyonun artışı değil, gelişigüzel sonsuz küçük olduğu gerçeğini gösterir. Böylece, δ Q ve δ ben- temel (yani, sistemin durumundaki sonsuz küçük değişikliklere karşılık gelen) ısı ve iş miktarları.
Termodinamik sistem uzaydaki konumunu değiştirmiyorsa ve tek iş türü, sistemin hacmindeki bir değişiklikle ilişkili iş ise, o zaman denklem (3.1) daha basit bir biçim alır:
iş δ ben hakkında ya dış basınç kuvvetlerine karşı gerçekleştirilir ve daha sonra çalışma sıvısının hacmi genişler ya da tersine dış ortam vücut üzerinde onu sıkıştırarak iş yapar. Denge süreçleri için, ortamın basıncı çalışma sıvısındaki basınca eşit olduğunda, bu iş şu şekilde hesaplanır: Rdv, Nerede vçalışma maddesinin özgül hacmidir.
Denklem
isminde termodinamiğin birinci yasası: Durgun haldeki kapalı bir termodinamik sisteme verilen ısı, sistemin iç enerjisini değiştirmeye ve sistemin hacmini değiştirmek için iş yapmaya harcanır.. Denge ilişkisi (3.2) aynı zamanda dersler olarak da adlandırılır. İle teorik edebiyat. 1. Barok: ...
L. A. Eliseeva © Federal Devlet Bütçe Bilim Kurumu Rusya Bilimler Akademisi Sibirya Şubesi Devlet Kamu Bilimsel ve Teknik Kütüphanesi, 2013
IşaretçiRastgele yürüyüşler / A.N. Borodin, I. A. Ibragimov; altında... 241. Dorogokupets P.I. Termodinamik mineraller ve mineral dengesi ... kataloglar: özet dersler İle kurs "Referans ... durum teknikÜniversite. Seri, Teknik Bilimler. - ...
N. V. Basova [ve diğerleri]; ed. N. V. Basova. Rostov n/a: Phoenix, 2008
ders kitabıKurs) Yazılı D. T. Özet dersler İle yüksek matematik [Metin]: ... Teknik termodinamik Rudobashta, S.P. Isı mühendisliği [Metin]: öğrenciler için ders kitabı. okuyan üniversiteler İle... 2008. - 204 s. 10 Borodin, I. F. Teknolojik süreçlerin otomasyonu...
Hazine Müsteşarlığının 2008 - 1 Haziran 2013 dönemine ait bilimsel çalışmaları listesi (1)
belge... "X-ışını araştırma yöntemleri" dersler İle klinik onkoloji. Almatı... ikinci yasanın termodinamik» 2-Uluslararası... ve uzman incelemesi teknik sağlık kuruluşlarının donatılması ... Rusya Tıp Bilimleri Akademisi akademisyeni Yu.I. Borodin, Bişkek, 2009, s. ...
Mühendislik uygulamasında, genellikle homojen gazlarla değil, kimyasal olarak ilgisiz gazların karışımlarıyla uğraşmak gerekir. Gaz karışımlarının örnekleri şunlardır: atmosferik hava, doğal gaz, yakıtların yanmasından kaynaklanan gazlı ürünler, vb.
Gaz karışımları için aşağıdaki hükümler geçerlidir.
1. Karışıma giren her gazın bir sıcaklığı vardır, sıcaklığa eşit karışımlar.
2. Karışımda bulunan gazlardan herhangi biri karışımın hacmi boyunca dağılmıştır ve bu nedenle her bir gazın hacmi tüm karışımın hacmine eşittir.
3. Karışımda bulunan gazların her biri kendi hal denklemine uyar.
4. Karışım bir bütün olarak yeni bir gaz gibidir ve kendi hal denklemine uyar.
Gaz karışımlarının incelenmesi, sabit bir sıcaklıkta karışımın basıncının, karışıma dahil olan gazların kısmi basınçlarının toplamına eşit olduğu Dalton yasasına dayanmaktadır:
burada p cm, karışımın basıncıdır;
p ben - karışıma dahil edilen i-inci gazın kısmi basıncı;
n, karışımda bulunan gazların sayısıdır.
Kısmi basınç, karışıma giren gazın, aynı sıcaklıkta karışımın tüm hacmini tek başına kaplaması durumunda uygulayacağı basınçtır.
Gaz karışımlarını ayarlama yöntemleri
Gaz karışımının bileşimi kütle, hacim ve mol kesirleri ile belirlenebilir.
kütle kesirleri. Karışımda bulunan herhangi bir gazın kütle oranı, bu gazın kütlesinin karışımın kütlesine oranıdır.
m 1 \u003d M 1 / M cm; m2 \u003d M2 / Mcm; ..........; m n \u003d M n / M cm,
nerede m 1 , m 2 , ..., m n - gazların kütle kesirleri;
M 1 , M 2 , ..., M n - bireysel gazların kütleleri;
M cm karışımın kütlesidir.
bunu görmek kolay  Ve
Ve  (100%).
(100%).
Hacim paylaşımları. Karışıma dahil olan herhangi bir gazın hacim oranı, bu gazın azaltılmış (kısmi) hacminin karışımın hacmine oranıdır.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
nerede V 1 , V 2 , ..., V n - azaltılmış gaz hacimleri;
V cm karışımın hacmidir;
r 1 , r 2 , ..., r n - gazların hacimsel fraksiyonları.
İndirgenmiş hacim, karışım koşulları altında (karışımın sıcaklık ve basıncında) gazın hacmidir.
Azaltılmış hacim şu şekilde temsil edilebilir: Karışımı içeren kaptan biri dışındaki tüm gazlar çıkarılırsa ve kalan gaz, sıcaklığı korurken karışımın basıncına sıkıştırılırsa, hacmi azaltılır veya kısmen azaltılır.
Karışımın hacminin, indirgenmiş gaz hacimlerinin toplamına eşit olacağı kanıtlanabilir.
 (100%).
(100%).
Mol fraksiyonları. Bir karışımda bulunan herhangi bir gazın mol kesri, bu gazın kilomol sayısının karışımın kilomol sayısına oranıdır.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
nerede r 1 , r 2 , ..., r n - gazların mol kesirleri;
n cm, karışımın kilomol sayısıdır;
n 1 , n 2 , ..., n n gazların kilomol sayısıdır.
Bir karışımın mol kesirlerine göre belirtilmesi, bir karışımın hacim kesirlerine göre belirtilmesiyle aynıdır, örn. molar ve hacim fraksiyonları, karışımda bulunan her gaz için aynı sayısal değerlere sahiptir.
Karışımın gaz sabiti ve görünen (ortalama) moleküler ağırlığı. Kütle kesirleri tarafından verilen gaz karışım sabitini hesaplamak için durum denklemlerini yazarız:
karışım için
p cm × V cm = M cm R cm T; (1.9)
gazlar için
 .
(1.10)
.
(1.10)
Denklemlerin sol ve sağ kısımlarını topluyoruz (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Çünkü  ,
,
o zaman p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
Denklemler (1.9) ve (1.11) şu anlama gelir:
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
veya  ,
(1.12)
,
(1.12)
burada R cm, karışımın gaz sabitidir.
i'inci gazın gaz sabiti olduğundan
R ben = 8314 / m ben ,
denklem (1.12) aşağıdaki gibi yeniden yazılır:
 .
(1.13)
.
(1.13)
Bir gaz karışımının parametrelerini belirlerken, gaz karışımının görünen (ortalama) moleküler ağırlığı olarak adlandırılan belirli bir koşullu değerin kullanılması uygundur. Bir karışımın görünür moleküler ağırlığı kavramı, karışımı geleneksel olarak hesaplamaları büyük ölçüde basitleştiren homojen bir gaz olarak düşünmemize izin verir.
Ayrı bir gaz için, ifade
Benzetme yaparak, bir karışım için yazabiliriz
m cm R cm = 8314, (1.14)
burada m cm, karışımın görünen moleküler ağırlığıdır.
(1.14) denkleminden, (1.12) ve (1.13) ifadelerini kullanarak şunu elde ederiz:
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Bu şekilde tartışarak, hacim fraksiyonları aracılığıyla R cm ve m cm hesaplamak için formüller, kütle fraksiyonlarını hacim fraksiyonlarına dönüştürmek için formüller ve tersine hacim fraksiyonlarını kütle fraksiyonlarına dönüştürmek için formüller, bir karışımın özgül hacmini hesaplamak için formüller elde edilebilir u cm ve kütle ve hacim fraksiyonları yoluyla karışım yoğunluğu r cm ve son olarak, hacim ve kütle fraksiyonları yoluyla karışıma dahil edilen gazların kısmi basınçlarını hesaplamak için formüller. Bu formülleri tabloda türetmeden sunuyoruz.
Gaz karışımlarını hesaplamak için formüller
|
Karışımın bileşiminin ayarlanması |
Bir kompozisyondan diğerine aktarma |
Karışımın yoğunluğu ve özgül hacmi |
Karışımın görünür moleküler ağırlığı |
Gaz karışımı sabiti |
Kısmi basıncı |
|
kütle kesirleri |
|
|
|
|
|
|
Hacim kesirleri |
|
|
|
|
|
Gazların ısı kapasitesi
Bir cismin ısı kapasitesi, cismi 1 K ısıtmak veya soğutmak için gereken ısı miktarıdır. Bir maddenin birim miktarının ısı kapasitesine özgül ısı kapasitesi denir.
Dolayısıyla, bir maddenin özgül ısı kapasitesi, bu süreçte sıcaklığını 1 K değiştirmek için bir maddenin biriminden verilmesi veya çıkarılması gereken ısı miktarıdır.
Aşağıda sadece özgül ısı kapasiteleri dikkate alınacağından, özgül ısı kapasitesinden sadece ısı kapasitesi olarak bahsedeceğiz.
Gaz miktarı kütle, hacim ve kilomol sayısı ile verilebilir. Bir gaz hacmi ayarlanırken, bu hacmin normal koşullara getirildiği ve normal metreküp (nm 3) cinsinden ölçüldüğü unutulmamalıdır.
Gaz miktarını ayarlama yöntemine bağlı olarak, aşağıdaki ısı kapasiteleri ayırt edilir:
c - kütle ısı kapasitesi, J / (kg × K);
c¢ - hacimsel ısı kapasitesi, J / (nm 3 × K);
c m - molar ısı kapasitesi, J / (kmol × K).
Bu ısı kapasiteleri arasında aşağıdaki ilişkiler vardır:
c = c m / m; m ile = × m ile;
с¢ = с m / 22.4; m = s¢ × 22,4 ile,
buradan  ; s¢ = s × r n,
; s¢ = s × r n,
nerede u n ve r n - normal koşullar altında belirli hacim ve yoğunluk.
İzokorik ve izobarik ısı kapasiteleri
Çalışma akışkanına verilen ısı miktarı termodinamik prosesin özelliklerine bağlıdır. Termodinamik sürece bağlı olarak iki tür ısı kapasitesi pratik öneme sahiptir: izokorik ve izobarik.
u = const noktasındaki ısı kapasitesi izokoriktir.
c u - kütle izokorik ısı kapasitesi,
c¢ sen hacimsel izokorik ısı kapasitesidir,
santimetre sen molar izokorik ısı kapasitesidir.
p = const noktasındaki ısı kapasitesi izobariktir.
c p - kütle izobarik ısı kapasitesi,
c¢ р - hacimsel izobarik ısı kapasitesi,
c m p - molar izobarik ısı kapasitesi.
P = const'ta gerçekleştirilen işlemde sıcaklıktaki aynı değişiklikle, u = const'ta gerçekleştirilen işlemden daha fazla ısı tüketilir. Bu, u = const'ta vücuda verilen ısının yalnızca iç enerjisini değiştirmek için harcanması, p = const'ta ise ısının hem iç enerjiyi artırmak hem de genişleme işini gerçekleştirmek için harcanması gerçeğiyle açıklanır. Mayer denklemine göre kütle izobarik ve kütle izokorik ısı kapasiteleri arasındaki fark
c p - c sen=R. (1.17)
Denklemin (1.17) sol ve sağ tarafları m kilomol kütlesi ile çarpılırsa, şunu elde ederiz:
cm p - cm m sen= 8314 J/(kmol×K) (1,18)
Termodinamik ve uygulamalarında izobarik ve izokorik ısı kapasitelerinin oranı büyük önem taşır:
 ,
(1.19)
,
(1.19)
burada k, adyabatik üsdür.
Hesaplamalar, tek atomlu gazlar k » 1.67, iki atomlu gazlar k » 1.4 ve üç atomlu gazlar k » 1.29 olduğunu göstermektedir.
değer olduğunu görmek kolaydır. İle sıcaklığa bağlıdır. Aslında, (1.17) ve (1.19) denklemlerinden şu sonuç çıkar:
 ,
(1.20)
,
(1.20)
ve (1.18) ve (1.19) denklemlerinden
 .
(1.21)
.
(1.21)
Isı kapasiteleri artan gaz sıcaklığı ile arttığından, k'nin değeri bire yaklaşarak azalır, ancak her zaman ondan daha büyük kalır.
k'nin değeri bilinerek, karşılık gelen ısı kapasitesinin değeri belirlenebilir. Örneğin, denklemden (1.20) elde ederiz
 ,
(1.22)
,
(1.22)
dan beri p = k × s ile sen, sonra alırız
 .
(1.23)
.
(1.23)
Benzer şekilde, molar ısı kapasiteleri için denklem (1.21)'den şunu elde ederiz:
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Ortalama ve gerçek ısı kapasitesi
Gazların ısı kapasitesi sıcaklığa ve bir dereceye kadar basınca bağlıdır. Isı kapasitesinin basınca bağımlılığı küçüktür ve çoğu hesaplamada ihmal edilir. Isı kapasitesinin sıcaklığa bağımlılığı önemlidir ve dikkate alınmalıdır. Bu bağımlılık, denklemle oldukça doğru bir şekilde ifade edilir.
c = bir + V t + et 2 , (1.26)
burada bir, V ve e, belirli bir gaz için sabit olan değerlerdir.
Genellikle termal mühendislik hesaplamalarında, doğrusal olmayan bağımlılık (1.26) doğrusal olanla değiştirilir:
c = bir + V T. (1.27)
|
Isı kapasitesinin sıcaklığa bağımlılığını denklem (1.26)'ya göre grafiksel olarak kurarsak, bu eğrisel bir bağımlılık olacaktır (Şekil 1.4). Şekilde gösterildiği gibi, her sıcaklık değerinin, genellikle gerçek ısı kapasitesi olarak adlandırılan kendi ısı kapasitesi değeri vardır. Matematiksel olarak, gerçek ısı kapasitesinin ifadesi aşağıdaki gibi yazılır:
|
|
|
|
Bu nedenle, gerçek ısı kapasitesi, sonsuz küçük bir ısı dq miktarının, dt sıcaklığındaki sonsuz küçük bir değişime oranıdır. Başka bir deyişle, gerçek ısı kapasitesi, belirli bir sıcaklıkta gazın ısı kapasitesidir. Şek. Şekil 1.4'te, t1 sıcaklığındaki gerçek ısı kapasitesi t1 ile gösterilir ve t2 sıcaklığında - t2 sıcaklığında segment 1-4 olarak gösterilir ve segment 2-3 olarak gösterilir. Denklemden (1.28) elde ederiz dq=cdt. (1.29) Pratik hesaplamalarda her zaman son değişimdeki ısı miktarı |
sıcaklık. Bir maddenin t 1'den t 2'ye ısıtıldığında birim miktarına bildirilen q ısı miktarının t 1'den t 2'ye (1.29) integrasyonu ile bulunabileceği açıktır.
 .
(1.30)
.
(1.30)
Grafik olarak, integral (1.30) 4-1-2-3 alanı ile ifade edilir. (1.30) ifadesinde, gerçek ısı kapasitesinin değerini doğrusal bağımlılığa (1.27) göre değiştirirsek, o zaman şunu elde ederiz:
 (1.31)
(1.31)
Nerede  - t 1 ila t 2 sıcaklık aralığında ortalama ısı kapasitesi.
- t 1 ila t 2 sıcaklık aralığında ortalama ısı kapasitesi.
 ,
(1.32)
,
(1.32)
Bu nedenle, ortalama ısı kapasitesi, nihai ısı miktarının (q) nihai sıcaklık değişimine (t2 - t1) oranıdır:
 .
(1.33)
.
(1.33)
4-3 temelinde (Şekil 1.4), şekil 4-1-2-3'e eşit boyutta bir 4-1¢-2¢-3 dikdörtgeni oluşturulursa, bu dikdörtgenin yüksekliği ortalama ısı kapasitesine eşit olmak, burada  t 1 - t 2 sıcaklık aralığındadır .
t 1 - t 2 sıcaklık aralığındadır .
Genellikle, ortalama ısı kapasitelerinin değerleri, maddelerin termodinamik özellikleri tablolarında verilir. Ancak bu tabloların hacmini küçültmek için 0°C ile t°C sıcaklık aralığında belirlenen ortalama ısı kapasitelerinin değerlerini verirler.
Belirli bir sıcaklık aralığında t 1 - t 2 ortalama ısı kapasitesinin değerini hesaplamak gerekirse, bu şu şekilde yapılabilir.
C \u003d f (t) eğrisi altındaki 0a14 alanı (Şekil 1.4), gaz sıcaklığını 0 ° C'den t 1 ° C'ye çıkarmak için gereken ısı miktarına q 1 karşılık gelir.

Benzer şekilde, sıcaklık 0 o C'den t 2 o C'ye yükseldiğinde 0a23 alanı q 2'ye karşılık gelir:

Böylece, q \u003d q2 - q1 (alan 4123) şu şekilde temsil edilebilir:
![]() (1.34)
(1.34)
(1.34)'e göre q değerini ifade (1.33)'te değiştirerek, herhangi bir sıcaklık aralığında ortalama ısı kapasitesi için formülü elde ederiz:
 .
(1.35)
.
(1.35)
Böylece, ortalama ısı kapasitesi denklem (1.35) kullanılarak tablodaki ortalama ısı kapasitelerinden hesaplanabilir. Ayrıca, lineer olmayan bir bağımlılık c = f(t) elde ederiz. Ortalama ısı kapasitesini doğrusal bir ilişki kullanarak (1.32) denklemini kullanarak da bulabilirsiniz. a ve değerleri V(1.32) denkleminde literatürde çeşitli gazlar için verilmiştir.
Çalışma sıvısından sağlanan veya çıkarılan ısı miktarı, aşağıdaki denklemlerden herhangi biri kullanılarak hesaplanabilir:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
Nerede 

 - sırasıyla ortalama kütle, hacim ve molar ısı kapasitesi; M, gazın kütlesidir; n, gazın kilomol sayısıdır; V n - normal koşullar altında gazın hacmi.
- sırasıyla ortalama kütle, hacim ve molar ısı kapasitesi; M, gazın kütlesidir; n, gazın kilomol sayısıdır; V n - normal koşullar altında gazın hacmi.
V n gazının hacmi aşağıdaki gibi bulunabilir. Verilen koşullar için durum denklemini yazdıktan sonra: pV = MRT ve normal koşullar için: p n V n = MRT n, ikinci denklemi birinciye atfediyoruz:
 ,
,
buradan  .
(1.39)
.
(1.39)
Gaz karışımlarının ısı kapasitesi
Bir gaz karışımının ısı kapasitesi, karışımın bileşimi verildiğinde ve karışımda yer alan bileşenlerin ısı kapasiteleri biliniyorsa hesaplanabilir.
Kütlesi M cm olan bir karışımı 1 K ısıtmak için bileşenlerin her birinin sıcaklığı da 1 K arttırılmalıdır. Aynı zamanda, kütlesi М i olan karışımın i'inci bileşenini ısıtmak için ci M i'ye eşit ısı miktarı harcanır. Tüm karışım için, ısı miktarı  ,
,
c i ve c cm i'inci bileşen ve karışımın kütle ısı kapasiteleridir.
Son ifadeyi M cm'ye bölerek, karışımın kütle ısı kapasitesi için hesaplama formülünü elde ederiz:
 ,
(1.40)
,
(1.40)
burada m i, i'nci bileşenin kütle kesridir.
Benzer şekilde, karışımın hacimsel ısı kapasitesini c¢ cm ve molar ısı kapasitesini c m cm buluyoruz:
 (1.41)
(1.41)
c¢ i - i'inci bileşenin hacimsel ısı kapasitesi, r ben - i'inci bileşenin hacim oranı,
 ,
(1.42)
,
(1.42)
burada c m i, i'nci bileşenin molar ısı kapasitesidir,
r ben - i'inci bileşenin mol (hacim) fraksiyonu.
Isı motorlarında (makinelerde), çalışma akışkanı çeşitli gazların karışımıdır. Karışımın bileşenleri birbirleriyle kimyasal reaksiyona girmiyorsa ve her bileşen Claiperon hal denklemine uyuyorsa, böyle bir karışım ideal gaz olarak kabul edilir.
Karışımı hesaplamak için, μ cm - ortalama molar kütle ve R c m - karışımın özgül gaz sabitini belirlemek gerekir. Bunları belirlemek için karışımın bileşimini, yani bu karışımı hangi bileşenlerin ve hangi miktarlarda oluşturduğunu, karışıma dahil olan her bileşenin hangi parametrelere sahip olduğunu bilmek gerekir.
Karışımın her bir bileşeni, karışımda başka gaz yokmuş gibi davranır, karışımın bulunduğu mevcut hacmin tamamını kaplar, kendi hal denklemini takip eder ve kısmi basınç olarak adlandırılan kısmi basıncını duvarlara uygularken, sıcaklık Karışımın tüm bileşenlerinin oranı aynıdır ve karışım sıcaklığına eşittir.
Dalton yasasına göre, karışımın basıncı P, karışıma dahil olan ayrı ayrı bileşenlerin kısmi basınçlarının toplamına eşittir:
burada n, karışım bileşenlerinin sayısıdır.
Amag yasasına göre, karışımın hacmi V, karışımın sıcaklık ve basıncında karışıma dahil olan tek tek bileşenlerin kısmi hacimlerinin toplamına eşittir:
 , (1.21)
, (1.21)
nerede - kısmi hacim, m3; V- karışımın hacmi, m3
Karışımın bileşimi hacim (molar) veya kütle fraksiyonları ile verilir.
i'inci bileşenin hacim oranı bileşenin kısmi hacminin karışımın hacmine oranıdır, yani, o zaman karışımın bileşenlerinin hacim kesirlerinin toplamı 1'dir, yani . Değer % olarak verilmişse, toplamları = %100'dür.
i'inci bileşenin molar fraksiyonu n i N i bileşeninin kilomol sayısının N karışımının kilomol sayısına oranıdır, yani burada ![]() , , yani her bileşenin ve bir bütün olarak karışımın kilomol sayısı, karşılık gelen bileşenin ve bir bütün olarak karışımın bir kilomolün kapladığı hacme oranına eşittir.
, , yani her bileşenin ve bir bütün olarak karışımın kilomol sayısı, karşılık gelen bileşenin ve bir bütün olarak karışımın bir kilomolün kapladığı hacme oranına eşittir.
Aynı koşullar altındaki ideal bir gazın aynı kilomol hacmine sahip olduğu göz önüne alındığında, ikameden sonra şunu elde ederiz: yani ideal gazlar için molar ve hacim fraksiyonları sayısal olarak eşittir.
i'inci bileşenin kütle kesri bileşenin kütlesinin karışımın kütlesine oranıdır: , bundan, karışımın kütlesinin bileşenlerin kütlelerinin toplamına eşit olduğu ve ayrıca bileşenlerin kütle kesirlerinin toplamının da eşit olduğu sonucu çıkar. 1'e (veya %100'e).
Hacim kesirlerinin kütle kesirlerine dönüştürülmesi ve bunun tersi aşağıdaki oranlara dayanmaktadır:
![]() ,
,
burada ρ = μ / 22.4, kg / m3.
Buradan, i-inci bileşenin kütle kesrinin ilişkiden belirleneceği sonucu çıkar:
 ,
,
karışımın yoğunluğu, kg / m3, i-inci bileşenin hacim fraksiyonudur.
Gelecekte, hacim kesirleri aracılığıyla belirlenebilir.
 .
.
Yoğunluk hacim fraksiyonları için karışımlar ilişkiden belirlenir
 , Neresi
, Neresi  , (1.22)
, (1.22)
 .
.
Kısmi basınç aşağıdaki formüllerle belirlenir:
![]() veya
veya  (1.23)
(1.23)
Bileşenlerin ve bir bütün olarak karışımın durum denklemleri şu şekildedir:
![]() ;
;
![]() ,
,
bu nedenle, dönüşümlerden sonra, cüsseli hisseler
 ,
,  . (1.24)
. (1.24)
Karışımın yoğunluğu ve özgül hacmi cüsseli paylaşmak:
;  . (1.25)
. (1.25)
Kısmi basınçları hesaplamak için aşağıdaki formül kullanılır:
 . (1.26)
. (1.26)
Kütle fraksiyonlarının hacim fraksiyonlarına dönüştürülmesi aşağıdaki formüle göre gerçekleştirilir:
 .
.
Bir gaz karışımının ısı kapasitesini belirlerken, bir gaz karışımını ısıtmak (soğutmak) için karışımın bileşenlerinin her birini ısıtmak (soğutmak) gerektiği varsayılır.
burada Q ben =M i c ben ∆t karışımın i'inci bileşeninin sıcaklığını değiştirmek için harcanan ısıdır, c i karışımın i'inci bileşeninin kütle ısı kapasitesidir.
Karışımın ısı kapasitesi orandan belirlenir (karışım kütle kesirleri ile verilirse)
 , benzer şekilde
, benzer şekilde  . (1.28)
. (1.28)
Hacim kesirleri tarafından verilen bir karışım için molar ve hacimsel ısı kapasiteleri şu şekilde belirlenir:
 ;
;  ;
;
 ;
; 
Örnek 1.5 Kütle olarak kuru hava, g O2 \u003d %23,3 oksijen ve g N2 \u003d %76,6 nitrojenden oluşur. Hacimce havanın bileşimini (r O2 ve r N 2) ve karışımın gaz sabitini belirleyin.
Çözüm.
1. Tablo 1'den kg/kmol ve kg/kmol'ü buluyoruz
2. Oksijen ve nitrojenin hacim fraksiyonlarını belirleyin:
1. Havanın (karışım) gaz sabiti aşağıdaki formülle belirlenir:
 , J/kg K
, J/kg K
Örnek 1.6. Kütlesi M = 2 kg olan bir gaz karışımını P = sabitte ısıtmak için gereken ısı miktarını belirleyin, ağırlıkça % olarak oluşur: , , , , sıcaklık t 1 =900 ° C'den t 2 = 1200'e değiştiğinde ° C
Çözüm:
1. P=sabit ve t 1 =900 o C'de (P2'den) gaz karışımını oluşturan bileşenlerin ortalama kütle ısı kapasitesini belirleyin:
1,0258 kJ/kg K; =1,1045 kJ/kg K;
1,1078 kJ/kg K; =2,1097 kJ/kg K;
2. Gaz karışımını oluşturan bileşenlerin ortalama kütle ısı kapasitesini P=sabit ve t 1 =1200 o C'de (P2'den) belirliyoruz:
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kg K; =2,2106 kJ/kg K;
3. Sıcaklık aralığı için karışımın ortalama kütle ısı kapasitesini belirleriz: t 2 \u003d 1200 ° C ve t 1 \u003d 900 ° C:
4. Karışımın 2 kg'ını P=sabit'te ısıtmak için gereken ısı miktarı:
termodinamiğin birinci yasasıçalışma akışkanına ısı verilmesi sonucu ortamın dış basınç kuvvetlerine karşı yapılan mekanik iş ile sistemin iç enerjisindeki değişim arasında niceliksel bir ilişki kurar.
Kapalı bir termodinamik sistem için birinci yasanın denklemi şu şekildedir:
Çalışma sıvısına (veya sisteme) verilen ısı, vücut sıcaklığındaki artış nedeniyle iç enerjisini (dU) artırmak ve çalışma sıvısının genleşmesi ve içindeki artış nedeniyle dış iş (dL) yapmak için kullanılır. hacim.
Birinci yasa dH=dq+VdP=dq-dL 0 şeklinde yazılabilir,
burada dL 0 \u003d VdP - basınç değişiminin temel çalışmasına yararlı harici (teknik) çalışma denir.
dU, moleküllerin termal hareketinin enerjisini (öteleme, dönme ve titreşim) ve moleküllerin etkileşiminin potansiyel enerjisini içeren çalışma sıvısının (sistem) iç enerjisindeki değişikliktir.
Sistemin bir halden başka bir hale geçişi ısı temini sonucunda gerçekleştiği için, çalışma akışkanı ısınır ve sıcaklığı dT kadar yükselir ve hacmi dV kadar artar.
Vücut sıcaklığındaki bir artış, parçacıklarının kinetik enerjisinde bir artışa neden olur ve vücut hacmindeki bir artış, parçacıkların potansiyel enerjisinde bir değişikliğe yol açar. Sonuç olarak, vücudun iç enerjisi dU kadar artar, yani iç enerji U vücudun durumunun bir fonksiyonudur ve iki bağımsız parametrenin bir fonksiyonu olarak temsil edilebilir U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T). Termodinamik bir süreçte iç enerjideki değişiklik, yalnızca ilk (U 1) ve son (U 2) durumlar tarafından belirlenir, yani.
Diferansiyel formda, iç enerjideki değişim yazılır.
a) özgül hacim ve sıcaklığın bir fonksiyonu olarak

b) sıcaklığın bir fonksiyonu olarak, çünkü , O
Sıcaklıkla birlikte C v'deki değişikliği hesaba katmanın gerekli olduğu pratik hesaplamalar için ampirik formüller ve özgül iç enerji tabloları (genellikle molar) vardır. İdeal gazlar için, karışımın molar iç enerjisi Um formülle belirlenir.
 , J/kmol
, J/kmol
Kütle kesirleri ile verilen bir karışım için. Böylece içsel enerji Orada sistemin özelliği ve sistemin durumunu karakterize eder.
entalpi Kamerling-Onnes tarafından tanıtılan termal durum fonksiyonudur, (kazanan Nobel Ödülü, 1913), U sisteminin iç enerjisinin toplamı ve P sisteminin basıncı ile hacminin V çarpımıdır.
İçerdiği nicelikler durum işlevleri olduğundan, H aynı zamanda bir durum işlevidir, yani. H \u003d f 1 (P, V); H=f2(V,T); H=f 3 (P, T).
Herhangi bir termodinamik işlemde entalpi dH'deki değişiklik, ilk H 1 ve son H 2 durumları tarafından belirlenir ve işlemin doğasına bağlı değildir. Sistem 1 kg madde içeriyorsa, özgül entalpi J/kg kullanılır.
İdeal bir gaz için diferansiyel denklem şu şekildedir:
buna göre, spesifik entalpi formül ile belirlenir
Termodinamiğin birinci yasasının denklemi dq=dU+Pdυ şeklindedir, tek iş türü genişleme çalışması Pdυ=d(Pυ)-υdP olduğunda, o zaman dq=d(U+Pυ)-υdP olur, buradan
Pratik iş№ 2
Konu: Isı kapasitesi, entalpi, ideal gaz karışımları, iç enerji, iş, termodinamik süreçler.
Çalışmanın amacı: Teorik eğitim sırasında edinilen bilgilerin pekiştirilmesi, ısı mühendisliği hesaplamalarının uygulanmasında becerilerin kazanılması.
BEN. Temel tanımlar, formüller ve denklemler
1. İdeal gazların karışımları
Bir gaz karışımı, birbiriyle kimyasal olarak etkileşime girmeyen birkaç gazın mekanik bir karışımıdır. Karışımdaki gazların her birine gaz bileşeni denir; karışımda başka gaz yokmuş gibi davranır, yani karışım boyunca eşit olarak dağıtılır. Karışımdaki her bir gazın kabın duvarlarına uyguladığı basınca kısmi basınç denir. İdeal gaz karışımları için temel yasa, karışımın basıncının, karışımı oluşturan gazların kısmi basınçlarının toplamına eşit olduğu Dalton yasasıdır:
2. İç enerji
Vücudun iç enerjisi, vücudu oluşturan mikropartiküllerin hareketinin kinetik enerjisi ile potansiyel enerjisinin birleşimidir. etkileşim tanımlandı. karşılıklı çekim veya itme kuvvetleri. İç enerjinin mutlak değerini belirlemek imkansızdır, bu nedenle termodinamik hesaplamalarda hesaplanan iç enerjinin mutlak değeri değil, değişimi yani değişimidir.
![]() veya
veya ![]()
burada U 1 ve U 2 - çalışma sıvısının (gaz) ilk ve son halinin iç enerjisi;
u 1 ve ve 2 - atım. çalışma sıvısının ilk ve son halinin iç enerjisi.
Bundan, iç enerjideki değişimin, sürecin doğasına ve yoluna bağlı olmadığı, ancak değişim sürecinin başında ve sonunda çalışan sıvının durumu tarafından belirlendiği sonucu çıkar.
İdeal bir gazın özelliği, içinde moleküler etkileşim kuvvetlerinin olmaması ve dolayısıyla iç potansiyel enerjinin olmamasıdır, yani. U n \u003d 0 ve U „ \u003d 0. Bu nedenle, ideal bir gazın iç enerjisi:
U=U k =f(T) unu u=uk =f(T).
H. Gaz işi.
Termodinamikte, enerji alışverişi sonucunda çalışma sıvısının durumundaki herhangi bir değişiklik çevre süreç denir. Bu durumda, çalışan gövdenin ana parametreleri değiştirilir:
Isının mekanik işe dönüşümü, çalışma sıvısının durumunu değiştirme süreci ile ilişkilidir. Bir gazın durumunu değiştirme işlemleri genleşme ve büzülme işlemleri olabilir. İsteğe bağlı bir gaz kütlesi M (kg) için iş şuna eşittir:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
burada l \u003d p (v 2 -v 1) J / kg, 1 kg gazın veya belirli bir işin işidir.
4. Gaz entalpisi,
Entalpi, çalışma sıvısının (gaz) çevre ile bağlantısının potansiyel enerjisini karakterize eden bir parametredir. Entalpi ve spesifik entalpi:
ben \u003d U + pV, J ve ben ben \u003d ve + pv, J / kg.
5. Isı kapasitesi.
Özgül ısı kapasitesi, belirli bir sıcaklık aralığında 1 ° C ısıtmak için 1 kg gaza verilmesi gereken ısı miktarıdır.
Özgül ısı kapasitesi kütle, hacim ve kilomoldür. Kütle C, hacim C ve kilomol C ısı kapasiteleri arasında bir bağlantı vardır:
 ;
; 
burada Vo 22,4 m3 / kmol - atıyor. normal koşullar altında gaz hacmi.
Kitle ud. gaz karışımının ısı kapasitesi:

Volumetrik özısı gaz karışımı:

Gaz karışımının kilomolar özgül ısısı:

6. Isı miktarını belirleme denklemi
Çalışma sıvısı (gaz) tarafından verilen veya alınan ısı miktarı aşağıdaki denklemle belirlenebilir:
Q \u003d M C m (t 2 -t 1), J veya Q \u003d VC (t-t), J, burada M ve V, gazın, kg veya m3'ün ağırlık veya hacim miktarıdır;
t u t - işlemin sonunda ve başında gaz sıcaklığı ° С;
C ve C - kütle ve hacim ortalama vuruşları. gazın ısı kapasitesi
t cp \u003d J / kgK veya J / m 3 K'da
7. Termodinamiğin birinci yasası
Bu yasa, ısı ve mekanik işin dönüşümlerini dikkate alır. Bu yasaya göre, ısı mekanik işe dönüştürülür ve tam tersi, mekanik iş ısıya kesinlikle eşdeğer miktarlarda dönüştürülür. Isı ve iş için denklik denklemi şu şekildedir:
Isı ve işin eşdeğerliği ilkesi dikkate alındığında, keyfi bir gaz kütlesi için ısı dengesi denklemi:
Q \u003d U + L ve q \u003d u + l \u003d u -u + l
Problem çözmeIII
Görev #1 (#1)
Atmosferik kuru hava aşağıdaki yaklaşık kütle bileşimine sahiptir: g 02 = %23,2, g N 2 = %76,8.
Bir barometre kullanarak hava P = 101325 Pa ise, havanın hacimsel bileşimini, gaz sabitini, görünür moleküler ağırlığını, oksijen ve nitrojenin kısmi basıncını belirleyin.
Havanın hacimsel bileşimini belirliyorum:
 ;
; ;
;
burada r, kütle kesridir;
m bağıl moleküler ağırlıktır;
g hacim fraksiyonudur.
m hava. =m O2 r O2 +m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
burada R 0 gaz sabitidir.
Çeşitli gazların kısmi basınçlarını belirliyorum:
P O 2 \u003d P cm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
nerede P O 2 , P N 2 - kısmi basınç;
P cm karışımın basıncıdır.
Görev #2 (#2)
Kap, bir bölme ile hacimleri V1 =1.5 m3 ve V2 =1.0 m3 olan 2 kısma bölünmüştür. Vı hacminin birinci kısmı, Pı =0.5 MPa ve tı =30°C'de C02 içerir; V2 hacminin ikinci kısmı, P2 =0.2 MPa ve t2 =57°C'de O2 içerir. C02 ve O2'nin kütle ve hacim fraksiyonlarını, karışımın görünür moleküler ağırlığını ve ayırma işlemi kaldırıldıktan ve karıştırma işlemi tamamlandıktan sonra gaz sabitini belirleyin.
Bireysel gaz sabitlerini belirliyorum:
Bunu yapmak için bağıl moleküler ağırlığı belirliyorum: m (C02) \u003d 32 + 12 \u003d 44; m(02)=32;

 ;
;
![]()
 ;
;
Klaiperon'un karakteristik denklemine göre gazların kütlelerini belirliyorum:
 (kilogram);
(kilogram);
 (kilogram);
(kilogram);
Kütle kesirlerini belirliyorum:


Hacim kesirlerini belirliyorum:


Havanın görünür moleküler ağırlığını belirleyin:
m hava. \u003d m O2 r O2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 \u003d 41,48;
Hava (R) için bireysel gaz sabitini belirliyorum:

 ;
;
Görev #3 (#6)
300 l hacimli bir kapta P 1 \u003d 0,2 MPa ve t 1 \u003d 20 0 C basıncında oksijen vardır. Oksijen sıcaklığının t 2 \u003d 300 0 C'ye yükselmesi için ne kadar ısı sağlanmalıdır? ? Kapta hangi basınç oluşturulacak? Hesaplama için oksijenin n.o.'daki ortalama hacimsel özgül ısısını alın. C 02 \u003d 0,935 
Charles yasasına göre, sürecin son baskısını belirliyorum:
;  (Pa);
(Pa);
burada P, T gaz parametreleridir.
Oksijen (R) için bireysel gaz sabitini belirliyorum:

 ;
;
İşlem izokorik olduğu için verilmesi gereken ısı miktarını uygun formüle göre belirliyorum: Q v \u003d M C cv (T 2 -T 1) bunun için Claiperon karakteristik denklemine göre kütleyi belirliyorum gaz
 (kilogram); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
(kilogram); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
Görev #4 (#7)
2m 3 havayı sabit bir aşırı basınç P ex ile ısıtmak için ne kadar ısı harcanmalıdır. \u003d 100 0 C sıcaklıktan 500 0 C sıcaklığa 0,2 MPa. Bu durumda hava ne iş yapacak? Hesaplama için şunları alın: atmosfer basıncı P at. \u003d 0,1 MPa, havanın ortalama kütle izobarik ısı kapasitesi Cpm \u003d 1,022  ; havanın görünür moleküler ağırlığının M hava olduğunu göz önünde bulundurarak gaz sabitini hesaplayın. =29.
; havanın görünür moleküler ağırlığının M hava olduğunu göz önünde bulundurarak gaz sabitini hesaplayın. =29.
Hava için bireysel gaz sabitini belirliyorum:

 ;
;
Mutlak basınç, fazlalık ile atmosferik P=P tahmininin toplamına eşittir. + P at. =0,1+0,2=0,3 MPa
 (kilogram);
(kilogram);
İşlem izobarik olduğundan, Q ve L'yi karşılık gelen formüllere göre belirlerim:
Gay-Lussac yasasına göre son hacmi belirliyorum:
 m3;
m3;
Q \u003d MC pm (T 2 -T 1) \u003d 5.56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2,15 \u003d 645000 (J).
Görev #5 (#8)
Silindirde P=0,5 MPa basınçta ve t 1 =400 0 C sıcaklıkta hava vardır. P=const'ta havadan ısı alınır, böylece işlemin sonunda sıcaklık t 2 =0 0 C olur içinde hava V 1 \u003d 400l olan silindirin hacmi.
Kaldırılan ısı miktarını, nihai hacmi, iç enerjideki değişimi ve mükemmel sıkıştırma işini belirleyin C pm = 1,028  .
.
İşlem izobarik olduğundan, Gay-Lussac yasasına göre son hacmi belirliyorum:
 m3;
m3;
Klaiperon'un karakteristik denklemine göre gazın kütlesini belirliyorum:
Önceki problemden R=286.7 
 (kilogram);
(kilogram);
Açığa çıkan ısı miktarını belirliyorum:
Q=M Cpm (T2 -T1)=1,03 1028 (273-673)=-423536 (J);
Harcanan iş miktarını belirliyorum:
L=P (V 2 - V 1)= 500,000 (0,16-0,4)=-120,000 (J);
Toplam miktarın belirlendiği denklemden, iç enerji miktarındaki değişimi belirliyorum:
![]() ; (J)
; (J)
Sorun #6 (#9)
P 1 = 1.1 MPa ve t 1 = 25 s basınçta V 1 = 0.02 m3 hacme sahip hava, hareketli bir pistona sahip bir silindirde P 2 = 0.11 MPa basınca genişler. Silindirde genleşme meydana gelirse, son hacim V2'yi, son sıcaklık t2'yi, havanın yaptığı işi ve sağlanan ısıyı bulun:
a) izotermal olarak
b) adyabatik üs k=1.4 ile adyabatik olarak
c) politropik indeks n=1.3 ile politropik
İzotermal süreç:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0,02 1,1 / 0,11 \u003d 0,2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000 J
Adyabatik süreç:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 298 \u003d 20,32k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1)=2.0275 10 6 J
Politropik süreç:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118M 3
T2 /T1 \u003d (P2 /P1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118)=30000J
Q=(k-n/k-1) l M=((1.4-1.3)/(1.4-1)) 30000=7500J
Edebiyat:
1. Enerji, Moskova, 1975.
2. Litvin AM "Isı mühendisliğinin teorik temelleri", "Enerji" yayınevi, Moskova, 1969.
3. Tugunov P.I., Samsonov A.A., "Isı mühendisliğinin temelleri, ısı motorları ve buhar gücü tesisleri", Nedra yayınevi, Moskova, 1970.
4. Krutov V.I., "Isı mühendisliği", "Mühendislik" yayınevi, Moskova, 1986.
Gaz karışımları. Gazların ısı kapasitesi
Gaz karışımları, birbirleriyle kimyasal olarak etkileşime girmeyen birkaç gazın mekanik bir karışımı olarak anlaşılır. İdeal gazların bir karışımı, ilgili tüm yasalara uyar. ideal gazlar. Gaz karışımının bileşimi, karışıma dahil edilen gazların her birinin miktarı ile belirlenir ve kütle veya hacim fraksiyonları ile belirtilebilir:
burada -inci bileşenin kütlesi, -inci bileşenin hacmi ve sırasıyla tüm karışımın kütlesi ve hacmidir.
açık ki
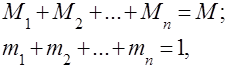
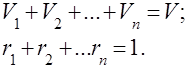
Gaz karışımlarıyla ilgili pratik problemleri çözme kolaylığı için, karışımın tek tek bileşenlerinin gerçek moleküler ağırlıklarının ortalama kütlesi olan bir gaz karışımının görünür moleküler ağırlığı kavramı tanıtılır.
Bir gaz karışımı için hal denklemi şu şekildedir:
Gaz karışımları, evrensel gaz sabiti kavramına tabidir.
Bir gaz karışımının basıncı ile karışıma dahil olan ayrı ayrı bileşenlerin kısmi basıncı arasındaki ilişki Dalton yasası ile belirlenir:
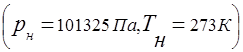
1 gaz, basınç ve sıcaklığa bağlı olarak farklı bir kütleye sahiptir. Bu bağlamda, hacimsel ısı kapasitesi her zaman normal koşullar altında 1'de bulunan gazın kütlesine atıfta bulunur. Bu durumda, çeşitli gazların 1 kmol hacmi 22,4 / kmol ve evrensel gaz sabiti . Gaza ısı sağlama yöntemine bağlı olarak, izobarik ve izokorik ısı kapasiteleri vardır. Bu miktarların oranına adyabatik üs denir.
Isı kapasiteleri ve ayrıca Mayer ilişkisi ile ilişkilidir.
Sıcaklık aralığında 1 kg gazın ısıtılması sürecinde harcanması gereken ısı miktarı aşağıdaki formülle belirlenir:
burada ve sırasıyla 0°- ve 0°- içindeki ortalama ısı kapasiteleridir.
İşlemde (kg) veya () gazı varsa, o zaman
Gaz karışımının ısı kapasitesi aşağıdaki formüllerle belirlenmelidir:
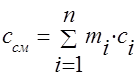
yığın - ;
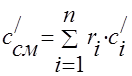
hacimsel -;
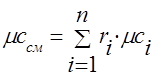
azı - .
Kazan ünitesinde yakıt yanması ürünleri olan gazların ısısını kullanmak için, yakıtın yanması için gerekli olan havanın hava ısıtıcıları, ikincisinin gaz kanallarına monte edilir (Şekil 1). Kazandan çıkan gazlar hava ısıtıcısına bir sıcaklıkla girer ve soğutularak havaya ısı verir. Kazan ünitesinin gaz kanalında, duman egzozunun çalışmasının etkisi altında, atmosferik basıncın biraz altına bir basınç ayarlanır. Hava ısıtıcısındaki hava sıcaklıktan sıcaklığa ısıtılır.
baca gazları
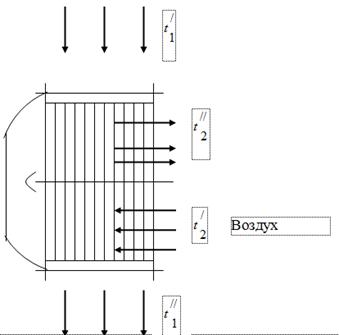
Kazan ünitesini test ederken aşağıdaki veriler elde edildi:
Hava ısıtıcısının girişindeki gazların sıcaklığı = 450 °C.
Hava ısıtıcısının çıkışındaki gazların sıcaklığı = 150 °C.
Hava ısıtıcısı girişindeki hava sıcaklığı, = 26 ° C.
Hava ısıtıcısının çıkışındaki hava sıcaklığı = 260 °C.
Baca gazlarının hacimsel bileşimi - = %11,5; = %6,5; = %17,2; = %64,8
Saatlik gaz tüketimi 50 ·/h'dir.
Gaz kanalında vakum - 15 mm su. Sanat.
Barometrik basınç 760 mm Hg. Sanat.
Tanımlamak:
baca gazlarının görünür moleküler ağırlığı;
baca gazı gaz sabiti;
baca gazlarını oluşturan münferit bileşenlerin ağırlık (kütle) fraksiyonları;
bileşenlerin kısmi basınçları:
saatlik hava akışı
Gaz tarafından verilen tüm ısının hava tarafından alındığını varsayalım.
Isı kapasitesinin sıcaklığa bağımlılığı eğrisel olarak kabul edilir.
1. Baca gazlarının görünür moleküler ağırlığı
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Baca gazı gaz sabiti
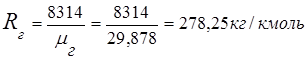
3. kütle kesirleri gaz bileşenleri
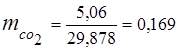
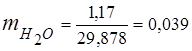
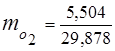
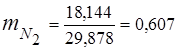
4. Bileşenlerin kısmi basınçları
Hesaplamanın sonuçları tabloya girilecektir.
|
Seçenekler |
gaz karışımı |
|||
|
|
||||
|
|
||||
|
|
5. Saatlik hava tüketimi
Hava tüketimi, hava ısıtıcısının ısı dengesi denkleminden belirlenir.
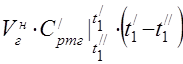
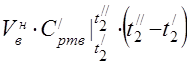
450 °C'de ortalama molar ısı kapasitesi
0 ... 450 ° C sıcaklık aralığında bileşenlerin ortalama özgül ısı kapasitesi.













 .
(1.28)
.
(1.28)