Ideal gaz. İdeal gazların moleküler kinetik teorisi
Moleküler kinetik teori, olarak adlandırılan özel bir ideal nesnenin davranışını ve özelliklerini tanımlar. Ideal gaz. Bu fiziksel model, maddenin moleküler yapısına dayanmaktadır. Moleküler teorinin yaratılması, R. Clausius, J. Maxwell, D. Joule ve L. Boltzmann'ın çalışmalarıyla ilişkilidir.
Ideal gaz. İdeal gazın moleküler kinetik teorisi aşağıdaki varsayımlar üzerine inşa edilmiştir:
atomlar ve moleküller şu şekilde görülebilir: maddi noktalar sürekli hareket halinde olan;
gaz moleküllerinin gerçek hacmi, kabın hacmine kıyasla ihmal edilebilir düzeydedir;
tüm atomlar ve moleküller ayırt edilebilir, yani ilke olarak her parçacığın hareketini takip etmek mümkündür;
gaz moleküllerinin aralarındaki çarpışmasından önce, etkileşim kuvvetleri yoktur ve moleküllerin kendi aralarında ve kabın duvarlarıyla çarpışmalarının kesinlikle elastik olduğu varsayılır;
Bir gazın her bir atomunun veya molekülünün hareketi, klasik mekanik yasalarıyla tanımlanır.
İdeal bir gaz için elde edilen yasalar, gerçek gazların incelenmesinde kullanılabilir. Bunun için, gerçek bir gazın özelliklerinin ideal bir gazınkine yakın olduğu (örneğin, düşük basınçlarda ve yüksek sıcaklıklarda) ideal bir gazın deneysel modelleri oluşturulur.
İdeal gaz kanunları
Boyle-Mariotte yasası:
sabit bir sıcaklıkta belirli bir gaz kütlesi için, gaz basıncının ve hacminin ürünü sabit bir değerdir: pV = sabit , (1.1)
de T = sabit , m = sabit .
Miktarlar arasındaki ilişkiyi gösteren eğri R ve V, bir maddenin özelliklerini sabit bir sıcaklıkta karakterize eder ve denir izoterm bu bir hiperboldür (Şekil 1.1.) ve sabit bir sıcaklıkta ilerleyen sürece izotermal denir.
Gay-Lussac kanunları:
Belirli bir gaz kütlesinin sabit basınçta hacmi sıcaklıkla doğrusal olarak değişir
V = V 0 (1 + t ) de P = sabit , m = sabit . (1.2)

p = p 0 (1 + t ) de V = sabit , m = sabit . (1.3)
(1.2) ve (1.3) denklemlerinde, sıcaklık Santigrat ölçeğinde, basınç ve hacim - de ifade edilir.
0 С iken
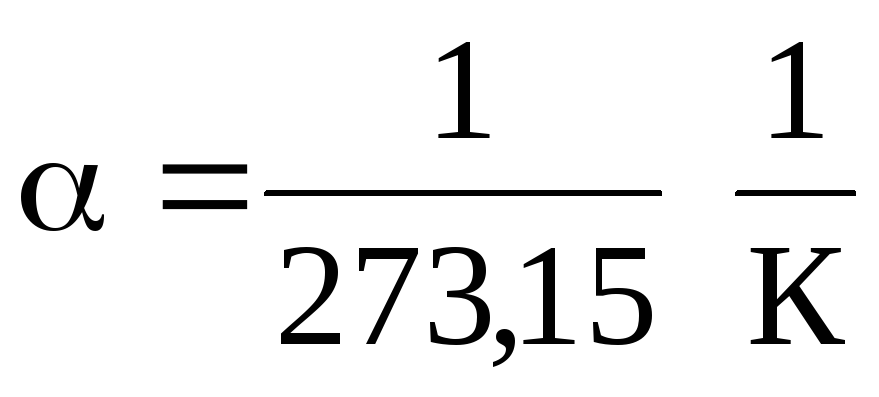 .
.
Sabit basınçta gerçekleşen bir sürece denir. izobarik, doğrusal bir fonksiyon olarak temsil edilebilir (Şekil 1.2.).
Sabit hacimde gerçekleşen bir sürece denir. izokorik(Şekil 1.3.).
Denklemler (1.2) ve (1.3)'ten, izobarların ve izokorların sıcaklık eksenini şu noktada kestiği sonucu çıkar: t =1/ \u003d - 273,15 С . Orijini bu noktaya taşırsak Kelvin ölçeğine geçeriz.
(1.2) ve (1.3) formüllerine giriş Termodinamik sıcaklık, Gay-Lussac kanunlarına daha uygun bir şekil verilebilir:
V = V 0 (1+t) = = V 0 = =V 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
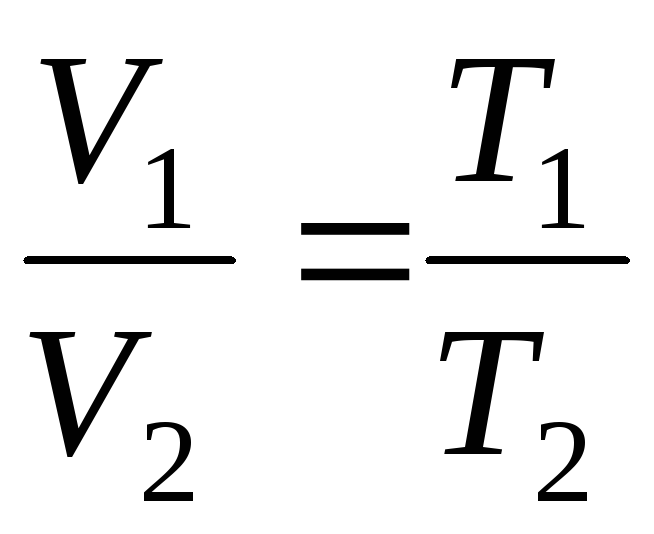 de
p=sabit, m=sabit
;
(1.4)
de
p=sabit, m=sabit
;
(1.4)
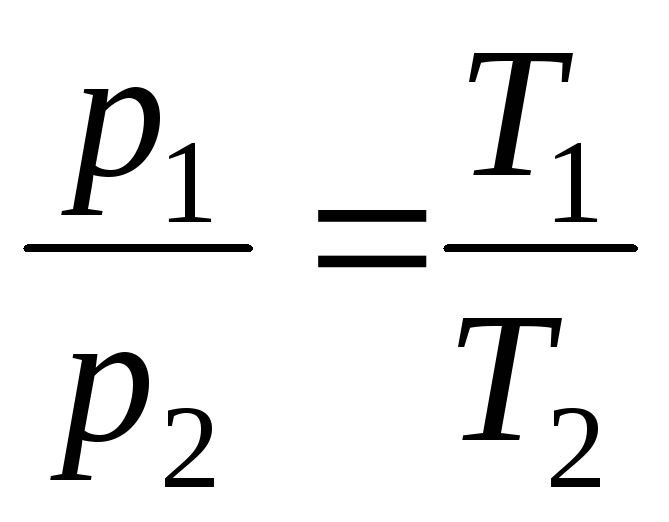 de V = sabit, m = sabit
,
(1.5)
de V = sabit, m = sabit
,
(1.5)
burada 1 ve 2 indisleri, aynı izobar veya izokorda bulunan keyfi durumları ifade eder. .
Avogadro yasası:
Aynı sıcaklık ve basınçtaki herhangi bir gazın molleri aynı hacimleri kaplar.
Normal koşullar altında, bu hacim şuna eşittir: V,0 \u003d 22.4110 -3 m3 / mol . Tanım olarak, bir mol çeşitli maddeler eşit sayıda molekül içerir sabit Avogadro:N A = 6,02210 23 mol -1 .
Dalton Yasası:
karışım basıncı ideal gazlar kısmi basınçların toplamına eşittir R 1 , R 2 , R 3 … R n, içerdiği gazlar:
p = p 1 + p 2 + R 3 + …+ p n .
Kısmi basıncı – BT Bileşimdeki gazın üreteceği basınç gaz karışımı tek başına aynı sıcaklıkta karışımın hacmine eşit bir hacim kaplıyorsa.
İdeal gaz hal denklemi
(Clapeyron-Mendeleev denklemi)
Sıcaklık, hacim ve basınç arasında kesin bir ilişki vardır. Bu ilişki işlevsel bir bağımlılıkla temsil edilebilir:
f(p, V, T)= 0.
Buna karşılık, değişkenlerin her biri ( p, v, t) diğer iki değişkenin bir fonksiyonudur. Bir maddenin (katı, sıvı, gaz) her bir faz durumu için işlevsel bağımlılığın türü deneysel olarak bulunur. Bu çok zahmetli bir süreçtir ve hal denklemi sadece seyreltilmiş gazlar için ve bazı sıkıştırılmış gazlar için yaklaşık olarak oluşturulmuştur. Gaz halinde olmayan maddeler için bu sorun henüz çözülmemiştir.
Fransız fizikçi B. Clapeyron getirdi ideal gaz hal denklemi, Boyle-Mariotte, Gay-Lussac, Charles yasalarını birleştirerek:
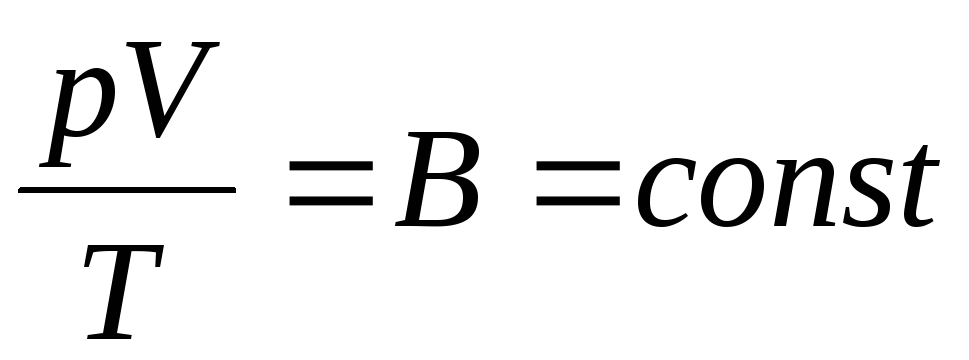 . (1.6)
. (1.6)
İfade (1.6), Clapeyron denklemidir, burada AT gaz sabitidir. Farklı gazlar için farklıdır.
DI. Mendeleev, Clapeyron denklemini Avogadro yasasıyla birleştirerek denklem (1.6)'yı bir mol'e atıfta bulundu ve molar hacmi kullandı. V . Avogadro yasasına göre aynı R ve T tüm gazların molleri aynı molar hacmi kaplar V .
.
Bu nedenle, sabit AT tüm ideal gazlar için aynı olacaktır. Bu sabit genellikle gösterilir R ve eşittir R=
8,31
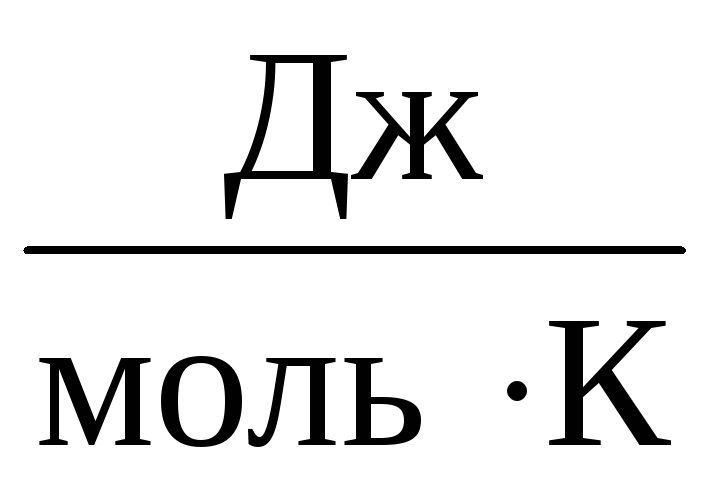 .
.
Clapeyron-Mendeleev denklemi aşağıdaki forma sahiptir:
p V . = RT.
Bir mol gaz için denklemden (1.7) şuna gidilebilir: keyfi bir gaz kütlesi için Clapeyron-Mendeleev denklemine:
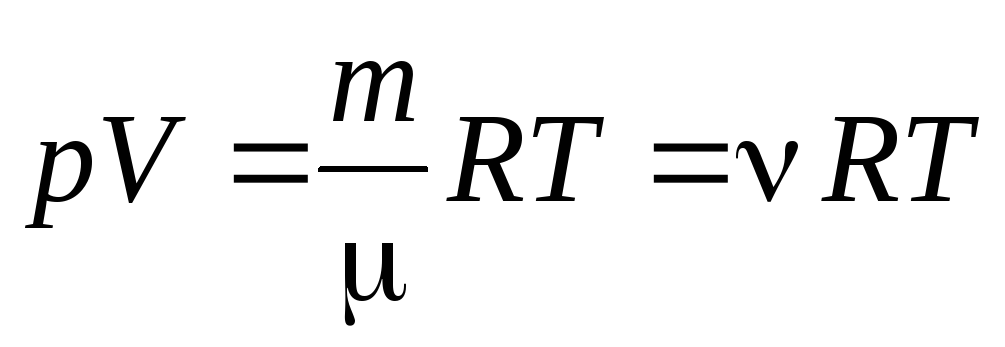 , (1.7)
, (1.7)
nerede
–
molar kütle
(bir mol maddenin kütlesi, kg/mol); m
gaz kütlesi;
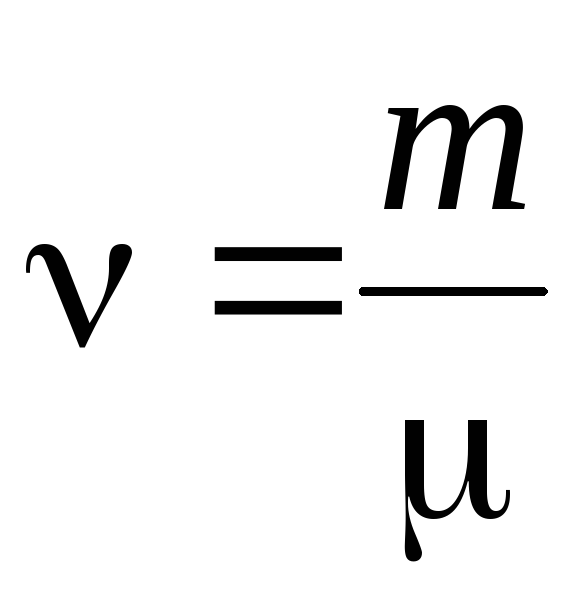 - madde miktarı .
- madde miktarı .
Daha sık olarak, ideal gaz durum denkleminin başka bir biçimi kullanılır ve Boltzmann sabiti: 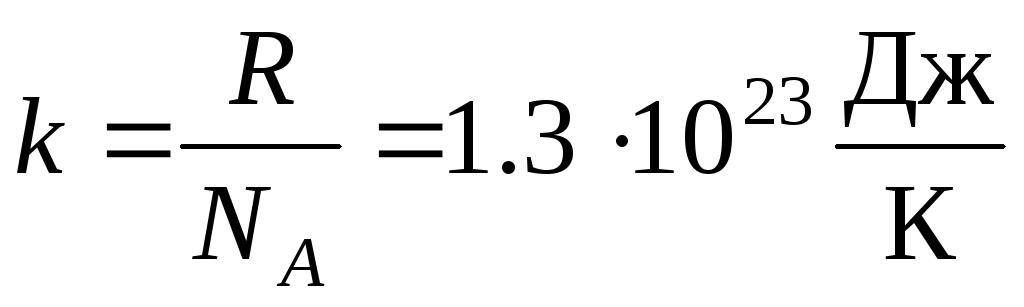 .
.
O zaman denklem (1.7) şöyle görünür:
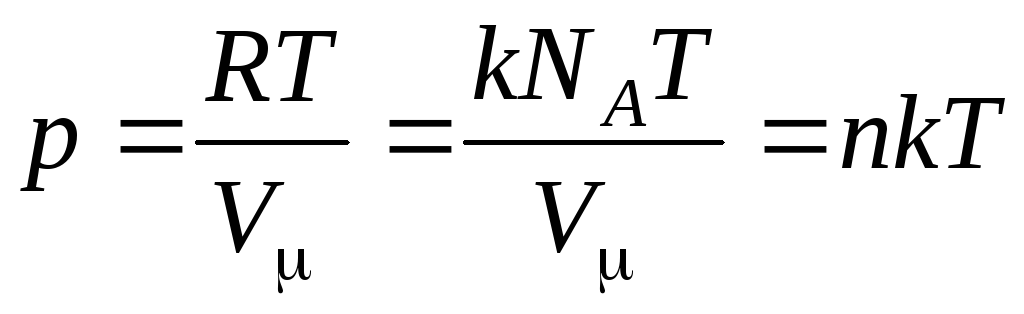 ,
(1.8)
,
(1.8)
nerede
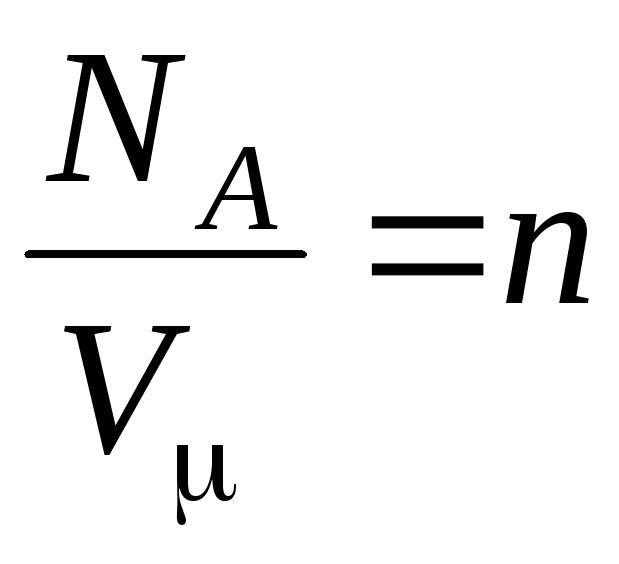 –
molekül konsantrasyonu (birim hacimdeki molekül sayısı). Bu ifadeden, ideal bir gazın basıncının, moleküllerinin konsantrasyonu veya gazın yoğunluğu ile doğru orantılı olduğu sonucu çıkar. Aynı sıcaklık ve basınçlarda, tüm gazlar birim hacim başına aynı sayıda molekül içerir. Normal şartlar altında 1 m3'te bulunan molekül sayısına denir.
Loschmidt numarası:
–
molekül konsantrasyonu (birim hacimdeki molekül sayısı). Bu ifadeden, ideal bir gazın basıncının, moleküllerinin konsantrasyonu veya gazın yoğunluğu ile doğru orantılı olduğu sonucu çıkar. Aynı sıcaklık ve basınçlarda, tüm gazlar birim hacim başına aynı sayıda molekül içerir. Normal şartlar altında 1 m3'te bulunan molekül sayısına denir.
Loschmidt numarası:
N L = 2,68 10 25 m -3.
Moleküler kinetiğin temel denklemi
ideal gazlar teorisi
en önemli görev Gazların kinetik teorisi, ideal bir gazın basıncının teorik olarak hesaplanmasıdır. moleküler kinetik kavramlara dayalıdır. İdeal gazların moleküler kinetik teorisinin temel denklemi şu şekilde elde edilir: istatistiksel yöntemler.
Gaz moleküllerinin rastgele hareket ettiği, gaz molekülleri arasındaki karşılıklı çarpışma sayısının, kabın duvarlarına çarpma sayısına kıyasla önemsiz olduğu ve bu çarpışmaların kesinlikle esnek olduğu varsayılmıştır. Geminin duvarında, bazı temel alan S ve gaz moleküllerinin bu alana uygulayacağı basıncı hesaplayınız.
Gerçekte moleküllerin bölgeye farklı açılardan hareket edebileceği ve sahip olabileceği gerçeğini hesaba katmak gerekir. çeşitli hızlar, ayrıca her çarpışmada değişebilen. Teorik hesaplamalarda, moleküllerin kaotik hareketi idealize edilir, bunların yerini karşılıklı olarak üç dikey yöndeki hareket alır.
Küp şeklindeki bir kabı ele alırsak, N altı yönde gaz molekülleri, herhangi bir anda tüm moleküllerin sayısının 1/3'ünün her biri boyunca hareket ettiğini ve yarısının (yani, tüm moleküllerin sayısının 1/6'sı) hareket ettiğini görmek kolaydır. bir yön ve ikinci yarı (ayrıca 1/6) - ters yönde. Her çarpışmada, bölgeye dik hareket eden, yansıtan tek bir molekül momentumu ona aktarırken, momentumu (momentumu) miktara göre değişir.
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Alan üzerinde belirli bir yönde hareket eden moleküllerin çarpma sayısı şuna eşit olacaktır: N = 1/6 n Svt. Platformla çarpışırken, bu moleküller platforma momentum aktaracak.
P= N P 1 =2 m 0 vnSvt= m 0 v 2 nSt,
nerede n moleküllerin konsantrasyonudur. Ardından, gazın kabın duvarına uyguladığı basınç şuna eşit olacaktır:
p = 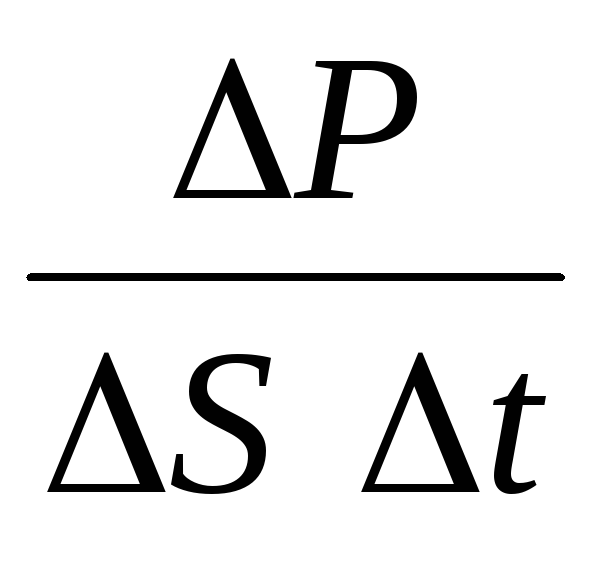 =
nm 0
v 2
.
(1.9)
=
nm 0
v 2
.
(1.9)
Bununla birlikte, gaz molekülleri farklı hızlarda hareket eder: v 1 , v 2 , …,v n, bu nedenle hızların ortalaması alınmalıdır. Gaz moleküllerinin hızlarının karelerinin toplamı, sayılarına bölünerek, ortalama karekök hızını belirler:
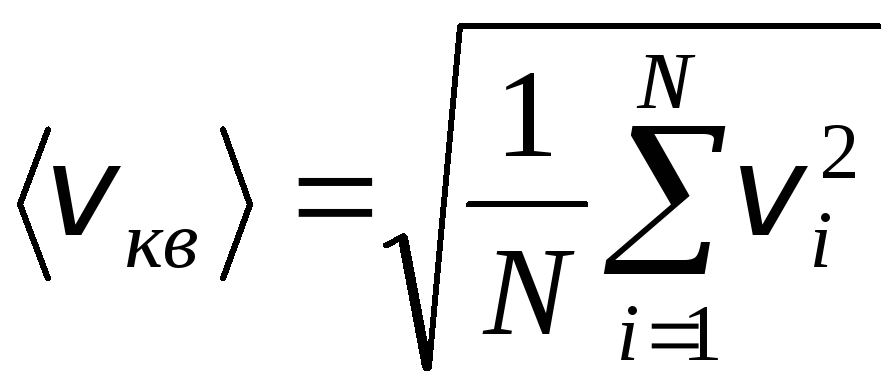 .
.
Denklem (1.9) şekli alacaktır:
![]() (1.10)
(1.10)
ifade (1.10) denir moleküler kinetik teorisinin temel denklemi ideal gazlar.
Verilen 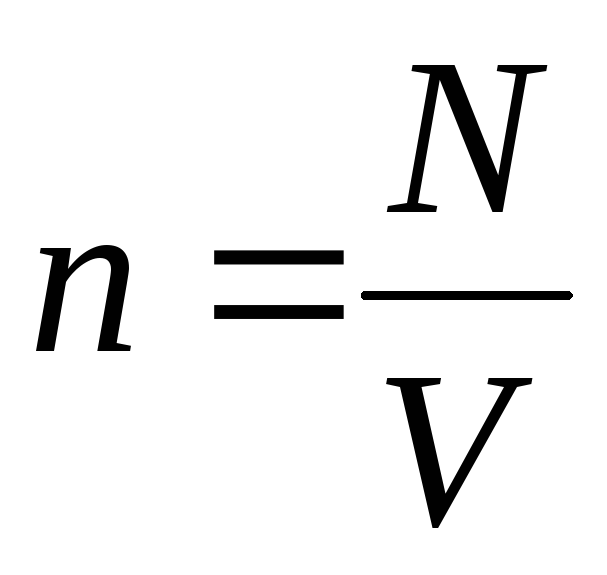 , şunu elde ederiz:
, şunu elde ederiz:
p V = N 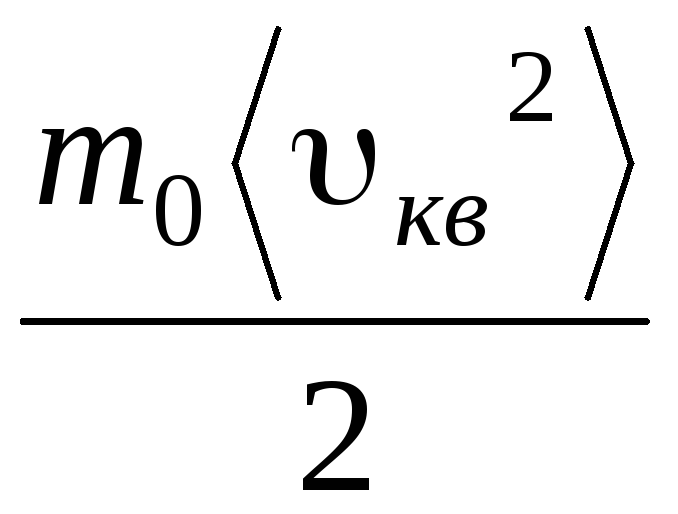 = E,
(1.11)
= E,
(1.11)
nerede e tüm gaz moleküllerinin öteleme hareketinin toplam kinetik enerjisidir. Bu nedenle, gaz basıncı, gaz moleküllerinin öteleme hareketinin kinetik enerjisi ile doğru orantılıdır.
Bir mol gaz için m = ve Clapeyron-Mendeleev denklemi aşağıdaki forma sahiptir:
s V . = RT,
ve (1.11)'den şu sonuç çıktığı için s V . = v metrekare 2 , şunu elde ederiz:
R.T.= v metrekare 2 .
Bu nedenle, gaz moleküllerinin ortalama karekök hızı eşittir
v
metrekare
=
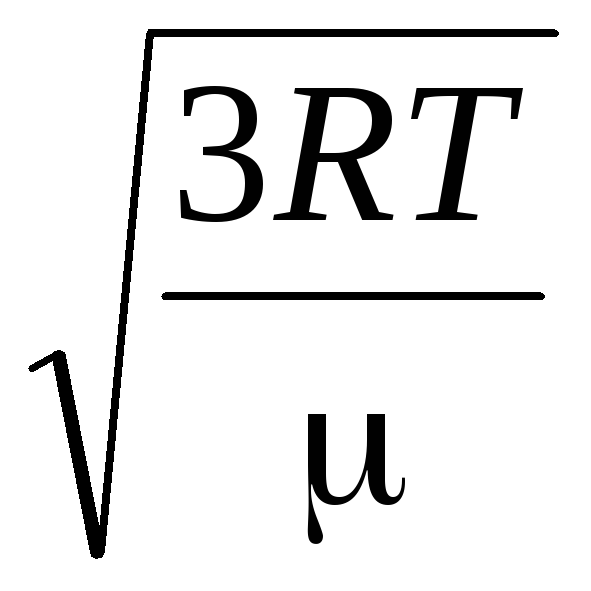 =
=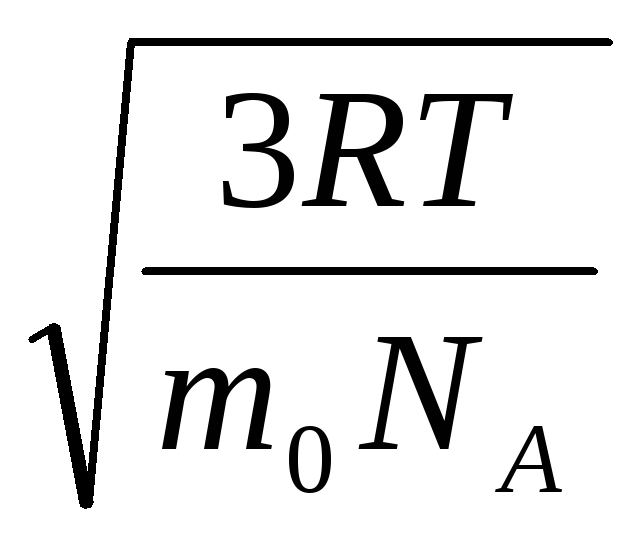 =
= ,
,
nerede k = R/N A = 1,3810 -23 J/K – Boltzmann sabiti. Buradan oksijen moleküllerinin oda sıcaklığında ortalama kare hızını bulabilirsiniz - 480 m/s, hidrojen - 1900 m/s.
Sıcaklığın moleküler kinetik anlamı
Sıcaklık, bir cismin ne kadar sıcak olduğunun kantitatif bir ölçüsüdür. Mutlak termodinamik sıcaklığın fiziksel anlamını netleştirmek için T Gazların moleküler kinetik teorisinin (1.14) temel denklemini Clapeyron-Mendeleev denklemiyle karşılaştıralım p V = R.T.
Bu denklemlerin doğru kısımlarını eşitleyerek, bir molekülün ortalama kinetik enerjisi 0 değerini buluruz ( = N/N A , k=R/N A):
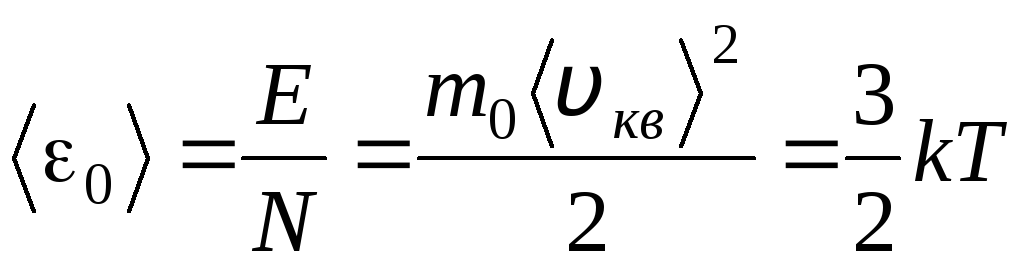 .
.
Moleküler kinetik teorisinin en önemli sonucu bu denklemden çıkar: ideal bir gazın bir molekülünün öteleme hareketinin ortalama kinetik enerjisi yalnızca sıcaklığa bağlıdır, oysa termodinamik sıcaklıkla doğru orantılıdır. Böylece, termodinamik sıcaklık ölçeği doğrudan fiziksel bir anlam kazanır: T= 0 ideal gaz moleküllerinin kinetik enerjisi sıfırdır. Bu nedenle, bu teoriye dayanarak, gaz moleküllerinin öteleme hareketi duracak ve basıncı sıfıra eşit olacaktır.
İdeal bir gazın denge özelliklerinin teorisi
Moleküllerin serbestlik derecesi sayısı. İdeal gazların moleküler kinetik teorisi çok önemli bir sonuca yol açar: gaz molekülleri rastgele hareket eder ve molekülün öteleme hareketinin ortalama kinetik enerjisi yalnızca sıcaklık tarafından belirlenir.
Moleküler hareketin kinetik enerjisi, kinetik tarafından tüketilmez. ileri hareket enerjisi: ayrıca kinetikten oluşur enerjiler rotasyon ve dalgalanmalar moleküller. Tüm moleküler hareket türlerine giren enerjiyi hesaplamak için, serbestlik derecesi sayısı.
Altında serbestlik derecesi sayısı (i) vücudun ima edilir cismin uzaydaki konumunu belirlemek için girilmesi gereken bağımsız koordinatların sayısı.
H  Örneğin, uzaydaki konumu üç koordinat tarafından belirlendiğinden, bir malzeme noktasının üç serbestlik derecesi vardır: x, y ve z. Bu nedenle, tek atomlu bir molekülün üç dereceli öteleme hareketi serbestliği vardır.
Örneğin, uzaydaki konumu üç koordinat tarafından belirlendiğinden, bir malzeme noktasının üç serbestlik derecesi vardır: x, y ve z. Bu nedenle, tek atomlu bir molekülün üç dereceli öteleme hareketi serbestliği vardır.
D  buchatomik bir molekülün 5 serbestlik derecesi vardır (Şekil 1.4): 3 derece öteleme hareketi ve 2 derece dönme hareketi serbestliği.
buchatomik bir molekülün 5 serbestlik derecesi vardır (Şekil 1.4): 3 derece öteleme hareketi ve 2 derece dönme hareketi serbestliği.
Üç veya daha fazla atomdan oluşan moleküller 6 serbestlik derecesine sahiptir: 3 derece öteleme hareketi serbestliği ve 3 derece dönme hareketi serbestliği (Şekil 1.5).
Her gaz molekülü, üçü öteleme hareketine karşılık gelen belirli sayıda serbestlik derecesine sahiptir.
Enerjinin eşit dağılımına ilişkin yönetmelik
serbestlik derecesine göre
Gazların moleküler kinetik teorisinin temel önermesi, moleküllerin hareketinde tam bir rastgelelik varsayımıdır. Bu hem salınım hem de dönme hareketleri için geçerlidir ve sadece öteleme için geçerli değildir. Bir gazdaki moleküllerin tüm hareket yönlerinin eşit derecede olası olduğu varsayılır. Bu nedenle, bir molekülün her bir serbestlik derecesi için ortalama olarak aynı miktarda enerji olduğu varsayılabilir - bu, enerjinin serbestlik dereceleri üzerinden eş-bölüşümüne ilişkin konumdur. Bir molekülün bir serbestlik derecesi başına düşen enerjisi:
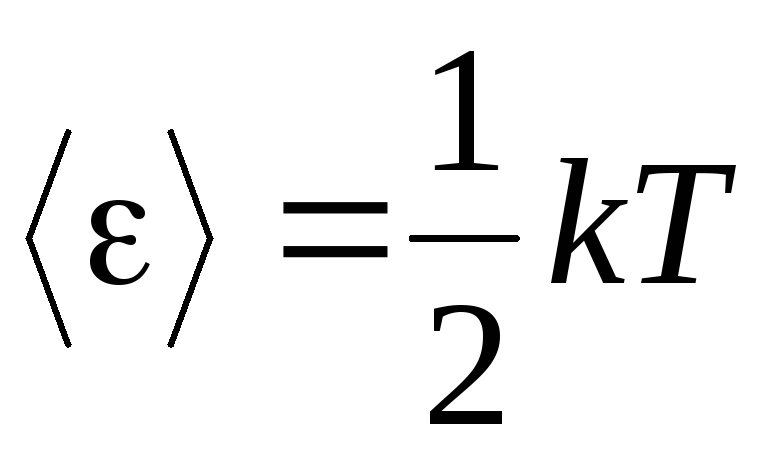 . (1.12)
. (1.12)
Molekül varsa i serbestlik dereceleri, o zaman her bir serbestlik derecesi için ortalama olarak:
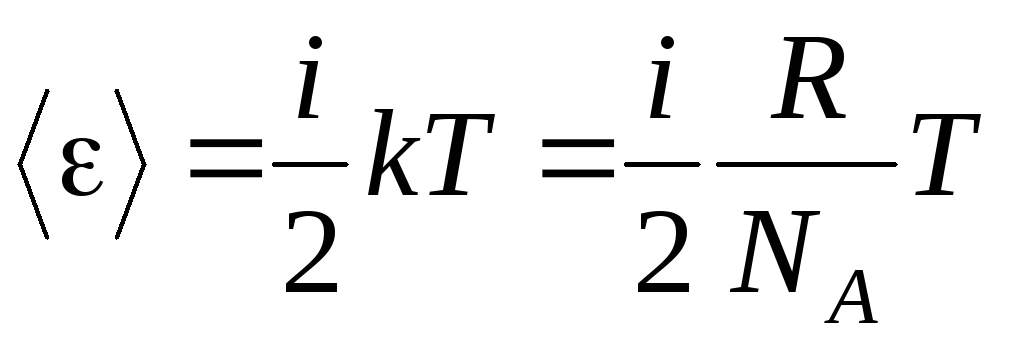 .
(1.13)
.
(1.13)
İdeal bir gazın iç enerjisi
Gazın toplam iç enerjisi arzını bir mol'e bağlarsak, değerini 'yı Avogadro sayısıyla çarparak elde ederiz:
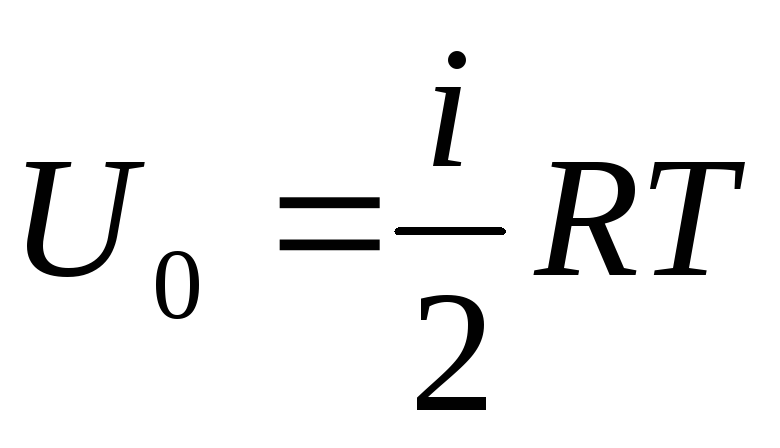 .
(1.14)
.
(1.14)
Bir mol ideal gazın iç enerjisinin yalnızca gaz moleküllerinin sıcaklığına ve serbestlik derecelerinin sayısına bağlı olduğu sonucu çıkar.
Maxwell ve Boltzmann dağılımları
İdeal bir gazın moleküllerinin termal hareketin hızları ve enerjileri cinsinden dağılımı (Maxwell dağılımı). Sabit bir gaz sıcaklığında, moleküler hareketin tüm yönlerinin eşit derecede olası olduğu varsayılır. Bu durumda, her molekülün ortalama karekök hızı sabit kalır ve şuna eşittir:
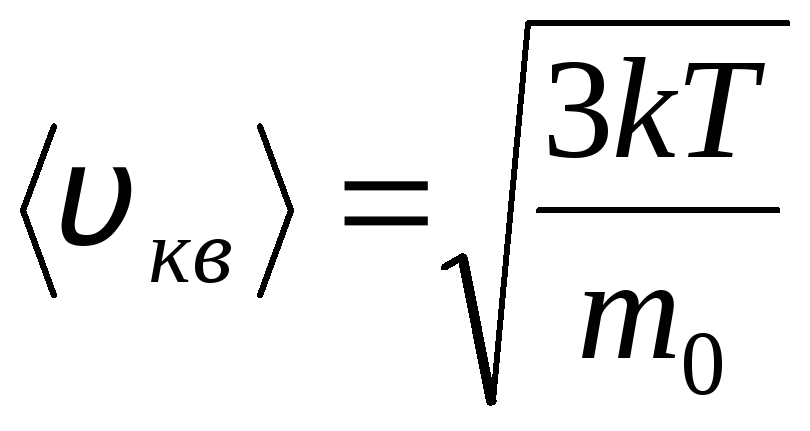 .
.
Bu, denge halindeki ideal bir gazda, moleküllerin zamanla değişmeyen belirli bir durağan hız dağılımının kurulmasıyla açıklanır. bu dağılım, teorik olarak J. Maxwell tarafından türetilen belirli bir istatistiksel yasaya tabidir. Maxwell yasası fonksiyon tarafından tanımlanır
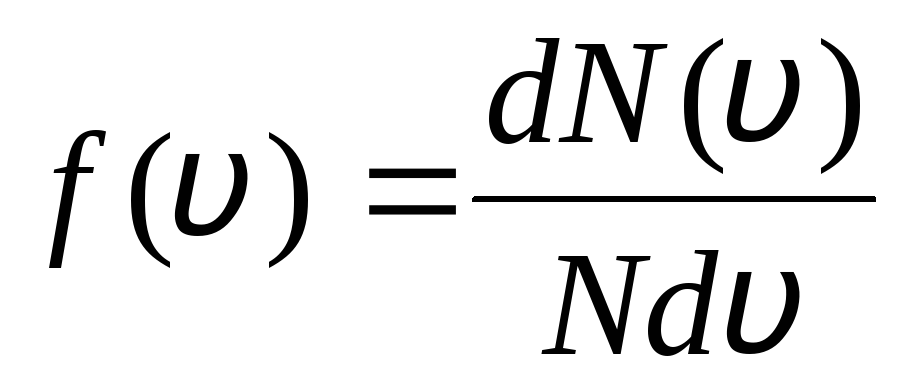 ,
,
işlev bu f(v) bağıl molekül sayısını belirler  hızları aralıkta olan v
önceki v+dv. Olasılık teorisi yöntemlerini uygulayan Maxwell, ideal bir gazın moleküllerinin hız cinsinden dağılım yasası:
hızları aralıkta olan v
önceki v+dv. Olasılık teorisi yöntemlerini uygulayan Maxwell, ideal bir gazın moleküllerinin hız cinsinden dağılım yasası:
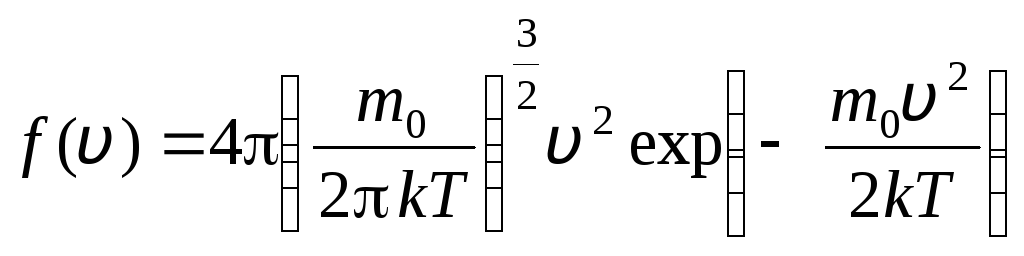 . (1.15)
. (1.15)
Dağılım fonksiyonu, şekil 2'de grafiksel olarak gösterilmiştir. 1.6. Dağılım eğrisi ve x ekseni tarafından sınırlanan alan bire eşittir. Bunun anlamı, işlevin f(v) normalleştirme koşulunu karşılar:
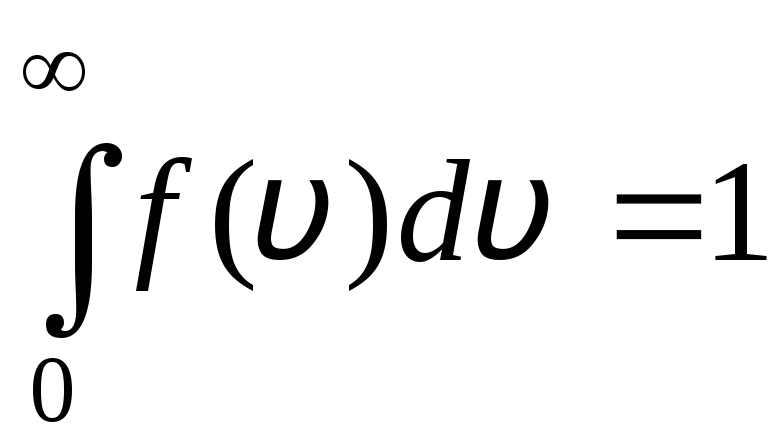 .
.
İle birlikte  hızlar açısından ideal gaz moleküllerinin dağılım fonksiyonunun olduğu hız f(v) maksimum, denir büyük ihtimalle
hız
v B .
hızlar açısından ideal gaz moleküllerinin dağılım fonksiyonunun olduğu hız f(v) maksimum, denir büyük ihtimalle
hız
v B .
Değerler v = 0 ve v = ifade minimumuna karşılık gelir (1.15). En olası hız, (1.23) ifadesinin türevi alınarak ve sıfıra eşitlenerek bulunabilir:
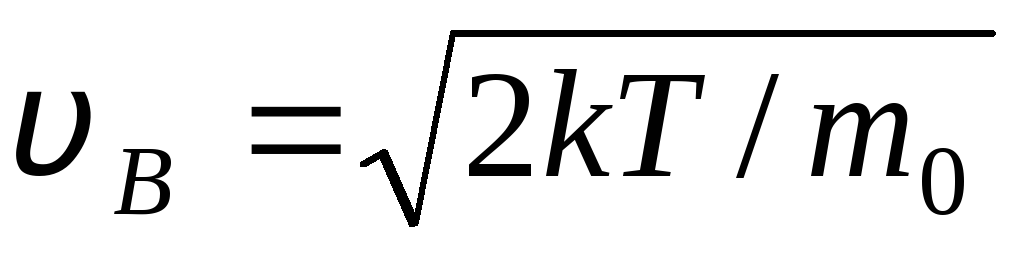 =
=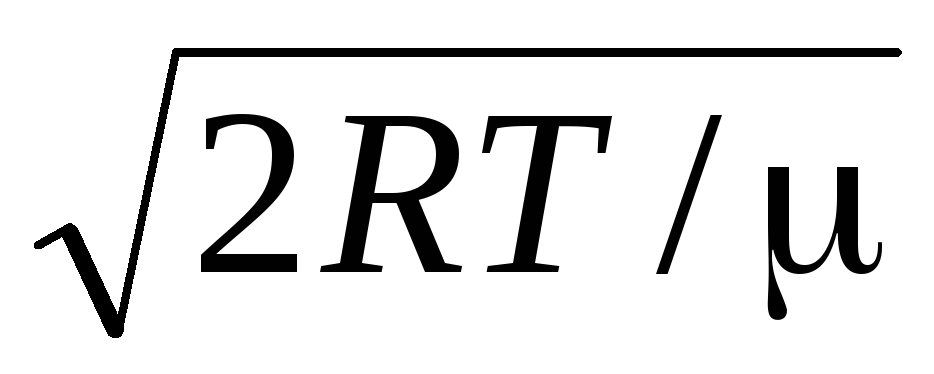 =
1,41
=
1,41
Sıcaklıktaki bir artışla, fonksiyonun maksimumu sağa kayar (Şekil 1.6), yani sıcaklıktaki bir artışla en olası hız da artar, ancak eğri tarafından sınırlanan alan değişmeden kalır. Gazlarda ve düşük sıcaklıklarda her zaman yüksek hızlarda hareket eden az sayıda molekül bulunduğuna dikkat edilmelidir. Bu tür "sıcak" moleküllerin varlığı, büyük önem birçok işlem sırasında.
Aritmetik ortalama hız moleküller formül tarafından belirlenir
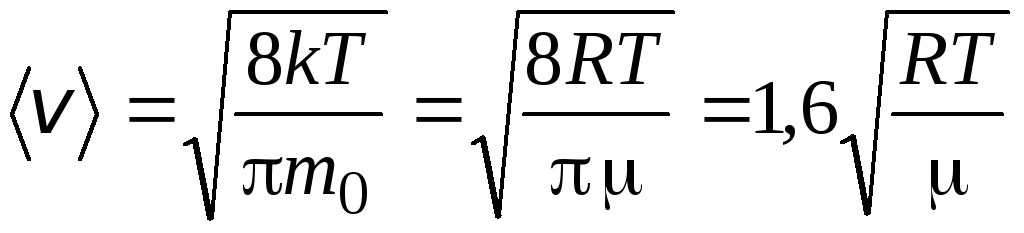 .
.
Kök ortalama kare hızı
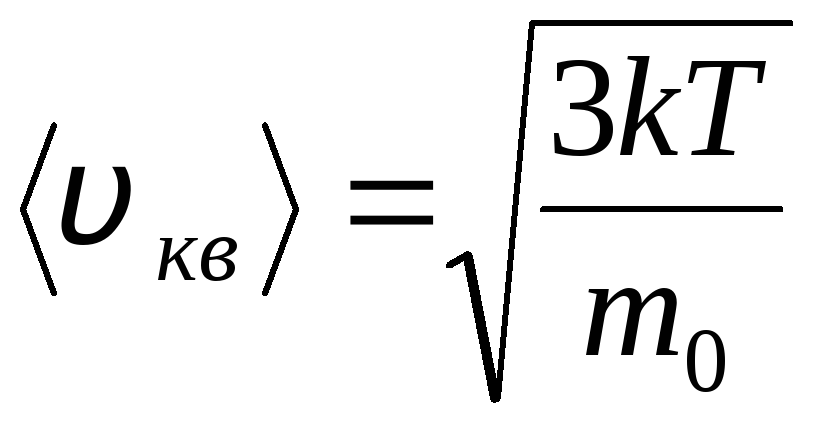 =
1,73
=
1,73 .
.
Bu hızların oranı sıcaklığa veya gazın türüne bağlı değildir.
Termal hareket enerjileri ile moleküllerin dağılım fonksiyonu. Bu fonksiyon, moleküllerin dağılım denkleminde (1.15) hız yerine kinetik enerjinin değerini değiştirerek elde edilebilir:
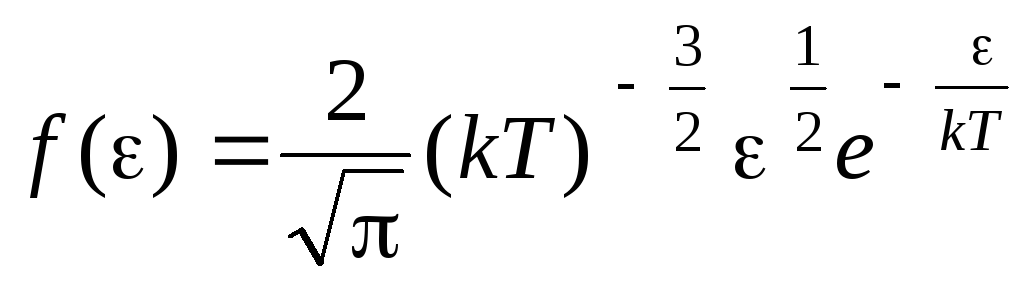 .
.
gelen enerji değerleri üzerinden ifadeyi entegre ederek  önceki
önceki 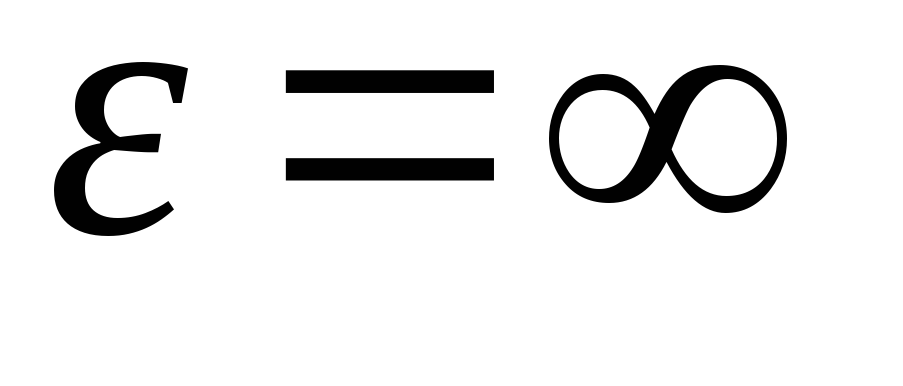
 , alırız ortalama kinetik enerji ideal gaz molekülleri:
, alırız ortalama kinetik enerji ideal gaz molekülleri:
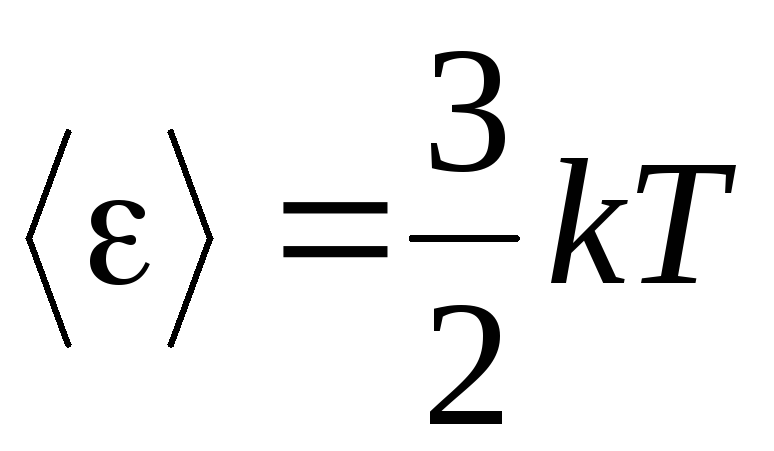 .
.
barometrik formül. Boltzmann dağılımı. Gazların moleküler kinetik teorisinin temel denklemini ve moleküllerin hızlara göre Maxwell dağılımını türetirken, ideal bir gazın moleküllerinin dış kuvvetlerden etkilenmediği, bu nedenle moleküllerin hacim boyunca düzgün bir şekilde dağıldığı varsayılmıştır. Bununla birlikte, herhangi bir gazın molekülleri Dünya'nın çekim alanı içindedir. Basıncın yüksekliğe bağımlılık yasasını türetirken, yerçekimi alanının tekdüze olduğu, sıcaklığın sabit olduğu ve tüm moleküllerin kütlesinin aynı olduğu varsayılır:
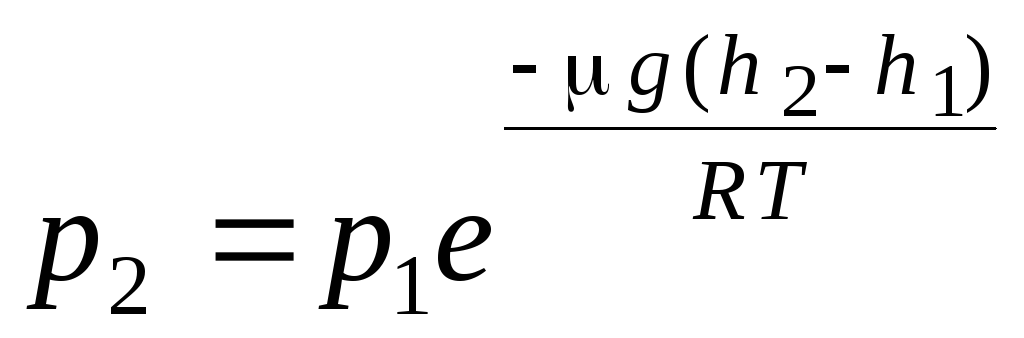 . (1.16)
. (1.16)
İfade (1.16) çağrılır barometrik formül. Yüksekliğe bağlı olarak atmosferik basıncı bulmanızı sağlar veya basıncı ölçerek yüksekliği bulabilirsiniz. Çünkü h 1 basıncın normal kabul edildiği deniz seviyesinden yüksekliktir, bu durumda ifade değiştirilebilir:
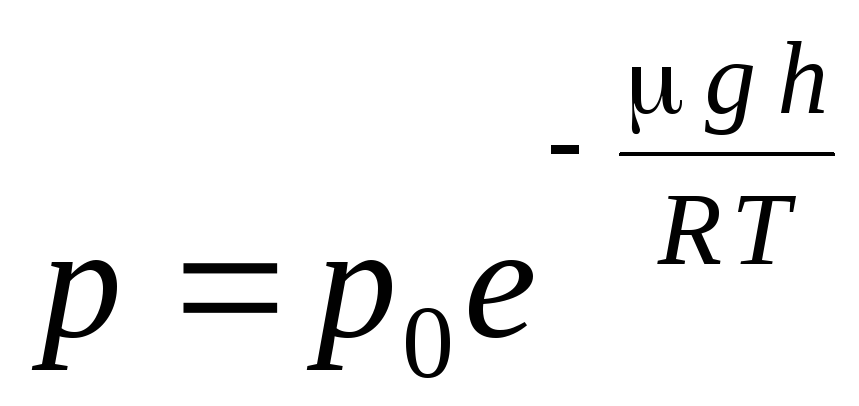 .
.
Barometrik formül, ifade kullanılarak dönüştürülebilir. p = nkT:
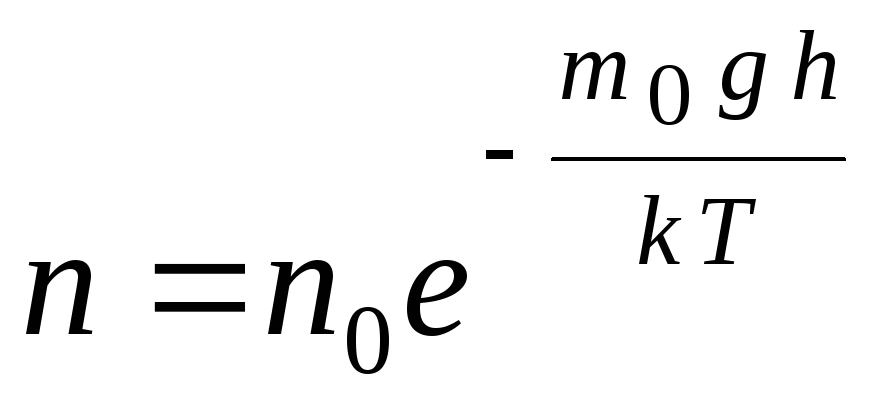 ,
,
G  de n
–
yükseklikte moleküllerin konsantrasyonu h,
m 0
gh=P–
yerçekimi alanındaki bir molekülün potansiyel enerjisi. Sabit sıcaklıkta, molekülün potansiyel enerjisinin düşük olduğu yerde gazın yoğunluğu daha fazladır. Grafiksel olarak, birim hacim başına parçacık sayısındaki yükseklikle azalma yasası Şekil 1'de gösterildiği gibi görünür. 1.7.
de n
–
yükseklikte moleküllerin konsantrasyonu h,
m 0
gh=P–
yerçekimi alanındaki bir molekülün potansiyel enerjisi. Sabit sıcaklıkta, molekülün potansiyel enerjisinin düşük olduğu yerde gazın yoğunluğu daha fazladır. Grafiksel olarak, birim hacim başına parçacık sayısındaki yükseklikle azalma yasası Şekil 1'de gösterildiği gibi görünür. 1.7.
Rastgele bir dış potansiyel alanı için aşağıdaki genel ifadeyi yazıyoruz.
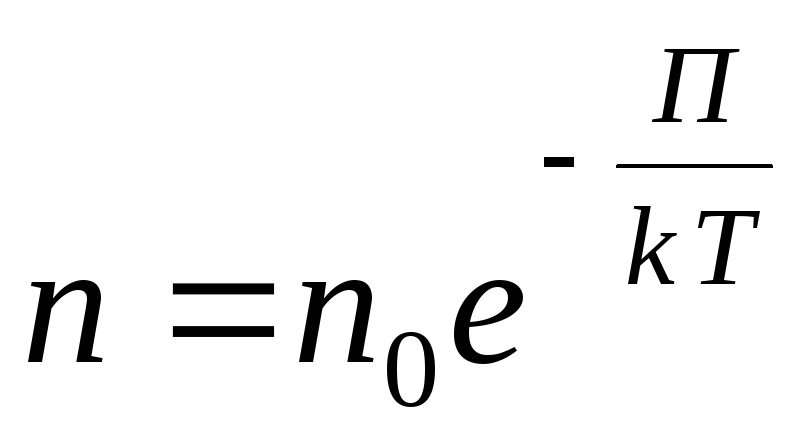 ,
,
Seyrekleştirilmiş bir gazda, moleküller arasındaki mesafe, boyutlarından birçok kez daha fazladır. Bu durumda, moleküller arasındaki etkileşim önemsizdir ve moleküllerin kinetik enerjisi, etkileşimlerinin potansiyel enerjisinden çok daha fazladır.
Bir maddenin özelliklerini gerçek bir gaz yerine gaz halinde açıklamak için fiziksel modeli kullanılır - ideal bir gaz. Model şunları varsayar:
moleküller arasındaki mesafe çaplarından biraz daha büyüktür;
moleküller elastik toplardır;
moleküller arasında çekici kuvvet yoktur;
moleküller birbirleriyle ve kabın duvarlarıyla çarpıştığında itici kuvvetler etki eder;
Moleküler hareket mekanik yasalarına uyar.
İdeal bir gaz mkt için temel denklem:
MKT'nin temel denklemi, molekülün kütlesi, hızın karesinin ortalama değeri ve moleküllerin konsantrasyonu biliniyorsa, bir gazın basıncını hesaplamayı mümkün kılar.
ideal gaz basıncı kabın duvarlarıyla çarpışan moleküllerin, elastik cisimler olarak mekanik yasalarına göre onlarla etkileşime girmesi gerçeğinde yatmaktadır. Bir molekül kabın duvarıyla çarpıştığında, hız vektörünün v x hızının OX ekseni üzerindeki duvara dik izdüşümü, işaretini tersine değiştirir, ancak mutlak değerde sabit kalır. Bu nedenle, bir molekülün bir duvarla çarpışması sonucunda, momentumunun OX ekseni üzerindeki izdüşümü mv 1x = -mv x'ten mv 2x =mv x'e değişir. Bir duvarla çarpışma üzerine bir molekülün momentumundaki bir değişiklik, duvarın yanından ona etki eden bir F 1 kuvvetine neden olur. Bir molekülün momentumundaki değişim, bu kuvvetin momentumuna eşittir:
Çarpışma sırasında, Newton'un üçüncü yasasına göre, molekül, F 1 kuvvetine mutlak değer olarak eşit ve zıt yönlü bir F 2 kuvveti ile duvara etki eder.
Pek çok molekül vardır ve her biri çarpışma anında duvara aynı momentumu verir. Bir saniyede bir dürtü iletirler 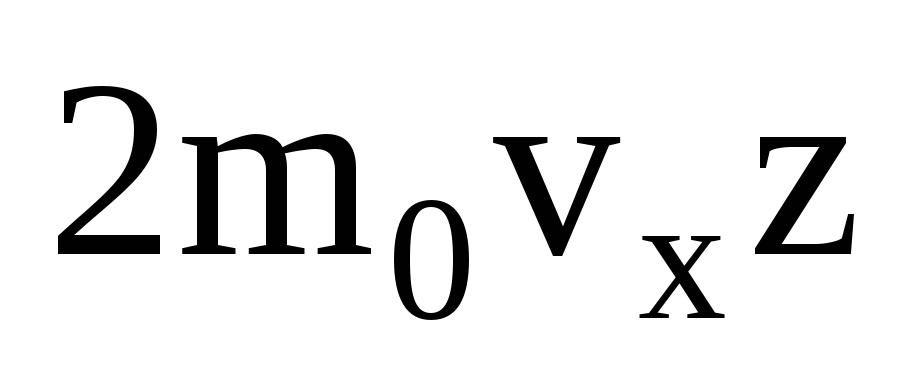 , burada z, gazdaki moleküllerin konsantrasyonu, moleküllerin hızı ve duvarın yüzey alanı ile orantılı olan tüm moleküllerin duvarla çarpışma sayısıdır:
, burada z, gazdaki moleküllerin konsantrasyonu, moleküllerin hızı ve duvarın yüzey alanı ile orantılı olan tüm moleküllerin duvarla çarpışma sayısıdır: 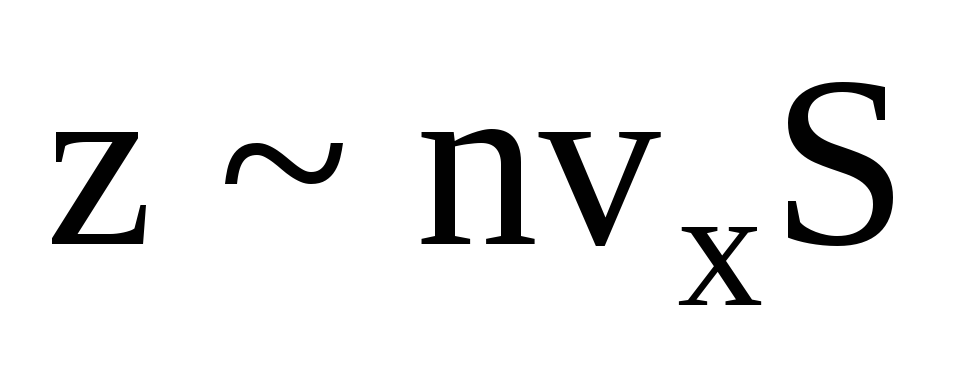 . Moleküllerin sadece yarısı duvara doğru hareket eder, geri kalanı ters yönde hareket eder:
. Moleküllerin sadece yarısı duvara doğru hareket eder, geri kalanı ters yönde hareket eder: 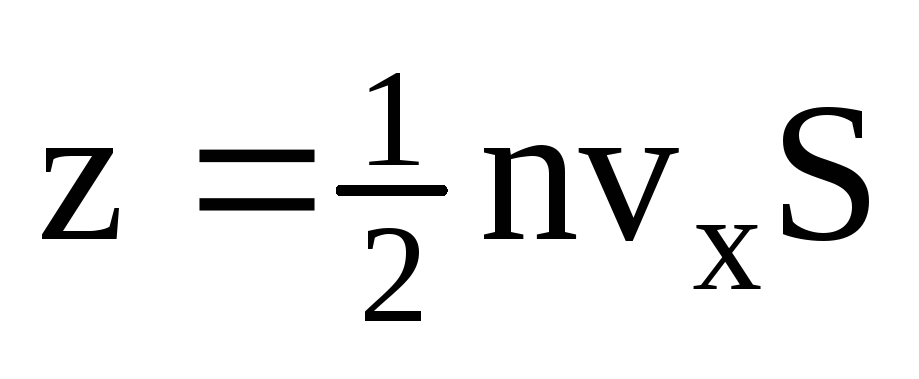 . Ardından 1 saniyede duvara aktarılan toplam momentum:
. Ardından 1 saniyede duvara aktarılan toplam momentum: 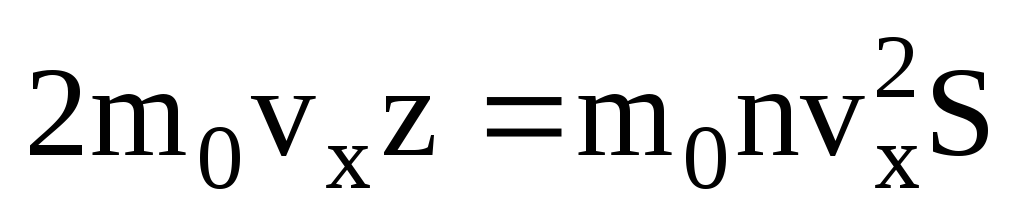 . Newton'un ikinci yasasına göre, bir cismin birim zamanda momentumundaki değişim ona etki eden kuvvete eşittir:
. Newton'un ikinci yasasına göre, bir cismin birim zamanda momentumundaki değişim ona etki eden kuvvete eşittir:
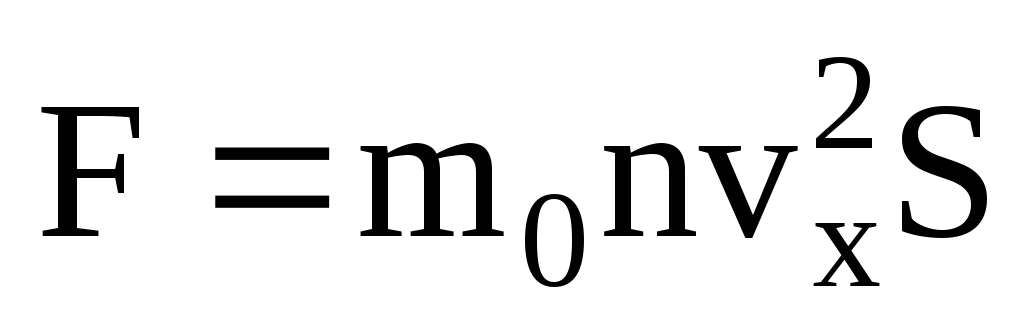
Tüm moleküllerin aynı hıza sahip olmadığı göz önüne alındığında, duvara etki eden kuvvet, hızın ortalama karesiyle orantılı olacaktır. Moleküller her yöne hareket ettiğinden, hız izdüşümlerinin karelerinin ortalama değerleri eşittir. Bu nedenle, hız projeksiyonunun ortalama karesi: 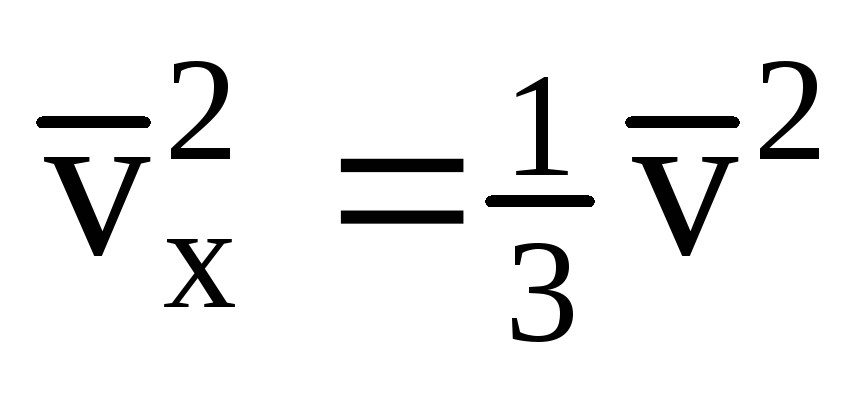 ;
;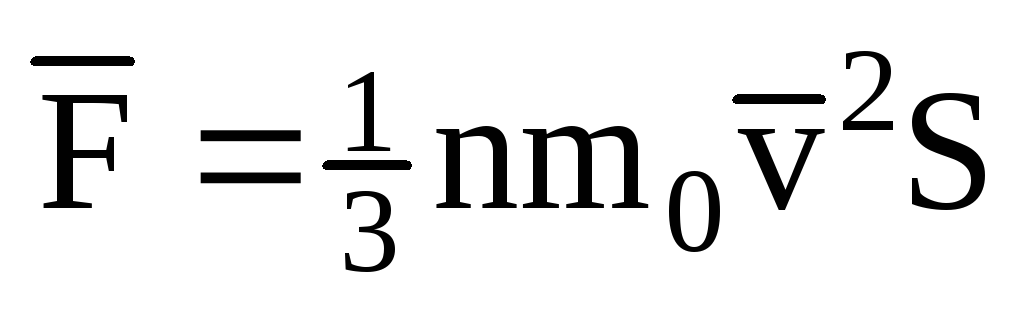 . O zaman kabın duvarındaki gazın basıncı:
. O zaman kabın duvarındaki gazın basıncı:
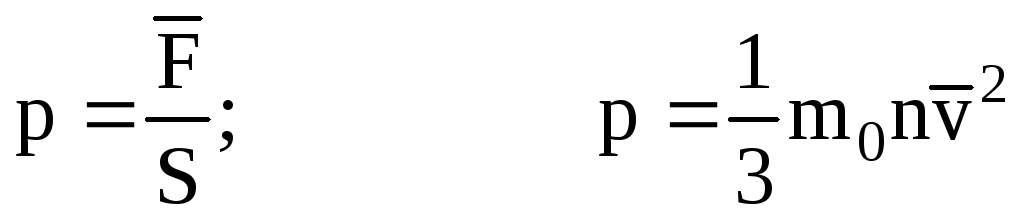 - MKT'nin temel denklemi.
- MKT'nin temel denklemi.
İdeal gaz moleküllerinin öteleme hareketinin kinetik enerjisinin ortalama değerini belirtmek:
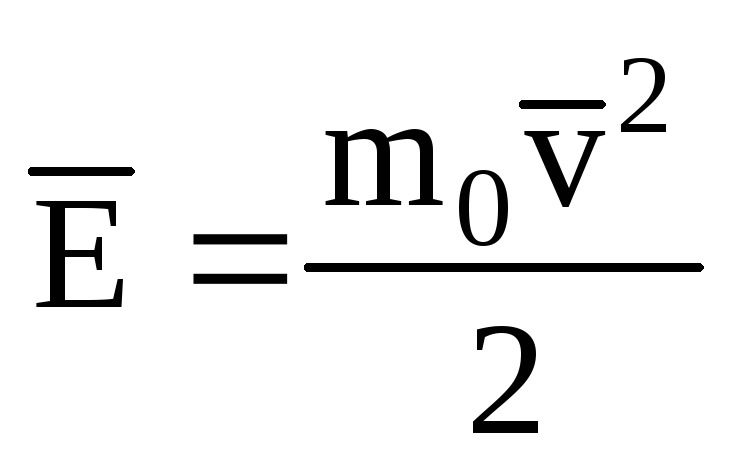 , alırız
, alırız
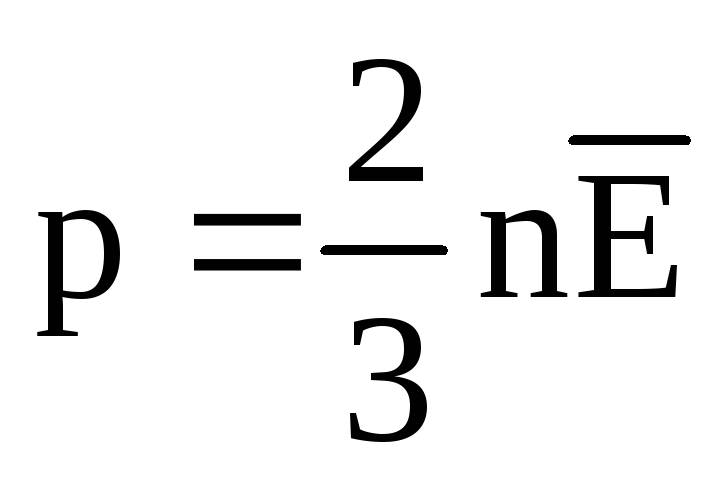
Sıcaklık ve ölçümü:
İdeal bir gaz için temel MKT denklemi, kolayca ölçülebilen makroskobik bir parametreyi (basınç) ortalama kinetik enerji ve moleküllerin konsantrasyonu gibi mikroskobik gaz parametreleriyle ilişkilendirir. Ancak, yalnızca basıncı ölçtüğümüzde, ne moleküllerin kinetik enerjisinin ortalama değerini ayrı ayrı ne de konsantrasyonlarını bulamıyoruz. Bu nedenle, gazın mikroskobik parametrelerini bulmak için, moleküllerin ortalama kinetik enerjisiyle ilgili başka bazı fiziksel niceliklerin ölçümlerine ihtiyaç vardır. Bu değer hava sıcaklığı.
Herhangi bir makroskobik cisim veya makroskobik cisimler grubu, sabit dış koşullar altında kendiliğinden bir termal denge durumuna geçer. Termal denge - bu, tüm makroskobik parametrelerin keyfi olarak uzun bir süre değişmeden kaldığı bir durumdur.
Sıcaklık, bir vücut sisteminin termal denge durumunu karakterize eder: sistemin birbiriyle termal dengede olan tüm gövdeleri aynı sıcaklığa sahiptir..
Sıcaklığı ölçmek için, sıcaklığa bağlı olarak herhangi bir makroskopik miktardaki değişikliği kullanabilirsiniz: hacim, basınç, elektrik direnci, vb.
Çoğu zaman pratikte, sıvı hacminin (cıva veya alkol) sıcaklığa bağımlılığı kullanılır. Bir termometreyi kalibre ederken, eriyen buzun sıcaklığı genellikle referans noktası (0) olarak alınır; ikinci sabit nokta (100), normal atmosfer basıncında (Santigrat ölçeği) suyun kaynama noktasıdır. Farklı sıvılar ısıtıldıklarında farklı şekilde genişledikleri için, bu şekilde oluşturulan ölçek bir dereceye kadar verilen sıvının özelliklerine bağlı olacaktır. Elbette 0 ve 100°C tüm termometreler için eşleşir, ancak 50°C eşleşmez.
Sıvılardan farklı olarak, tüm seyreltilmiş gazlar ısıtıldıklarında aynı şekilde genişler ve sıcaklıktaki bir değişiklikle basınçlarını aynı şekilde değiştirir. Bu nedenle fizikte, rasyonel bir sıcaklık ölçeği oluşturmak için, sabit bir hacimde belirli miktarda seyreltilmiş gazın basıncındaki bir değişiklik veya sabit bir basınçta bir gazın hacmindeki bir değişiklik kullanılır. Bu ölçek bazen denir ideal gaz sıcaklığı ölçeği.
Termal dengede, tüm gazların moleküllerinin öteleme hareketinin ortalama kinetik enerjisi aynıdır. Basınç, moleküllerin öteleme hareketinin ortalama kinetik enerjisi ile doğru orantılıdır: 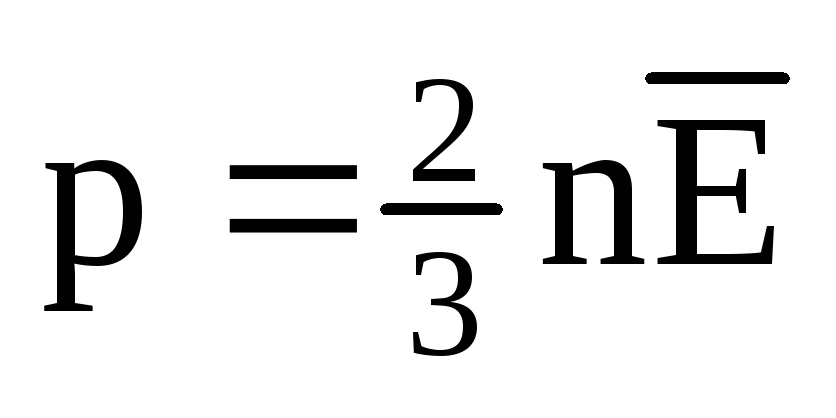 . Termal dengede, eğer belirli bir kütleye sahip bir gazın basıncı ve hacmi sabitse, gaz moleküllerinin ortalama kinetik enerjisi sıcaklık gibi kesin olarak tanımlanmış bir değere sahip olmalıdır. Çünkü
. Termal dengede, eğer belirli bir kütleye sahip bir gazın basıncı ve hacmi sabitse, gaz moleküllerinin ortalama kinetik enerjisi sıcaklık gibi kesin olarak tanımlanmış bir değere sahip olmalıdır. Çünkü 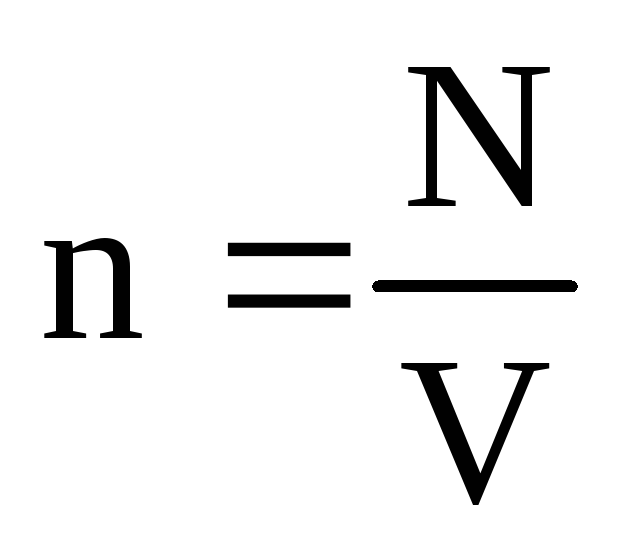 , o zamanlar
, o zamanlar 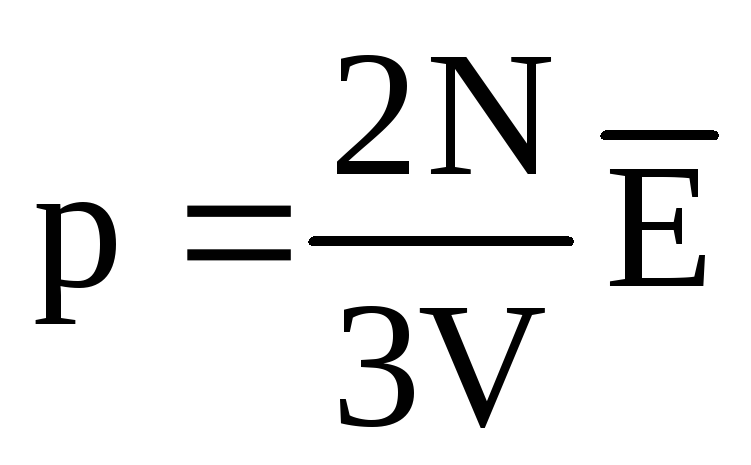 , veya
, veya 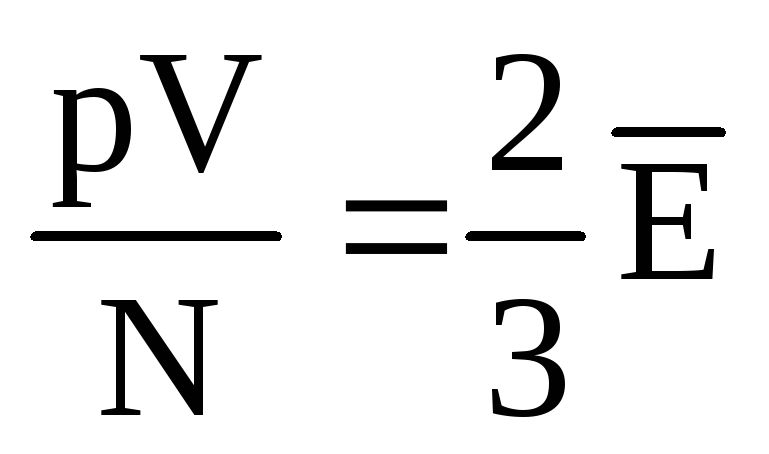 .
.
belirtmek 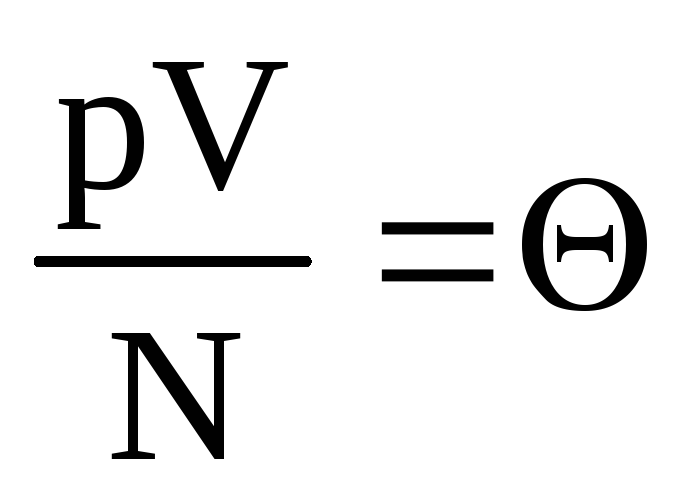 . Değer
. Değer  sıcaklıkla artar ve sıcaklıktan başka bir şeye bağlı değildir. Bu nedenle, doğal bir sıcaklık ölçüsü olarak kabul edilebilir.
sıcaklıkla artar ve sıcaklıktan başka bir şeye bağlı değildir. Bu nedenle, doğal bir sıcaklık ölçüsü olarak kabul edilebilir.
Biliyor musun,
düşünce deneyi, gedanken deneyi nedir?
Bu var olmayan bir pratiktir, uhrevî bir deneyimdir, gerçekte orada olmayanın hayalidir. Düşünce deneyleri hayallere benzer. Canavarlar doğururlar. Hipotezlerin deneysel bir testi olan fiziksel bir deneyin aksine, bir "düşünce deneyi" sihirli bir şekilde deneysel bir testi istenen, denenmemiş sonuçlarla değiştirir ve kanıtlanmamış öncülleri kanıtlanmış önermeler gibi kullanarak mantığı fiilen ihlal eden mantıksal yapıları manipüle eder. ikame. Bu nedenle, "düşünce deneyleri" başvuranlarının asıl görevi, gerçek bir fiziksel deneyi "bebeği" ile değiştirerek dinleyiciyi veya okuyucuyu aldatmaktır - fiziksel doğrulama olmadan şartlı tahliye üzerine hayali akıl yürütme.
Fiziği hayali, "düşünce deneyleri" ile doldurmak saçma, gerçeküstü, kafa karıştırıcı bir dünya resmine yol açtı. Gerçek bir araştırmacı, bu tür "sarmalayıcıları" gerçek değerlerden ayırt etmelidir.
Rölativistler ve pozitivistler, "düşünce deneyi"nin (zihnimizde ortaya çıkan) teorileri tutarlılık açısından test etmek için çok faydalı bir araç olduğunu iddia ederler. Bunda insanları aldatırlar, çünkü herhangi bir doğrulama ancak doğrulama nesnesinden bağımsız bir kaynak tarafından yapılabilir. Hipotezin başvuranının kendisi, kendi ifadesinin bir testi olamaz, çünkü bu ifadenin nedeni, başvuru sahibi tarafından ifadede görülebilen çelişkilerin olmamasıdır.
Bunu, bilimi yöneten ve yöneten bir tür dine dönüşen SRT ve GTR örneğinde görüyoruz. kamuoyu. Onlarla çelişen hiçbir gerçek, Einstein'ın formülünün üstesinden gelemez: "Gerçek, teoriyle örtüşmüyorsa, gerçeği değiştirin" (Başka bir versiyonda, "Gerçek, teoriyle örtüşmüyor mu? - Gerçek için çok daha kötü) ").
Bir "düşünce deneyinin" iddia edebileceği maksimum değer, yalnızca, başvuranın çoğu zaman hiçbir şekilde doğru olmayan kendi mantığı çerçevesinde hipotezin iç tutarlılığıdır. Uygulamaya uygunluk bunu kontrol etmez. Gerçek bir test ancak gerçek bir fiziksel deneyde gerçekleşebilir.
Bir deney bir deneydir, çünkü o bir düşünce iyileştirmesi değil, bir düşünce testidir. Kendi içinde tutarlı olan düşünce kendini sınayamaz. Bu Kurt Gödel tarafından kanıtlanmıştır.
