Hidrojen sülfürün çeşitli sıcaklıklardaki ısı kapasitesi. Doğal gazın özgül ısı kapasitesi
Spesifik değil, ancak genel olarak kabul edilen fiziksel anlamda toplam termal kapasite, bir maddenin ısınma yeteneğidir. En azından termal fizikle ilgili herhangi bir ders kitabı bize bunu söylüyor - bu klasik tanımısı kapasitesi(doğru ifade). Aslında, bu ilginç bir fiziksel özelliktir. Günlük yaşamda bize az bilinen "madalyonun yüzü". Dışarıdan ısı verildiğinde (ısıtma, ısınma), tüm maddelerin ısıya eşit tepki vermediği ortaya çıktı ( Termal enerji) ve farklı şekilde ısıtın. Kabiliyet Yakıt olarak kullanılan doğal kaynaklı GAZ termal enerjiyi almak, almak, tutmak ve biriktirmek (biriktirmek) DOĞAL yanıcı gazın ısı kapasitesi denir. ve kendisi metanın ısı kapasitesi, gaz yakıtın termofiziksel özelliklerini tanımlayan fiziksel bir özelliktir. Aynı zamanda, uygulanan farklı yönlerde, belirli bir pratik duruma bağlı olarak, bizim için bir şey önemli olabilir. Örneğin: bir maddenin alma yeteneği ılık veya biriktirme yeteneği Termal enerji ya da onu korumak için "yetenek". Ancak bazı farklılıklara rağmen, fiziksel anlamda ihtiyacımız olan özellikler anlatılacaktır. metanın ısı kapasitesi.
Temel bir doğanın küçük ama çok "kötü bir engeli", ısınma yeteneğinin - metanın termal kapasitesi ile doğrudan ilgili değildir. kimyasal bileşim, bir maddenin moleküler yapısı, aynı zamanda miktarı (ağırlık, kütle, hacim) ile. Böyle "hoş olmayan" bir bağlantı nedeniyle, genel metanın ısı kapasitesi maddenin çok uygunsuz fiziksel özelliği haline gelir. Çünkü ölçülen bir parametre aynı anda "iki farklı şeyi" tanımlar. Yani: gerçekten karakterize ediyor DOĞAL GAZ'ın termofiziksel özellikleri, ancak "geçerken" miktarını da hesaba katar. "Yüksek" termal fiziğin ve "sıradan" miktarda maddenin (bizim durumumuzda: gaz yakıtı) otomatik olarak bağlandığı bir tür ayrılmaz özellik oluşturmak.
Peki, neden "yetersiz ruhun" açıkça izlendiği bu tür termofiziksel özelliklere ihtiyacımız var? Fizik açısından bakıldığında, toplam metanın ısı kapasitesi(en beceriksizce), sadece gaz yakıtta birikebilecek termal enerji miktarını tarif etmeye çalışmakla kalmaz, aynı zamanda "geçerken bize haber verin" miktarı hakkında da bilgi verir. DOĞAL YANICI GAZ. Saçmalık ortaya çıkıyor ve net, anlaşılır, istikrarlı, doğru değil metanın termofiziksel özelliği. Pratik için uygun kullanışlı bir sabit yerine termofiziksel hesaplamalar, alınan ısı miktarının toplamı (integral) olan değişken bir parametre verilir. DOĞAL GAZ ve kütlesi veya metan hacmi.
Tabii ki, böyle bir "coşku" için teşekkür ederim, ancak miktar DOĞAL YAKIT GAZI Kendimi ölçebilirim. Sonuçları çok daha uygun, "insan" biçiminde almış olmak. Miktar DOĞAL YANICI GAZ Genel formülden karmaşık bir formül kullanarak matematiksel yöntemler ve hesaplamalarla "çıkarmamak" istiyorum. metanın ısı kapasitesi, farklı sıcaklıklarda, ancak gram (g, g), kilogram (kg), ton (ton), küp (metreküp, metreküp, m3), litre (l) veya mililitre (ml) cinsinden ağırlığı (kütle) öğrenin. ). Özellikle beri Zeki insanlar uzun zaman önce bu amaçlar için oldukça uygun ölçü aletleri ortaya çıktı. Örneğin: teraziler veya diğer cihazlar.
Özellikle parametrenin "sinir bozucu yüzen doğası": genel doğal olarak oluşan gazın ısı kapasitesi. Kararsız, değişken "ruh hali". "Servis büyüklüğü veya dozu" değiştirilirken, DOĞAL GAZ'ın farklı sıcaklıklardaki ısı kapasitesi hemen değişir. Daha yanıcı gaz karışımı, fiziksel miktar, mutlak değer metanın ısı kapasitesi- artışlar. Daha az miktarda yanıcı gaz karışımı, değer metanın termal kapasitesi azalır. "Rezalet" bazıları çıkıyor! Başka bir deyişle, "sahip olduğumuz" hiçbir şekilde sabit bir betimleme olarak kabul edilemez. DOĞAL GAZ'ın farklı sıcaklıklarda termofiziksel özellikleri. Ve anlaşılabilir, sabit bir katsayıya, karakterize eden bir referans parametresine "sahip olmamız" arzu edilir. termal özellikler metan miktarına (ağırlık, kütle, hacim) "referans" olmadan gaz yakıtı. Ne yapalım?
İşte bu noktada çok basit ama "çok bilimsel" bir yöntem imdadımıza yetişiyor. Sadece icra memuruna değil "ud. - özel", önceki fiziksel miktar, ancak madde miktarının dikkate alınmamasını içeren zarif bir çözüme. Doğal olarak, "rahatsız edici, gereksiz" parametreler: kütle veya hacim DOĞAL YANICI GAZ dışlamak kesinlikle imkansız. En azından metan miktarı yoksa, o zaman "tartışma konusu" olmayacağı için. Ve madde olmalıdır. Bu nedenle, ihtiyacımız olan "C" katsayısının değerini belirlemek için uygun bir birim olarak kabul edilebilecek bazı koşullu kütle veya hacim standardı seçiyoruz. İçin DOĞALGAZ yakıt ağırlığı, pratik kullanımda uygun olan böyle bir metan kütlesi biriminin 1 kilogram (kg) olduğu ortaya çıktı.
Şimdi biz bir kilogram DOĞAL GAZI 1 derece ısıtıyoruz ve ısı miktarı (termal enerji)ısıtmamız gerekiyor gaz karışımı bir derece - bu bizim doğru fiziksel parametremiz, "C" katsayısı, iyi, oldukça tam ve açık bir şekilde birini tanımlayan DOĞAL GAZ'ın farklı sıcaklıklarda termofiziksel özellikleri. Lütfen şu anda açıklayan bir karakteristik ile uğraştığımızı unutmayın. fiziksel özellik ama miktarı hakkında "ek olarak bizi bilgilendirmeye" çalışmıyor. Rahat? Hiç bir kelime yok. Bu tamamen farklı bir konu. Bu arada, şimdi genel hakkında konuşmuyoruz. metanın termal kapasitesi. Her şey değişti. DOĞALGAZIN ÖZGÜN ISISI BUDUR, bazen başka bir adla anılır. Nasıl? sadece MUHTEŞEM DOĞAL YANICI GAZIN ISI KAPASİTESİ. Spesifik (ud.) Ve kütle (m.) - bu durumda: eş anlamlılar, burada ihtiyacımız olanı kastediyorlar "C" katsayısı.
Tablo 1. Katsayı: DOĞAL GAZ'ın özgül ısı kapasitesi (sp.). DOĞAL yanıcı GAZ'ın kütle ısıl kapasitesi. Referans verisi.
Basitçe söylemek gerekirse, ısı kapasitesi İTİBAREN vücutta harcanması gereken ısı miktarına denir. bu süreç vücudu bir derece ısıtmak için: .
Genellikle, ısı kapasitesi, bir maddenin miktarının bir birimine atıfta bulunur ve seçilen birime bağlı olarak, ayırt ederler:
özgül kütle ısı kapasitesi İle birlikte, 1 kg gaza atıfta bulunulur, J/(kgK);
özgül hacimsel ısı kapasitesi İle birlikte´, normal fiziksel koşullar altında 1 m3 hacminde bulunan gaz miktarına atıfta bulunulur, J / (m3 K);
özgül molar ısı kapasitesi μ İle birlikte, bir kilomol, J / (kmolK) olarak adlandırılır.
Spesifik ısı kapasiteleri arasındaki ilişki, bariz ilişkilerle belirlenir:
İle birlikte= μ İle birlikte/μ; İle birlikte´= İle birlikteρ n. (2.13)
Burada ρ n, normal koşullar altında gaz yoğunluğudur.
Sağlanan aynı miktarda ısı ile vücut sıcaklığındaki değişiklik, gerçekleşen işlemin doğasına bağlıdır, bu nedenle ısı kapasitesi işlemin bir fonksiyonudur. Bu, işleme bağlı olarak aynı çalışma sıvısının 1 K ısıtılması için farklı miktarda ısı gerektirdiği anlamına gelir. sayısal büyüklük İle birlikte+ ∞ ile – ∞ arasında değişir.
Termodinamik hesaplamalarda büyük önem Sahip olmak:
sabit basınçta ısı kapasitesi
İle birlikte p = δ q p/ dT, (2.14)
q p , süreçte vücuda getirilen sabit basınçta, vücut sıcaklığındaki bir değişikliğe dT;
sabit hacimde ısı kapasitesi
İle birlikte v = δ q v /dT, (2.15)
ısı miktarının oranına eşittir δ q v, süreçte vücuda getirilen sabit bir hacimde, vücut sıcaklığındaki bir değişikliğe dT.
Kapalı sistemler için termodinamiğin birinci yasasına göre δ q = du + pdv.
olduğu gerçeğini göz önünde bulundurarak 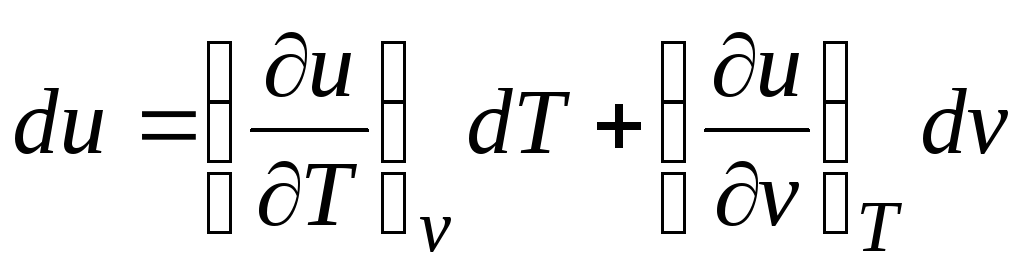 (ilişkiler (2.1))
(ilişkiler (2.1))
Δ q = (∂sen/∂T) v dT + [(∂sen/∂v) T + p]dvd. (2.16)
Bir izokorik süreç için ( v=const) bu denklem şu şekli alır 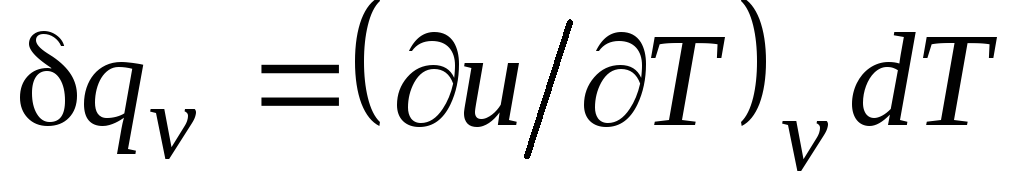 , ve (2.15)'i dikkate alarak, şunu elde ederiz:
, ve (2.15)'i dikkate alarak, şunu elde ederiz:
c v = (∂sen/∂T) v . (2.17)
İdeal bir gaz için
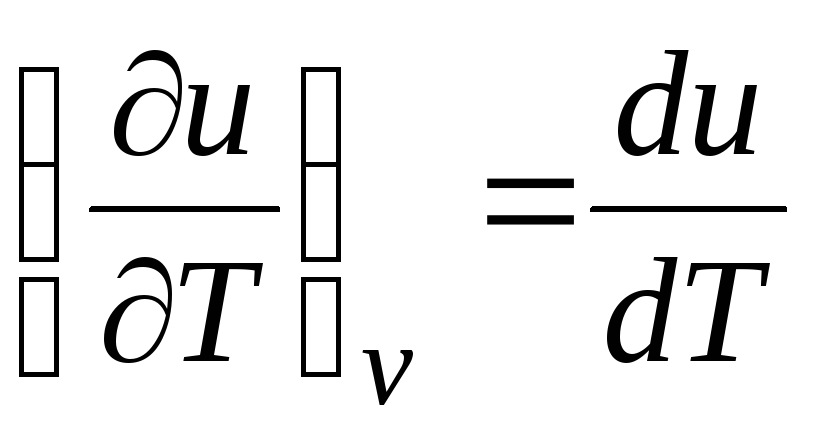 (denklem 2.2), yani
(denklem 2.2), yani
c v = du/dT. (2.18)
Bir izobarik süreç için ( R=const) (2.16) ve (2.14) denklemlerinden elde ederiz
c p = (∂ sen/∂T) v + [(∂sen/∂v) T + p](dvd/dT) p
İç enerjiden beri Ideal gaz sadece sıcaklığı ile belirlenir ve spesifik hacme bağlı değildir, o zaman
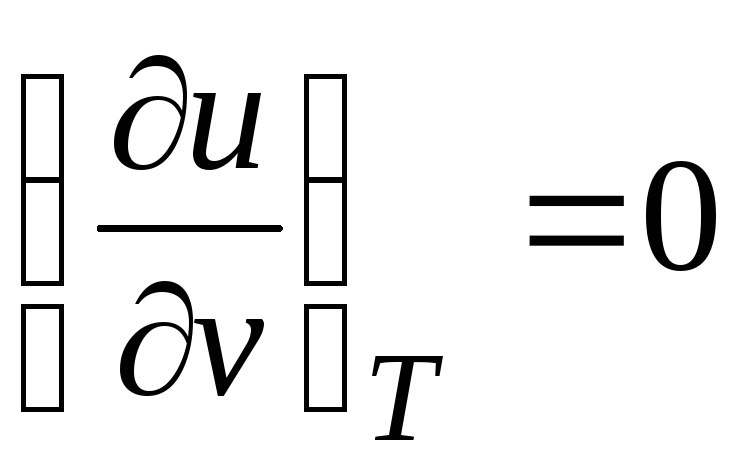 .
(2.19)
.
(2.19)
Clapeyron denkleminden (1.4) pv
= RT(1.3) takip eder 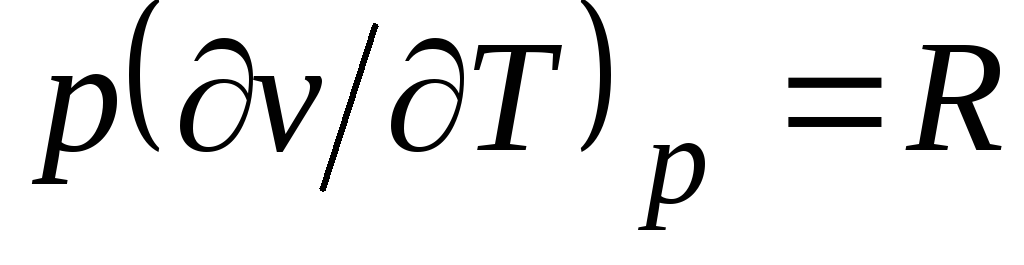 , nerede
, nerede
c p= İle birlikte v + R. (2.20)
İlişki (2.20) Mayer denklemi olarak adlandırılır ve ideal gazların teknik termodinamiğindeki ana denklemlerden biridir.
Süreç içerisinde v\u003d const, gaza verilen ısı sadece iç enerjisini değiştirmek için giderken, p \u003d const sürecinde ısı hem iç enerjiyi arttırmak hem de genişleme işini gerçekleştirmek için harcanır. Bu yüzden c p daha fazla İle birlikte v bu işin miktarına göre.
formül ![]() sözde gerçek ısı kapasitesini, yani belirli bir sıcaklıktaki ısı kapasitesinin değerini belirler. Uygulamada, ısı miktarını hesaplamak için ısı kapasitesi yaygın olarak kullanılmaktadır. q 12, vücudu bir sıcaklıktan ısıtmak için harcanması gereken ( t 1) diğerine ( t 2) (veya soğutma sırasında serbest bırakılacak olan t 2 ila t 1).
sözde gerçek ısı kapasitesini, yani belirli bir sıcaklıktaki ısı kapasitesinin değerini belirler. Uygulamada, ısı miktarını hesaplamak için ısı kapasitesi yaygın olarak kullanılmaktadır. q 12, vücudu bir sıcaklıktan ısıtmak için harcanması gereken ( t 1) diğerine ( t 2) (veya soğutma sırasında serbest bırakılacak olan t 2 ila t 1).
Belirtilen sıcaklık aralığında ısı kapasitesi değişmezse, o zaman
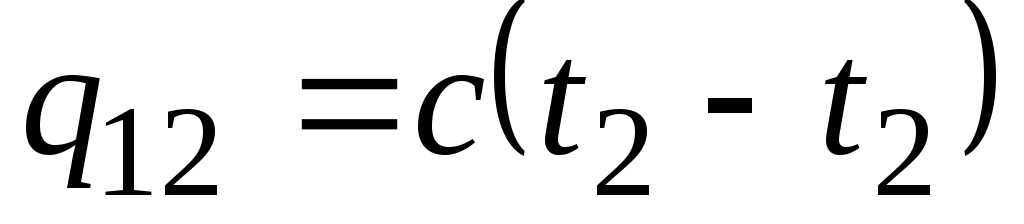 , kJ/kg ve
, kJ/kg ve 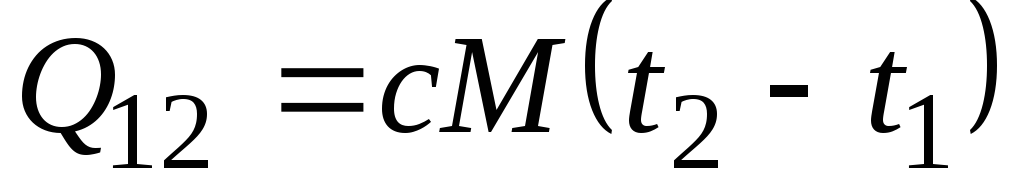 , kJ. (2.21)
, kJ. (2.21)
Bu formül, yaklaşık (çok doğru olmayan) hesaplamalar için de kullanılabilir. Örneğin, oda sıcaklığında suyun özgül ısı kapasitesi 4.187 kJ/(kgC) ve havanın 1 kJ/(kgC)'dir. Hemen hemen tüm maddelerin ısı kapasitesi artan sıcaklıkla değiştiğinden (çoğunlukla arttığından), kesinlikle konuşmak gerekirse, formülü kullanmak gerekir.
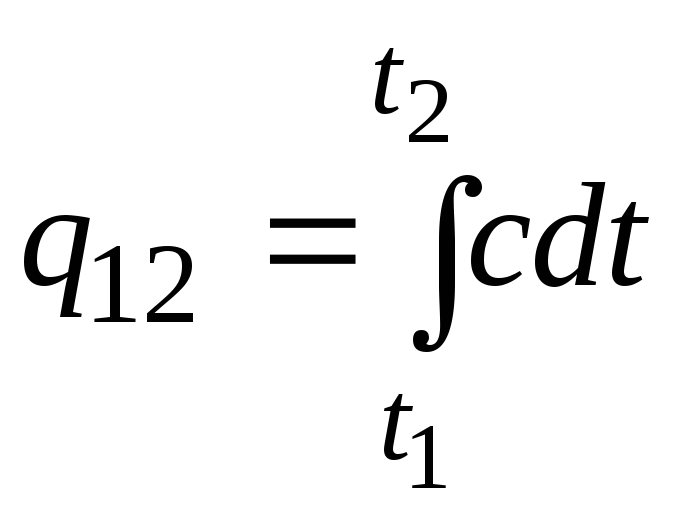 .
(2.21a)
.
(2.21a)
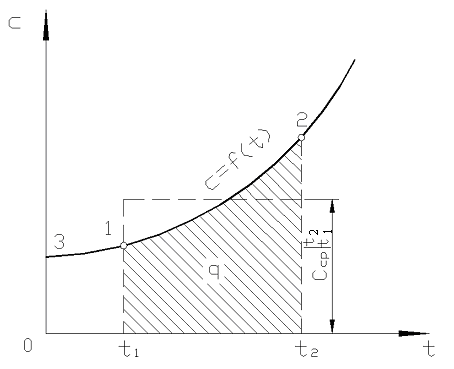
Şek. 2.2 büyüklük q 12 taralı alan olarak gösterilir. Ortalama değer teoremini uygulayarak en kolay yol yazmaktır.
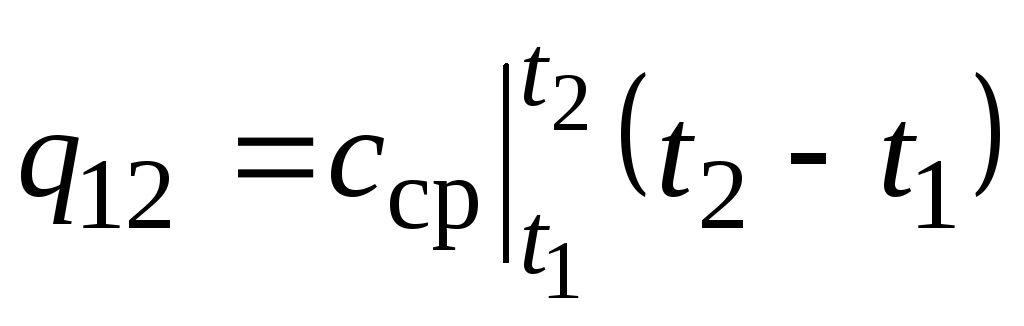 ,
(2.22)
,
(2.22)
nerede 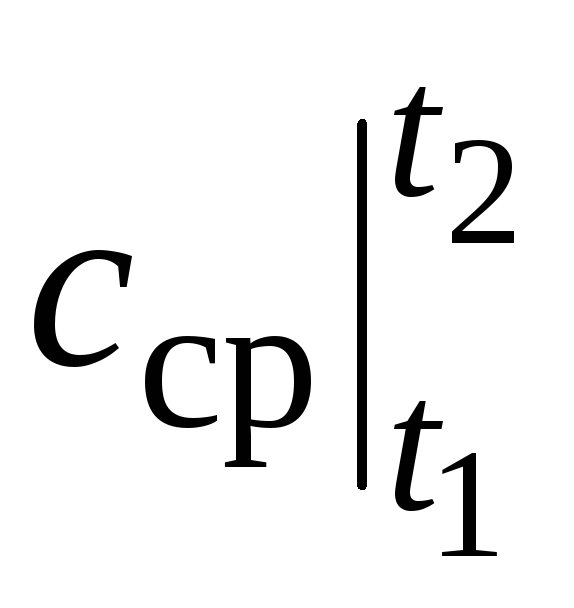 sıcaklık aralığındaki ortalama ısı kapasitesidir t 1 …t 2 .
sıcaklık aralığındaki ortalama ısı kapasitesidir t 1 …t 2 .
Pirinç. 2.2. Gerçek ısı kapasitesinin sıcaklığa bağımlılığı
Ancak, gerçek hesaplamalar için, ısı kapasitesi tablolardan seçildiğinden, böyle bir gösterim çok elverişsizdir ve 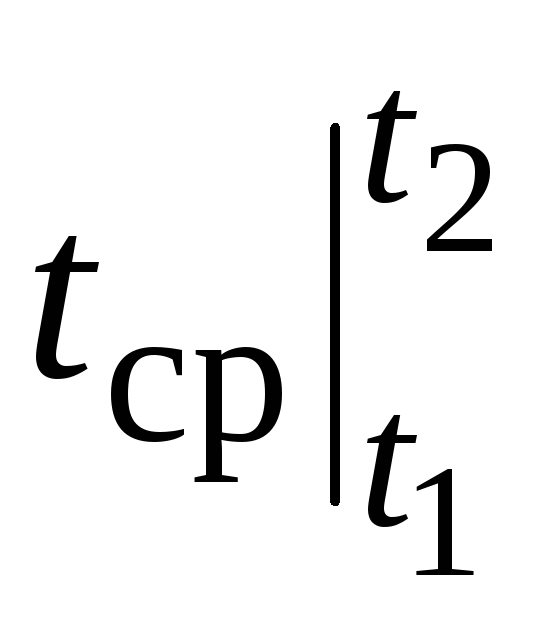 nasıl olduğuna bağlı t 1 ve t 2. İki bağımsız değişkenden oluşan bir işlev tablosu çok hantal olurdu.
nasıl olduğuna bağlı t 1 ve t 2. İki bağımsız değişkenden oluşan bir işlev tablosu çok hantal olurdu.
Pratikte aşağıdaki gibi ilerleyin. İstenen ısı miktarı, vücudu 0 С'den sıcaklıklara ısıtmak için gereken miktarlar arasındaki fark olarak sunulur. t 2 ve t 1 sırasıyla (Şekil 2.2)
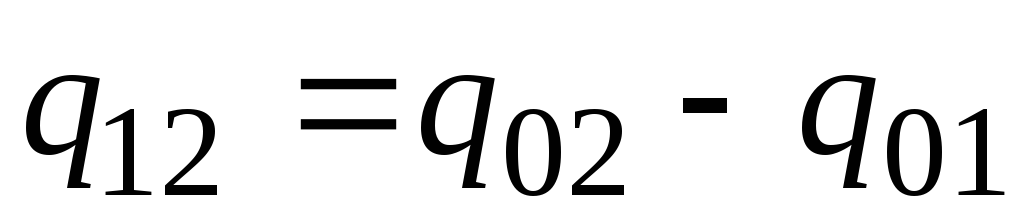 . (2.23)
. (2.23)
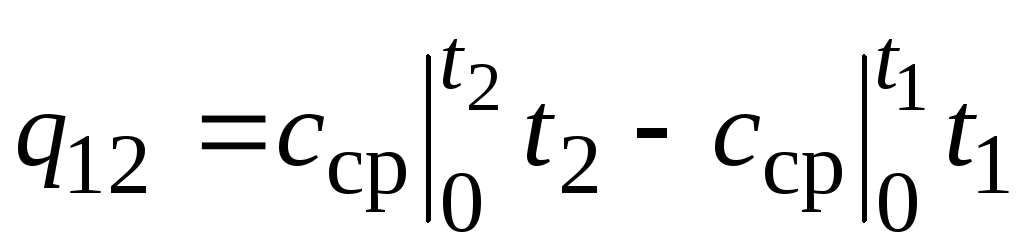 ,
(2.24)
,
(2.24)
nerede  - 0… sıcaklık aralığında ortalama ısı kapasitesi tC.
- 0… sıcaklık aralığında ortalama ısı kapasitesi tC.
Ortalama ısı kapasitesinin değeri  belirli bir madde (ve belirli bir süreç, yani İle birlikte R veya c v) sadece bir sıcaklığa bağlıdır t. Tüm tablolarda "ortalama" adı altında verilen bu ısı kapasiteleridir. için söylenenler doğrudur İle birlikte
(İle birlikte R ve c v) için olduğu kadar İle birlikte ve İle birlikte. Örnek olarak, aşağıdaki tablo en yaygın gazlardan bazıları için ısı kapasitesini sıcaklığa karşı göstermektedir. Formül (2.24)'de sıcaklığın santigrat derece olarak değiştirildiği vurgulanmalıdır.
belirli bir madde (ve belirli bir süreç, yani İle birlikte R veya c v) sadece bir sıcaklığa bağlıdır t. Tüm tablolarda "ortalama" adı altında verilen bu ısı kapasiteleridir. için söylenenler doğrudur İle birlikte
(İle birlikte R ve c v) için olduğu kadar İle birlikte ve İle birlikte. Örnek olarak, aşağıdaki tablo en yaygın gazlardan bazıları için ısı kapasitesini sıcaklığa karşı göstermektedir. Formül (2.24)'de sıcaklığın santigrat derece olarak değiştirildiği vurgulanmalıdır.
Çeşitli gazların ortalama molar ısı kapasitesi R=sabit
(M.P. Vukalovich, V.A. Kirillin, V.N. Timofeev'e göre)
|
t, C |
İle birlikte R, kJ/(kmolK) |
|||||||
|
N 2 atmosferik | ||||||||
Bu tabloda, değerler İle birlikte p 100 С ile verilir. Sıcaklıkla çok fazla değişmedikleri için lineer ekstrapolasyon ile ara değerler bulunabilir. Bunun nasıl yapıldığını hatırlayın. Tablo fonksiyon değerleri var y
= f(x) de 1 (ne zaman X= X 1) ve de 2 (ne zaman X= X 2). fonksiyon değeri de(X) X 1 <X<X 2 eşittir 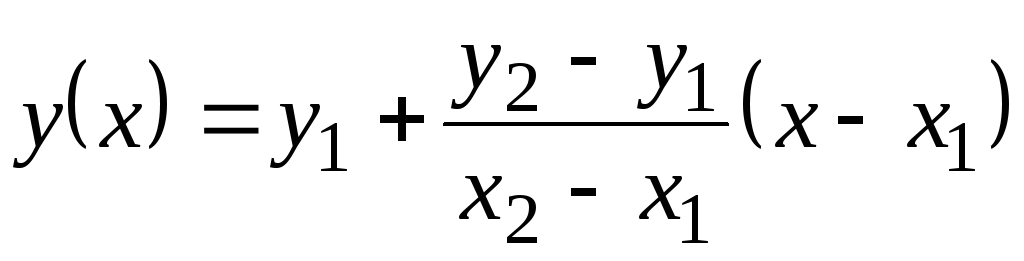 . Bu formül hem monoton artan bir fonksiyon için geçerlidir ( de 2 >de 1) ve monoton azalan için ( de 2 <de bir); Bu durumda, kesir negatif olacaktır, çünkü X 2 > X 1 her zaman.
. Bu formül hem monoton artan bir fonksiyon için geçerlidir ( de 2 >de 1) ve monoton azalan için ( de 2 <de bir); Bu durumda, kesir negatif olacaktır, çünkü X 2 > X 1 her zaman.
Tablo, sıcaklık ve basınca bağlı olarak gazların termal iletkenlik değerlerini göstermektedir.
Termal iletkenlik değerleri, 20 K (-253 °C) ila 1500 K (1227 °C) aralığındaki sıcaklıklar ve 1 ila 1000 atmosfer arasındaki basınç için belirtilmiştir.
Masa aşağıdaki gazların ısıl iletkenliği göz önüne alındığında: , , freon-14 CF 4 , etilen C2H4 . Termal iletkenlik birimi W/(m derece)'dir.
bu not alınmalı Gazların ısıl iletkenliği artan sıcaklık ve basınçla artar. Örneğin, amonyak gazının oda sıcaklığında ve normal atmosfer basıncında termal iletkenliği 0,024 W/(m°)'dir ve 300 derece ısıtıldığında, termal iletkenlik 0,067 W/(m°) değerine yükselir. Bu gazın basıncı 300 atmosfere çıkarılırsa, termal iletkenlik değeri daha da yüksek olacak ve 0.108 W / (m derece) değerine sahip olacaktır.
Not: Dikkatli olun! Tablodaki termal iletkenlik 10 3 faktörü ile belirtilmiştir. 1000'e bölmeyi unutmayın!
Sıcaklığa bağlı olarak inorganik gazların ısıl iletkenliği
Tablo, normal atmosfer basıncında sıcaklığa bağlı olarak inorganik gazların termal iletkenlik değerlerini vermektedir. Gazların termal iletkenlik değerleri, 80 ila 1500 K (-193 ... 1227 ° C) arasındaki sıcaklıklarda gösterilir.
Tablo, aşağıdaki gazların termal iletkenliğini göstermektedir: azot oksit N 2 O, kükürt heksaflorür SF 6, nitrik oksit NO, hidrojen sülfür H 2 S, amonyak NH 3, kükürt dioksit SO 2, buhar H 2 O, karbondioksit CO 2 , ağır su buharı D 2 O, hava.
bu not alınmalı inorganik gazların termal iletkenliği artan gaz sıcaklığı ile artar.
Not: Tablodaki gazların ısıl iletkenliği 10 3 faktörü ile belirtilmiştir. 1000'e bölmeyi unutmayın!
Organik gazların sıcaklığın bir fonksiyonu olarak ısıl iletkenliği
Tablo, normal atmosfer basıncında sıcaklığa bağlı olarak organik gazların ve bazı sıvıların buharlarının termal iletkenlik değerlerini göstermektedir. Gazların ısıl iletkenlik değerleri tabloda 120 ila 800 K sıcaklık aralığında verilmiştir.
Aşağıdaki organik gazların ve sıvıların termal iletkenliği verilmiştir: aseton CH3 COCH3, oktan C8H18, pentan C5H12, bütan C4H10, heksan C6H14, propilen C3H6, heptan C7H16, amil alkol C5H11OH, ksilen C8H10, izopropil alkol C2H7OH, metan CH4, metil alkol CH30H, karbon tetraklorür CCl 4, sikloheksan C6H12, etan C2H6, karbon tetraflorür CF 4, freon-11 CFCl 3, etil klorür C2H5Cl, freon-12 CF2Cl2, etilen C2H4, freon-13 CF3Cl, etil format HCOOC 2H5, freon-21 CHFCl2, dietil eter (C2H 5) 2O.
Tablodan da anlaşılacağı üzere, organik gazların termal iletkenlik değeri de artan gaz sıcaklığı ile artar.
Dikkat olmak! Tablodaki termal iletkenlik 10 3 faktörü ile belirtilmiştir. 1000'e bölmeyi unutmayın!Örneğin, aseton buharının 400 K (127°C) sıcaklıkta termal iletkenliği 0.0204 W/(m°)'dir.
