ガス混合物。 ガスの熱容量。 燃料、ガス混合物および熱容量
1.3。 理想気体の状態方程式
実際の物質の状態方程式 (1.1) の形式はかなり複雑です。
この点で、熱力学では作業体の単純化された物理モデルが使用されます。
気体状態の作動流体の場合、最も単純で歴史的に最初のモデルは次のとおりです。 理想気体. 理想気体は、分子間相互作用の力 (引力と反発) が存在しない気体であり、分子自体は次のように見なされます。 質点. 理想気体は クライペロン方程式– メンデレーエフ
どこ メートルシステム内のガスの質量です。 μ はガスのモル質量です。 Rμ = 8314 J/(kmol K) は、ガスの種類や存在条件に依存しない普遍的なガス定数です。 状態方程式 (1.2) は、 ボイル・マリオットの法則と ゲイ・リュサック考慮して アボガドロの法則.
モル質量 μ = m/n、kg / molは、1モルの量で摂取される物質の質量です。 1モル 12 グラムの炭素と同じ数の粒子を含む物質の量の単位です。 物質の量– n = N/N あ、モル、どこ Nは粒子(原子、分子)の数、 N あ ≈ 6.02 10 23 - 12 グラムの炭素に含まれる原子の数 ( アボガドロ数)。 数値的にμ = Мr 10 -3 、ここで Mr は物質の相対分子量 ( タブ。 メンデレーエフ) (例: =2 kg/kmol)。
具体的には (つまり、1 kg のガスの場合)、式 (1.2) は次の形式になります。
どこ R– 特定の気体定数、J/(kg K)。
特定の気体定数の物理的な意味を説明しましょう R. 最初の状態の式 (1.2) は 、同じ圧力での 2 番目の状態は - と書かれます。 2 番目の式から 1 番目の式を減算し、次の式を見つけます。 比気体定数は、一定の圧力で 1 度加熱されたときに 1 kg の気体が行う仕事です。
実験データによると、実在気体は理想気体に近づくほど密度が低くなります。 言い換えれば、圧力の上昇または温度の低下によって一定量のガスの体積が減少すると、どのガスも理想的なガスの特性からますます逸脱します。 したがって、「理想気体」の概念の下では、高温および低圧でのすべての実在気体に適合します。
1.4。 ミックス 理想気体
実際には、作動流体は多くの場合、均一なガス (空気など) の混合物であり、それぞれが理想的であると見なすことができ、内部に侵入することはありません。 化学反応.
このような混合物も理想気体であり、混合物の状態方程式 (1.2) に従います。
どこ R=R μ / μ は混合物のガス定数です。 μ は、混合物の平均 (見かけの) モル質量です。(分子の数と総質量が分子の数と混合物の質量に等しい均一な代表的なガスを参照する条件値)。
混合物の質量は、すべての構成成分の質量に等しい
ガス混合物の挙動を決定する主な法則は次のとおりです。 ダルトンの法則:
個々のガスは、ガス混合物中で、混合物の温度で単独で混合物の全体積を占めているかのように振る舞います。
ガス混合物に入る個々のガスは、単独でガス混合物の全容積を占める場合と同じ圧力を持っています。
したがって、値 R(絶対混合気圧力) は次のように定義されます。
どこ R 私 – 分圧 私番目のコンポーネント、つまり 圧力 私番目の成分、同じ温度で混合物の全体積を単独で占める場合()。
混合物の組成は、混合物の構成成分の質量またはモル分率、ならびに体積分率(濃度)によって与えられます。
質量分率は、混合物の総質量に対する各ガスの質量の比率です。
式 (1.3) は、 を意味します。
体積分率比と呼ばれる 部分ボリューム(ガスの圧力と温度がガス混合物の圧力と温度に等しい場合にガスが占める体積、つまり) ガス混合物の総体積: . 分圧と体積の定義と温度の一定性から、次のようになります。
![]() (1.5)
(1.5)
混合物のすべての成分の最後の等値を合計すると、 が得られます。 混合物を構成するガスの部分体積の合計は、ガスの混合物の体積に等しくなります。
体積分率の合計は 1 です。
モル分率成分は、各ガスの物質量の比率と呼ばれます n 私 ガスの混合物の物質の量に n. and and の関係から アボガドロの法則(同じ温度と同じ圧力での異なる理想気体の等体積では、同数の分子が封入されます。つまり) は次のとおりです。
それらの。 モル分率で混合物を指定することは、その体積分率を指定することと同じです。
質量分率と体積分率は次の比率で関連付けられます。
![]() .
.
混合物が質量分率で与えられる場合 g 私、次に混合物のガス定数と混合物のモル質量は次のように計算されます。
![]()
![]()
混合物が体積分率で与えられる場合 r 私、次に、混合物のモル質量と混合物の気体定数を計算するための式は次のとおりです。
![]() (1.6)
(1.6)
ガスの分圧と体積は、 ボイルの法則–マリオット(ガス温度が一定の場合、ガス圧力とその体積の積は一定値になります。つまり、):
![]() .
.
テスト問題
国際単位系 (SI) とその基本単位。
基本的な熱力学的パラメーターとその寸法。
熱力学系の平衡状態とは何を意味しますか?
平衡状態と非平衡状態の概念。
システムの状態方程式とは何ですか?
システムの状態の幾何学的解釈、熱力学的プロセス。
理想気体とは何ですか? 理想気体と実在気体の違いは何ですか?
ガス定数とは何ですか? その物理的意味、次元、および定義方法。
2.熱容量
どのプロセスにおいても作業体への熱のメッセージは、その状態の変化を引き起こし、一般に、温度の変化を伴います。 温度の変化、および作動流体の状態の他のパラメーターは、プロセスの種類には依存しませんが、その初期 ( 1 ) と最終 ( 2 ) 状態、つまり (素過程の場合、パラメータの変化はその微分に置き換えられます)。
熱量比δ Q体温の変化を体に伝える dT基本的な熱力学的プロセスで呼び出されます 真の熱容量このプロセスのボディ:
ここの下付き文字は、熱と同様に、熱容量がプロセスの性質に依存するという事実を示しています。 さらに、熱容量は体の量とその熱力学的状態に依存します。 また、このプロセスでは、体の化学組成は変化せず、ある凝集状態から別の凝集状態への物質の移行はなく、成分の溶解などもありません。
選択した物質の量の単位に応じて、質量、体積、およびモル比熱容量が区別されます。
質量熱容量の概念は、実際に最も頻繁に使用されます。
2.1. 真の平均熱容量
実在する物質の熱容量は一定の値ではありません。 これは温度によって変化し、この依存性は非常に大きくなる可能性があります (図 2.1)。
プロセス熱の特定の量は、次の式で計算されます。
この値を決定するには、次の方法が使用されます。
実験の結果によると、熱容量の温度依存性は近似多項式として表されます
は近似係数です。 これらの係数は参考文献に記載されています。 それで
温度範囲での実際の計算で t 1 , t 2 熱容量は次の値に等しい定数と見なされます
と呼ばれる 平均熱容量(2.1 で導入された真の熱容量とは対照的に)。 参照データは、0 から固定温度までの平均熱容量を示します t経験的に得られた、すなわち
温度範囲の平均熱容量 t 1 , t 2 これらの参照データによると、次の式で計算できます。
それで 特定の数量プロセス熱は次のように定義されます
2.2. 等容性および等圧性熱容量
熱力学において非常に重要です。
アイソコリック熱容量
体温の変化に対する一定の体積でのプロセス中の熱量の比率に等しい、
等圧熱容量
体温の変化に対する一定の圧力でのプロセスの熱量の比率に等しい。
熱工学計算では、温度に応じてさまざまな物質の特定の等圧および等容熱容量について実験的に得られた数値を示す表が使用されます。
2.3. ガス混合物の熱容量
計算では、多くの場合、ガスの混合物を扱う必要があり、熱容量は個々のガスについてのみ表に示されています。
ガスの混合物が質量分率で与えられる場合 g 私、その後、混合物の比質量熱容量は式によって決定されます
![]()
気体の混合物が体積分率で与えられる場合 r 私、次に、混合物の特定の体積熱容量は、式によって決定されます
![]()
テスト問題
比熱容量の単位を書き留めます。
平均熱容量の概念はどのように導入されましたか?
3. エネルギーの保存と変換の法則
エネルギーの概念は、物質の動きに関連付けられています。
エネルギーは、機械的仕事、熱、化学エネルギー、電界および磁界のエネルギーなど、さまざまな形を取ることができます。
熱力学的プロセスでは、環境と閉じた熱力学的システムの相互作用は、熱と機械的仕事の形でエネルギーを交換することによって実行されます。
3.1. 内部エネルギー
どの環境にもある程度のマージンがあります 内部エネルギーう(J)、技術的な熱力学では、媒体の分子と原子の運動エネルギーとポテンシャル エネルギーの合計として表されます。 これらの粒子の運動エネルギーは速度と質量によって決まりますが、位置エネルギーはそれらの相対位置に依存する粒子間の相互作用の力によって決まります。 システムの内部エネルギーは、システム自体に含まれるエネルギーです。 これは、内部エネルギーが量とともに身体の状態を特徴付けることができることを意味します R, Ⅴ, T.
内部エネルギーには加法性があります。 複雑なシステムの内部エネルギーは、その構成部分の内部エネルギーの合計に等しくなります。
物質1kgの内部エネルギーを 比内部エネルギー あなた= う/ メートル (J/kg)。
熱力学のほとんどの技術的応用では、重要なのは絶対値ではありません う、およびこの値の変化。 したがって、均一系の内部エネルギーの定量的定義は、多くの場合、従来から選択されている標準状態に関して決定されます。
3.2. 熱力学におけるエネルギー保存則
熱力学的プロセスを実行すると、閉じたシステムは外部環境(外部の物体とフィールド)と相互作用します。 エネルギーを交換します。 技術的な熱力学では、熱の伝達と機械的仕事の実行の 2 種類のエネルギー伝達が考慮されます。
熱伝達は、電磁波によって、温度の異なる物体間で接触したり、離れた場所にある温度の異なる物体間で発生します( 熱放射)。 ブロードキャスト 暖かさ体の目に見える動きを伴わずに、分子 (微物理) レベルで発生します。
仕事の形でのエネルギーの伝達は、空間での体全体またはその一部の動きとともに発生します。 この方法では、体は力場で動くか、外圧の影響下でその体積を変化させます。 仕事エネルギー移動の巨視的形態です。
体のエネルギーとは異なり、熱と仕事はその状態の関数ではなく、プロセスのタイプに依存し、このプロセスを決定することに注意する必要があります。 プロセス自体の機能です。
数多くの実験と観察により、自然の基本法則、つまりエネルギー保存の法則が発見されました。 自然界のエネルギーは無から発生せず、消滅せず、また エネルギーの量は変わらず、ある形から別の形に変化するだけです。また
どこ Qプロセスに含まれる熱です。 L- 行われている作業; △ えシステムのエネルギーの変化です。 ここと以下で、私たちは以下を考慮することに同意します:
仕事 ポジティブこの作業が作業団体によって行われる場合、および ネガティブ、システムの作業本体で作業が行われた場合。
体に熱が供給される ポジティブ、および割り当てられた - ネガティブ
さらに、最終プロセスにおける状態パラメータの変化は、記号Δ(デルタ)で示され、基本プロセスでは - d(対応するパラメータの微分)。 有限の熱力学的プロセスでは、状態パラメーター (圧力、温度、内部エネルギー、エンタルピー、エントロピーなど) の変化は、プロセスの種類には依存しませんが、初期状態と最終状態によって決まります。
一般に、熱力学系には内部エネルギーがあります。 う、運動エネルギー(熱力学では、システムは全体が速度で動いていると見なされます w) – 分波 2/2、ポテンシャル - mgz (zはシステムが配置されている高さです)。 プロセスにおける総エネルギーの変化 1 –2 次のように想像できます。
このプロセスで行われる仕事は、仕事の合計です Lシステムの作動流体の体積の変化に関連する(変形作業)、仕事について L宇宙でのシステムの動きに関する dv、 技術職 L それら(エンジン、蒸気ボイラー、コンプレッサーなどのさまざまな技術装置でシステムを移動する場合)は、摩擦力に逆らって機能します L翻訳:
L \u003d Lについて+ L dv + Lそれら+ L tr。
プロセスに含まれる熱は、熱の合計です Q外部、外部環境との交換に関与し、摩擦熱 Q翻訳:
Q = Q外部の + Q tr。
とすれば Q tr = L tr (多数の実験により、摩擦を克服するために費やされた流れの仕事は、流れによって感知される熱に完全に変換されることが示されています)、1 kg の作用する均質な物質 (つまり、特定の質量値) の熱力学におけるエネルギー保存則) は基本プロセスで次のように記述できます。
![]() , (3.1)
, (3.1)
(外部インデックスは不要なので省略)。
(3.1) の右側の微分記号の下にあるのは状態関数であり、残りは熱力学的過程の性質に依存する量であることを強調しておく必要があります。 仕事と熱はプロセス関数であり、状態関数ではないので、記号 δ は、素過程においてそれに続く量が任意の無限小であり、特定の関数の増分ではないという事実のみを示します。 したがって、δ qとδ l-基本的な(つまり、システムの状態のごくわずかな変化に対応する)量の熱と仕事。
熱力学系が空間内でその位置を変えず、唯一の仕事が系の体積の変化に関連する仕事である場合、式 (3.1) はより単純な形になります。
仕事δ l約 外圧の力に逆らって実行され、作動流体の体積が膨張するか、逆に、外部環境が体に作用して体を圧縮します。 平衡過程では、媒体の圧力が作動流体の圧力と等しい場合、この仕事は次のように計算されます。 RDV、 どこ v作用物質の比容積です。
方程式
と呼ばれる 熱力学の第 1 法則: 静止時に閉じた熱力学系に供給される熱は、系の内部エネルギーの変化と、系の体積を変化させる仕事に費やされます。. バランス関係 (3.2) はレクチャーとも呼ばれます。 の上理論文献。 1. バロック: ...
L. A. Eliseeva © Federal State Budgetary Institution of Science ロシア科学アカデミー シベリア支部の州公共科学技術図書館、2013
ポインターランダムウォーク / A.N. ボロディン、I. A.イブラギモフ。 下... 241.どろぐくペット P.I. 熱力学鉱物と鉱物平衡 ... カタログ: 概要 講義 の上コース「参考・・・状態」 テクニカル大学。 シリーズ、 テクニカル理科。 - ...
N. V. Basova [およびその他]; ed。 N. V. バソバ。 ロストフ n/a: フェニックス、2008
教科書コース)執筆D.T.あらすじ 講義 の上高等数学 [テキスト]: ... テクニカル 熱力学 Rudobashta, S.P. 熱工学 [テキスト]: 学生向けの教科書。 勉強している大学 の上... 2008年。 - 204ページ。 十 ボロディン、I. F.技術プロセスの自動化...
2008 年から 2013 年 6 月 1 日までの財務省の科学的研究のリスト (1)
書類…「X線研究法」 講義 の上臨床腫瘍学。 アルマトイ...第二法の 熱力学» 2-インターナショナル...そして エキスパートレビュー テクニカル医療機関の装備...ロシア医学アカデミーの学者Yu.I。 ボロディン、ビシュケク、2009年、p。 ...
エンジニアリングの実践では、均一なガスではなく、化学的に無関係なガスの混合物を扱わなければならないことがよくあります。 混合ガスの例としては、大気、天然ガス、燃料の燃焼によるガス状生成物などがあります。
ガス混合物については、次の規定が有効です。
1.混合物に入る各ガスには温度があり、 温度に等しい混合物。
2. 混合物に含まれるガスはいずれも、混合物の体積全体に分配されるため、各ガスの体積は混合物全体の体積に等しくなります。
3. 混合物に含まれる各ガスは、独自の状態方程式に従います。
4. 混合物は全体として新しい気体のようであり、独自の状態方程式に従います。
ガス混合物の研究は、ダルトンの法則に基づいています。これによれば、一定の温度では、混合物の圧力は混合物に含まれるガスの分圧の合計に等しくなります。
ここで、p cm は混合物の圧力です。
p i - 混合物に含まれるi番目のガスの分圧;
n は、混合物に含まれるガスの数です。
分圧は、混合物に入るガスが、同じ温度で混合物の全体積を単独で占める場合に及ぼす圧力です。
混合ガスの設定方法
ガス混合物の組成は、質量、体積、およびモル分率で指定できます。
質量分率. 混合物に含まれるガスの質量分率は、混合物の質量に対するこのガスの質量の比率です。
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ..........; m n \u003d M n / M cm、
どこで m 1 、 m 2 、...、 m n - ガスの質量分率;
M 1 、M 2 、...、M n - 個々のガスの質量。
M cm は混合物の質量です。
それは簡単にわかる  と
と  (100%).
(100%).
ボリュームシェア。混合物に含まれるガスの体積分率は、混合物の体積に対するこのガスの減少した(部分的な)体積の比率です。
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
ここで、 V 1 、 V 2 、...、 V n - ガスの体積を減らします。
V cm は混合物の体積です。
r 1 、r 2 、...、r n - ガスの体積分率。
換算体積は、混合物の条件下 (混合物の温度と圧力) での気体の体積です。
減少した体積は次のように表すことができます: 1 つを除くすべてのガスが混合物を含む容器から除去され、残りのガスが温度を維持しながら混合物の圧力まで圧縮される場合、その体積は減少または部分的になります。
混合物の体積は、削減されたガスの体積の合計に等しいことが証明できます。
 (100%).
(100%).
モル分率。混合物に含まれるガスのモル分率は、混合物のキロモル数に対するこのガスのキロモル数の比率です。
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; .........、r n \u003d n n / n cm、
どこで r 1 , r 2 , ..., r n - ガスのモル分率;
n cm は混合物のキロモル数です。
n 1 , n 2 , ..., n n はガスのキロモル数です。
モル分率で混合物を指定することは、体積分率で混合物を指定することと同じです。 モル分率と体積分率は、混合物に含まれる各ガスの数値が同じです。
混合物の気体定数と見かけの (平均) 分子量。質量分率で与えられるガス混合定数を計算するには、次の状態方程式を書きます。
混合用
p cm × V cm = M cm R cm T; (1.9)
ガス用
 .
(1.10)
.
(1.10)
式 (1.10) の左部分と右部分を合計します。
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
なぜなら  ,
,
p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
式 (1.9) と (1.11) は、
M cm R cm T \u003d(M 1 R 1 + M 2 R 2 + ..... + M n R n)T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + …… + m n R n
また  ,
(1.12)
,
(1.12)
ここで、R cm は混合物のガス定数です。
i 番目の気体の気体定数
R i = 8314 / m i 、
式 (1.12) は次のように書き直されます。
 .
(1.13)
.
(1.13)
ガス混合物のパラメーターを決定する場合、ガス混合物の見かけの (平均) 分子量と呼ばれる特定の条件値を使用すると便利です。 混合物の見かけの分子量の概念により、従来は混合物を均一なガスと見なすことができ、計算が大幅に簡素化されました。
別のガスの場合、式
類推すると、混合物の場合、次のように書くことができます。
mcm Rcm = 8314, (1.14)
ここで、m cm は混合物の見かけの分子量です。
式 (1.14) から、式 (1.12) と (1.13) を使用して、
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
このように議論すると、体積分率からR cmおよびm cmを計算する式、質量分率を体積分率に変換する式、逆に体積分率を質量分率に変換する式、混合物の比体積u cmを計算する式、および質量分率と体積分率による混合密度r cm、そして最後に、体積分率と質量分率による混合物に含まれるガスの分圧を計算するための式。 これらの式を導出せずに表に示します。
混合ガスの計算式
|
混合物の組成の設定 |
あるコンポジションから別のコンポジションへの転送 |
混合物の密度と比容積 |
混合物の見かけの分子量 |
ガス混合定数 |
分圧 |
|
質量分率 |
|
|
|
|
|
|
体積分率 |
|
|
|
|
|
気体の熱容量
物体の熱容量は、物体を 1 K 加熱または冷却するのに必要な熱量です。物質の単位量の熱容量は比熱容量と呼ばれます。
したがって、物質の比熱容量は、このプロセスで温度を 1 K 変化させるために、物質の単位から付与または差し引かなければならない熱の量です。
以下では比熱容量のみを考慮するため、比熱容量を単に熱容量と呼びます。
ガスの量は、質量、体積、およびキロモル数で指定できます。 ガス量を設定する場合、この量は通常の状態に戻され、通常の立方メートル (nm 3) で測定されることに注意してください。
ガス量の設定方法に応じて、次の熱容量が区別されます。
c - 質量熱容量、J / (kg × K);
c¢ - 体積熱容量、J / (nm 3 × K);
c m - モル熱容量、J / (kmol × K)。
これらの熱容量の間には、次の関係があります。
c = cm / m; m = × m;
? = ? m / 22.4; m = s¢ × 22.4 で、
ここから  ; s¢ = s × r n,
; s¢ = s × r n,
どこで u n および r n - 通常の条件下での特定の体積と密度。
等容性および等圧性熱容量
作動流体に与えられる熱量は、熱力学的プロセスの特徴によって異なります。 熱力学的プロセスに応じて、等容性と等圧性の 2 種類の熱容量が実際に重要です。
u = const での熱容量は等容性です。
c u - 質量等容熱容量、
カ¢ あなたは体積等積熱容量、
cm あなたモル等容熱容量です。
p = const での熱容量は等圧です。
c p - 質量等圧熱容量、
c¢ р - 体積等圧熱容量、
c m p - モル等圧熱容量。
p = const で実行されるプロセスで同じ温度変化がある場合、u = const で実行されるプロセスよりも多くの熱が消費されます。 これは、u = const では、体に与えられた熱は内部エネルギーの変化にのみ費やされ、p = const では、熱は内部エネルギーの増加と膨張の仕事の実行の両方に費やされるという事実によって説明されます。 マイヤーの式による質量等圧熱容量と質量等容熱容量の差
c p - c あなた=R. (1.17)
式 (1.17) の左辺と右辺にキロモル質量 m を掛けると、
cm p - cm あなた= 8314 J/(kmol×K) (1.18)
熱力学とその応用では、等圧熱容量と等容熱容量の比率が非常に重要です。
 ,
(1.19)
,
(1.19)
ここで、k は断熱指数です。
計算によると、単原子ガス k » 1.67、二原子ガス k » 1.4、三原子ガス k » 1.29 です。
価値があることは容易にわかる. に温度依存。 実際、式 (1.17) と (1.19) から、
 ,
(1.20)
,
(1.20)
および式 (1.18) および (1.19) から
 .
(1.21)
.
(1.21)
熱容量はガス温度の上昇とともに増加するため、k の値は減少し、1 に近づきますが、常にそれよりも大きいままです。
k の値がわかれば、対応する熱容量の値を決定できます。 したがって、たとえば、式 (1.20) から、
 ,
(1.22)
,
(1.22)
それ以来 p = k × s あなた、それから私たちは得る
 .
(1.23)
.
(1.23)
同様に、モル熱容量については、式 (1.21) から得られます。
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
平均および真の熱容量
気体の熱容量は温度に依存し、ある程度は圧力にも依存します。 圧力に対する熱容量の依存性は小さく、ほとんどの計算では無視されます。 熱容量の温度依存性は大きく、考慮に入れる必要があります。 この依存関係は、次の式で正確に表されます。
c = a + の t + et 2 , (1.26)
ここで、 のおよび e は、特定のガスに対して一定の値です。
多くの場合、熱工学計算では、非線形依存 (1.26) が線形依存に置き換えられます。
c = a + の t。 (1.27)
|
式(1.26)に従って熱容量の温度への依存性をグラフィカルに構築すると、これは曲線依存性になります(図1.4)。 図に示すように、各温度値には独自の熱容量値があり、これは一般に真の熱容量と呼ばれます。 数学的には、真の熱容量の式は次のように記述されます。
|
|
|
|
したがって、真の熱容量は、微小な熱量 dq と微小な温度変化 dt の比です。 言い換えれば、真の熱容量は、特定の温度でのガスの熱容量です。 図上。 図1.4において、温度t 1 での真の熱容量は、t1で示され、セグメント1-4として示され、温度t 2 -t2でセグメント2-3として示される。 式 (1.28) から、 dq=cdt. (1.29) 実際の計算では、常に決定します 最終変化時の熱量 |
温度。 t 1 から t 2 に加熱されたときの物質の単位量に報告される熱量 q は、t 1 から t 2 まで (1.29) を積分することによって求めることができることは明らかです。
 .
(1.30)
.
(1.30)
グラフでは、積分 (1.30) は 4-1-2-3 の領域で表されます。 式(1.30)で、線形依存(1.27)に従って真の熱容量の値を代入すると、次のようになります。
 (1.31)
(1.31)
どこ  - t 1 から t 2 までの温度範囲における平均熱容量。
- t 1 から t 2 までの温度範囲における平均熱容量。
 ,
(1.32)
,
(1.32)
したがって、平均熱容量は、最終的な温度変化 t 2 - t 1 に対する最終的な熱量 q の比率です。
 .
(1.33)
.
(1.33)
4-3 (図 1.4) に基づいて、図 4-1-2-3 と同じサイズの長方形 4-1¢-2¢-3 を作成すると、この長方形の高さはは平均熱容量に等しく、ここで  は温度範囲 t 1 - t 2 にあります。
は温度範囲 t 1 - t 2 にあります。
通常、平均熱容量の値は、物質の熱力学的特性の表に示されています。 ただし、これらの表の量を減らすために、0°Cからt°Cの温度範囲で決定された平均熱容量の値を提供します。
所定の温度範囲t 1 - t 2における平均熱容量の値を計算する必要がある場合、これは次のように行うことができます。
曲線c \u003d f(t)(図1.4)の下の領域0a14は、ガス温度を0°Cからt 1°Cに上げるのに必要な熱量q 1に対応します。

同様に、領域 0a23 は、温度が 0 o C から t 2 o C に上昇するときの q 2 に対応します。

したがって、q \u003d q 2 - q 1(エリア4123)は次のように表すことができます
![]() (1.34)
(1.34)
(1.34) による q の値を式 (1.33) に代入すると、任意の温度範囲での平均熱容量の式が得られます。
 .
(1.35)
.
(1.35)
したがって、平均熱容量は、式(1.35)を使用して、表の平均熱容量から計算できます。 さらに、非線形依存性 c = f(t) が得られます。 線形関係を使用して、式 (1.32) を使用して平均熱容量を求めることもできます。 値 a と のさまざまなガスの式(1.32)の式は、文献に記載されています。
作動流体から供給または除去される熱量は、次の式のいずれかを使用して計算できます。
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
どこ 

 - それぞれ、平均質量、体積、およびモル熱容量; M はガスの質量です。 n はガスのキロモル数です。 V n - 通常の状態でのガスの量。
- それぞれ、平均質量、体積、およびモル熱容量; M はガスの質量です。 n はガスのキロモル数です。 V n - 通常の状態でのガスの量。
気体の体積 V n は次のように求めることができます。 与えられた条件: pV = MRT および通常の条件: p n V n = MRT n の状態方程式を書いたので、2 番目の方程式を最初の方程式に帰します。
 ,
,
ここから  .
(1.39)
.
(1.39)
ガス混合物の熱容量
ガス混合物の熱容量は、混合物の組成が与えられ、混合物に含まれる成分の熱容量がわかっている場合に計算できます。
質量 M cm の混合物を 1 K 加熱するには、各成分の温度も 1 K 上げる必要があります。 同時に、 c i M i に等しい熱量が、質量 М i の混合物の i 番目の成分の加熱に費やされます。 混合物全体の熱量  ,
,
ここで、ci と c cm は i 番目の成分と混合物の質量熱容量です。
最後の式を M cm で割ると、混合物の質量熱容量の計算式が得られます。
 ,
(1.40)
,
(1.40)
ここで、m i は i 番目の成分の質量分率です。
同様に議論すると、混合物の体積熱容量 c¢ cm とモル熱容量 c m cm が得られます。
 (1.41)
(1.41)
ここで、c¢ i - i 番目のコンポーネントの体積熱容量、r i - i 番目のコンポーネントの体積分率、
 ,
(1.42)
,
(1.42)
ここで、c m i は i 番目のコンポーネントのモル熱容量です。
r i - i 番目の成分のモル (体積) 分率。
熱機関 (機械) では、作動流体はさまざまなガスの混合物です。 混合物の成分が互いに化学反応を起こさず、各成分がクレイペロンの状態方程式に従う場合、そのような混合物は理想気体と見なされます。
混合物を計算するには、μ cm - 平均モル質量と R c m - 混合物の比気体定数を決定する必要があります。 それらを決定するには、混合物の組成、つまり、どの成分とどの量でこの混合物を形成するか、混合物に含まれる各成分がどのようなパラメーターを持っているかを知る必要があります。
混合物の各成分は、混合物に他のガスが存在しないかのように振る舞い、混合物が存在する利用可能な体積全体を占め、独自の状態方程式に従い、いわゆる分圧を壁に加えます。混合物のすべての成分の温度は同じで、混合物の温度に等しい。
ダルトンの法則によれば、混合物の圧力 P は、混合物に含まれる個々の成分の分圧の合計に等しくなります。
ここで、n は混合成分の数です。
アマグの法則によれば、混合物の体積 V は、混合物の温度と圧力で混合物に含まれる個々の成分の部分体積の合計に等しくなります。
 , (1.21)
, (1.21)
どこで - 部分体積、m 3; V- 混合物の体積、m 3
混合物の組成は、体積(モル)または質量分率で与えられます。
i 番目の成分の体積分率は混合物の体積に対する成分の部分体積の比率です。つまり、混合物の成分の体積分率の合計は 1 です。 値が % で指定されている場合、それらの合計 = 100% です。
i 番目の成分のモル分率 n i成分 N i のキロモル数と混合物 N のキロモル数の比、つまり、 ![]() 、すなわち、各成分および混合物全体のキロモル数は、対応する成分および混合物全体と、1キロモルが占める体積との比に等しい。
、すなわち、各成分および混合物全体のキロモル数は、対応する成分および混合物全体と、1キロモルが占める体積との比に等しい。
同じ条件下での理想気体の体積は同じキロモルであることを考慮すると、置換後、次のようになります。つまり、理想気体の場合、モル分率と体積分率は数値的に等しくなります。
i 番目の成分の質量分率は混合物の質量に対する成分の質量の比率です: 、したがって、混合物の質量は成分の質量の合計に等しく、成分の質量分率の合計も等しいことがわかります。 1 (または 100%) にします。
体積分率から質量分率への変換、およびその逆の変換は、次の比率に基づいています。
![]() ,
,
ここで、ρ = μ / 22.4、kg / m 3。
したがって、i 番目のコンポーネントの質量分率は次の関係から決定されます。
 ,
,
ここで、 は混合物の密度、kg / m 3、i 番目の成分の体積分率です。
将来的には、体積分率によって決定できます。
 .
.
密度体積分率の混合物は、比率から決定されます
 、 どこ
、 どこ  , (1.22)
, (1.22)
 .
.
分圧は次の式で決定されます。
![]() また
また  (1.23)
(1.23)
成分と混合物全体の状態方程式は、次の形式をとります。
![]() ;
;
![]() ,
,
そこから、変換後、 大規模株式
 ,
,  . (1.24)
. (1.24)
混合物の密度と比容積 大規模シェア:
;  . (1.25)
. (1.25)
分圧を計算するには、次の式を使用します。
 . (1.26)
. (1.26)
質量分率から体積分率への変換は、次の式に従って実行されます。
 .
.
ガスの混合物の熱容量を決定するとき、ガス混合物を加熱(冷却)するには、混合物の各成分を加熱(冷却)する必要があると想定されています
ここで、Q i =M i c i Δt は混合物の i 番目の成分の温度変化に費やされる熱、ci は混合物の i 番目の成分の質量熱容量です。
混合物の熱容量は、比率から決定されます(混合物が質量分率で与えられている場合)
 、同様に
、同様に  . (1.28)
. (1.28)
体積分率で与えられる混合物のモルおよび体積熱容量は、次のように決定されます。
 ;
;  ;
;
 ;
; 
例 1.5乾燥空気の質量は、g O2 \u003d 23.3% 酸素とg N 2 \u003d 76.6% 窒素で構成されています。 体積による空気の組成 (r O2 および r N 2) と混合物のガス定数を決定します。
解決.
1. 表 1 から、kg/kmol および kg/kmol を見つけます。
2. 酸素と窒素の体積分率を決定します。
1.空気(混合物)のガス定数は、次の式で決まります。
 、J/kg K
、J/kg K
例 1.6. 温度が t 1 = 900 ° C から t 2 = 1200 に変化するとき、重量 % で構成される、P = const で質量 M = 2 kg のガス混合物を加熱するために必要な熱量を決定します。 ℃
解決:
1. P=const および t 1 =900 o C でのガス混合物を構成する成分の平均質量熱容量を決定します (P2 から):
1.0258 kJ/kg K; =1.1045 kJ/kg K;
1.1078 kJ/kg K; =2.1097 kJ/kg K;
2. P=const および t 1 =1200 o C でのガス混合物を構成する成分の平均質量熱容量を決定します (P2 から):
1.0509 kJ/kg K; =1.153 kJ/kg K;
1.1359 kJ/kg K; =2.2106 kJ/kg K;
3.温度範囲の混合物の平均質量熱容量を決定します:t 2 \u003d 1200°Cおよびt 1 \u003d 900°C:
4. 2 kg の混合物を P=const で加熱するための熱量:
熱力学第一法則システムの内部エネルギーの変化と、作動流体への熱供給の結果としての環境の外圧の力に対して実行される機械的仕事との間の定量的関係を確立します。
閉じた熱力学系の場合、第一法則の方程式は次の形式になります。
作動流体 (またはシステム) に与えられた熱は、体温の上昇による内部エネルギー (dU) の増加と、作動流体の膨張とその膨張による外部仕事 (dL) の実行に使用されます。音量。
第 1 法則は、dH=dq+VdP=dq-dL 0 として記述できます。
どこで dL 0 \u003d VdP - 圧力変化の基本的な仕事は、有用な外部(技術的)仕事と呼ばれます。
dU は作動流体 (システム) の内部エネルギーの変化です。これには、分子の熱運動 (並進、回転、振動) のエネルギーと、分子の相互作用のポテンシャル エネルギーが含まれます。
システムのある状態から別の状態への遷移は熱供給の結果として発生するため、作動流体が加熱され、その温度が dT だけ上昇し、体積が dV だけ増加します。
体温が上昇すると、その粒子の運動エネルギーが増加し、体の体積が増加すると、粒子の位置エネルギーが変化します。 その結果、身体の内部エネルギーは dU だけ増加するため、内部エネルギー U は身体の状態の関数であり、2 つの独立したパラメーター U=f 1 (P,V) の関数として表すことができます。 U=f 2 (P,T)、U=f 3 (υ,T)。 熱力学的プロセスにおける内部エネルギーの変化は、初期 (U 1) および最終 (U 2) 状態によってのみ決定されます。
微分形式では、内部エネルギーの変化が書かれています
a) 比容積と温度の関数として

b) 温度の関数として 、 それから
温度による C v の変化を考慮する必要がある実際の計算では、実験式と比内部エネルギー (多くの場合モル) の表があります。 理想気体の場合、混合物のモル内部エネルギー U m は次の式で決まります。
 、J/kmol
、J/kmol
質量分率で与えられる混合物の場合。 この上 内部エネルギーがある システムのプロパティとシステムの状態を特徴付ける.
エンタルピー Kamerling-Onnes によって導入された熱状態関数です (勝者) ノーベル賞、1913)、これはシステム U の内部エネルギーと、システム P の圧力とその体積 V の積の合計です。
それに含まれる量は状態関数であるため、Hも状態関数です。つまり、H \u003d f 1(P、V)です。 H=f 2 (V,T); H=f 3 (P、T)。
熱力学的プロセスにおけるエンタルピー dH の変化は、最初の H 1 状態と最終的な H 2 状態によって決まり、プロセスの性質には依存しません。 システムに 1 kg の物質が含まれている場合、比エンタルピー J/kg が適用されます。
理想気体の場合、微分方程式は次の形式になります。
したがって、比エンタルピーは式によって決定されます
熱力学の第一法則の方程式は dq=dU+Pdυ であり、仕事のタイプが膨張仕事 Pdυ=d(Pυ)-υdP のみの場合、dq=d(U+Pυ)-υdP となります。
実務№ 2
トピック: 熱容量、エンタルピー、理想気体の混合物、内部エネルギー、仕事、熱力学的プロセス。
仕事の目的:理論的なトレーニング中に得られた知識の統合、熱工学計算の実装におけるスキルの習得。
私。基本的な定義、式、方程式
1. 理想気体の混合物
ガス混合物は、互いに化学的に相互作用しないいくつかのガスの機械的混合物です。 混合物中の各ガスはガス成分と呼ばれます。 混合物に他のガスが存在しないかのように動作します。 混合物全体に均等に分配されます。 混合物の各ガスによって容器の壁に加えられる圧力は、分圧と呼ばれます。 理想気体の混合物の基本的な法則は、混合物の圧力が混合物を形成する気体の分圧の合計に等しいダルトンの法則です。
2. 内部エネルギー
体の内部エネルギーは、体を構成する微粒子の運動の運動エネルギーと、それらの位置エネルギーの組み合わせです。 相互作用が定義されています。 相互の引力または斥力。 内部エネルギーの絶対値を決定することは不可能であるため、熱力学的計算では、計算されるのは内部エネルギーの絶対値ではなく、その変化です。
![]() また
また ![]()
どこで U 1 と U 2 - 作動流体(ガス)の初期状態と最終状態の内部エネルギー。
u 1 and and 2 - ビート。 作動流体の初期状態と最終状態の内部エネルギー。
このことから、内部エネルギーの変化はプロセスの性質や経路には依存せず、変化プロセスの開始時と終了時の作動流体の状態によって決定されることがわかります。
理想気体の特徴は、その中に分子相互作用の力がないことであり、したがって内部ポテンシャルエネルギーがないことです。 U n \u003d 0およびU n \u003d 0。したがって、理想気体の内部エネルギー:
U=U k =f(T)unu u=uk =f(T)。
H. ガス工事。
熱力学では、エネルギー交換の結果として作動流体の状態が変化すること。 環境プロセスと呼ばれます。 この場合、作業体の主なパラメータが変更されます。
熱の機械的仕事への変換は、作動流体の状態を変化させるプロセスに関連しています。 気体の状態を変化させるプロセスには、膨張プロセスと収縮プロセスがあります。 気体の任意の質量 M (kg) の場合、仕事は次のようになります。
L \u003d M l \u003d Mp (v 2 - v 1) \u003d、J
ここで、l \u003d p (v 2 -v 1) J / kg は、1 kg のガスの仕事または特定の仕事です。
4.ガスエンタルピー、
エンタルピーは、作動流体 (気体) と環境との接続の位置エネルギーを特徴付けるパラメーターです。 エンタルピーと比エンタルピー:
I \u003d U + pV、J および i i \u003d および + pv、J / kg。
5.熱容量。
比熱容量は、特定の温度範囲でガスを 1 ° C 加熱するために、1 kg のガスに供給しなければならない熱量です。
比熱容量は、質量、体積、およびキロモルです。 質量 C、体積 C、キロモル C の熱容量の間には関係があります。
 ;
; 
どこで Vo 22.4 m 3 / kmol - ビート。 通常の状態でのガスの量。
マスウド。 ガス混合物の熱容量:

容積測定 比熱混合ガス:

ガス混合物のキロモル比熱:

6. 熱量を求める式
作動流体 (ガス) によって放出または吸収される熱量は、次の式で求めることができます。
Q \u003d M C m (t 2 -t 1)、J または Q \u003d VC (t-t)、J、ここで、M および V はガスの重量または体積、kg または m 3 です。
t u t - プロセスの最後と最初のガス温度°С;
C と C - 質量と体積の平均ビート。 ガスの熱容量
t cpで\u003d J / kgKまたはJ / m 3 K
7. 熱力学第一法則
この法則は、熱と機械的仕事の相互変換を考慮しています。 この法則によれば、熱は機械的仕事に変換され、機械的仕事は厳密に等しい量で熱に変換されます。 熱と仕事の等価方程式の形式は次のとおりです。
熱と仕事の等価原理を考慮に入れると、任意の質量のガスの熱収支方程式は次のようになります。
Q \u003d U + Lおよびq \u003d u + l \u003d u -u + l
問題解決Ⅱ
タスク #1 (#1)
大気中の乾燥空気は、次のようなおおよその質量組成を持っています: g 02 =23.2%、g N 2 =76.8%。
気圧計を使用して、空気が P = 101325 Pa の場合、空気の体積組成、そのガス定数、見かけの分子量、酸素と窒素の分圧を決定します。
空気の体積組成を決定します。
 ;
; ;
;
ここで、r は質量分率です。
m は相対分子量です。
g は体積分率です。
空気。 =m O2 r O2 +m N2 r N2 = 32 0.209 + 28 0.7908=6.688+22.14=28.83;

 ;
;
ここで、R 0 はガス定数です。
さまざまなガスの分圧を決定します。
P O 2 \u003d P cm r O2 \u003d 101325 0.209 \u003d 21176.9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0.7908 \u003d 80127.81 (Pa);
どこで P O 2 、 P N 2 - 分圧;
P cm は混合物の圧力です。
タスク #2 (#2)
容器は仕切りによって2つの部分に分けられ、その容積はV 1 =1.5m 3 およびV 2 =1.0m 3 である。 体積V 1 の最初の部分は、P 1 =0.5MPaおよびt 1 =30℃でCO 2 を含む。 ボリューム V 2 の 2 番目の部分は、P 2 =0.2 MPa および t 2 =57°C で O 2 を含みます。 CO 2 と O 2 の質量分率と体積分率、混合物の見かけの分子量、およびパーティションが取り除かれ、混合プロセスが完了した後のガス定数を決定します。
個々のガス定数を決定します。
これを行うために、相対分子量を決定します:m(CO 2)\u003d 32 + 12 \u003d 44; m(O2)=32;

 ;
;
![]()
 ;
;
クライペロンの特性方程式に従って、気体の質量を決定します。
 (kg);
(kg);
 (kg);
(kg);
質量分率を決定します。


体積分率を決定します。


空気の見かけの分子量を決定します。
空気。 \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0.21 + 44 0.79 \u003d 6.72 + 34.74 \u003d 41.48;
空気の個々の気体定数 (R) を決定します。

 ;
;
タスク #3 (#6)
容積300リットルの容器には、圧力P 1 \u003d 0.2 MPaおよびt 1 \u003d 20 0 Cの酸素があります。酸素の温度がt 2 \u003d 300 0 Cに上昇するには、どれだけの熱を供給しなければなりませんか? 容器内の圧力はどのくらいになりますか? 計算のために、n.o.での酸素の平均体積比熱を取ります。 C 02 \u003d 0.935 
シャルルの法則に従って、プロセスの最終的な圧力を決定します。
;  (Pa);
(Pa);
ここで、P、T はガス パラメータです。
酸素 (R) の個々のガス定数を決定します。

 ;
;
プロセスは等容性であるため、適切な式に従って供給する必要がある熱量を決定します。Q v \u003d M C cv (T 2 -T 1) このため、Claiperon の特性方程式に従って、質量を決定します。ガスの
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
タスク #4 (#7)
一定の過圧 P ex で 2m 3 の空気を加熱するためにどれだけの熱を消費しなければならないか。 \u003d 0.2 MPa の温度から 100 ℃ の温度まで 0.2 ℃. この場合、空気はどのような仕事をしますか? 計算のために、大気圧P at。 \u003d 0.1 MPa、空気の平均質量等圧熱容量 C pm \u003d 1.022  ; 空気の見かけの分子量 M air を念頭に置いてガス定数を計算します。 =29.
; 空気の見かけの分子量 M air を念頭に置いてガス定数を計算します。 =29.
空気の個々のガス定数を決定します。

 ;
;
絶対圧力は、過剰圧力と大気圧の合計 P=P est に等しくなります。 + Pで。 =0.1+0.2=0.3MPa
 (kg);
(kg);
プロセスは等圧であるため、対応する式に従って Q と L を決定します。
ゲイ・リュサックの法則に従って、最終的なボリュームを決定します。
 m 3;
m 3;
Q \u003d M C pm(T 2 -T 1)\u003d 5.56 1022 400 \u003d 2272928(J);
L \u003d P (V 2 -V 1) \u003d 300000 2.15 \u003d 645000 (J).
タスク #5 (#8)
シリンダ内には、圧力 P=0.5 MPa、温度 t 1 =400 ℃ の空気があります。プロセスの最後に温度 t 2 =0 ℃ になるように、熱は P = const で空気から取り除かれます。セット 空気が入っているシリンダーの容積 V 1 \u003d 400l.
除去された熱量、最終体積、内部エネルギーの変化、完全圧縮仕事 C pm =1.028 を決定します。  .
.
プロセスは等圧であるため、ゲイ・リュサックの法則に従って、最終的なボリュームを決定します。
 m 3;
m 3;
クライペロンの特性方程式に従って、気体の質量を決定します。
前の問題より R=286.7 
 (kg);
(kg);
放出される熱量を決定します。
Q=M C pm (T 2 -T 1)=1.03 1028 (273-673)=-423536 (J);
費やされた作業量を決定します。
L=P (V 2 -V 1)= 500,000 (0.16-0.4)=-120,000 (J);
総量を決定する式から、内部エネルギー量の変化を決定します。
![]() ; (ジ)
; (ジ)
問題 #6 (#9)
圧力P 1 =1.1MPaおよびt 1 =25秒で体積V 1 =0.02m3を有する空気は、可動ピストンを備えたシリンダ内で圧力P 2 =0.11MPaまで膨張する。 シリンダー内で膨張が発生した場合、最終体積 V 2、最終温度 t 2 、空気が行う仕事、および供給される熱を求めます。
a) 等温的に
b) 断熱指数 k=1.4 による断熱
c) ポリトロープ指数 n=1.3 のポリトロープ
等温プロセス:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0.02 1.1 / 0.11 \u003d 0.2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1.1 10 6 0.02Ln(0.2/0.02)=22000 J
断熱プロセス:
V 1 / V 2 \u003d(P 2 / P 1)1 / k
V 2 \u003d V 1 /(P 2 / P 1)1 / k \u003d 0.02 /(0.11 / 1.1)1 / 1.4 \u003d 0.1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0.11 / 1.1) 1.4-1 / 1.4 298 \u003d 20.32k
C v \u003d 727.4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1)=2.0275 10 6 J
ポリトロープ プロセス:
V 1 / V 2 \u003d(P 2 / P 1)1 / n
V 2 \u003d V 1 /(P 2 / P 1)1 / n \u003d 0.02 /(0.11 / 1.1)1 / 1.3 \u003d 0.118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0.11 / 1.1) 1.3-1 / 1.3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118)=30000J
Q=(k-n/k-1) l M=((1.4-1.3)/(1.4-1)) 30000=7500J
文学:
1. エネルギー、モスクワ、1975 年。
2. リトビン A.M. 「熱工学の理論的基礎」、出版社「エネルギー」、モスクワ、1969 年。
3. Tugunov P.I.、Samsonov A.A.、「熱工学、熱機関、蒸気動力設備の基礎」、Nedra 出版社、モスクワ、1970 年。
4. Krutov V.I.、「熱工学」、出版社「Engineering」、モスクワ、1986 年。
混合ガス. 気体の熱容量
ガス混合物は、互いに化学的に相互作用しないいくつかのガスの機械的混合物として理解されています。 理想気体の混合物は、以下に関するすべての法則に従います。 理想気体. ガス混合物の組成は、混合物に含まれる各ガスの量によって決まり、質量または体積分率で指定できます。
ここで、 は - 番目の成分の質量、 は - 番目の成分の体積、 および はそれぞれ混合物全体の質量と体積です。
それは明らかです
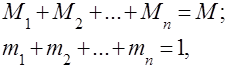
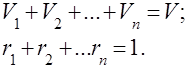
ガス混合物に関する実際的な問題を解決する便宜上、ガス混合物の見かけの分子量の概念が導入されています。これは、混合物の個々の成分の実際の分子量の平均質量です。
混合気体の状態方程式は、次の形式になります。
ガス混合物は、普遍的なガス定数の概念に従います
ガス混合物の圧力と混合物に含まれる個々の成分の分圧との関係は、ダルトンの法則によって確立されます。
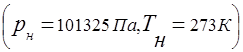
1 気体は、圧力と温度によって質量が異なります。 この点で、体積熱容量は常に、通常の状態で 1 に含まれるガスの質量を指します。 この場合、さまざまな気体の 1 kmole の体積は 22.4 / kmol であり、普遍気体定数は です。 ガスへの熱供給の方法に応じて、等圧熱容量と等容熱容量があります。 これらの量の比率は断熱指数と呼ばれます
熱容量 と は、マイヤーの関係によっても関連付けられています
から までの温度範囲で 1 kg のガスを加熱するプロセスで費やさなければならない熱量は、式によって決定されます。
ここで、 と は、それぞれ 0°- と 0°- 内の平均熱容量です。
(kg) または () ガスがプロセスに含まれている場合、
ガス混合物の熱容量は、次の式で決定する必要があります。
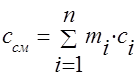
質量 - ;
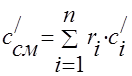
体積 -;
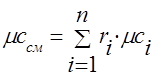
大臼歯 - 。
ボイラーユニット内の燃料燃焼生成物であるガスの熱を利用するために、燃料燃焼に必要な空気のエアヒーターがボイラーユニットのガスダクトに設置されています(図1)。 ボイラーを出るガスは、ある温度でエアヒーターに入り、冷却されて空気に熱を放出します。 ボイラーユニットのガスダクトでは、排煙装置の動作の影響を受けて、圧力が大気圧よりわずかに低く設定されます。 エアヒーター内の空気は温度から温度まで加熱されます。
煙道ガス
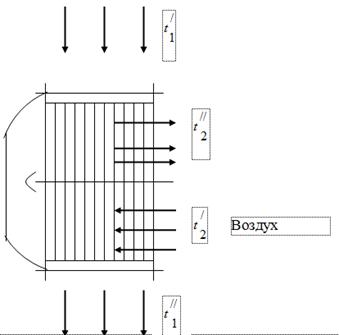
ボイラーユニットをテストすると、次のデータが得られました。
エアヒーターへの入口でのガスの温度 = 450 °C。
エアヒーターの出口でのガスの温度 = 150 ° C.
エアヒーターへの入口での空気温度 = 26 ° C.
エアヒーターの出口での空気温度 = 260 ° C.
煙道ガスの体積組成 - = 11.5%; = 6.5%; = 17.2%; = 64.8%
でのガスの 1 時間あたりの消費量は 50 ·/h です。
ガスダクト内の真空 - 15 mm の水。 美術。
気圧 760 mm Hg。 美術。
定義:
煙道ガスの見かけの分子量;
煙道ガスガス定数;
煙道ガスを構成する個々の成分の重量(質量)分率。
成分の分圧:
毎時の空気の流れ。
気体が発する熱はすべて空気に吸収されると仮定します。
熱容量の温度依存性は曲線的であると考えられます。
1. 排ガスの見かけの分子量
0.115 44 + 0.065 18 + 0.172 32 + 0.648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. 排ガスガス定数
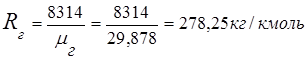
3. 質量分率ガス成分
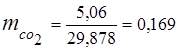
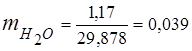
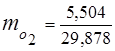
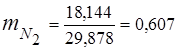
4. 成分の分圧
計算結果が表に入力されます
|
オプション |
混合ガス |
|||
|
|
||||
|
|
||||
|
|
5. 毎時の空気消費量
エアヒータの熱収支式から空気消費量を求める
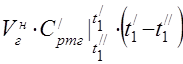
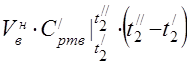
450 °C での平均モル熱容量
温度範囲 0 ~ 450 ° C でのコンポーネントの平均比熱容量。













 .
(1.28)
.
(1.28)