理想気体の分子動力学理論
知ってますか、
思考実験、ゲダンケン実験とは?
それは実在しない実践であり、別世界の体験であり、実際には存在しないものへの想像力です。 思考実験は空想のようなものです。 彼らはモンスターを産みます。 仮説の実験的テストである物理的実験とは異なり、「思考実験」は、証明されていない前提を証明済みのものとして使用することによって、実際には論理自体に違反する論理構造を操作して、実験的テストを望ましい未検証の結論に魔法のように置き換えます。代用。 したがって、「思考実験」の申請者の主な仕事は、実際の物理的実験を彼の「人形」に置き換えることによって聞き手または読者を欺くことです。
物理学を架空の「思考実験」で埋め尽くすと、ばかげた、超現実的で、混乱を招く世界像が生まれました。 真の研究者は、そのような「ラッパー」を実際の値と区別する必要があります。
相対主義者と実証主義者は、「思考実験」は理論の一貫性をテストするための非常に便利なツールであると主張しています (私たちの心の中にも生じます)。 検証は、検証対象とは独立した情報源によってのみ実行できるため、この点で彼らは人々を欺きます。 この声明自体の理由は、声明の中に申請者に見える矛盾がないため、仮説の申請者自身が彼自身の声明のテストになることはできません。
これは、SRT と GTR の例に見ることができます。これらは、科学と宗教を支配する一種の宗教になりました。 世論. それらに矛盾する事実の量は、アインシュタインの公式を克服することはできません。 」)。
「思考実験」が主張できる最大のことは、申請者自身の、多くの場合、決して真ではない論理の枠内での仮説の内部一貫性のみです。 慣行の遵守はこれをチェックしません。 実際のテストは、実際の物理実験でのみ行うことができます。
実験は実験なのです。なぜなら、それは思考の洗練ではなく、思考のテストだからです。 それ自体で一貫している思考は、それ自体をテストすることはできません。 これは、Kurt Gödel によって証明されています。
希薄ガスでは、分子間の距離はそれらのサイズの何倍も大きくなります。 この場合、分子間の相互作用は無視でき、分子の運動エネルギーはそれらの相互作用のポテンシャルエネルギーよりもはるかに大きくなります。
気体状態の物質の特性を説明するために、実際の気体ではなく、その物理モデル、つまり理想気体が使用されます。 モデルは次のことを前提としています。
分子間の距離は直径よりもわずかに大きくなります。
分子は弾性ボールです。
分子間に引力はありません。
分子が互いに衝突し、容器の壁と衝突すると、反発力が作用します。
分子運動は力学の法則に従います。
理想気体 mkt の基本方程式:
MKT の基本式により、分子の質量、速度の 2 乗の平均値、および分子の濃度が分かれば、気体の圧力を計算できます。
理想ガス圧これは、容器の壁と衝突する分子が、弾性体としての力学の法則に従ってそれらと相互作用するという事実にあります。 分子が容器の壁に衝突すると、壁に垂直な軸 OX 上の速度ベクトルの速度 v x の投影は、その符号を反対に変更しますが、絶対値は一定のままです。 したがって、壁との分子の衝突の結果として、OX 軸上のその運動量の射影は mv 1x = -mv x から mv 2x =mv x に変化します。 壁との衝突による分子の運動量の変化により、壁の側面から分子に作用する力 F 1 が発生します。 分子の運動量の変化は、この力の運動量に等しくなります。
衝突中、ニュートンの第 3 法則に従って、分子は力 F 1 に絶対値が等しく、反対方向に向かう力 F 2 で壁に作用します。
多くの分子があり、それぞれが衝突すると壁に同じ運動量を与えます。 瞬時にインパルスを送信します 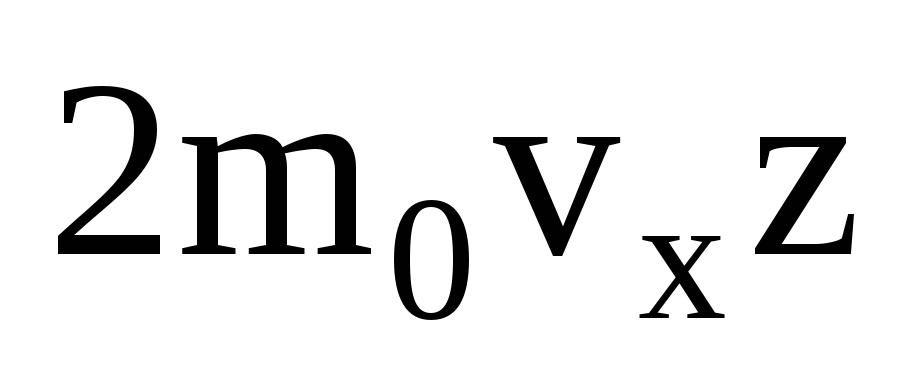 ここで、z はすべての分子が壁に衝突した回数で、ガス内の分子の濃度、分子の速度、および壁の表面積に比例します。
ここで、z はすべての分子が壁に衝突した回数で、ガス内の分子の濃度、分子の速度、および壁の表面積に比例します。 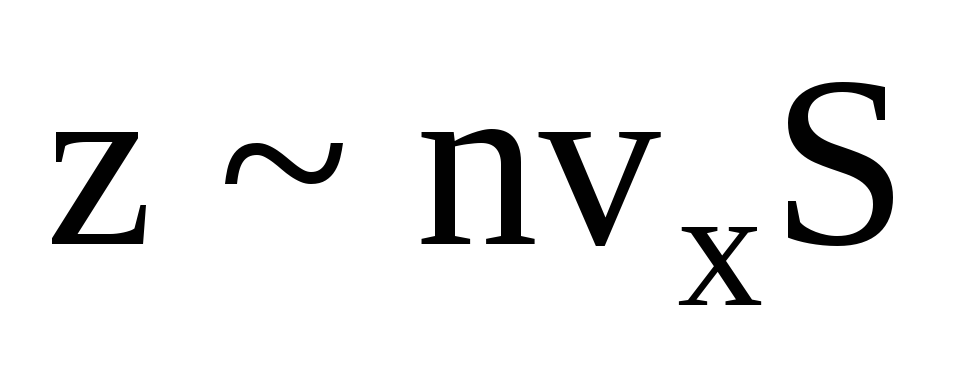 . 分子の半分だけが壁に向かって移動し、残りは反対方向に移動します。
. 分子の半分だけが壁に向かって移動し、残りは反対方向に移動します。 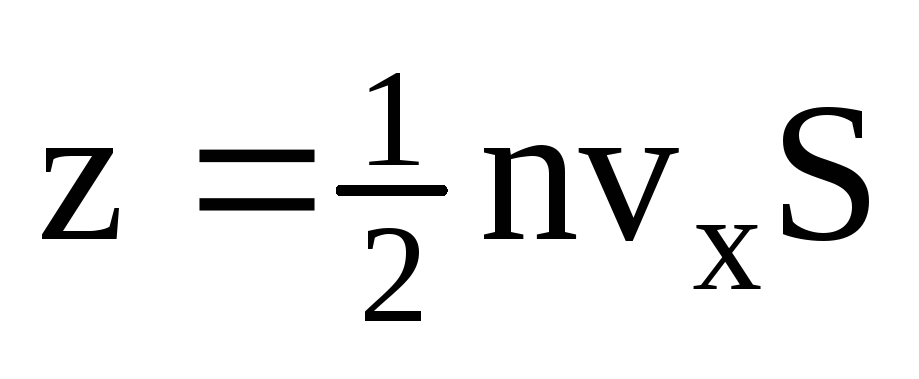 . 次に、1 秒間に壁に移動した総運動量:
. 次に、1 秒間に壁に移動した総運動量: 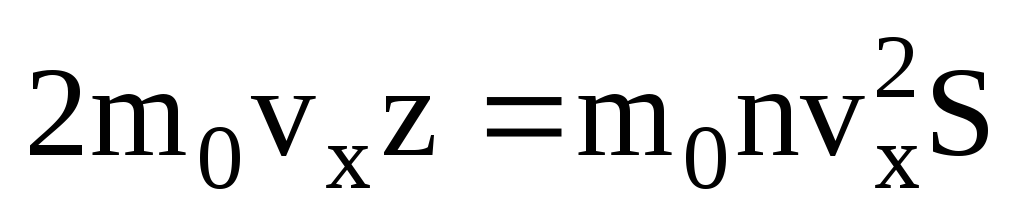 . ニュートンの第 2 法則によると、単位時間あたりの物体の運動量の変化は、物体に作用する力に等しくなります。
. ニュートンの第 2 法則によると、単位時間あたりの物体の運動量の変化は、物体に作用する力に等しくなります。
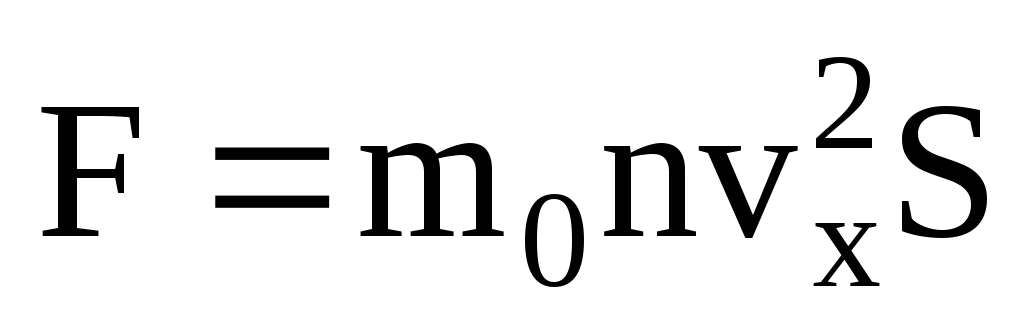
すべての分子が同じ速度を持っているわけではないことを考えると、壁に作用する力は速度の平均二乗に比例します。 分子はすべての方向に移動するため、速度射影の二乗の平均値は等しくなります。 したがって、速度射影の平均二乗は次のようになります。 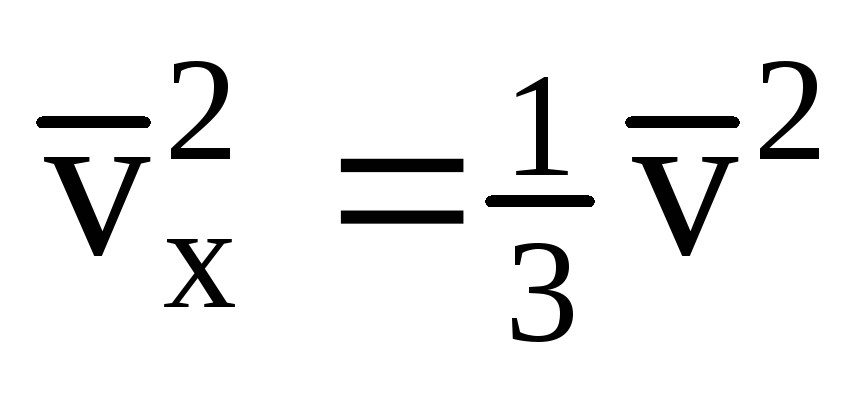 ;
;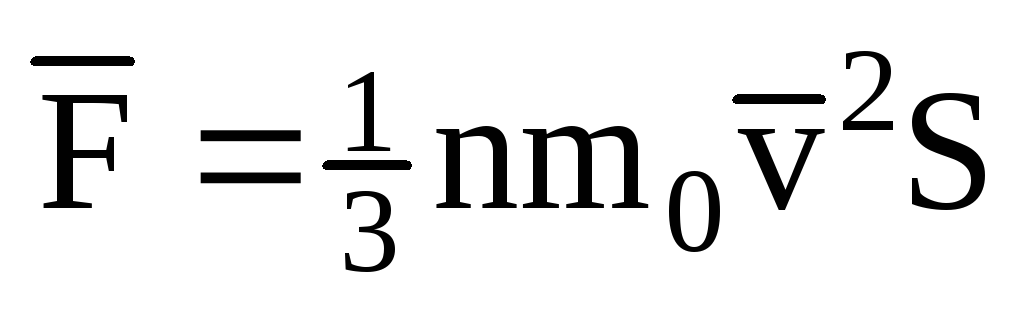 . 次に、容器の壁にかかるガスの圧力は次のとおりです。
. 次に、容器の壁にかかるガスの圧力は次のとおりです。
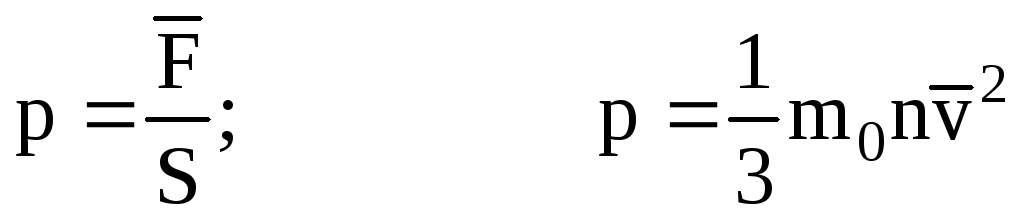 - MKT の基本式。
- MKT の基本式。
分子の並進運動の運動エネルギーの平均値を表す 理想気体:
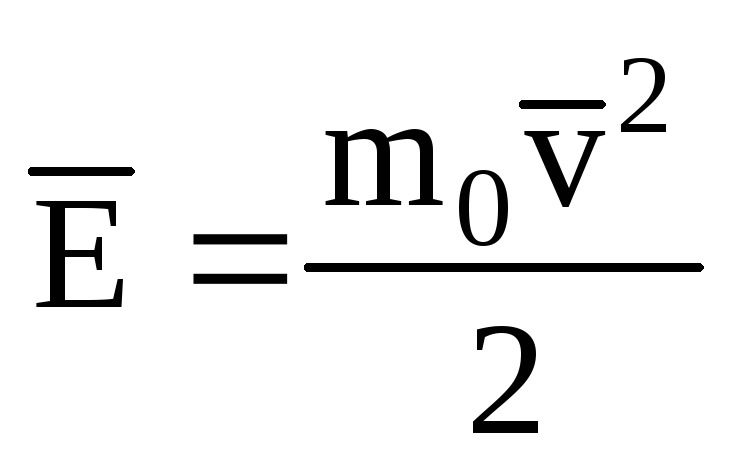 、 我々が得る
、 我々が得る
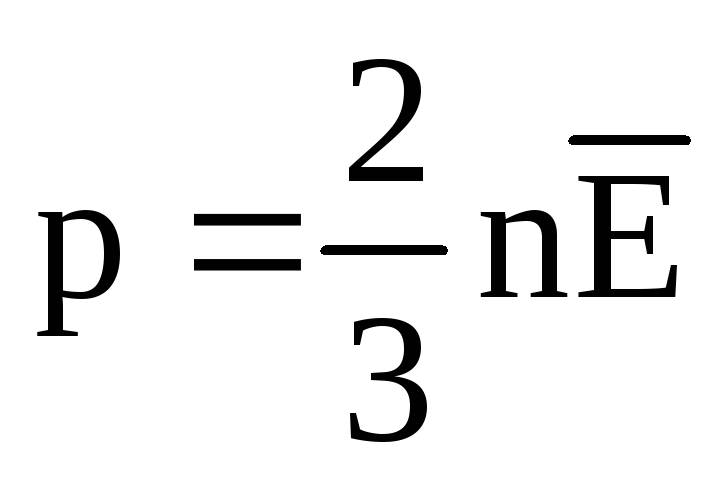
温度とその測定:
理想気体の基本的な MKT 式は、簡単に測定できる巨視的パラメーター (圧力) を、分子の平均運動エネルギーや濃度などの微視的気体パラメーターに関連付けます。 しかし、圧力だけを測定しただけでは、分子の運動エネルギーの平均値や分子の濃度を個別に見つけることはできません。 したがって、ガスの微視的なパラメーターを見つけるには、分子の平均運動エネルギーに関連する他の物理量の測定が必要です。 この値は 温度.
巨視的な物体または巨視的な物体のグループは、一定の外部条件下で、自然に熱平衡状態になります。 熱平衡 -これは、すべての巨視的パラメータが任意の長い時間変化しない状態です。
温度は、物体のシステムの熱平衡状態を特徴付けます。互いに熱平衡にあるシステムのすべての物体は同じ温度を持ちます.
温度を測定するには、温度に応じた巨視的な量 (体積、圧力、電気抵抗など) の変化を使用できます。
実際には、ほとんどの場合、液体(水銀またはアルコール)の体積の温度依存性が使用されます。 温度計を校正するときは、通常、氷が溶ける温度を基準点 (0) とします。 2 番目の一定点 (100) は、通常の大気圧 (摂氏スケール) での水の沸点です。 異なる液体は加熱されたときの膨張が異なるため、このようにして確立されるスケールは、特定の液体の特性にある程度依存します。 もちろん、0℃と100℃はどの温度計でも一致しますが、50℃は一致しません。
液体とは異なり、すべての希薄ガスは、加熱すると同じように膨張し、温度の変化とともに同じように圧力を変化させます。 したがって、物理学では、合理的な温度スケールを確立するために、一定の体積での一定量の希薄ガスの圧力の変化、または一定の圧力でのガスの体積の変化が使用されます。 このスケールは時々呼ばれます 理想ガス温度目盛り.
熱平衡では、すべての気体の分子の並進運動の平均運動エネルギーは同じです。 圧力は、分子の並進運動の平均運動エネルギーに正比例します。 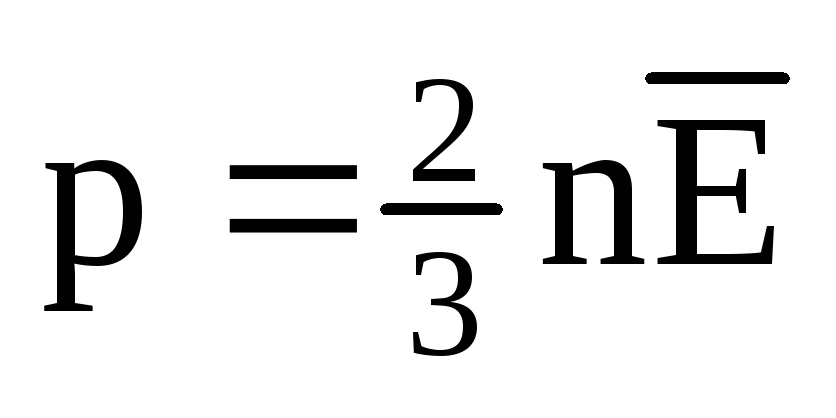 . 熱平衡では、特定の質量のガスの圧力とその体積が固定されている場合、ガス分子の平均運動エネルギーは、温度のように厳密に定義された値を持たなければなりません。 なぜなら
. 熱平衡では、特定の質量のガスの圧力とその体積が固定されている場合、ガス分子の平均運動エネルギーは、温度のように厳密に定義された値を持たなければなりません。 なぜなら 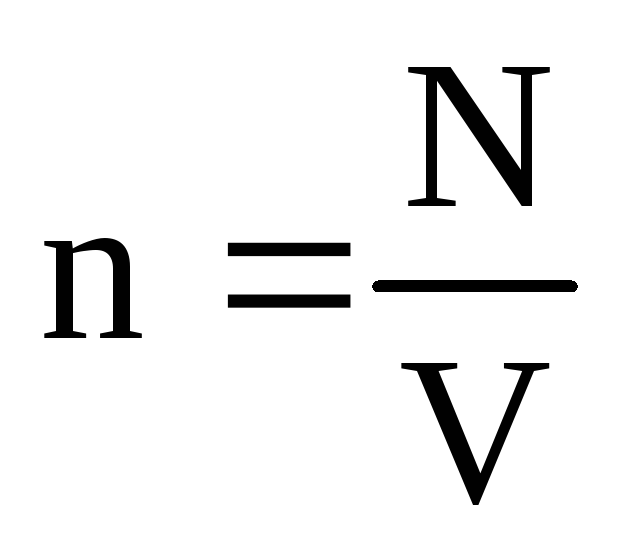 、 それから
、 それから 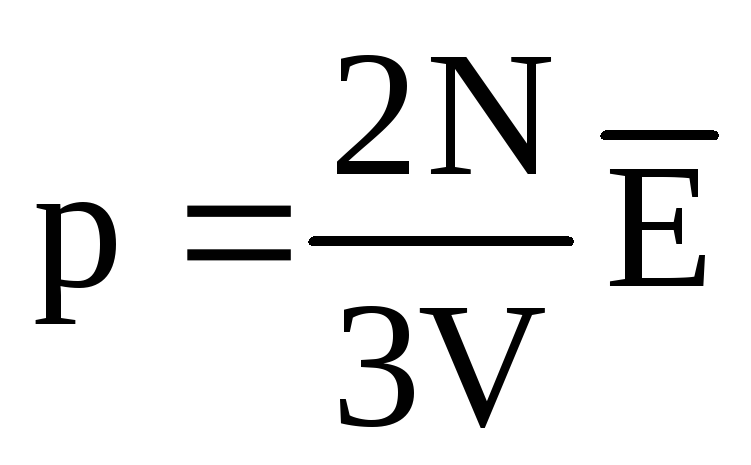 、 また
、 また 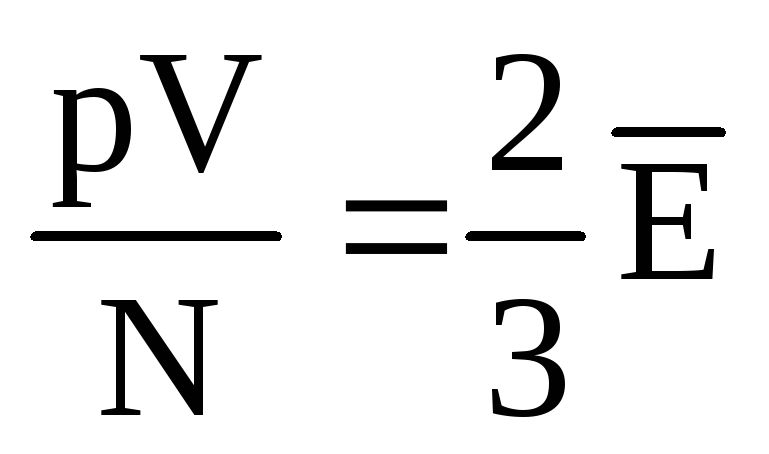 .
.
示す 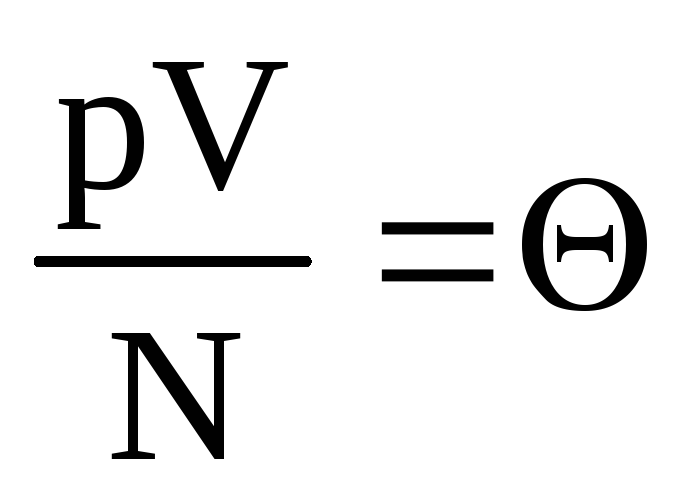 . 価値
. 価値  温度とともに増加し、温度以外には依存しません。 したがって、温度の自然な尺度と考えることができます。
温度とともに増加し、温度以外には依存しません。 したがって、温度の自然な尺度と考えることができます。
分子動力学理論は、 と呼ばれる特別な理想的なオブジェクトの動作と特性を説明します。 理想気体. この物理モデルは、物質の分子構造に基づいています。 分子理論の創造は、R. クラウジウス、J. マクスウェル、D. ジュール、L. ボルツマンの業績に関連しています。
理想気体. 理想気体の分子動力学理論 は、次の前提に基づいて構築されています。
原子と分子は次のように見ることができます 質点、連続して動いています。
ガス分子の固有の体積は、容器の体積に比べて無視できます。
すべての原子と分子は識別可能です。つまり、原則として、各粒子の動きを追跡できます。
それらの間のガス分子の衝突の前に、相互作用力はなく、分子同士の間および容器の壁との分子の衝突は完全に弾性であると想定されます。
気体の各原子または分子の運動は、古典力学の法則によって記述されます。
理想気体について得られた法則は、実在気体の研究に使用できます。 このために、実在気体の特性が理想気体の特性に近い理想気体の実験モデルが作成されます (たとえば、低圧および高温で)。
理想気体の法則
ボイル・マリオットの法則:
一定の温度で一定の質量の気体がある場合、気体の圧力とその体積の積は一定の値になります。 pV =定数 , (1.1)
で T = 定数 , m = 定数 .
数量間の関係を示す曲線 Rと Ⅴ、一定温度での物質の特性を特徴付け、と呼ばれます 等温線これは双曲線であり(図1.1)、一定温度で進行するプロセスは等温と呼ばれます。
ゲイ・リュサックの法則:
一定圧力での一定質量の気体の体積は、温度に比例して変化します
V = V 0 (1 + t ) で P =定数 , m = 定数 . (1.2)

p = p 0 (1 + t ) で V =定数 , m = 定数 . (1.3)
式 (1.2) と (1.3) では、温度は摂氏スケール、圧力と体積で表されます。
0С、一方
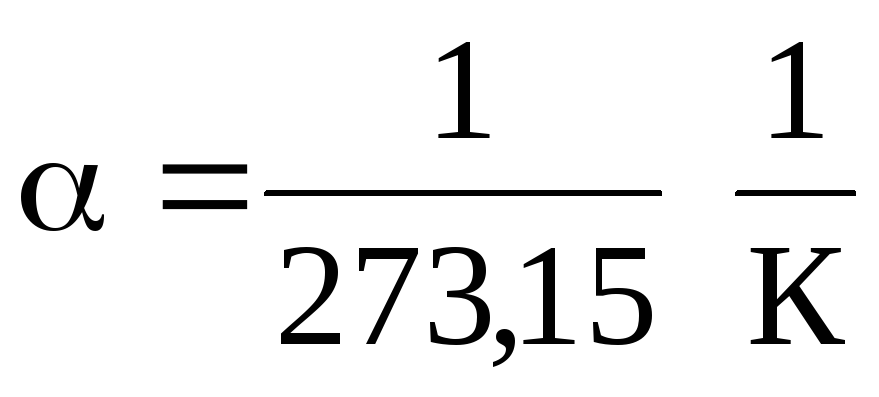 .
.
一定の圧力で行われるプロセスは呼ばれます 等圧、線形関数として表すことができます (図 1.2)。
一定の体積で行われるプロセスは呼ばれます アイソコリック(図 1.3)。
式 (1.2) と (1.3) から、等圧線と等積線が点で温度軸と交差することがわかります。 t =1/ \u003d - 273.15С . 原点をこの点に移動すると、ケルビン スケールに移動します。
式 (1.2) および (1.3) への導入 熱力学的温度、Gay-Lussac の法則は、より便利な形式を与えることができます。
Ⅴ = Ⅴ 0 (1+t) = = Ⅴ 0 = =Ⅴ 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
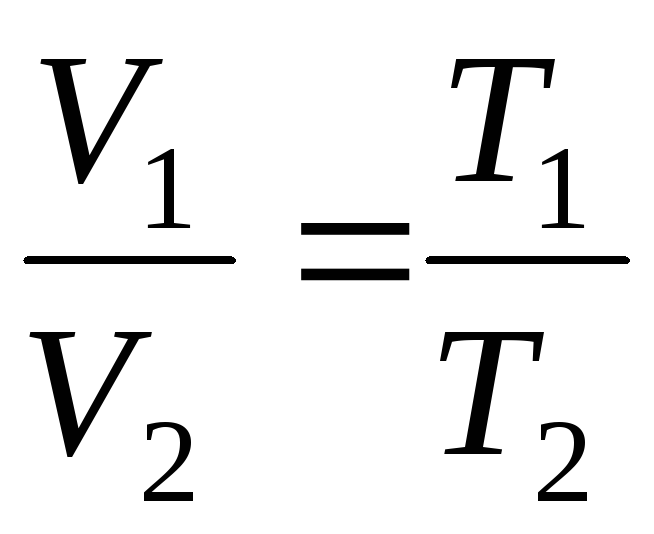 で
p=定数、m=定数
;
(1.4)
で
p=定数、m=定数
;
(1.4)
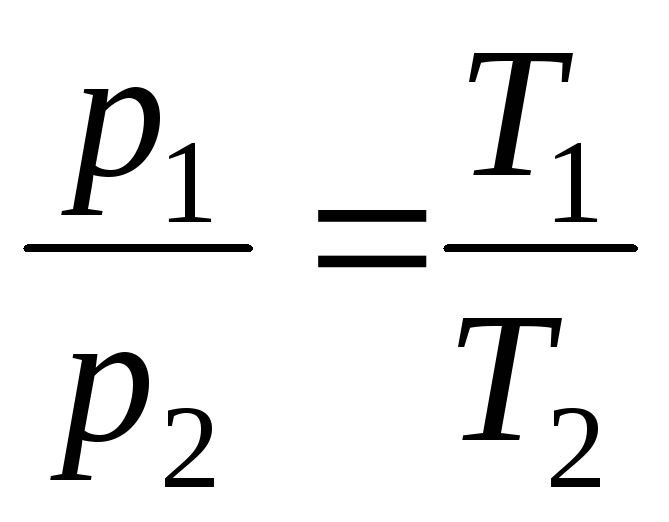 で V = 定数、m = 定数
,
(1.5)
で V = 定数、m = 定数
,
(1.5)
ここで、インデックス 1 と 2 は、同じアイソバーまたはアイソコア上にある任意の状態を指します .
アボガドロの法則:
同じ温度と圧力の気体のモル数は同じ体積を占めます。
通常の状態では、この体積は Ⅴ,0 \u003d 22.4110 -3 m 3 /モル . 定義上、1モルで さまざまな物質に等しい、同じ数の分子を含む 定数アボガドロ:N あ = 6,02210 23 モル -1 .
ダルトンの法則:
混合気圧力 理想気体分圧の合計に等しい R 1 , R 2 , R 3 … R n、それに含まれるガス:
p = p 1 + p 2 + R 3 + …+p n .
分圧 – これは 組成物中のガスが生成する圧力 混合ガス同じ温度で混合物の体積に等しい体積を単独で占める場合。
理想気体の状態方程式
(クラペイロン・メンデレーエフ方程式)
温度、体積、圧力の間には明確な関係があります。 この関係は、関数の依存関係によって表すことができます。
f(p, V, T)= 0.
次に、各変数 ( p、v、t) は、他の 2 つの変数の関数です。 物質の各相状態 (固体、液体、気体) に対する機能依存性のタイプは、実験的に見出されます。 これは非常に骨の折れるプロセスであり、状態方程式は、希薄な状態にあるガスに対してのみ確立されており、一部の圧縮ガスでは近似形式で確立されています。 気体状態ではない物質の場合、この問題はまだ解決されていません。
フランスの物理学者 B. クラペイロンがもたらした 理想気体の状態方程式、Boyle-Mariotte、Gay-Lussac、Charles の法則を組み合わせることにより、
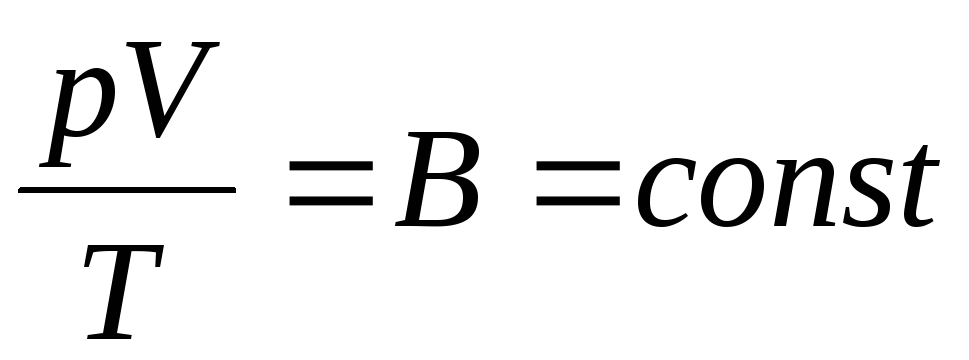 . (1.6)
. (1.6)
式 (1.6) はクラペイロン方程式です。 ではガス定数です。 ガスごとに異なります。
DI。 メンデレーエフは、クラペイロンの式をアボガドロの法則と組み合わせ、式 (1.6) を 1 モルと見なし、モル体積を使用しました。 Ⅴ . アボガドロの法則によると、同じ Rと Tすべてのガスのモルは同じモル体積を占めます Ⅴ .
.
したがって、定数 ですべての理想気体で同じになります。 この定数は通常 Rそして等しい R=
8,31
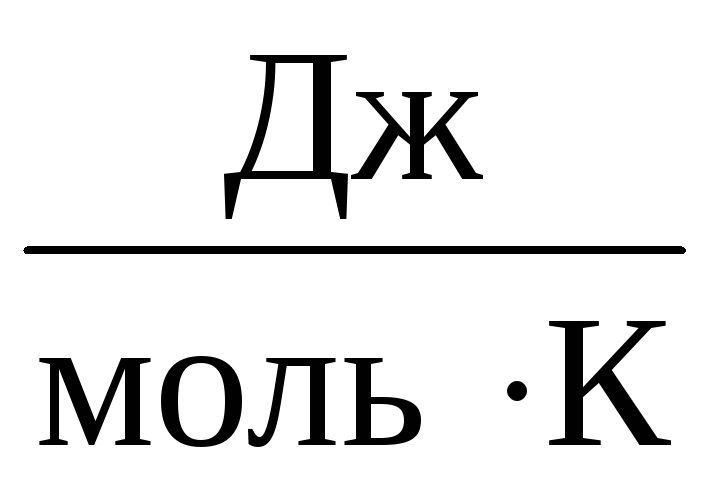 .
.
クラペイロン・メンデレーエフ方程式 次の形式があります。
p Ⅴ . = R T.
1 モルの気体の式 (1.7) から、 任意の質量のガスのクラペイロン-メンデレーエフ方程式に:
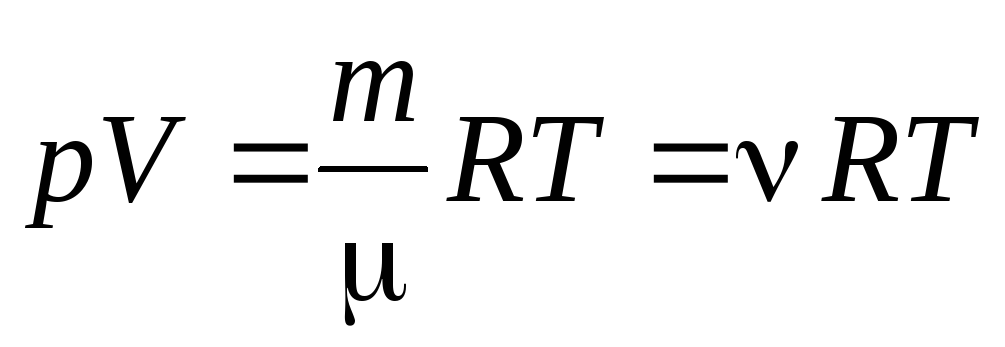 , (1.7)
, (1.7)
どこ
–
モル質量
(物質 1 モルの質量、kg/mol); メートル
ガスの質量;
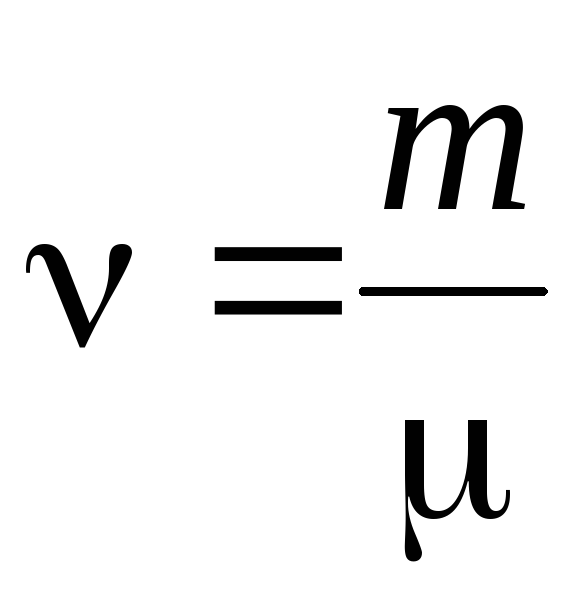 - 物質の量 .
- 物質の量 .
多くの場合、理想気体の状態方程式の別の形式が使用されます。 ボルツマン定数: 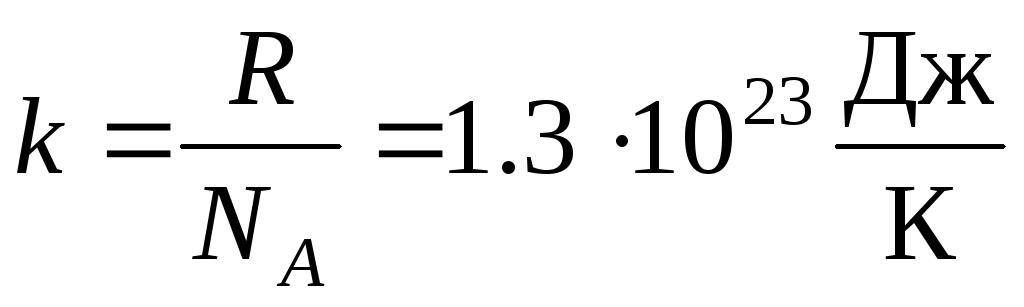 .
.
式 (1.7) は次のようになります。
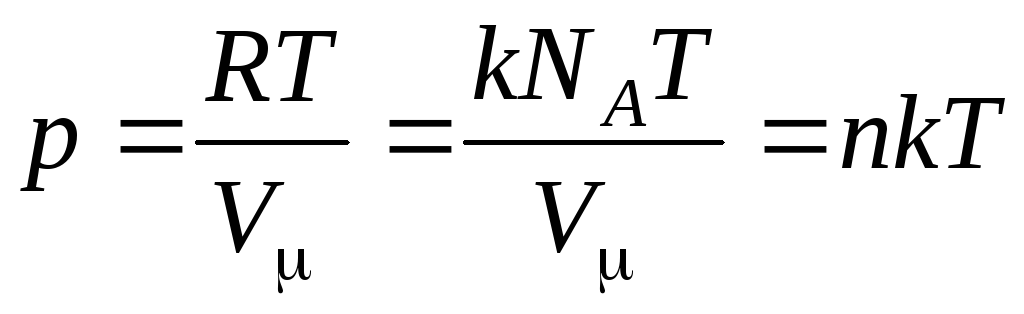 ,
(1.8)
,
(1.8)
どこ
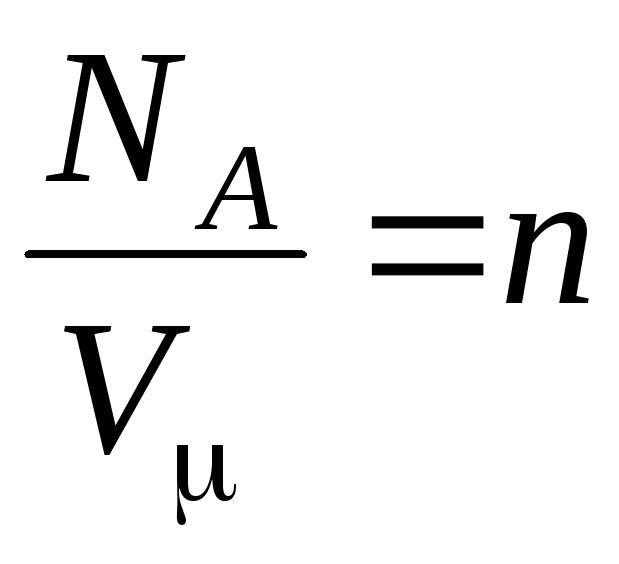 –
分子の濃度 (単位体積あたりの分子数)。 この式から、理想気体の圧力は、その分子の濃度または気体の密度に正比例することがわかります。 同じ温度と圧力では、すべての気体は単位体積あたり同じ数の分子を含んでいます。 通常の状態で1 m 3に含まれる分子の数は呼ばれます
ロシュミット数:
–
分子の濃度 (単位体積あたりの分子数)。 この式から、理想気体の圧力は、その分子の濃度または気体の密度に正比例することがわかります。 同じ温度と圧力では、すべての気体は単位体積あたり同じ数の分子を含んでいます。 通常の状態で1 m 3に含まれる分子の数は呼ばれます
ロシュミット数:
N L = 2.68 10 25 m -3.
分子動力学の基本方程式
理想気体の理論
最も重要なタスク 気体の動力学理論は、理想気体の圧力の理論計算です 分子動力学の概念に基づいています。 理想気体の分子動力学理論の基本方程式は、次を使用して導出されます。 統計的方法.
ガス分子はランダムに移動し、ガス分子間の相互衝突の数は、容器の壁への衝突の数に比べて無視できるものであり、これらの衝突は完全に弾性的であると想定されています。 船の壁に、いくつかの基本エリア Sガス分子がこの領域に及ぼす圧力を計算します。
実際には、分子がさまざまな角度でサイトに移動する可能性があるという事実を考慮する必要があります。 さまざまな速度、さらに、衝突ごとに変化する可能性があります。 理論計算では、分子の無秩序な運動が理想化され、相互に垂直な 3 つの方向に沿った運動に置き換えられます。
立方体の形の容器を考えると、 N気体分子が 6 方向に移動する場合、いつでもすべての分子の数の 1/3 がそれぞれの方向に沿って移動し、それらの半分 (つまり、すべての分子の数の 1/6) が移動することが容易にわかります。一方向、および後半(1/6も)-反対方向。 衝突するたびに、個々の分子がサイトに対して垂直に移動し、反射して運動量をそれに転送しますが、その運動量 (運動量) は次の量だけ変化します。
R 1 =メートル 0 v – (– メートル 0 v) = 2 メートル 0 v.
サイト上の特定の方向に移動する分子の影響の数は次のようになります。 N = 1/6 n Svt. プラットフォームと衝突すると、これらの分子は運動量をプラットフォームに移します。
P= N P 1 =2 メートル 0 vnSvt=m 0 v 2 nSt,
どこ n分子の濃度です。 次に、ガスが容器の壁に及ぼす圧力は次のようになります。
p = 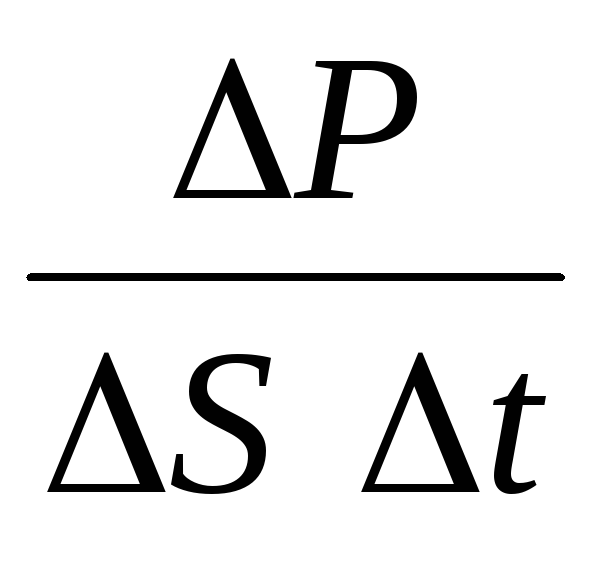 =
メートル 0
v 2
.
(1.9)
=
メートル 0
v 2
.
(1.9)
ただし、ガス分子はさまざまな速度で移動します。 v 1 , v 2 , …,v nであるため、速度を平均化する必要があります。 ガス分子の速度の二乗和をその数で割ると、二乗平均平方根速度が決まります。
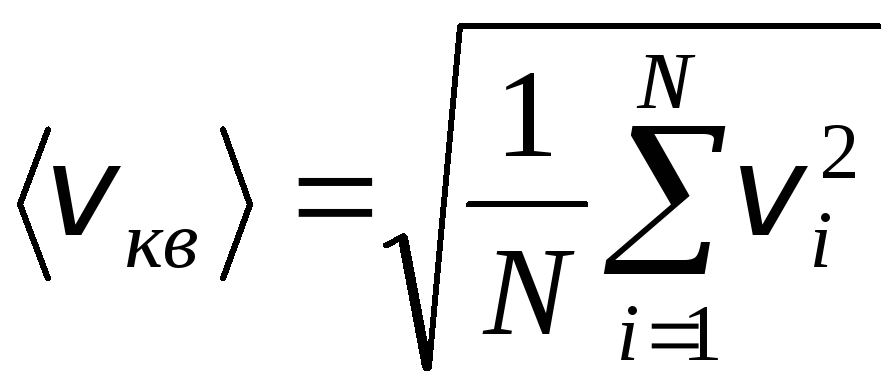 .
.
式 (1.9) 次の形式になります。
![]() (1.10)
(1.10)
式 (1.10) が呼び出されます 分子動力学理論の基本方程式理想気体。
とすれば 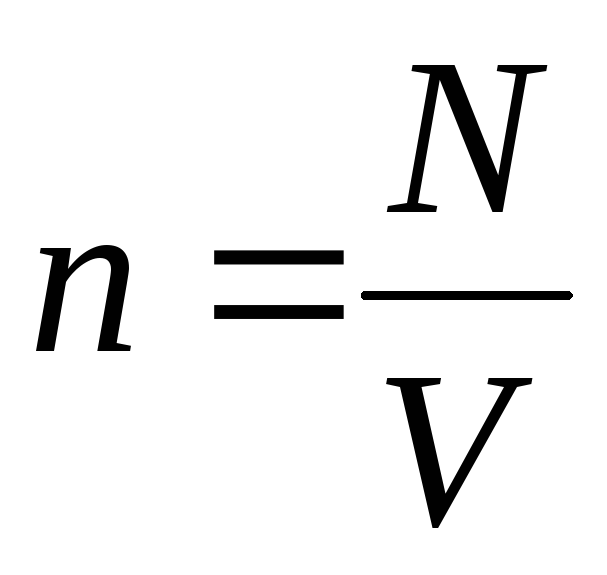 、 我々が得る:
、 我々が得る:
p V = N 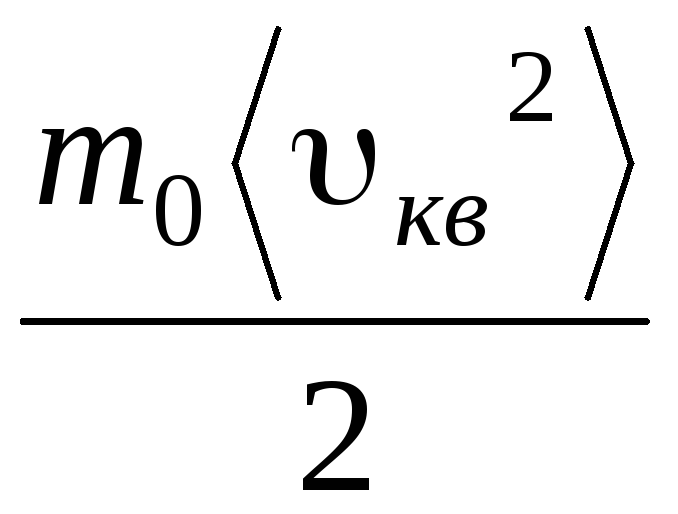 =E,
(1.11)
=E,
(1.11)
どこ えは、すべての気体分子の並進運動の総運動エネルギーです。 したがって、ガス圧力は、ガス分子の並進運動の運動エネルギーに正比例します。
1モルのガスに対して メートル= であり、クラペイロン-メンデレーエフ方程式は次の形式をとります。
p V . = R T,
(1.11) から p V . = v 平方 2 、次のようになります。
RT= v 平方 2 .
したがって、気体分子の二乗平均速度は次のようになります。
v
平方
=
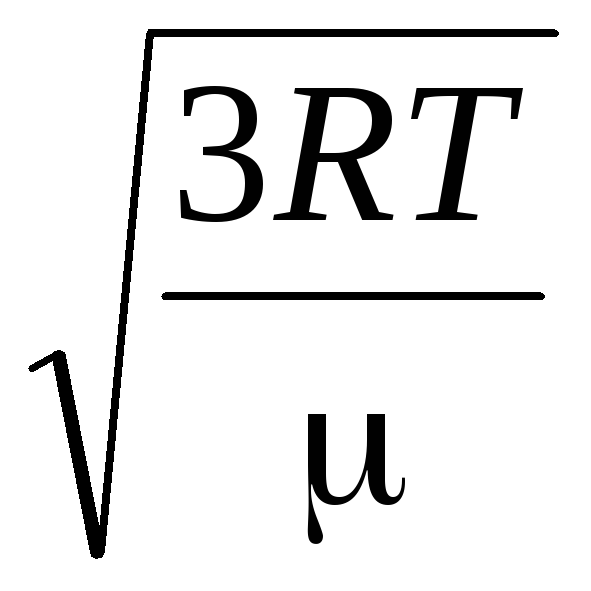 =
=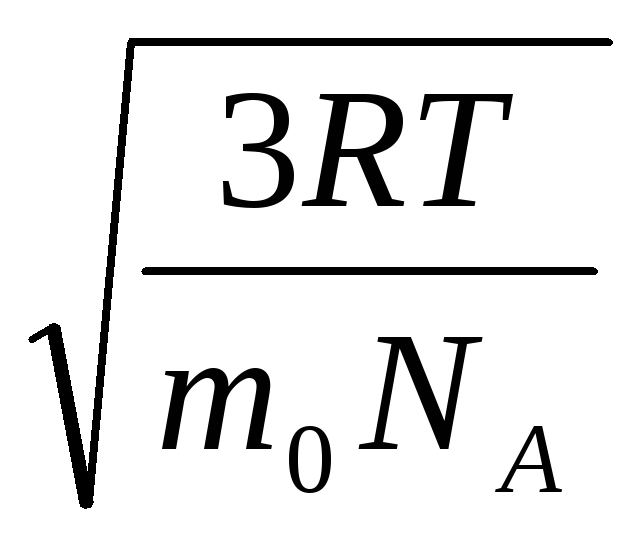 =
= ,
,
どこ k = R/N あ = 1.3810 -23 J/K – ボルツマン定数。 ここから、室温での酸素分子の平均二乗速度 - 480 m/s、水素 - 1900 m/s を見つけることができます。
温度の分子動力学的意味
温度は、身体の熱さを定量的に測定するものです。 絶対熱力学的温度の物理的意味を明らかにする T気体の分子動力学理論の基本方程式 (1.14) をクラペイロン-メンデレーエフ方程式と比較してみましょう。 pⅤ = R.T.
これらの方程式の右側の部分を等分すると、1 つの分子の運動エネルギー 0 の平均値が得られます ( = N/N あ 、k=R/N あ):
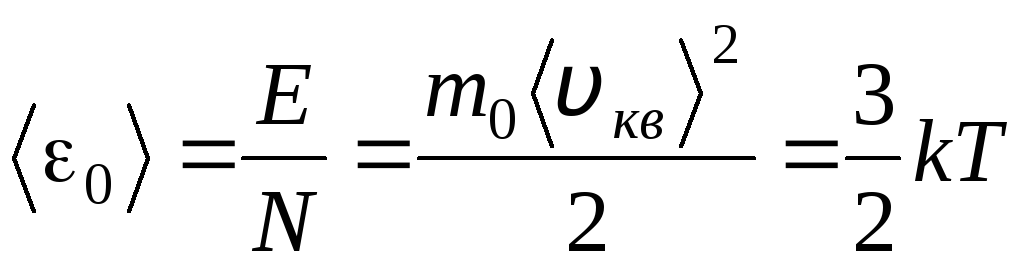 .
.
分子動力学理論の最も重要な結論は、次の式から得られます。 理想気体の 1 つの分子の並進運動の平均運動エネルギーは温度のみに依存しますが、熱力学的温度に正比例します。 したがって、熱力学的温度スケールは直接的な物理的意味を獲得します。 T= 0 理想気体分子の運動エネルギーはゼロです。 したがって、この理論に基づいて、気体分子の並進運動は停止し、その圧力はゼロに等しくなります。
理想気体の平衡特性の理論
分子の自由度の数. 理想気体の分子動力学理論は、非常に重要な結果をもたらします。気体分子はランダムに動き、分子の並進運動の平均運動エネルギーは温度によってのみ決定されます。
分子運動の運動エネルギーは、運動によって消耗されません。 前進運動エネルギー: それはまたキネティックで構成されています エネルギー 回転と ゆらぎ分子。 すべてのタイプの分子運動に入るエネルギーを計算するには、次のように定義する必要があります。 自由度の数.
下 自由度の数 (私) が暗示されている 空間内の物体の位置を決定するために入力する必要がある独立した座標の数。
H  たとえば、空間内の位置は 3 つの座標によって決定されるため、質点には 3 つの自由度があります。 x、yと ぜ. したがって、単原子分子には並進運動の自由度が 3 つあります。
たとえば、空間内の位置は 3 つの座標によって決定されるため、質点には 3 つの自由度があります。 x、yと ぜ. したがって、単原子分子には並進運動の自由度が 3 つあります。
D 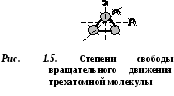 ブカトミック分子には 5 つの自由度があります (図 1.4)。3 つの並進運動の自由度と 2 つの回転運動の自由度です。
ブカトミック分子には 5 つの自由度があります (図 1.4)。3 つの並進運動の自由度と 2 つの回転運動の自由度です。
3 つ以上の原子からなる分子は、並進運動の自由度 3 と回転運動の自由度 3 の 6 つの自由度を持ちます (図 1.5)。
各気体分子には一定数の自由度があり、そのうちの 3 つはその並進運動に対応しています。
エネルギーの均等配分に関する規制
自由度による
気体の分子動力学理論の基本的な前提は、分子の運動が完全にランダムであるという仮定です。 これは並進運動だけでなく、振動運動と回転運動の両方に当てはまります。 気体中の分子のすべての方向の運動は、確率的に等しいと仮定されます。 したがって、分子の自由度ごとに、平均して同じ量のエネルギーがあると想定できます。これは、自由度に対するエネルギーの等分配上の位置です。 分子の自由度 1 あたりのエネルギーは次のとおりです。
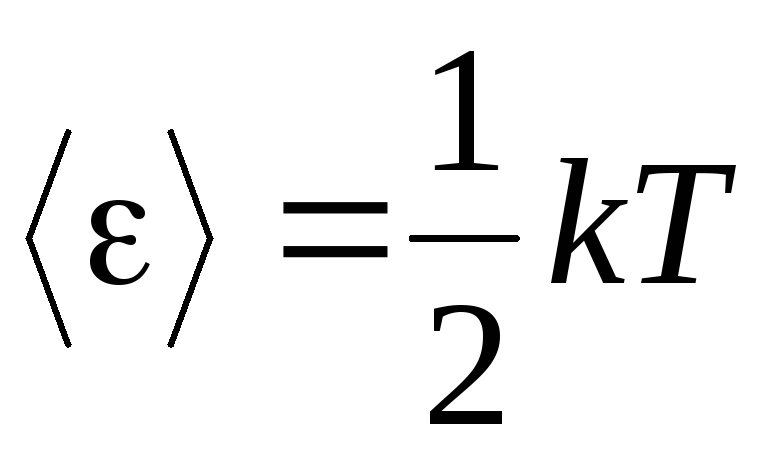 . (1.12)
. (1.12)
分子が持っている場合 私自由度の場合、自由度ごとに平均すると次のようになります。
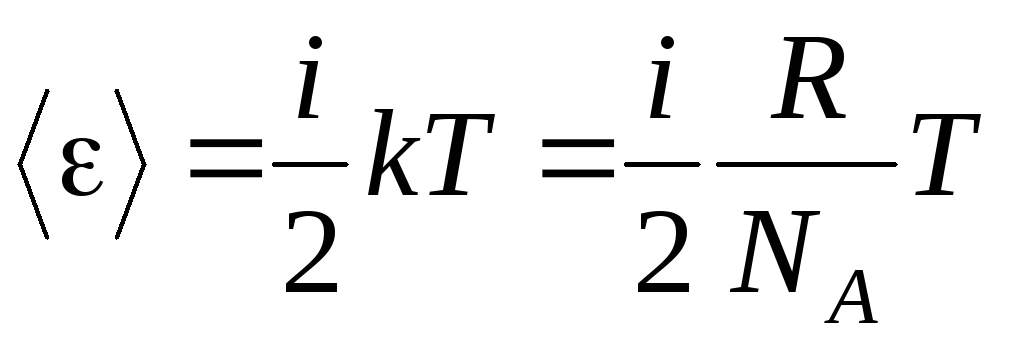 .
(1.13)
.
(1.13)
理想気体の内部エネルギー
ガスの内部エネルギーの総供給を1モルに帰する場合、にアボガドロ数を掛けてその値を取得します。
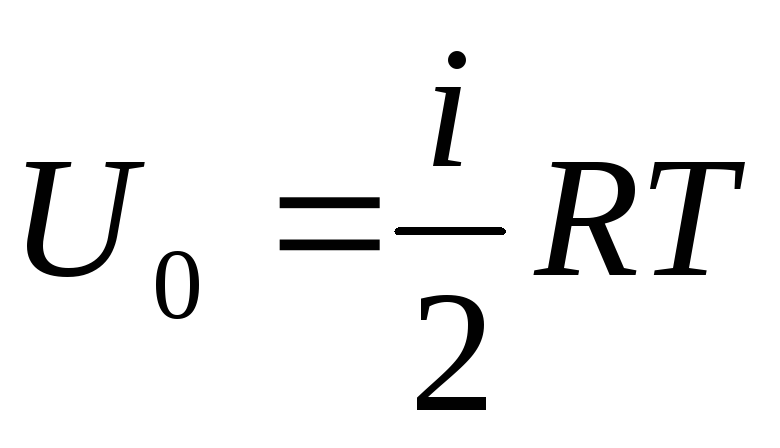 .
(1.14)
.
(1.14)
したがって、理想気体の 1 モルの内部エネルギーは、温度と気体分子の自由度の数だけに依存します。
マクスウェル分布とボルツマン分布
熱運動の速度とエネルギーに関する理想気体の分子の分布 (マクスウェル分布)。 一定のガス温度では、分子運動のすべての方向が同じ確率であると仮定されます。 この場合、各分子の二乗平均速度は一定のままで、
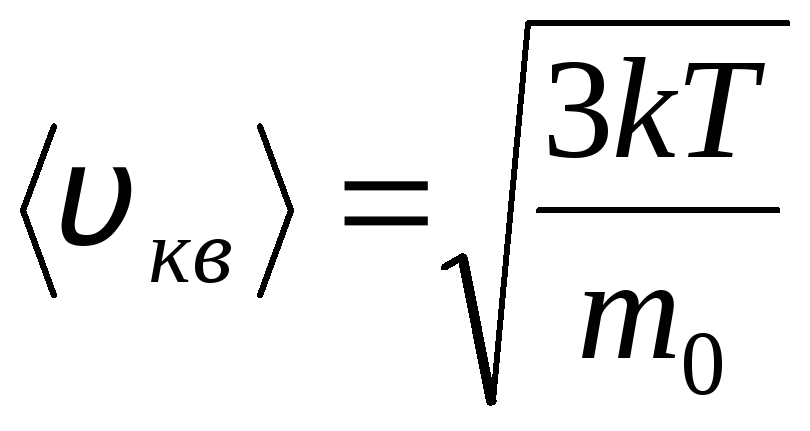 .
.
これは、平衡状態にある理想気体では、時間とともに変化しない分子の特定の定常速度分布が確立されるという事実によって説明されます。 この分布は、J. Maxwell によって理論的に導き出された特定の統計法則に従います。 マクスウェルの法則は次の関数で表されます。
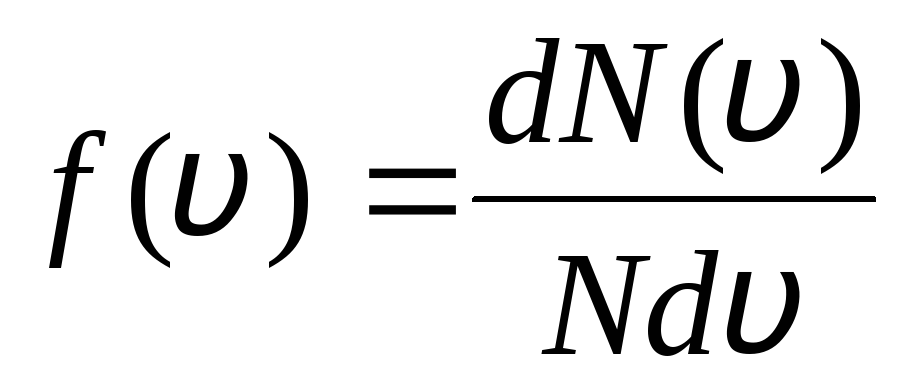 ,
,
それが機能です へ(v) 分子の相対数を決定します  、その速度はからの間隔にあります v
前 v+dv. 確率論の方法を適用して、マクスウェルは発見した 速度に関する理想気体の分子の分布の法則:
、その速度はからの間隔にあります v
前 v+dv. 確率論の方法を適用して、マクスウェルは発見した 速度に関する理想気体の分子の分布の法則:
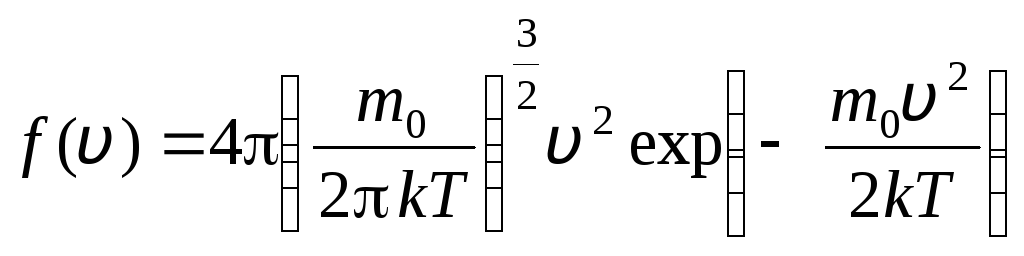 . (1.15)
. (1.15)
分布関数は、図にグラフで示されています。 1.6。 分布曲線と x 軸で囲まれた面積は 1 です。 これは、関数 へ(v) 正規化条件を満たします。
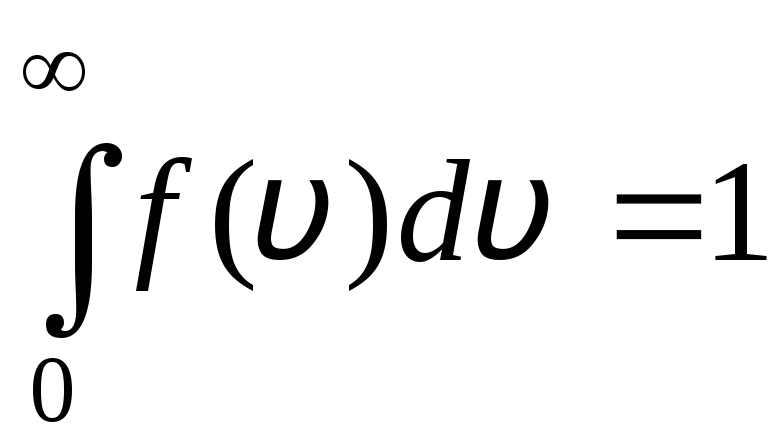 .
.
から  理想気体分子の分布関数が速度で表される速度。 へ(v) は最大で、呼び出されます 最も可能性が高い
速度
v B .
理想気体分子の分布関数が速度で表される速度。 へ(v) は最大で、呼び出されます 最も可能性が高い
速度
v B .
値 v = 0 と v = 式 (1.15) の最小値に対応します。 最も可能性の高い速度は、式 (1.23) を微分し、それをゼロに等しくすることによって見つけることができます。
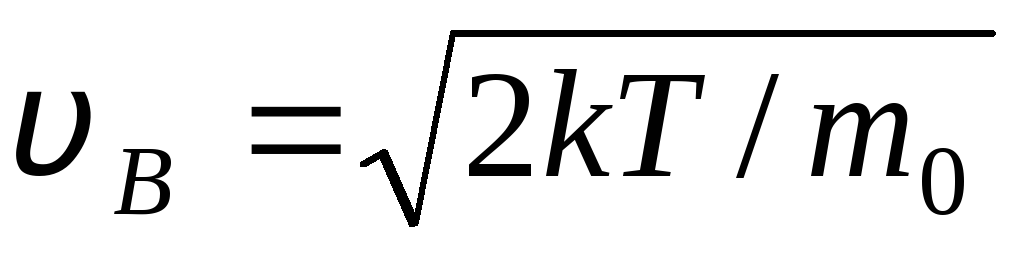 =
=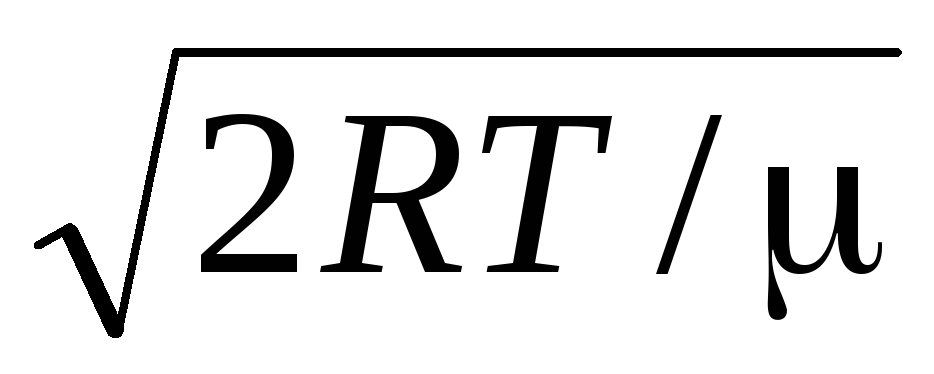 =
1,41
=
1,41
温度が上昇すると、関数の最大値は右にシフトします(図1.6)。つまり、温度が上昇すると、最も可能性の高い速度も増加しますが、曲線で囲まれた領域は変化しません。 気体中および低温では、高速で移動する少数の分子が常に存在することに注意してください。 そのような「熱い」分子の存在は 非常に重要多くのプロセスの間。
算術平均速度分子は式によって決定されます
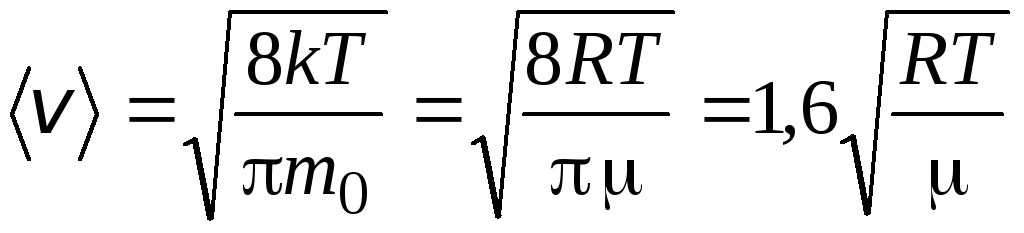 .
.
二乗平均速度
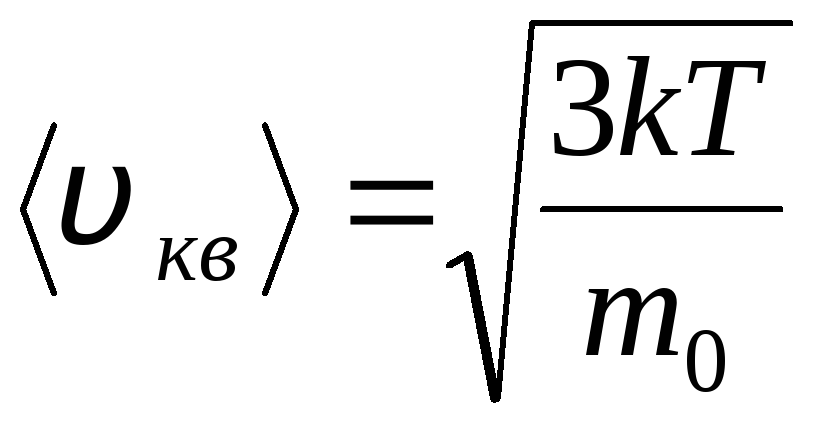 =
1,73
=
1,73 .
.
これらの速度の比率は、温度やガスの種類には依存しません。
熱運動エネルギーによる分子の分布関数. この関数は、速度の代わりに運動エネルギーの値を分子の分布方程式 (1.15) に代入することによって取得できます。
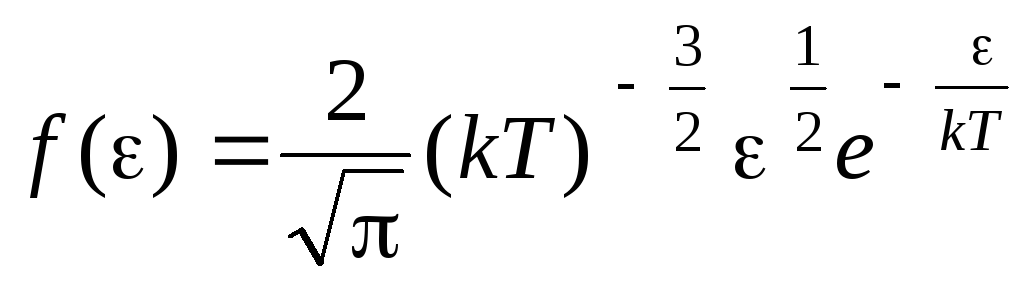 .
.
からのエネルギー値に対する式を統合した  前
前 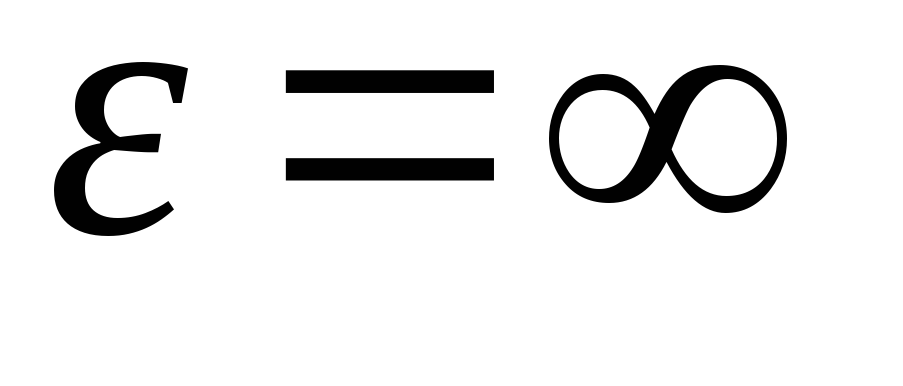
 、 我々が得る 平均運動エネルギー理想気体分子:
、 我々が得る 平均運動エネルギー理想気体分子:
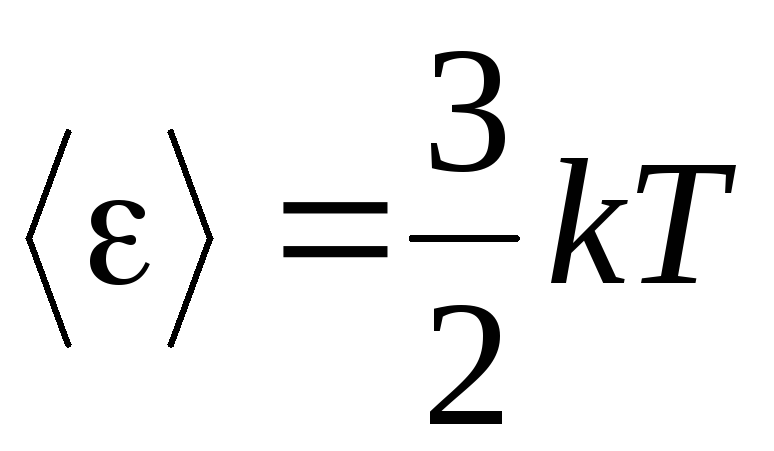 .
.
気圧式。 ボルツマン分布。 気体の分子動力学理論と速度による分子のマクスウェル分布の基本方程式を導き出すとき、理想気体の分子は外力の影響を受けないため、分子は体積全体に均一に分布していると仮定されました。 しかし、どのガスの分子も地球の重力場にあります。 圧力が高さに依存する法則を導き出すとき、重力場は均一で、温度は一定で、すべての分子の質量は同じであると仮定されます。
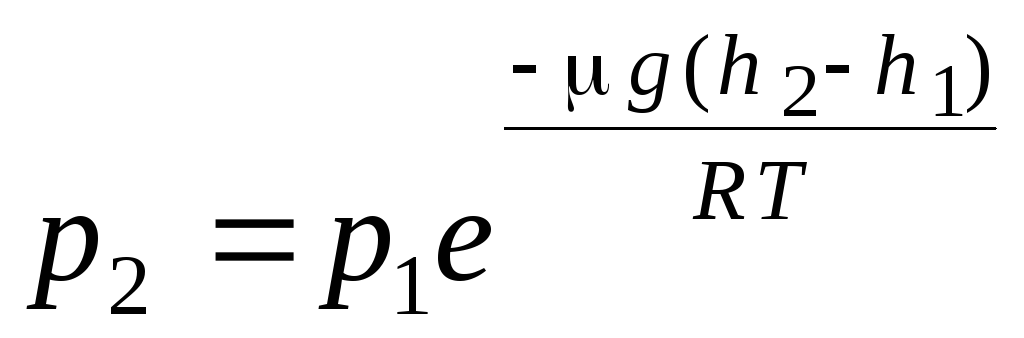 . (1.16)
. (1.16)
式 (1.16) が呼び出されます 気圧式. 高度に応じて気圧がわかったり、気圧を測ることで高度がわかったりします。 なぜなら 時間 1 は海面からの高さで、圧力が正常と見なされる場合、式は次のように変更できます。
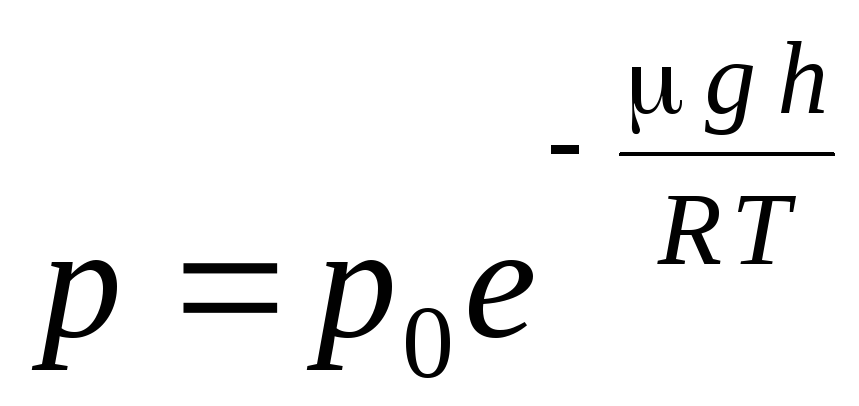 .
.
気圧式は、次の式を使用して変換できます。 p = nkT:
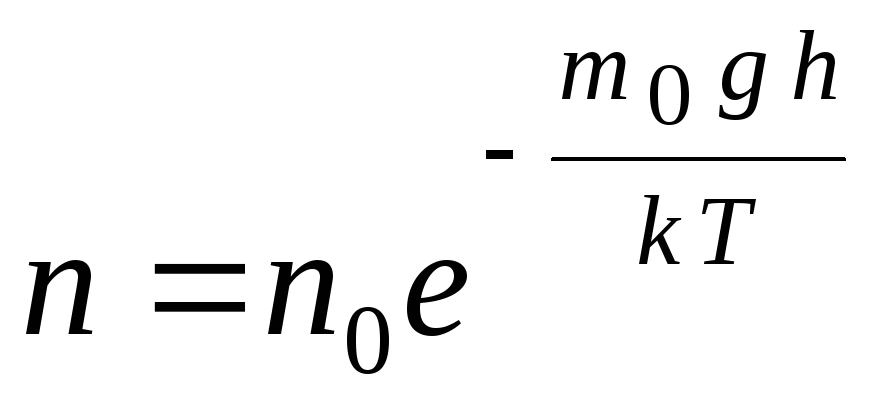 ,
,
G  で n
–
高度での分子の濃度 時間,
メートル 0
ああ=P–
重力場における分子のポテンシャルエネルギー。 一定の温度では、ガスの密度は、分子のポテンシャルエネルギーが低いところで大きくなります。 グラフィカルに、高さとともに単位体積あたりの粒子数が減少する法則は、図のようになります。 1.7。
で n
–
高度での分子の濃度 時間,
メートル 0
ああ=P–
重力場における分子のポテンシャルエネルギー。 一定の温度では、ガスの密度は、分子のポテンシャルエネルギーが低いところで大きくなります。 グラフィカルに、高さとともに単位体積あたりの粒子数が減少する法則は、図のようになります。 1.7。
任意の外部ポテンシャル場に対して、次の一般式を書きます
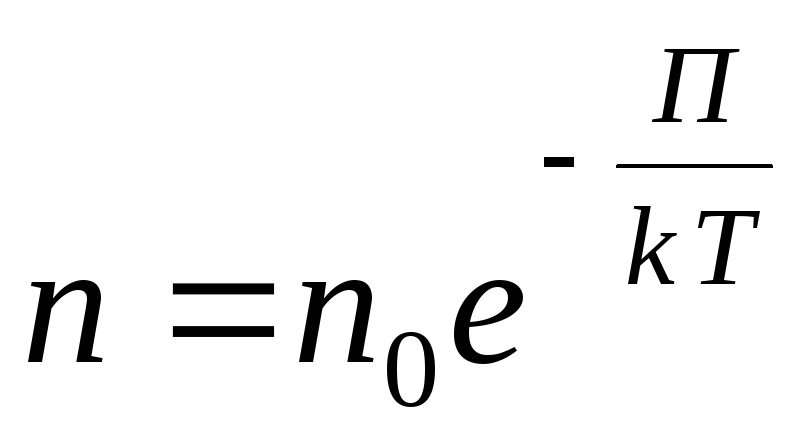 ,
,
