Metode untuk menentukan kapasitas panas benda padat
Apa itu KAPASITAS PANAS
Ketika panas diberikan, suhu sistem naik. Dalam kasus perubahan suhu yang sangat kecil, proporsionalitasnya valid
dT=δQ , atau dT=constδQ
Lebih mudah menuliskan relasi ini dalam bentuk: δQ=СdT atau
Nilai C disebut kapasitas panas sebenarnya dari sistem.
Kapasitas kalor adalah perbandingan jumlah kalor yang disuplai ke sistem terhadap perubahan suhu yang terjadi.
Selain yang sebenarnya, ada juga kapasitas panas rata-rata:
Kapasitas panas
Jika kapasitas panas dikaitkan dengan satuan massa (mol) suatu zat, maka ia menjadi tidak bergantung pada massa seluruh sistem dan memperoleh sifat-sifat parameter intensif. Jika kapasitas panas mengacu pada satuan massa suatu zat, itu disebut spesifik, dan untuk 1 mol - kapasitas panas dengan dimensi J / (mol * k)
Kami hanya akan mempertimbangkan kapasitas panas molar, karena bagi mereka, semua keteraturan jauh lebih sederhana daripada untuk kapasitas panas tertentu.
Kapasitas panas tergantung pada kondisi di mana perpindahan panas ke sistem terjadi. Jika sistem tertutup dalam volume konstan, maka peningkatan suhu sebesar dT akan terjadi di bawah aksi panas yang sama dengan CvdT, di mana Cv adalah kapasitas panas pada volume konstan. Dalam kasus tekanan konstan selama pemuaian sistem, untuk menaikkan suhu sebesar dT, diperlukan panas CpdT, di mana Cp adalah kapasitas panas pada tekanan konstan.
Mengingat kondisi perpindahan panas, ketika satu atau lebih variabel dijaga konstan, sementara yang lain berubah, kapasitas panas dapat dinyatakan dengan menggunakan turunan parsial: ![]() . Karena δQ v = dU,
. Karena δQ v = dU,
δQ p = dH, kita dapat menulis:
![]() (1)
(1)
Cv adalah kapasitas panas isokorik gas, Cp adalah kapasitas panas isobarik gas.
Perbedaan antara kapasitas panas isokorik dan isobarik disebabkan oleh perbedaan energi dalam dan entalpi. Perubahan entalpi dan energi dalam berbeda dengan jumlah kerja yang dilakukan oleh sistem.
δW=∆nRT, ∆H-∆U=∆nRT
Oleh karena itu, kapasitas panas pada volume konstan Cv dan tekanan konstan Cp juga berbeda dengan jumlah usaha: Cp - Cv = δW
Berdasarkan ekspresi (1), kita dapat menulis:
Substitusi persamaan ini ke dalam persamaan ∆H- ∆U=∆nRT
dan dengan mempertimbangkan bahwa ∆n= 1, kita akan menemukan hubungan antara kapasitas panas molar gas:
Cp– Cv= R atau Cp= Cv+ R
Seperti dapat dilihat, mereka berbeda dengan nilai konstanta gas.
Dari kondisi Cp=Cv+R maka Cp˃Cv, yaitu pada proses isobarik, ketika P=const, untuk menaikkan suhu sistem diperlukan jumlah besar panas daripada dalam proses isokorik.
Kapasitas panas molar gas memiliki nilai orde R, sehingga perbedaan antara Cp dan Cv sangat signifikan. Jadi, untuk karbon dioksida CO 2 pada 25 0 C Cp = 37, 14; dan Cv = 28,83 J / (mol * K)
Selisih Cp - Cv adalah kerja pemuaian isobarik satu mol gas ideal ketika suhu naik satu derajat. Cairan dan padatan tubuh ditandai dengan sedikit peningkatan volume saat dipanaskan. Oleh karena itu, untuk benda terkondensasi, kita dapat mengasumsikan bahwa Ср ≈ Сv.
PERSAMAAN KIRCHHOFF. KETERGANTUNGAN EFEK TERMAL TERHADAP SUHU.
Perhitungan efek termal yang dipertimbangkan sebelumnya berdasarkan hukum Hess untuk panas pembentukan dan pembakaran dibatasi oleh kondisi standar. Untuk tujuan praktis, perlu menghitung efek termal untuk kondisi tertentu selain yang standar.
Mulai dari efek termal yang diketahui dalam kondisi standar, mis. pada suhu 25 0 C (298,15 K) dan tekanan 1 atm. (1,013 * 10 5 Pa), dimungkinkan untuk menghitung efek termal pada suhu apa pun yang kami minati menggunakan hukum Kirchoff. Proses dalam kondisi industri dicirikan oleh variasi suhu yang signifikan, yang kisarannya ditentukan tidak hanya oleh kondisi teknologi, tetapi juga oleh musim Kisaran ini dapat mencapai ratusan derajat - wajar jika efek termal akan terjadi. berbeda secara signifikan dan tergantung pada suhu.
Pertimbangkan hukum Kirchhoff dalam bentuk diferensial. Untuk melakukan ini, kami menuliskan perubahan entalpi dalam isobarik dan energi internal dalam proses isokorik.
∆H \u003d H 2 -H 1; ∆U \u003d U 2 -U 1.
Bedakan persamaan ini terhadap suhu dan dapatkan:
Persamaan Kirchhoff:

Dan - koefisien suhu dari efek termal dari proses isobarik dan isokorik, masing-masing; dan - perubahan kapasitas panas sistem sebagai akibat dari proses isobarik dan isokorik.
Berdasarkan persamaan Kirchhoff, hukum Kirchhoff dirumuskan dalam bentuk diferensial: koefisien temperatur dari efek termal proses sama dengan perubahan kapasitas panas sistem yang terjadi sebagai akibat dari proses ini.
Jadi, hukum Kirchhoff dalam bentuk diferensial memungkinkan untuk menentukan hanya perubahan efek termal dengan suhu, dan bukan besarnya efek termal itu sendiri.
Mari kita menganalisis persamaan Kirchhoff
Untuk reaksi: aA + bB = dD + rR dalam proses isobarik (р=const), menurut hukum Kirchhoff, perubahan kapasitas kalor dalam sistem akan berbentuk:
Ekspresi serupa dapat diperoleh untuk proses isokorik:
Karena hukum Kirchhoff memungkinkan Anda untuk menentukan perubahan efek termal dari proses dengan perubahan suhu, kami membuat grafik:
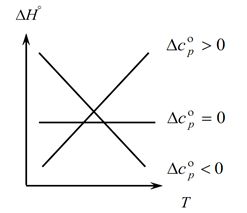
1. Pertimbangkan kasus pertama, ketika ∆Ср(∆Сv)˃0, karena ∆Ср=∑С con. -∑С awal, oleh karena itu jumlah kapasitas panas produk reaksi lebih besar dari jumlah kapasitas panas zat awal: ∑С con. ˃∑Dari awal Dalam hal ini, kita memperoleh kurva 1 pada grafik, yang berarti bahwa dengan kenaikan suhu, perubahan efek termal dari proses juga meningkat (T dan ∆H);
2. Kasus kedua, ketika ∆Ср(∆Сv)˂0. Mirip dengan hukum pertama, kami memiliki ∑С con. ˂∑Dari awal (Jumlah kapasitas kalor produk akhir kurang dari jumlah kapasitas kalor zat awal). Kemudian kita mendapatkan kurva pada grafik, yang berarti bahwa dengan peningkatan suhu, perubahan efek termal dari proses berkurang (Т→∆H↓)
3. Dan kasus ketiga, ketika perubahan kapasitas panas sistem sama dengan nol ∆Ср(∆Сv)=0. Kemudian jumlah kapasitas panas produk akhir reaksi sama dengan jumlah kapasitas panas bahan awal ∑С con. \u003d ∑ Dari awal. Dalam hal ini, efek termal dari reaksi bukanlah fungsi temperatur (∆H ≠ f(T)) dan kita mendapatkan garis lurus pada grafik.
PERHITUNGAN EFEK TERMAL BAGI YANG DIBERIKAN
SUHU. INTEGRASI PERSAMAAN KIRCHHOFF
Untuk mencari nilai efek termal sebagai fungsi temperatur, perlu dilakukan integrasi persamaan

Dari T ke T 0 (di mana T adalah suhu yang diperlukan, T 0 adalah suhu standar), dari ∆H ke ∆H 0 atau dari ∆U ke ∆U 0 (di mana ∆H dan ∆U adalah entalpi dan energi dalam di bawah kondisi yang berbeda dari standar). Integrasi dilakukan untuk dua kasus:
Untuk tidak bahan organik: Untuk zat organik:
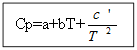
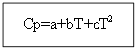
Contoh: untuk H 2 (g) - zat anorganik
| Ср=f(T) | T | |||
| A | b*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27,28 + 3,26 * 10 -3 T +.
A) Perkiraan integrasi:
untuk proses isobarik
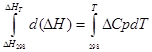
∆H T - ∆H 298 =∆Cp*(T-298)
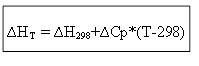
untuk proses isokorik:
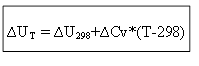
Jadi, untuk menentukan efek termal ∆H atau energi internal ∆U pada setiap suhu T, perlu diketahui panas proses dalam kondisi standar ∆H 0 (∆U 0) dan perubahan kapasitas panas ∆Ср, ∆ CV.
Contoh. Hitung efek termal ∆H dari proses memperoleh benzena dari asetilena:
3C 2 H 2 (g) → C 6 H 6 (g) pada 75 0 C (348K).
1. Kami menemukan dari tabel rata-rata kapasitas panas isobarik molar dari benzena dan asetilena:
Ср С6Н6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J / (mol * K).
2. Kami menemukan perubahan kapasitas panas dari proses:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) awal \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81.67 - 3 * 43.93 \u003d - 50.12 J / (mol * K) .
3. Menurut data tabel, kami menemukan efek termal dalam kondisi standar:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 kJ / mol
4. Temukan efek termal pada suhu tertentu:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 J / mol
B) Integrasi yang tepat:
Mari kita perhatikan kasus kedua yang lebih rumit, ketika perubahan kapasitas panas bergantung pada suhu, yaitu. Ср=f(T), Cv=f(T).
Mari kita beralih ke persamaan reaksi dalam bentuk umum
dD + rR = qQ + pP
| A | b*10 3 | c’*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
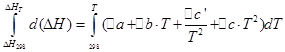
Kami akan melakukan operasi yang sama untuk proses isokorik:
PANAS PELABUARAN
Perubahan entalpi selama transisi zat padat, cair atau gas menjadi larutan disebut termal atau entalpi pembubaran.
Panas pelarutan umumnya termasuk panas penghancuran kisi kristal (untuk padatan), ionisasi dan solvasi.
Untuk memutus ikatan antar ion garam kristal, diperlukan energi, yaitu sementara panas diserap. Pada saat yang sama, hidrasi ion terjadi dalam larutan berair; ikatan terbentuk antara ion dan molekul H 2 O. Tanda panas pelarutan ditentukan oleh proses yang secara energik lebih terasa.
LiBr : ∆H dist = - 49,02 kJ / mol - kalor dilepaskan
KCl: ∆H dist = 7,23 kJ/mol - kalor diserap
Bedakan: panas integral pelarutan adalah panas yang dilepaskan atau diserap ketika 1 mol zat tertentu dilarutkan untuk membentuk larutan dengan konsentrasi tertentu. Panas integral pelarutan bervariasi tergantung pada jumlah zat terlarut.
Bedakan: panas diferensial pelarutan - ini adalah panas yang menyertai pembubaran 1 mol zat tertentu dalam waktu tak terhingga volume besar larutan zat ini. Kalor integral banyak digunakan dalam menghitung kalor pembentukan dan kalor reaksi lain menurut hukum Hess. Perbedaan panas pembubaran mencirikan sifat termodinamika larutan dan proses pembentukannya.
LAB #8
PENENTUAN KAPASITAS PANAS BADAN PADAT
Instrumen dan aksesori: pengaturan eksperimental FPT1-8.
Tujuan pekerjaan: penentuan kapasitas panas sampel logam dengan metode kalorimetri menggunakan pemanas listrik.
Teori singkat
Kapasitas panas spesifik suatu zat - nilai yang sama dengan jumlah panas yang dibutuhkan untuk memanaskan 1 kg suatu zat sebesar 1 K:
kapasitas panas molar - nilai yang sama dengan jumlah panas yang dibutuhkan untuk memanaskan 1 mol zat per 1 K:
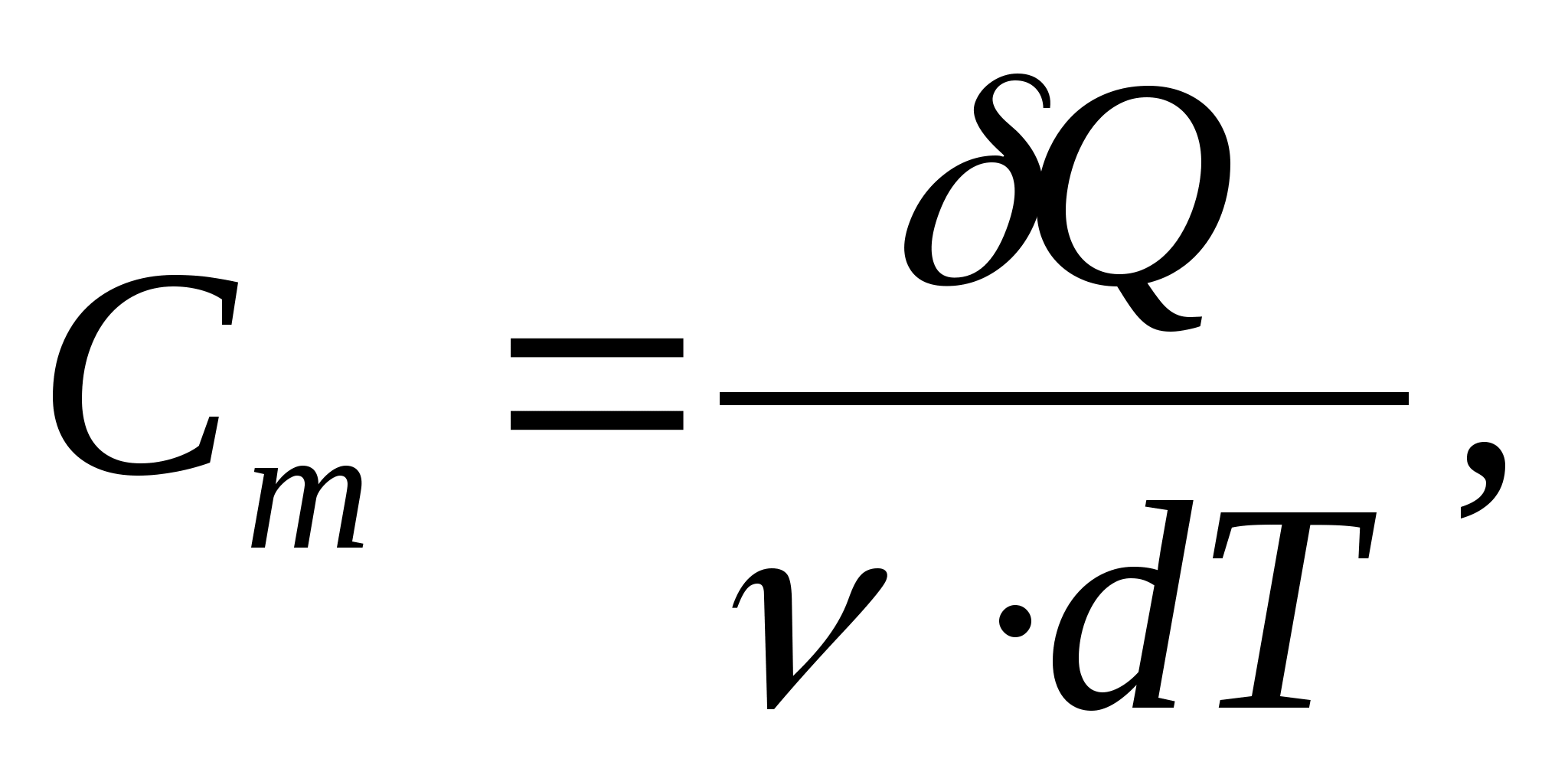
Di mana 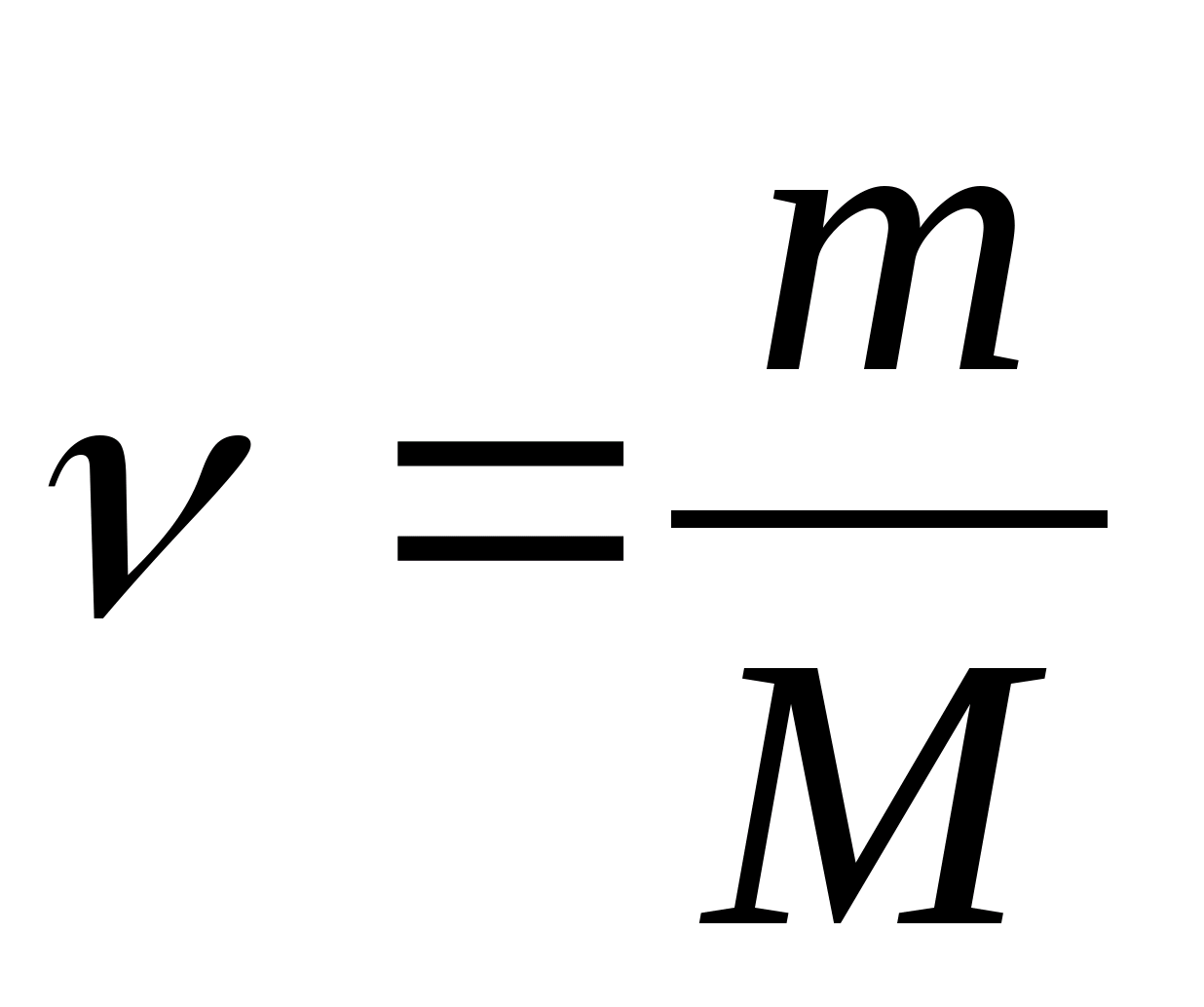 − jumlah zat.
− jumlah zat.
Panas spesifik C berhubungan dengan molar C M perbandingan

Di mana M adalah massa molar zat.
Membedakan kapasitas panas pada volume tetap Dan tekanan konstan, jika dalam proses memanaskan suatu zat volume atau tekanannya dipertahankan konstan.
Jumlah terkecil variabel independen (koordinat) yang sepenuhnya menentukan posisi sistem dalam ruang disebut jumlah derajat kebebasan .
Menurut hukum Boltzmann tentang distribusi seragam energi pada derajat kebebasan molekul, setiap derajat kebebasan translasi dan rotasi memiliki energi kinetik rata-rata sama dengan
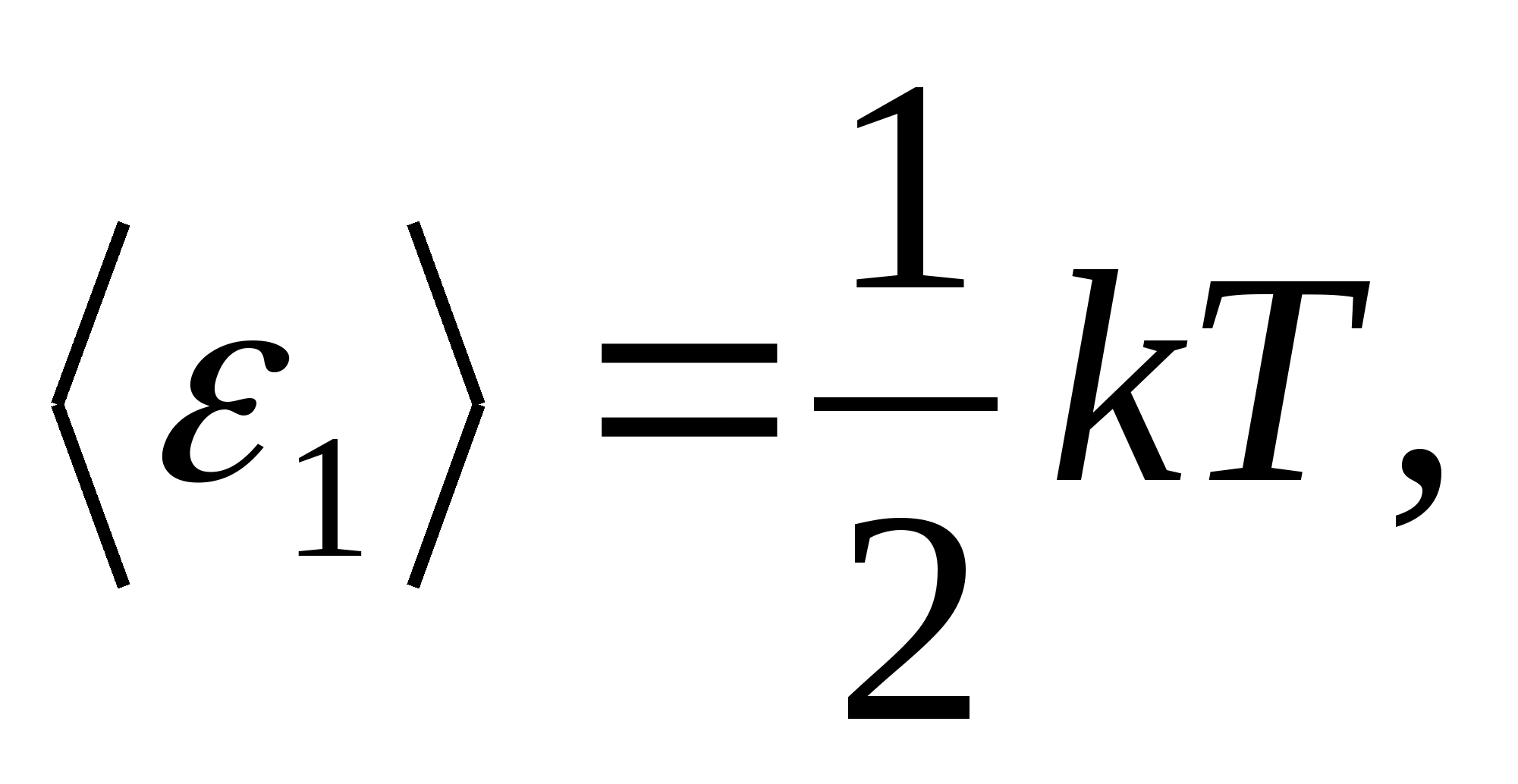
(Di mana k adalah konstanta Boltzmann), dan untuk setiap derajat kebebasan vibrasi, rata-rata energinya sama dengan
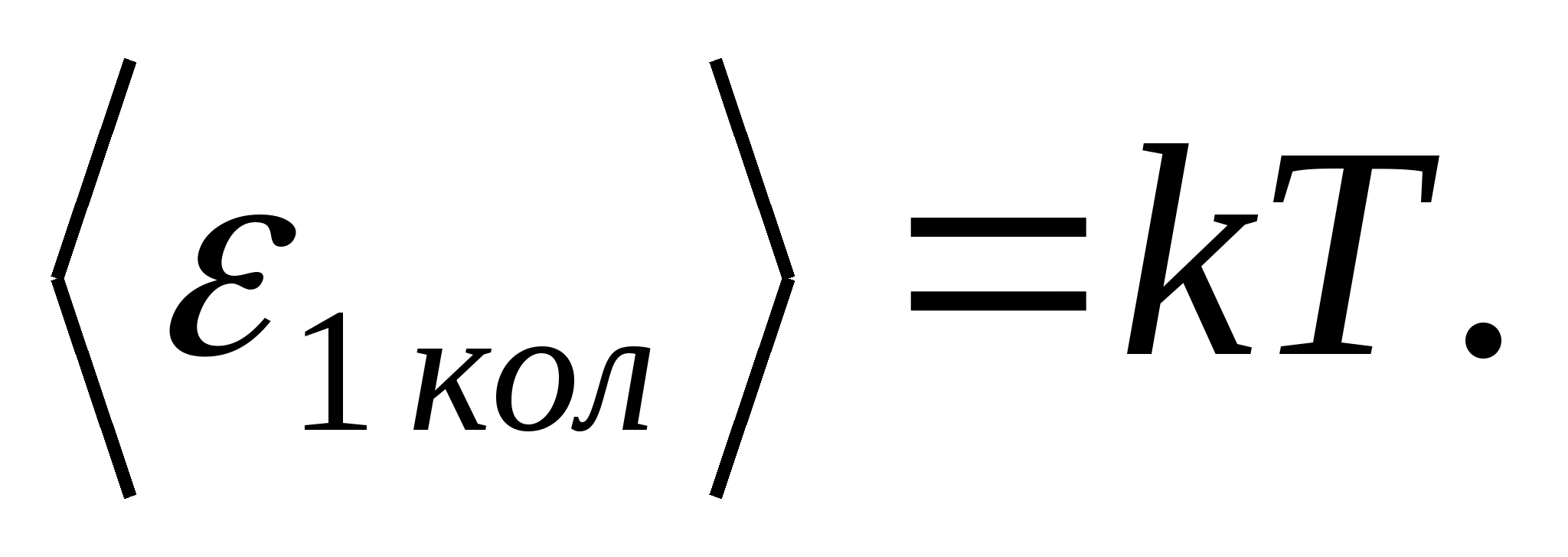
Dengan demikian, energi rata-rata molekul
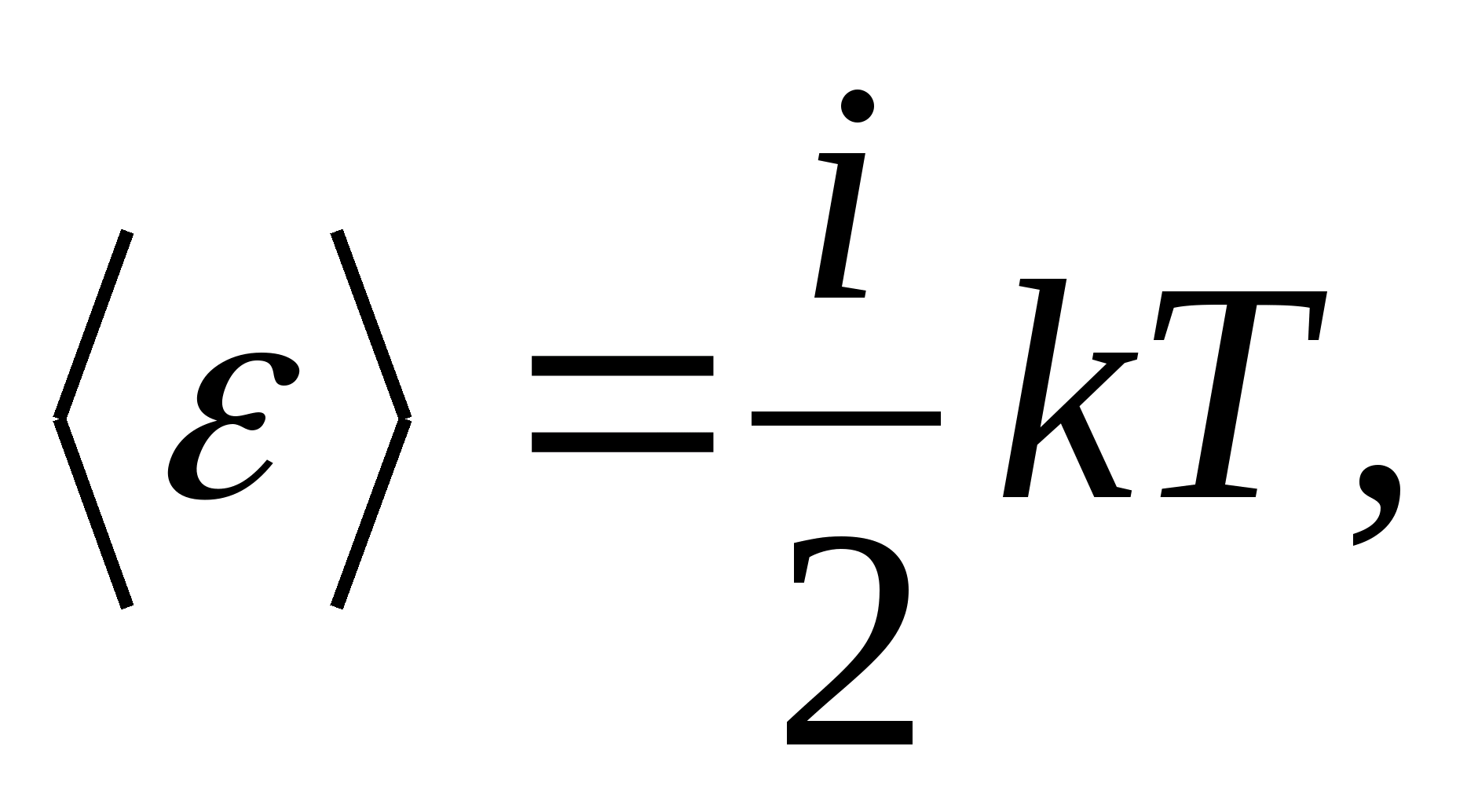
Di mana Saya adalah jumlah dari jumlah translasi, jumlah rotasi dan dua kali jumlah derajat kebebasan getaran molekul:
![]()
Misalnya, energi kinetik rata-rata molekul gas ideal monoatomik ( 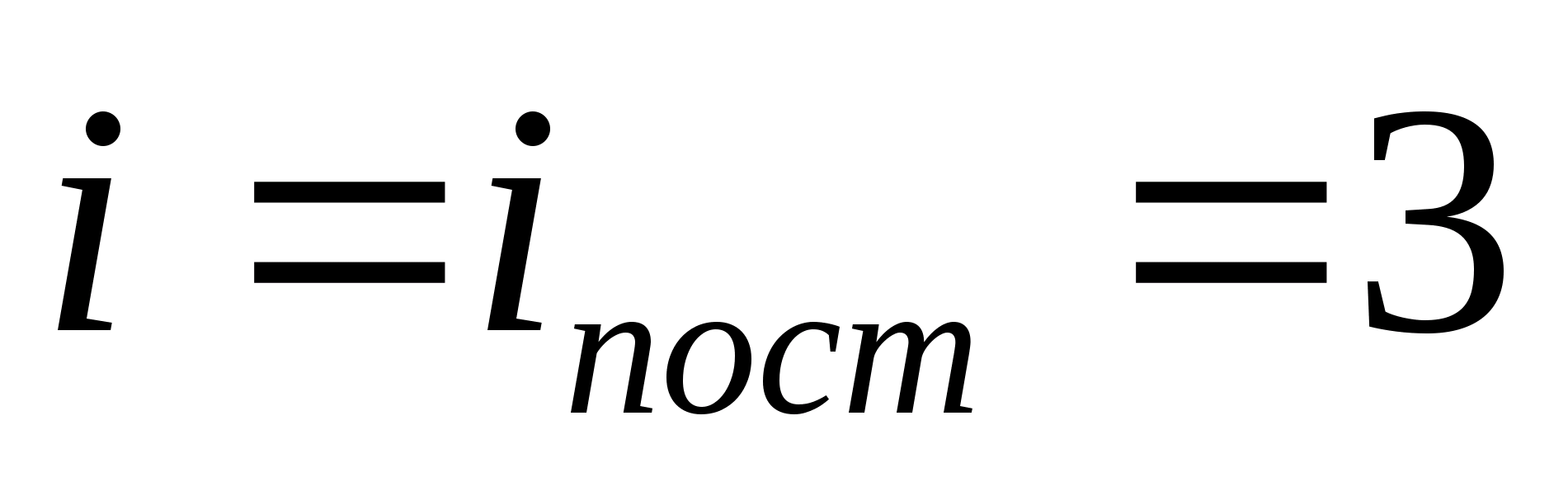 ) adalah sama dengan
) adalah sama dengan
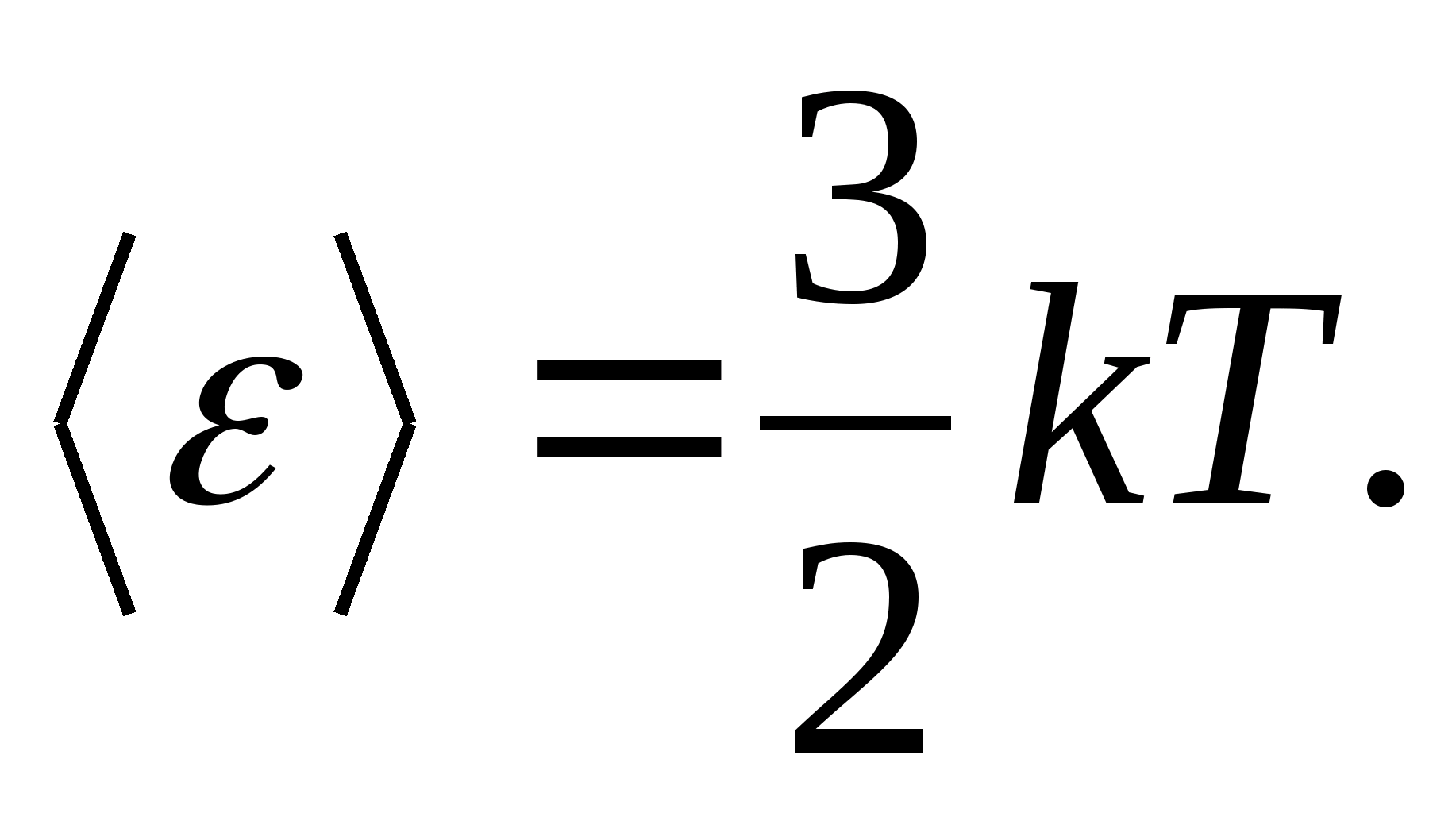
Sebagai model dari benda padat, pertimbangkan kisi kristal yang dibangun dengan benar, di simpul di mana partikel (atom, ion, molekul) diambil sebagai poin materi, berosilasi di sekitar posisi kesetimbangannya - simpul kisi - dalam tiga arah yang saling tegak lurus. Jadi, setiap partikel yang menyusun kisi kristal diberi tiga derajat kebebasan vibrasi, yang masing-masing, menurut hukum tentang distribusi seragam energi pada derajat kebebasan, memiliki energi. kT.
Kemudian nilai rata-rata energi total partikel selama gerak osilasi dalam kisi kristal
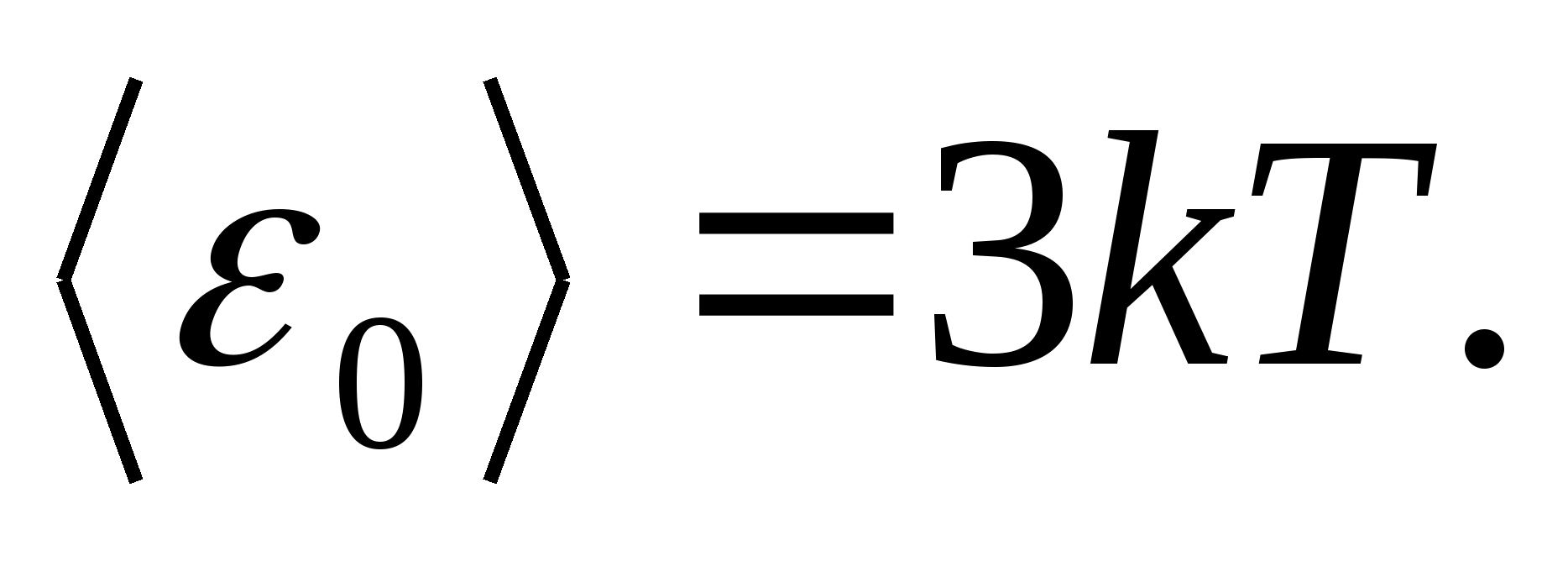
Total energi internal dari satu mol benda padat diperoleh dengan mengalikan energi rata-rata satu partikel dengan jumlah partikel yang bergetar secara independen yang terkandung dalam satu mol, yaitu. ke konstanta Avogadro N SEBUAH :
Di mana R=N SEBUAH k adalah konstanta gas universal (molar), R= 8,31 J/(molK).
Untuk padatan, karena koefisien muai panas yang kecil, kapasitas panas pada tekanan konstan dan volume konstan praktis tidak berbeda. Oleh karena itu, dengan mempertimbangkan (8.1), kapasitas panas molar suatu zat padat
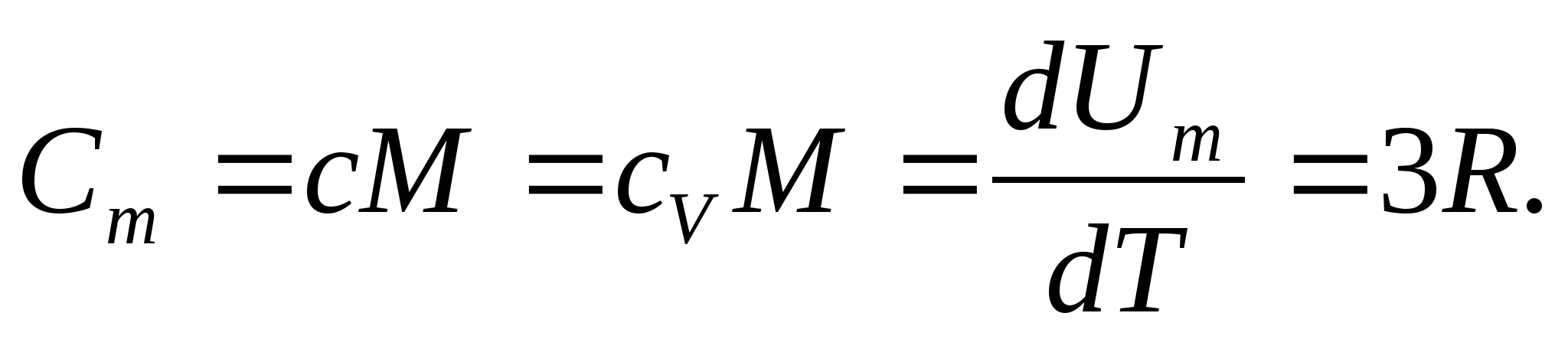 (8.2)
(8.2)
Mengganti nilai numerik konstanta gas molar, kami memperoleh:
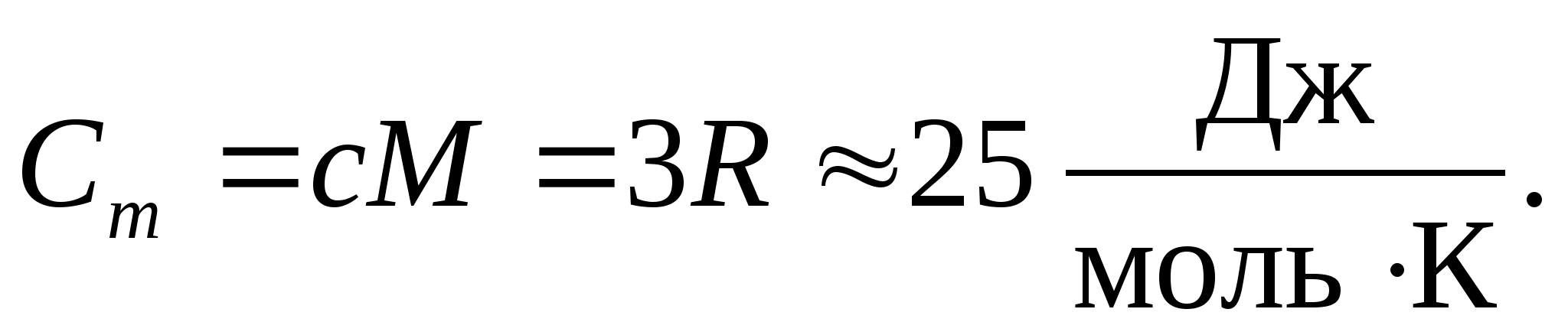
Kesetaraan ini berlaku untuk perkiraan yang cukup baik untuk banyak zat pada suhu kamar dan disebut Hukum Dulong dan Petit : kapasitas panas molar dari semua kristal kimia sederhana padatan kira-kira sama dengan 25 J/(mol KE). Ketika suhu menurun, kapasitas panas semua padatan menurun, mendekati nol T0. Mendekati nol mutlak, kapasitas kalor molar semua benda sebanding dengan T 3, dan hanya pada karakteristik suhu yang cukup tinggi dari setiap zat baru persamaan (8.2) mulai berlaku. Ciri-ciri kapasitas panas benda padat pada suhu rendah ini dapat dijelaskan dengan menggunakan teori kuantum kapasitas panas yang diciptakan oleh Einstein dan Debye.
Untuk menentukan kapasitas panas secara eksperimental, benda yang diteliti ditempatkan dalam kalorimeter, yang dipanaskan oleh arus listrik. Jika suhu kalorimeter dengan sampel uji dinaikkan sangat lambat dari awalnya T 0 sampai T, maka energi arus listrik akan digunakan untuk memanaskan sampel dan kalorimeter:
Di mana SAYA Dan AS− arus dan tegangan pemanas; − waktu pemanasan; M 0 dan M adalah massa kalorimeter dan sampel uji, Dengan 0 dan Dengan− kapasitas panas spesifik kalorimeter dan sampel uji, Q− kehilangan panas ke insulasi termal kalorimeter dan ke ruang sekitarnya.
Untuk mengecualikan dari persamaan (8.3) jumlah panas yang dikeluarkan untuk memanaskan kalorimeter dan kehilangan panas ke ruang sekitarnya, perlu, dengan daya pemanas yang sama, untuk memanaskan kalorimeter kosong (tanpa sampel) dari suhu awal. T 0 untuk perbedaan suhu yang sama T. Kehilangan panas dalam kedua kasus akan hampir sama dan sangat kecil jika suhu selubung pelindung kalorimeter dalam kedua kasus konstan dan sama dengan suhu kamar:
Persamaan (8.3) dan (8.4) menyiratkan
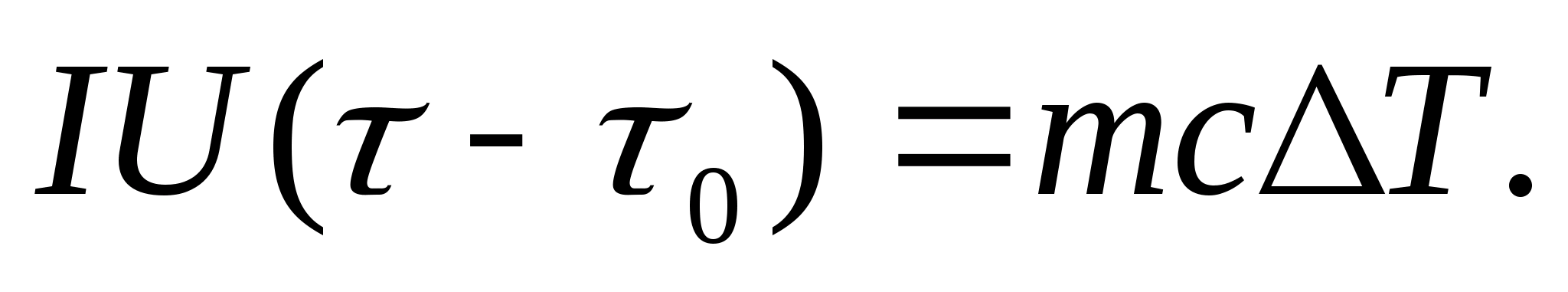 (8.5)
(8.5)
Persamaan (8.5) dapat digunakan untuk menentukan secara eksperimental kapasitas panas spesifik dari bahan sampel uji. Dengan mengubah suhu kalorimeter, perlu untuk memplot ketergantungan perbedaan waktu pemanasan pada perubahan suhu sampel uji: (
−
0)=F(T), sesuai dengan koefisien sudutnya 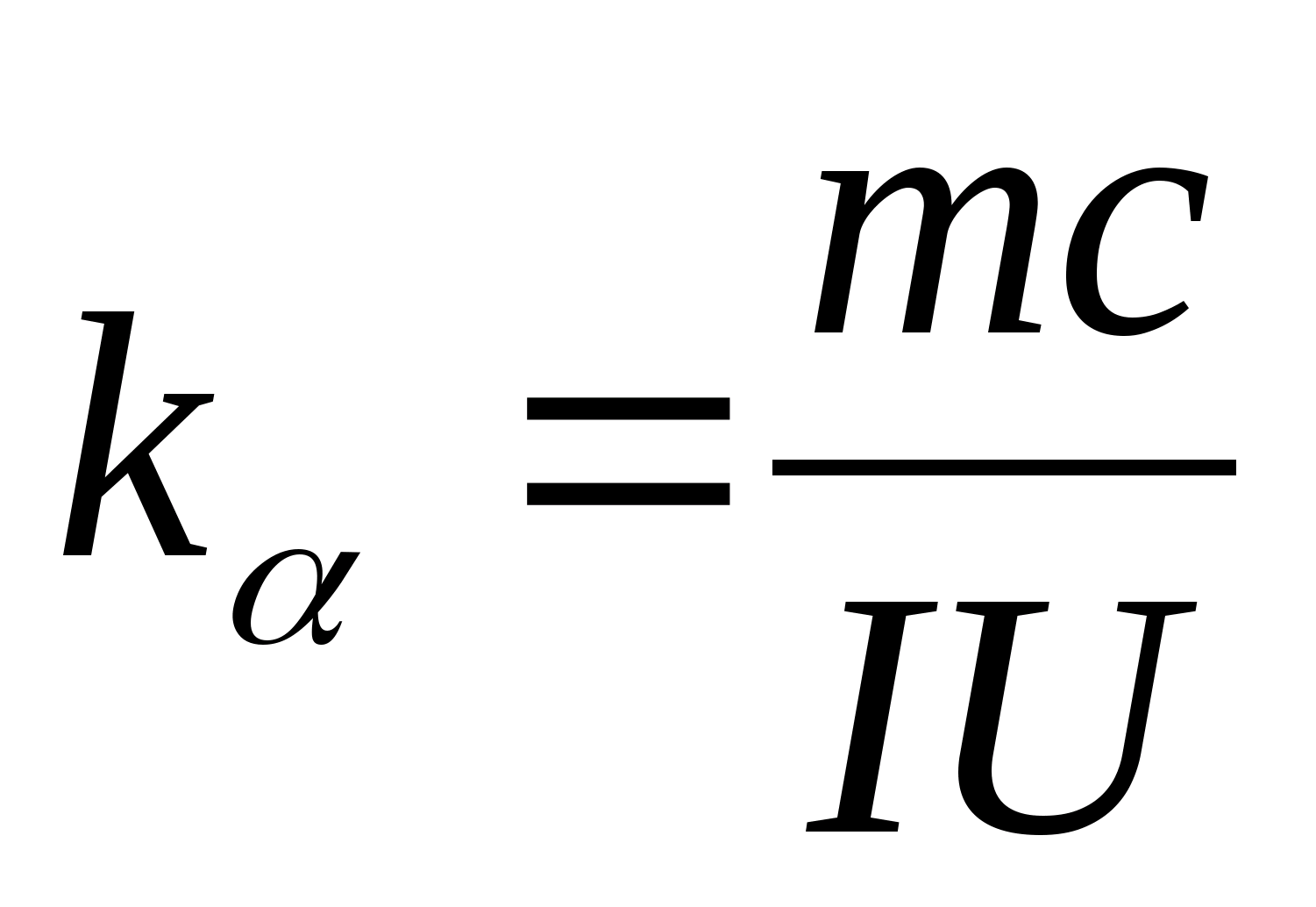 kapasitas panas spesifik sampel dapat ditentukan.
kapasitas panas spesifik sampel dapat ditentukan.
Deskripsi pengaturan laboratorium
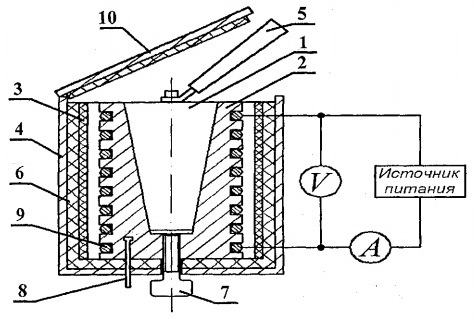
Untuk menentukan kapasitas panas padatan, pengaturan eksperimental FPT1-8 dirancang, tampilan umum ditunjukkan pada Gambar. 8.1. Instalasi terdiri dari tiga bagian utama: unit instrumen 1, unit elemen operasi 2 dan rak 3.
Di panel depan unit kontrol 1 terdapat: sakelar sakelar "JARINGAN", yang menghubungkan unit ke jaringan tegangan suplai; sakelar sakelar "PEMANASAN", yang menyalakan pemanas; regulator "PEMANASAN", dengan bantuan yang mengatur daya pemanas; voltmeter dan ammeter, yang mengukur tegangan dan arus di sirkuit pemanas; stopwatch, yang mengukur waktu pemanasan kalorimeter. Stopwatch diaktifkan saat unit instrumen dihidupkan.
Blok elemen kerja 2 ditutup di depan dengan layar yang dapat dilepas dari org. kaca. Saat melakukan pekerjaan, layar digantung di dinding belakang blok elemen kerja. Pada blok panel elemen kerja terdapat termometer digital 6 untuk mengukur suhu. Di bagian bawah sarang terdapat 5 sampel uji yang terbuat dari berbagai bahan dan pegangan untuk meletakkan sampel di dalam pemanas.
Pemanas 4 terdiri dari selubung logam, bahan isolasi panas, dan kalorimeter.

Sampel dipanaskan dalam kalorimeter, skemanya ditunjukkan pada Gambar. 8.2.
Kalorimeter adalah kasing kuningan 2 dengan lubang berbentuk kerucut, tempat sampel uji 1 dimasukkan. Pada permukaan luar kasing, koil pemanas 9 ditempatkan di alur khusus. Di luar, kasing kalorimeter diisolasi secara termal dengan lapisan asbes 3 dan serat gelas 6 dan ditutup dengan selongsong aluminium 4. Kalorimeter ditutup dengan penutup insulasi panas 10. Setelah percobaan berakhir, sampel dapat didorong keluar dari lubang kerucut badan kalorimeter dengan bantuan sekrup 7. Untuk mengeluarkan sampel yang dipanaskan dari kalorimeter dan memasang sampel ke dalam pemanas, digunakan pegangan 5, yang terletak di soket khusus di sebelah sampel yang diteliti.
Suhu kalorimeter diukur dengan termometer digital, sensor suhu 8 di antaranya terletak di rumahan 2 kalorimeter.
Keamanan
Saat melakukan pekerjaan, persyaratan keselamatan umum di laboratorium mekanik diperhatikan.
Perintah kerja
PERHATIAN! Kalorimeter membutuhkan waktu lama untuk menjadi dingin, jadi setelah mengukur semua nilai waktu 0 pemanasan kalorimeter kosong, segera matikan pemanas (lihat poin 4 di bawah). Suhu pemanasan maksimum untuk unit ini adalah +44С.
1. Lepaskan penutup transparan unit elemen kerja instalasi dan gantung di sekrup panel belakang. Setel kenop kontrol HEAT ke minimum. Nyalakan penginstalan dengan sakelar sakelar "JARINGAN".
2. Tutup rapat kalorimeter kosong. Nyalakan sakelar sakelar "PANAS". Dengan menggunakan pengatur HEAT, setel voltase ke 10-20 V (semakin tinggi voltase, semakin cepat pemanasannya). Tulis di tabel. 8.1 nilai tegangan yang dipilih AS dan saat ini SAYA.
3. Mulai dari temperatur kalorimeter T 0 yang ditentukan oleh guru, setelah selang waktu 1С masukkan ke dalam tabel. 8.1 nilai waktu 0 sesuai dengan setiap suhu yang dicapai T.
4. Matikan sakelar sakelar "PANAS", buka tutupnya dan dinginkan kalorimeter ke suhu awal T 0 . Untuk mendinginkan kalorimeter dengan cepat, Anda dapat menurunkan salah satu sampel ke dalam kalorimeter, kecuali yang ditunjukkan oleh guru (saat memasang sampel ke dalam kalorimeter, putar sekrup di bagian bawah kalorimeter ke kiri). Suhu akan mulai turun. Saat laju pendinginan berkurang, keluarkan sampel yang dipanaskan dan masukkan yang berikutnya (dingin), kecuali yang ditunjukkan oleh guru. Untuk melepaskan sampel, putar sekrup di bagian bawah kalorimeter ke kanan (searah jarum jam), lalu tarik keluar sampel dengan pegangannya.
Tabel 8.1
|
T= T− T 0 , |
= − 0 , |
J/(kgK) |
C M =DenganM, J/(molK) |
||||||||
5. Putar sekrup ke kiri, masukkan salah satu contoh uji, yang diambil sesuai petunjuk guru, ke dalam kalorimeter. Tutup tutup kalorimeter dengan rapat dan tunggu 2-3 menit agar kalorimeter dan suhu sampel sama.
6. Nyalakan sakelar sakelar "PANAS" dan setel voltase yang sama di sirkuit seperti saat memanaskan kalorimeter kosong.
7. Dimulai dari temperatur kalorimeter awal yang sama T 0, setelah selang waktu 1С masukkan ke dalam tabel. 8.1 nilai waktu sesuai dengan masing-masing suhu yang dicapai T.
8. Setel pengatur "PEMANASAN" ke posisi paling kiri (minimal), matikan sakelar sakelar "PEMANASAN", buka tutup kalorimeter. Untuk mengeluarkan sampel dari kalorimeter, putar sekrup ke kanan, kemudian keluarkan sampel yang telah dipanaskan dengan menggunakan pegangan.
9. Matikan unit dengan sakelar sakelar "JARINGAN".
10. Terjemahkan semua nilai besaran 0 dan menjadi nilai dalam detik (tanpa menit) dan masukkan ke dalam tabel. 8.1. Untuk setiap baris tabel. 8.1 menghitung nilai = − 0 dan T= T− T 0 .
11. Buatlah perkiraan perhitungan kapasitas panas spesifik sampel dengan menggunakan rumus 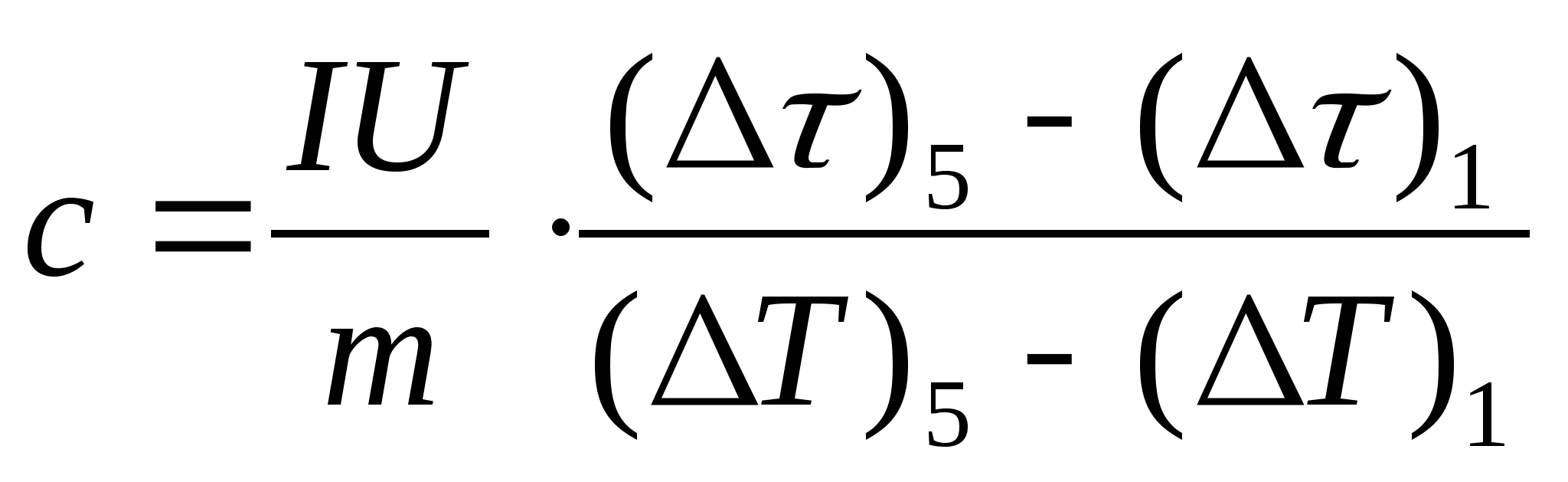 , dimana massa sampel M=139,5 g (kuningan) atau M=129,7 g (baja) atau
M=46,05 g (duralumin). Datang ke guru untuk verifikasi.
, dimana massa sampel M=139,5 g (kuningan) atau M=129,7 g (baja) atau
M=46,05 g (duralumin). Datang ke guru untuk verifikasi.
Memproses hasil pengukuran
1. Plot
=f(T) ketergantungan perbedaan waktu pemanasan kalorimeter dengan sampel dan kalorimeter kosong pada perubahan suhu kalorimeter, pilih dua titik mana pun pada grafik dan tentukan kemiringan garis lurus menggunakan rumus 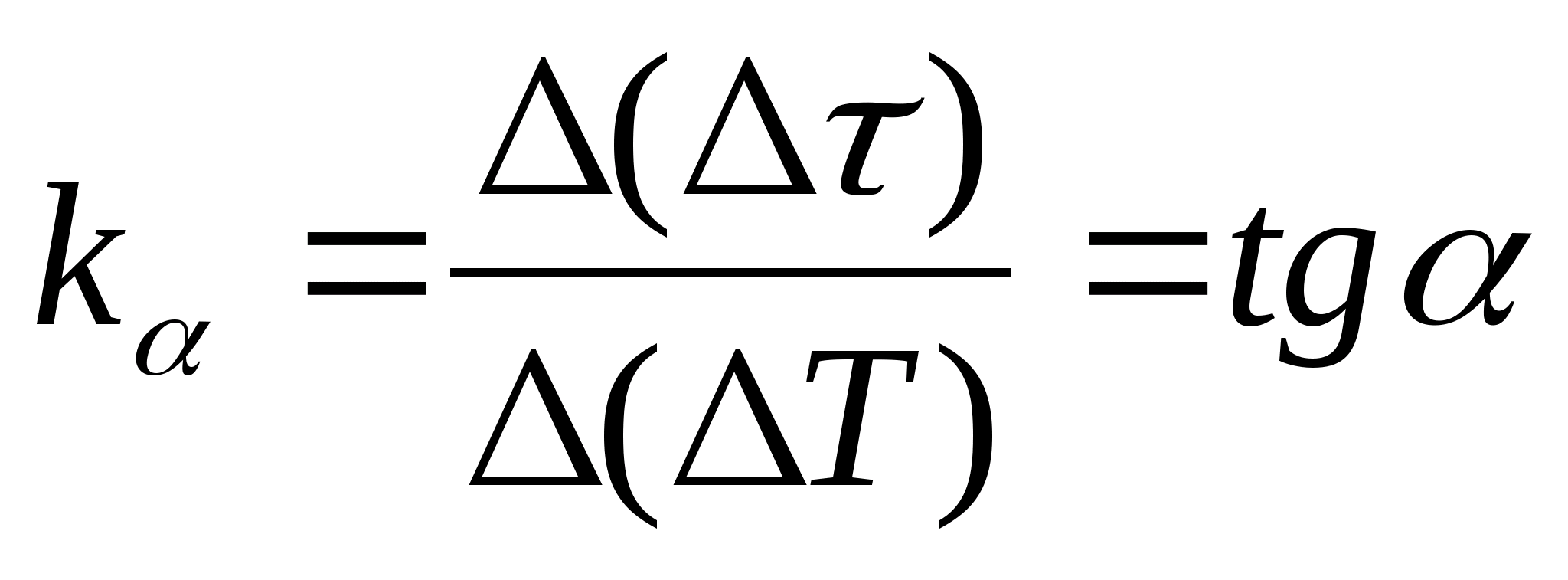 , Di mana
− sudut kemiringan grafik ke sumbu T
(jika satuan
dan T ditampilkan pada kedua sumbu sebagai segmen dengan panjang yang sama).
, Di mana
− sudut kemiringan grafik ke sumbu T
(jika satuan
dan T ditampilkan pada kedua sumbu sebagai segmen dengan panjang yang sama).
2. Menggunakan nilai kemiringan k
, tentukan kapasitas panas spesifik sampel menggunakan rumus 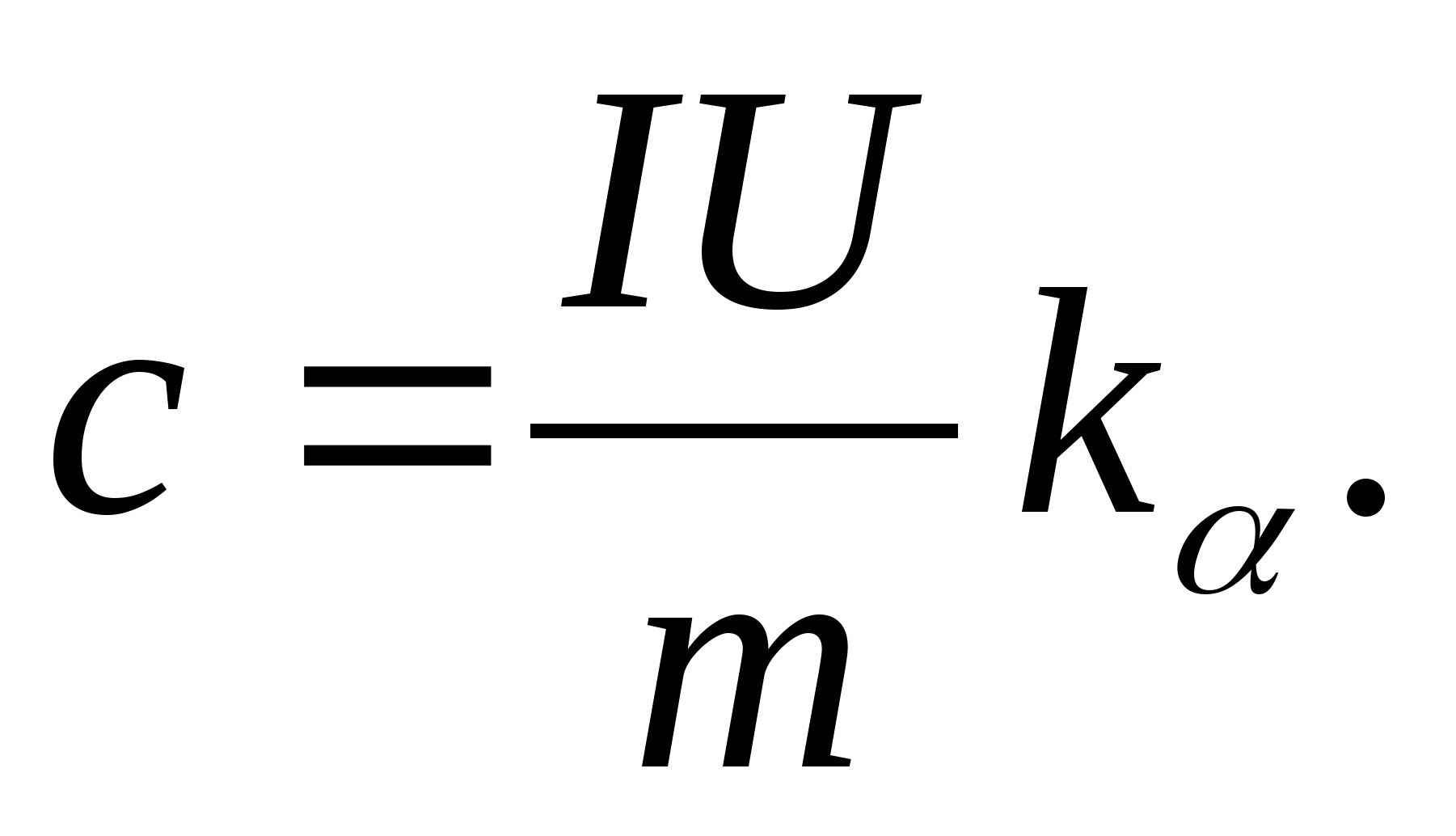
3. Dengan menggunakan data pada tabel 8.2 (atau tabel periodik), tentukan kapasitas kalor molar sampel menggunakan rumus C M =DenganM.
Tabel 8.2
|
Bahan sampel |
Massa atom, kg/mol |
|
Sebagai model benda padat, mari kita pertimbangkan kisi kristal yang dibangun dengan benar, di simpul di mana partikel (atom, ion, molekul), diambil sebagai titik material, berosilasi di sekitar posisi kesetimbangannya - simpul kisi - dalam tiga arah yang saling tegak lurus . Jadi, setiap partikel yang menyusun kisi kristal diberi tiga derajat kebebasan vibrasi, yang masing-masing, menurut hukum ekuipartisi energi terhadap derajat kebebasan (lihat § 50), memiliki energi kT.
Energi internal dari satu mol benda padat
U m \u003d 3N A kT \u003d 3RT,
di mana N A adalah konstanta Avogadro; N SEBUAH k= R (R adalah konstanta gas molar).
Kapasitas panas molar dari padatan
yaitu kapasitas panas molar (atomik). tubuh sederhana secara kimiawi dalam keadaan kristal adalah sama (sama dengan 3 R) dan tidak bergantung pada temperatur. Hukum ini diperoleh secara empiris oleh ilmuwan Perancis P. Dulong (1785-1838) dan L. Petit (1791-1820) dan NamaHukum Dulong dan Petit.
Jika padatan adalah senyawa kimia (misalnya NaCl), maka jumlah partikel dalam mol tidak sama dengan konstanta Avogadro, tetapi sama dengan nN SEBUAH , Di mana N - jumlah atom dalam molekul (untuk NaCl, jumlah partikel dalam mol adalah 2 N dan, jadi, satu mol NaCl mengandung atom N A Na dan atom N A Cl). Jadi kapasitas panas molar senyawa kimia padat
C V \u003d 3R25n J / (mol K),
yaitu, sama dengan jumlah kapasitas panas atom dari unsur-unsur yang membentuk senyawa ini.
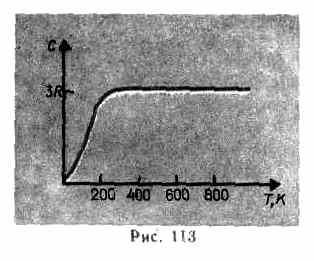
Seperti yang ditunjukkan oleh data eksperimen (Tabel 4), untuk banyak zat, hukum Dulong dan Petit dipenuhi dengan perkiraan yang cukup baik, meskipun beberapa zat (C, Be, B) memiliki penyimpangan yang signifikan dari kapasitas panas yang dihitung. Selain itu, seperti dalam kasus gas (lihat § 53), percobaan mengukur kapasitas panas zat padat pada suhu rendah telah menunjukkan bahwa ia bergantung pada suhu (Gbr. 113). Mendekati nol Kelvin, kapasitas kalor benda sebanding dengan T 3 , dan hanya pada suhu yang cukup tinggi, karakteristik masing-masing zat, kondisi (73.1) terpenuhi. Berlian, misalnya, memiliki kapasitas panas 3 R pada 1800 K! Namun, untuk sebagian besar padatan, suhu ruangan sudah cukup tinggi.
Perbedaan antara nilai eksperimental dan teoritis dari kapasitas panas dihitung
dasar teori klasik, dijelaskan, berdasarkan teori kuantum kapasitas panas, A. Einstein dan P. Debye (1884-1966).
§ 74. Penguapan, sublimasi, peleburan dan kristalisasi. Tubuh amorf
Baik dalam cairan maupun padatan, selalu ada sejumlah molekul tertentu yang energinya cukup untuk mengatasi tarikan ke molekul lain dan yang mampu melepaskan diri dari permukaan cairan atau padatan dan masuk ke ruang di sekitarnya. Proses untuk cairan ini disebut penguapan(atau penguapan), untuk padatan - sublimasi(atau sublimasi).
Penguapan cairan terjadi pada suhu berapa pun, tetapi intensitasnya meningkat dengan meningkatnya suhu. Seiring dengan proses penguapan, terjadi proses kompensasi kondensasi uap menjadi cair. Jika jumlah molekul yang meninggalkan cairan per satuan waktu melalui permukaan satuan sama dengan jumlah molekul yang berpindah dari uap ke cairan, maka keseimbangan dinamis antara proses evaporasi dan kondensasi. Uap yang berada dalam kesetimbangan dengan cairannya disebut kaya(lihat juga § 62).
Untuk sebagian besar padatan, proses sublimasi pada suhu biasa dapat diabaikan dan tekanan uap di atas permukaan padatan rendah; itu meningkat dengan meningkatnya suhu. Sublimasi zat secara intensif seperti naftalena, kapur barus, yang dideteksi oleh bau khas yang tajam. Sublimasi terjadi terutama secara intensif dalam ruang hampa - ini digunakan untuk membuat cermin. Contoh sublimasi yang terkenal adalah transformasi es menjadi uap - cucian basah mengering dalam cuaca dingin.
Jika benda padat dipanaskan, maka itu energi dalam(jumlah energi getaran partikel di lokasi kisi dan energi interaksi partikel-partikel ini) meningkat. Saat suhu naik, amplitudo partikel berosilasi
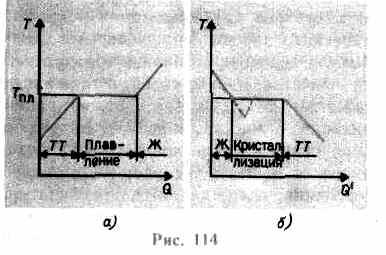
meningkat sampai kisi kristal runtuh - padatan meleleh. Pada ara. 114 SEBUAH perkiraan ketergantungan ditampilkan T(Q), Di mana Q- jumlah panas yang diterima tubuh selama pencairan. Sebagai pesan untuk padat kehangatan tubuh suhunya naik, dan pada titik lelehnya T pl memulai transisi tubuh dari keadaan padat ke keadaan cair. Suhu T pl tetap konstan sampai seluruh kristal meleleh, dan baru kemudian suhu cairan mulai naik lagi.
Memanaskan padatan hingga T pl belum mengubahnya menjadi keadaan cair, karena energi partikel zat harus cukup untuk menghancurkan kisi kristal. Dalam proses peleburan, panas yang diberikan ke zat digunakan untuk melakukan kerja penghancuran kisi kristal, dan karenanya T pl = konstan hingga seluruh kristal meleleh. Kemudian panas yang disuplai akan kembali meningkatkan energi partikel cairan dan suhunya akan mulai naik. Banyaknya kalor yang diperlukan untuk meleburkan 1 kg suatu zat disebut panas fusi spesifik.
Jika cairan didinginkan, maka proses berlangsung berlawanan arah (Gbr. 114, b; Q" - jumlah panas yang dilepaskan oleh tubuh selama kristalisasi): pertama, suhu cairan menurun, kemudian pada suhu konstan sama dengan T pl, dimulai kristalisasi, setelah selesai, suhu kristal mulai menurun. Untuk kristalisasi suatu zat, keberadaannya disebut pusat kristalisasi - inti kristal, yang tidak hanya berupa kristal dari zat yang terbentuk, tetapi juga kotoran, serta debu, jelaga, dll. Tidak adanya pusat kristalisasi dalam cairan murni mempersulit pembentukan kristal mikroskopis, dan zat tersebut, tersisa dalam keadaan cair, mendingin ke suhu yang lebih rendah dari suhu kristalisasi, sehingga terbentuk cairan superdingin(pada 114, b itu sesuai dengan kurva putus-putus). Dengan supercooling yang kuat, pembentukan pusat kristalisasi secara spontan dimulai dan zat mengkristal dengan agak cepat.
Biasanya, supercooling lelehan terjadi dari pecahan hingga puluhan derajat, namun untuk sejumlah zat bisa mencapai ratusan derajat. Karena viskositasnya yang tinggi, cairan yang sangat dingin kehilangan fluiditasnya, mempertahankan bentuknya, seperti padatan. Badan-badan ini disebut padatan amorf; ini termasuk resin, lilin, lilin penyegel, kaca. Badan amorf, menjadi cairan yang sangat dingin, isotropik, yaitu, propertinya sama di semua arah; bagi mereka, serta untuk cairan, itu adalah karakteristik urutan jarak pendek dalam susunan partikel; di dalamnya, berbeda dengan cairan, mobilitas partikel agak kecil. Ciri benda amorf adalah bahwa mereka tidak memiliki titik leleh tertentu, yaitu, tidak mungkin untuk menunjukkan suhu tertentu di atas yang dapat dipastikan keadaan cair, dan di bawah keadaan padat. Dari pengalaman diketahui bahwa pada benda amorf proses kristalisasi dapat diamati dari waktu ke waktu, misalnya kristal muncul di kaca; itu, kehilangan transparansi, mulai menjadi keruh dan berubah menjadi tubuh polikristalin.
Baru-baru ini, penggunaan luas di ekonomi Nasional telah mendapatkan polimer- benda amorf organik, yang molekulnya terdiri dari sejumlah besar rantai molekul panjang identik yang dihubungkan oleh ikatan kimia (valensi). Polimer meliputi zat organik alami (pati, protein, karet, serat, dll.) Dan buatan (plastik, karet, polistiren, lavsan, nilon, dll.). Polimer memiliki kekuatan dan elastisitas yang melekat; beberapa polimer menahan peregangan 5-10 kali panjang aslinya. Ini dijelaskan oleh fakta bahwa rantai molekul yang panjang dapat, di bawah deformasi, terlipat menjadi bola padat atau meregang menjadi garis lurus. Elastisitas polimer memanifestasikan dirinya hanya dalam kisaran suhu tertentu, di bawahnya menjadi keras dan rapuh, dan di atas - plastik. Meskipun banyak bahan polimer sintetik telah dibuat (serat buatan, pengganti kulit, bahan bangunan, pengganti logam, dll.), Teori polimer belum sepenuhnya berkembang. Perkembangannya ditentukan oleh tuntutan teknologi modern, yang membutuhkan sintesis polimer dengan sifat yang telah ditentukan.
Kapasitas panas spesifik suatu zat dipahami sebagai nilai
, (1)
dimana jumlah panas yang diberikan ke tubuh.
adalah perubahan suhu yang terjadi pada
sebagai akibat perpindahan panas ke tubuh,
m adalah massa benda yang dipanaskan.
Pengalaman biasanya menentukan rata-rata panas spesifik zat c, secara numerik sama dengan jumlah panas yang harus diberikan pada satu satuan massa zat ini untuk menaikkan suhunya dengan:
(2),
di mana perbedaan antara suhu akhir dan awal tubuh yang diteliti.
Berbagai metode kalorimetrik digunakan untuk menentukan kapasitas kalor secara eksperimental. Keragaman metode ini disebabkan oleh fakta bahwa pengukuran yang akurat dari jumlah panas yang diberikan ke tubuh memerlukan penghapusan kehilangan panas yang tidak diperhitungkan saat memanaskan tubuh yang diteliti.
Biasanya, dalam apa yang disebut kalorimeter dengan cangkang isotermal, koreksi radiasi yang dihitung atau ditentukan secara eksperimental diperkenalkan, yaitu, jumlah panas yang diterima atau dilepaskan kalorimeter ke lingkungan eksternal melalui radiasi selama percobaan.
Namun, dimungkinkan untuk secara signifikan mengurangi kehilangan panas dengan memperkenalkan isolasi termal yang baik atau dengan mengurangi durasi percobaan, yang dicapai dengan laju pemanasan sampel yang tinggi ~ (metode pulsa untuk mengukur kapasitas panas), di mana kehilangan panas akan menjadi kecil dibandingkan dengan jumlah total panas yang diberikan.
Salah satu metode yang paling akurat untuk menentukan kapasitas panas adalah metode kalorimeter adiabatik. Kesulitan yang terkait dengan kebutuhan untuk memperhitungkan kehilangan panas dalam kalorimeter jenis ini dihilangkan dengan fakta bahwa pengukuran dilakukan dalam kondisi kesetimbangan termal, yaitu, dalam kondisi suhu yang sama dari sampel yang diteliti dan blok yang mengelilingi sampel. . Keuntungan dari metode ini, bersama dengan akurasi yang tinggi, juga termasuk kemungkinan untuk menentukan kapasitas panas padatan dalam rentang suhu yang luas, yang sangat penting jika zat mengalami transformasi fasa.
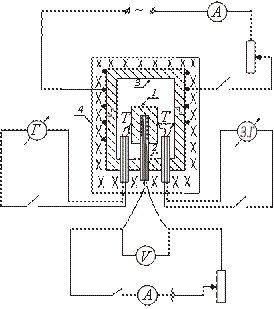
Perangkat salah satu jenis kalorimeter adiabatik ditunjukkan secara skematis pada gambar. Sampel uji 1 ditempatkan di blok tembaga 3 dan bersama-sama dipanaskan di tungku 4. Pemanas 2 dimasukkan ke dalam sampel, yang memungkinkan pemanasan tambahan pada sampel.
Setelah menyalakan tungku 4, di mana balok dengan sampel ditempatkan, suhu sampel mulai naik, tetap di bawah suhu balok. Untuk menetapkan kesetaraan antara suhu sampel dan blok, nyalakan pemanas yang ditempatkan di dalam sampel. Ketika suhu sampel sedikit di atas suhu blok, pemanas internal dimatikan.
Selanjutnya pemanas ini dinyalakan dan dimatikan secara berkala, sehingga perbedaan temperatur antara sampel dan blok berubah tanda setiap saat.
Pada saat sama dengan nol (saat pemanas internal menyala), tidak ada pertukaran panas antara sampel dan blok, dan seluruh jumlah panas yang dilepaskan oleh pemanas internal hanya digunakan untuk memanaskan sampel; kalor jenis dalam hal ini dapat ditentukan dengan rumus (2).
Jumlah panas yang dilepaskan oleh pemanas internal ditentukan dengan rumus:
di mana saya adalah arus pemanas internal;
V adalah penurunan tegangan;
- interval waktu di mana suhu meningkat sebesar .
Kemudian
(4)
di mana waktu di mana suhu sampel berubah sebesar .
Dalam bentuk diferensial, rumus (4) memiliki bentuk
(5)
Suhu sampel diukur dengan termokopel T. Perbedaan suhu antara blok dan sampel diukur dengan termokopel diferensial. Untuk menentukan suhu sampel, digunakan kurva kalibrasi termokopel T. Perbedaan suhu antara balok dan sampel ditentukan dalam pembagian skala galvanometer (karena hanya perlu untuk memperbaiki momen ketika perbedaan suhu antara balok dan tanda perubahan sampel).
Menyelesaikan pekerjaan.
Sampel diletakkan pada pemanas yang ditempatkan di dalam blok tembaga. Persimpangan termokopel T dan terhubung ke sampel dan blok. Oven ditutup dengan penutup. Gulungan listrik tungku, tempat blok ditempatkan, dihidupkan. Pemanas yang ditempatkan di dalam sampel dihidupkan dan dimatikan secara berkala, dan nilai I dan V dicatat di sirkuit pemanas internal.
Sebelum memulai pengukuran, perlu untuk memeriksa posisi nol galvanometer cermin. Untuk melakukan ini, dengan melepaskan termokopel dari galvanometer, mereka mengharapkan kelinci berhenti berfluktuasi di sepanjang skala. Jika setelah ini gambar utas tidak sesuai dengan nol, maka dengan memindahkan skala kebetulan ini tercapai.
Kurva ketergantungan T dan tepat waktu diplot.
Dari kemiringan kurva T(t) pada titik di mana ia berubah tanda (yaitu, ketika kesetimbangan termal terbentuk), panas jenis dihitung dengan menggunakan rumus (5). Kapasitas panas ini mengacu pada suhu yang akan dibaca dari kurva T(t) pada saat perbedaan suhu antara balok dan sampel berubah tanda.
