Kapasitas panas hidrogen sulfida pada berbagai suhu. Kapasitas panas spesifik gas alam
Tidak spesifik, tetapi kapasitas termal total, dalam pengertian fisik yang diterima secara umum, adalah kemampuan suatu zat untuk memanas. Setidaknya itulah yang dikatakan buku teks fisika termal kepada kita - ini definisi klasik kapasitas panas(kata-kata yang benar). Sebenarnya, ini adalah fitur fisik yang menarik. Sedikit yang kita ketahui dalam kehidupan sehari-hari "sisi koin." Ternyata ketika panas disuplai dari luar (pemanasan, pemanasan), tidak semua zat bereaksi sama terhadap panas ( energi termal) dan memanas secara berbeda. Kemampuan GAS yang berasal dari alam digunakan sebagai bahan bakar menerima, menerima, mempertahankan, dan mengumpulkan (mengakumulasi) energi panas disebut kapasitas panas gas yang mudah terbakar ALAMI. Dan dirinya sendiri kapasitas panas metana, adalah karakteristik fisik yang menggambarkan sifat termofisika bahan bakar gas. Pada saat yang sama, dalam aspek penerapan yang berbeda, tergantung pada kasus praktis tertentu, satu hal mungkin menjadi penting bagi kami. Misalnya: kemampuan suatu zat untuk mengambil hangat atau kemampuan untuk mengumpulkan energi termal atau "bakat" untuk menyimpannya. Namun, terlepas dari beberapa perbedaan, dalam arti fisik, sifat-sifat yang kita butuhkan akan dijelaskan kapasitas panas metana.
Hal mendasar yang kecil, tetapi sangat "menjijikkan" adalah kemampuan untuk memanas - kapasitas termal metana, berhubungan langsung tidak hanya dengan komposisi kimia, struktur molekul suatu zat, tetapi juga dengan kuantitasnya (berat, massa, volume). Karena koneksi yang "tidak menyenangkan" seperti itu, sang jenderal kapasitas panas metana menjadi karakteristik fisik zat yang terlalu merepotkan. Karena, satu parameter yang diukur secara bersamaan menggambarkan "dua hal yang berbeda". Yaitu: sangat mencirikan sifat termofisika GAS ALAMI, namun, "secara sepintas" juga memperhitungkan kuantitasnya. Membentuk semacam karakteristik integral, di mana fisika termal "tinggi" dan jumlah materi "dangkal" (dalam kasus kami: bahan bakar gas) terhubung secara otomatis.
Nah, mengapa kita membutuhkan karakteristik termofisika seperti itu, di mana "jiwa yang tidak memadai" dilacak dengan jelas? Dari sudut pandang fisika, total kapasitas panas metana(dengan cara yang paling kikuk), mencoba tidak hanya menggambarkan jumlah energi panas yang dapat terakumulasi dalam bahan bakar gas, tetapi juga "secara sepintas memberi tahu kami" tentang jumlah GAS ALAMI YANG TERBAKAR. Ternyata absurditas, dan tidak jelas, dapat dimengerti, stabil, benar karakteristik termofisika metana. Alih-alih konstanta berguna yang cocok untuk praktis perhitungan termofisika, kita diberikan parameter mengambang, yang merupakan jumlah (integral) dari jumlah panas yang diterima GAS ALAM dan massa atau volume metananya.
Terima kasih, tentu saja, untuk "antusiasme" seperti itu, tetapi jumlahnya BAHAN BAKAR ALAMI Saya bisa mengukur diri saya sendiri. Setelah menerima hasil dalam bentuk "manusia" yang jauh lebih nyaman. Kuantitas GAS ALAMI YANG TERBAKAR Saya tidak ingin "mengekstrak" dengan metode matematika dan perhitungan menggunakan rumus kompleks dari umum kapasitas panas metana, pada suhu yang berbeda, tetapi cari tahu berat (massa) dalam gram (g, g), kilogram (kg), ton (ton), kubus (meter kubik, meter kubik, m3), liter (l) atau mililiter (ml ). Terutama sejak orang pintar lama datang dengan alat ukur yang cukup cocok untuk tujuan ini. Misalnya: timbangan atau perangkat lainnya.
Terutama "sifat mengambang yang mengganggu" dari parameter: umum kapasitas panas GAS yang terjadi secara alami. "Suasana hatinya" yang tidak stabil dan berubah-ubah. Saat mengubah "ukuran atau dosis penyajian", kapasitas panas GAS ALAM pada suhu yang berbeda segera berubah. Campuran gas yang lebih mudah terbakar, kuantitas fisik, nilai absolut kapasitas panas metana- meningkat. Lebih sedikit jumlah campuran gas yang mudah terbakar, nilai kapasitas termal metana menurun. "Memalukan" beberapa ternyata! Dengan kata lain, apa yang kita "miliki" sama sekali tidak dapat dianggap sebagai deskripsi konstan karakteristik termofisika GAS ALAM pada suhu yang berbeda. Dan diinginkan bagi kita untuk "memiliki" koefisien konstan yang dapat dimengerti, parameter referensi yang menjadi ciri sifat termal bahan bakar gas, tanpa "referensi" untuk jumlah metana (berat, massa, volume). Apa yang harus dilakukan?
Di sinilah metode yang sangat sederhana namun "sangat ilmiah" datang untuk menyelamatkan kita. Bukan hanya juru sita "ud. - spesifik", sebelum kuantitas fisik, tetapi untuk solusi elegan yang melibatkan pengecualian jumlah materi dari pertimbangan. Secara alami, parameter "tidak nyaman, berlebihan": massa atau volume GAS ALAMI YANG TERBAKAR benar-benar mustahil untuk dikesampingkan. Setidaknya dengan alasan bahwa jika tidak ada jumlah metana, maka tidak akan ada “subjek diskusi” itu sendiri. Dan substansinya harus. Oleh karena itu, kami memilih beberapa standar massa atau volume bersyarat, yang dapat dianggap sebagai unit yang cocok untuk menentukan nilai koefisien "C" yang kami butuhkan. Untuk berat bahan bakar GAS ALAMI, satuan massa metana, yang nyaman dalam penggunaan praktis, ternyata 1 kilogram (kg).
Sekarang kita kita memanaskan satu kilogram GAS ALAM sebesar 1 derajat, dan jumlah panas (energi termal) kita perlu memanaskan campuran gas satu derajat - ini adalah parameter fisik kami yang benar, koefisien "C", yah, cukup lengkap dan jelas menggambarkan salah satu dari sifat termofisika GAS ALAM pada suhu yang berbeda. Harap dicatat bahwa sekarang kita berurusan dengan deskripsi karakteristik sifat fisik substansi, tetapi tidak mencoba untuk "menambahkan informasi kepada kami" tentang kuantitasnya. Nyaman? Tidak ada kata-kata. Ini masalah yang sama sekali berbeda. Omong-omong, sekarang kita tidak berbicara tentang jenderal kapasitas termal metana. Semuanya telah berubah. INILAH PANAS KHUSUS GAS ALAM, yang terkadang disebut dengan nama lain. Bagaimana? BESAR-BESAR saja KAPASITAS PANAS DARI GAS ALAMI YANG TERBAKAR. Spesifik (ud.) Dan massa (m.) - dalam hal ini: sinonim, artinya di sini yang kita butuhkan koefisien "C".
Tabel 1. Koefisien: kapasitas panas spesifik GAS ALAM (sp.). Kapasitas termal massa GAS ALAMI yang mudah terbakar. Data referensi.
Sederhananya, kapasitas panas DARI tubuh disebut jumlah panas yang perlu dikeluarkan dalam proses ini untuk memanaskan tubuh satu derajat: .
Biasanya, kapasitas panas disebut unit jumlah zat dan, tergantung pada unit yang dipilih, mereka membedakan:
kapasitas panas massa spesifik Dengan, mengacu pada 1 kg gas, J/(kgK);
kapasitas panas volumetrik spesifik Dengan, mengacu pada jumlah gas yang terkandung dalam 1 m 3 volume dalam kondisi fisik normal, J / (m 3 K);
kapasitas panas molar spesifik Dengan, disebut satu kilomol, J / (kmolK).
Hubungan antara kapasitas panas spesifik ditentukan oleh hubungan yang jelas:
Dengan= μ Dengan/μ; Dengan´= Dengan n. (2.13)
Di sini n adalah kerapatan gas dalam kondisi normal.
Perubahan suhu tubuh dengan jumlah panas yang sama yang diberikan tergantung pada sifat proses yang terjadi, oleh karena itu kapasitas panas adalah fungsi dari proses. Ini berarti bahwa fluida kerja yang sama, tergantung pada prosesnya, membutuhkan jumlah panas yang berbeda untuk pemanasannya sebesar 1 K. Besaran numerik Dengan bervariasi dari + hingga – .
Dalam perhitungan termodinamika sangat penting memiliki:
kapasitas panas pada tekanan konstan
Dengan p = q p/ dT, (2.14)
q p , dibawa ke tubuh dalam proses pada tekanan konstan, ke perubahan suhu tubuh dT;
kapasitas panas pada volume konstan
Dengan v = δ q v /dT, (2.15)
sama dengan rasio jumlah panas q v, dibawa ke tubuh dalam proses pada volume konstan, ke perubahan suhu tubuh dT.
Sesuai dengan hukum pertama termodinamika untuk sistem tertutup q = du + pdv.
Mempertimbangkan fakta bahwa 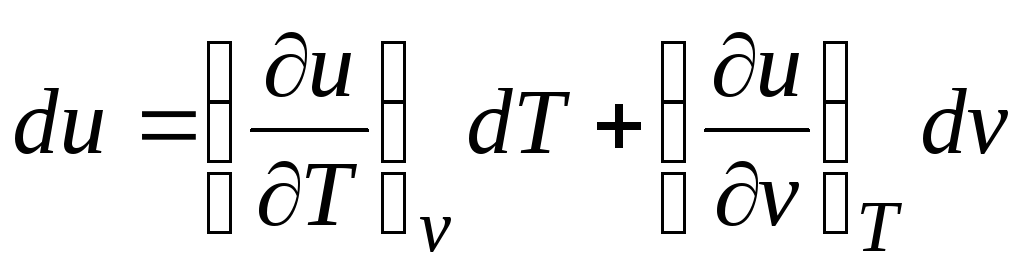 (hubungan (2.1))
(hubungan (2.1))
Δ q = (∂kamu/∂T) v dT + [(∂kamu/∂v) T + p]dv. (2.16)
Untuk proses isokhorik ( v=const) persamaan ini mengambil bentuk 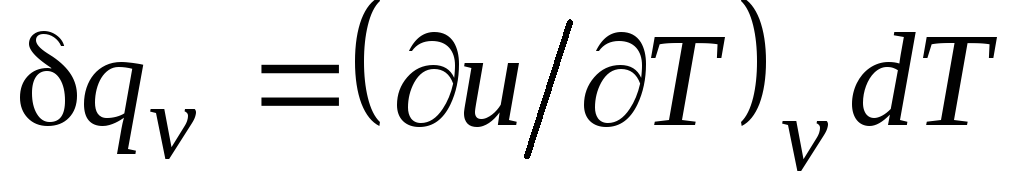 , dan, dengan mempertimbangkan (2.15), kita peroleh bahwa
, dan, dengan mempertimbangkan (2.15), kita peroleh bahwa
c v = (∂kamu/∂T) v . (2.17)
Untuk gas ideal
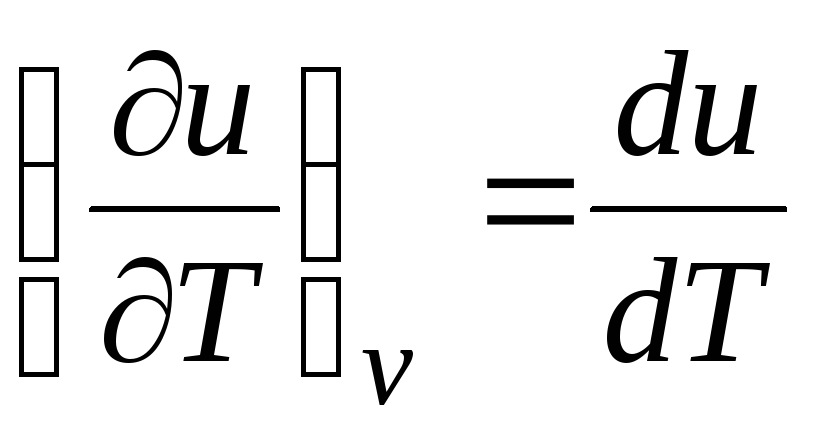 (persamaan 2.2), jadi
(persamaan 2.2), jadi
c v = du/dT. (2.18)
Untuk proses isobarik ( R=const) dari persamaan (2.16) dan (2.14) kita peroleh
c p = ( kamu/∂T) v + [(∂kamu/∂v) T + p](dv/dT) p
Karena energi dalam gas ideal ditentukan hanya oleh suhunya dan tidak bergantung pada volume spesifik, maka
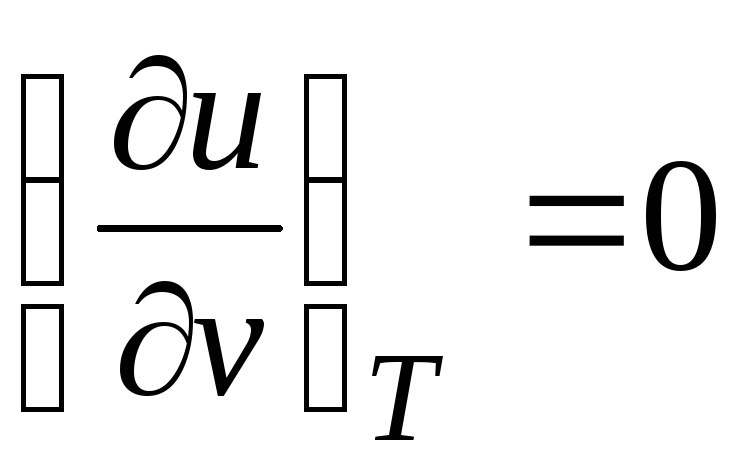 .
(2.19)
.
(2.19)
Dari persamaan Clapeyron (1.4) pv
= RT(1.3) berikut 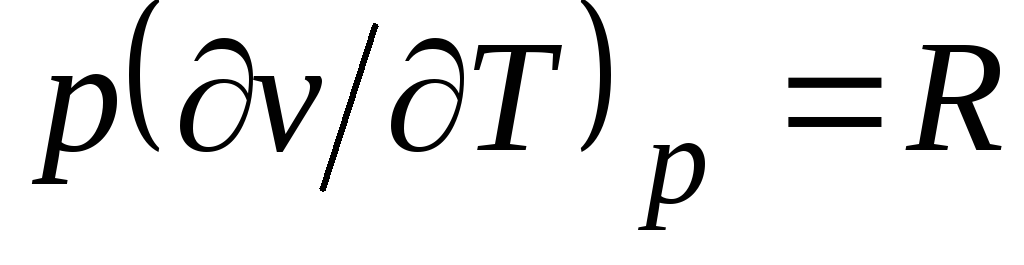 , di mana
, di mana
c p= Dengan v + R. (2.20)
Hubungan (2.20) disebut persamaan Mayer dan merupakan salah satu yang utama dalam termodinamika teknis gas ideal.
Dalam proses v\u003d const, panas yang diberikan ke gas hanya mengubah energi internalnya, sedangkan dalam proses p \u003d const, panas dihabiskan baik untuk meningkatkan energi internal maupun untuk melakukan pekerjaan ekspansi. Itu sebabnya c lebih banyak lagi Dengan v dengan jumlah pekerjaan ini.
Rumus ![]() menentukan apa yang disebut kapasitas panas sebenarnya, yaitu nilai kapasitas panas pada suhu tertentu. Dalam praktiknya, kapasitas panas banyak digunakan untuk menghitung jumlah panas q 12 , yang harus dikeluarkan untuk memanaskan tubuh dari satu suhu ( t 1) ke yang lain ( t 2) (atau yang akan dilepaskan setelah pendinginan dari t 2 sampai t 1).
menentukan apa yang disebut kapasitas panas sebenarnya, yaitu nilai kapasitas panas pada suhu tertentu. Dalam praktiknya, kapasitas panas banyak digunakan untuk menghitung jumlah panas q 12 , yang harus dikeluarkan untuk memanaskan tubuh dari satu suhu ( t 1) ke yang lain ( t 2) (atau yang akan dilepaskan setelah pendinginan dari t 2 sampai t 1).
Jika kapasitas panas tidak berubah dalam kisaran suhu yang ditunjukkan, maka
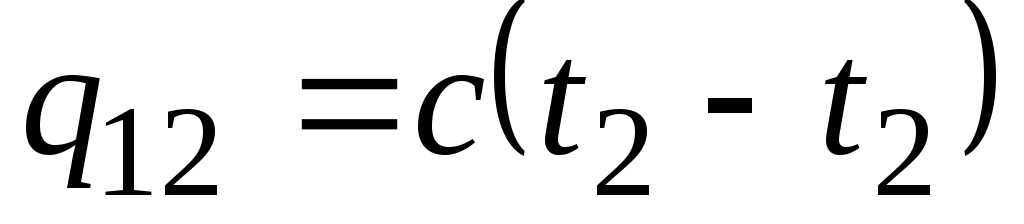 , kJ/kg dan
, kJ/kg dan 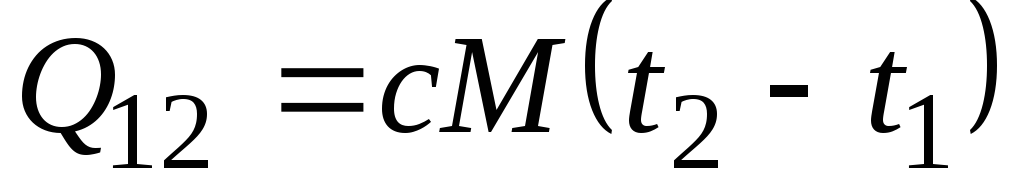 , kJ. (2.21)
, kJ. (2.21)
Rumus ini juga dapat digunakan untuk perhitungan perkiraan (tidak terlalu akurat). Misalnya, kapasitas kalor jenis air pada suhu kamar adalah 4,187 kJ/(kgC), dan udara 1 kJ/(kgC). Karena kapasitas panas hampir semua zat berubah (paling sering meningkat) dengan meningkatnya suhu, maka perlu, secara tegas, menggunakan rumus
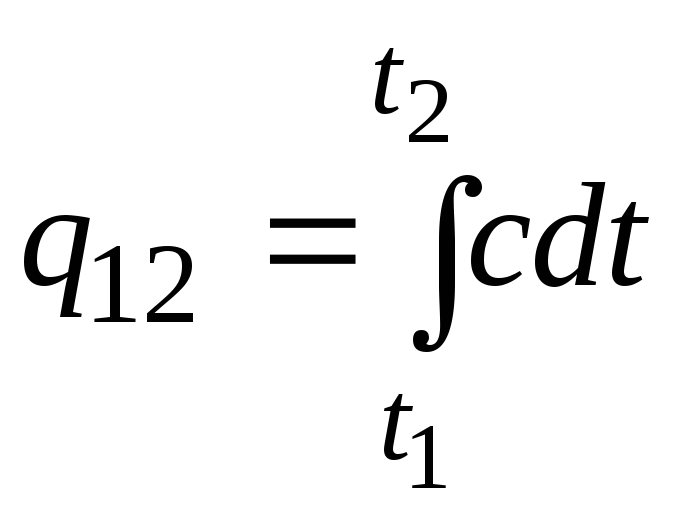 .
(2.21sebuah)
.
(2.21sebuah)
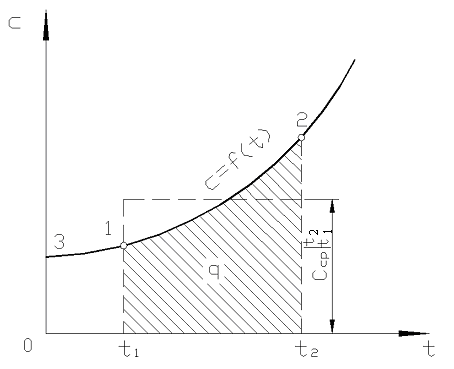
pada gambar. 2.2 besarnya q 12 ditampilkan sebagai area yang diarsir. Tampaknya cara termudah, dengan menerapkan teorema nilai rata-rata, adalah dengan menulis
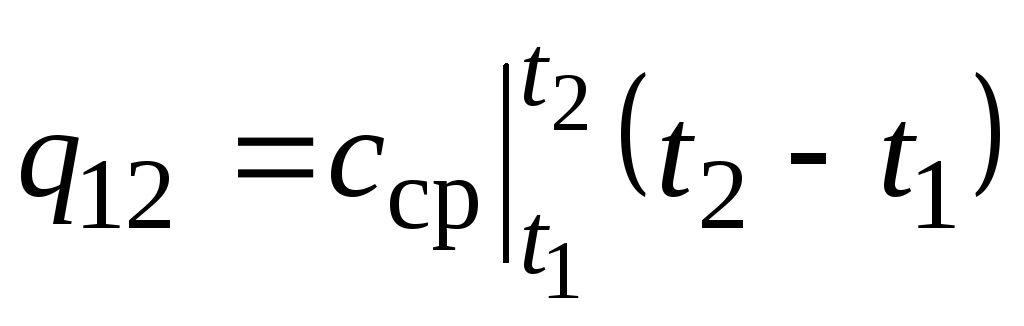 ,
(2.22)
,
(2.22)
di mana 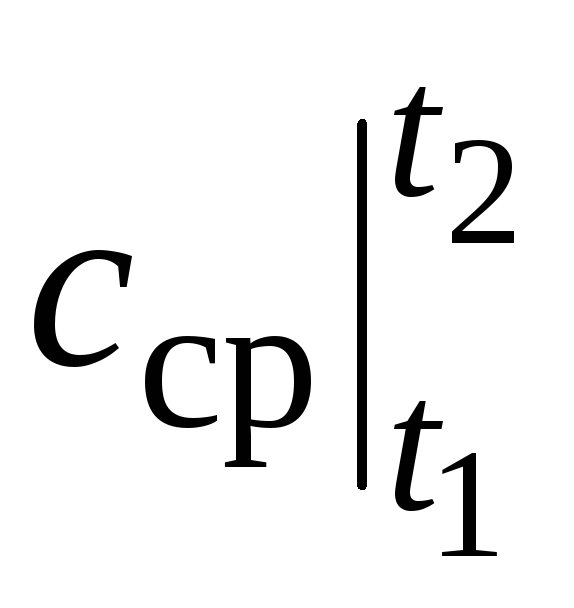 adalah kapasitas panas rata-rata dalam kisaran suhu t 1 …t 2 .
adalah kapasitas panas rata-rata dalam kisaran suhu t 1 …t 2 .
Beras. 2.2. Ketergantungan kapasitas panas sebenarnya pada suhu
Namun, untuk perhitungan nyata, notasi seperti itu sangat merepotkan, karena kapasitas panas dipilih dari tabel, dan 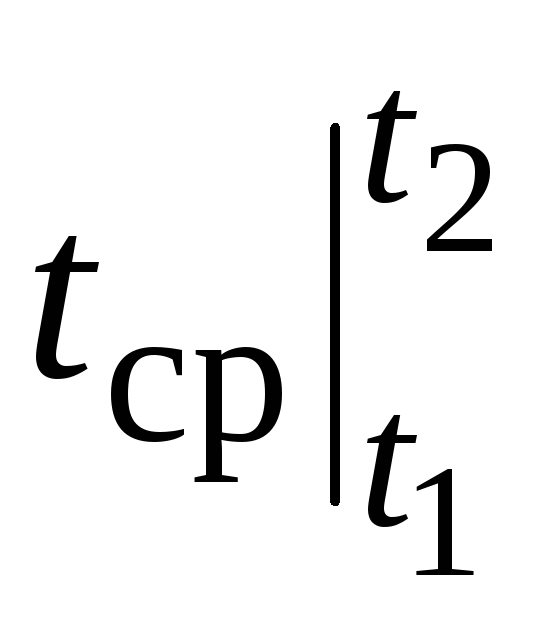 tergantung caranya t 1 dan dari t 2. Tabel fungsi dua argumen akan sangat rumit.
tergantung caranya t 1 dan dari t 2. Tabel fungsi dua argumen akan sangat rumit.
Dalam praktiknya, lanjutkan sebagai berikut. Jumlah panas yang diinginkan disajikan sebagai perbedaan antara jumlah yang dibutuhkan untuk memanaskan tubuh dari 0 ke suhu t 2 dan t 1 masing-masing (Gbr. 2.2)
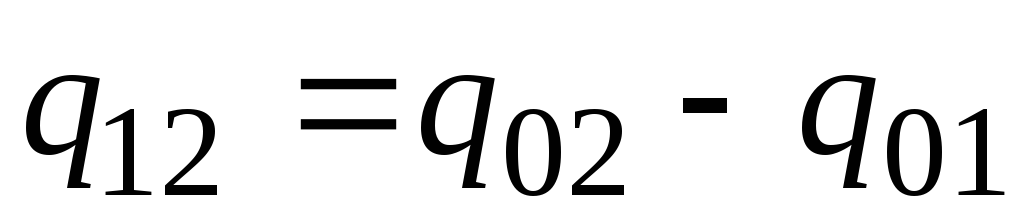 . (2.23)
. (2.23)
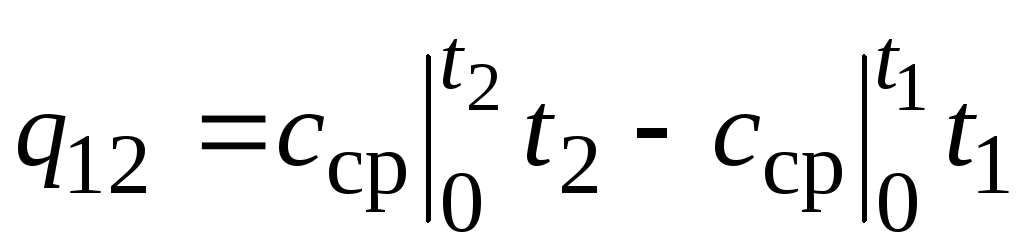 ,
(2.24)
,
(2.24)
di mana  - kapasitas panas rata-rata dalam kisaran suhu 0… t C.
- kapasitas panas rata-rata dalam kisaran suhu 0… t C.
Nilai kapasitas panas rata-rata  untuk zat tertentu (dan proses tertentu, mis. Dengan R atau c v) hanya bergantung pada satu suhu t. Kapasitas panas inilah yang diberikan di semua tabel dengan nama "rata-rata". Apa yang dikatakan benar untuk Dengan
(Dengan R dan c v), serta untuk Dengan dan Dengan. Sebagai contoh, tabel di bawah ini menunjukkan kapasitas panas versus suhu untuk beberapa gas yang paling umum. Perlu ditekankan bahwa dalam rumus (2.24) suhu disubstitusikan dalam derajat Celcius.
untuk zat tertentu (dan proses tertentu, mis. Dengan R atau c v) hanya bergantung pada satu suhu t. Kapasitas panas inilah yang diberikan di semua tabel dengan nama "rata-rata". Apa yang dikatakan benar untuk Dengan
(Dengan R dan c v), serta untuk Dengan dan Dengan. Sebagai contoh, tabel di bawah ini menunjukkan kapasitas panas versus suhu untuk beberapa gas yang paling umum. Perlu ditekankan bahwa dalam rumus (2.24) suhu disubstitusikan dalam derajat Celcius.
Kapasitas panas molar rata-rata berbagai gas pada R= konstan
(menurut M.P. Vukalovich, V.A. Kirillin, V.N. Timofeev)
|
t, C |
Dengan R, kJ/(kmolK) |
|||||||
|
N 2 atmosfer | ||||||||
Dalam tabel ini, nilai Dengan p diberikan melalui 100 . Karena mereka tidak banyak berubah dengan suhu, nilai antara dapat ditemukan dengan ekstrapolasi linier. Ingat bagaimana ini dilakukan. Ada nilai fungsi tabel kamu
= f(x) pada 1 (ketika X= X 1) dan pada 2 (ketika X= X 2). Nilai fungsi pada(X) pada X 1 <X<X 2 sama dengan 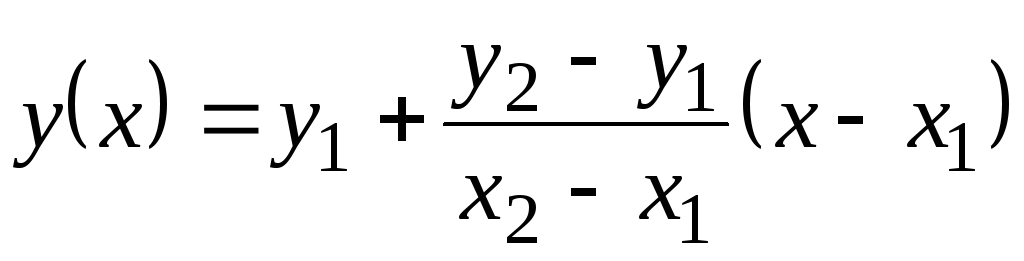 . Rumus ini berlaku baik untuk fungsi yang meningkat secara monoton (ketika pada 2 >pada 1) dan untuk penurunan monoton ( pada 2 <pada satu); Dalam hal ini, pecahannya akan negatif, karena X 2 > X 1 selalu.
. Rumus ini berlaku baik untuk fungsi yang meningkat secara monoton (ketika pada 2 >pada 1) dan untuk penurunan monoton ( pada 2 <pada satu); Dalam hal ini, pecahannya akan negatif, karena X 2 > X 1 selalu.
Tabel menunjukkan nilai konduktivitas termal gas tergantung pada suhu dan tekanan.
Nilai konduktivitas termal ditunjukkan untuk suhu dalam kisaran dari 20 K (-253 °C) hingga 1500 K (1227 °C) dan tekanan dari 1 hingga 1000 atmosfer.
Meja diberikan konduktivitas termal dari gas berikut:: , , freon-14 CF 4 , etilena C 2 H 4 . Satuan konduktivitas termal adalah W/(m derajat).
Perlu dicatat bahwa konduktivitas termal gas meningkat dengan meningkatnya suhu dan tekanan. Misalnya, konduktivitas termal gas amonia pada suhu kamar dan tekanan atmosfer normal adalah 0,024 W / (m derajat), dan ketika dipanaskan 300 derajat, konduktivitas termal meningkat menjadi 0,067 W / (m derajat). Jika tekanan gas ini dinaikkan menjadi 300 atmosfer, maka nilai konduktivitas termal akan semakin tinggi dan akan memiliki nilai 0,108 W / (m deg).
Catatan: Hati-hati! Konduktivitas termal dalam tabel ditunjukkan dengan faktor 10 3 . Jangan lupa bagi dengan 1000!
Konduktivitas termal gas anorganik tergantung pada suhu
Tabel memberikan nilai konduktivitas termal gas anorganik tergantung pada suhu pada tekanan atmosfer normal. Nilai konduktivitas termal gas ditunjukkan pada suhu dari 80 hingga 1500 K (-193 ... 1227 ° C).
Tabel menunjukkan konduktivitas termal dari gas-gas berikut: dinitrogen oksida N 2 O, sulfur heksafluorida SF 6, oksida nitrat NO, hidrogen sulfida H 2 S, amonia NH 3, sulfur dioksida SO 2, uap H 2 O, karbon dioksida CO 2 , uap air berat D 2 O, udara.
Perlu dicatat bahwa konduktivitas termal gas anorganik meningkat dengan meningkatnya suhu gas.
Catatan: Konduktivitas termal gas dalam tabel ditunjukkan dengan faktor 10 3 . Jangan lupa bagi dengan 1000!
Konduktivitas termal gas organik sebagai fungsi suhu
Tabel menunjukkan nilai konduktivitas termal gas organik dan uap beberapa cairan tergantung pada suhu pada tekanan atmosfer normal. Nilai konduktivitas termal gas diberikan dalam tabel dalam kisaran suhu dari 120 hingga 800 K.
Konduktivitas termal dari gas dan cairan organik berikut diberikan: aseton CH 3 COCH 3, oktan C 8 H 18, pentana C 5 H 12, butana C 4 H 10, heksana C 6 H 14, propilena C 3 H 6, heptana C 7 H 16, amil alkohol C 5 H 11 OH, xilena C 8 H 10, isopropil alkohol C 2 H 7 OH, metana CH 4, metil alkohol CH 3 OH, karbon tetraklorida CCl 4, sikloheksana C 6 H 12, etana C 2 H 6, karbon tetrafluorida CF 4, freon-11 CFCl 3, etil klorida C 2 H 5 Cl, freon-12 CF 2 Cl 2, etilena C 2 H 4, freon-13 CF 3 Cl, etil format HCOOC 2 H 5, freon-21 CHFCl 2, dietil eter (C 2 H 5) 2O.
Seperti yang terlihat dari tabel, nilai konduktivitas termal gas organik juga meningkat dengan meningkatnya suhu gas.
Hati-hati! Konduktivitas termal dalam tabel ditunjukkan dengan faktor 10 3 . Jangan lupa bagi dengan 1000! Misalnya, konduktivitas termal uap aseton pada suhu 400 K (127°C) adalah 0,0204 W/(m derajat).
