Gas ideal. Teori Molekuler-Kinetika Gas Ideal
Teori kinetika molekuler menjelaskan perilaku dan sifat-sifat benda ideal khusus yang disebut gas ideal. Model fisik ini didasarkan pada struktur molekul materi. Penciptaan teori molekuler dikaitkan dengan karya R. Clausius, J. Maxwell, D. Joule dan L. Boltzmann.
gas ideal. Teori Molekuler-Kinetika Gas Ideal dibangun di atas asumsi berikut:
atom dan molekul dapat dilihat sebagai poin materi, yang bergerak terus menerus;
volume intrinsik molekul gas dapat diabaikan dibandingkan dengan volume bejana;
semua atom dan molekul dapat dibedakan, yaitu, pada prinsipnya dimungkinkan untuk mengikuti pergerakan setiap partikel;
sebelum tumbukan molekul gas di antara mereka, tidak ada gaya interaksi, dan tumbukan molekul antara mereka sendiri dan dengan dinding bejana dianggap benar-benar elastis;
gerak setiap atom atau molekul gas dijelaskan oleh hukum mekanika klasik.
Hukum yang diperoleh untuk gas ideal dapat digunakan dalam mempelajari gas nyata. Untuk ini, model eksperimental gas ideal dibuat, di mana sifat-sifat gas nyata mendekati sifat-sifat gas ideal (misalnya, pada tekanan rendah dan suhu tinggi).
Hukum gas ideal
Hukum Boyle-Mariotte:
untuk massa gas tertentu pada suhu konstan, produk dari tekanan gas dan volumenya adalah nilai konstan: pV = konstanta , (1.1)
pada T = konstan , m = konstanta .
Kurva yang menunjukkan hubungan antara besaran R dan V, mencirikan sifat-sifat suatu zat pada suhu konstan, dan disebut isoterm ini adalah hiperbola (Gbr. 1.1.), dan proses yang berlangsung pada suhu konstan disebut isotermal.
Hukum Gay-Lussac:
Volume sejumlah massa gas pada tekanan konstan bervariasi secara linier dengan suhu
V = V 0 (1 + t ) pada P = konstanta , m = konstanta . (1.2)

p = p 0 (1 + t ) pada V = konstanta , m = konstanta . (1.3)
Dalam persamaan (1.2) dan (1.3), suhu dinyatakan dalam skala Celcius, tekanan dan volume - at
0 , sedangkan
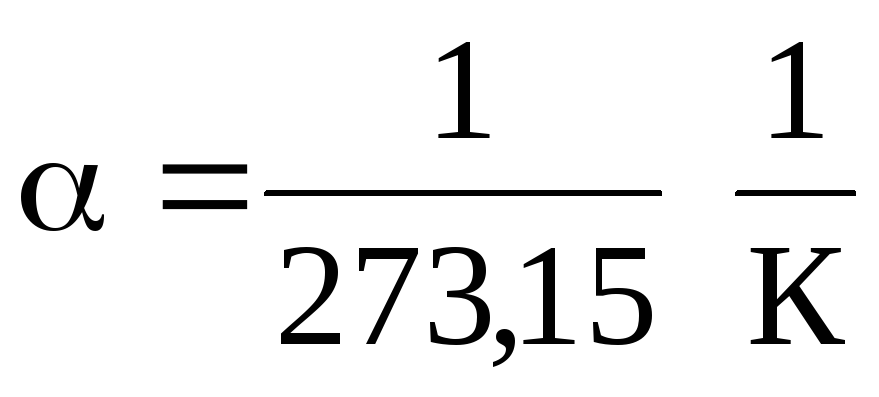 .
.
Proses yang berlangsung pada tekanan tetap disebut isobarik, itu dapat direpresentasikan sebagai fungsi linier (Gbr. 1.2.).
Proses yang berlangsung pada volume tetap disebut isokhorik(Gbr. 1.3.).
Ini mengikuti dari persamaan (1.2) dan (1.3) bahwa isobar dan isokor berpotongan dengan sumbu suhu di titik t =1/ \u003d - 273,15 . Jika kita memindahkan titik asal ke titik ini, maka kita beralih ke skala Kelvin.
Memperkenalkan ke dalam rumus (1.2) dan (1.3) suhu termodinamika, hukum Gay-Lussac dapat diberikan bentuk yang lebih mudah:
V = V 0 (1+t) = = V 0 = =V 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
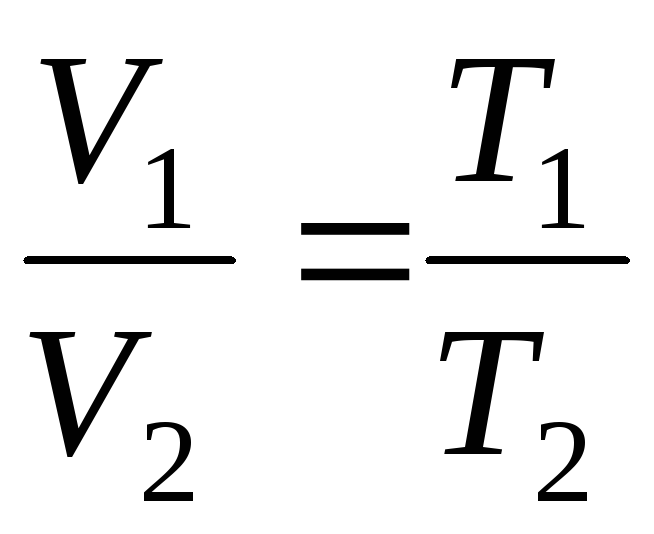 pada
p=konst, m=konst
;
(1.4)
pada
p=konst, m=konst
;
(1.4)
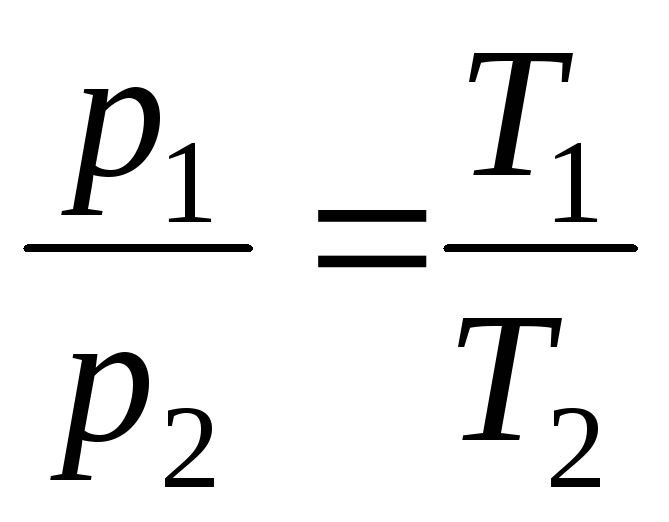 pada V = konstan, m = konstan
,
(1.5)
pada V = konstan, m = konstan
,
(1.5)
di mana indeks 1 dan 2 merujuk pada keadaan arbitrer yang terletak pada isobar atau isochore yang sama .
Hukum Avogadro:
mol gas apa pun pada suhu dan tekanan yang sama menempati volume yang sama.
Dalam kondisi normal, volume ini sama dengan V,0 \u003d 22.4110 -3 m 3 / mol . Menurut definisi, dalam satu mol berbagai zat mengandung jumlah molekul yang sama, sama dengan Avogadro konstan:N SEBUAH = 6,02210 23 mol -1 .
Hukum Dalton:
tekanan campuran gas ideal sama dengan jumlah tekanan parsial R 1 , R 2 , R 3 … R n, gas termasuk di dalamnya:
p = p 1 + p 2 + R 3 + …+ p n .
Tekanan parsial – ini tekanan yang akan dihasilkan oleh gas dalam komposisi campuran gas jika itu sendiri menempati volume yang sama dengan volume campuran pada suhu yang sama.
Persamaan keadaan gas ideal
(Persamaan Clapeyron-Mendeleev)
Ada hubungan yang pasti antara suhu, volume dan tekanan. Hubungan ini dapat diwakili oleh ketergantungan fungsional:
f(p, V, T)= 0.
Pada gilirannya, masing-masing variabel ( p, v, t) adalah fungsi dari dua variabel lainnya. Jenis ketergantungan fungsional untuk setiap keadaan fase zat (padat, cair, gas) ditemukan secara eksperimental. Ini adalah proses yang sangat melelahkan dan persamaan keadaan telah ditetapkan hanya untuk gas yang berada dalam keadaan yang dimurnikan, dan dalam bentuk perkiraan untuk beberapa gas terkompresi. Untuk zat yang tidak berbentuk gas, masalah ini belum terpecahkan.
Fisikawan Prancis B. Clapeyron membawa persamaan keadaan gas ideal, dengan menggabungkan hukum Boyle-Mariotte, Gay-Lussac, Charles:
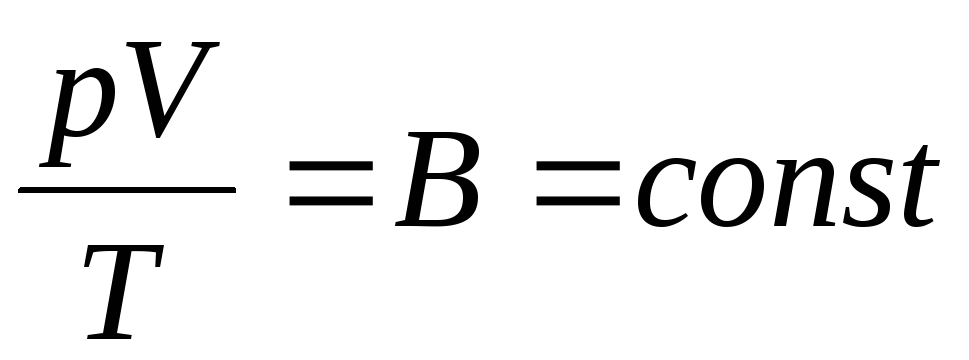 . (1.6)
. (1.6)
Ekspresi (1.6) adalah persamaan Clapeyron, di mana PADA adalah konstanta gas. Ini berbeda untuk gas yang berbeda.
DI. Mendeleev menggabungkan persamaan Clapeyron dengan hukum Avogadro, merujuk persamaan (1.6) ke satu mol dan menggunakan volume molar V. Menurut hukum Avogadro, untuk hal yang sama R dan T mol semua gas menempati volume molar yang sama V .
.
Oleh karena itu, konstanta PADA akan sama untuk semua gas ideal. Konstanta ini biasanya dilambangkan R dan sama dengan R=
8,31
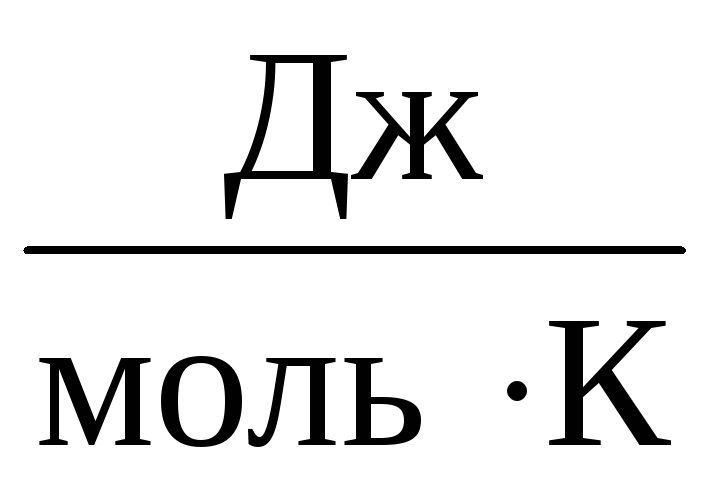 .
.
Persamaan Clapeyron-Mendeleev memiliki bentuk sebagai berikut:
p V . = R T.
Dari persamaan (1.7) untuk satu mol gas, seseorang dapat pergi ke ke persamaan Clapeyron-Mendeleev untuk massa gas yang berubah-ubah:
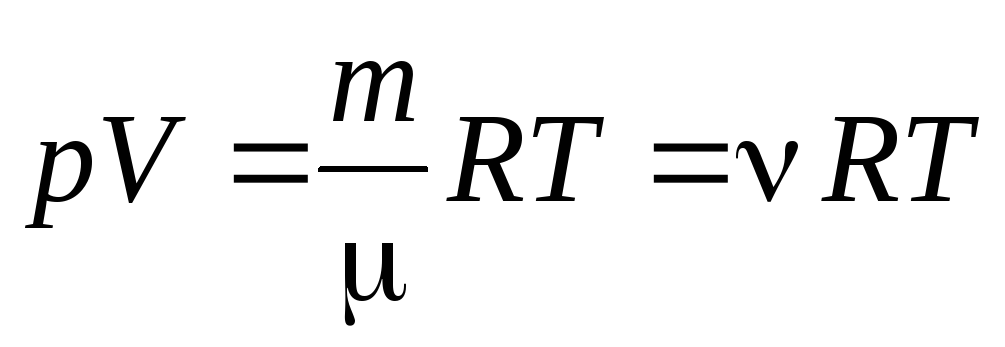 , (1.7)
, (1.7)
di mana
–
masa molar
(massa satu mol zat, kg/mol); m
massa gas;
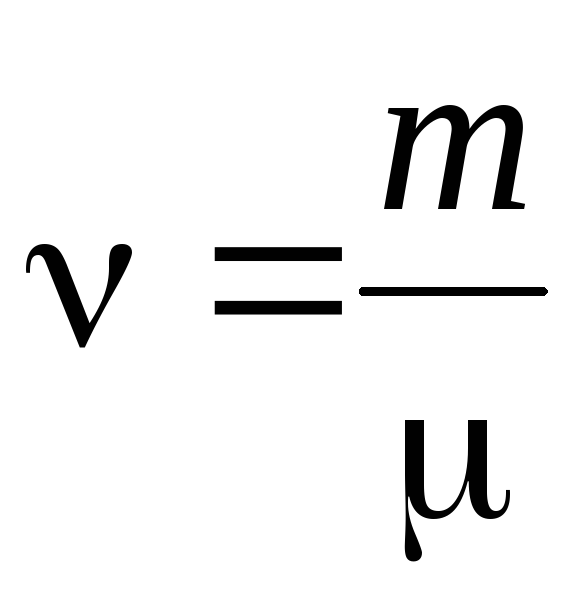 - jumlah materi .
- jumlah materi .
Lebih sering, bentuk lain dari persamaan keadaan gas ideal digunakan, memperkenalkan Konstanta Boltzmann: 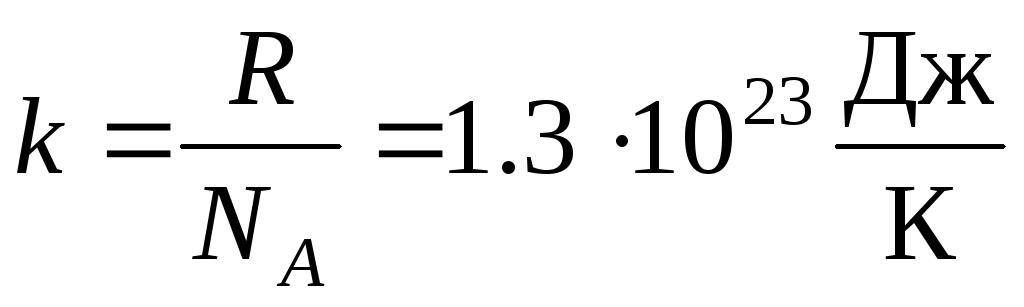 .
.
Maka persamaan (1.7) terlihat seperti ini:
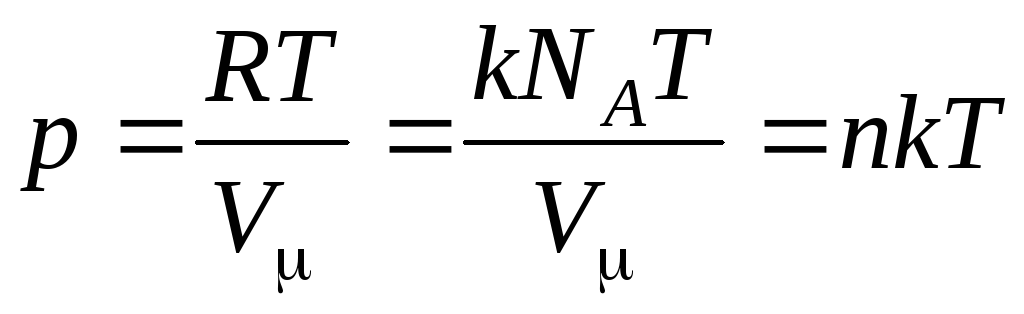 ,
(1.8)
,
(1.8)
di mana
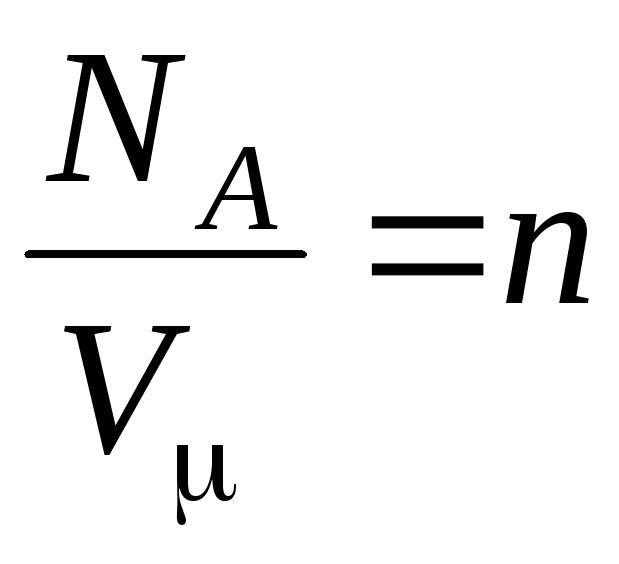 –
konsentrasi molekul (jumlah molekul per satuan volume). Dari ekspresi ini dapat disimpulkan bahwa tekanan gas ideal berbanding lurus dengan konsentrasi molekulnya atau densitas gas. Pada suhu dan tekanan yang sama, semua gas mengandung jumlah molekul yang sama per satuan volume. Banyaknya molekul yang terkandung dalam 1 m3 dalam keadaan normal disebut
Nomor Loschmidt:
–
konsentrasi molekul (jumlah molekul per satuan volume). Dari ekspresi ini dapat disimpulkan bahwa tekanan gas ideal berbanding lurus dengan konsentrasi molekulnya atau densitas gas. Pada suhu dan tekanan yang sama, semua gas mengandung jumlah molekul yang sama per satuan volume. Banyaknya molekul yang terkandung dalam 1 m3 dalam keadaan normal disebut
Nomor Loschmidt:
N L = 2.68 10 25 m -3.
Persamaan dasar kinetika molekul
teori gas ideal
Tugas yang paling penting Teori kinetik gas adalah perhitungan teoritis dari tekanan gas ideal berdasarkan konsep kinetika molekuler. Persamaan dasar teori kinetik molekuler gas ideal diturunkan dengan menggunakan metode statistik.
Diasumsikan bahwa molekul gas bergerak secara acak, jumlah tumbukan timbal balik antara molekul gas dapat diabaikan dibandingkan dengan jumlah tumbukan pada dinding bejana, dan tumbukan ini benar-benar elastis. Di dinding kapal, beberapa area dasar S dan hitung tekanan yang akan diberikan molekul gas pada area ini.
Penting untuk mempertimbangkan fakta bahwa pada kenyataannya molekul dapat bergerak ke lokasi pada sudut yang berbeda dan dapat memiliki berbagai kecepatan, yang, apalagi, dapat berubah dengan setiap tabrakan. Dalam perhitungan teoretis, gerakan molekul yang kacau diidealkan, mereka digantikan oleh gerakan sepanjang tiga arah yang saling tegak lurus.
Jika kita mempertimbangkan sebuah kapal berbentuk kubus, di mana N molekul gas dalam enam arah, mudah untuk melihat bahwa setiap saat 1/3 dari jumlah semua molekul bergerak di sepanjang masing-masingnya, dan setengahnya (yaitu, 1/6 dari jumlah semua molekul) bergerak masuk satu arah, dan babak kedua (juga 1/6) - ke arah yang berlawanan. Dengan setiap tumbukan, sebuah molekul individu bergerak tegak lurus ke situs, mencerminkan, mentransfer momentum ke sana, sementara momentumnya (momentum) berubah dengan jumlah
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Jumlah tumbukan molekul yang bergerak ke arah tertentu di situs akan sama dengan: N = 1/6 n Svt. Ketika bertabrakan dengan platform, molekul-molekul ini akan mentransfer momentum ke sana.
P= N P 1 =2 m 0 vnSvt= m 0 v 2 nSt,
di mana n adalah konsentrasi molekul. Maka tekanan yang diberikan gas pada dinding bejana akan sama dengan:
p = 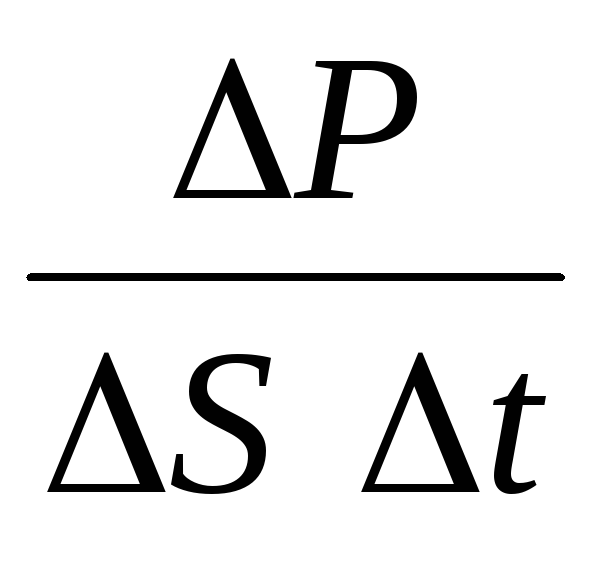 =
n m 0
v 2
.
(1.9)
=
n m 0
v 2
.
(1.9)
Namun, molekul gas bergerak dengan kecepatan yang berbeda: v 1 , v 2 , …,v n, sehingga kecepatannya harus dirata-ratakan. Jumlah kuadrat kecepatan molekul gas, dibagi dengan jumlah mereka, menentukan kecepatan kuadrat rata-rata akar:
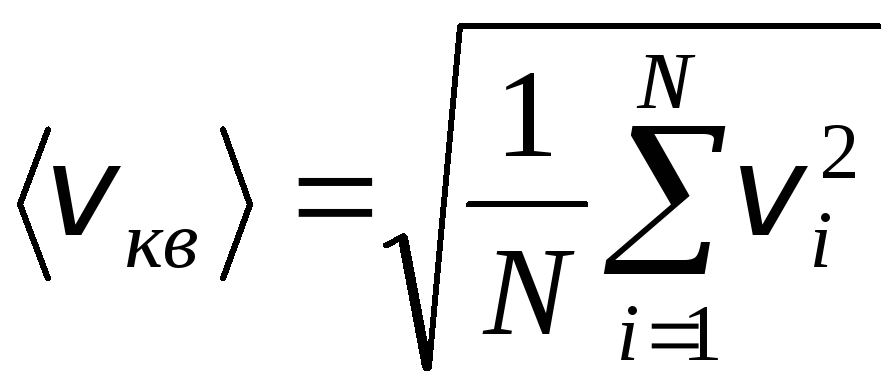 .
.
Persamaan (1.9) akan mengambil bentuk:
![]() (1.10)
(1.10)
ekspresi (1.10) disebut persamaan dasar teori kinetika molekul gas ideal.
Mengingat bahwa 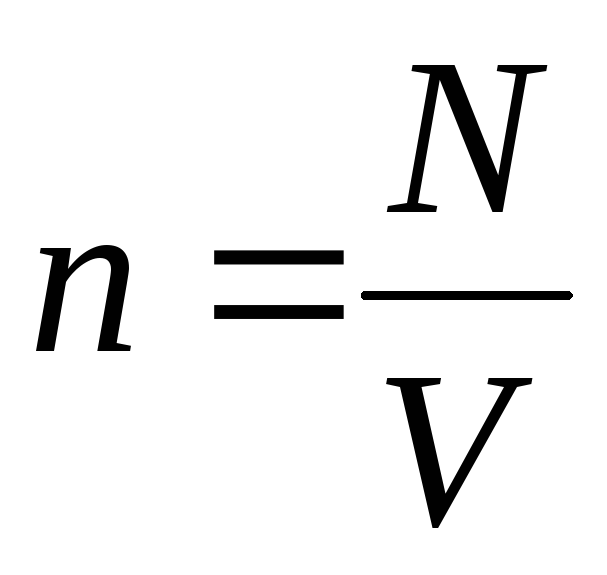 , kita mendapatkan:
, kita mendapatkan:
pV = N 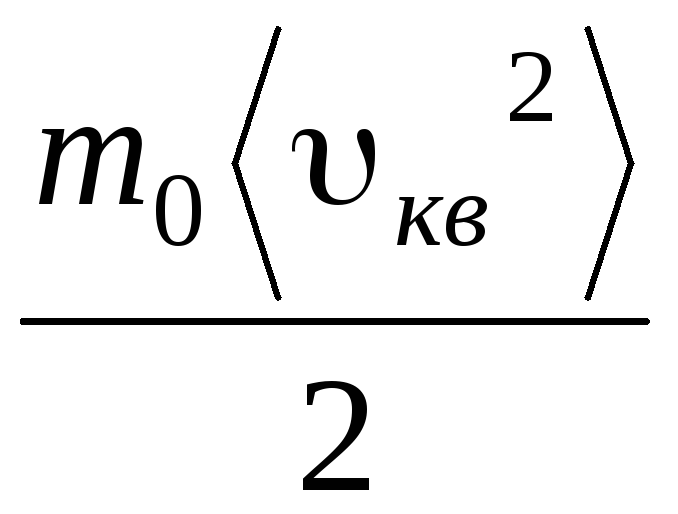 =E,
(1.11)
=E,
(1.11)
di mana E adalah energi kinetik total dari gerak translasi semua molekul gas. Oleh karena itu, tekanan gas berbanding lurus dengan energi kinetik gerak translasi molekul gas.
Untuk satu mol gas m =, dan persamaan Clapeyron-Mendeleev memiliki bentuk berikut:
p V . = R T,
dan karena mengikuti dari (1.11) bahwa p V . = v persegi 2 , kita peroleh:
R.T.= v persegi 2 .
Oleh karena itu, kecepatan akar-rata-rata-kuadrat molekul gas sama dengan
v
persegi
=
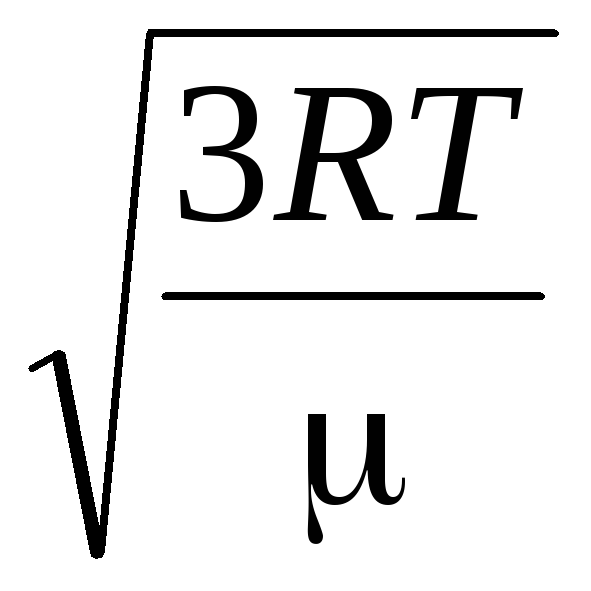 =
=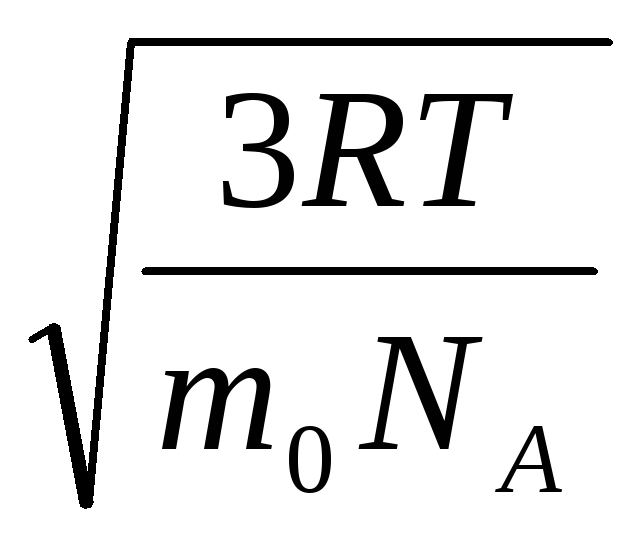 =
= ,
,
di mana k = R/N SEBUAH = 1,3810 -23 J/K – konstanta Boltzmann. Dari sini Anda dapat menemukan kecepatan kuadrat rata-rata molekul oksigen pada suhu kamar - 480 m/s, hidrogen - 1900 m/s.
Arti suhu molekul-kinetik
Suhu adalah ukuran kuantitatif seberapa panas suatu benda. Untuk memperjelas arti fisik dari suhu termodinamika absolut T Mari kita bandingkan persamaan dasar teori molekul-kinetik gas (1.14) dengan persamaan Clapeyron-Mendeleev p V = R.T.
Menyamakan bagian kanan persamaan ini, kita menemukan nilai rata-rata energi kinetik 0 dari satu molekul ( = N/N SEBUAH , k=R/N SEBUAH):
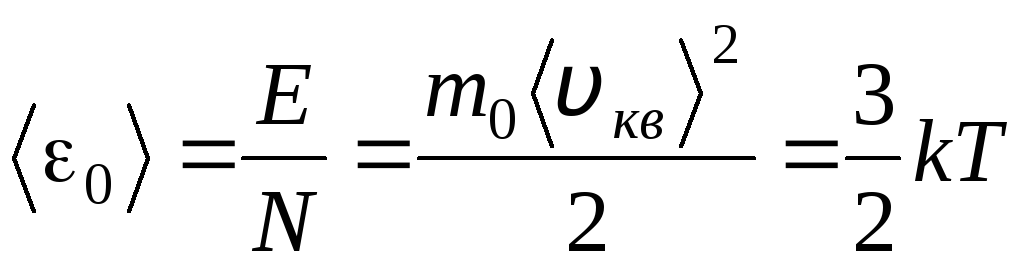 .
.
Kesimpulan yang paling penting dari teori kinetika molekuler berikut dari persamaan ini: energi kinetik rata-rata dari gerak translasi satu molekul gas ideal hanya bergantung pada suhu, sementara itu berbanding lurus dengan suhu termodinamika. Dengan demikian, skala suhu termodinamika memperoleh makna fisik langsung: at T= 0 energi kinetik molekul gas ideal adalah nol. Oleh karena itu, berdasarkan teori ini, gerak translasi molekul-molekul gas akan berhenti dan tekanannya menjadi sama dengan nol.
Teori sifat kesetimbangan gas ideal
Jumlah derajat kebebasan molekul. Teori kinetik-molekul gas ideal mengarah pada konsekuensi yang sangat penting: molekul gas bergerak secara acak, dan energi kinetik rata-rata dari gerakan translasi molekul ditentukan semata-mata oleh suhu.
Energi kinetik dari gerakan molekul tidak habis oleh kinetik energi gerak maju: itu juga terdiri dari kinetika energi rotasi dan fluktuasi molekul. Untuk menghitung energi yang masuk ke semua jenis gerakan molekul, perlu untuk mendefinisikan jumlah derajat kebebasan.
Dibawah jumlah derajat kebebasan (saya) tubuh tersirat jumlah koordinat independen yang harus dimasukkan untuk menentukan posisi benda di ruang angkasa.
H  Misalnya, suatu titik material memiliki tiga derajat kebebasan, karena posisinya dalam ruang ditentukan oleh tiga koordinat: x, y dan z. Oleh karena itu, molekul monoatomik memiliki tiga derajat kebebasan gerak translasi.
Misalnya, suatu titik material memiliki tiga derajat kebebasan, karena posisinya dalam ruang ditentukan oleh tiga koordinat: x, y dan z. Oleh karena itu, molekul monoatomik memiliki tiga derajat kebebasan gerak translasi.
D  sebuah molekul buchatomic memiliki 5 derajat kebebasan (Gbr. 1.4): 3 derajat kebebasan gerak translasi dan 2 derajat kebebasan gerak rotasi.
sebuah molekul buchatomic memiliki 5 derajat kebebasan (Gbr. 1.4): 3 derajat kebebasan gerak translasi dan 2 derajat kebebasan gerak rotasi.
Molekul dari tiga atom atau lebih memiliki 6 derajat kebebasan: 3 derajat kebebasan gerak translasi dan 3 derajat kebebasan gerak rotasi (Gbr. 1.5).
Setiap molekul gas memiliki sejumlah derajat kebebasan, tiga di antaranya sesuai dengan gerakan translasinya.
Regulasi tentang pemerataan energi
dengan derajat kebebasan
Premis dasar dari teori molekul-kinetik gas adalah asumsi keacakan lengkap dalam gerakan molekul. Ini berlaku untuk gerakan osilasi dan rotasi, dan bukan hanya translasi. Diasumsikan bahwa semua arah gerak molekul dalam gas memiliki kemungkinan yang sama. Oleh karena itu, dapat diasumsikan bahwa untuk setiap derajat kebebasan molekul, rata-rata, ada jumlah energi yang sama - ini adalah posisi pada ekipartisi energi di atas derajat kebebasan. Energi per satu derajat kebebasan molekul adalah:
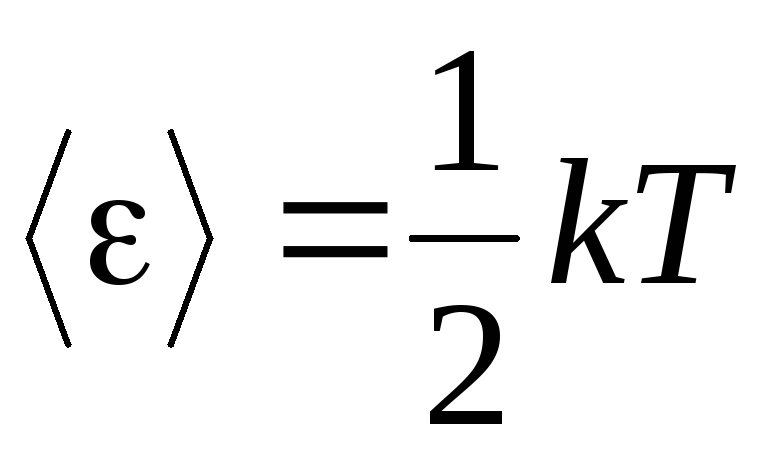 . (1.12)
. (1.12)
Jika molekul memiliki saya derajat kebebasan, maka untuk setiap derajat kebebasan rata-rata ada:
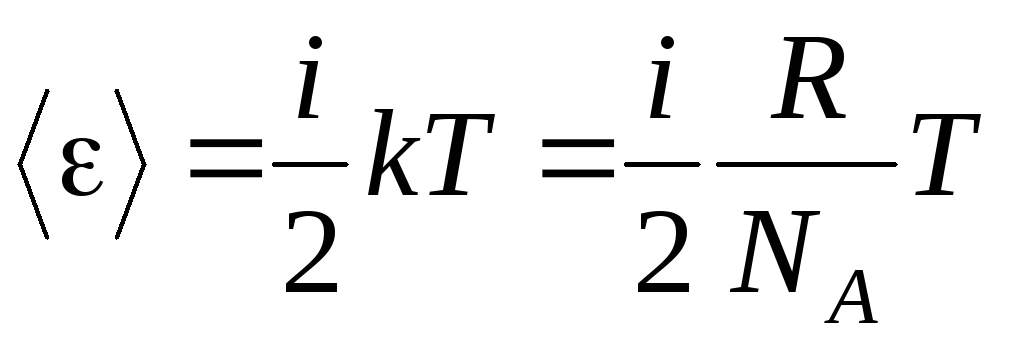 .
(1.13)
.
(1.13)
Energi dalam gas ideal
Jika kita mengatribusikan total suplai energi internal gas dengan satu mol, maka kita memperoleh nilainya dengan mengalikan dengan bilangan Avogadro:
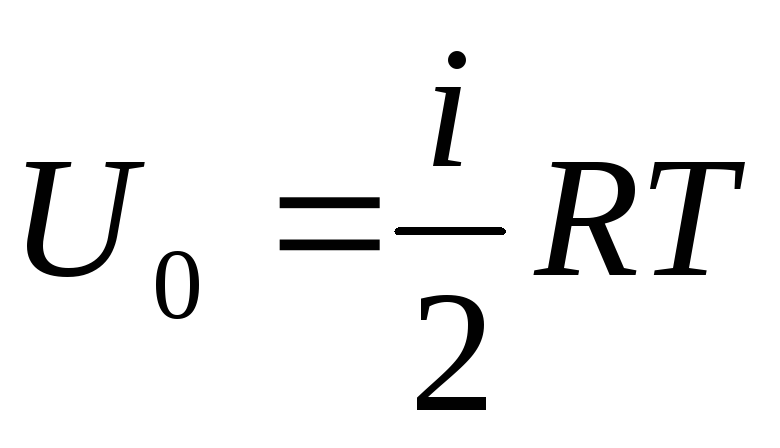 .
(1.14)
.
(1.14)
Oleh karena itu, energi internal satu mol gas ideal hanya bergantung pada suhu dan jumlah derajat kebebasan molekul gas.
Distribusi Maxwell dan Boltzmann
Distribusi molekul gas ideal dalam hal kecepatan dan energi gerak termal (distribusi Maxwell). Pada suhu gas yang konstan, semua arah gerakan molekul dianggap sama-sama mungkin. Dalam hal ini, kecepatan akar-rata-rata-kuadrat setiap molekul tetap konstan dan sama dengan
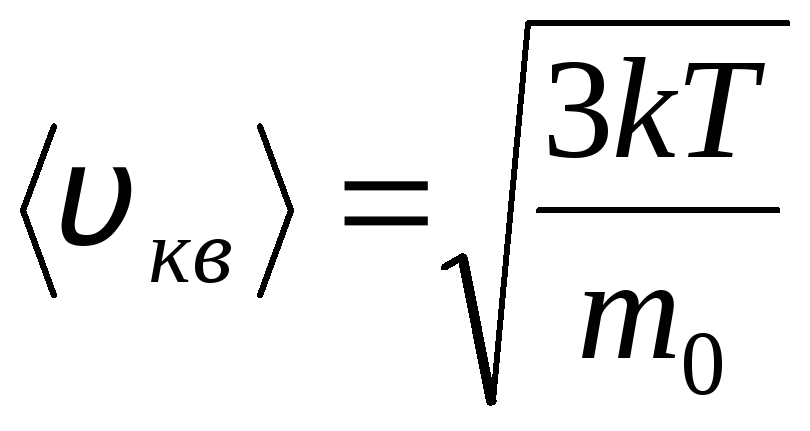 .
.
Ini dijelaskan oleh fakta bahwa dalam gas ideal, yang berada dalam keadaan setimbang, distribusi kecepatan stasioner molekul tertentu yang tidak berubah terhadap waktu ditetapkan. distribusi ini tunduk pada hukum statistik tertentu, yang secara teoritis diturunkan oleh J. Maxwell. Hukum Maxwell dijelaskan oleh fungsi
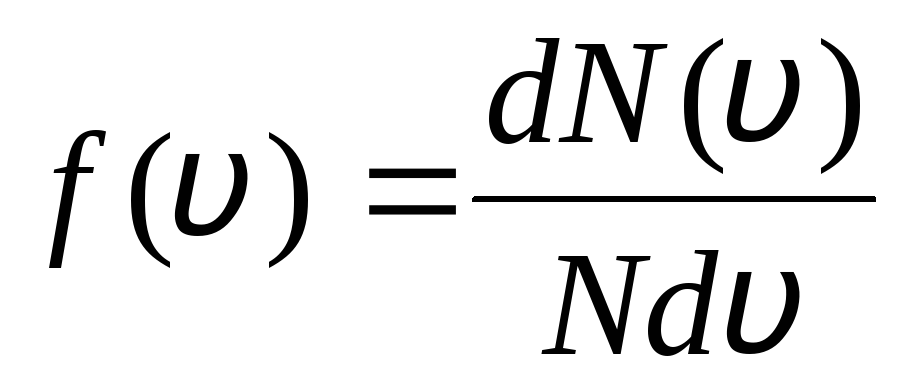 ,
,
itulah fungsinya f(v) menentukan jumlah relatif molekul  , yang kecepatannya terletak pada selang dari v
sebelum v+dv. Menerapkan metode teori probabilitas, Maxwell menemukan hukum distribusi molekul gas ideal dalam hal kecepatan:
, yang kecepatannya terletak pada selang dari v
sebelum v+dv. Menerapkan metode teori probabilitas, Maxwell menemukan hukum distribusi molekul gas ideal dalam hal kecepatan:
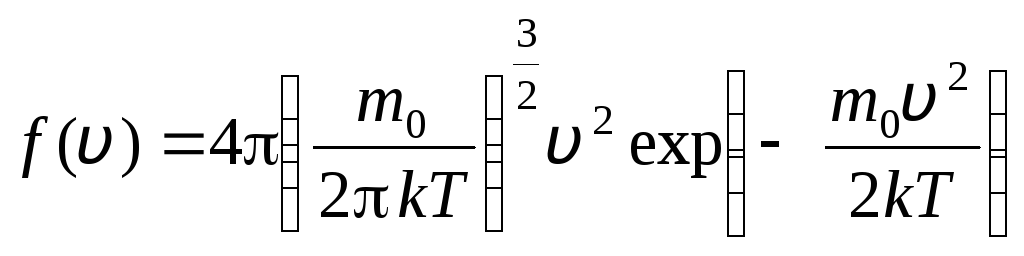 . (1.15)
. (1.15)
Fungsi distribusi ditunjukkan secara grafis pada gambar. 1.6. Luas daerah yang dibatasi oleh kurva distribusi dan sumbu x sama dengan satu. Ini berarti bahwa fungsi f(v) memenuhi kondisi normalisasi:
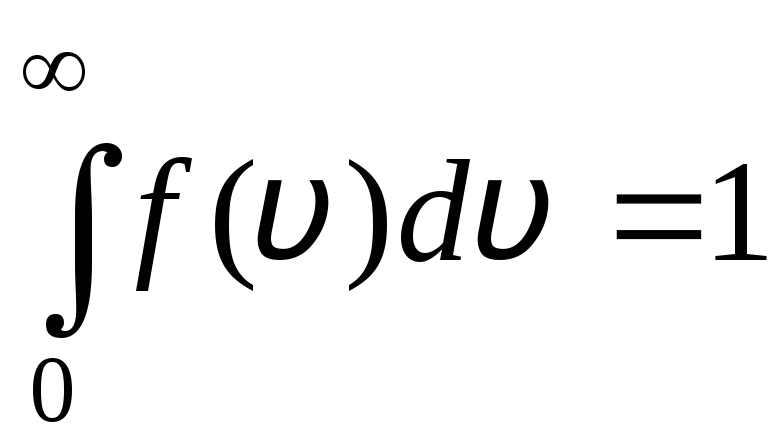 .
.
DARI  kecepatan di mana fungsi distribusi molekul gas ideal dalam hal kecepatan f(v) maksimum, disebut yang paling disukai
kecepatan
v B .
kecepatan di mana fungsi distribusi molekul gas ideal dalam hal kecepatan f(v) maksimum, disebut yang paling disukai
kecepatan
v B .
Nilai v = 0 dan v = sesuai dengan minimum ekspresi (1,15). Kecepatan yang paling mungkin dapat ditemukan dengan membedakan ekspresi (1.23) dan menyamakannya dengan nol:
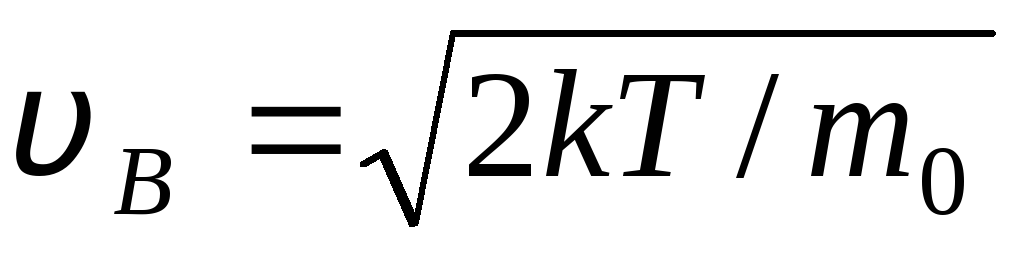 =
=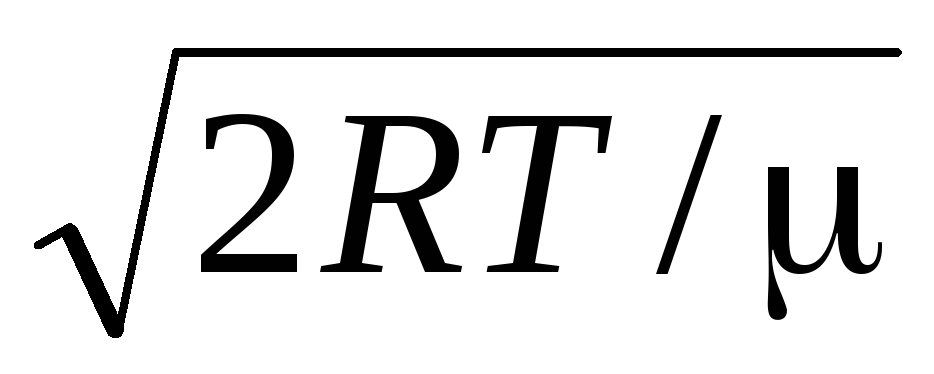 =
1,41
=
1,41
Dengan peningkatan suhu, fungsi maksimum akan bergeser ke kanan (Gbr. 1.6), yaitu, dengan peningkatan suhu, kecepatan yang paling mungkin juga meningkat, namun, area yang dibatasi oleh kurva tetap tidak berubah. Perlu dicatat bahwa dalam gas dan pada suhu rendah selalu ada sejumlah kecil molekul yang bergerak dengan kecepatan tinggi. Kehadiran molekul "panas" seperti itu telah sangat penting selama banyak proses.
Kecepatan rata-rata aritmatika molekul ditentukan oleh rumus
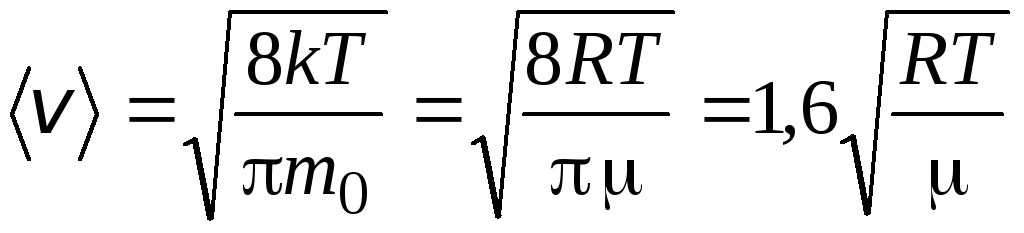 .
.
Kecepatan kuadrat rata-rata akar
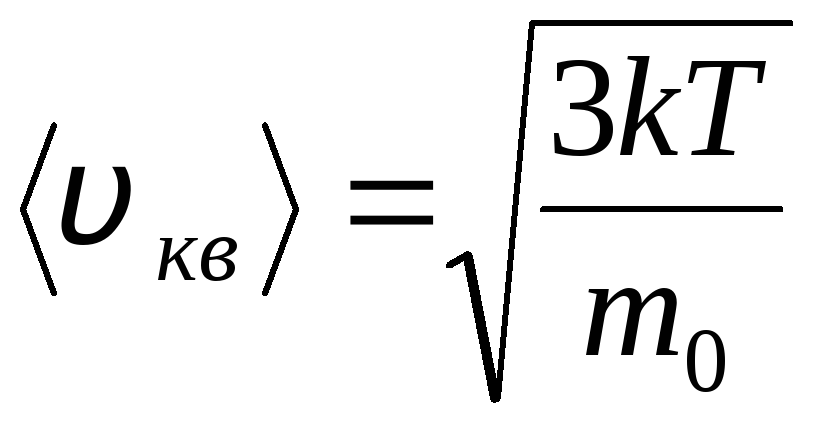 =
1,73
=
1,73 .
.
Rasio kecepatan ini tidak tergantung pada suhu atau jenis gas.
Fungsi distribusi molekul menurut energi gerak termal. Fungsi ini dapat diperoleh dengan mensubstitusi nilai energi kinetik alih-alih kecepatan ke dalam persamaan distribusi molekul (1,15):
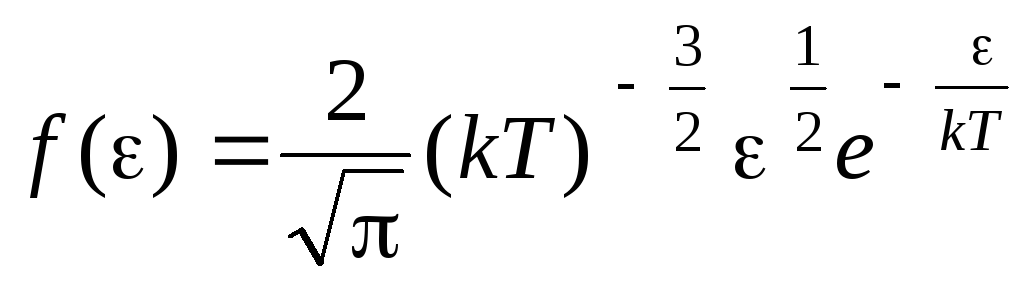 .
.
Setelah mengintegrasikan ekspresi atas nilai energi dari  sebelum
sebelum 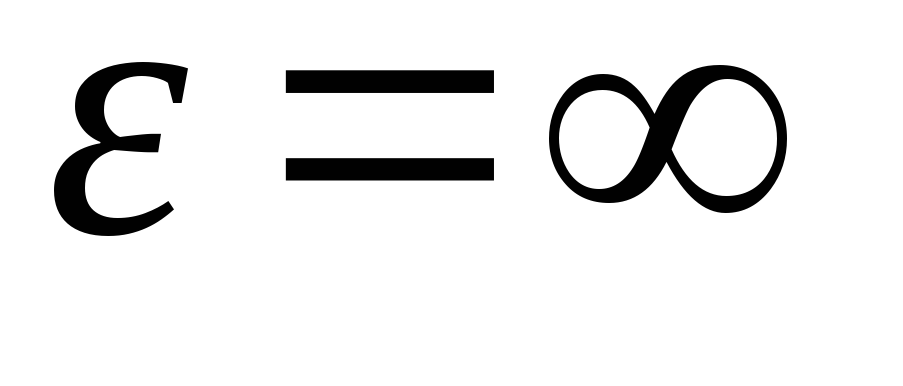
 , kita mendapatkan energi kinetik rata-rata molekul gas ideal:
, kita mendapatkan energi kinetik rata-rata molekul gas ideal:
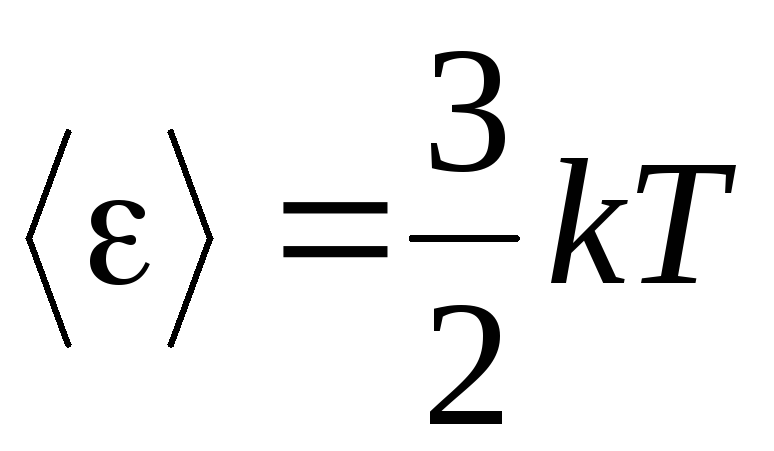 .
.
rumus barometrik. distribusi Boltzmann. Ketika menurunkan persamaan dasar teori kinetik molekuler gas dan distribusi Maxwell molekul berdasarkan kecepatan, diasumsikan bahwa molekul gas ideal tidak dipengaruhi oleh gaya eksternal, oleh karena itu molekul terdistribusi secara merata di seluruh volume. Namun, molekul gas apapun berada di medan gravitasi bumi. Ketika menurunkan hukum ketergantungan tekanan pada ketinggian, diasumsikan bahwa medan gravitasi seragam, suhu konstan dan massa semua molekul adalah sama:
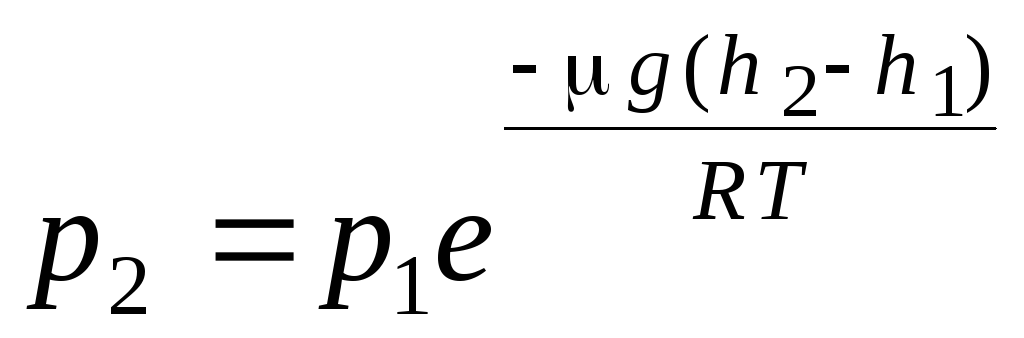 . (1.16)
. (1.16)
Ekspresi (1.16) disebut rumus barometrik. Ini memungkinkan Anda untuk menemukan tekanan atmosfer tergantung pada ketinggian, atau dengan mengukur tekanan, Anda dapat menemukan ketinggian. Karena h 1 adalah ketinggian di atas permukaan laut, di mana tekanan dianggap normal, maka ekspresi dapat dimodifikasi:
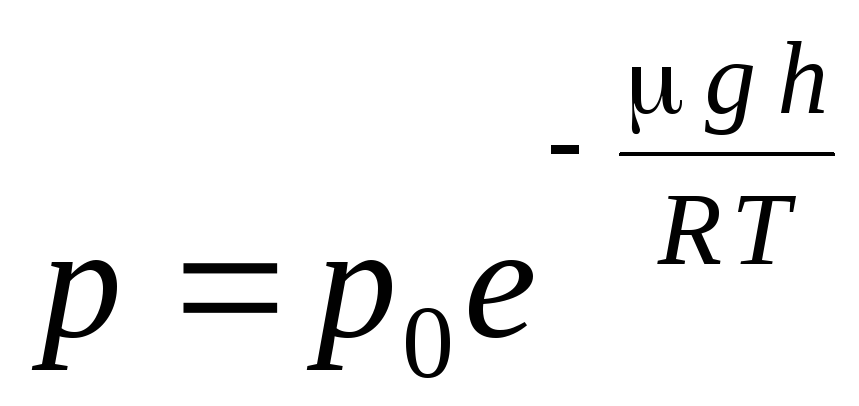 .
.
Rumus barometrik dapat dikonversi menggunakan ekspresi p = nkT:
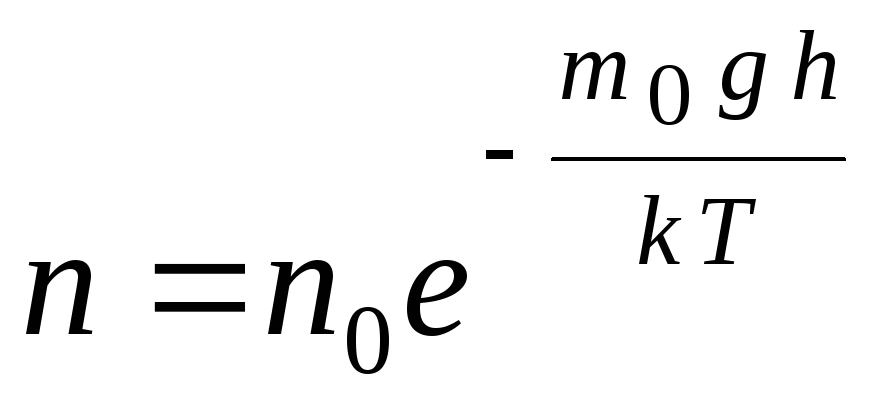 ,
,
G  de n
–
konsentrasi molekul pada ketinggian h,
m 0
gh=P–
energi potensial molekul dalam medan gravitasi. Pada suhu konstan, kerapatan gas lebih besar di mana energi potensial molekul lebih rendah. Secara grafis, hukum penurunan jumlah partikel per satuan volume dengan tinggi terlihat seperti yang ditunjukkan pada Gambar. 1.7.
de n
–
konsentrasi molekul pada ketinggian h,
m 0
gh=P–
energi potensial molekul dalam medan gravitasi. Pada suhu konstan, kerapatan gas lebih besar di mana energi potensial molekul lebih rendah. Secara grafis, hukum penurunan jumlah partikel per satuan volume dengan tinggi terlihat seperti yang ditunjukkan pada Gambar. 1.7.
Untuk medan potensial eksternal yang berubah-ubah, kami menulis ekspresi umum berikut:
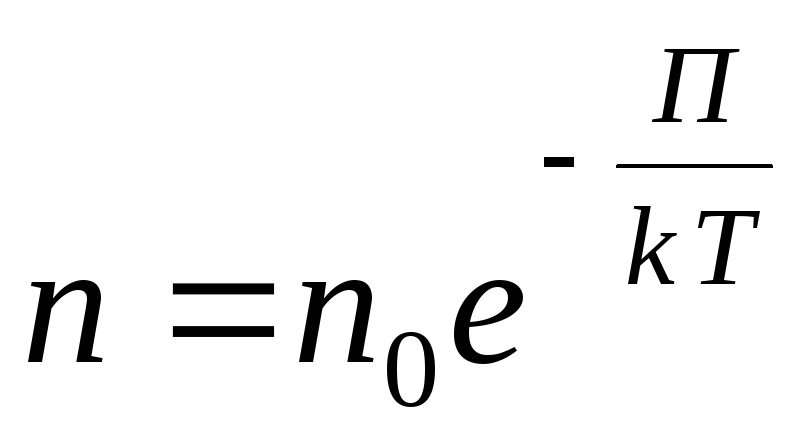 ,
,
Dalam gas yang dijernihkan, jarak antar molekul berkali-kali lebih besar dari ukurannya. Dalam hal ini, interaksi antar molekul dapat diabaikan dan energi kinetik molekul jauh lebih besar daripada energi potensial interaksinya.
Untuk menjelaskan sifat-sifat suatu zat dalam keadaan gas, alih-alih gas nyata, model fisiknya digunakan - gas ideal. Model mengasumsikan:
jarak antara molekul sedikit lebih besar dari diameternya;
molekul adalah bola elastis;
tidak ada gaya tarik menarik antar molekul;
ketika molekul bertabrakan satu sama lain dan dengan dinding bejana, gaya tolak bekerja;
Gerak molekul mematuhi hukum mekanika.
Persamaan dasar untuk mkt gas ideal:
Persamaan dasar MKT memungkinkan untuk menghitung tekanan gas jika massa molekul, nilai rata-rata kuadrat kecepatan, dan konsentrasi molekul diketahui.
Tekanan gas ideal terletak pada kenyataan bahwa molekul-molekul yang bertumbukan dengan dinding bejana berinteraksi dengan mereka sesuai dengan hukum mekanika sebagai benda elastis. Ketika sebuah molekul bertabrakan dengan dinding bejana, proyeksi kecepatan v x dari vektor kecepatan pada sumbu OX, tegak lurus dinding, berubah tandanya menjadi kebalikannya, tetapi tetap konstan dalam nilai absolut. Oleh karena itu, sebagai akibat tumbukan molekul dengan dinding, proyeksi momentumnya pada sumbu OX berubah dari mv 1x = -mv x menjadi mv 2x =mv x . Perubahan momentum suatu molekul pada tumbukan dengan dinding menyebabkan gaya F 1 yang bekerja padanya dari sisi dinding. Perubahan momentum molekul sama dengan momentum gaya ini:
Selama tumbukan, menurut hukum ketiga Newton, molekul bekerja pada dinding dengan gaya F 2 yang besarnya sama dengan gaya F 1 dan arahnya berlawanan.
Ada banyak molekul, dan masing-masing memberikan momentum yang sama ke dinding saat bertumbukan. Dalam sedetik mereka mengirimkan impuls 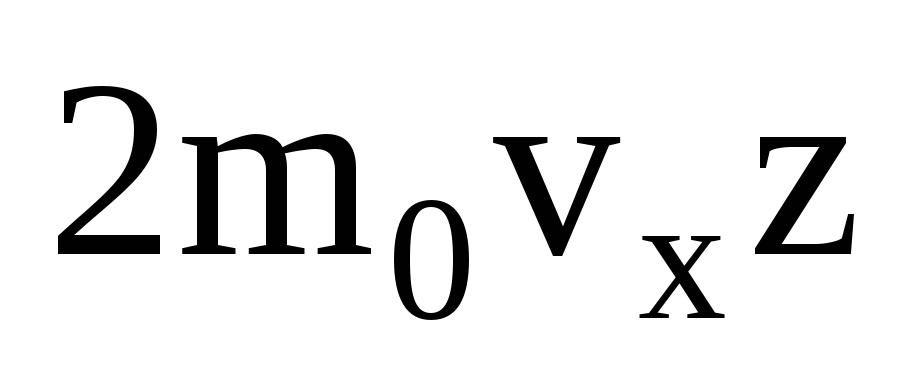 , di mana z adalah jumlah tumbukan semua molekul dengan dinding, yang sebanding dengan konsentrasi molekul dalam gas, kecepatan molekul, dan luas permukaan dinding:
, di mana z adalah jumlah tumbukan semua molekul dengan dinding, yang sebanding dengan konsentrasi molekul dalam gas, kecepatan molekul, dan luas permukaan dinding: 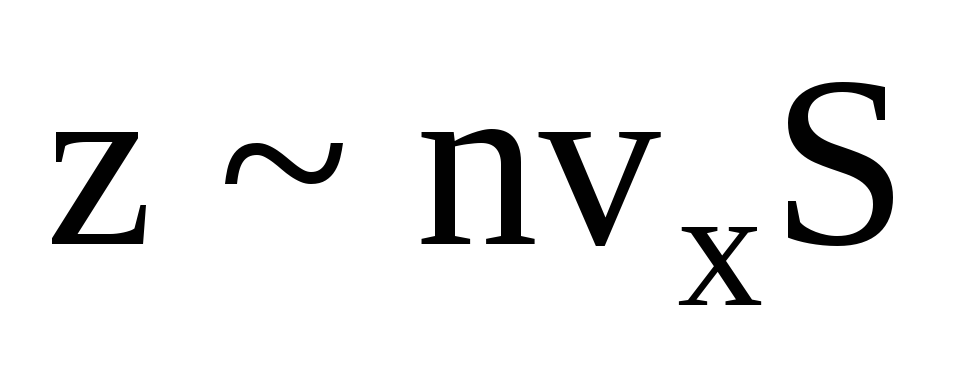 . Hanya setengah dari molekul yang bergerak ke arah dinding, sisanya bergerak ke arah yang berlawanan:
. Hanya setengah dari molekul yang bergerak ke arah dinding, sisanya bergerak ke arah yang berlawanan: 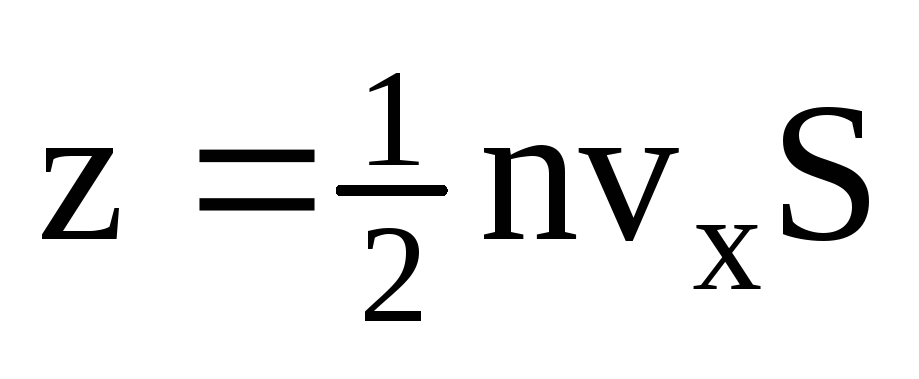 . Maka momentum total yang dipindahkan ke dinding dalam 1 sekon:
. Maka momentum total yang dipindahkan ke dinding dalam 1 sekon: 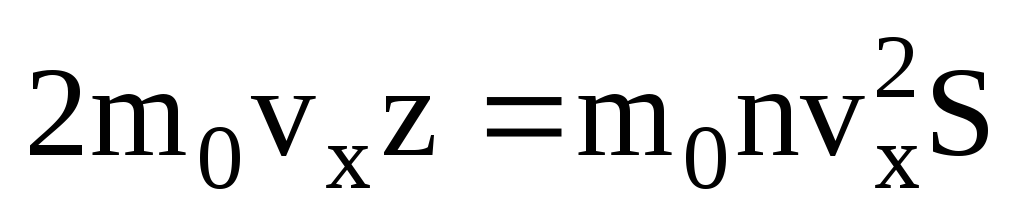 . Menurut hukum kedua Newton, perubahan momentum suatu benda per satuan waktu sama dengan gaya yang bekerja padanya:
. Menurut hukum kedua Newton, perubahan momentum suatu benda per satuan waktu sama dengan gaya yang bekerja padanya:
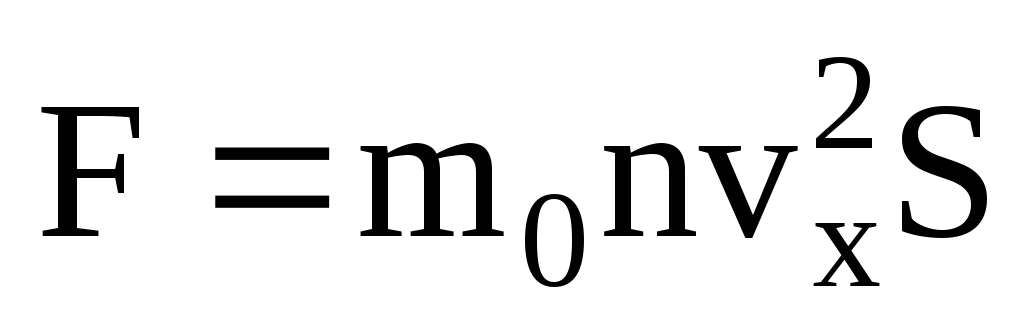
Mengingat bahwa tidak semua molekul memiliki kecepatan yang sama, gaya yang bekerja pada dinding akan sebanding dengan kuadrat rata-rata kecepatan. Karena molekul bergerak ke segala arah, nilai rata-rata kuadrat proyeksi kecepatan adalah sama. Oleh karena itu, kuadrat rata-rata proyeksi kecepatan adalah: 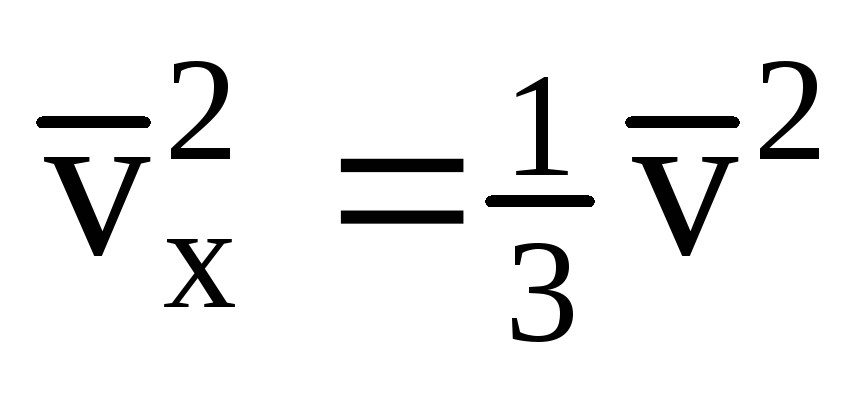 ;
;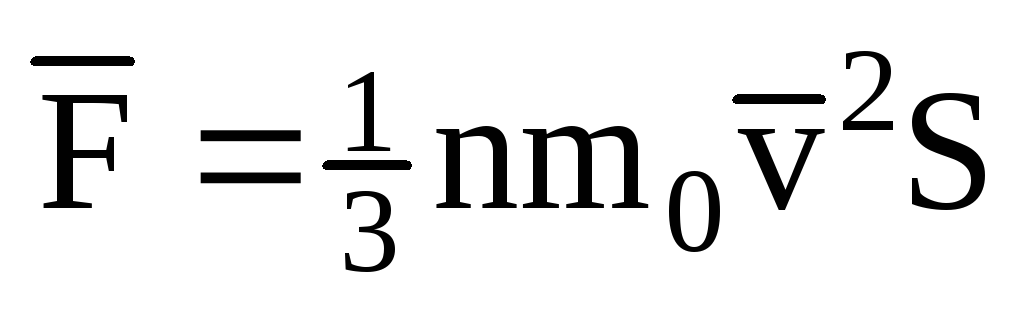 . Maka tekanan gas pada dinding bejana adalah:
. Maka tekanan gas pada dinding bejana adalah:
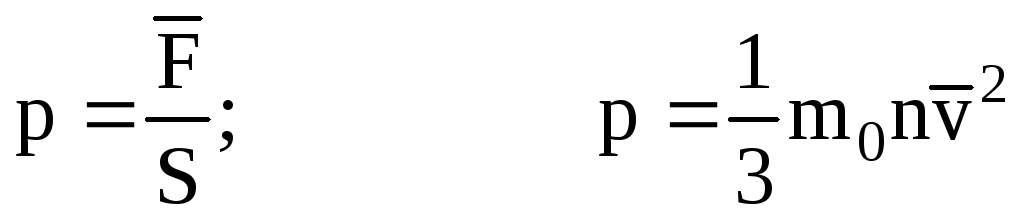 - persamaan dasar MKT.
- persamaan dasar MKT.
Menunjukkan nilai rata-rata energi kinetik dari gerak translasi molekul gas ideal:
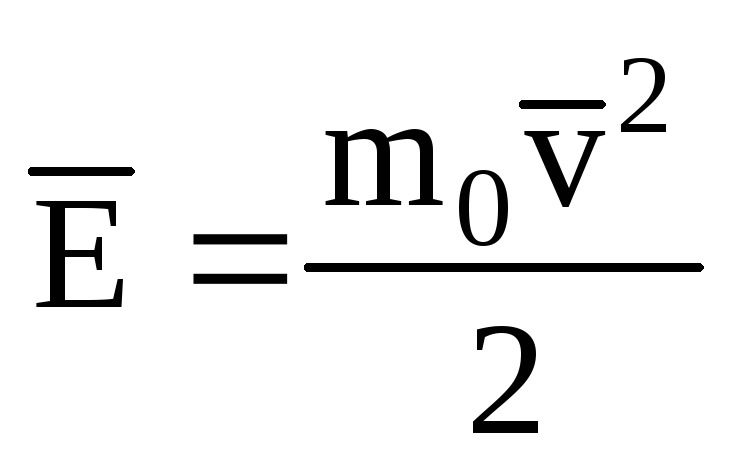 , kita mendapatkan
, kita mendapatkan
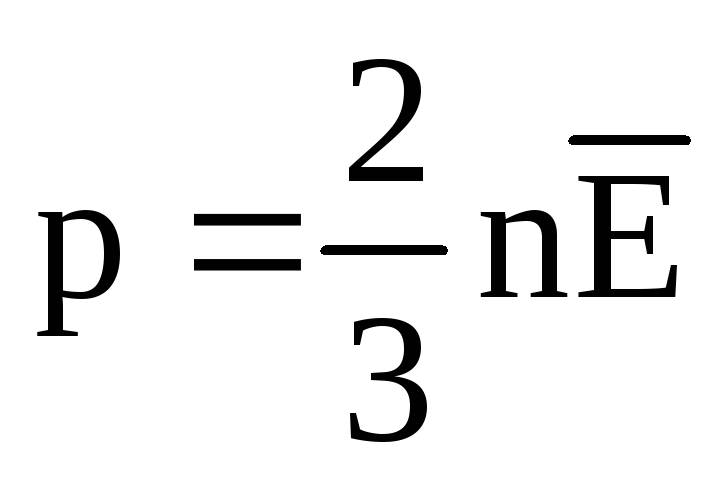
Suhu dan pengukurannya:
Persamaan dasar MKT untuk gas ideal menghubungkan parameter makroskopik yang mudah diukur - tekanan - dengan parameter gas mikroskopis seperti energi kinetik rata-rata dan konsentrasi molekul. Tetapi, dengan hanya mengukur tekanan, kita tidak dapat menemukan nilai rata-rata energi kinetik molekul secara terpisah, atau konsentrasinya. Oleh karena itu, untuk menemukan parameter mikroskopis gas, diperlukan pengukuran beberapa kuantitas fisik lain yang terkait dengan energi kinetik rata-rata molekul. Nilai ini adalah suhu.
Setiap benda makroskopik atau kelompok benda makroskopik, di bawah kondisi eksternal yang konstan, secara spontan masuk ke keadaan kesetimbangan termal. Kesetimbangan termal - ini adalah keadaan di mana semua parameter makroskopik tetap tidak berubah untuk waktu yang lama.
Suhu mencirikan keadaan kesetimbangan termal dari suatu sistem benda: semua benda dari sistem yang berada dalam kesetimbangan termal satu sama lain memiliki suhu yang sama.
Untuk mengukur suhu, Anda dapat menggunakan perubahan dalam kuantitas makroskopik tergantung pada suhu: volume, tekanan, hambatan listrik, dll.
Paling sering dalam praktiknya, ketergantungan volume cairan (merkuri atau alkohol) pada suhu digunakan. Saat mengkalibrasi termometer, suhu es yang mencair biasanya diambil sebagai titik referensi (0); titik konstan kedua (100) adalah titik didih air pada tekanan atmosfer normal (skala Celcius). Karena cairan yang berbeda memuai secara berbeda ketika dipanaskan, skala yang ditetapkan akan tergantung sampai batas tertentu pada sifat-sifat cairan yang diberikan. Tentu saja, 0 dan 100 °C akan cocok untuk semua termometer, tetapi 50 °C tidak cocok.
Tidak seperti cairan, semua gas yang dijernihkan mengembang dengan cara yang sama ketika dipanaskan dan mengubah tekanannya dengan cara yang sama dengan perubahan suhu. Oleh karena itu, dalam fisika, untuk menetapkan skala suhu rasional, perubahan tekanan sejumlah gas yang dijernihkan pada volume konstan atau perubahan volume gas pada tekanan konstan digunakan. Skala ini kadang-kadang disebut skala suhu gas ideal.
Pada kesetimbangan termal, energi kinetik rata-rata dari gerakan translasi molekul semua gas adalah sama. Tekanan berbanding lurus dengan energi kinetik rata-rata dari gerakan translasi molekul: 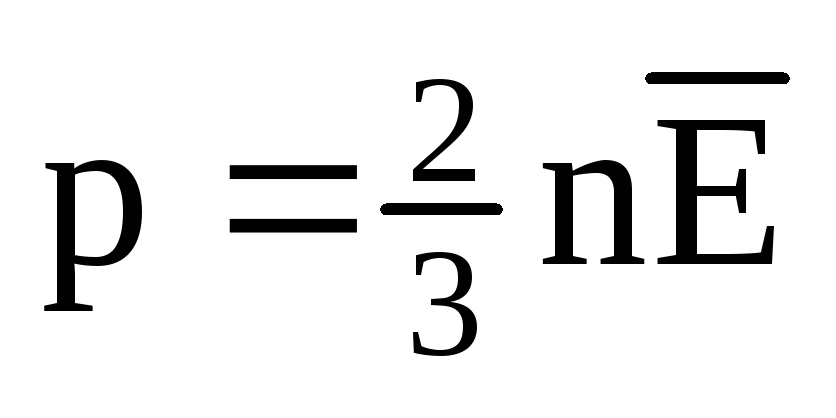 . Pada kesetimbangan termal, jika tekanan gas dengan massa tertentu dan volumenya tetap, energi kinetik rata-rata molekul gas harus memiliki nilai yang ditentukan secara ketat, seperti suhu. Karena
. Pada kesetimbangan termal, jika tekanan gas dengan massa tertentu dan volumenya tetap, energi kinetik rata-rata molekul gas harus memiliki nilai yang ditentukan secara ketat, seperti suhu. Karena  , kemudian
, kemudian 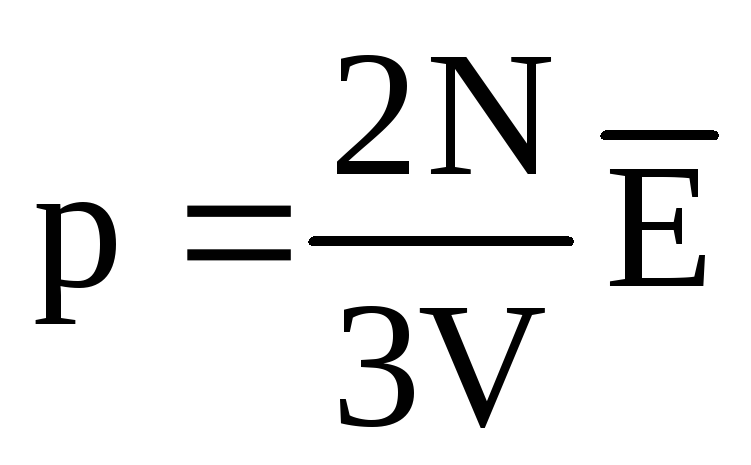 , atau
, atau 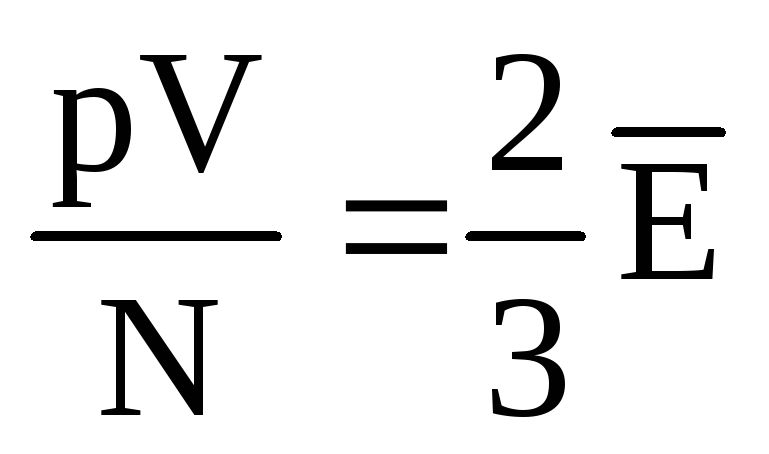 .
.
Menunjukkan 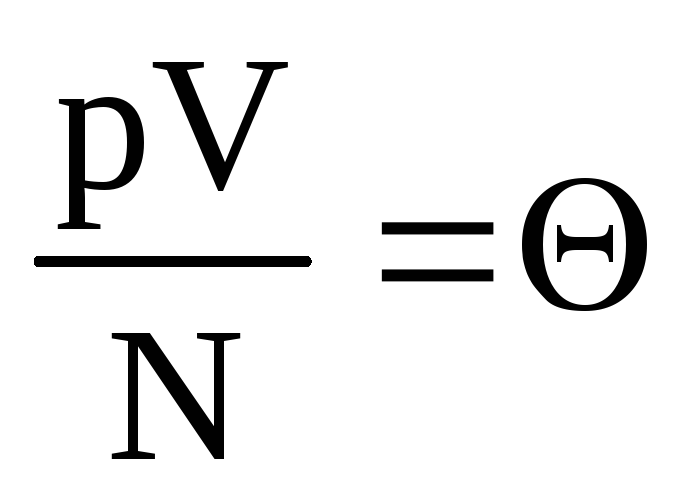 . Nilai
. Nilai  meningkat dengan suhu dan tidak bergantung pada apa pun selain suhu. Oleh karena itu, ini dapat dianggap sebagai ukuran suhu alami.
meningkat dengan suhu dan tidak bergantung pada apa pun selain suhu. Oleh karena itu, ini dapat dianggap sebagai ukuran suhu alami.
Tahukah kamu,
apa itu eksperimen pikiran, eksperimen gedanken?
Ini adalah praktik yang tidak ada, pengalaman dunia lain, imajinasi tentang apa yang sebenarnya tidak ada. Eksperimen pikiran seperti lamunan. Mereka melahirkan monster. Tidak seperti eksperimen fisik, yang merupakan uji eksperimental hipotesis, "eksperimen pikiran" secara ajaib menggantikan pengujian eksperimental dengan kesimpulan yang diinginkan dan belum diuji, memanipulasi konstruksi logis yang sebenarnya melanggar logika itu sendiri dengan menggunakan premis yang belum terbukti sebagai yang terbukti, yaitu dengan pengganti. Dengan demikian, tugas utama pelamar "eksperimen pikiran" adalah menipu pendengar atau pembaca dengan mengganti eksperimen fisik nyata dengan "bonekanya" - penalaran fiktif tentang pembebasan bersyarat tanpa verifikasi fisik itu sendiri.
Mengisi fisika dengan imajiner, "eksperimen pikiran" telah menghasilkan gambaran dunia yang absurd, surealis, dan membingungkan. Seorang peneliti sejati harus membedakan "pembungkus" seperti itu dari nilai-nilai nyata.
Relativis dan positivis berpendapat bahwa "eksperimen pikiran" adalah alat yang sangat berguna untuk menguji teori (juga muncul dalam pikiran kita) untuk konsistensi. Dalam hal ini mereka menipu orang, karena verifikasi apa pun hanya dapat dilakukan oleh sumber yang tidak bergantung pada objek verifikasi. Pemohon hipotesis itu sendiri tidak dapat menguji pernyataannya sendiri, karena alasan pernyataan ini sendiri adalah tidak adanya kontradiksi yang terlihat oleh pemohon dalam pernyataan itu.
Hal ini kita lihat dalam contoh SRT dan GTR, yang telah berubah menjadi semacam agama yang mengatur ilmu pengetahuan dan opini publik. Tidak ada fakta yang bertentangan dengan mereka yang dapat mengatasi rumus Einstein: "Jika fakta tidak sesuai dengan teori, ubah fakta" (Dalam versi lain, "Apakah fakta tidak sesuai dengan teori? - Lebih buruk lagi faktanya ").
Maksimum yang dapat diklaim oleh "eksperimen pikiran" hanyalah konsistensi internal hipotesis dalam kerangka logika pemohon sendiri, seringkali sama sekali tidak benar. Kepatuhan dengan praktik tidak memeriksa ini. Sebuah tes nyata hanya dapat terjadi dalam eksperimen fisik yang nyata.
Eksperimen adalah eksperimen, karena itu bukan penyempurnaan pemikiran, tetapi ujian pemikiran. Pikiran yang konsisten di dalam dirinya sendiri tidak dapat menguji dirinya sendiri. Hal ini telah dibuktikan oleh Kurt Gödel.
