U kojim jedinicama se mjeri toplinski kapacitet? Toplinski kapacitet plinova. Vrste toplinskih kapaciteta
Toplinski kapacitet tijela je količina topline koja se mora predati određenom tijelu da bi se njegova temperatura povisila za jedan stupanj. Kad se tijelo ohladi za jedan stupanj, odaje istu količinu topline. Toplinski kapacitet proporcionalan je masi tijela. Toplinski kapacitet jedinice mase tijela naziva se specifičnim, a umnožak specifične topline s atomskom, odnosno molekularnom masom naziva se atomski, odnosno molarni.
Toplinski kapaciteti razne tvari međusobno se jako razlikuju. Tako, određena toplina voda na 20 ° C je 4200 J / kg K, borovo drvo - 1700, zrak - 1010. Za metale je manje: aluminij - 880 J / kg K, željezo - 460, bakar - 385, olovo - 130. Specifična toplina blago raste s temperaturom (na 90°C, toplinski kapacitet vode je 4220 J/kg K) i jako varira tijekom faznih transformacija: toplinski kapacitet leda na 0°C je 2 puta manji od vode; toplinski kapacitet vodene pare pri 100°C je oko 1500 J/kg K.
Toplinski kapacitet ovisi o uvjetima u kojima se mijenja temperatura tijela. Ako se dimenzije tijela ne mijenjaju, tada sva toplina odlazi na promjenu unutarnje energije. Ovdje govorimo o toplinskom kapacitetu pri konstantnom volumenu. Pri stalnom vanjskom tlaku, zbog toplinskog širenja, mehanički rad se odvija protiv vanjskih sila, a zagrijavanje na određenu temperaturu zahtijeva više topline. Stoga je toplinski kapacitet pri stalnom tlaku uvijek veći od . Za idealni plinovi(vidi sliku), gdje je R plinska konstanta, jednaka 8,32 J / mol K.
Obično se mjeri. Klasičan način mjerenja toplinskog kapaciteta su sljedeća: tijelo čiji se toplinski kapacitet želi zagrijati na određenu temperaturu i staviti u kalorimetar s početnom temperaturom od , napuniti vodom ili drugom tekućinom poznatog toplinskog kapaciteta i - toplinskog kapaciteta od kalorimetar i tekućina).
Mjerenjem temperature u kalorimetru nakon uspostavljanja toplinske ravnoteže može se izračunati toplinski kapacitet tijela po formuli:
![]()
gdje su i mase tijela, tekućine i kalorimetra.
Najrazvijenija teorija je toplinski kapacitet plinova. Na uobičajenim temperaturama zagrijavanje dovodi uglavnom do promjene energije translatornog i rotacijskog gibanja molekula plina. Za molarni toplinski kapacitet jednoatomnih plinova teorija daje , dvoatomne i višeatomne - i . Na vrlo niskim temperaturama, toplinski kapacitet je nešto manji zbog kvantnih učinaka (vidi sl. Kvantna mehanika). Na visoke temperature dodaje se vibracijska energija, a toplinski kapacitet višeatomskih plinova raste s porastom temperature.
Atomski toplinski kapacitet kristala, prema klasičnoj teoriji, jednak je , što je u skladu s empirijskim zakonom Dulonga i Petita (utvrdili su ga 1819. francuski znanstvenici P. Dulong i A. Petit). Kvantna teorija toplinski kapacitet dovodi do istog zaključka pri visokim temperaturama, ali predviđa smanjenje toplinskog kapaciteta s padom temperature. U blizini apsolutne nule toplinski kapacitet svih tijela teži nuli (treći zakon termodinamike).
Toplinski kapacitet tijela- Ovo fizička količina, određena omjerom količine topline koju tijelo apsorbira kada se zagrije, i promjene njegove temperature:
Fizikalni smisao toplinskog kapaciteta tijela: toplinski kapacitet tijela jednak je količini topline koju tijelo apsorbira zagrijavanjem ili oslobađa kada se ohladi za 1K.
Budući da su toplinski kapaciteti promjenjivi, razlikuju se prosječni i stvarni toplinski kapaciteti. Pod prosječnim toplinskim kapacitetom razumjeti omjer količine topline q , sabrano do jedinice količine tvari (plina), do promjene njezine temperature od t 1 prije t 2 pod uvjetom da temperaturna razlika t 2 – t 1 je konačna vrijednost. Prosječna masa, volumen i molarni toplinski kapaciteti označeni su s c m , c m ' I m . Iz definicije prosječnog toplinskog kapaciteta proizlazi da ako temperatura plina raste od t 1 prije t 2 zatim njegov prosječni toplinski kapacitet [kJ / (kg * K)]
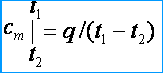
Pod pravim toplinskim kapacitetom razumijevamo toplinski kapacitet plina, koji odgovara infinitezimalnoj promjeni temperature plina, koji odgovara infinitezimalnoj promjeni temperature dt , tj.
c = dq/dt,
gdje dq=cdt.
Određena toplina je sposobnost različitih tvari da apsorbiraju toplinu kada se zagrijavaju. Specifični toplinski kapacitet tvari određen je omjerom količine topline koju je primila zagrijavanjem prema masi tvari i promjenom njezine temperature, ako: ![]()
odnos koji izražava odnos između molarnih toplinskih kapaciteta Cp i CV ima oblik (Mayerova formula): Cp = CV + R. ILI PROŠIRENIJI Toplinski kapacitet. idealni plin Ako se kao rezultat prijenosa topline tijelu preda određena količina topline, tada se mijenja unutarnja energija tijela i njegova temperatura. Količina topline Q potrebna da se 1 kg tvari zagrije za 1 K naziva se specifična toplina tvari c. c = Q / (mΔT). U mnogim slučajevima prikladno je koristiti molarni toplinski kapacitet C: C = M c, gdje je M molarna masa tvari. Tako utvrđen toplinski kapacitet nije jednoznačna karakteristika tvari. Prema prvom zakonu termodinamike, promjena unutarnje energije tijela ne ovisi samo o količini primljene topline, već i o radu koji tijelo izvrši. Ovisno o uvjetima pod kojima se odvijao proces prijenosa topline, tijelo je moglo obavljati različite radove. Stoga bi ista količina topline prenesena na tijelo mogla uzrokovati različite promjene njegove unutarnje energije, a time i temperature. Takva dvosmislenost u određivanju toplinskog kapaciteta tipična je samo za plinovitu tvar. Kada se tekuća i čvrsta tijela zagrijavaju, njihov volumen se praktički ne mijenja, a rad širenja je jednak nuli. Dakle, cjelokupna količina topline koju primi tijelo odlazi na promjenu njegove unutarnje energije. Za razliku od tekućina i čvrste tvari, plin u procesu prijenosa topline može jako promijeniti svoj volumen i izvršiti rad. Stoga toplinski kapacitet plinovite tvari ovisi o prirodi termodinamičkog procesa. Obično se razmatraju dvije vrijednosti toplinskog kapaciteta plinova: CV je molarni toplinski kapacitet u izohornom procesu (V = const) i Cp je molarni toplinski kapacitet u izobarnom procesu (p = const). U procesu pri konstantnom volumenu plin ne vrši rad: A = 0. Iz prvog zakona termodinamike za 1 mol plina slijedi QV = CVΔT = ΔU. Promjena ΔU unutarnje energije plina izravno je proporcionalna promjeni ΔT njegove temperature. Za proces pri konstantnom tlaku prvi zakon termodinamike daje: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV, gdje je ΔV promjena volumena 1 mola idealnog plina kada mu se temperatura promijeni za ΔT. Iz ovoga slijedi: Omjer ΔV / ΔT može se pronaći iz jednadžbe stanja idealnog plina napisane za 1 mol: pV = RT, gdje je R univerzalna plinska konstanta. Pri p = const Dakle, relacija koja izražava odnos između molarnih toplinskih kapaciteta Cp i CV ima oblik (Mayerova formula): Cp = CV + R.
Plinska konstanta brojčano je jednaka radu širenja 1 mola idealnog plina pod stalnim tlakom pri zagrijavanju za 1 K. R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K =8,31(44) Dzh/ (mol K)
Univerzalna plinska konstanta je univerzalna, temeljna fizikalna konstanta R, jednaka umnošku Boltzmannove konstante k i Avogadrove konstante
Fizičko značenje: Plinska konstanta i je numerički jednak radu širenja jednog mola idealnog plina u izobarnom procesu s porastom temperature za 1 K
U CGS sustavu plinska konstanta je:
Specifična plinska konstanta je:
Adijabatski eksponent(ponekad se naziva koeficijentPoisson) - omjer toplinskog kapaciteta pri konstantnom tlaku () i toplinskog kapaciteta pri konstantnom volumenu (). Ponekad se također zove faktor izentropski proširenja. Označava se grčkim slovom (gama) ili (kapa). Simbol slova se uglavnom koristi u disciplinama kemijskog inženjerstva. U toplinskoj tehnici koristi se latinično slovo.
Mješavina plinova je skup nekoliko različitih plinova koji, u uvjetima koji se razmatraju, ne stupaju u međusobne kemijske reakcije.
Mješavina plinova je homogeni termodinamički sustav (unutar kojeg ne postoje sučelja koja međusobno odvajaju makroskopske dijelove sustava koji se razlikuju po svojstvima i sastavu).
Parcijalni tlak P i i-tog plina u smjesi je tlak pod kojim bi se taj plin nalazio kada bi se iz smjese uklonili svi ostali plinovi, a V i T ostali isti.
Daltonov zakon – Tlak mješavine plinova koji međusobno ne kemijski djeluju jednak je zbroju parcijalnih tlakova tih plinova.
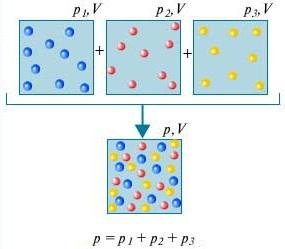
Da bismo razumjeli što jest daltonov zakon, uzmite u obzir zrak u sobi. To je mješavina nekoliko plinova: dušik (80%), kisik (20%). Parcijalni tlak svakog od ovih plinova je tlak koji bi plin imao kada bi sam zauzimao cijeli volumen. Na primjer, ako su svi plinovi osim dušika uklonjeni iz prostorije, tada bi tlak onoga što je ostalo bio parcijalni tlak dušika. Daltonov zakon kaže da je ukupni tlak svih plinova zajedno jednak zbroju parcijalnih tlakova svakog plina zasebno. (Strogo govoreći, zakon se primjenjuje samo na idealne plinove, ali u dovoljno dobroj aproksimaciji opisuje i stvarne plinove.)
Prvi zakon termodinamike je generalizacija zakona održanja i transformacije energije za termodinamički sustav. Formuliran je na sljedeći način:
Promjena ΔU unutarnja energija neizoliranog termodinamičkog sustava jednaka je razlici između količine toplineQ prenijeti u sustav i raditiA , savršen sustav nad vanjskim tijelima.
|
Relacija koja izražava prvi zakon termodinamike često se piše u drugom obliku:
|
Količina topline koju sustav prima koristi se za promjenu njegove unutarnje energije i obavljanje rada na vanjskim tijelima.
Prvi zakon termodinamike je generalizacija eksperimentalnih činjenica. Prema ovom zakonu energija se ne može stvoriti niti uništiti; prenosi se iz jednog sustava u drugi i pretvara iz jednog oblika u drugi. Važna posljedica prvog zakona termodinamike je tvrdnja da je nemoguće stvoriti stroj sposoban za obavljanje korisnog rada bez utroška energije izvana i bez ikakvih promjena unutar samog stroja. Takav hipotetski stroj naziva se perpetuum mobile (perpetuum mobile) prve vrste . Brojni pokušaji stvaranja takvog stroja uvijek su završavali neuspjehom. Svaki stroj može obaviti pozitivan rad A preko vanjskih tijela samo dobivanjem određene količine topline Q od okolnih tijela ili smanjenje Δ U svoju unutarnju energiju.
Primijenimo prvi zakon termodinamike na izoprocese u plinovima.
S izobarnim širenjem Q> 0 - toplinu apsorbira plin, a plin vrši pozitivan rad. S izobarnom kompresijom Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T 1 ; unutarnja energija se smanjuje, Δ U < 0.
U izotermni proces temperatura plina se ne mijenja, dakle, unutarnja energija plina, Δ U = 0.
U izohorni proces (V= const) plin ne radi, A= 0. Prema tome,
Prvi zakon termodinamike za izobarni proces daje:
|
Prvi zakon termodinamike za izotermni proces izražava se relacijom
|
Količina topline Q, dobiven plinom u procesu izotermnog širenja, prelazi u rad na vanjskim tijelima. Pod izotermnom kompresijom, rad vanjskih sila proizvedenih na plin pretvara se u toplinu, koja se prenosi na okolna tijela.
Uz izohorne, izobarne i izotermne procese, termodinamika često razmatra procese koji se odvijaju bez izmjene topline s okolnim tijelima. Posude s izolacijskim stijenkama nazivaju se adijabatske ljuske, a procesi širenja ili kompresije plina u takvim posudama nazivaju se adijabatski.
U adijabatski procesQ= 0; pa prvi zakon termodinamike poprima oblik
|
|
|
U svom fizičkom značenju, prvi zakon termodinamike je zakon održanja (promjene) energije u termodinamici. Ako je prema zakonu promjene energije u mehanici rad nekonzervativnih sila jednak prirastu mehaničke energije sustava (osobito rad sila trenja s negativnim predznakom jednak je smanjenju mehanička energija sustava), tada je prema prvom zakonu termodinamike prirast unutarnje energije termodinamičkog sustava jednak zbroju rada vanjskih sila, savršenih nad sustavom, i energije prenesene na sustav prijenosom topline. Entalpija(od grčkog. enthalpo- zagrijati) je svojstvo materije, označavajući količinu energije koja se može pretvoriti u toplinu. Entalpija je termodinamičko svojstvo tvari koje pokazuje razinu energije pohranjene u njezinoj molekularnoj strukturi. To znači da iako materija može imati energiju temeljenu na temperaturi i tlaku, ne može se sva pretvoriti u toplinu. Dio unutarnje energije uvijek ostaje u tvari i održava njezinu molekularnu strukturu. Dio kinetičke energije tvari nije dostupan kada se njezina temperatura približi temperaturi okoline. Stoga, entalpija je količina energije koja je dostupna za pretvorbu u toplinu pri određenoj temperaturi i tlaku. Jedinice entalpije su BTU ili Joule za energiju i Btu/lbm ili J/kg za specifičnu energiju. 11 pitanje |

Cilj rada: Eksperimentalno određivanje toplinskog kapaciteta materijala.
Oprema: Vaga, uteg, kalorimetar, metalni cilindar s poznatim toplinskim kapacitetom, menzura, grijač, kuka.
Kratka teorija:
Sva makroskopska tijela i sustavi tijela, osim mehaničke energije zbog svog gibanja i međusobnog djelovanja, imaju energiju koja ovisi o njihovom unutarnjem stanju. Ova energija, koja je energija kretanja i interakcije između svih čestica koje čine tijelo, naziva se unutarnja.
Unutarnja energija uključuje kinetičku energiju toplinskog gibanja molekula i atoma koji čine određeno tijelo, kinetičku energiju kretanja elektrona u atomima oko jezgri, potencijalnu energiju međudjelovanja između molekula, atoma, elektrona i jezgri, nukleona u jezgri. itd. Pojam unutarnje energije ne uključuje kinetičku i potencijalnu energiju danog tijela kao cjeline.
Unutarnja energija je jednoznačno određena skupom parametara koji karakteriziraju stanje danog sustava, tj. je jednovrijedna funkcija stanja ovog sustava.
Unutarnja energija obično se označava slovom U.
U toplinskim pojavama koje se javljaju na temperaturama daleko od temperatura faznih prijelaza, promjena unutarnje energije DU povezana je s promjenom kinetičke i potencijalne energije molekula, dok se ostale komponente unutarnje energije ne mijenjaju. Stoga u takvim procesima možemo pretpostaviti da je unutarnja energija tijela jednaka zbroju kinetičkih energija kaotičnog toplinskog gibanja svih molekula u odnosu na središte mase tog tijela i potencijalnih energija međudjelovanja svih molekula. molekule jedna s drugom.
Kada se stanje tijela mijenja, mijenja se i njegova unutarnja energija. Na primjer, kada temperatura nekog tijela raste, povećava se njegova unutarnja energija, jer se povećava prosječna kinetička energija kretanja molekula ovog tijela. Kako se temperatura smanjuje, unutarnja energija tijela opada.
Unutarnja energija tijela može se mijenjati različiti putevi. Na primjer, unutarnja energija se mijenja kada se vanjskim silama vrši mehanički rad na određenom tijelu tijekom njegove deformacije, a također i bez obavljenog rada, kada je tijelo u dodiru s drugim tijelom (ili medijem) koje ima višu ili nižu temperaturu od dato tijelo.
Proces promjene unutarnje energije tijela bez vršenja mehaničkog rada naziva se prijenos topline ili prijenos topline. Postoje tri vrste prijenosa topline: konvekcija, kondukcija i zračenje.
Tijekom izmjene topline ne dolazi do pretvorbe energije iz jedne vrste u drugu. Proces prijenosa topline sastoji se u tome da se dio unutarnje energije s toplijeg tijela prenosi na manje vruće tijelo (ili medij).
Za karakterizaciju procesa prijenosa topline uvodi se pojam količine topline, koja se naziva veličina koja je kvantitativna mjera promjene unutarnje energije tijela u procesu prijenosa topline.
Treba imati na umu da tijelo može samo davati ili primati energiju, a količina topline Q samo je numerički ekvivalent energije koju tijelo daje ili prima u procesu prijenosa topline.
Količina topline ovisi o vrsti procesa i nije funkcija stanja sustava.
Količina topline potrebna za zagrijavanje tijela koja se javlja bez faznih transformacija (bez promjene agregatnog stanja tvari):
gdje je c specifični toplinski kapacitet tijela, određen omjerom količine prenesene topline i mase m tijela i rezultirajuće promjene temperature DT, m je masa tijela, DT je razlika između konačne i početne temperature zadanog tijela.
Količina topline koju je potrebno predati tijelu da bi mu se temperatura povisila za jedan Kelvin naziva se toplinski kapacitet ove tvari. Kad se ohladi za jedan Kelvin, tijelo odaje istu količinu topline. Toplinski kapacitet tijela proporcionalan je masi tijela i ovisi o tvari od koje se ono sastoji. U SI sustavu jedinica toplinski kapacitet se mjeri u J/K.
Za karakterizaciju toplinskih svojstava tvari uzima se toplinski kapacitet jedinice mase te tvari. Ova karakteristika se naziva specifični toplinski kapacitet. Jednaka je omjeru toplinskog kapaciteta određenog tijela i njegove mase. Specifični toplinski kapacitet SI sustavom mjeri se u J / (kg × K).
Eksperimentalno se specifična toplina metalnog tijela određuje pomoću kalorimetra i termometra. Najjednostavniji kalorimetar sastoji se od poliranog metalnog stakla postavljenog unutar drugog stakla na čepovima (radi toplinske izolacije). Unutarnje staklo ispunjeno je vodom ili drugom tekućinom poznatog specifičnog toplinskog kapaciteta. U kalorimetar se spusti tijelo zagrijano na određenu temperaturu t. Neka je prije spuštanja tijela temperatura tekućine u kalorimetru t 1, a nakon što se uspostavi toplinska ravnoteža tekućine i tijela spuštenog u nju njihova će ukupna temperatura postati jednaka q.
Iz zakona održanja energije slijedi da je:
Q \u003d Q 1 + Q 2,(2)
gdje je količina topline Q, koju daje zagrijano tijelo, jednaka je zbroju količine topline Q1, dobiven vodom, i Q2, koju prima kalorimetar.
Uzimajući u obzir (1), prepisujemo (2) kao:
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
Gdje c 1 I m 1- specifični toplinski kapacitet i masa vode u kalorimetru, c 2 I m2- specifični toplinski kapacitet i masa kalorimetra. Ova se jednadžba naziva jednadžba toplinske bilance. Iz njega nalazimo specifični toplinski kapacitet tijela:
Rješenju ovog problema moguće je pristupiti i na drugačiji način, pretpostavimo da će gubici energije u okviru jednog eksperimenta biti isti. Tijelo S poznati specifični toplinski kapacitet, zagrijan na određenu temperaturu t, spušten u kalorimetar, čija se temperatura mijenja. Tada će jednadžba toplinske ravnoteže imati oblik:
cm(t-q) = c 1 m 1 (q-t 1) + Q gubitak,(5)
Gdje Q gubitak je količina topline koju prima kalorimetar i okoliš, stoga:
Q gubitak, = cm(t-q) - c 1 m 1 (q-t 1). (6)
Ako se tijelo s nepoznatim specifičnim toplinskim kapacitetom, zagrijano na istu temperaturu, spusti u kalorimetar, tada će jednadžba toplinske ravnoteže imati oblik:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q gubici,(7)
Gdje m¢ 1 je masa vode u kalorimetru, i t¢ 1- temperatura vode u ovom pokusu. Zatim:
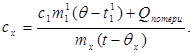 (8)
(8)
Zamjenom vrijednosti (6) u (8) dobivamo:
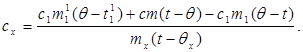 (9)
(9)
gdje je elementarna količina topline; - elementarna promjena temperature.
Toplinski kapacitet je brojčano jednak količini topline koja se mora dovesti u sustav da bi mu se pod danim uvjetima povećala temperatura za 1 stupanj. Budući da je jedinica topline u SI joule, a temperatura stupanj K, jedinica toplinskog kapaciteta je J/K.
Ovisno o kvantitativnoj jedinici tijela kojemu se dovodi toplina u termodinamici se razlikuju maseni, volumni i molarni toplinski kapaciteti.
Maseni toplinski kapacitet je toplinski kapacitet po jedinici mase radnog fluida,
gdje su i volumen i gustoća tijela u normalnim fizičkim uvjetima.
Volumetrijski toplinski kapacitet mjeri se u J/(m3 K).
Molarni toplinski kapacitet- toplinski kapacitet, koji se odnosi na količinu radnog fluida (plina) u molovima,
| , |
gdje je m3/mol molarni volumen plina u normalnim uvjetima.
S obzirom da toplinski kapacitet nije konstantan, već ovisi o temperaturi i drugim toplinskim parametrima, razlikuje se pravi i prosječni toplinski kapacitet. Obično se stvarni toplinski kapacitet shvaća kao omjer elementarne količine topline koja je priopćena termodinamičkom sustavu u bilo kojem procesu i infinitezimalnog povećanja temperature tog sustava uzrokovanog predanom toplinom. Razmotrit ćemo pravi toplinski kapacitet termodinamičkog sustava pri temperaturi sustava jednakoj , i - pravu specifičnu toplinu radnog fluida pri njegovoj temperaturi jednakoj . Tada se prosječni specifični toplinski kapacitet radnog fluida pri promjeni njegove temperature od do može odrediti kao
Određivanje unutarnje energije tijela.
Unutarnja energija tijelo (naziva se kao E ili U) je zbroj energija međudjelovanja molekula i toplinskih gibanja molekule. Konkretno, unutarnja energija idealnog plina jednaka je zbroju kinetičkih energija svih čestica plina u kontinuiranom i nasumičnom toplinskom gibanju. Iz toga slijedi Jouleov zakon, potvrđen brojnim eksperimentima.
Molekularno kinetička teorija dovodi do sljedećeg izraza za unutarnju energiju jednog mola idealnog monoatomskog plina (helij, neon, itd.), čije molekule vrše samo translatorno gibanje:
Tako, unutarnja energija U tijelo je jedinstveno određeno makroskopskim parametrima koji karakteriziraju stanje tijela. Ne ovisi o tome kako je dato stanje realizirano. Uobičajeno je reći da je unutarnja energija funkcija stanja.
U TD se koristi promjena unutarnje energije, a ne njezina apsolutna vrijednost.
Što je rad na proširenju. Prvi zakon TD.
Ekspanzijski rad - mehanički rad koji vozilo obavlja protiv sila vanjskog pritiska u procesu svog širenja. Pri promjeni volumena plin obavlja rad, predznak promjene V poklapa se s predznakom rada
Prvi zakon TD: toplina koja se prenosi sustavu koristi se za pretvaranje unutarnje energije i obavljanje rada.
S gledišta njegove sposobnosti primanja (ili davanja) energije u obliku topline, uobičajeno je karakterizirati termodinamički sustav njegovim toplinskim kapacitetom.
Toplinski kapacitet tijela (sustava) je fizikalna veličina koja je brojčano jednaka količini topline koja se mora predati tijelu (sustavu) da bi se njegova temperatura promijenila za jedan Kelvin.
Ako se tijelu prida beskrajno mala količina topline Q, što je izazvalo infinitezimalno povećanje temperature dT, zatim njegov toplinski kapacitet S je po definiciji jednako
SI jedinica toplinskog kapaciteta je džul podijeljen s kelvinom ( J/DO).
Pokusi i teorijski proračuni to pokazuju toplinski kapacitet tijela ovisi o njegovom kemijskom sastavu, masi i termodinamičkom stanju(na primjer, o temperaturi), kao i o vrsti procesa promjene stanja tijela kada mu se preda toplina.
Specifični toplinski kapacitet je toplinski kapacitet po jedinici mase tvari, odnosno za homogenu tvar
![]() , (25.2)
, (25.2)
Gdje S- specifični toplinski kapacitet, M je masa tvari.
SI jedinica specifične topline je džul podijeljen s kelvin-kilogramom [( J/(DO . kg)].
Molarni toplinski kapacitet je toplinski kapacitet jednog mola tvari, to je
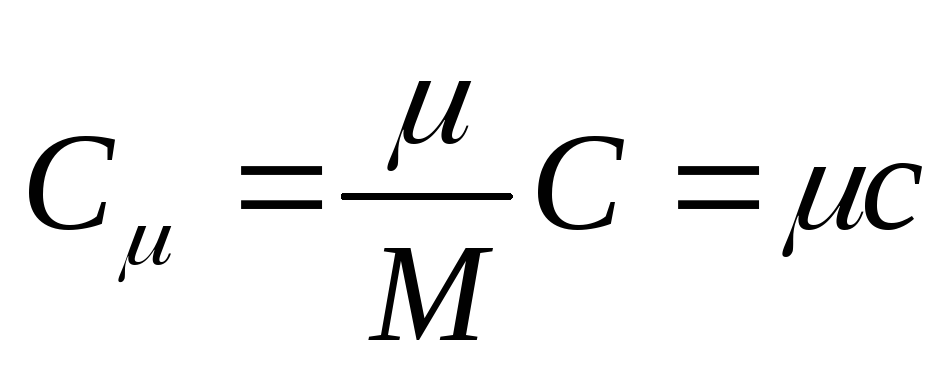 , (25.3)
, (25.3)
Gdje S - molarni toplinski kapacitet; je molarna masa tvari.
Jedinica za molarni toplinski kapacitet u SI je džul podijeljen s kelvin-molom [ J/(DO . madež)].
Elementarna količina topline Q, potrebno za promjenu tjelesne temperature dT, definira se kao
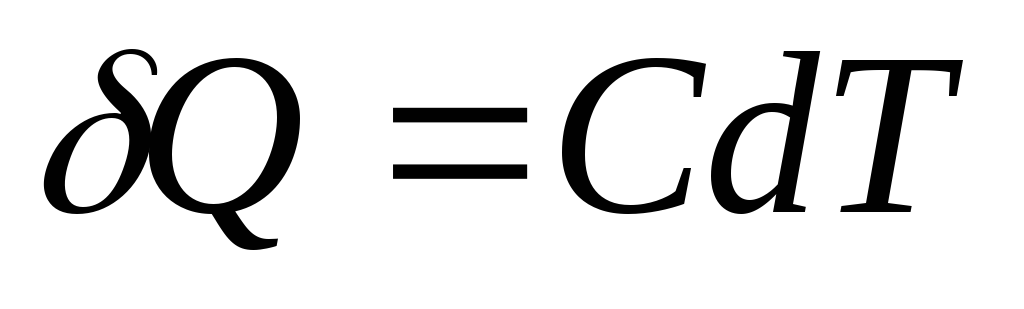 ,
,
a za homogeno tijelo
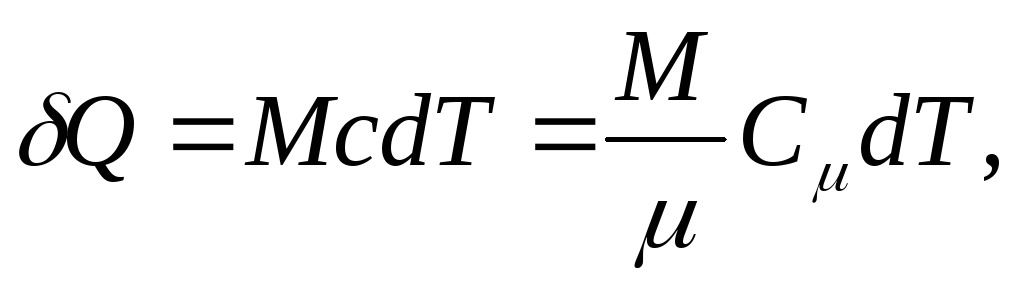 (25.4)
(25.4)
Gdje M/ - količina tvari (broj molova).
§26. Prvi zakon termodinamike
Prvi zakon (prvi zakon) termodinamike matematički je izraz zakona održanja i transformacije energije primijenjen na termodinamičke sustave. Nastala je kao rezultat eksperimentalnih i teorijskih istraživanja u području fizike i kemije, čija je završna faza bila otkriće ekvivalencije topline i rada, odnosno otkriće da pretvorba topline u rad i rad u toplina se provodi uvijek u istom strogo konstantnom količinskom omjeru .
U §24 je navedeno da se unutarnja energija sustava može promijeniti na dva načina: vršenjem rada i prijenosom topline. Stoga možemo napisati:
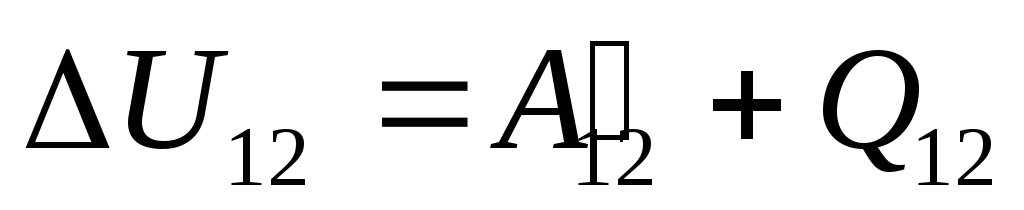 ,
(26.1)
,
(26.1)
Gdje
U 12
-
promjena unutarnje energije sustava tijekom njegovog prijelaza iz stanja 1
u stanje 2
kao rezultat rada na njemu  od vanjskih tijela i predajući mu izvana određenu količinu topline
od vanjskih tijela i predajući mu izvana određenu količinu topline  .
.
Znamo taj posao  koji obavlja sam sustav na vanjskim tijelima brojčano je jednak i suprotnog predznaka radu
koji obavlja sam sustav na vanjskim tijelima brojčano je jednak i suprotnog predznaka radu  vanjska tijela iznad sustava tj
vanjska tijela iznad sustava tj
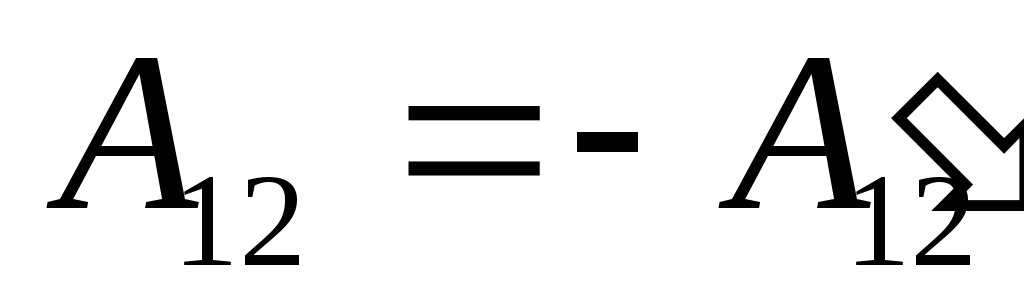 ,
(26.2)
,
(26.2)
stoga se izraz (26.1) može prepisati kao
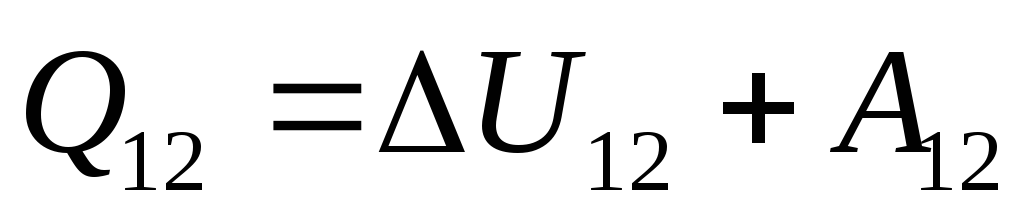 . (26.3)
. (26.3)
Ova je jednadžba matematički zapis prvog zakona termodinamike: količina topline koja se prenosi sustavu troši se na promjenu njegove unutarnje energije i na izvođenje rada sustava na vanjskim tijelima.
S infinitezimalnom promjenom stanja sustava jednadžba (26.3) poprima oblik
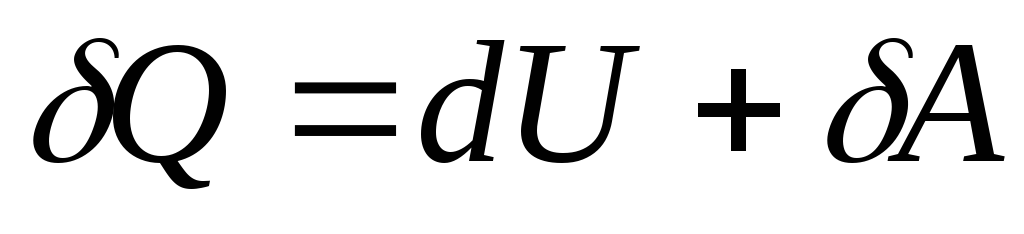 , (26.4)
, (26.4)
Gdje 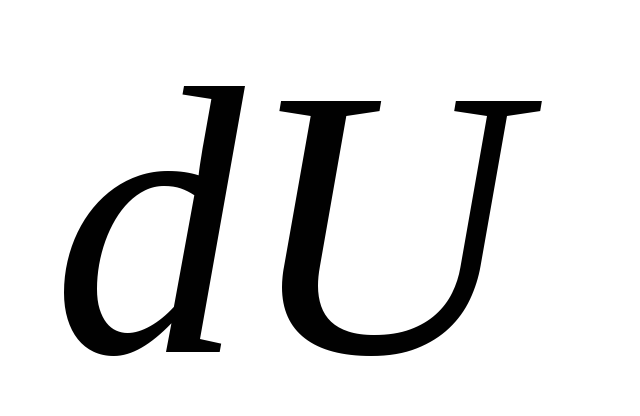 - infinitezimalna promjena unutarnje energije sustava kada mu se preda elementarna količina topline
Q te obavljanje elementarnog rada sustava
A preko vanjskih tijela.
- infinitezimalna promjena unutarnje energije sustava kada mu se preda elementarna količina topline
Q te obavljanje elementarnog rada sustava
A preko vanjskih tijela.
