Molekularno-kinetička teorija idealnih plinova
Dali si znao,
što je misaoni eksperiment, gedanken eksperiment?
To je nepostojeća praksa, onostrano iskustvo, mašta o onome čega zapravo nema. Misaoni eksperimenti su poput sanjarenja. Rađaju čudovišta. Za razliku od fizičkog eksperimenta, koji je eksperimentalni test hipoteza, “misaoni eksperiment” magično zamjenjuje eksperimentalni test sa željenim, neprovjerenim zaključcima, manipulirajući logičkim konstrukcijama koje zapravo krše samu logiku korištenjem nedokazanih premisa kao dokazanih, tj. zamjena. Dakle, glavna zadaća podnositelja zahtjeva za "misaone eksperimente" je prevariti slušatelja ili čitatelja zamjenom stvarnog fizičkog eksperimenta njegovom "lutkom" - fiktivnim razmišljanjem na uvjetnoj slobodi bez same fizičke provjere.
Ispunjavanje fizike imaginarnim, "misaonim eksperimentima" dovelo je do apsurdne, nadrealne, zbunjujuće slike svijeta. Pravi istraživač mora razlikovati takve "omotače" od stvarnih vrijednosti.
Relativisti i pozitivisti tvrde da je "misaoni eksperiment" vrlo koristan alat za provjeru dosljednosti teorija (također nastalih u našim umovima). Time varaju ljude, jer svaku provjeru može izvršiti samo izvor neovisan o predmetu provjere. Sam predlagatelj hipoteze ne može biti verifikacija vlastite tvrdnje, budući da je razlog za samu tu tvrdnju nepostojanje proturječja koje podnositelj zahtjeva vidi u izjavi.
To vidimo na primjeru SRT-a i GTR-a koji su se pretvorili u svojevrsnu religiju koja upravlja znanošću i javno mišljenje. Nikakve činjenice koje im proturječe ne mogu nadvladati Einsteinovu formulu: "Ako činjenica ne odgovara teoriji, promijenite činjenicu" (U drugoj verziji, "Činjenica ne odgovara teoriji? - Utoliko gore po činjenicu ").
Maksimalno što "misaoni eksperiment" može zahtijevati samo je unutarnja dosljednost hipoteze unutar okvira podnositeljeve vlastite, često nimalo istinite, logike. Sukladnost s praksom to ne provjerava. Pravi test može se održati samo u stvarnom fizičkom eksperimentu.
Eksperiment je eksperiment, jer to nije usavršavanje misli, već test misli. Misao koja je unutar sebe dosljedna ne može se testirati. To je dokazao Kurt Gödel.
U razrijeđenom plinu udaljenost između molekula mnogo je puta veća od njihove veličine. U tom je slučaju međudjelovanje između molekula zanemarivo, a kinetička energija molekula mnogo je veća od potencijalne energije njihove interakcije.
Za objašnjenje svojstava tvari u plinovitom stanju umjesto realnog plina koristi se njegov fizikalni model – idealni plin. Model pretpostavlja:
udaljenost između molekula nešto je veća od njihova promjera;
molekule su elastične kuglice;
među molekulama nema privlačnih sila;
pri sudaru molekula međusobno i sa stijenkama posude djeluju odbojne sile;
Molekulsko gibanje podliježe zakonima mehanike.
Osnovna jednadžba za mkt idealnog plina:
Osnovna jednadžba MKT-a omogućuje izračunavanje tlaka plina ako su poznati masa molekule, prosječna vrijednost kvadrata brzine i koncentracija molekula.
Idealan tlak plina leži u činjenici da molekule u sudarima sa stijenkama posude s njima međusobno djeluju prema zakonima mehanike kao elastična tijela. Kada se molekula sudari sa stijenkom posude, projekcija brzine vx vektora brzine na os OX, okomitu na stijenku, mijenja predznak u suprotan, ali ostaje konstantna u apsolutnoj vrijednosti. Dakle, kao rezultat sudara molekule sa stijenkom, projekcija njezine količine gibanja na os OX mijenja se od mv 1x = -mv x do mv 2x =mv x . Promjena količine gibanja molekule pri sudaru sa stijenkom uzrokuje silu F 1 koja na nju djeluje sa strane stijenke. Promjena količine gibanja molekule jednaka je količini gibanja te sile:
Prilikom sudara, prema trećem Newtonovom zakonu, molekula djeluje na stijenku silom F 2 koja je po apsolutnoj vrijednosti jednaka sili F 1 i suprotno je usmjerena.
Postoji mnogo molekula i svaka daje isti zamah zidu nakon sudara. U sekundi prenose impuls 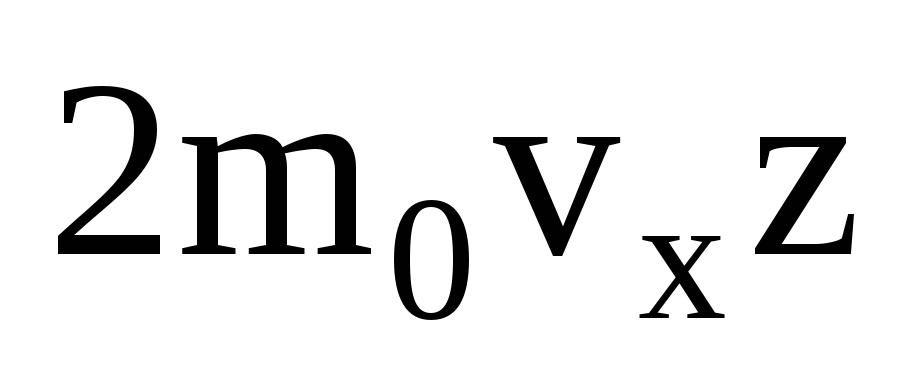 , gdje je z broj sudara svih molekula sa stijenkom, koji je proporcionalan koncentraciji molekula u plinu, brzini molekula i površini stijenke:
, gdje je z broj sudara svih molekula sa stijenkom, koji je proporcionalan koncentraciji molekula u plinu, brzini molekula i površini stijenke: 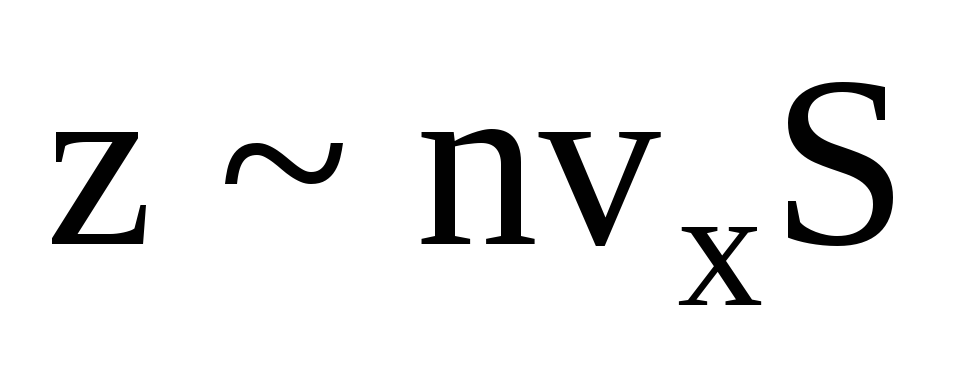 . Samo se polovica molekula kreće prema stijenci, a ostale se kreću u suprotnom smjeru:
. Samo se polovica molekula kreće prema stijenci, a ostale se kreću u suprotnom smjeru: 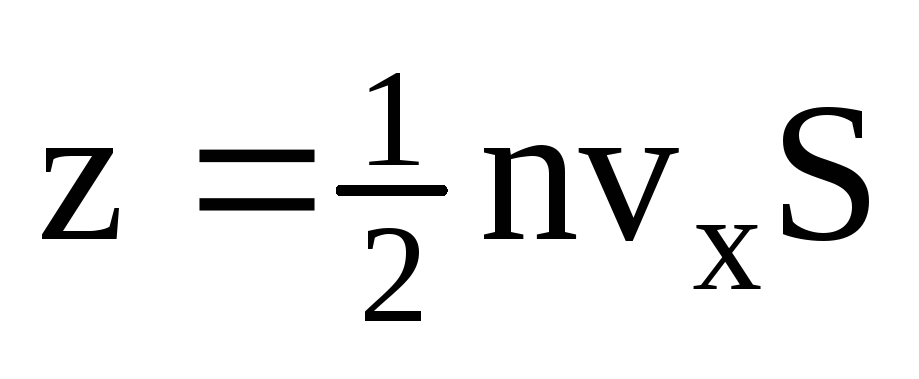 . Tada je ukupni zamah prenesen na zid u 1 sekundi:
. Tada je ukupni zamah prenesen na zid u 1 sekundi: 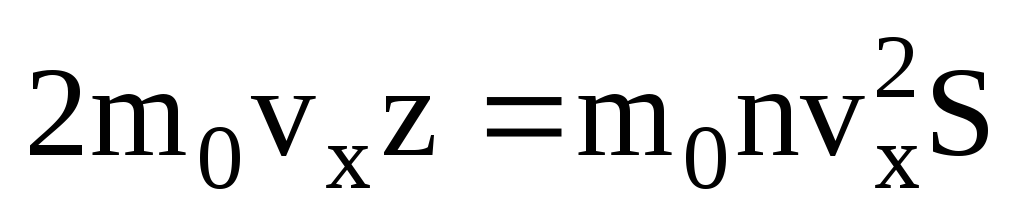 . Prema drugom Newtonovom zakonu, promjena količine gibanja tijela u jedinici vremena jednaka je sili koja na njega djeluje:
. Prema drugom Newtonovom zakonu, promjena količine gibanja tijela u jedinici vremena jednaka je sili koja na njega djeluje:
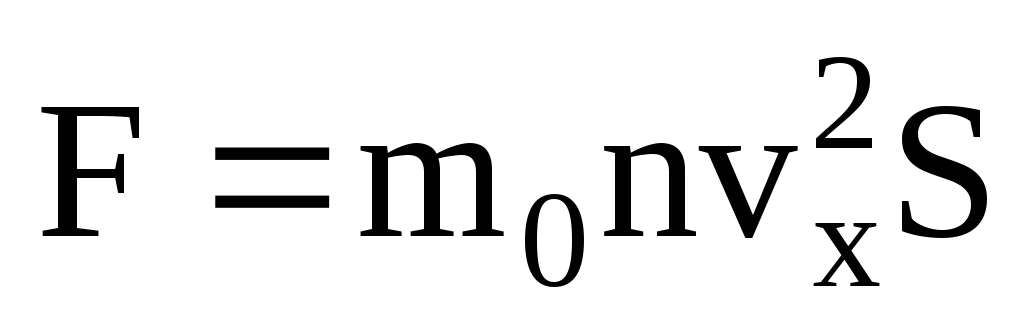
S obzirom da nemaju sve molekule istu brzinu, sila koja djeluje na stijenku bit će proporcionalna srednjem kvadratu brzine. Budući da se molekule kreću u svim smjerovima, prosječne vrijednosti kvadrata projekcija brzine su jednake. Stoga je srednji kvadrat projekcije brzine: 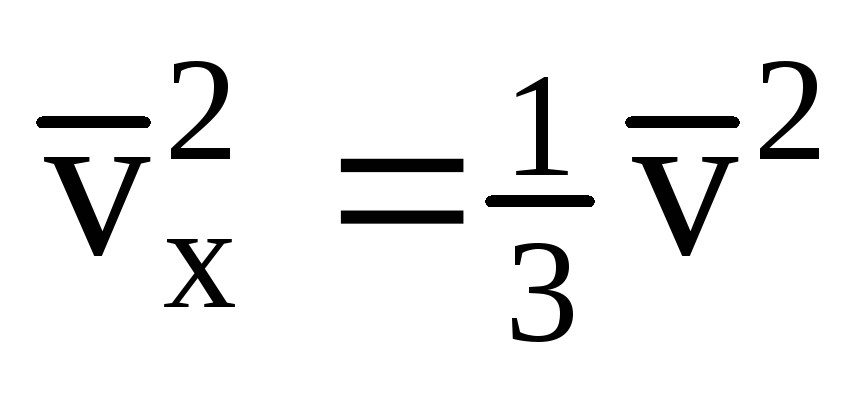 ;
;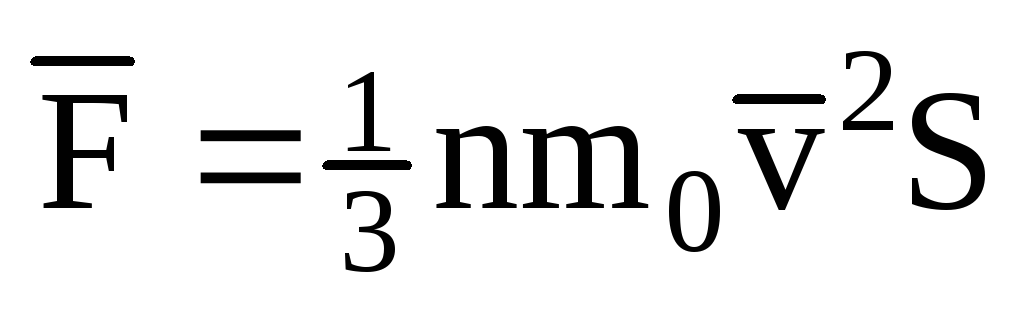 . Tada je tlak plina na stijenku posude:
. Tada je tlak plina na stijenku posude:
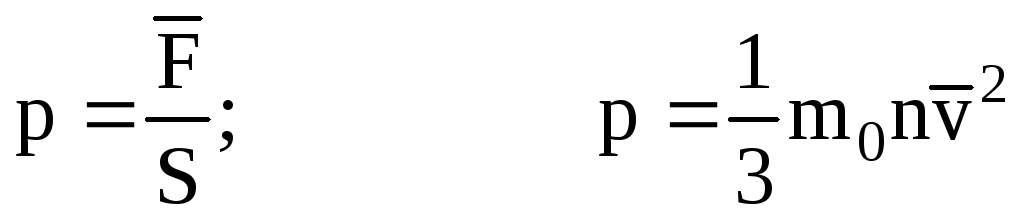 - osnovna jednadžba MKT.
- osnovna jednadžba MKT.
Označavanje prosječne vrijednosti kinetičke energije translatornog gibanja molekula idealni plin:
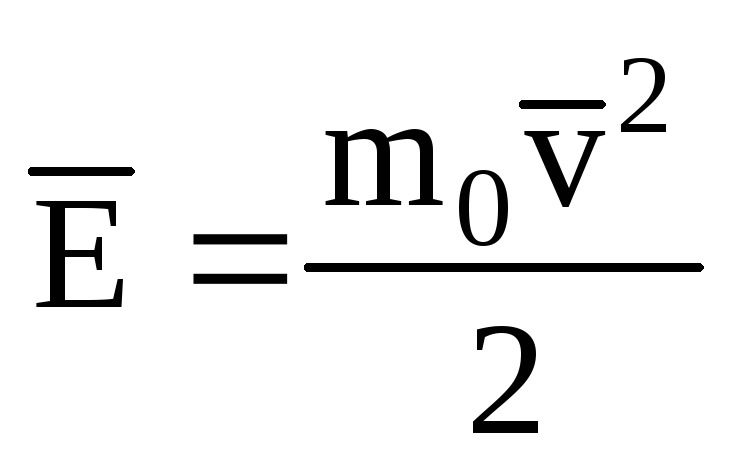 , dobivamo
, dobivamo
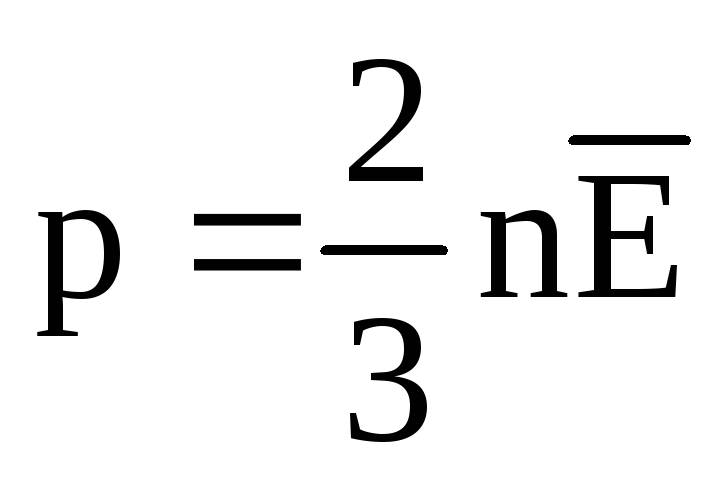
Temperatura i njeno mjerenje:
Osnovna MKT jednadžba za idealni plin povezuje lako mjerljiv makroskopski parametar - tlak - s takvim mikroskopskim parametrima plina kao što su prosječna kinetička energija i koncentracija molekula. No, izmjerivši samo tlak, ne možemo saznati niti prosječnu vrijednost kinetičke energije molekula zasebno, niti njihovu koncentraciju. Stoga su za pronalaženje mikroskopskih parametara plina potrebna mjerenja neke druge fizičke veličine povezane s prosječnom kinetičkom energijom molekula. Ova vrijednost je temperatura.
Svako makroskopsko tijelo ili skupina makroskopskih tijela pod stalnim vanjskim uvjetima spontano prelazi u stanje toplinske ravnoteže. Toplinska ravnoteža - ovo je stanje u kojem svi makroskopski parametri ostaju nepromijenjeni proizvoljno dugo vremena.
Temperatura karakterizira stanje toplinske ravnoteže sustava tijela: sva tijela sustava koja su međusobno u toplinskoj ravnoteži imaju istu temperaturu.
Za mjerenje temperature možete koristiti promjenu bilo koje makroskopske veličine ovisno o temperaturi: volumen, tlak, električni otpor itd.
Najčešće se u praksi koristi ovisnost volumena tekućine (živa ili alkohol) o temperaturi. Pri kalibraciji termometra obično se kao referentna točka (0) uzima temperatura topljenja leda; druga konstantna točka (100) je vrelište vode pri normalnom atmosferskom tlaku (Celzijeva ljestvica). Budući da se različite tekućine različito šire kada se zagrijavaju, tako utvrđena ljestvica donekle će ovisiti o svojstvima dane tekućine. Naravno, 0 i 100°C odgovarat će za sve termometre, ali 50°C neće odgovarati.
Za razliku od tekućina, svi razrijeđeni plinovi se zagrijavanjem na isti način šire i na isti način mijenjaju svoj tlak s promjenom temperature. Stoga se u fizici za uspostavljanje racionalne temperaturne ljestvice koristi promjena tlaka određene količine razrijeđenog plina pri stalnom volumenu ili promjena volumena plina pri stalnom tlaku. Ova se ljestvica ponekad naziva skala temperature idealnog plina.
U toplinskoj ravnoteži prosječna kinetička energija translatornog gibanja molekula svih plinova je ista. Tlak je izravno proporcionalan prosječnoj kinetičkoj energiji translatornog gibanja molekula: 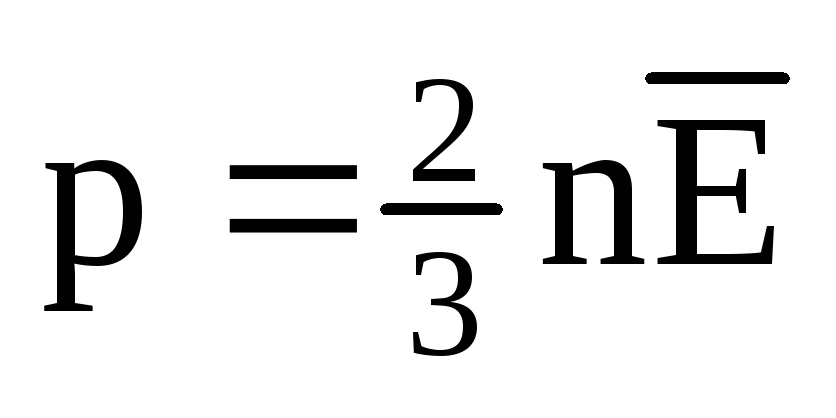 . U toplinskoj ravnoteži, ako su tlak plina dane mase i njegov volumen fiksni, prosječna kinetička energija molekula plina mora imati strogo definiranu vrijednost, poput temperature. Jer
. U toplinskoj ravnoteži, ako su tlak plina dane mase i njegov volumen fiksni, prosječna kinetička energija molekula plina mora imati strogo definiranu vrijednost, poput temperature. Jer 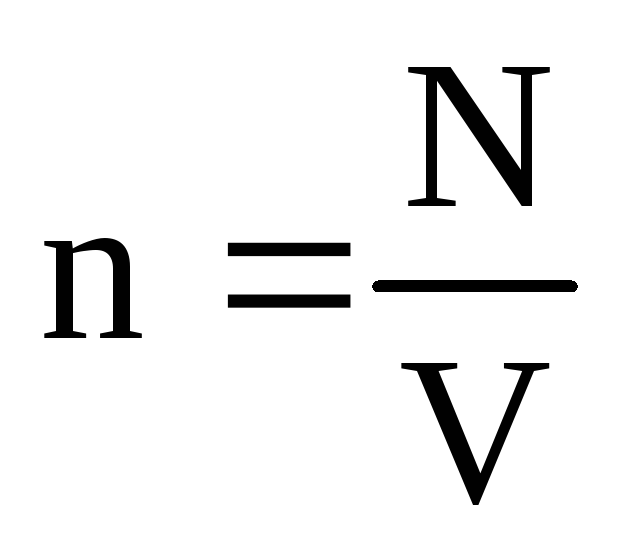 , onda
, onda 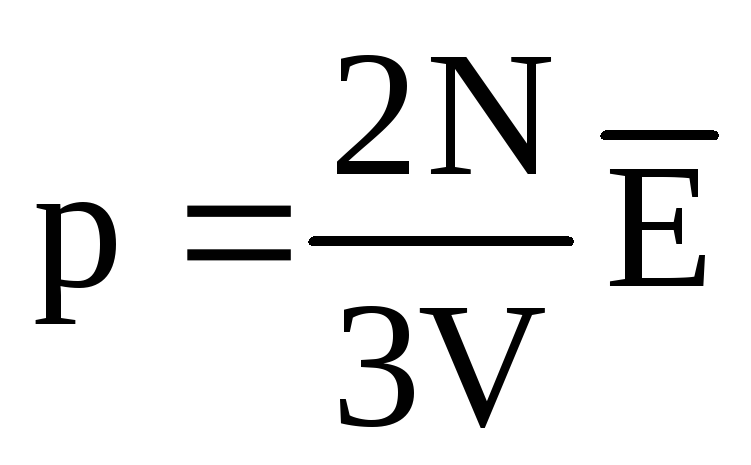 , ili
, ili 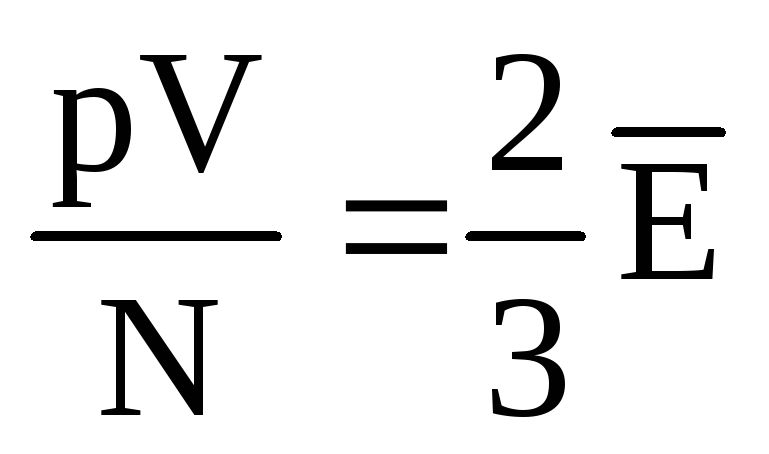 .
.
Označiti 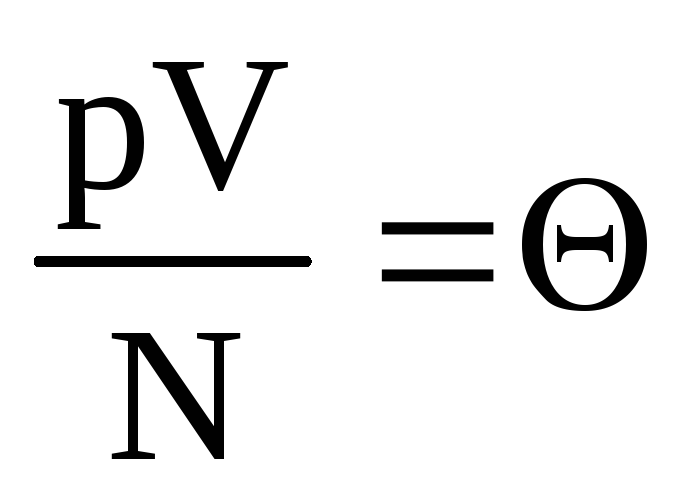 . Vrijednost
. Vrijednost  raste s temperaturom i ne ovisi ni o čemu osim o temperaturi. Stoga se može smatrati prirodnom mjerom temperature.
raste s temperaturom i ne ovisi ni o čemu osim o temperaturi. Stoga se može smatrati prirodnom mjerom temperature.
Molekularno kinetička teorija opisuje ponašanje i svojstva posebnog idealnog objekta zvanog idealni plin. Ovaj fizički model temelji se na molekularnoj strukturi materije. Stvaranje molekularne teorije veže se uz radove R. Clausiusa, J. Maxwella, D. Joulea i L. Boltzmanna.
Idealan plin. Molekularno-kinetička teorija idealnog plina temelji se na sljedećim pretpostavkama:
atomi i molekule mogu se promatrati kao materijalne bodove, koji su u neprekidnom kretanju;
vlastiti volumen molekula plina je zanemariv u usporedbi s volumenom posude;
svi atomi i molekule su razlučivi, odnosno načelno je moguće pratiti kretanje svake čestice;
prije sudara molekula plina između njih ne postoje sile međudjelovanja, a sudari molekula između sebe i sa stijenkama posude pretpostavljaju se apsolutno elastičnima;
gibanje svakog atoma ili molekule plina opisano je zakonima klasične mehanike.
Zakoni dobiveni za idealni plin mogu se koristiti u proučavanju realnih plinova. Za to se stvaraju eksperimentalni modeli idealnog plina, u kojima su svojstva stvarnog plina bliska svojstvima idealnog plina (na primjer, pri niskim tlakovima i visokim temperaturama).
Zakoni idealnog plina
Boyle-Mariotteov zakon:
za danu masu plina pri konstantnoj temperaturi, umnožak tlaka plina i njegovog volumena je konstantna vrijednost: pV = konst , (1.1)
na T = konst , m = konst .
Krivulja koja prikazuje odnos između količina R i V, karakterizira svojstva tvari pri konstantnoj temperaturi, a naziva se izoterma to je hiperbola (sl. 1.1.), a proces koji se odvija pri konstantnoj temperaturi naziva se izoterma.
Gay-Lussacovi zakoni:
Volumen dane mase plina pri konstantnom tlaku varira linearno s temperaturom
V = V 0 (1 + t ) na P = konst , m = konst . (1.2)

str = str 0 (1 + t ) na V = konst , m = konst . (1.3)
U jednadžbama (1.2) i (1.3) temperatura je izražena na Celzijevoj skali, tlak i volumen - na
0 S, dok
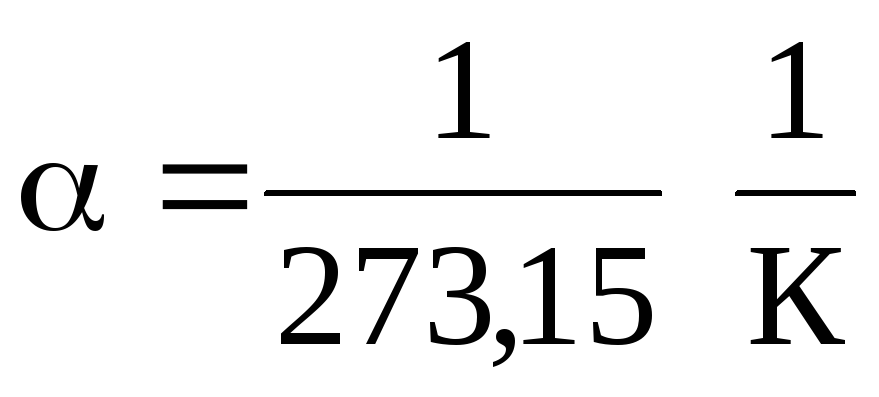 .
.
Proces koji se odvija pri stalnom tlaku naziva se izobarni, može se prikazati kao linearna funkcija (slika 1.2.).
Proces koji se odvija pri konstantnom volumenu naziva se izohorni(Sl. 1.3.).
Iz jednadžbi (1.2) i (1.3) slijedi da izobare i izohore sijeku temperaturnu os u točki t =1/ \u003d - 273,15 S . Ako ishodište pomaknemo na ovu točku, prelazimo na Kelvinovu ljestvicu.
Uvodeći u formule (1.2) i (1.3) termodinamičke temperature, Gay-Lussacovim zakonima može se dati prikladniji oblik:
V = V 0 (1+t) = = V 0 = =V 0 T;
str = str 0 (1+t) = str 0 = str 0 T;
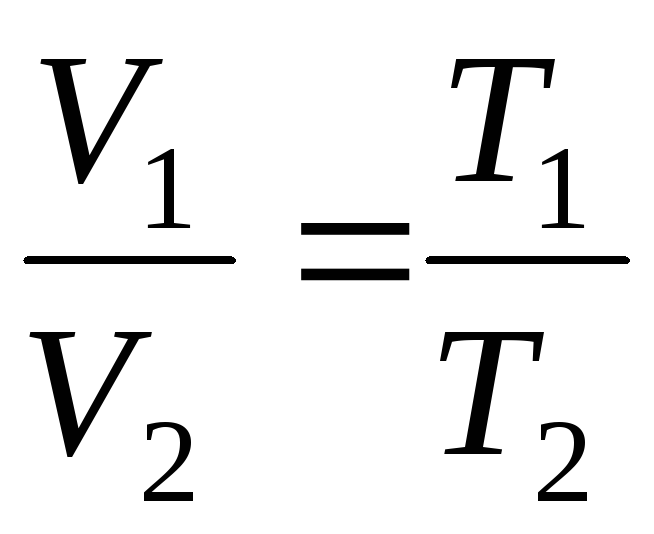 na
p=konst, m=konst
;
(1.4)
na
p=konst, m=konst
;
(1.4)
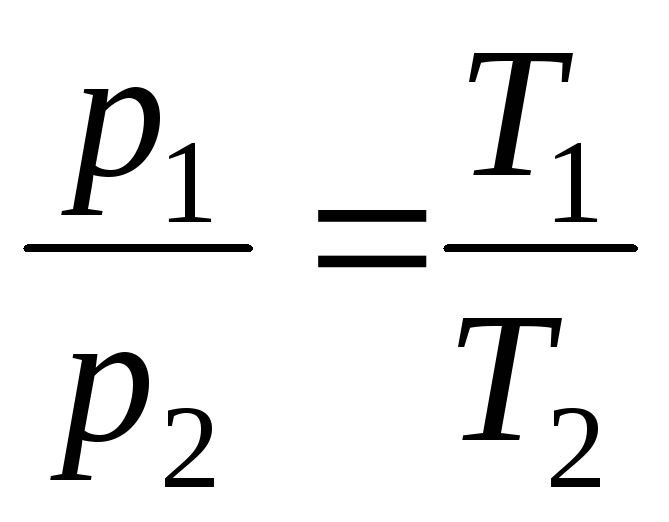 na V = konst, m = konst
,
(1.5)
na V = konst, m = konst
,
(1.5)
gdje se indeksi 1 i 2 odnose na proizvoljna stanja koja leže na istoj izobari ili izohori .
Avogadrov zakon:
molovi bilo kojeg plina pri istim temperaturama i tlakovima zauzimaju iste volumene.
U normalnim uvjetima, ovaj volumen je jednak V,0 \u003d 22,4110 -3 m 3 / mol . Po definiciji, u jednom molu razne tvari sadrži isti broj molekula, jednako stalni Avogadro:N A = 6,02210 23 mol -1 .
Daltonov zakon:
tlak smjese idealni plinovi jednak zbroju parcijalnih tlakova R 1 , R 2 , R 3 … R n, plinovi uključeni u njega:
p = str 1 + str 2 + R 3 + …+ str n .
Parcijalni tlak – ovo je tlak koji bi plin u sastavu proizveo plinska smjesa ako je sama zauzimala volumen jednak volumenu smjese pri istoj temperaturi.
Jednadžba stanja idealnog plina
(Clapeyron-Mendeleev jednadžba)
Između temperature, volumena i tlaka postoji jasan odnos. Ovaj odnos se može prikazati funkcionalnom ovisnošću:
f(p, V, T)= 0.
Zauzvrat, svaka od varijabli ( p, v, t) je funkcija dvije druge varijable. Eksperimentalno se utvrđuje vrsta funkcionalne ovisnosti za svako fazno stanje tvari (kruto, tekuće, plinovito). To je vrlo naporan proces i jednadžba stanja je utvrđena samo za plinove koji su u razrijeđenom stanju, au približnom obliku za neke komprimirane plinove. Za tvari koje nisu u plinovitom stanju ovaj problem još nije riješen.
Francuski fizičar B. Clapeyron donio je jednadžba stanja idealnog plina, kombinirajući zakone Boyle-Mariotte, Gay-Lussac, Charles:
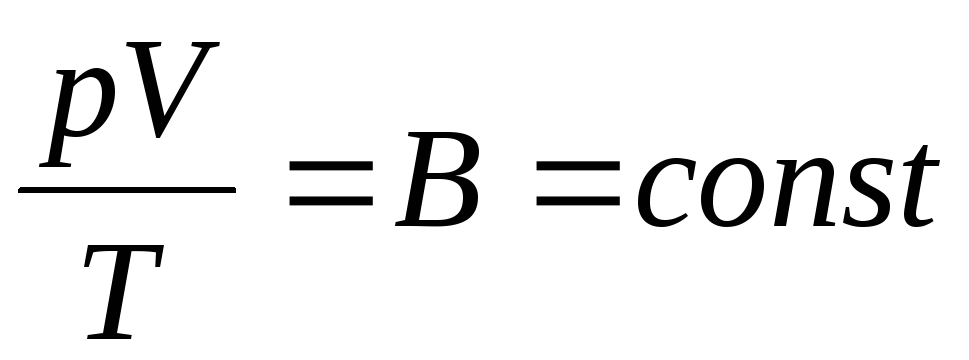 . (1.6)
. (1.6)
Izraz (1.6) je Clapeyronova jednadžba, gdje je NA je plinska konstanta. Različit je za različite plinove.
DI. Mendeljejev je spojio Clapeyronovu jednadžbu s Avogadrovim zakonom, odnoseći jednadžbu (1.6) na jedan mol i koristeći molarni volumen V . Prema Avogadrovom zakonu, za isto R i T molovi svih plinova zauzimaju isti molarni volumen V .
.
Prema tome, konstanta NA bit će isti za sve idealne plinove. Ova se konstanta obično označava R i jednako R=
8,31
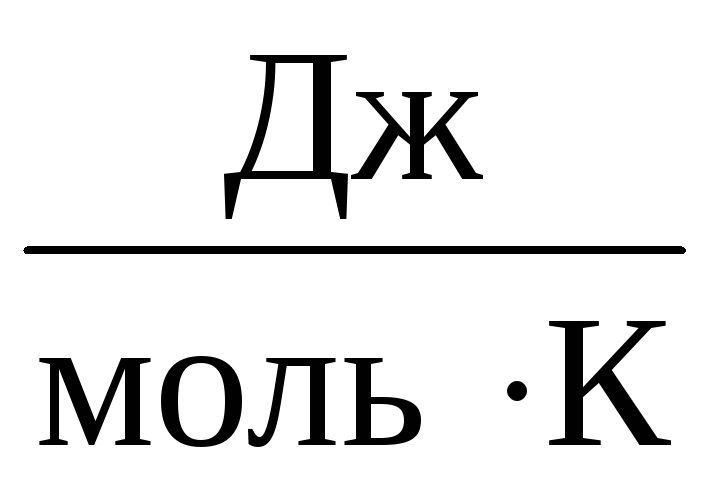 .
.
Clapeyron-Mendeleev jednadžba ima sljedeći oblik:
str V . = R T.
Iz jednadžbe (1.7) za jedan mol plina može se ići na na Clapeyron-Mendelejevu jednadžbu za proizvoljnu masu plina:
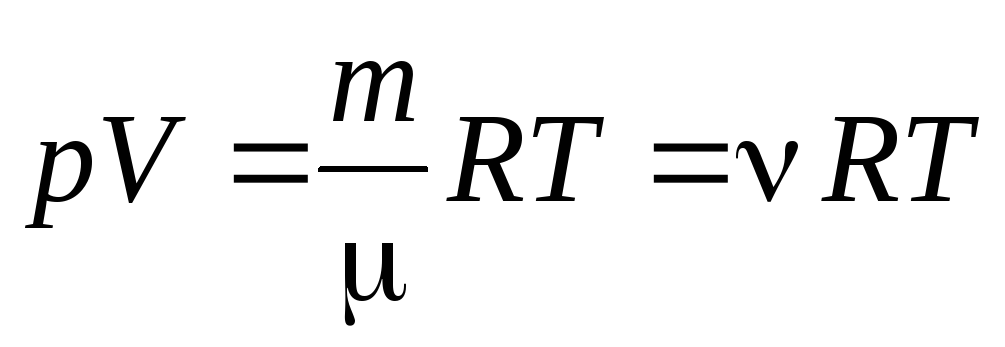 , (1.7)
, (1.7)
gdje
–
molekulska masa
(masa jednog mola tvari, kg/mol); m
masa plina;
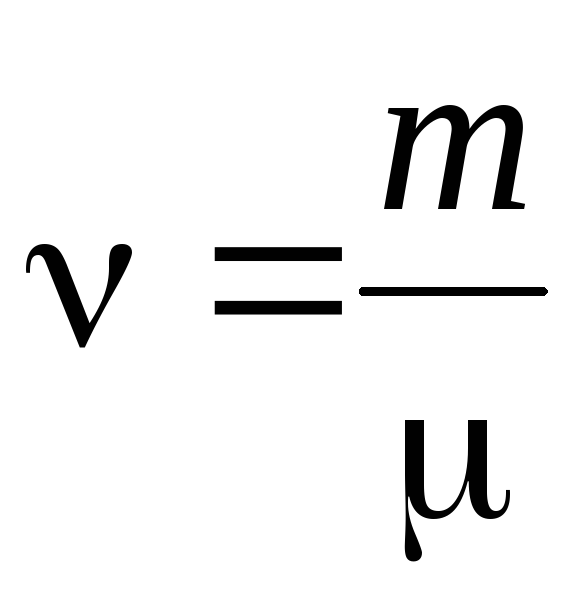 - količina materije .
- količina materije .
Češće se koristi drugi oblik jednadžbe stanja idealnog plina, uvodeći Boltzmannova konstanta: 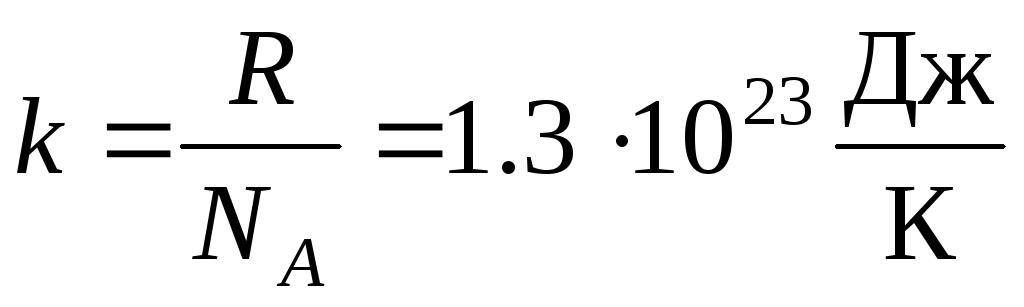 .
.
Tada jednadžba (1.7) izgleda ovako:
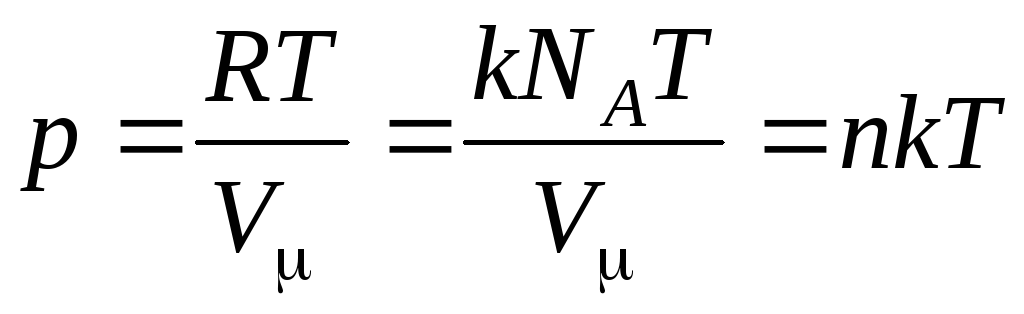 ,
(1.8)
,
(1.8)
gdje
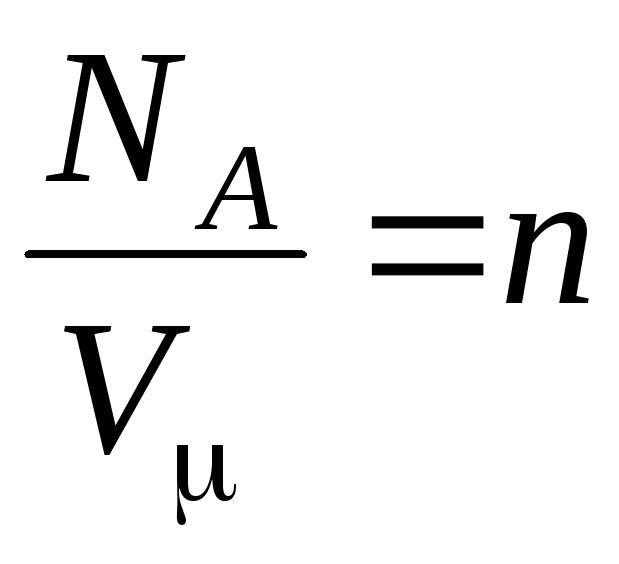 –
koncentracija molekula (broj molekula po jedinici volumena). Iz ovog izraza proizlazi da je tlak idealnog plina izravno proporcionalan koncentraciji njegovih molekula odnosno gustoći plina. Pri istim temperaturama i tlakovima svi plinovi sadrže isti broj molekula po jedinici volumena. Naziva se broj molekula sadržanih u 1 m 3 pod normalnim uvjetima
Loschmidtov broj:
–
koncentracija molekula (broj molekula po jedinici volumena). Iz ovog izraza proizlazi da je tlak idealnog plina izravno proporcionalan koncentraciji njegovih molekula odnosno gustoći plina. Pri istim temperaturama i tlakovima svi plinovi sadrže isti broj molekula po jedinici volumena. Naziva se broj molekula sadržanih u 1 m 3 pod normalnim uvjetima
Loschmidtov broj:
N L = 2.68 10 25 m -3.
Osnovna jednadžba molekularne kinetike
teorija idealnih plinova
Najvažniji zadatak Kinetička teorija plinova je teorijski izračun tlaka idealnog plina na temelju molekularno-kinetičkih pojmova. Osnovna jednadžba molekularne kinetičke teorije idealnih plinova izvedena je pomoću statističke metode.
Pretpostavlja se da se molekule plina gibaju nasumično, broj međusobnih sudara između molekula plina zanemariv je u usporedbi s brojem udaraca o stijenke posude, a ti sudari su apsolutno elastični. Na stijenci posude neko elementarno područje S te izračunajte pritisak koji će molekule plina vršiti na to područje.
Potrebno je uzeti u obzir činjenicu da se u stvarnosti molekule mogu kretati do mjesta pod različitim kutovima i mogu imati razne brzine, koji se, osim toga, može promijeniti sa svakim sudarom. U teorijskim proračunima kaotično gibanje molekula je idealizirano, zamijenjeno je gibanjem duž tri međusobno okomita pravca.
Ako uzmemo u obzir posudu u obliku kocke, u kojoj N molekule plina u šest smjerova, lako je vidjeti da se u svakom trenutku 1/3 broja svih molekula kreće duž svakog od njih, a polovica njih (odnosno 1/6 broja svih molekula) kreće se u jednom smjeru, a druga polovica (također 1/6) - u suprotnom smjeru. Pri svakom sudaru pojedinačna molekula koja se kreće okomito na mjesto, reflektirajući se, prenosi na njega zamah, pri čemu se njezin zamah (momentum) mijenja za iznos
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Broj udaraca molekula koje se kreću u određenom smjeru na mjestu bit će jednak: N = 1/6 n Svt. Kada se sudare s platformom, ove će molekule prenijeti zamah na nju.
P= N P 1 =2 m 0 vnSvt= m 0 v 2 nSt,
gdje n je koncentracija molekula. Tada će tlak kojim plin djeluje na stijenku posude biti jednak:
p = 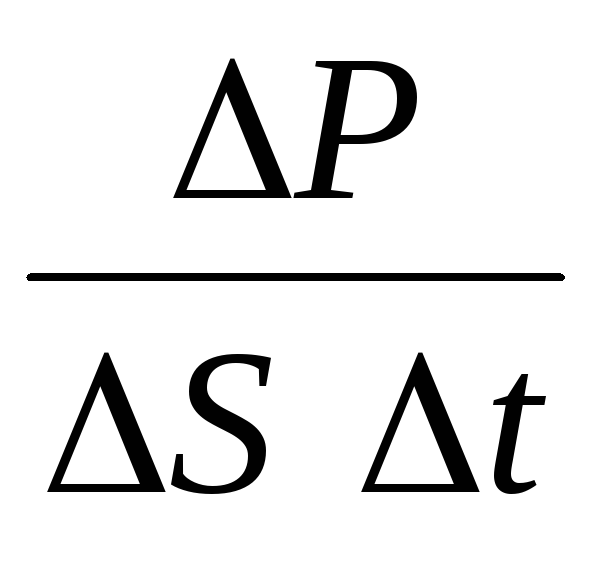 =
nm 0
v 2
.
(1.9)
=
nm 0
v 2
.
(1.9)
Međutim, molekule plina kreću se različitim brzinama: v 1 , v 2 , …,v n, pa se brzine moraju usrednjiti. Zbroj kvadrata brzina molekula plina, podijeljen njihovim brojem, određuje srednju kvadratnu brzinu:
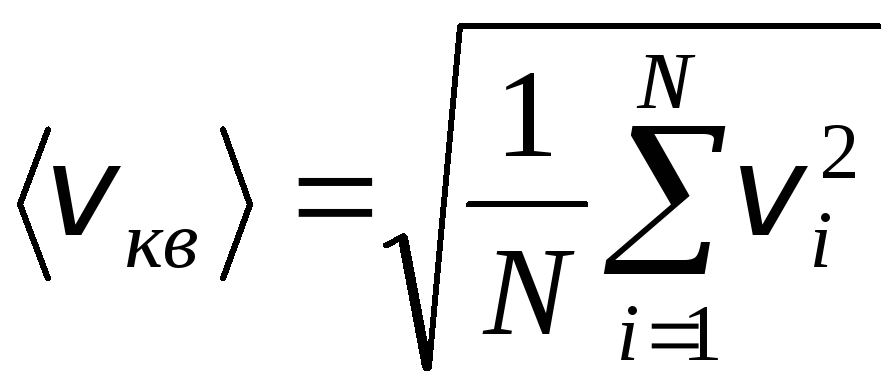 .
.
Jednadžba (1.9) poprimit će oblik:
![]() (1.10)
(1.10)
naziva se izraz (1.10). osnovna jednadžba molekularne kinetičke teorije idealni plinovi.
S obzirom na to 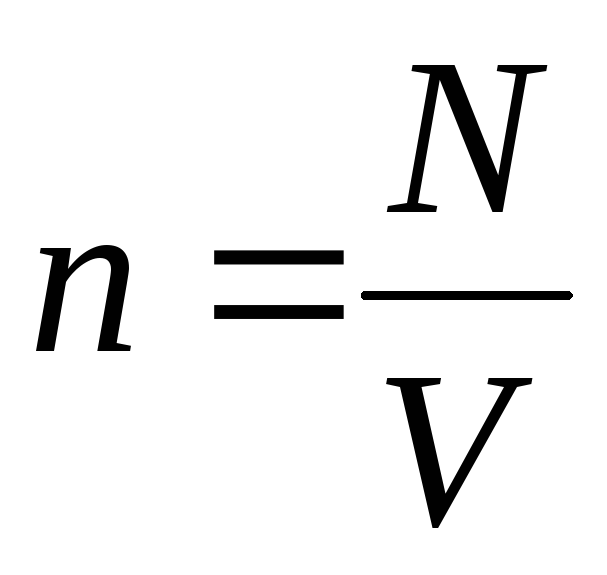 , dobivamo:
, dobivamo:
p V = N 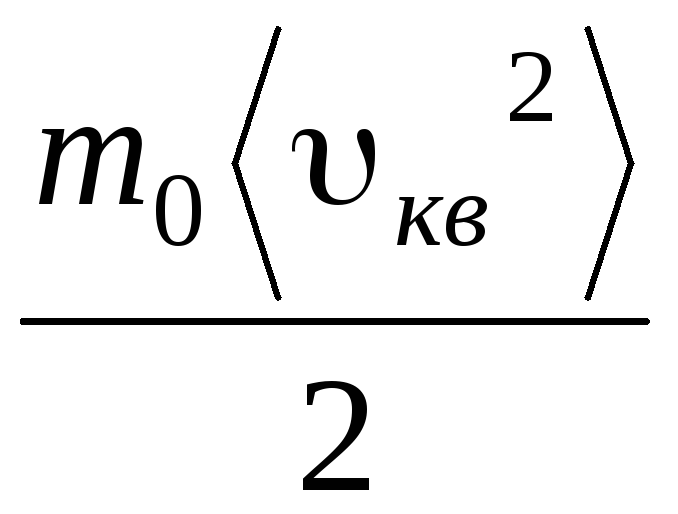 =E,
(1.11)
=E,
(1.11)
gdje E je ukupna kinetička energija translatornog gibanja svih molekula plina. Stoga je tlak plina izravno proporcionalan kinetičkoj energiji translatornog gibanja molekula plina.
Za jedan mol plina m =, a Clapeyron-Mendeleev jednadžba ima sljedeći oblik:
str V . = R T,
a budući da iz (1.11) slijedi da str V . = v kvadrat 2 , dobivamo:
R.T.= v kvadrat 2 .
Dakle, srednja kvadratna brzina molekula plina jednaka je
v
kvadrat
=
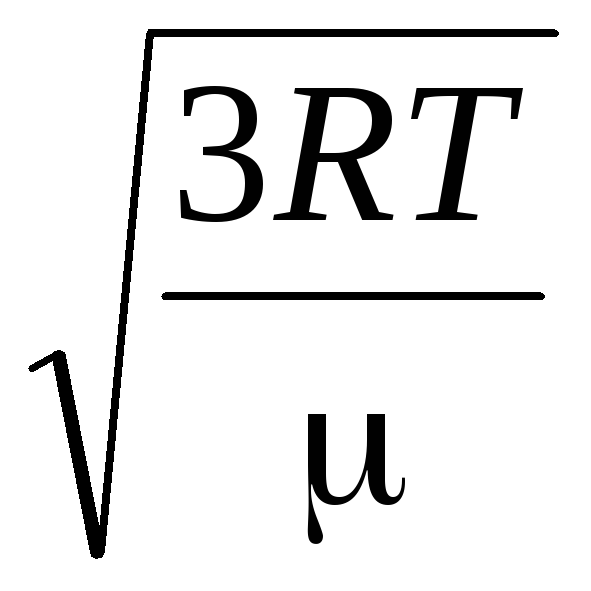 =
=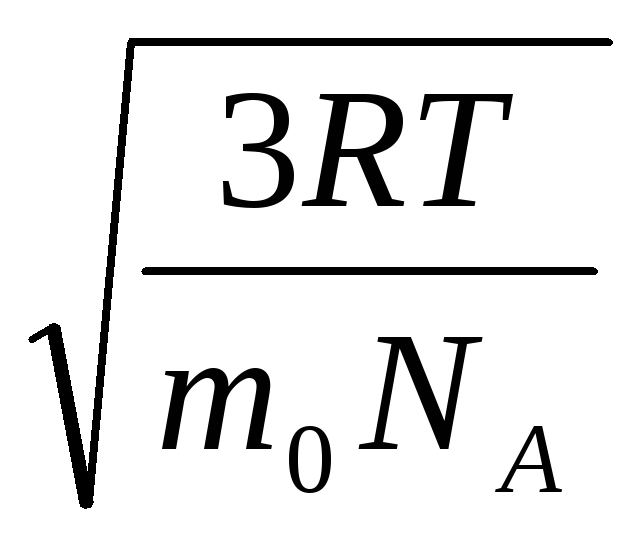 =
= ,
,
gdje k = R/N A = 1,3810 -23 J/K – Boltzmannova konstanta. Odavde možete pronaći srednju kvadratnu brzinu molekula kisika na sobnoj temperaturi - 480 m/s, vodika - 1900 m/s.
Molekularno-kinetičko značenje temperature
Temperatura je kvantitativna mjera koliko je neko tijelo vruće. Da bismo pojasnili fizikalno značenje apsolutne termodinamičke temperature T Usporedimo osnovnu jednadžbu molekularno-kinetičke teorije plinova (1.14) s Clapeyron-Mendelejevom jednadžbom str V = R.T.
Izjednačavanjem desnih dijelova ovih jednadžbi nalazimo prosječnu vrijednost kinetičke energije 0 jedne molekule ( = N/N A , k=R/N A):
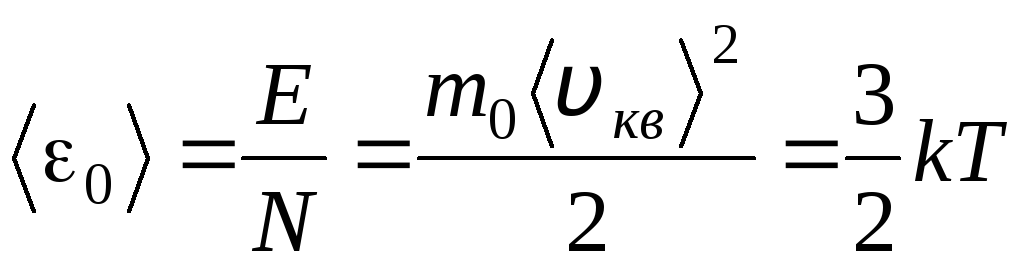 .
.
Najvažniji zaključak molekularne kinetičke teorije proizlazi iz ove jednadžbe: prosječna kinetička energija translatornog gibanja jedne molekule idealnog plina ovisi samo o temperaturi, dok je upravno proporcionalna termodinamičkoj temperaturi. Time termodinamička temperaturna ljestvica dobiva izravno fizičko značenje: pri T= 0 kinetička energija molekula idealnog plina jednaka je nuli. Prema tome, prema ovoj teoriji, translatorno gibanje molekula plina će prestati i njegov će tlak postati jednak nuli.
Teorija svojstava ravnoteže idealnog plina
Broj stupnjeva slobode molekula. Molekularno-kinetička teorija idealnih plinova dovodi do vrlo važne posljedice: molekule plina gibaju se nasumično, a prosječna kinetička energija translatornog gibanja molekule određena je isključivo temperaturom.
Kinetička energija molekularnog gibanja ne iscrpljuje se kinetičkom energija kretanja naprijed: također se sastoji od kinetičke energije rotacija i fluktuacije molekule. Da bi se izračunala energija koja ulazi u sve vrste molekularnog gibanja, potrebno je definirati broj stupnjeva slobode.
Pod, ispod broj stupnjeva slobode (ja) tijela se podrazumijeva broj neovisnih koordinata koje je potrebno unijeti za određivanje položaja tijela u prostoru.
H  Na primjer, materijalna točka ima tri stupnja slobode, budući da je njezin položaj u prostoru određen s tri koordinate: x, y i z. Prema tome, monoatomska molekula ima tri stupnja slobode translatornog gibanja.
Na primjer, materijalna točka ima tri stupnja slobode, budući da je njezin položaj u prostoru određen s tri koordinate: x, y i z. Prema tome, monoatomska molekula ima tri stupnja slobode translatornog gibanja.
D 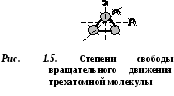 buchatomska molekula ima 5 stupnjeva slobode (slika 1.4): 3 stupnja slobode translatornog gibanja i 2 stupnja slobode rotacijskog gibanja.
buchatomska molekula ima 5 stupnjeva slobode (slika 1.4): 3 stupnja slobode translatornog gibanja i 2 stupnja slobode rotacijskog gibanja.
Molekule od tri ili više atoma imaju 6 stupnjeva slobode: 3 stupnja slobode translatornog gibanja i 3 stupnja slobode rotacijskog gibanja (slika 1.5).
Svaka molekula plina ima određeni broj stupnjeva slobode, od kojih tri odgovaraju njezinu translatornom gibanju.
Uredba o ravnomjernoj raspodjeli energije
po stupnjevima slobode
Temeljna postavka molekularno-kinetičke teorije plinova je pretpostavka potpune slučajnosti u gibanju molekula. To se odnosi i na oscilatorna i na rotacijska kretanja, a ne samo na translacijska. Pretpostavlja se da su svi smjerovi gibanja molekula u plinu jednako vjerojatni. Stoga možemo pretpostaviti da za svaki stupanj slobode molekule u prosjeku postoji ista količina energije – to je stav o ravnomjernoj raspodjeli energije po stupnjevima slobode. Energija po jednom stupnju slobode molekule je:
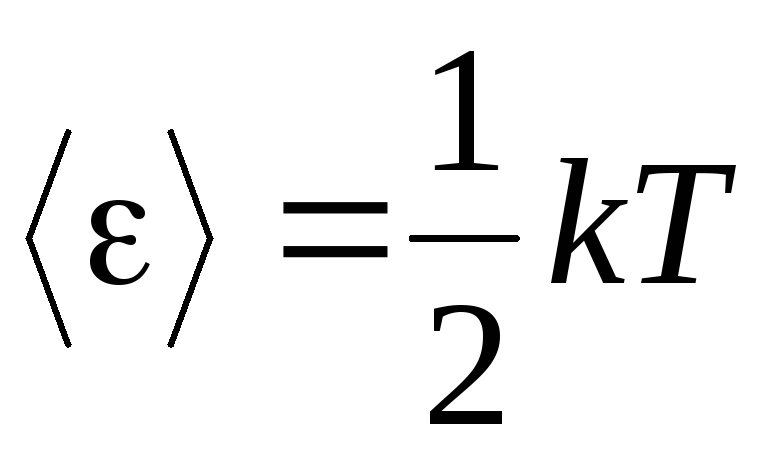 . (1.12)
. (1.12)
Ako molekula ima ja stupnjeva slobode, tada za svaki stupanj slobode postoji u prosjeku:
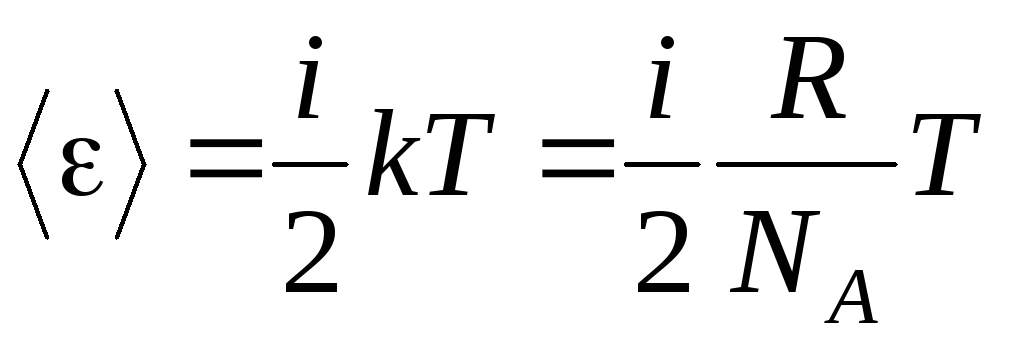 .
(1.13)
.
(1.13)
Unutarnja energija idealnog plina
Ako ukupnu opskrbu unutarnje energije plina pripišemo jednom molu, tada njegovu vrijednost dobivamo množenjem s Avogadrovim brojem:
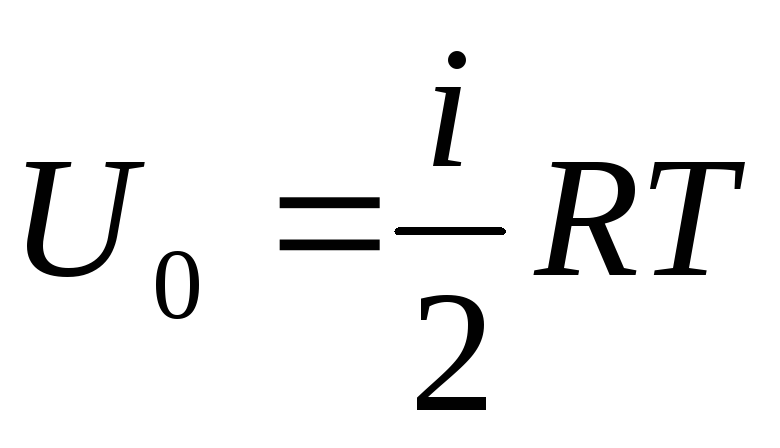 .
(1.14)
.
(1.14)
Iz toga slijedi da unutarnja energija jednog mola idealnog plina ovisi samo o temperaturi i broju stupnjeva slobode molekula plina.
Maxwellova i Boltzmannova distribucija
Raspodjela molekula idealnog plina po brzinama i energijama toplinskog gibanja (Maxwellova razdioba). Pri konstantnoj temperaturi plina pretpostavlja se da su svi smjerovi gibanja molekula jednako vjerojatni. U ovom slučaju, srednja kvadratna brzina svake molekule ostaje konstantna i jednaka je
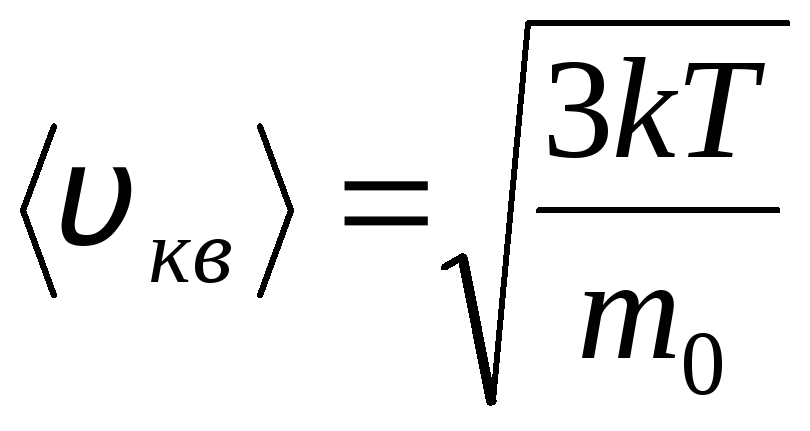 .
.
To se objašnjava činjenicom da se u idealnom plinu, koji je u stanju ravnoteže, uspostavlja određena stacionarna raspodjela brzina molekula koja se ne mijenja s vremenom. ova raspodjela podliježe određenom statističkom zakonu, koji je teorijski izveo J. Maxwell. Maxwellov zakon opisuje se funkcijom
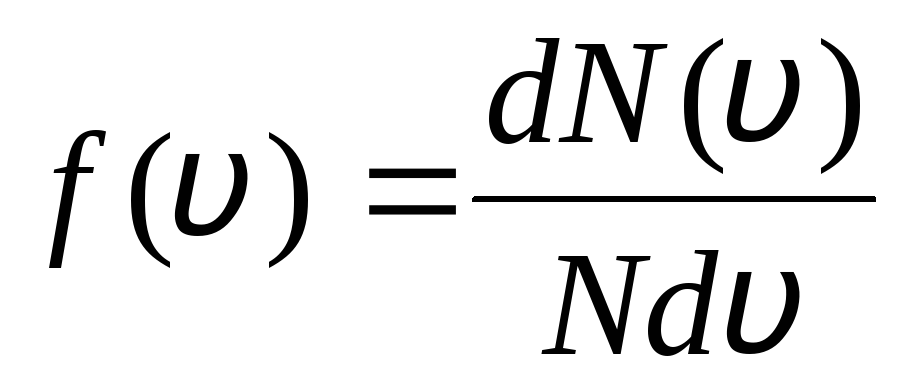 ,
,
to je funkcija f(v) određuje relativni broj molekula  , čije brzine leže u intervalu od v
prije v+dv. Primjenom metoda teorije vjerojatnosti Maxwell je utvrdio zakon raspodjele molekula idealnog plina po brzinama:
, čije brzine leže u intervalu od v
prije v+dv. Primjenom metoda teorije vjerojatnosti Maxwell je utvrdio zakon raspodjele molekula idealnog plina po brzinama:
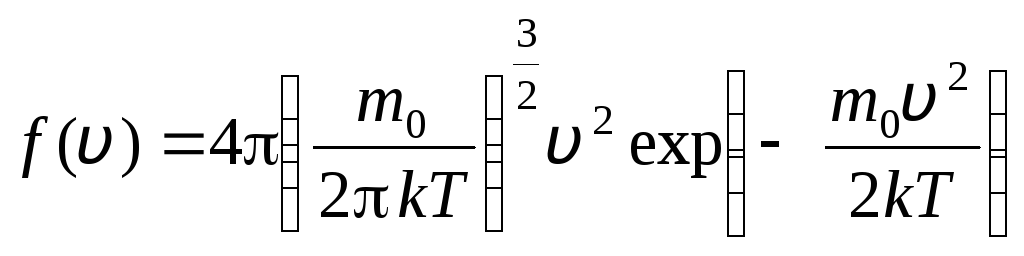 . (1.15)
. (1.15)
Funkcija distribucije je grafički prikazana na sl. 1.6. Površina omeđena krivuljom distribucije i osi x jednaka je jedinici. To znači da funkcija f(v) zadovoljava uvjet normalizacije:
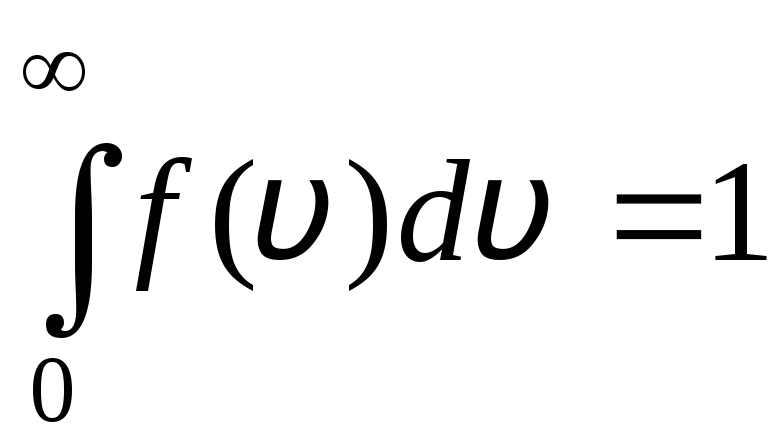 .
.
IZ  brzina pri kojoj je funkcija distribucije idealnih molekula plina u smislu brzina f(v) je maksimum, zove se najvjerojatnije
ubrzati
v B .
brzina pri kojoj je funkcija distribucije idealnih molekula plina u smislu brzina f(v) je maksimum, zove se najvjerojatnije
ubrzati
v B .
Vrijednosti v = 0 i v = odgovaraju minimumima izraza (1.15). Najvjerojatnija brzina može se pronaći diferenciranjem izraza (1.23) i izjednačavanjem s nulom:
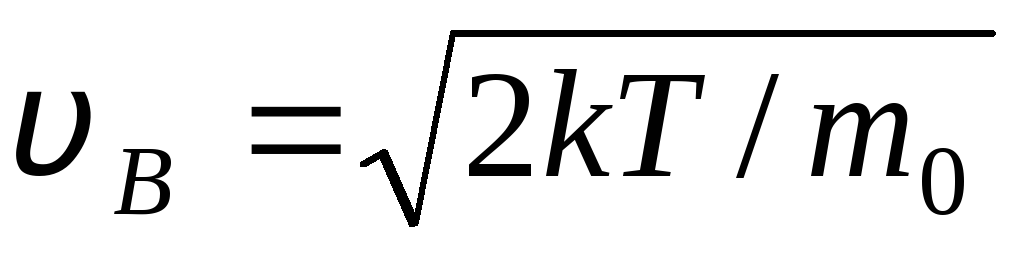 =
=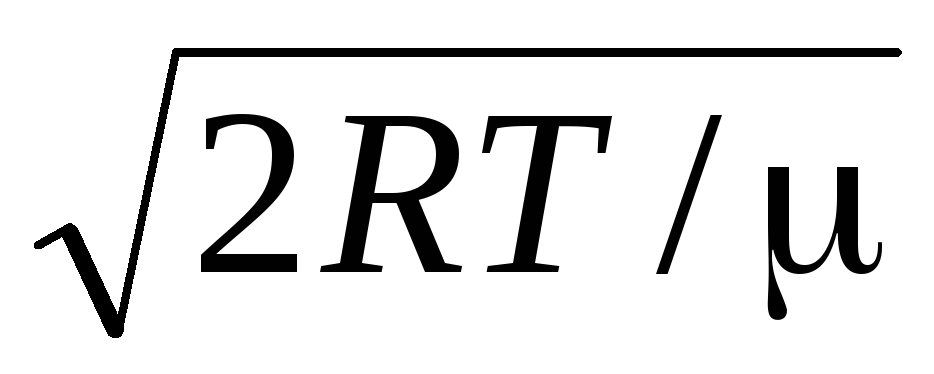 =
1,41
=
1,41
S porastom temperature maksimum funkcije pomaknut će se udesno (sl. 1.6), odnosno s porastom temperature raste i najvjerojatnija brzina, no površina omeđena krivuljom ostaje nepromijenjena. Treba napomenuti da u plinovima i pri niskim temperaturama uvijek postoji mali broj molekula koje se gibaju velikim brzinama. Prisutnost takvih "vrućih" molekula ima veliki značaj tijekom mnogih procesa.
Aritmetička srednja brzina molekula određuje se formulom
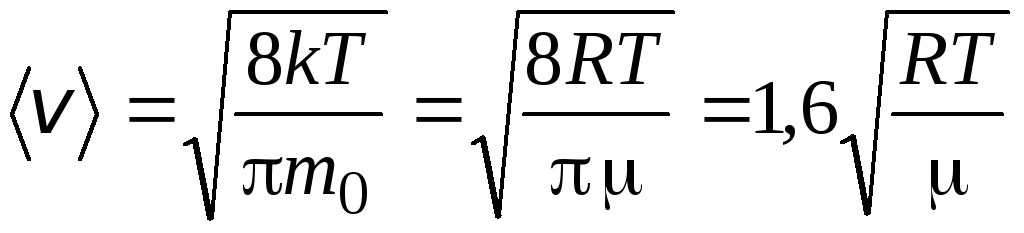 .
.
Srednja kvadratna brzina
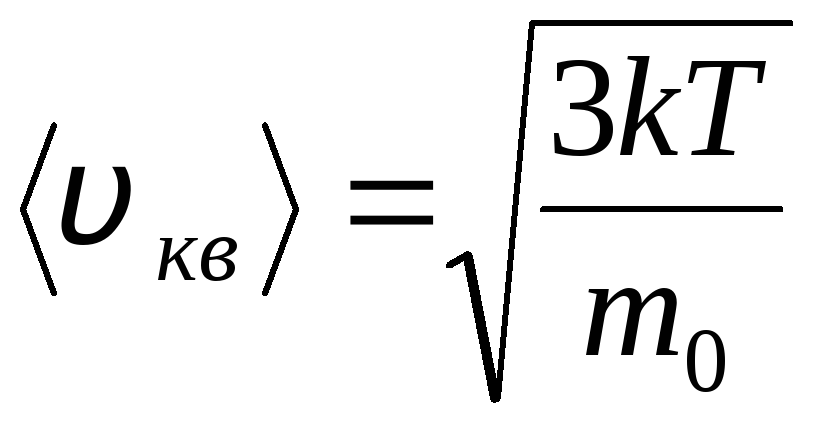 =
1,73
=
1,73 .
.
Omjer tih brzina ne ovisi o temperaturi niti o vrsti plina.
Funkcija raspodjele molekula po energijama toplinskog gibanja. Ova se funkcija može dobiti zamjenom vrijednosti kinetičke energije umjesto brzine u jednadžbu distribucije molekula (1.15):
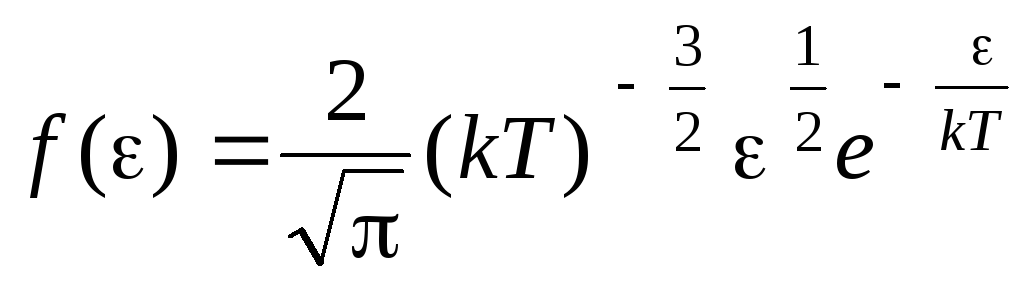 .
.
Integrirajući izraz preko energetskih vrijednosti iz  prije
prije 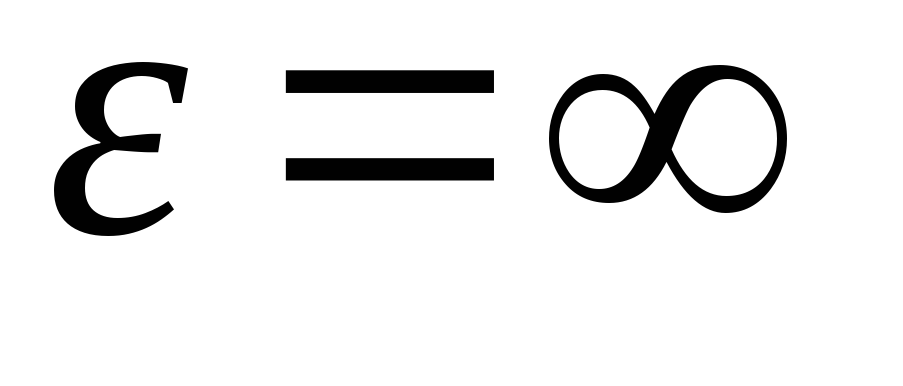
 , dobivamo prosječna kinetička energija molekule idealnog plina:
, dobivamo prosječna kinetička energija molekule idealnog plina:
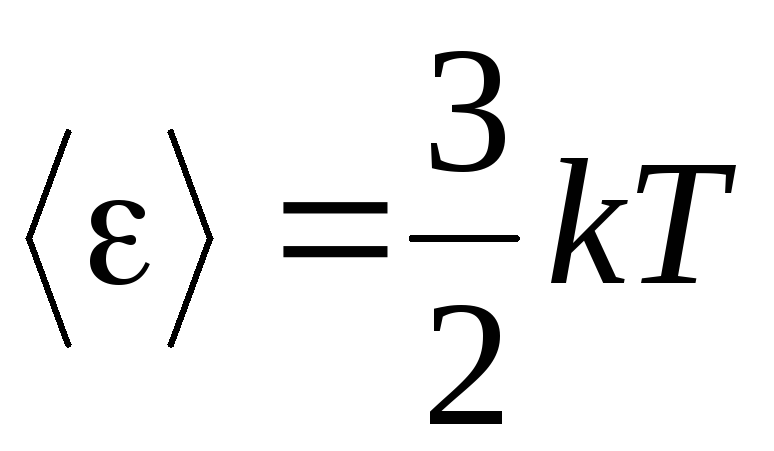 .
.
barometarska formula. Boltzmannova distribucija. Prilikom izvođenja osnovne jednadžbe molekularno-kinetičke teorije plinova i Maxwellove raspodjele molekula po brzinama, pretpostavljeno je da na molekule idealnog plina ne djeluju vanjske sile, te su stoga molekule jednoliko raspoređene po volumenu. Međutim, molekule bilo kojeg plina nalaze se u gravitacijskom polju Zemlje. Pri izvođenju zakona ovisnosti tlaka o visini pretpostavlja se da je gravitacijsko polje jednoliko, temperatura konstantna i masa svih molekula jednaka:
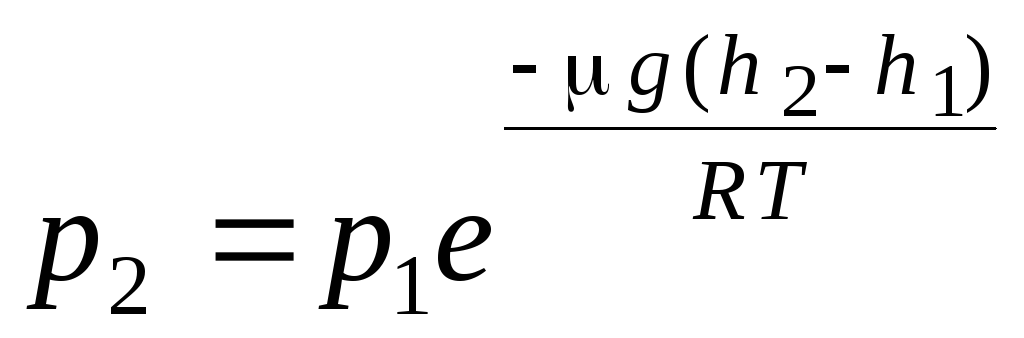 . (1.16)
. (1.16)
Izraz (1.16) naziva se barometarska formula. Omogućuje vam da pronađete atmosferski tlak ovisno o nadmorskoj visini ili mjerenjem tlaka možete pronaći nadmorsku visinu. Jer h 1 je visina iznad razine mora, gdje se tlak smatra normalnim, tada se izraz može modificirati:
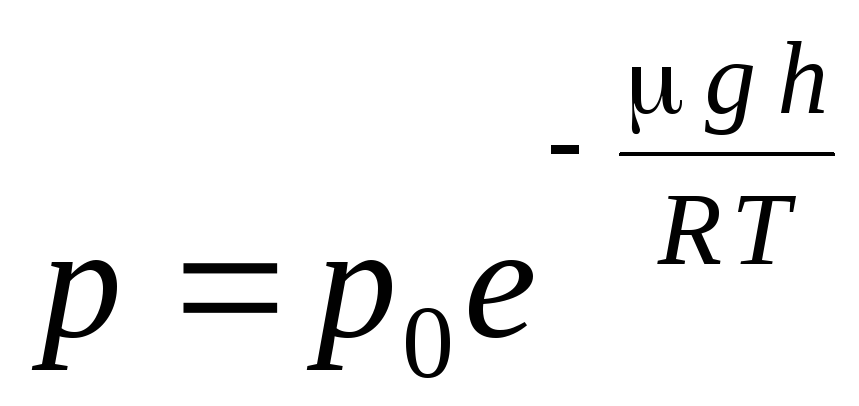 .
.
Barometarska formula može se pretvoriti pomoću izraza p = nkT:
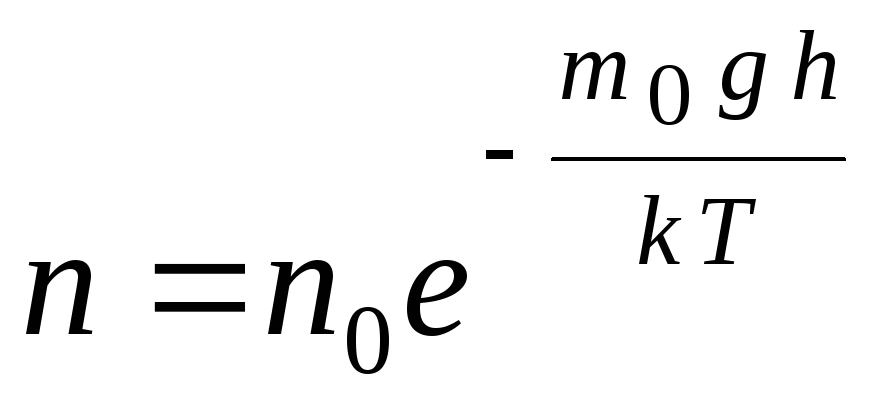 ,
,
G  de n
–
koncentracija molekula na visini h,
m 0
gh=P–
potencijalna energija molekule u gravitacijskom polju. Pri konstantnoj temperaturi gustoća plina je veća tamo gdje je potencijalna energija molekule manja. Grafički, zakon smanjenja broja čestica po jedinici volumena s visinom izgleda kao što je prikazano na sl. 1.7.
de n
–
koncentracija molekula na visini h,
m 0
gh=P–
potencijalna energija molekule u gravitacijskom polju. Pri konstantnoj temperaturi gustoća plina je veća tamo gdje je potencijalna energija molekule manja. Grafički, zakon smanjenja broja čestica po jedinici volumena s visinom izgleda kao što je prikazano na sl. 1.7.
Za proizvoljno vanjsko potencijalno polje pišemo sljedeći opći izraz
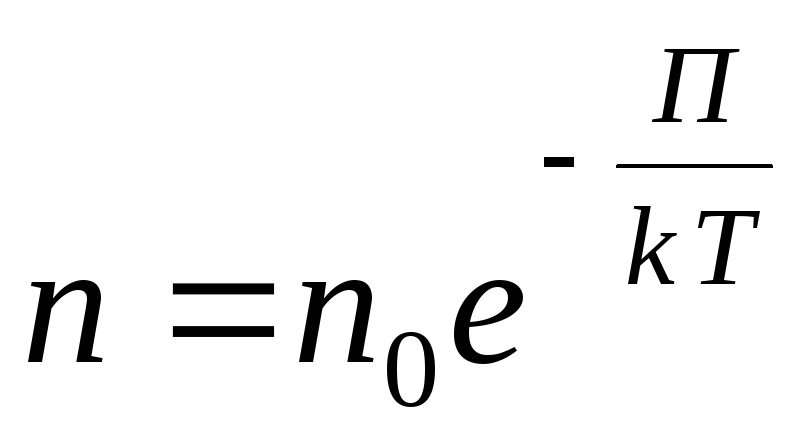 ,
,
