مقدار گرما در سیستم SI اندازه گیری می شود. روش ها و وسایل اندازه گیری مقدار گرما
حرارت- انرژی منتقل شده از یک جسم گرمتر به جسم کمتر گرمتر از طریق تماس مستقیم یا تابش.
دما معیاری برای سنجش شدت حرکت مولکولی است.
مقدار گرمای یک جسم در دمای معین به جرم آن بستگی دارد. به عنوان مثال، در همان دما، گرمای بیشتری در یک فنجان آب بزرگ نسبت به یک فنجان کوچک ذخیره می شود و در یک سطل آب سرد می تواند بیشتر از یک فنجان آب باشد. آب گرم(البته دمای آب داخل سطل کمتر است).
گرما نقش مهمی در زندگی انسان از جمله در عملکرد بدن او دارد. بخشی از انرژی شیمیایی موجود در غذا به گرما تبدیل می شود و به همین دلیل دمای بدن نزدیک به 37 درجه سانتیگراد حفظ می شود. تعادل حرارتی بدن انسان به دما نیز بستگی دارد. محیطو مردم مجبورند در زمستان انرژی زیادی را صرف گرم کردن اماکن مسکونی و صنعتی و در تابستان سرمایش کنند. بیشتر این انرژی توسط موتورهای حرارتی، مانند نیروگاه های دیگ بخار و توربین های بخار نیروگاه هایی که با سوخت های فسیلی (زغال سنگ، نفت) کار می کنند و برق تولید می کنند، تامین می شود.
تا پایان قرن هجدهم. گرما به عنوان یک ماده مادی در نظر گرفته می شد و معتقد بود که دمای بدن با مقدار آن تعیین می شود<калорической жидкости>، یا<теплорода>. بعدها، بی رامفورد، جی. ژول و سایر فیزیکدانان آن زمان، از طریق آزمایشات و استدلال های هوشمندانه، رد کردند.<калорическую>تئوری، ثابت می کند که گرما بی وزن است و می توان آن را در هر مقداری به سادگی به دلیل حرکت مکانیکی به دست آورد. گرما به خودی خود یک ماده نیست - فقط انرژی حرکت اتم ها یا مولکول های آن است. این درک از گرما است که فیزیک مدرن به آن پایبند است.
در این مقاله به چگونگی ارتباط گرما و دما و نحوه اندازه گیری این کمیت ها خواهیم پرداخت. موضوع بحث ما نیز سؤالات زیر خواهد بود: انتقال گرما از یک قسمت بدن به قسمت دیگر; انتقال حرارت در خلاء (فضایی که حاوی ماده نیست)؛ نقش گرما در دنیای مدرن
گرما و دما
میزان انرژی حرارتی یک ماده را نمی توان با مشاهده حرکت هر یک از مولکول های آن به طور جداگانه تعیین کرد. برعکس، تنها با مطالعه خواص ماکروسکوپی یک ماده، میتوان ویژگیهای حرکت میکروسکوپی بسیاری از مولکولها را در یک دوره زمانی معین بهطور میانگین یافت. دمای یک ماده نشانگر متوسط شدت حرکت مولکولها است که انرژی آن برابر است با انرژی حرارتیمواد
یکی از آشناترین و در عین حال کمدقتترین روشهای تخمین دما، لمس کردن است. با لمس یک شی، با تمرکز بر احساسات خود قضاوت می کنیم که گرم یا سرد است. البته، این احساسات به دمای بدن ما بستگی دارد، که ما را به مفهوم تعادل حرارتی می رساند - یکی از مهمترین موارد در اندازه گیری دما.
تعادل گرمایی
تعادل حرارتی بین اجسام A و B
بدیهی است که اگر دو جسم A و B محکم به یکدیگر فشار داده شوند، پس از لمس آنها پس از مدت زمان کافی متوجه می شویم که دمای آنها یکسان است. در این حالت اجسام A و B با یکدیگر در تعادل حرارتی هستند. با این حال، اجسام، به طور کلی، برای برقراری تعادل حرارتی بین آنها لازم نیست در تماس باشند - کافی است که دمای آنها یکسان باشد. این را می توان با استفاده از جسم سوم C تأیید کرد، ابتدا آن را با جسم A به تعادل حرارتی رساند و سپس دمای اجسام C و B را با هم مقایسه کرد. بدن C در اینجا نقش یک دماسنج را بازی می کند. در یک فرمول دقیق، این اصل را قانون صفر ترمودینامیک می نامند: اگر اجسام A و B با جسم سوم C در تعادل حرارتی باشند، این اجسام نیز با یکدیگر در تعادل حرارتی هستند. این قانون زیربنای تمام روش های اندازه گیری دما است.
اندازه گیری دما

مقیاس های دما

دماسنج ها
دماسنج بر اساس اثرات الکتریکی
اگر میخواهیم آزمایشها و محاسبات دقیقی انجام دهیم، پس درجهبندیهای دما مانند گرم، گرم، سرد، سرد کافی نیست - ما به یک مقیاس درجه حرارت مدرج نیاز داریم. چندین چنین مقیاس وجود دارد و معمولاً نقطه انجماد و جوش آب به عنوان نقطه مرجع در نظر گرفته می شود. چهار مقیاس رایج در شکل نشان داده شده است. مقیاس درجه سانتیگراد که بر اساس آن نقطه انجماد آب برابر با 0 درجه و نقطه جوش 100 درجه است، مقیاس سلسیوس نامیده می شود که به نام A. Celsius، ستاره شناس سوئدی که آن را در سال 1742 توصیف کرد، نامگذاری شده است. اعتقاد بر این است که K. Linnaeus طبیعت شناس سوئدی اولین بار این مقیاس را به کار برد. اکنون مقیاس سلسیوس رایج ترین مقیاس در جهان است. مقیاس دمای فارنهایت، که در آن نقاط انجماد و جوش آب با اعداد بسیار ناراحت کننده 32 و 212 درجه مطابقت دارد، در سال 1724 توسط G. Fahrenheit پیشنهاد شد. مقیاس فارنهایت به طور گسترده در کشورهای انگلیسی زبان استفاده می شود، اما به ندرت در ادبیات علمی استفاده می شود. برای تبدیل دمای سلسیوس (°C) به دمای فارنهایت (°F)، یک فرمول °F = (9/5)°C + 32، و برای ترجمه معکوس - فرمول °C = (5/9) وجود دارد. °F- 32).
هر دو مقیاس - هم فارنهایت و هم درجه سانتیگراد - هنگام انجام آزمایشات در شرایطی که دما به زیر نقطه انجماد آب می رسد و به عنوان یک عدد منفی بیان می شود بسیار ناخوشایند هستند. برای چنین مواردی، مقیاس های دمای مطلق معرفی شدند که مبتنی بر برون یابی به به اصطلاح صفر مطلق هستند - نقطه ای که حرکت مولکولی باید متوقف شود. یکی از آنها مقیاس رنکین و دیگری مقیاس ترمودینامیکی مطلق نامیده می شود. دما بر حسب درجه رانکین (°R) و کلوین (K) اندازه گیری می شود. هر دو مقیاس از صفر مطلق شروع می شوند و نقطه انجماد آب برابر با 491.7 درجه R و 273.16 کلوین است. تعداد درجه و کلوین بین نقطه انجماد و جوش آب در مقیاس سانتیگراد و مقیاس ترمودینامیکی مطلق یکسان و مساوی است تا 100؛ برای مقیاس فارنهایت و رانکین نیز یکسان است، اما برابر با 180 است. درجه سانتیگراد با استفاده از فرمول K \u003d ° C + 273.16 به کلوین تبدیل می شود و درجه فارنهایت با استفاده از فرمول ° R \u003d به درجه رانکین تبدیل می شود. درجه فارنهایت + 459.7.
عملکرد دستگاه های طراحی شده برای اندازه گیری دما بر اساس پدیده های فیزیکی مختلف مرتبط با تغییر در انرژی حرارتی یک ماده است - تغییر در مقاومت الکتریکی، حجم، فشار، ویژگی های تابشی، خواص ترموالکتریک. یکی از ساده ترین و آشناترین ابزارهای اندازه گیری دما دماسنج شیشه ای است که در شکل نشان داده شده است. توپ c در قسمت پایینی دماسنج در محیط قرار می گیرد یا روی جسمی که قرار است دمای آن اندازه گیری شود فشار داده می شود و بسته به اینکه توپ گرما دریافت می کند یا می دهد، منبسط یا منقبض می شود و ستون آن در آن بالا یا پایین می شود. مویرگی اگر دماسنج از قبل کالیبره شده و مجهز به ترازو باشد، می توانید مستقیماً دمای بدن را دریابید.
دستگاه دیگری که عملکرد آن بر اساس انبساط حرارتی است دماسنج های دو فلزی است که در شکل نشان داده شده است. عنصر اصلی آن یک صفحه مارپیچ از دو فلز لحیم شده با ضرایب انبساط حرارتی متفاوت است. هنگامی که گرم می شود، یکی از فلزات بیشتر از دیگری منبسط می شود، مارپیچ فلش را نسبت به مقیاس می پیچد و می چرخاند. چنین دستگاه هایی اغلب برای اندازه گیری دمای هوای داخلی و خارجی استفاده می شوند، اما برای تعیین دمای محلی مناسب نیستند.
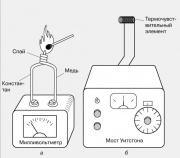
دمای محلی معمولاً با استفاده از یک ترموکوپل اندازه گیری می شود که دو سیم از فلزات غیر مشابه در یک انتها لحیم شده اند. هنگامی که چنین اتصالی گرم می شود، یک EMF در انتهای آزاد سیم ها ایجاد می شود، معمولاً چند میلی ولت. ترموکوپل ها از جفت فلزات مختلفی ساخته می شوند: آهن و کنستانتان، مس و کنستانتان، کرومل و آلومل. Thermo-EMF آنها تقریباً به صورت خطی با دما در یک محدوده دمایی گسترده تغییر می کند.
اثر ترموالکتریک دیگری نیز شناخته شده است - وابستگی مقاومت یک ماده رسانا به دما. زیربنای عملکرد دماسنج های مقاومت الکتریکی است که یکی از آنها در شکل نشان داده شده است. مقاومت یک عنصر کوچک حسگر دما (ترموکوپل) - معمولاً سیم پیچ هایی از سیم نازک - با مقاومت یک مقاومت متغیر کالیبره شده با استفاده از پل وتستون مقایسه می شود. ابزار خروجی را می توان مستقیماً بر حسب درجه درجه بندی کرد.
پیرومترهای نوری برای اندازه گیری دمای اجسام داغی که نور مرئی ساطع می کنند استفاده می شود. در یکی از نسخههای این دستگاه، نور ساطع شده از بدن با تابش رشتهای لامپ رشتهای که در صفحه کانونی دوربین دوچشمی قرار گرفته است، مقایسه میشود. جریان الکتریکی که رشته لامپ را گرم می کند، تغییر می کند تا زمانی که هنگام مقایسه بصری درخشش رشته و بدنه، مشخص شود که تعادل حرارتی بین آنها برقرار شده است. مقیاس دستگاه را می توان به طور مستقیم بر حسب واحد دما درجه بندی کرد.
پیشرفت های فنی سالهای اخیراجازه ایجاد حسگرهای دمایی جدید. به عنوان مثال، در مواردی که حساسیت به ویژه بالا مورد نیاز است، به جای یک ترموکوپل یا یک دماسنج مقاومتی معمولی، از یک دستگاه نیمه هادی - ترمیستور استفاده می شود. رنگ ها و کریستال های مایع که حالت فاز خود را تغییر می دهند نیز به عنوان مبدل حرارتی استفاده می شوند، به ویژه در مواردی که دمای سطح بدن در محدوده وسیعی تغییر می کند. در نهایت از ترموگرافی مادون قرمز استفاده می شود که در آن تصویر مادون قرمز از یک جسم در رنگ های شرطی به دست می آید که در آن هر رنگ با دمای خاصی مطابقت دارد. این روش اندازه گیری دما گسترده ترین کاربرد را پیدا می کند - از تشخیص پزشکیقبل از بررسی عایق حرارتی محل.
اندازه گیری مقدار گرما
کالری سنج آب
انرژی حرارتی (مقدار گرما) یک جسم را می توان مستقیماً با یک کالریمتر اندازه گیری کرد. یک نسخه ساده از چنین دستگاهی در شکل نشان داده شده است. این ظرف بسته ای است که با دقت عایق بندی شده است، مجهز به دستگاه هایی برای اندازه گیری دمای داخل آن است و گاهی اوقات با یک سیال فعال با خواص شناخته شده مانند آب پر می شود. برای اندازه گیری مقدار گرما در یک جسم کوچک گرم شده، آن را در یک کالری متر قرار می دهند و منتظر می مانند تا سیستم به تعادل گرمایی برسد. مقدار گرمای منتقل شده به کالری سنج (به طور دقیق تر به آبی که آن را پر می کند) با افزایش دمای آب تعیین می شود.
مقدار گرمای آزاد شده در طی یک واکنش شیمیایی مانند احتراق را می توان با قرار دادن یک کوچک اندازه گیری کرد<бомбу>. AT<бомбе>یک نمونه قرار دارد که سیم های برق برای احتراق به آن وصل شده است و مقدار اکسیژن مربوطه. پس از سوختن کامل نمونه و برقراری تعادل حرارتی، مشخص میشود که دمای آب در کالریسنج چقدر افزایش یافته است و در نتیجه میزان گرمای آزاد شده نیز افزایش یافته است.
واحدهای حرارتی
گرما نوعی انرژی است و بنابراین باید با واحد انرژی اندازه گیری شود. در سیستم بین المللی SI، واحد انرژی ژول (J) است. همچنین مجاز به استفاده از واحدهای خارج از سیستم مقدار گرما - کالری است: یک کالری بین المللی 4.1868 J، یک کالری ترموشیمیایی 4.1840 J است. در آزمایشگاه های خارجی، نتایج تحقیقات اغلب با استفاده از به اصطلاح بیان می شود. کالری 15 درجه برابر با 4.1855 J. واحد حرارتی خارج از سیستم بریتانیا (BTU) در حال از بین رفتن است: میانگین BTU = 1.055 J.
منابع حرارتی
منابع اصلی گرما واکنش های شیمیایی و هسته ای و همچنین فرآیندهای مختلف تبدیل انرژی هستند. نمونه هایی از واکنش های شیمیایی با آزاد شدن گرما عبارتند از احتراق و تجزیه اجزای غذا. تقریباً تمام گرمای دریافتی زمین از واکنش های هسته ای که در اعماق خورشید رخ می دهد تأمین می شود. بشر یاد گرفته است که چگونه با کمک فرآیندهای کنترل شده شکافت هسته ای گرما را بدست آورد و اکنون سعی دارد از واکنش های همجوشی گرما هسته ای برای همین منظور استفاده کند. انواع دیگر انرژی نیز می توانند به گرما تبدیل شوند، مانند کار مکانیکی و انرژی الکتریکی. مهم است که به یاد داشته باشید که انرژی حرارتی (مانند هر انرژی دیگر) فقط می تواند به شکل دیگری تبدیل شود، اما نمی توان به دست آورد.<из ничего>، و نه تخریب. این یکی از اصول اولیه علمی به نام ترمودینامیک است.
ترمودینامیک
ترمودینامیکعلم ارتباط بین گرما، کار و ماده است. ایده های مدرن در مورد این روابط بر اساس آثار دانشمندان بزرگ گذشته مانند کارنو، کلازیوس، گیبس، ژول، کلوین و دیگران شکل گرفت.ترمودینامیک معنای ظرفیت گرمایی و هدایت حرارتی یک ماده را توضیح می دهد. انبساط حرارتی اجسام و گرمای انتقال فاز. این علم بر اساس چندین قانون - اصول تثبیت شده تجربی است.
گرما و خواص مواد
مواد مختلفتوانایی متفاوتی برای انباشت انرژی حرارتی دارند. این به ساختار مولکولی و چگالی آنها بستگی دارد. مقدار گرمای لازم برای افزایش دمای یک واحد جرم یک ماده را ظرفیت گرمایی ویژه آن می گویند. ظرفیت گرمایی بستگی به شرایطی دارد که ماده در آن قرار دارد. به عنوان مثال، برای گرم کردن یک گرم هوا در یک بالون به میزان 1 K، به حرارت بیشتری نسبت به گرم کردن آن در یک ظرف مهر و موم شده با دیواره های سفت و سخت نیاز است، زیرا بخشی از انرژی که به بالون منتقل می شود صرف انبساط می شود. هوا، و نه در حرارت دادن آن. بنابراین، به طور خاص، ظرفیت گرمایی گازها به طور جداگانه در فشار ثابت و در حجم ثابت اندازه گیری می شود.
با افزایش دما، شدت حرکت هرج و مرج مولکول ها افزایش می یابد - بیشتر مواد هنگام گرم شدن منبسط می شوند. درجه انبساط یک ماده با افزایش 1 K دما را می گویند ضریب انبساط حرارتی.
برای اینکه یک ماده از حالت فازی به حالت دیگر مثلاً از جامد به مایع (و گاهی بلافاصله به گاز) عبور کند، باید مقدار معینی گرما دریافت کند. اگر گرم شود جامد، سپس دمای آن افزایش می یابد تا زمانی که شروع به ذوب شدن کند. تا زمانی که ذوب کامل نشود، دمای بدن با وجود گرمای ورودی ثابت می ماند. مقدار گرمای لازم برای ذوب یک واحد جرم یک ماده را گرمای همجوشی می گویند. اگر به تامین گرما ادامه دهید، ماده مذاب تا نقطه جوش گرم می شود. مقدار گرمای مورد نیاز برای تبخیر یک واحد جرم مایع در یک دمای معین، گرمای تبخیر نامیده می شود.
نقش گرما و کاربرد آن
طرح بهره برداری از نیروگاه توربین بخار
نمودار چرخه تبرید
فرآیندهای انتقال حرارت جهانی به گرم کردن زمین توسط تابش خورشیدی کاهش نمی یابد. جریانهای جابجایی عظیم در جو تغییرات روزانه شرایط آب و هوایی در سراسر کره زمین را تعیین می کند. اختلاف دما در جو بین مناطق استوایی و قطبی، همراه با نیروهای کوریولیس به دلیل چرخش زمین، منجر به ظهور جریان های همرفتی دائماً در حال تغییر، مانند بادهای تجاری، جریان های جت و جبهه های گرم و سرد می شود.
انتقال گرما (به دلیل هدایت حرارتی) از هسته مذاب زمین به سطح آن منجر به فوران های آتشفشانی و ظهور آبفشان ها می شود. در برخی مناطق از انرژی زمین گرمایی برای گرمایش فضا و تولید برق استفاده می شود.
گرما یک شرکت کننده ضروری تقریباً در همه موارد است فرآیندهای تولید. ما به مهمترین آنها مانند ذوب و فرآوری فلزات، بهره برداری از موتورها، تولید مواد غذایی، سنتز شیمیایی، تصفیه روغن، ساخت انواع اقلام - از آجر و ظروف گرفته تا ماشین و وسایل الکترونیکی اشاره خواهیم کرد.
بسیاری از تولیدات صنعتی و حمل و نقل و همچنین نیروگاه های حرارتی نمی توانند بدون موتورهای حرارتی کار کنند - دستگاه هایی که گرما را به کار مفید تبدیل می کنند. نمونه هایی از این ماشین ها کمپرسورها، توربین ها، بخار، بنزینی و موتورهای جت هستند.
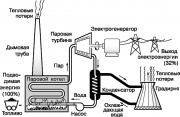
یکی از شناخته شده ترین موتورهای حرارتی، توربین بخار است که بخشی از چرخه رانکین مورد استفاده در نیروگاه های مدرن را اجرا می کند. نمودار ساده شده این چرخه در شکل نشان داده شده است. سیال عامل - آب - در یک دیگ بخار گرم شده با سوزاندن سوخت های فسیلی (زغال سنگ، نفت یا گاز طبیعی) به بخار فوق گرم تبدیل می شود. بخار زیاد
Gasovik - تجهیزات گاز صنعتی فهرست GOST، SNiP، PB واحدهای مقادیر فیزیکی، مفاهیم فیزیکی و شیمیایی، نسبت ها، ترکیب و ویژگی های گازها
واحدهای اندازه گیری دما و مقدار گرما
واحد اصلی اندازه گیری دما درجه مقیاس بین المللی دما بود که عملاً با درجه سانتیگراد مطابقت دارد. این مقدار برابر است با 1/100 فاصله دمایی بین 0 تا 100 درجه سانتیگراد، یعنی بین نقطه ذوب یخ و آب در حال جوش در فشار 760 میلی متر جیوه. هنر
دمای مطلق دمایی است که از صفر مطلق، یعنی از 273.16- درجه سانتی گراد اندازه گیری می شود و بر حسب درجه کلوین (درجه کلوین) اندازه گیری می شود. درجه کلوین همان درجه سانتیگراد است. بنابراین دمای مطلق بر حسب درجه سانتیگراد به صورت زیر بیان می شود:
T، °K = t، °C + 273.16
در سیستم SI واحد دما کلوین است. بیان نتایج عملی اندازه گیری دما با استفاده از درجه سانتیگراد به همراه درجه کلوین بسته به مبدا (موقعیت صفر) در مقیاس مجاز است.
مثال: 250 ± 5 ° C = 523.16 ± 5 ° K.
در سیستم SI، کار، انرژی و گرما با ژول (J) اندازه گیری می شود. گاهی اوقات از یک واحد بزرگتر و راحت تر برای اهداف عملی استفاده می شود - یک کیلوژول (کیلوژول)، برابر با 1000 ژول. کمیت فیزیکینشان می دهد که بدن چقدر کار می تواند انجام دهد.
کالری و کیلوکالری را می توان به عنوان واحد حرارتی خارج از سیستم استفاده کرد. کالری مقدار حرارت مورد نیاز برای افزایش دمای 1 گرم آب به میزان 1 درجه سانتیگراد (19.5 تا 20.5 درجه سانتیگراد) است.
1 کالری (کالری) = 4.1868 J;
1 کیلو کالری (کیلو کالری) \u003d 1000 کالری \u003d 4186.8 ژول \u003d 4.187 کیلوژول؛
1 Mcal (مگا کالری) \u003d 10 6 کالری \u003d 4.1868 MJ.
1 Gcal (گیگا کالری) \u003d 10 9 کالری \u003d 4186.8 MJ.
برای مقایسه، هنگام ارزیابی سوخت، از گرمای به اصطلاح شرطی استفاده می شود که ارزش حرارتی آن برای محاسبه به طور مشروط برابر با 7 Mcal/kg یا 7 Gcal/t در نظر گرفته می شود. در چنین مواردی، فرد به ترتیب از 1 کیلوگرم یا 1 تن سوخت استاندارد (t.c.f.) صحبت می کند.
گرما نقش مهمی در زندگی انسان از جمله در عملکرد بدن او دارد. بخشی از انرژی شیمیایی موجود در غذا به گرما تبدیل می شود و در نتیجه دمای بدن نزدیک به 37 حفظ می شود.
° ج- تعادل حرارتی بدن انسان به دمای محیط نیز بستگی دارد و افراد مجبورند انرژی زیادی را صرف گرم کردن اماکن مسکونی و صنعتی در زمستان و خنک کردن آنها در تابستان کنند. بیشتر این انرژی توسط موتورهای حرارتی، مانند نیروگاه های دیگ بخار و توربین های بخار نیروگاه هایی که با سوخت های فسیلی (زغال سنگ، نفت) کار می کنند و برق تولید می کنند، تامین می شود.تا پایان قرن هجدهم. گرما به عنوان یک ماده مادی در نظر گرفته می شد و معتقد بود که دمای بدن با مقدار "مایع کالری" یا "کالری" موجود در آن تعیین می شود. بعدها، B. Rumford، J. Joule و دیگر فیزیکدانان آن زمان، با آزمایشات و استدلال های هوشمندانه، نظریه "کالری" را رد کردند و ثابت کردند که گرما بی وزن است و می توان آن را در هر مقداری صرفاً به دلیل حرکت مکانیکی به دست آورد. گرما خود یک ماده نیست، فقط انرژی حرکت اتم ها یا مولکول های آن است. این درک از گرما است که فیزیک مدرن به آن پایبند است. همچنین ببینیدفیزیک.
در این مقاله به چگونگی ارتباط گرما و دما و نحوه اندازه گیری این کمیت ها خواهیم پرداخت. موضوع بحث ما نیز سؤالات زیر خواهد بود: انتقال گرما از یک قسمت بدن به قسمت دیگر; انتقال حرارت در خلاء (فضایی که حاوی ماده نیست)؛ نقش گرما در دنیای مدرن
گرما و دما میزان انرژی حرارتی یک ماده را نمی توان با مشاهده حرکت هر یک از مولکول های آن به طور جداگانه تعیین کرد. برعکس، تنها با مطالعه خواص ماکروسکوپی ماده، میتوان ویژگیهای حرکت میکروسکوپی بسیاری از مولکولها را در یک دوره زمانی معین بهطور میانگین یافت. دمای یک ماده نشانگر متوسط شدت حرکت مولکول ها است که انرژی آن انرژی حرارتی یک ماده است.یکی از آشناترین و در عین حال کمدقتترین راهها برای ارزیابی دما با لمس. با لمس یک شی، با تمرکز بر احساسات خود قضاوت می کنیم که گرم یا سرد است. البته این احساسات به دمای بدن ما بستگی دارد که ما را به مفهوم تعادل حرارتی می رساند که یکی از مهمترین موارد در اندازه گیری دما است.
تعادل حرارتی. بدیهی است که اگر دو بدن A و ب (شکل 1) محکم روی یکدیگر فشار داده می شوند، سپس با لمس آنها پس از مدت زمان کافی متوجه می شویم که دمای آنها یکسان است. در این صورت اجساد گفته می شود A و ب با یکدیگر در تعادل حرارتی هستند. با این حال، اجسام، به طور کلی، برای برقراری تعادل حرارتی بین آنها لازم نیست در تماس باشند، کافی است که دمای آنها یکسان باشد. این را می توان با استفاده از بدن سوم تأیید کرد سی ، ابتدا آن را با بدن به تعادل حرارتی می رساند آ و سپس دمای بدن را با هم مقایسه کنید سی و ب بدن سی در اینجا نقش یک دماسنج را بازی می کند. در یک فرمول دقیق، این اصل را قانون صفر ترمودینامیک می نامند: اگر اجسام A و B با جسم سوم C در تعادل حرارتی باشند، این اجسام نیز با یکدیگر در تعادل حرارتی هستند.این قانون زیربنای تمام روش های اندازه گیری دما است.اندازه گیری دما. اگر میخواهیم آزمایشها و محاسبات دقیقی انجام دهیم، درجهبندیهای دما مانند گرم، گرم، سرد، سرد کافی نیست، ما به مقیاس درجهبندی درجه حرارت نیاز داریم. چندین چنین مقیاس وجود دارد و معمولاً نقطه انجماد و جوش آب به عنوان نقطه مرجع در نظر گرفته می شود. چهار مقیاس رایج در شکل نشان داده شده است. 2. مقیاس درجه سانتیگراد که بر اساس آن نقطه انجماد آب برابر با 0 است° و نقطه جوش 100 است° ، مقیاس سلسیوس نامیده می شود که به نام A. Celsius، ستاره شناس سوئدی که آن را در سال 1742 توصیف کرد، نامگذاری شده است. اعتقاد بر این است که K. Linney طبیعت شناس سوئدی اولین کسی بود که از این مقیاس استفاده کرد. اکنون مقیاس سلسیوس رایج ترین مقیاس در جهان است. مقیاس دمای فارنهایت، که در آن نقطه انجماد و جوش آب با اعداد بسیار ناراحت کننده 32 و 212 مطابقت دارد.° ، در سال 1724 توسط G. Fahrenheit پیشنهاد شد. مقیاس فارنهایت به طور گسترده در کشورهای انگلیسی زبان استفاده می شود، اما به ندرت در ادبیات علمی استفاده می شود. برای تبدیل دما به سانتیگراد (° C) تا دمای فارنهایت (° و) یک فرمول وجود دارد° F = (9/5) ° C + 32 و برای فرمول ترجمه معکوس°C = (5/9) (°F - 32). هر دو مقیاس، هم فارنهایت و هم درجه سانتیگراد، هنگام انجام آزمایش در شرایطی که دما به زیر نقطه انجماد آب میرسد و به صورت یک عدد منفی بیان میشود، بسیار ناخوشایند هستند. برای چنین مواردی، مقیاسهای دمای مطلق معرفی شدهاند که بر اساس برونیابی به صفر مطلق، نقطهای که حرکت مولکولی باید در آن متوقف شود، است. یکی از آنها مقیاس رنکین و دیگری مقیاس ترمودینامیکی مطلق نامیده می شود. دما بر حسب درجه رانکین اندازه گیری می شود (° R) و کلوین (K). هر دو مقیاس از صفر مطلق شروع می شوند و نقطه انجماد آب 491.7 است° R و 273.16 K. تعداد درجه و کلوین بین نقاط انجماد و جوش آب در مقیاس سلسیوس و مقیاس ترمودینامیکی مطلق یکسان و برابر با 100 است. برای مقیاس فارنهایت و رانکین نیز یکسان است، اما برابر با 180 است. درجه سانتیگراد با استفاده از فرمول K \u003d به کلوین تبدیل می شود.° C + 273.16 و درجه فارنهایت تا درجه رانکین با استفاده از فرمول°R = °F + 459.7. عملکرد دستگاههایی که برای اندازهگیری دما طراحی شدهاند، بر اساس پدیدههای فیزیکی مختلف مرتبط با تغییر در انرژی حرارتی یک ماده، تغییر در مقاومت الکتریکی، حجم، فشار، ویژگیهای تابشی و خواص ترموالکتریکی است. یکی از ساده ترین و آشناترین ابزار برای اندازه گیری دما دماسنج جیوه ای در شیشه است که در شکل. 3, آ. توپ با جیوه در قسمت پایین دماسنج در محیط قرار می گیرد یا بر روی جسمی که می خواهند دمای آن را اندازه گیری کنند فشار داده می شود و بسته به اینکه توپ گرما دریافت کند یا منتشر کند، جیوه منبسط یا منقبض می شود و ستون آن بالا می رود یا در مویرگ می افتد. اگر دماسنج از قبل کالیبره شده و مجهز به ترازو باشد، می توانید مستقیماً دمای بدن را دریابید.دستگاه دیگری که عملکرد آن بر اساس انبساط حرارتی است، دماسنج دو فلزی است که در شکل.
3, ب عنصر اصلی آن صفحه مارپیچ از دو فلز لحیم کاری شده با ضرایب انبساط حرارتی متفاوت. هنگامی که گرم می شود، یکی از فلزات بیشتر از دیگری منبسط می شود، مارپیچ فلش را نسبت به مقیاس می پیچد و می چرخاند. چنین دستگاه هایی اغلب برای اندازه گیری دمای هوای داخلی و خارجی استفاده می شوند، اما برای تعیین دمای محلی مناسب نیستند.دمای محلی معمولاً با استفاده از یک ترموکوپل اندازه گیری می شود که دو سیم از فلزات نامشابه است که در یک انتها لحیم شده اند (شکل 1).
4, آ). هنگامی که چنین اتصالی گرم می شود، یک emf در انتهای آزاد سیم ها ایجاد می شود، معمولاً چند میلی ولت. ترموکوپل ها از جفت فلزات مختلفی ساخته می شوند: آهن و کنستانتان، مس و کنستانتان، کرومل و آلومل. Thermo-EMF آنها تقریباً به صورت خطی با دما در یک محدوده دمایی گسترده تغییر می کند.اثر ترموالکتریک دیگری نیز شناخته شده است - وابستگی مقاومت یک ماده رسانا به دما. زیربنای عملکرد دماسنج های مقاومت الکتریکی است که یکی از آنها در شکل نشان داده شده است.
4, ب مقاومت یک عنصر حساس به دما کوچک (حسگر حرارتی) معمولا سیم پیچ های سیم نازک با مقاومت یک مقاومت متغیر کالیبره شده با استفاده از پل ویت استون مقایسه می شود. ابزار خروجی را می توان مستقیماً بر حسب درجه درجه بندی کرد.پیرومترهای نوری برای اندازه گیری دمای اجسام رشته ای که نور مرئی ساطع می کنند استفاده می شود. در یکی از نسخههای این دستگاه، نور ساطع شده از بدن با تابش رشتهای لامپ رشتهای که در صفحه کانونی دوربین دوچشمی قرار گرفته است، مقایسه میشود. جریان الکتریکی که رشته لامپ را گرم می کند تغییر می کند تا زمانی که مقایسه بصری درخشندگی رشته و بدنه نشان دهد که تعادل حرارتی بین آنها برقرار شده است. مقیاس دستگاه را می توان به طور مستقیم بر حسب واحد دما درجه بندی کرد.
پیشرفت های فنی در سال های اخیر امکان ایجاد حسگرهای دمایی جدید را فراهم کرده است. به عنوان مثال، در مواردی که به حساسیت بالایی نیاز است، به جای ترموکوپل یا دماسنج مقاومتی معمولی، از یک دستگاه نیمه هادی، ترمیستور استفاده می شود. رنگ ها و کریستال های مایع که حالت فاز خود را تغییر می دهند نیز به عنوان مبدل حرارتی استفاده می شوند، به ویژه در مواردی که دمای سطح بدن در محدوده وسیعی تغییر می کند. در نهایت از ترموگرافی مادون قرمز استفاده می شود که در آن تصویر مادون قرمز از یک جسم در رنگ های شرطی به دست می آید که در آن هر رنگ با دمای خاصی مطابقت دارد. این روش اندازه گیری دما گسترده ترین کاربرد را از تشخیص پزشکی تا بررسی عایق حرارتی اتاق ها پیدا می کند. همچنین ببینیدفیزیک حالت جامد. کریستال مایع.
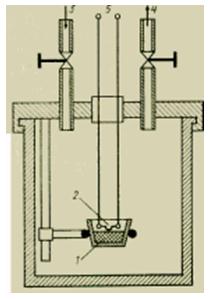
اندازه گیری مقدار گرما. انرژی حرارتی (مقدار گرما) یک جسم را می توان مستقیماً با یک کالریمتر اندازه گیری کرد. یک نسخه ساده از چنین دستگاهی در شکل نشان داده شده است. 5. این ظرف بسته ای است که با دقت عایق بندی شده است، مجهز به دستگاه هایی برای اندازه گیری دمای داخل آن است و گاهی اوقات با یک سیال فعال با خواص شناخته شده مانند آب پر می شود. برای اندازه گیری مقدار گرما در یک جسم کوچک گرم شده، آن را در یک کالری متر قرار می دهند و منتظر می مانند تا سیستم به تعادل گرمایی برسد. مقدار گرمای منتقل شده به کالری سنج (به طور دقیق تر به آبی که آن را پر می کند) با افزایش دمای آب تعیین می شود.میزان گرمای آزاد شده در طی یک واکنش شیمیایی مانند احتراق را می توان با قرار دادن یک "بمب" کوچک در کالری سنج اندازه گیری کرد. "بمب" حاوی نمونه ای است که سیم های الکتریکی برای احتراق به آن وصل شده و مقدار مربوط به آن اکسیژن است. پس از سوختن کامل نمونه و برقراری تعادل حرارتی، مشخص میشود که دمای آب در کالریسنج چقدر افزایش یافته است و در نتیجه میزان گرمای آزاد شده را تعیین میکند. همچنین ببینیدکالریمتری.
واحدهای حرارتی گرما نوعی انرژی است و بنابراین باید با واحد انرژی اندازه گیری شود. در سیستم بین المللی SI، واحد انرژی ژول (J) است. همچنین مجاز به استفاده از واحدهای غیر سیستمی مقدار کالری گرما است: یک کالری بین المللی 4.1868 J، یک کالری ترموشیمیایی 4.1840 J است. در آزمایشگاه های خارجی، نتایج تحقیقات اغلب با استفاده از به اصطلاح بیان می شود. کالری 15 درجه برابر با 4.1855 J. واحد حرارتی خارج از سیستم بریتانیا (BTU) در حال از بین رفتن است: میانگین BTU = 1.055 J. منابع اصلی گرما واکنش های شیمیایی و هسته ای و همچنین فرآیندهای مختلف تبدیل انرژی هستند. نمونه هایی از واکنش های شیمیایی با آزاد شدن گرما عبارتند از احتراق و تجزیه اجزای غذا. تقریباً تمام گرمای دریافتی زمین از واکنش های هسته ای که در اعماق خورشید رخ می دهد تأمین می شود. بشر یاد گرفته است که چگونه با کمک فرآیندهای کنترل شده شکافت هسته ای گرما را بدست آورد و اکنون سعی دارد از واکنش های همجوشی گرما هسته ای برای همین منظور استفاده کند. انواع دیگر انرژی نیز می توانند به گرما تبدیل شوند، مانند کار مکانیکی و انرژی الکتریکی. مهم است که به یاد داشته باشید که انرژی حرارتی (مانند هر انرژی دیگر) فقط می تواند به شکل دیگری تبدیل شود، اما نه می توان آن را "از هیچ" به دست آورد و نه از بین برد. این یکی از اصول اولیه علمی به نام ترمودینامیک است. ترمودینامیکس ترمودینامیک علم ارتباط بین گرما، کار و ماده است. ایده های مدرن در مورد این روابط بر اساس آثار دانشمندان بزرگ گذشته مانند کارنو، کلازیوس، گیبس، ژول، کلوین و دیگران شکل گرفت.ترمودینامیک معنای ظرفیت گرمایی و هدایت حرارتی یک ماده را توضیح می دهد. انبساط حرارتی اجسام و گرمای انتقال فاز. این علم بر اساس چندین اصل قانون تثبیت شده است.آغاز ترمودینامیک. قانون صفر ترمودینامیک فرموله شده در بالا مفاهیم تعادل حرارتی، دما و دماسنجی را معرفی می کند. قانون اول ترمودینامیک بیانیه ای از اهمیت کلیدی برای کل علم است: انرژی نه می تواند نابود شود و نه می توان "از هیچ" به دست آورد، بنابراین انرژی کل جهان یک مقدار ثابت است. در ساده ترین شکل، قانون اول ترمودینامیک را می توان به صورت زیر بیان کرد: انرژی که سیستم دریافت می کند، منهای انرژی ای که می دهد، برابر با انرژی باقی مانده در سیستم است. در نگاه اول، این جمله بدیهی به نظر می رسد، اما برای مثال در چنین چیزی نیست, شرایطی مانند احتراق بنزین در سیلندرهای موتور خودرو: در اینجا انرژی دریافتی شیمیایی است، انرژی منتشر شده مکانیکی (کار) و انرژی باقی مانده در سیستم حرارتی است.بنابراین، واضح است که انرژی می تواند از شکلی به شکل دیگر تغییر کند و چنین دگرگونی هایی دائماً در طبیعت و فناوری رخ می دهد. بیش از صد سال پیش، J. Joule این را برای مورد تبدیل انرژی مکانیکی به انرژی حرارتی با استفاده از دستگاه نشان داده شده در شکل ثابت کرد. 6، آ. در این دستگاه وزنه های نزولی و بالارونده یک شفت با تیغه ها را در یک کالری متر پر از آب می چرخاند که در نتیجه آب گرم می شود. اندازه گیری های دقیق به ژول اجازه داد تا تعیین کند که یک کالری گرما معادل 4.186 ژول کار مکانیکی است. دستگاه نشان داده شده در شکل.
6, b، برای تعیین معادل حرارتی انرژی الکتریکی استفاده شد.قانون اول ترمودینامیک بسیاری از پدیده های رایج را توضیح می دهد. به عنوان مثال، مشخص می شود که چرا نمی توان آشپزخانه را با یخچال اوپن خنک کرد. بیایید فرض کنیم که آشپزخانه را از محیط عایق حرارتی کرده ایم. انرژی به طور مداوم از طریق سیم برق یخچال به سیستم تامین می شود، اما سیستم هیچ انرژی نمی دهد. بنابراین، کل انرژی آن افزایش می یابد و آشپزخانه گرمتر می شود: کافی است لوله های مبدل حرارتی (کندانسور) را در پشت یخچال لمس کنید و بی فایده بودن آن را به عنوان یک وسیله "خنک کننده" درک خواهید کرد. اما اگر این لولهها از سیستم خارج میشدند (مثلاً از پنجره)، آشپزخانه بیش از آنچه دریافت میکرد انرژی میداد، یعنی. خنک می شد و یخچال به عنوان تهویه مطبوع پنجره ای کار می کرد.
قانون اول ترمودینامیک یک قانون طبیعت است که از ایجاد یا نابودی انرژی جلوگیری می کند. با این حال، در مورد چگونگی انجام فرآیندهای انتقال انرژی در طبیعت چیزی نمی گوید. بنابراین، می دانیم که اگر این اجسام در تماس باشند، یک جسم گرم، یک جسم سرد را گرم می کند. اما آیا جسم سرد به خودی خود می تواند ذخیره گرمایی خود را به جسم گرم منتقل کند؟ آخرین فرصتبه طور قطع توسط قانون دوم ترمودینامیک رد شده است.
قانون اول همچنین امکان ایجاد موتور با ضریب را منتفی می کند اقدام مفید(بازده) بیش از 100٪ (مشابه
" ابدی " موتور می تواند انرژی بیشتری را برای مدت زمان طولانی بیش از آنچه مصرف می کند تولید کند). ساخت موتور حتی با راندمان 100٪ غیرممکن است، زیرا بخشی از انرژی عرضه شده به آن باید لزوماً توسط آن به شکل انرژی حرارتی کمتر مفید از بین برود. بنابراین چرخ بدون تامین انرژی به طور نامحدود نمی چرخد، زیرا در اثر اصطکاک در یاتاقان ها، انرژی حرکت مکانیکی به تدریج تبدیل به گرما می شود تا زمانی که چرخ متوقف شود.تمایل به تبدیل کار "مفید" به گرمای انرژی کمتر مفید را می توان با فرآیند دیگری مقایسه کرد که زمانی اتفاق می افتد که دو ظرف حاوی گازهای مختلف به هم متصل می شوند. پس از مدت زمان طولانی منتظر ماندن، در هر دو ظرف متوجه میشویم که مخلوط همگنی از گازها، طبیعت به گونهای عمل میکند که نظم سیستم کاهش مییابد. معیار ترمودینامیکی این بی نظمی آنتروپی نامیده می شود و قانون دوم ترمودینامیک را می توان به گونه ای دیگر فرموله کرد: فرآیندها در طبیعت همیشه به گونه ای پیش می روند که آنتروپی سیستم و محیط آن افزایش می یابد. بنابراین، انرژی جهان ثابت می ماند، در حالی که آنتروپی آن به طور مداوم در حال رشد است.
گرما و خواص مواد. مواد مختلف توانایی متفاوتی برای ذخیره انرژی حرارتی دارند. این به ساختار مولکولی و چگالی آنها بستگی دارد. مقدار گرمای لازم برای افزایش دمای یک واحد جرم یک ماده را آن می گویند گرمای ویژه. ظرفیت گرمایی بستگی به شرایطی دارد که ماده در آن قرار دارد. به عنوان مثال، برای گرم کردن یک گرم هوا در یک بالون به میزان 1 K، به حرارت بیشتری نسبت به گرم کردن آن در یک ظرف مهر و موم شده با دیواره های سفت و سخت نیاز است، زیرا بخشی از انرژی که به بالون منتقل می شود صرف انبساط می شود. هوا، و نه در حرارت دادن آن. بنابراین، به طور خاص، ظرفیت گرمایی گازها به طور جداگانه در فشار ثابت و در حجم ثابت اندازه گیری می شود.با افزایش دما، شدت حرکت هرج و مرج مولکولها افزایش مییابد که بیشتر مواد هنگام گرم شدن منبسط میشوند. درجه انبساط یک ماده با افزایش 1 K دما را ضریب انبساط حرارتی می گویند.
برای اینکه یک ماده از حالت فازی به حالت دیگر مثلاً از جامد به مایع (و گاهی بلافاصله به گاز) عبور کند، باید مقدار معینی گرما دریافت کند. اگر جسم جامد گرم شود، دمای آن بالا می رود تا زمانی که شروع به ذوب شدن کند. تا زمانی که ذوب کامل نشود، با وجود تامین گرما، دمای بدن ثابت می ماند. مقدار گرمای لازم برای ذوب یک واحد جرم یک ماده را گرمای همجوشی می گویند. اگر به تامین گرما ادامه دهید، ماده مذاب تا نقطه جوش گرم می شود. مقدار گرمای مورد نیاز برای تبخیر یک واحد جرم مایع در یک دمای معین، گرمای تبخیر نامیده می شود.
نظریه مولکولی جنبشی. تئوری جنبشی مولکولی خواص ماکروسکوپی یک ماده را با در نظر گرفتن رفتار اتم ها و مولکول های سازنده این ماده در سطح میکروسکوپی توضیح می دهد. در این مورد از یک رویکرد آماری استفاده می شود و فرضیاتی در مورد خود ذرات و ماهیت حرکت آنها مطرح می شود. بنابراین، مولکولها توپهای جامدی در نظر گرفته میشوند که در محیطهای گازی در حرکت بینظم پیوسته هستند و از برخوردی به برخورد دیگر فواصل قابل توجهی را طی میکنند. برخوردها الاستیک در نظر گرفته می شوند و بین ذراتی که اندازه آنها کوچک و تعداد آنها بسیار زیاد است رخ می دهد. هیچ یک از گازهای واقعی دقیقاً با این مدل مطابقت ندارند، اما بیشتر گازها کاملاً به آن نزدیک هستند، که دلیل ارزش عملی نظریه جنبشی مولکولی است.بر اساس این ایده ها و با استفاده از یک رویکرد آماری، ماکسول توزیع سرعت مولکول های گاز را در حجم محدودی بدست آورد که بعدها به نام او نامگذاری شد. این توزیع به صورت گرافیکی در شکل نشان داده شده است. 7 برای جرم معینی از هیدروژن در دماهای 100 و 1000
° ج. اردینات تعداد مولکول هایی را نشان می دهد که با سرعت مشخص شده روی آبسیسا حرکت می کنند. تعداد کل ذرات برابر با مساحت زیر هر منحنی است و در هر دو حالت یکسان است. از نمودار می توان دریافت که بیشتر ذرات دارای سرعتی نزدیک به مقدار متوسط هستند و فقط تعداد کمی از آنها دارای سرعت بسیار بالا یا پایین هستند. سرعت متوسط در این دماها در محدوده 2000-3000 متر بر ثانیه است، یعنی. بسیار بزرگتعداد زیادی از این گونه مولکول های گازی که به سرعت در حال حرکت هستند با یک نیروی کاملاً قابل اندازه گیری بر روی اجسام اطراف عمل می کنند. نیروهای میکروسکوپی که با آن مولکولهای گاز متعددی به دیوارههای ظرف برخورد میکنند، مقداری ماکروسکوپی به نام فشار را تشکیل میدهند. هنگامی که انرژی به گاز داده می شود (دما افزایش می یابد)، متوسط انرژی جنبشی مولکول های آن افزایش می یابد، ذرات گاز بیشتر و شدیدتر به دیواره ها برخورد می کنند، فشار افزایش می یابد و اگر دیوارها کاملاً صلب نباشند، کش می شوند و گاز حجم افزایش می یابد. بنابراین، رویکرد آماری میکروسکوپی زیربنای نظریه جنبشی مولکولی، توضیح پدیده انبساط حرارتی را که مورد بحث قرار دادیم ممکن میسازد.
یکی دیگر از نتایج تئوری جنبشی مولکولی، قانونی است که خواص گازی را که الزامات ذکر شده در بالا را برآورده می کند، توصیف می کند. این به اصطلاح معادله حالت است گاز ایده آلفشار، حجم و دمای یک مول گاز را به هم وصل می کند و شکل برابری دارد
PV = RT که در آن پ فشار، حجم V، تی دما، و آر ثابت گاز جهانی برابر با (8.31441 0.00026 ±) J/(mol H به). همچنین ببینیدنظریه مولکولی-سینتیکی;ترمودینامیکس. انتقال حرارت انتقال حرارت فرآیند انتقال گرما در یک جسم یا از جسمی به جسم دیگر به دلیل اختلاف دما است. شدت انتقال حرارت به خواص ماده، اختلاف دما بستگی دارد و از قوانین تجربی تعیین شده طبیعت پیروی می کند. برای ایجاد سیستم های گرمایش یا سرمایش کارآمد، موتورهای مختلف، نیروگاه ها، سیستم های عایق حرارتی، باید اصول انتقال حرارت را بدانید. در برخی موارد، تبادل حرارت نامطلوب است (عایق حرارتی کوره های ذوب، سفینه های فضایی و غیره)، در حالی که در برخی دیگر باید تا حد امکان بزرگ باشد (دیگ بخار، مبدل های حرارتی، ظروف آشپزخانه).سه نوع اصلی انتقال حرارت وجود دارد: رسانایی، همرفتی و انتقال حرارت تابشی.
رسانایی گرمایی. اگر در داخل بدن اختلاف دما وجود داشته باشد، انرژی حرارتی از قسمت گرمتر آن به قسمت سردتر آن منتقل می شود. این نوع انتقال حرارت در اثر حرکات حرارتی و برخورد مولکول ها، هدایت حرارتی نامیده می شود. به اندازه کافی دمای بالادر جامدات می توان آن را به صورت بصری مشاهده کرد. بنابراین، هنگامی که یک میله فولادی از یک طرف در شعله یک مشعل گاز گرم می شود، انرژی حرارتی از طریق میله منتقل می شود و درخششی در فاصله معینی از انتهای گرم شده پخش می شود (با فاصله از محل، شدت آن کمتر و کمتر می شود. گرمایش).شدت انتقال حرارت به دلیل هدایت حرارتی به گرادیان دما بستگی دارد، یعنی. روابط
D T/D ایکس اختلاف دما در انتهای میله به فاصله بین آنها. همچنین به سطح مقطع میله (در متر) بستگی دارد 2 ) و هدایت حرارتی مواد[ در واحدهای مربوطه W/(mچ K)] . رابطه بین این مقادیر توسط ریاضیدان فرانسوی J. Fourier بدست آمده است و به شکل زیر است:جایی که q جریان دما، ک ضریب هدایت حرارتی و آ سطح مقطع این رابطه را قانون هدایت گرما فوریه می نامند. علامت منفی در آن نشان می دهد که گرما در جهت مخالف گرادیان دما منتقل می شود.از قانون فوریه نتیجه می گیرد که جریان گرما را می توان با کاهش یکی از مقادیر ضریب هدایت حرارتی، سطح یا گرادیان دما کاهش داد. برای یک ساختمان در شرایط زمستانی، مقادیر دوم عملاً ثابت است، و بنابراین، برای حفظ دمای مورد نظر در اتاق، باید رسانایی حرارتی دیوارها کاهش یابد، یعنی. عایق حرارتی آنها را بهبود بخشد.
جدول ضرایب هدایت حرارتی برخی از مواد و مواد را نشان می دهد. جدول نشان می دهد که برخی از فلزات بسیار بهتر از سایرین رسانای گرما هستند، اما همه آنها رسانای گرمایی بسیار بهتری نسبت به هوا و مواد متخلخل هستند.
|
رسانایی حرارتی برخی از مواد و مواد |
|
|
مواد و مواد |
هدایت حرارتی، W / (m × K) |
| آلومینیوم | |
| برنز | |
| بیسموت | |
| تنگستن | |
| اهن | |
| طلا | |
| کادمیوم | |
| منیزیم | |
| فلز مس | |
| آرسنیک | |
| نیکل | |
| پلاتین | |
| سیاره تیر | |
| رهبری | |
| فلز روی | |
|
مواد دیگر |
|
| آزبست | |
| بتن | |
| هوا | |
| Eider down (شل) | |
| مهره درختی) | |
| منیزیم (MgO) | |
| خاک اره | |
| لاستیک (اسفنج) | |
| میکا | |
| شیشه | |
| کربن (گرافیت) | |
مقاومت حرارتی و الکتریکی بسیاری از مواد با کاهش دما به زیر دمای هلیوم مایع (1.8 K) به شدت کاهش می یابد. این پدیده که ابررسانایی نامیده می شود، برای بهبود کارایی بسیاری از دستگاه ها، از دستگاه های میکروالکترونیک گرفته تا خطوط برق و آهنرباهای الکتریکی بزرگ، استفاده می شود. همچنین ببینیدابررسانایی
همرفت. همانطور که قبلاً گفتیم، هنگامی که گرما به مایع یا گاز می رسد، شدت حرکت مولکول ها افزایش می یابد و در نتیجه فشار افزایش می یابد. اگر حجم مایع یا گاز محدود نباشد، منبسط می شوند. چگالی موضعی مایع (گاز) کمتر می شود و به دلیل نیروی شناوری (ارشمیدسی)، قسمت گرم شده محیط به سمت بالا حرکت می کند (به همین دلیل است که هوای گرم اتاق از باتری ها به سقف بالا می رود). این پدیده همرفت نامیده می شود. برای اینکه گرمای سیستم گرمایش را بیهوده هدر ندهید، باید از بخاری های مدرن استفاده کنید که گردش هوای اجباری را فراهم می کنند.جریان گرمای همرفتی از بخاری به محیط گرم شده به سرعت اولیه مولکول ها، چگالی، ویسکوزیته، هدایت حرارتی و ظرفیت گرمایی و محیط بستگی دارد. اندازه و شکل بخاری نیز بسیار مهم است. نسبت بین مقادیر متناظر از قانون نیوتن پیروی می کند
q = hA( تی دبلیو- TҐ)، که در آن q جریان گرما (اندازه گیری شده بر حسب وات)، آ مساحت سطح منبع گرما (در متر 2), تی دبلیوو تی دمای منبع و محیط آن (بر حسب کلوین). ضریب انتقال حرارت همرفتی ساعت به خواص محیط، سرعت اولیه مولکول های آن و همچنین به شکل منبع گرما بستگی دارد و در واحد W/(m) اندازه گیری می شود. 2 ساعت به).ارزش
ساعت برای مواردی که هوای اطراف بخاری ساکن است (همرفت آزاد) و زمانی که همان بخاری در جریان هوا است (همرفت اجباری) یکسان نیست. در موارد ساده جریان سیال از طریق لوله یا جریان در اطراف یک سطح صاف، ضریب ساعت را می توان به صورت تئوری محاسبه کرد. با این حال، هنوز نمی توان یک راه حل تحلیلی برای مشکل همرفت برای یک جریان آشفته یک محیط پیدا کرد. آشفتگی یک حرکت پیچیده مایع (گاز) است که در مقیاسی آشفته است که به طور قابل توجهی از حرکات مولکولی فراتر می رود.اگر یک جسم گرم (یا برعکس، سرد) در یک محیط ثابت یا در یک جریان قرار گیرد، جریان های همرفتی و یک لایه مرزی در اطراف آن تشکیل می شود. دما، فشار و سرعت مولکول ها در این لایه نقش مهمی در تعیین ضریب انتقال حرارت همرفتی دارد.
همرفت باید در طراحی مبدل های حرارتی، سیستم های تهویه مطبوع، هواپیماهای پرسرعت و بسیاری از کاربردهای دیگر مورد توجه قرار گیرد. در تمام این سیستمها، رسانش گرما همزمان با همرفت، هم بین جامدات و هم در محیط آنها صورت میگیرد. در دماهای بالاانتقال حرارت تابشی نیز می تواند نقش مهمی ایفا کند.
انتقال حرارت تابشی نوع سوم انتقال حرارت تابشی انتقال حرارت با هدایت گرما و همرفت متفاوت است زیرا در این حالت گرما از طریق خلاء قابل انتقال است. شباهت آن با سایر روش های انتقال حرارت این است که به دلیل اختلاف دما نیز می باشد. تابش حرارتی یکی از انواع آن است تابش الکترومغناطیسی. انواع دیگر امواج رادیویی، اشعه ماوراء بنفش و گاما در غیاب اختلاف دما رخ می دهند.روی انجیر شکل 8 وابستگی انرژی تابش حرارتی (مادون قرمز) را به طول موج نشان می دهد. تابش حرارتی می تواند با انتشار نور مرئی همراه باشد، اما انرژی آن در مقایسه با انرژی تابشی قسمت نامرئی طیف ناچیز است.
شدت انتقال حرارت توسط رسانش گرما و همرفت متناسب با دما است و شار حرارت تابشی متناسب با توان چهارم دما و از قانون استفان بولتزمن تبعیت می کند.
فضاهای مسکونی و اداری اغلب با ساطع کننده های حرارتی الکتریکی کوچک گرم می شوند. درخشش مایل به قرمز مارپیچ آنها تابش حرارتی قابل مشاهده است که نزدیک به لبه قسمت مادون قرمز طیف است. اتاق با گرما گرم می شود که عمدتاً توسط قسمت نامرئی و مادون قرمز تابش منتقل می شود. در دستگاه های دید در شب
^ این دوربین از یک منبع تابش حرارتی و یک گیرنده حساس به IR استفاده می کند که به شما امکان می دهد در تاریکی ببینید.خورشید یک ساطع کننده قدرتمند انرژی حرارتی است. حتی در فاصله 150 میلیون کیلومتری زمین را گرم می کند. شدت تابش خورشید که سال به سال توسط ایستگاه های واقع در بسیاری از نقاط کره زمین ثبت می شود، تقریباً 1.37 وات است.
/ متر 2 . انرژی خورشیدی منبع حیات در زمین است. جستجوها برای یافتن راه هایی برای استفاده مؤثرتر از آن در حال انجام است. پنل های خورشیدی برای گرم کردن خانه ها و تولید برق برای نیازهای خانگی ساخته شده اند. نقش گرما و استفاده از آن فرآیندهای انتقال حرارت جهانی به گرم کردن زمین توسط تابش خورشیدی کاهش نمی یابد. جریانهای جابجایی عظیم در جو تغییرات روزانه شرایط آب و هوایی در سراسر کره زمین را تعیین می کند. اختلاف دما در جو بین مناطق استوایی و قطبی، همراه با نیروهای کوریولیس به دلیل چرخش زمین، منجر به ظهور جریان های همرفتی دائماً در حال تغییر، مانند بادهای تجاری، جریان های جت و جبهه های گرم و سرد می شود. همچنین ببینیداقلیم؛ هواشناسی و اقلیم شناسی.انتقال گرما (به دلیل هدایت حرارتی) از هسته مذاب زمین به سطح آن منجر به فوران های آتشفشانی و ظهور آبفشان ها می شود. در برخی مناطق از انرژی زمین گرمایی برای گرمایش فضا و تولید برق استفاده می شود.
گرما یک شرکت کننده ضروری تقریباً در تمام فرآیندهای تولید است. در ادامه به مهمترین آنها مانند ذوب و فرآوری فلزات، کارکرد موتورها، تولید محصولات غذایی، سنتز شیمیایی، پالایش روغن، ساخت انواع اشیاء از آجر و ظروف گرفته تا اتومبیل و ... اشاره خواهیم کرد. لوازم برقی.
بسیاری از تولیدات صنعتی و حمل و نقل و همچنین نیروگاه های حرارتی نمی توانند بدون موتورهای حرارتی کار کنند - دستگاه هایی که گرما را به کار مفید تبدیل می کنند. نمونه هایی از این ماشین ها کمپرسورها، توربین ها، بخار، بنزینی و موتورهای جت هستند.
یکی از معروف ترین موتورهای حرارتی، توربین بخار است که بخشی از چرخه رانکین مورد استفاده در نیروگاه های مدرن را اجرا می کند. یک نمودار ساده از این چرخه در شکل نشان داده شده است. 9. آب سیال کار در یک دیگ بخار گرم شده با سوزاندن سوخت های فسیلی (زغال سنگ، نفت یا گاز طبیعی) به بخار فوق گرم تبدیل می شود. بخار فشار بالاشفت یک توربین بخار را می چرخاند که ژنراتوری را به حرکت در می آورد که برق تولید می کند. بخار خروجی هنگام خنک شدن توسط آب جاری متراکم می شود که مقداری از گرمای استفاده نشده در چرخه رانکین را جذب می کند. سپس آب وارد برج خنک کننده (برج خنک کننده) می شود، که از آنجا بخشی از گرما به جو آزاد می شود. میعانات دوباره به دیگ بخار پمپ می شود و کل چرخه تکرار می شود.
تمام فرآیندهای چرخه رانکین اصول ترمودینامیک شرح داده شده در بالا را نشان می دهند. به ویژه طبق قانون دوم، بخشی از انرژی مصرفی نیروگاه باید به صورت گرما در محیط پخش شود. به نظر می رسد که حدود 68 درصد از انرژی موجود در سوخت های فسیلی در این راه از بین می رود. افزایش قابل توجه در راندمان نیروگاه تنها با افزایش دمای دیگ بخار (که توسط مقاومت حرارتی مواد محدود می شود) یا با کاهش دمای محیطی که گرما می رود، حاصل می شود. جو
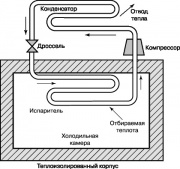
چرخه ترمودینامیکی دیگری که دارد پراهمیتدر ما زندگی روزمره، سیکل تبرید بخار کمپرسور Rankin است که نمودار آن در شکل نشان داده شده است. 10. در یخچال و کولرهای خانگی برای تامین آن انرژی از بیرون تامین می شود. کمپرسور دما و فشار ماده کار فریون یخچال، آمونیاک یا دی اکسید کربن را افزایش می دهد. گاز فوق گرم به کندانسور وارد می شود و در آنجا خنک و متراکم می شود و گرما را به محیط می دهد. مایع خروجی از نازل های کندانسور از طریق دریچه گاز به داخل اواپراتور می رود و بخشی از آن تبخیر می شود که با افت شدید دما همراه است. اواپراتور گرما را از محفظه یخچال می گیرد که سیال کار در نازل ها را گرم می کند. این مایع توسط کمپرسور به کندانسور می رسد و چرخه دوباره تکرار می شود.
چرخه تبرید نشان داده شده در شکل. 10 همچنین می تواند در پمپ حرارتی استفاده شود. چنین پمپ های حرارتی در تابستان به هوای گرم جوی گرما می دهند و اتاق را مطبوع می کنند و در زمستان برعکس از هوای سرد گرما می گیرند و اتاق را گرم می کنند.
واکنشهای هستهای منبع مهم گرما برای اهدافی مانند تولید برق و حمل و نقل هستند. در سال 1905، A. Einstein نشان داد که جرم و انرژی با این رابطه مرتبط هستند
E=mc2 ، یعنی می توانند به یکدیگر منتقل شوند. سرعت نور ج بسیار بزرگ: 300 هزار کیلومتر/ با. این بدان معنی است که حتی مقدار کمی از ماده می تواند مقدار زیادی انرژی را فراهم کند. بنابراین از 1 کیلوگرم ماده شکافت پذیر (مثلا اورانیوم) از نظر تئوری می توان انرژی به دست آورد که برای 1000 روز کار مداوم توسط نیروگاهی با ظرفیت 1 مگاوات تامین می شود. همچنین ببینیدساختار اتم; FURNACES AND FURNACES TECHNOLOGY; تابش الکترومغناطیسی؛مبدل حرارتی؛ توربین; واحدهای اندازه گیری کمیت های فیزیکی.ادبیات زمانسکی ام. درجه حرارت بسیار بالا و بسیار پایین. م.، 1968پل آر. مکانیک، آکوستیک و دکترین گرما. م.، 1971
اسمورودینسکی یا.آ. درجه حرارت. م.، 1981
فن جی. ماشین ها، انرژی و آنتروپی. م.، 1986
اتکینز پی.وی. نظم و بی نظمی در طبیعت.م.، 1987
کالریمترهای مایع
این نوع کالریمتر که بیشترین استفاده را در تکنولوژی دارد، طراحی ساده و نگهداری آسان دارد. مقدار گرمای تولید شده توسط یک واکنش القا شده از خارج ابتدا به ظرف واکنش (که واکنش در آن انجام شد) و سپس به حمام مایع منتقل می شود. مایع موجود در حمام به طور مداوم توسط یک پروانه، یک پیچ بالابر یا پمپ ها به هم زده می شود که باعث افزایش سرعت یکسان شدن دماها می شود. حمام تا حد امکان عایق حرارتی (محافظه) از محیط است. تغییر دمای حمام مایع اندازه گیری مقدار گرمای شناسایی شده است. ظرفیت گرمایی توده هایی که قرار است گرم شوند نباید خیلی زیاد باشد تا از تغییر کافی دما اطمینان حاصل شود و فرآیند اندازه گیری خیلی طول نکشد (به این دلیل تلفات حرارتی افزایش می یابد).
شکل دستگاه گرماسنج مایع.
با الزامات بالا برای ثبات شرایط محیطی، می توان کل کالری سنج را در حمام دیگری قرار داد و با استفاده از یک حلقه کنترل دما را در آن با دقت بالا تثبیت کرد. این در وهله اول در مواردی که نیاز به انجام آزمایش در دماهایی است که به طور قابل توجهی با دمای محیط متفاوت است ضروری است.
برای تجزیه و تحلیل در دماهای پایین (تا حدود -150 درجه سانتیگراد)، از نیتروژن مایع به عنوان یک محیط خنک کننده استفاده می شود. در این مورد، توجه به این نکته ضروری است که هنگام تعویض آنها، یخ زدگی از هوای مرطوب اطراف بر روی نمونه ها یا ظروف نمونه رسوب نمی کند، زیرا لایه آن می تواند بر روند اندازه گیری تأثیر بگذارد. برای جلوگیری از این امر، هنگامی که کالری سنج باز است، نمونه و ظرف نمونه با گاز نیتروژن سرد تصفیه می شوند.
کالریمترهای بدنه فلزی
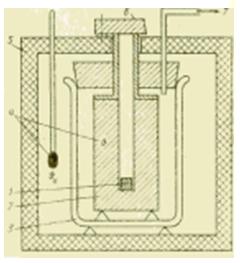
طرح شکل دستگاه گرماسنج فلزی.
اگر نیاز به انجام مطالعات کالریمتری در محدوده دمایی وسیعتری باشد، دیگر کالریسنجهای مایع مناسب نیستند. در کالریمترهای بدنه فلزی مناسب برای این منظور، مقدار حرارت منتقل شده توسط یک بلوک فلزی (نقره، مس، آلومینیوم) که معمولاً در دمای محیط است، جذب می شود. چنین کالری سنج عمدتاً برای تعیین ظرفیت گرمایی ویژه c، J / (kg * K)، مواد مایع و جامد در نظر گرفته شده است.
نمونه ابتدا خارج از کالریمتر در داخل سرد می شود کارخانه سردخانهیا در یک کوره گرم می شود و پس از رسیدن به حالت ثابت، به سوراخی در یک بلوک فلزی فرو می رود (افتاده می شود). با توجه به روش کار، به چنین دستگاهی کالریمتر سقوط آزاد و با توجه به ماهیت فرآیندهای ترمودینامیکی در آن، گاهی اوقات آن را گرماسنج جابجایی می نامند.
مقدار حرارت منتقل شده در طول این اختلاط از نمونه (با پارامترهای m1, c1, ) به بلوک فلزی (m2, c2, ) باعث تغییر قابل اندازه گیری دمای بلوک می شود. این امر تعیین مقدار معمولاً ناشناخته ظرفیت گرمایی ویژه نمونه را ممکن می سازد شرایط ایده آل(در صورت عدم تبادل حرارت با محیط) از عبارت:
خود بلوک فلزی در یک ظرف تخلیه شده Dewar و گاهی اوقات در یک حمام مایع قرار دارد. در حالت دوم، برای به دست آوردن ظرفیت گرمایی کالری سنج Ck، ظرفیت گرمایی حمام Cw باید به ظرفیت گرمایی بلوک فلزی C2 اضافه شود:
CK=C2+CW=c2m2+cWmW.
روش های کالریمتری اندازه گیری
بیشتر اوقات، کالریمترها در حالت شرایط محیطی ثابت استفاده می شوند. این در درجه اول برای اکثر کالریمترهای احتراق صدق می کند، که در آنها زمان واکنش بسیار کوتاه است.در حالی که دمای قسمت های داخلی کالری سنج به دلیل واکنش تغییر می کند، دمای هوای محیط ثابت می ماند.در بسیاری از موارد، یک حمام با دمای کنترل شده است. به عنوان محیط زیست برای جلوگیری از تأثیر بر مقدار اندازه گیری تداخل خارجی - نوسانات دما در اتاق، تابش، پیش نویس ها و غیره استفاده می شود.
مزیت این طرح اندازه گیری هزینه نسبتا پایین تجهیزات است که می توان از آن برای انجام بخش غالب اندازه گیری های کالریمتری استفاده کرد. نقطه ضعف اصلی را باید تبادل حرارت کالری سنج با محیط دانست که تفسیر نتایج را پیچیده می کند. این روش اندازه گیری همیشه ایزوپریبول (دیاترمیک) نامیده می شود. در هر صورت، نمی توان آن را همدما نامید، که ماهیت آن در این واقعیت است که دمای کالری سنج در طول واکنش ثابت می ماند، به عنوان مثال، کالریمترهایی که برای اندازه گیری تبدیل فاز طراحی شده اند.
روش آدیاباتیک
اگر بتوان تبادل حرارت را با محیط حذف کرد، یعنی اطمینان از جریان آدیاباتیک فرآیند، آزمایش و تفسیر نتایج سادهتر میشود و نتیجه اندازهگیری دقیقتر است، زیرا نیازی به ثبت مداوم نیست. تغییر دما و محاسبه اصلاحات علاوه بر این، در این مورد، افزایش تا حدودی بیشتر دما در ظرف کالریسنج قابل تحمل است. برای دستگاه های غیر آدیاباتیک، به دلیل افزایش تلفات حرارتی، این غیر قابل قبول است.
برای جلوگیری از تبادل حرارت بین ظرف کالریسنج و محیط اطراف آن (معمولاً حمام مایع)، دمای حمام باید به طور مداوم مطابق با تغییرات دمای داخل ظرف اصلاح شود. با کمک یک کنترل کننده الکترونیکی (مدار ردیابی) می توان به طور مداوم اختلاف این دماها را عملاً برابر با صفر حفظ کرد. این امر هزینه تجهیزات اندازه گیری را بسته به دقت اندازه گیری مورد نیاز افزایش می دهد.
عناصر سخت افزاری باید برای مدت طولانی سریع و پایدار باشند (حداقل جابجایی داشته باشند). ناحیه مرده حلقه کنترل ردیابی باید در محدوده 3-10± تا 5-10-5 K باشد. به عنوان دستگاه های اندازه گیری، می توان از هر دماسنج برقی با واکنش سریع استفاده کرد که وقتی در مدار پل قرار می گیرد، می تواند یک ضربه به کنترل کننده برای تغییر قدرت گرمایش. گرمایش یا با استفاده از یک سیم پیچ مقاومت الکتریکی یا مستقیماً در یک حمام مایع انجام می شود که به دلیل تفکیک ضعیف (به اصطلاح گرمایش الکترولیتی) به عنوان یک مقاومت گرمایش عمل می کند. این روش دوم عملاً بدون اینرسی است. نتیجه را می توان با استفاده از ابزارهای موجود برای اندازه گیری دمای الکتریکی یا با استفاده از یک دماسنج مایع اضافی نصب شده (Beckmann) به دست آورد.
روش اندازه گیری آدیاباتیک برای مطالعه فرآیندهای عمدتا کند و اثرات حرارتی مناسب است. با تغییرات سریع مقدار گرما (در کالریمترهای احتراق)، اینرسی یکسان سازی دما چنان تأثیر نامطلوبی دارد که حتی دقت روش های غیر آدیاباتیک معمولی نیز به دست نمی آید. با این حال، با ارائه ظرفیت حرارتی کم عناصر گرمایشی و سنسورهای دما و با اختلاط شدید مایع حمام، می توان مقادیر کمی از ثابت های زمانی مختلف را به دست آورد (کاهش اینرسی).
روش جبران خسارت
با استفاده از کالریسنجهای دیفرانسیل یا دوگانه بر اساس اصل جبران، میتوان تا حد زیادی تأثیرات خارجی را بر فرآیند اندازهگیری حذف کرد. دو کشتی کالریمتری یکسان با لوازم جانبی یکسان در یک محیط تحت شرایط یکسان قرار می گیرند. در یک ظرف، فرآیند بررسی شده با اثر حرارتی رخ می دهد و ظرف دیگر با کمک یک سیستم کنترل سروو گرم می شود به گونه ای که اتلاف حرارت به محیط برای هر دو ظرف یکسان باشد. بنابراین، توان گرمایش ورودی را می توان در تناسب مستقیم با مقدار گرمای آزاد شده در طول فرآیند مورد مطالعه قرار داد. در این مورد، کار آزمایشی اندازه گیری به ناحیه دیگری می رود و به تعیین بسیار دقیق توان گرمایش الکتریکی ارائه شده (W * s, J) کاهش می یابد:
کالری سنج دیفرانسیل به ویژه در شرایط محیطی آدیاباتیک استفاده می شود، به ویژه زمانی که تغییرات بسیار کوچک یا بسیار آهسته در مقدار گرما انتظار می رود. در فرآیندهای گرماگیر، داشتن یک ظرف کالریمتری کافی است. گرمای ورودی به گونه ای کنترل می شود که دمای ظرف همیشه ثابت بماند (روش همدما). نقطه ضعف کالریمترهای دیفرانسیل هزینه بالای تجهیزات و ابزار اندازه گیری است.
کالریمترهای احتراق
سوخت مورد استفاده در تاسیسات حرارتی و برق به منظور تعیین ارزش حرارتی آن H (J/kg) مورد بررسی قرار می گیرد. این شاخص برای تعیین فاکتورهای بازده، مطالعه بازده و محاسبه انرژی مصرفی در تاسیسات مختلف و همچنین برای کنترل بهینه فرآیند احتراق مورد نیاز است. نوسانات قابل توجه در ترکیب اجزای قابل احتراق اغلب نیاز به تعیین مداوم ارزش حرارتی دارد.
هنگامی که یک ماده به طور کامل می سوزد، مقدار مشخصی از حرارت Q (گرمای احتراق) آزاد می شود. اگر آن را بر جرم m (یا بر حجم در شرایط عادی Vn) تقسیم کنیم، گرمای (ویژه) احتراق را بدست می آوریم:
بسته به وضعیت محصولات احتراق، دو نوع ارزش حرارتی متمایز می شود: H0 بالاتر و H پایین تر که به آنها گرمای احتراق و ارزش حرارتی نیز می گویند. هنگام تعیین ارزش حرارتی خالص نیکل، آب تشکیل شده است واکنش های شیمیاییباید در حالت بخار باشد. تفاوت بین هر دو گرما H0 - Ni مربوط به گرمای تبخیر آب تغلیظ شده (شاخص KO - میعانات) r است که برابر با 2.441 MJ / kg است.
برای سوخت های جامد و مایع، مقدار آب حاصل را می توان بر اساس آنالیز عنصری و هنگام سوزاندن سوخت های گازی با اندازه گیری میزان میعانات تعیین کرد.
در کوره های صنعتی دمای محصولات احتراق همیشه از نقطه جوش آب بیشتر می شود. بنابراین، تنها ارزش حرارتی خالص Ni معمولا مورد توجه است، زیرا از گرمای تراکم آب نمی توان استفاده کرد.
کالریمتر احتراق برای جامدات و مایعات
برای فرآیندهای احتراق سریع، شکل خاصی از کالریسنج مایع ایجاد شده است - به اصطلاح بمب کالریمتری Berthelot (شکل 3).
شکل دستگاه یک بمب کالریمتری.
احتراق یک مقدار کوچک و دقیقاً اندازهگیری شده از یک ماده در حجم ثابتی در یک بمب مهر و موم شده در فضایی با خالصترین اکسیژن ممکن با فشار 30 اتمسفر (3 مگاپاسکال) اتفاق میافتد. بمب پر شده در حمام مایع کالری سنج قرار می گیرد که گرمای آزاد شده حاصل از احتراق را جذب می کند.
مواد جامدمعمولاً به شکل بریکت های کوچک (قرص) فشرده می شود و بسیار دقیق وزن می شود. توصیه می شود که مواد بد سوزش را با مایعات خوب سوز با حرارت شناخته شده احتراق مخلوط کنید (مثلاً اسید بنزوئیک). مواد مایع را در فنجان (قایق) ساخته شده از پلاتین یا کوارتز یا در کپسول های پلاستیکی کوچک قرار می دهند. روی جلد، که به بدنه بمب پیچ شده است، تمام وسایل لازم برای تحقیق وجود دارد: دریچه هایی برای تامین اکسیژن و حذف محصولات احتراق، نگهدارنده های نمونه و یک جرقه زن الکتریکی. احتراق با تامین برق به یک سیم پلاتین نازک انجام می شود. گرمای ارائه شده برای احتراق باید به طور دقیق اندازه گیری شود تا بتوان آن را در هنگام رمزگشایی نتایج آزمایش در نظر گرفت. در یک بمب کالریمتری، بالاترین ارزش حرارتی H0 تعیین می شود. در طول تأیید، معادل حرارتی کالریسنج Ck با سوزاندن یک ماده مرجع (به عنوان مثال، اسید بنزوئیک) یا با استفاده از یک دستگاه گرمایش الکتریکی تعیین میشود.
کالری سنج احتراق برای مواد گازی
برای تعیین گرمای احتراق محیط های گازی روش های مختلفی وجود دارد. همه آنها، بر خلاف بمب کالریمتری مواد جامد و مایع، بر اساس اندازه گیری مداوم هستند. اصل اندازه گیری استفاده شده بسیار ساده است. گاز آزمایشی به طور مداوم در یک مشعل با فشار ثابت سوزانده می شود. تمام گرمای آزاد شده در طی احتراق یا توسط جریان محیط خنک کننده در مبدل حرارتی (کالری سنج مرطوب یا تبادل حرارت)، یا با مخلوط کردن محصولات احتراق با جریان هوا با سرعت جریان شناخته شده (کالری سنج خشک یا مخلوط) جذب می شود. معمولا ارزش حرارتی خالص هو را تعیین می کند. برای تعیین ارزش حرارتی ناخالص H0، لازم است بخار آب (شاخص KO) موجود در گازهای دودکش متراکم شود. با دانستن دبی جرمی و اختلاف دما در ورودی (شاخص e) و خروجی (شاخص a) کالریسنج، میتوان مقدار حرارتی مربوطه را با استفاده از معادله تعادل حرارتی محاسبه کرد.
تهیه گاز مورد نیاز اساساً در تمام کالریمترهای گاز یکسان است. قبل از احتراق، گاز (شاخص G) ابتدا از ناخالصی های مکانیکی جامد (در فیلتر) تمیز می شود و مرطوب می شود (تا اشباع با رطوبت، 100٪)، و سپس به مقادیر مشخص شده فشار اولیه می رسد (با استفاده از یک کاهش دهنده فشار). شیر) و دمای محیط خنک کننده (شاخص K). هوای مورد نیاز برای احتراق (شاخص L) نیز مرطوب شده و به دمای محیط خنک کننده می رسد.
بسته به دقت مورد نیاز و هزینه های مجاز ابزار دقیق، ممکن است برخی از این شرایط رعایت نشود. کالریمترها باید با یک گاز مرجع (مثلاً هیدروژن) تأیید شوند تا انحراف از معادله برای حالت ایده آل کالری سنج تعیین شود. برای یک کالریمتر تبادل حرارتی (مرطوب)، معادله فوق شکل دارد
نرخ جریان جرمی محیط خنک کننده و سوخت، کیلوگرم بر ثانیه کجاست. sk - ظرفیت گرمایی ویژه محیط خنک کننده، J / (kg * K)؛ - افزایش دمای محیط خنک کننده، K.
شکل دستگاه کالریمتر مرطوب (الف) و خشک (ب) برای سوخت گازی.
افزایش دما به طور معمول 5-15 کلوین است. به دلیل جرم حرارتی زیاد، کالریمترهای انتقال حرارت ثابت زمانی بسیار طولانی دارند که می تواند تا چند دقیقه باشد. بنابراین، آنها برای استفاده در یک حلقه کنترل بسته به عنوان سنسور نسبت به کالریمترهای خشک (مخلوط) که ثابت زمانی آنها فقط چند ثانیه است، کمتر مناسب هستند. از سوی دیگر، دقت قابل دستیابی کالریمترهای تبادل حرارتی نسبتاً بالا است. خطای آنها از ± 0.25-1٪ تجاوز نمی کند، بنابراین می توان از آنها برای کارهای آزمایشگاهی و تأیید نیز استفاده کرد. کالریمترهای خشک (اختلاط) دارای خطای 1± تا 2± درصد از حد بالایی محدوده اندازه گیری هستند.
نسخههای طراحی کالریسنجها از تولیدکنندگان مختلف، عمدتاً در دستگاههای کمکی و ایمنی، عناصر حسگر و مدارهای محاسباتی که جبران خطا را فراهم میکنند، متفاوت است. بنابراین، در کالریسنجهای تبادل حرارتی، نسبت دبی گاز و محیط خنککننده به روشهای مختلف حفظ میشود (به معادله کالریسنج بالا مراجعه کنید)، به همین دلیل ارزش حرارتی بالاتر H0 به طور مستقیم تنها به افزایش دما بستگی دارد.
در کالریسنجهای خشک، افزایش دما یا بهطور مستقیم با استفاده از دماسنجهای تماس الکتریکی یا بهطور غیرمستقیم با استفاده از حسگر دیلاتومتریک - یک لوله در حال گسترش که در جریان گاز خروجی قرار دارد، اندازهگیری میشود. در کالریسنج ADOS، افزایش طول حرارتی لوله دیلاتومتر مستقیماً با گرمای احتراق مطابقت دارد و میتواند با استفاده از پیوند و طول سنج به هر سیگنالی تبدیل شود. در کالریمتر Reinecke، از امتداد میله به عنوان یک سیگنال اندازه گیری در مدار کنترلی استفاده می شود که جریان هوای خنک کننده را به گونه ای کنترل می کند که افزایش دمای آن تقریباً ثابت بماند. در این حالت، حلقه کنترل کاملاً متناسب است، اما مقداری انحراف باقیمانده در آن اجتناب ناپذیر است. در این حالت، مصرف هوای خنک کننده یا ازدیاد طول لوله دیلاتومتری (میله) معیاری برای ارزش حرارتی تعیین شده است. یک پیش نیاز برای به دست آوردن دقت کافی در تمام کالریمترهای خشک، اختلاط خوب هوای خنک کننده و محصولات احتراق است.
اندازه گیری جریان گرما
گرما به عنوان شکلی از انرژی به سه طریق منتقل می شود: از طریق جسم جامد (رسانای گرمایی)، مایع یا گاز (همرفت) و بدون مشارکت ماده (تابش). در فناوری، هر سه جزء تقریباً همیشه در انتقال گرما نقش دارند. با این حال، در بسیاری از موارد می توان تنها با اندازه گیری یک جزء به نتایجی با دقت قابل قبول دست یافت.
اندازه گیری جریان دمابا هدایت حرارتی
انتقال حرارت از طریق دیوارهای رسانای گرما در بسیاری از زمینه های فناوری (انواع مبدل های حرارتی، عایق های حرارتی و غیره) از اهمیت بالایی برخوردار است. در عین حال، کنترل فعلی مقادیر تولید مورد توجه نیست، بلکه نتایج اندازه گیری های منفرد مورد استفاده برای ارزیابی بار، تأیید برآورده شدن شاخص های تضمین شده و کارایی است.
با توجه به قوانین هدایت حرارتی ثابت، شار گرما با فرمول های زیر (J/s) تعیین می شود:
از آنجایی که رسانایی حرارتی دیوار [J/(m*s*K)] و ابعاد هندسی آن مشخص است، اندازهگیری شار حرارتی برای اندازهگیری اختلاف دما کاهش مییابد. با این حال، این تکنیک نیاز به تعیین بسیار دقیق دمای سطح دارد. خطاهای مربوط به تغییرات در شرایط انتقال حرارت هنگام نصب عناصر حساس به دما روی سطوح می تواند بسیار زیاد باشد. بنابراین برای اندازه گیری های دقیق تر، روش های زیر پیشنهاد می شود که در آن ها از هدایت حرارتی و انتقال حرارت به طور همزمان استفاده می شود.
اندازه گیری جریان گرما در انتقال حرارت (انتقال حرارت همراه با هدایت گرما)
برای دیوار مسطح ذکر شده در بخش قبل، قانون انتقال حرارت زیر (J/s) معتبر است:
![]() ,
,
که در ضریب انتقال حرارت k 1J/(m2*s*K)]، همراه با ضریب انتقال حرارت [J/Dm*s*K)]، ضرایب انتقال حرارت و [J/(m2*s*K) ] دو طرف دیوار نیز در نظر گرفته شده است.
روی یک دیوار صاف که شار حرارتی اندازه گیری شده از آن عبور می کند، یک صفحه نازک کوچک قرار می گیرد که دمای سطح آن توسط ترموکوپل های لایه نازک داخلی تعیین می شود. مزیت اندازه گیری به این روش این است که نیازی به آگاهی از خواص حرارتی دیوار ندارد و می توان خواص مربوط به صفحه را در حین کالیبراسیون به یک مقدار ثابت کاهش داد. چنین عناصر حساسی دارای اندازه تقریباً 30x30x0.5 میلی متر هستند. محدوده اندازه گیری شار حرارتی از 10 تا 100000 W/m2 را پوشش می دهد. خطا 2-5٪ است.
شکل اصل عملکرد شار سنج حرارتی.
با بهبود این روش اندازه گیری، به جای صفحه روی هم از تشک های لاستیکی استفاده می شود. با چسباندن آنها به سطوح غیر مسطح یا پیچاندن آنها به دور یک سطح منحنی، می توان انتقال حرارت را از سطحی با یک منطقه نسبتاً بزرگ، به عنوان مثال، از یک لوله، ظرف و غیره تعیین کرد. ترموکوپل ها در هر دو سطح تعبیه می شوند. حصیر به طوری که اتصالات سرد و گرم آنها دقیقاً روی هم قرار گیرند (شکل 6). و در این حالت چگالی شار حرارتی مطابق با کالیبراسیون با اختلاف دما متناسب است. با این حال، تشک های اعمال شده تا حدودی انتقال حرارت اولیه را مختل می کنند که با اندازه گیری های دقیق قابل توجه می شود. بنابراین، این روش اندازه گیری عمدتا برای تعیین ثابت های ترمودینامیکی یک ماده استفاده می شود، زمانی که نقض جریان گرما بر نتیجه اندازه گیری تأثیر نمی گذارد.
اندازه گیری جریان گرما در محیط های فعلی
بخش قابل توجهی از انرژی حرارتی توسط رسانه های مایع یا گازی (آب، بخار و غیره) که در یک شبکه خط لوله بسته حرکت می کنند، منتقل می شود. با این حال، در مقایسه با انتقال انرژی الکتریکی توسط سیم، فاصله ای که می توان انرژی حرارتی را از طریق آن منتقل کرد، محدود است. برای مطالعات ترموتکنیکی انواع سیستم های گرمایشی و برودتی، اندازه گیری میزان انتشار و مصرف گرما ضروری است.
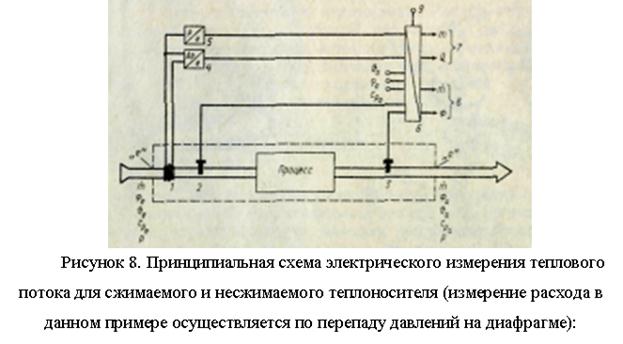
شار حرارتی F (J/s)، که توسط جریان حامل حرارتی متوسط (کیلوگرم بر ثانیه) از طریق بخش کنترل با مساحت A (m2) در یک منطقه خاص، که تعادل حرارتی برای آن جمعآوری شده است، منتقل میشود. منطقه فرآیند، شکل 7)، برابر است با
مقدار گرمای آزاد شده در بازه زمانی t2 - t1 به صورت انتگرال (J) تعیین می شود:
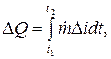
اختلاف مقدار حرارت (آنتالپی، J/kg) مایع خنک کننده در ورودی (شاخص e) و در خروجی (شاخص a) منطقه تعادل حرارتی کجاست.
از آنجایی که، در حالت کلی، مقدار آنتالپی فقط در مقایسه با یک سطح معین مورد توجه است، به عنوان مثال، با آنتالپی در دمای محیط، تمام اندازهگیریهای شار حرارتی اساساً اندازهگیریهای تفاوت هستند.
آنتالپی های منفرد موجود در معادله کلی را می توان بر حسب دماهای مربوطه و ظرفیت های گرمایی ویژه بیان کرد.
بنابراین، اندازه گیری جریان گرما به طور مستقیم به اندازه گیری دما و نرخ جریان جرمی کاهش می یابد. در بسیاری از موارد، نه جرم، بلکه جریان حجمی مایع خنک کننده اندازه گیری می شود. در این حالت، نتیجه به دست آمده تنها با مقدار چگالی مایع خنک کننده р متفاوت خواهد بود. ظرفیت های گرمایی ویژه، ci، خود تابعی از دما هستند. با این حال، به دلیل محدوده باریک اندازه گیری بسیاری از ابزارها، معمولاً می توان آنها را مقادیر ثابت و بدون کاهش دقت در نظر گرفت. ظرفیت گرمایی ویژه باید مشخص باشد. برای مایعات، معادله جریان گرما ساده تر است، زیرا آنها ظرفیت های حرارتی خاصبه فشار وابسته نباشید:
![]() ، J/s.
، J/s.
در تمام معادلات از این نوع، بسته به اینکه گرما تامین یا حذف شده است، گرما یا گرمازا بودن فرآیند، سرد شدن یا گرمایش رخ می دهد، باید علائم کمیت ها را در نظر گرفت.
