گاز ایده آل نظریه مولکولی-سینتیکی گازهای ایده آل
نظریه جنبشی مولکولی رفتار و خواص یک جسم ایده آل خاص به نام را توصیف می کند گاز ایده آل. این مدل فیزیکی بر اساس ساختار مولکولی ماده است. ایجاد نظریه مولکولی با آثار R. Clausius، J. Maxwell، D. Joule و L. Boltzmann مرتبط است.
گاز ایده آل. نظریه مولکولی-سینتیکی گاز ایده آل بر اساس مفروضات زیر ساخته شده است:
اتم ها و مولکول ها را می توان به صورت مشاهده کرد نقاط مادی، که در حرکت مداوم هستند;
حجم ذاتی مولکول های گاز در مقایسه با حجم ظرف ناچیز است.
همه اتم ها و مولکول ها قابل تشخیص هستند، یعنی اصولاً می توان حرکت هر ذره را دنبال کرد.
قبل از برخورد مولکول های گاز بین آنها، هیچ نیروی برهمکنشی وجود ندارد و برخورد مولکول ها بین خود و با دیواره های ظرف کاملاً کشسان فرض می شود.
حرکت هر اتم یا مولکول گاز توسط قوانین مکانیک کلاسیک توصیف می شود.
قوانین به دست آمده برای یک گاز ایده آل را می توان در مطالعه گازهای واقعی استفاده کرد. برای این کار، مدلهای آزمایشی یک گاز ایدهآل ایجاد میشود که در آن خواص گاز واقعی نزدیک به گاز ایدهآل است (مثلاً در فشارهای پایین و دماهای بالا).
قوانین گاز ایده آل
قانون بویل ماریوت:
برای جرم معینی از گاز در دمای ثابت، حاصل ضرب فشار گاز و حجم آن یک مقدار ثابت است: pV = const , (1.1)
در تی = پایان , m = ثابت .
منحنی نشان دهنده رابطه بین کمیت ها آرو V، ویژگی های یک ماده را در دمای ثابت مشخص می کند و نامیده می شود ایزوترم این یک هذلولی است (شکل 1.1.) و فرآیندی که در دمای ثابت انجام می شود همدما نامیده می شود.
قوانین گی-لوساک:
حجم یک جرم معین گاز در فشار ثابت به صورت خطی با دما تغییر می کند
V = V 0 (1 + تی ) در P = const , m = ثابت . (1.2)

پ = پ 0 (1 + تی ) در V = const , m = ثابت . (1.3)
در معادلات (1.2) و (1.3)، دما در مقیاس سانتیگراد، فشار و حجم بیان می شود - در
0 С، در حالی که
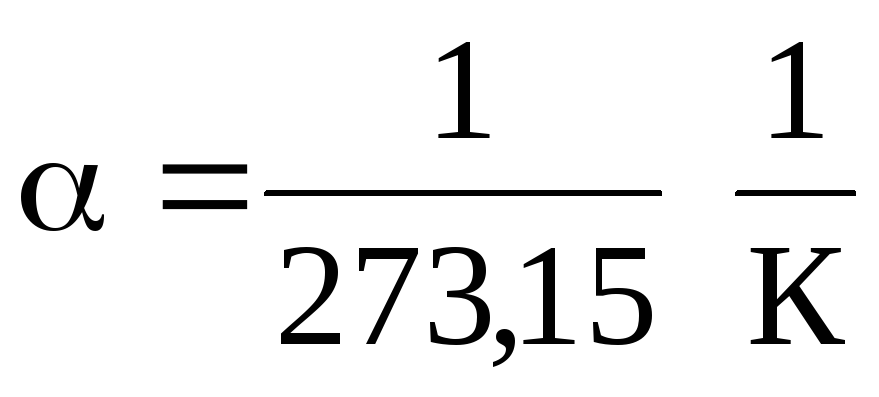 .
.
فرآیندی که در فشار ثابت انجام می شود نامیده می شود ایزوباریک، می توان آن را به صورت یک تابع خطی نشان داد (شکل 1.2.).
فرآیندی که در حجم ثابت انجام می شود نامیده می شود ایزوکوریک(شکل 1.3.).
از معادلات (1.2) و (1.3) نتیجه می شود که ایزوبارها و ایزوکورها محور دما را در نقطه قطع می کنند. t =1/ \u003d - 273.15 С . اگر مبدا را به این نقطه منتقل کنیم، سپس به مقیاس کلوین می رویم.
معرفی فرمول های (1.2) و (1.3) دمای ترمودینامیکی، قوانین Gay-Lussac را می توان شکل راحت تری ارائه داد:
V = V 0 (1+تی) = = V 0 = =V 0 تی;
پ = پ 0 (1+تی) = پ 0 = پ 0 تی;
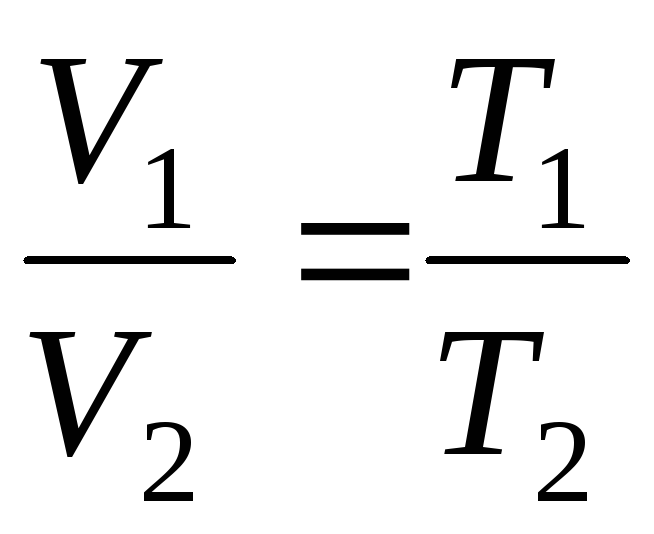 در
p=const، m=const
;
(1.4)
در
p=const، m=const
;
(1.4)
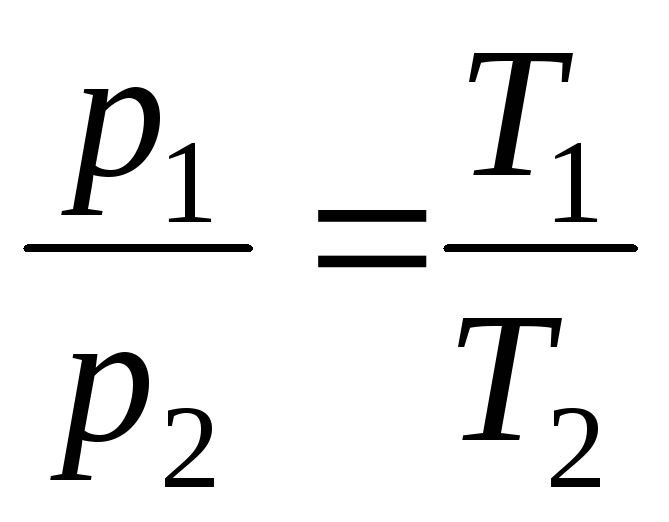 در V = const، m = const
,
(1.5)
در V = const، m = const
,
(1.5)
که در آن شاخصهای 1 و 2 به حالتهای دلخواه در همان ایزوبار یا ایزوکور اشاره دارد. .
قانون آووگادرو:
مول هر گازی در دما و فشار یکسان حجم یکسانی را اشغال می کند.
در شرایط عادی این حجم برابر است با V,0 \u003d 22.4110 -3 m 3 / mol . طبق تعریف، در یک خال مواد مختلفحاوی همان تعداد مولکول، برابر با آووگادرو ثابت:ن آ = 6,02210 23 مول -1 .
قانون دالتون:
فشار مخلوط گازهای ایده آلبرابر با مجموع فشارهای جزئی است آر 1 , آر 2 , آر 3 … آر n، گازهای موجود در آن:
p = p 1 + ص 2 + آر 3 + …+ ص n .
فشار جزئی – این هست فشاری که گاز موجود در ترکیب ایجاد می کند مخلوط گازاگر به تنهایی حجمی برابر با حجم مخلوط را در همان دما اشغال کند.
معادله حالت گاز ایده آل
(معادله کلاپیرون- مندلیف)
بین دما، حجم و فشار رابطه مشخصی وجود دارد. این رابطه را می توان با یک وابستگی عملکردی نشان داد:
f(p، V، T)= 0.
به نوبه خود، هر یک از متغیرها ( p، v، t) تابعی از دو متغیر دیگر است. نوع وابستگی عملکردی برای هر حالت فاز یک ماده (جامد، مایع، گاز) به صورت تجربی یافت میشود. این یک فرآیند بسیار پر زحمت است و معادله حالت فقط برای گازهایی که در حالت کمیاب هستند و برای برخی از گازهای فشرده به شکل تقریبی ایجاد شده است. برای موادی که حالت گازی ندارند، این مشکل هنوز حل نشده است.
فیزیکدان فرانسوی B. Clapeyron آورد معادله حالت گاز ایده آلبا ترکیب قوانین بویل ماریوت، گی لوساک، چارلز:
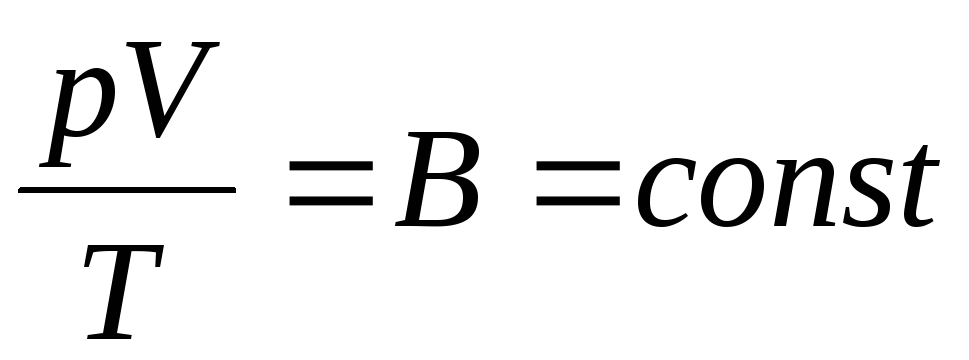 . (1.6)
. (1.6)
عبارت (1.6) معادله کلاپیرون است که در آن ATثابت گاز است. برای گازهای مختلف متفاوت است.
DI. مندلیف معادله کلاپیرون را با قانون آووگادرو ترکیب کرد و معادله (1.6) را به یک مول ارجاع داد و از حجم مولی استفاده کرد. V . طبق قانون آووگادرو، برای همین آرو تیمول های همه گازها حجم مولی یکسانی را اشغال می کنند V .
.
بنابراین، ثابت ATبرای همه گازهای ایده آل یکسان خواهد بود. این ثابت معمولا نشان داده می شود آرو برابر با آر=
8,31
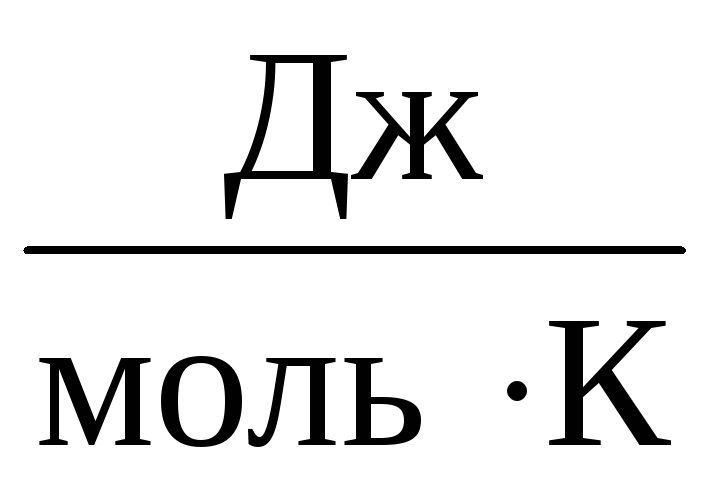 .
.
معادله کلاپیرون - مندلیف دارای فرم زیر است:
پ V . = آر تی.
از معادله (1.7) برای یک مول گاز، می توان به به معادله کلاپیرون- مندلیف برای جرم دلخواه گاز:
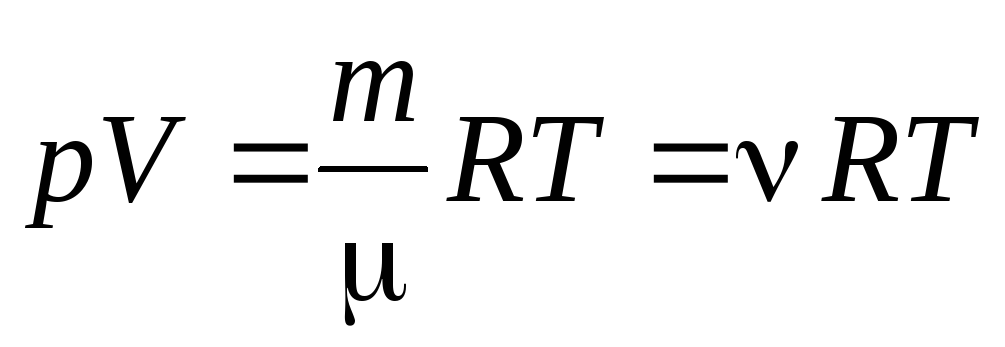 , (1.7)
, (1.7)
جایی که
–
جرم مولی
(جرم یک مول ماده، کیلوگرم بر مول)؛ متر
جرم گاز؛
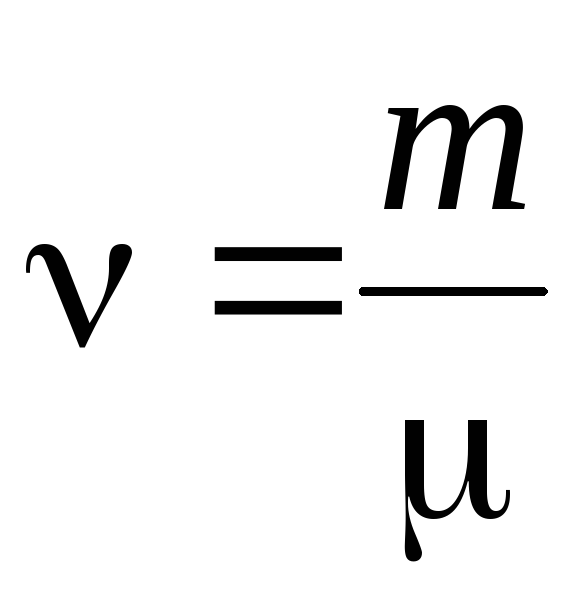 - مقدار ماده .
- مقدار ماده .
بیشتر اوقات، شکل دیگری از معادله حالت گاز ایده آل استفاده می شود که معرفی می شود ثابت بولتزمن: 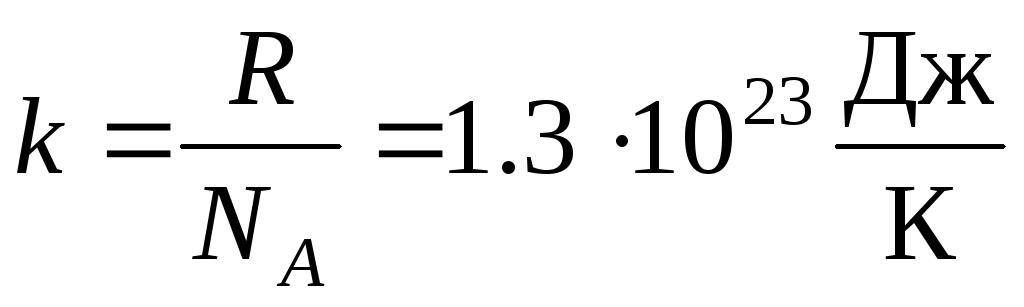 .
.
سپس معادله (1.7) به صورت زیر است:
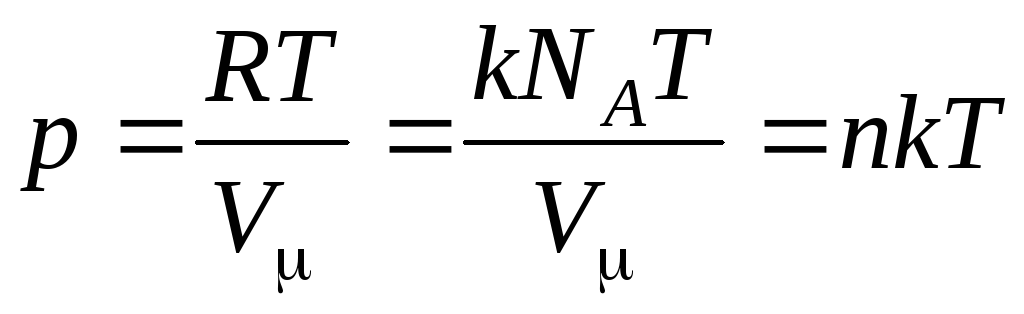 ,
(1.8)
,
(1.8)
جایی که
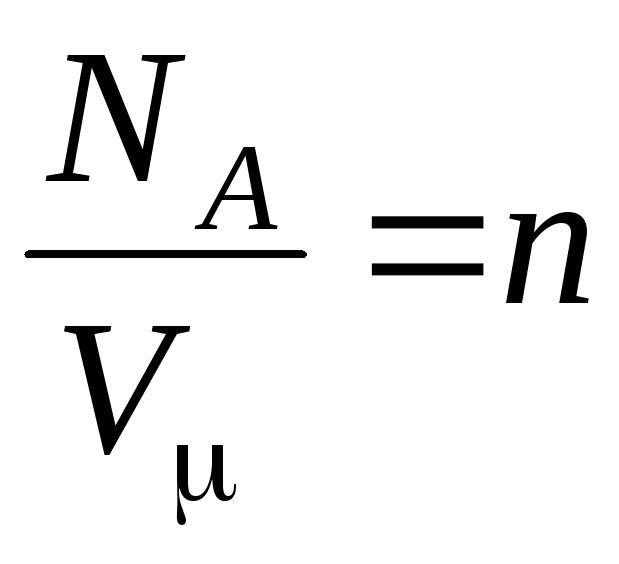 –
غلظت مولکول ها (تعداد مولکول در واحد حجم). از این عبارت نتیجه می شود که فشار یک گاز ایده آل با غلظت مولکول های آن یا چگالی گاز نسبت مستقیم دارد. در دماها و فشارهای یکسان، همه گازها دارای تعداد یکسانی مولکول در واحد حجم هستند. تعداد مولکول های موجود در 1 متر مکعب در شرایط عادی نامیده می شود
شماره لوشمیت:
–
غلظت مولکول ها (تعداد مولکول در واحد حجم). از این عبارت نتیجه می شود که فشار یک گاز ایده آل با غلظت مولکول های آن یا چگالی گاز نسبت مستقیم دارد. در دماها و فشارهای یکسان، همه گازها دارای تعداد یکسانی مولکول در واحد حجم هستند. تعداد مولکول های موجود در 1 متر مکعب در شرایط عادی نامیده می شود
شماره لوشمیت:
ن L = 2.68 10 25 m -3.
معادله اصلی سینتیک مولکولی
نظریه گازهای ایده آل
مهمترین وظیفه نظریه جنبشی گازها محاسبه نظری فشار یک گاز ایده آل است بر اساس مفاهیم جنبشی مولکولی معادله اصلی نظریه جنبشی مولکولی گازهای ایده آل با استفاده از روش های آماری.
فرض بر این است که مولکولهای گاز بهطور تصادفی حرکت میکنند، تعداد برخوردهای متقابل بین مولکولهای گاز در مقایسه با تعداد ضربههای روی دیوارههای ظرف ناچیز است و این برخوردها کاملاً کشسان هستند. روی دیواره رگ مقداری ناحیه ابتدایی اسو فشاری را که مولکول های گاز بر این ناحیه وارد می کنند را محاسبه کنید.
باید این واقعیت را در نظر گرفت که در واقعیت مولکول ها می توانند در زوایای مختلف به محل حرکت کنند و می توانند سرعت های مختلف، که علاوه بر این، می تواند با هر برخورد تغییر کند. در محاسبات نظری، حرکت هرج و مرج مولکول ها ایده آل می شود، آنها با حرکت در امتداد سه جهت عمود بر یکدیگر جایگزین می شوند.
اگر ظرفی را به شکل مکعب در نظر بگیریم که در آن نمولکول های گاز در شش جهت، به راحتی می توان مشاهده کرد که در هر لحظه 1/3 از تعداد کل مولکول ها در امتداد هر یک از آنها حرکت می کند و نیمی از آنها (یعنی 1/6 از تعداد همه مولکول ها) در حرکت هستند. یک جهت، و نیمه دوم (همچنین 1/6) - در جهت مخالف. با هر برخورد، یک مولکول منفرد که عمود بر محل حرکت می کند و منعکس می شود، تکانه را به آن منتقل می کند، در حالی که تکانه آن (تکانه) به مقدار تغییر می کند.
آر 1 =متر 0 v – (– متر 0 v) = 2 متر 0 v.
تعداد ضربه های مولکول هایی که در یک جهت معین روی سایت حرکت می کنند برابر با: ن = 1/6 n اسvتی. هنگام برخورد با پلت فرم، این مولکول ها حرکت حرکتی را به آن منتقل می کنند.
پ= ن پ 1 =2 متر 0 vnاسvt= m 0 v 2 nاستی,
جایی که nغلظت مولکول ها است. سپس فشاری که گاز به دیواره ظرف وارد می کند برابر خواهد بود با:
p = 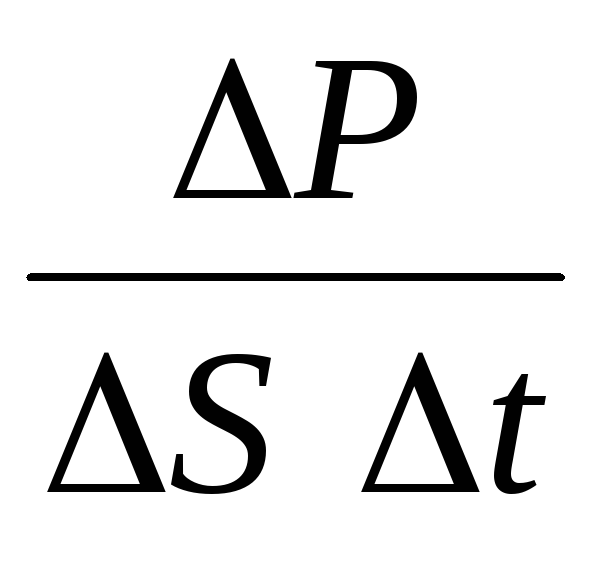 =
نانومتر 0
v 2
.
(1.9)
=
نانومتر 0
v 2
.
(1.9)
با این حال، مولکول های گاز با سرعت های مختلف حرکت می کنند: v 1 , v 2 , …,v n، بنابراین سرعت ها باید میانگین باشد. مجموع مجذورهای سرعت مولکول های گاز، تقسیم بر تعداد آنها، ریشه میانگین سرعت مربع را تعیین می کند:
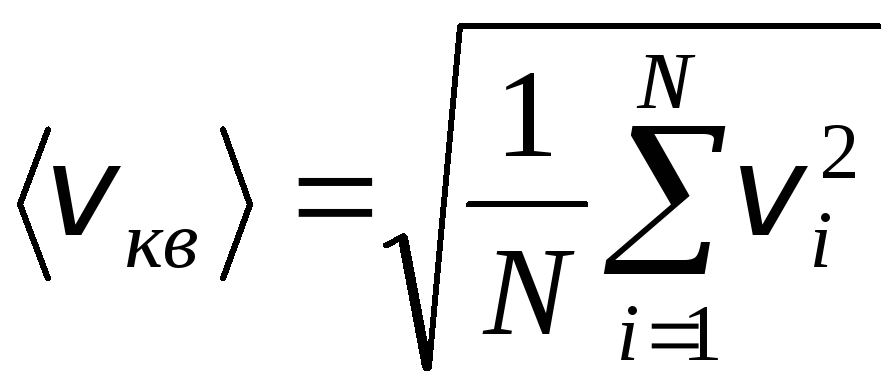 .
.
معادله (1.9) شکل خواهد گرفت:
![]() (1.10)
(1.10)
عبارت (1.10) نامیده می شود معادله اصلی نظریه جنبشی مولکولیگازهای ایده آل
با توجه به اینکه 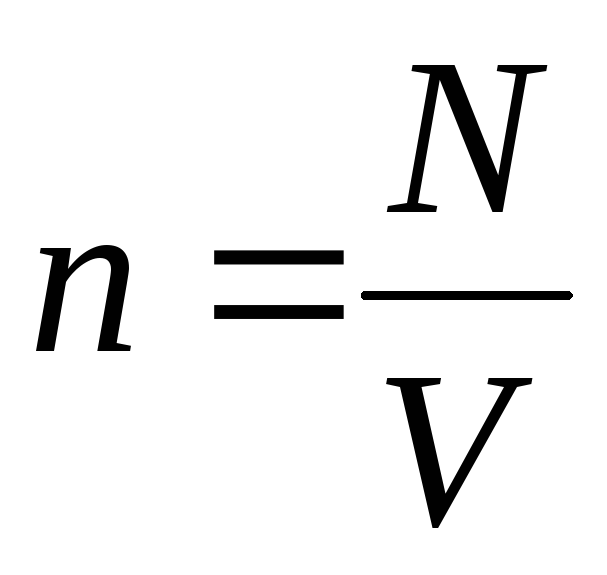 ، ما گرفتیم:
، ما گرفتیم:
p V = N 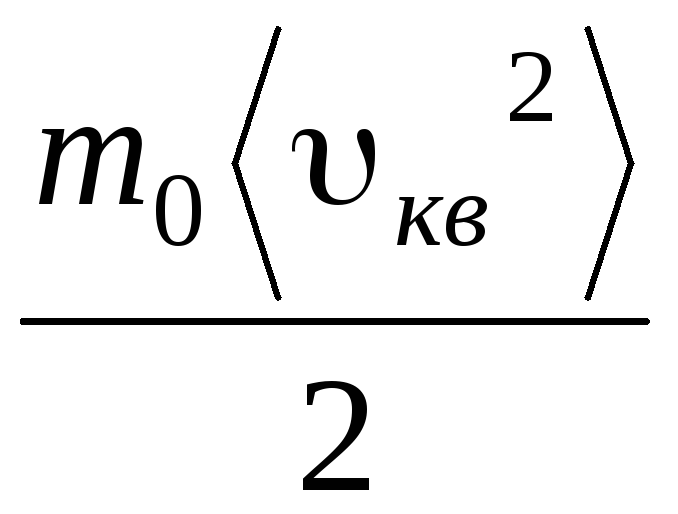 = E,
(1.11)
= E,
(1.11)
جایی که Eانرژی جنبشی کل حرکت انتقالی تمام مولکول های گاز است. بنابراین فشار گاز با انرژی جنبشی حرکت انتقالی مولکول های گاز نسبت مستقیم دارد.
برای یک مول گاز m = و معادله کلاپیرون - مندلیف به شکل زیر است:
p V . = آر تی,
و از آنجا که از (1.11) بر می آید که p V . = v مربع 2 دریافت می کنیم:
R.T.= v مربع 2 .
بنابراین، سرعت ریشه میانگین مربع مولکول های گاز برابر است با
v
مربع
=
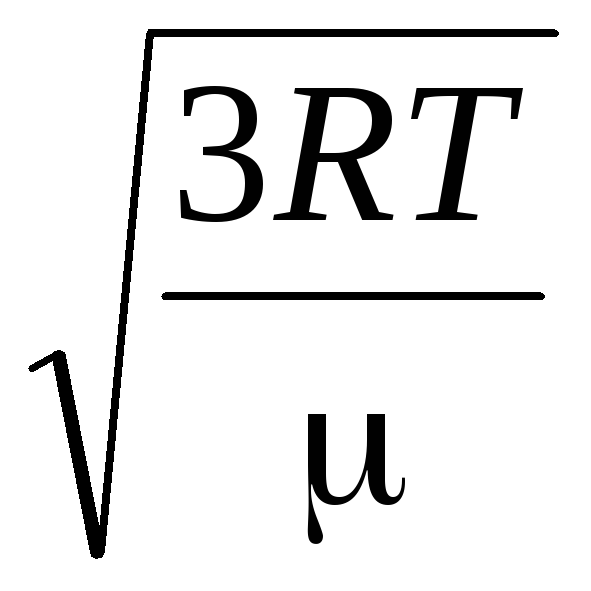 =
=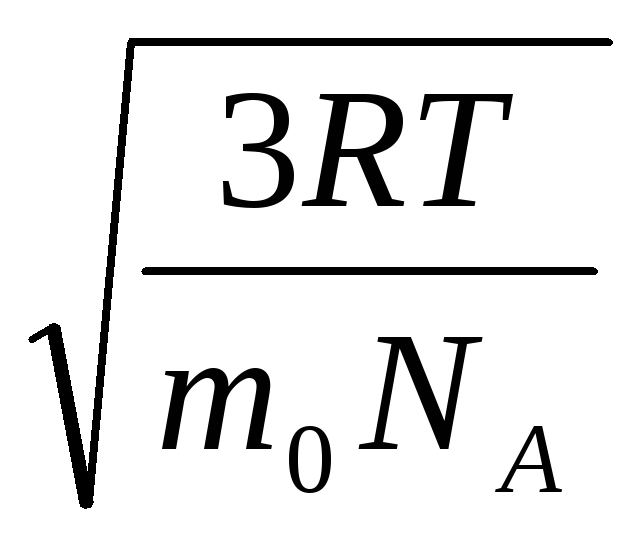 =
= ,
,
جایی که ک = آر/ن آ = 1.3810 -23 J/K - ثابت بولتزمن از اینجا می توانید میانگین سرعت مربع مولکول های اکسیژن را در دمای اتاق - 480 متر بر ثانیه، هیدروژن - 1900 متر بر ثانیه پیدا کنید.
معنی مولکولی جنبشی دما
دما یک معیار کمی است که نشان می دهد یک بدن چقدر گرم است. برای روشن شدن معنای فیزیکی دمای ترمودینامیکی مطلق تیبیایید معادله پایه نظریه مولکولی- جنبشی گازها (1.14) را با معادله کلاپیرون- مندلیف مقایسه کنیم. پ V = R.T.
با معادل سازی قسمت های مناسب این معادلات، مقدار متوسط انرژی جنبشی 0 یک مولکول را می یابیم ( = ن/ن آ ، ک=آر/ن آ):
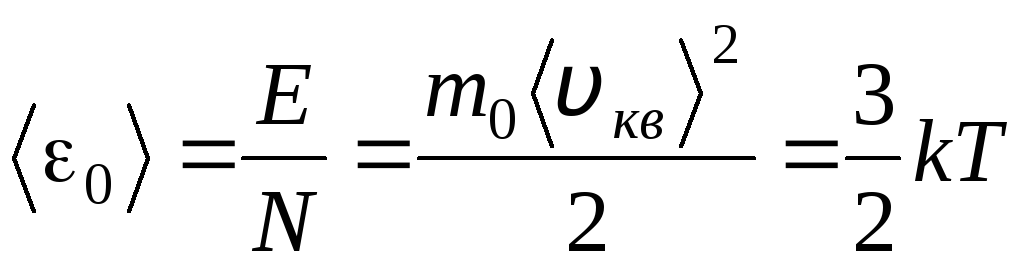 .
.
مهمترین نتیجه تئوری جنبشی مولکولی از این معادله به دست می آید: میانگین انرژی جنبشی حرکت انتقالی یک مولکول یک گاز ایده آل فقط به دما بستگی دارد، در حالی که با دمای ترمودینامیکی نسبت مستقیم دارد. بنابراین، مقیاس دمای ترمودینامیکی یک معنای فیزیکی مستقیم به دست می آورد: در تی= 0 انرژی جنبشی مولکول های گاز ایده آل صفر است. بنابراین، بر اساس این نظریه، حرکت انتقالی مولکول های گاز متوقف شده و فشار آن برابر با صفر می شود.
تئوری خواص تعادلی گاز ایده آل
تعداد درجات آزادی مولکولها. نظریه مولکولی- جنبشی گازهای ایده آل منجر به یک نتیجه بسیار مهم می شود: مولکول های گاز به طور تصادفی حرکت می کنند و میانگین انرژی جنبشی حرکت انتقالی مولکول صرفاً توسط دما تعیین می شود.
انرژی جنبشی حرکت مولکولی توسط جنبشی تمام نمی شود انرژی حرکت رو به جلو: از جنبشی نیز تشکیل شده است انرژی ها چرخشو نوساناتمولکول ها. برای محاسبه انرژی وارد شده به انواع حرکت مولکولی، لازم است تعریف شود تعداد درجات آزادی.
زیر تعداد درجات آزادی (من) از بدن دلالت دارد تعداد مختصات مستقلی که برای تعیین موقعیت جسم در فضا باید وارد شود.
اچ  به عنوان مثال، یک نقطه مادی دارای سه درجه آزادی است، زیرا موقعیت آن در فضا توسط سه مختصات تعیین می شود: x، yو z. بنابراین، یک مولکول تک اتمی دارای سه درجه آزادی حرکت انتقالی است.
به عنوان مثال، یک نقطه مادی دارای سه درجه آزادی است، زیرا موقعیت آن در فضا توسط سه مختصات تعیین می شود: x، yو z. بنابراین، یک مولکول تک اتمی دارای سه درجه آزادی حرکت انتقالی است.
D 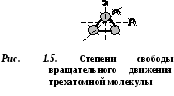 یک مولکول بوکاتومیک 5 درجه آزادی دارد (شکل 1.4): 3 درجه آزادی حرکت انتقالی و 2 درجه آزادی حرکت چرخشی.
یک مولکول بوکاتومیک 5 درجه آزادی دارد (شکل 1.4): 3 درجه آزادی حرکت انتقالی و 2 درجه آزادی حرکت چرخشی.
مولکول های سه یا چند اتم 6 درجه آزادی دارند: 3 درجه آزادی حرکت انتقالی و 3 درجه آزادی حرکت چرخشی (شکل 1.5).
هر مولکول گاز دارای تعداد مشخصی درجه آزادی است که سه تای آن مربوط به حرکت انتقالی آن است.
مقررات توزیع برابر انرژی
با درجات آزادی
فرض اصلی نظریه مولکولی-سینتیکی گازها، فرض تصادفی بودن کامل در حرکت مولکول ها است. این امر در مورد حرکات نوسانی و چرخشی و نه فقط انتقالی صدق می کند. فرض بر این است که تمام جهات حرکت مولکول ها در یک گاز به یک اندازه محتمل است. بنابراین، می توانیم فرض کنیم که برای هر درجه آزادی یک مولکول، به طور متوسط، همان مقدار انرژی وجود دارد - این موقعیت در تقسیم انرژی بر درجات آزادی است. انرژی هر یک درجه آزادی یک مولکول برابر است با:
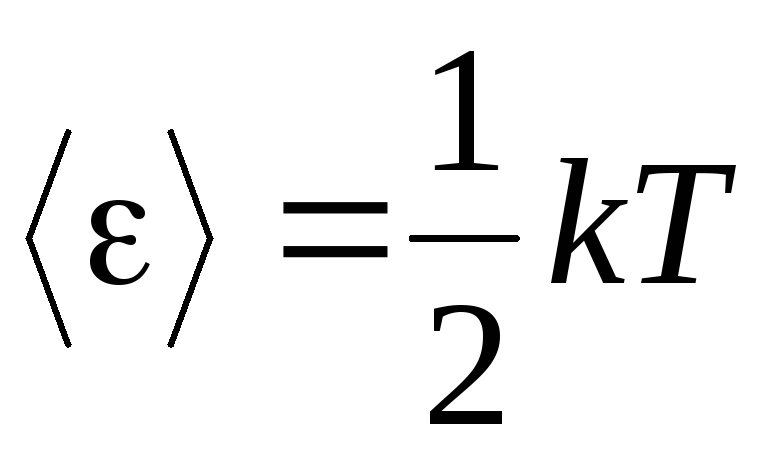 . (1.12)
. (1.12)
اگر مولکول داشته باشد مندرجات آزادی، سپس برای هر درجه آزادی به طور متوسط وجود دارد:
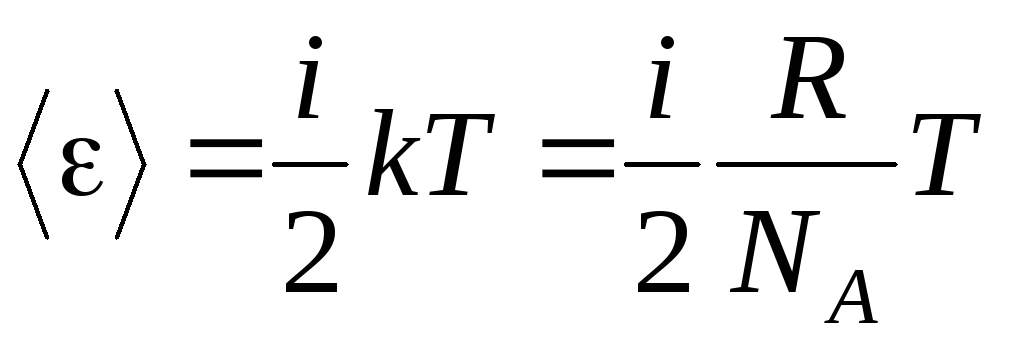 .
(1.13)
.
(1.13)
انرژی داخلی یک گاز ایده آل
اگر مجموع انرژی داخلی گاز را به یک مول نسبت دهیم، مقدار آن را با ضرب در عدد آووگادرو بدست می آوریم:
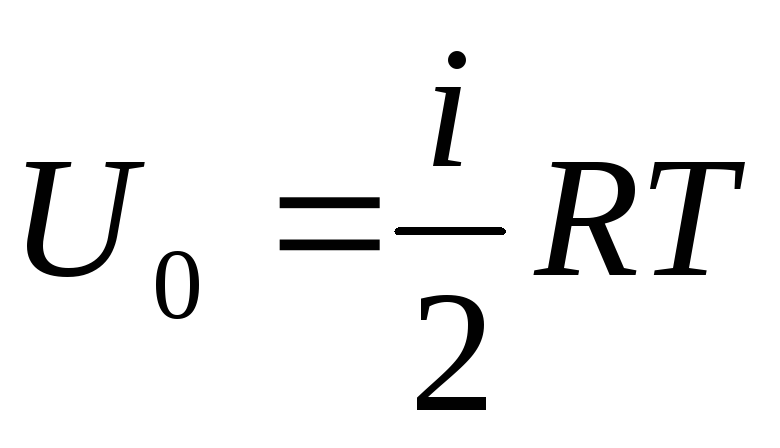 .
(1.14)
.
(1.14)
نتیجه این است که انرژی داخلی یک مول گاز ایده آل فقط به دما و تعداد درجات آزادی مولکول های گاز بستگی دارد.
توزیع های ماکسول و بولتزمن
توزیع مولکول های یک گاز ایده آل بر حسب سرعت و انرژی حرکت حرارتی (توزیع ماکسول). در دمای گاز ثابت، همه جهات حرکت مولکولی به یک اندازه محتمل فرض می شود. در این حالت سرعت ریشه میانگین مربع هر مولکول ثابت می ماند و برابر است با
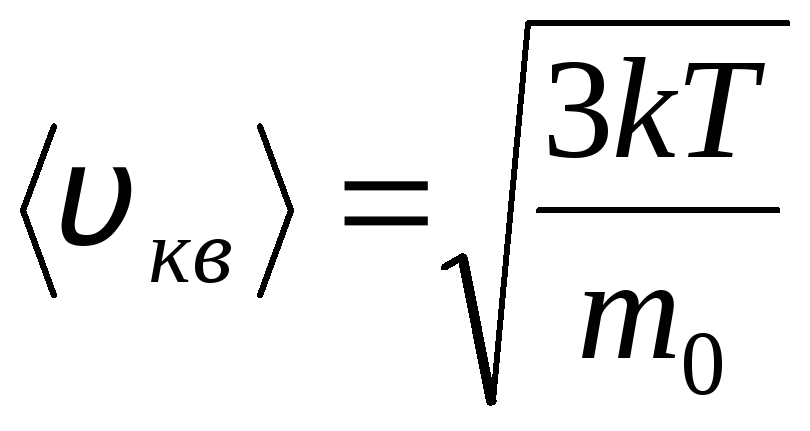 .
.
این با این واقعیت توضیح داده می شود که در یک گاز ایده آل، که در حالت تعادل است، توزیع سرعت ثابت خاصی از مولکول ها ایجاد می شود که با زمان تغییر نمی کند. این توزیع تابع قانون آماری خاصی است که به طور نظری توسط جی. ماکسول استخراج شده است. قانون ماکسول با تابع توصیف می شود
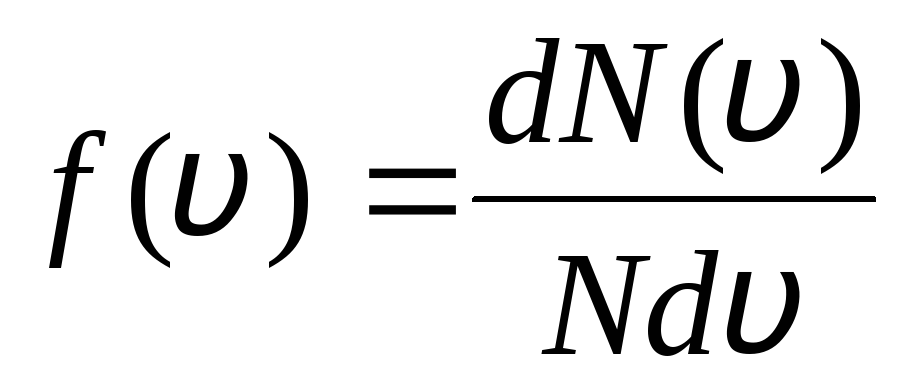 ,
,
این تابع است f(v) تعداد نسبی مولکول ها را تعیین می کند  ، که سرعت های آن در بازه از v
قبل از v+dv. ماکسول با استفاده از روش های نظریه احتمالات دریافت قانون توزیع مولکول های یک گاز ایده آل بر حسب سرعت:
، که سرعت های آن در بازه از v
قبل از v+dv. ماکسول با استفاده از روش های نظریه احتمالات دریافت قانون توزیع مولکول های یک گاز ایده آل بر حسب سرعت:
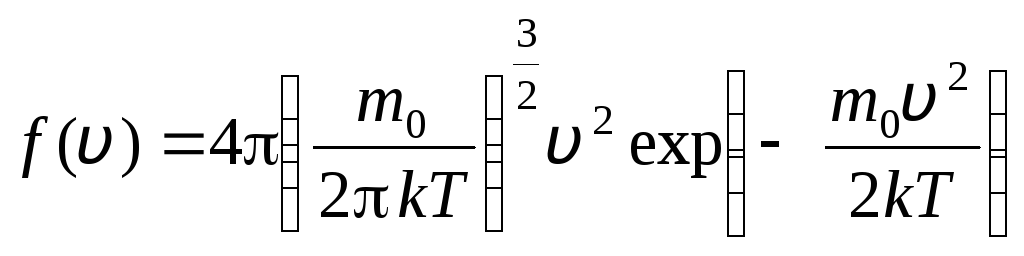 . (1.15)
. (1.15)
تابع توزیع به صورت گرافیکی در شکل نشان داده شده است. 1.6. مساحت محدود شده توسط منحنی توزیع و محور x برابر با یک است. این بدان معنی است که تابع f(v) شرایط عادی سازی را برآورده می کند:
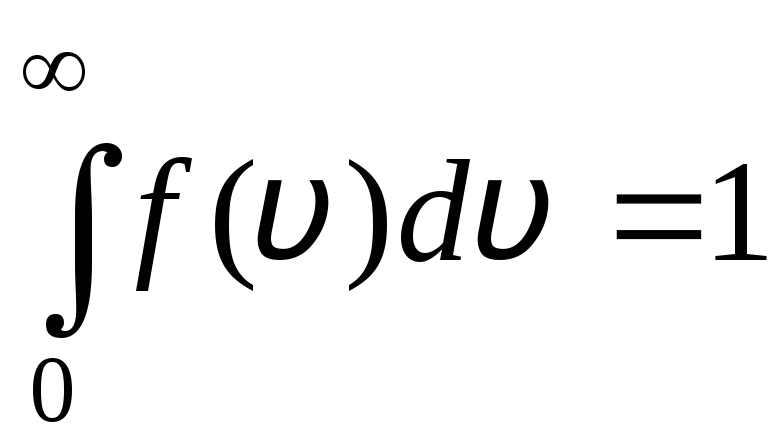 .
.
از جانب  سرعتی که تابع توزیع مولکول های گاز ایده آل بر حسب سرعت است f(v) حداکثر است، نامیده می شود به احتمال زیاد
سرعت
v ب .
سرعتی که تابع توزیع مولکول های گاز ایده آل بر حسب سرعت است f(v) حداکثر است، نامیده می شود به احتمال زیاد
سرعت
v ب .
ارزش های v = 0 و v = با حداقل بیان (1.15) مطابقت دارد. محتمل ترین سرعت را می توان با تفکیک عبارت (1.23) و برابر کردن آن با صفر پیدا کرد:
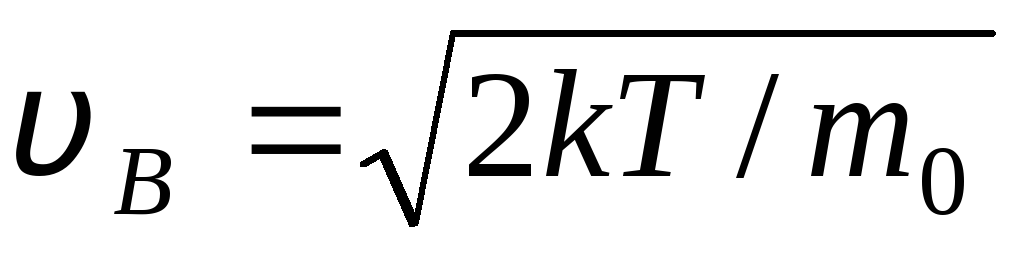 =
= =
1,41
=
1,41
با افزایش دما، حداکثر تابع به سمت راست تغییر می کند (شکل 1.6)، یعنی با افزایش دما، محتمل ترین سرعت نیز افزایش می یابد، با این حال، منطقه محدود شده توسط منحنی بدون تغییر باقی می ماند. لازم به ذکر است که در گازها و در دماهای پایین همیشه تعداد کمی مولکول وجود دارد که با سرعت بالا حرکت می کنند. وجود چنین مولکول های "گرم" دارد پراهمیتطی بسیاری از فرآیندها
سرعت متوسط حسابیمولکول ها با فرمول تعیین می شوند
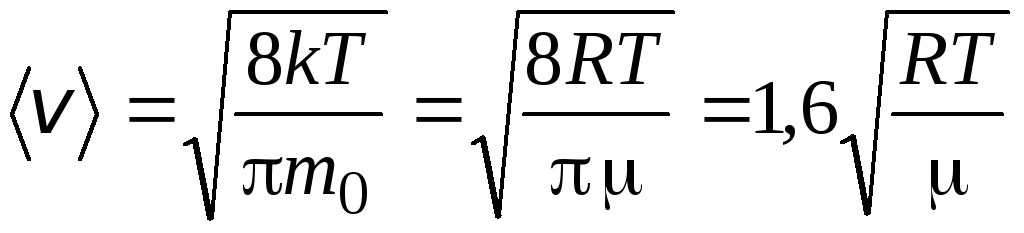 .
.
ریشه میانگین سرعت مربع
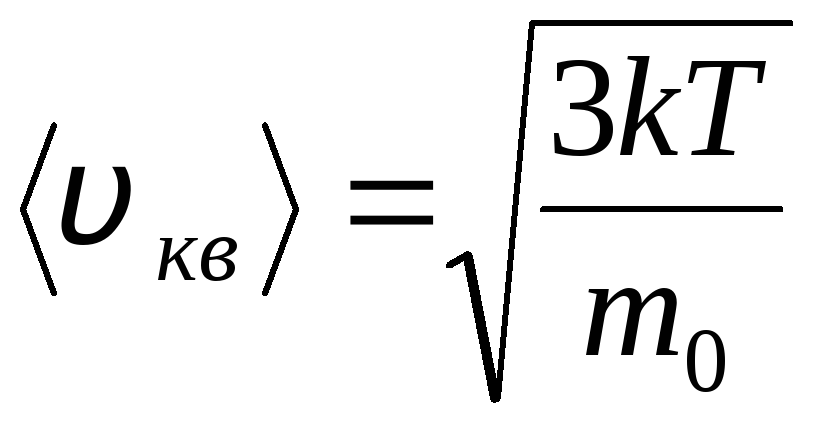 =
1,73
=
1,73 .
.
نسبت این سرعت ها به دما یا نوع گاز بستگی ندارد.
عملکرد توزیع مولکول ها توسط انرژی های حرکت حرارتی. این تابع را می توان با جایگزین کردن مقدار انرژی جنبشی به جای سرعت در معادله توزیع مولکول ها به دست آورد (1.15):
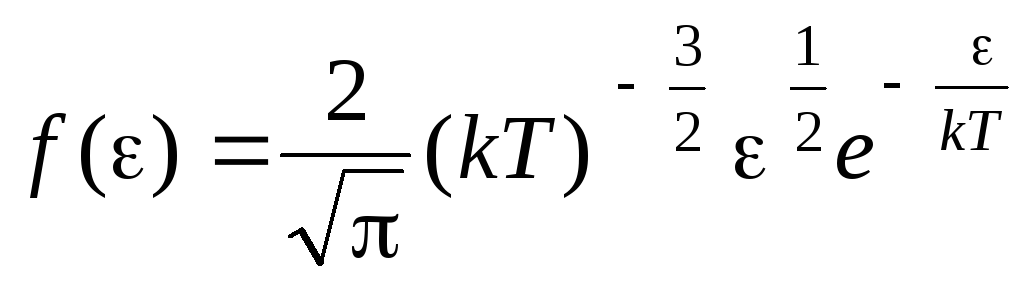 .
.
با ادغام عبارت بر روی مقادیر انرژی از  قبل از
قبل از 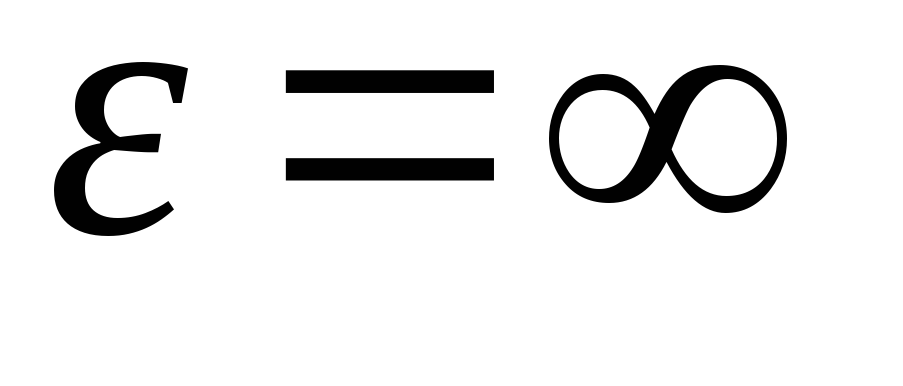
 ، ما گرفتیم انرژی جنبشی متوسطمولکول های گاز ایده آل:
، ما گرفتیم انرژی جنبشی متوسطمولکول های گاز ایده آل:
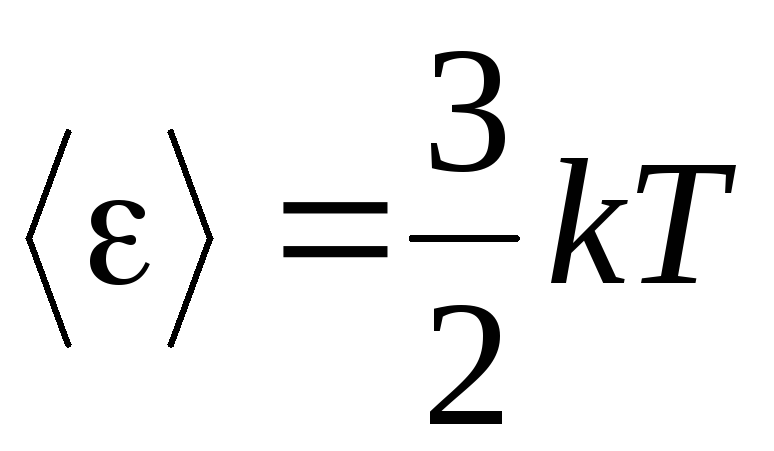 .
.
فرمول فشارسنجی توزیع بولتزمن هنگام استخراج معادله اصلی نظریه مولکولی-سینتیکی گازها و توزیع ماکسول مولکول ها بر اساس سرعت، فرض شد که مولکول های یک گاز ایده آل تحت تأثیر نیروهای خارجی قرار نمی گیرند، بنابراین مولکول ها به طور یکنواخت در سراسر حجم توزیع می شوند. با این حال، مولکول های هر گاز در میدان گرانشی زمین هستند. هنگام استخراج قانون وابستگی فشار به ارتفاع، فرض می شود که میدان گرانشی یکنواخت، دما ثابت و جرم همه مولکول ها یکسان است:
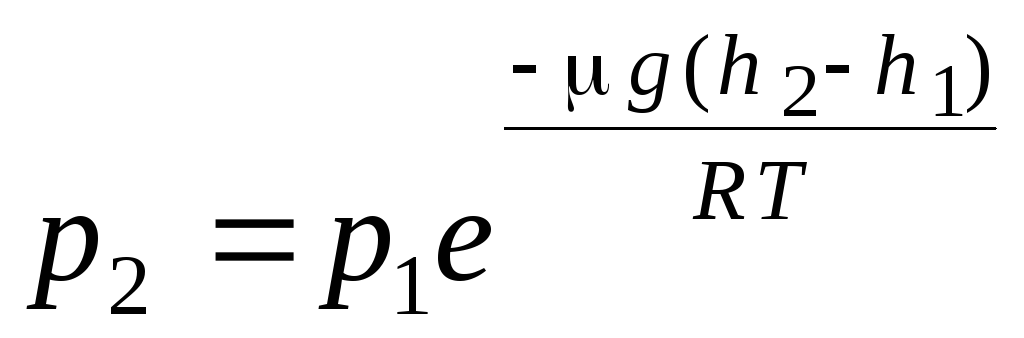 . (1.16)
. (1.16)
عبارت (1.16) نامیده می شود فرمول فشارسنجی. به شما این امکان را می دهد که بسته به ارتفاع، فشار اتمسفر را پیدا کنید یا با اندازه گیری فشار، ارتفاع را پیدا کنید. زیرا ساعت 1 ارتفاع بالاتر از سطح دریا است، که در آن فشار نرمال در نظر گرفته می شود، سپس عبارت را می توان تغییر داد:
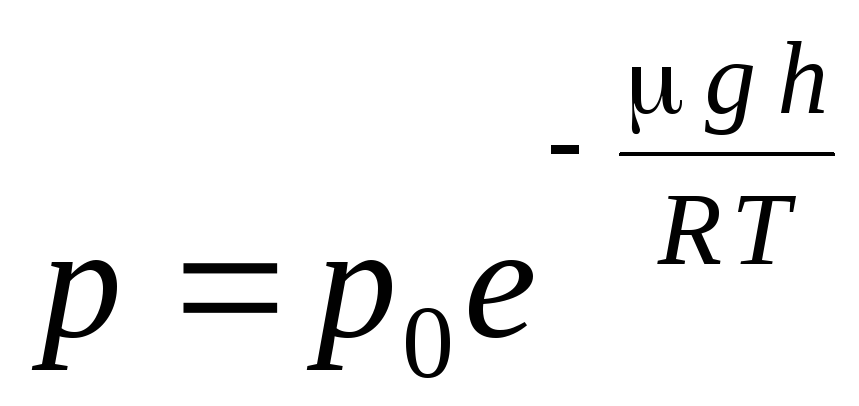 .
.
فرمول فشارسنجی را می توان با استفاده از عبارت تبدیل کرد p = nkT:
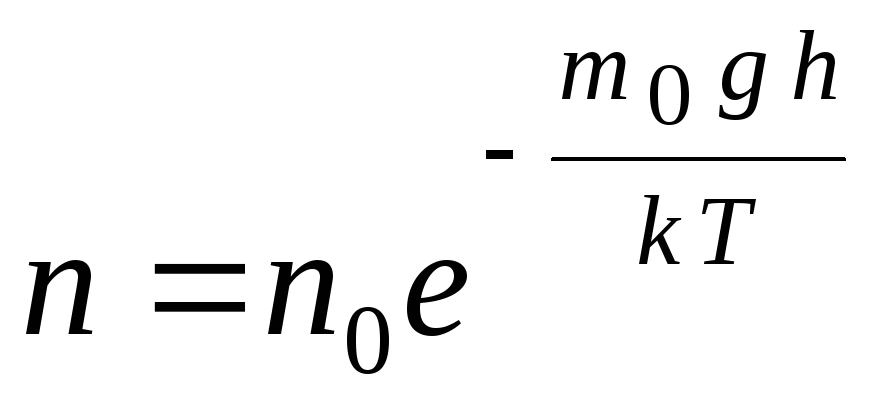 ,
,
جی  de n
–
غلظت مولکول ها در ارتفاع ساعت,
متر 0
غ=پ–
انرژی پتانسیل یک مولکول در میدان گرانشی در دمای ثابت، چگالی گاز در جایی که انرژی پتانسیل مولکول کمتر است بیشتر است. از نظر گرافیکی، قانون کاهش تعداد ذرات در واحد حجم با ارتفاع همانطور که در شکل نشان داده شده است به نظر می رسد. 1.7.
de n
–
غلظت مولکول ها در ارتفاع ساعت,
متر 0
غ=پ–
انرژی پتانسیل یک مولکول در میدان گرانشی در دمای ثابت، چگالی گاز در جایی که انرژی پتانسیل مولکول کمتر است بیشتر است. از نظر گرافیکی، قانون کاهش تعداد ذرات در واحد حجم با ارتفاع همانطور که در شکل نشان داده شده است به نظر می رسد. 1.7.
برای یک میدان پتانسیل خارجی دلخواه، عبارت کلی زیر را می نویسیم
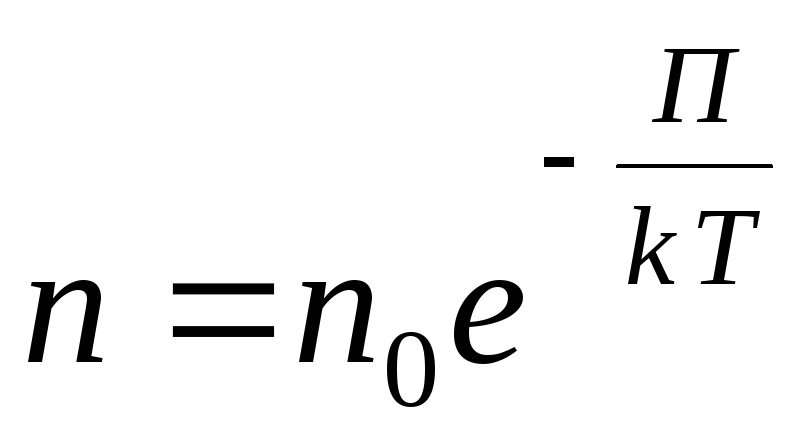 ,
,
در یک گاز کمیاب، فاصله بین مولکول ها چندین برابر بزرگتر از اندازه آنها است. در این حالت برهمکنش بین مولکول ها ناچیز است و انرژی جنبشی مولکول ها بسیار بیشتر از انرژی پتانسیل برهمکنش آنها است.
برای توضیح خواص یک ماده در حالت گازی، به جای گاز واقعی، از مدل فیزیکی آن - گاز ایده آل - استفاده می شود. مدل فرض می کند:
فاصله بین مولکول ها کمی بیشتر از قطر آنها است.
مولکول ها توپ های الاستیک هستند.
هیچ نیروی جاذبه ای بین مولکول ها وجود ندارد.
هنگامی که مولکول ها با یکدیگر و با دیواره های رگ برخورد می کنند، نیروهای دافعه عمل می کنند.
حرکت مولکولی از قوانین مکانیک پیروی می کند.
معادله اصلی برای یک گاز ایده آل mkt:
معادله اصلی MKT امکان محاسبه فشار گاز را در صورتی که جرم مولکول، میانگین مجذور سرعت و غلظت مولکول ها مشخص باشد، ممکن می سازد.
فشار گاز ایده آلدر این واقعیت نهفته است که مولکول ها در برخورد با دیواره های رگ بر اساس قوانین مکانیک به عنوان اجسام الاستیک با آنها تعامل دارند. هنگامی که یک مولکول با دیواره ظرف برخورد می کند، برآمدگی سرعت vx بردار سرعت بر روی محور OX، عمود بر دیوار، علامت خود را به عکس تغییر می دهد، اما در مقدار مطلق ثابت می ماند. بنابراین، در اثر برخورد یک مولکول با دیوار، برآمدگی تکانه آن بر روی محور OX از mv 1x = -mv x به mv 2x =mv x تغییر میکند. تغییر در تکانه یک مولکول در برخورد با دیوار باعث می شود نیروی F 1 از سمت دیوار بر روی آن وارد شود. تغییر تکانه یک مولکول برابر است با تکانه این نیرو:
در هنگام برخورد، طبق قانون سوم نیوتن، مولکول با نیروی F 2 برابر با نیروی F 1 و جهت مخالف بر دیواره وارد می شود.
مولکولهای زیادی وجود دارند و هرکدام در هنگام برخورد، حرکت یکسانی را به دیوار میدهند. در یک ثانیه آنها یک تکانه را منتقل می کنند 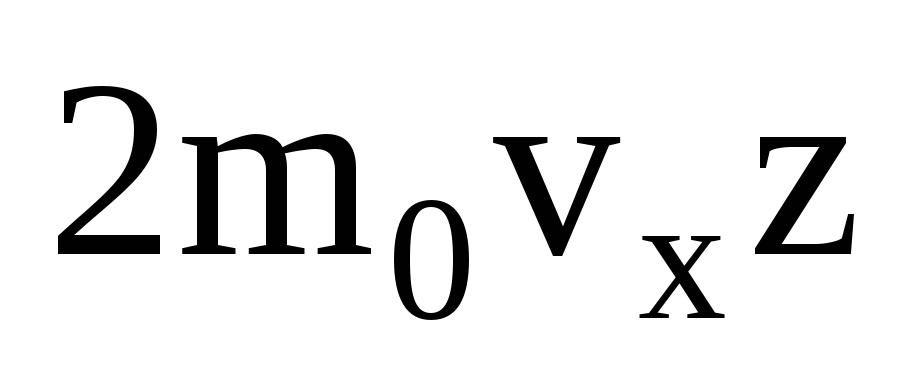 ، که z تعداد برخورد همه مولکول ها با دیواره است که متناسب با غلظت مولکول ها در گاز، سرعت مولکول ها و سطح دیواره است:
، که z تعداد برخورد همه مولکول ها با دیواره است که متناسب با غلظت مولکول ها در گاز، سرعت مولکول ها و سطح دیواره است:  . فقط نیمی از مولکول ها به سمت دیوار حرکت می کنند، بقیه در جهت مخالف حرکت می کنند:
. فقط نیمی از مولکول ها به سمت دیوار حرکت می کنند، بقیه در جهت مخالف حرکت می کنند: 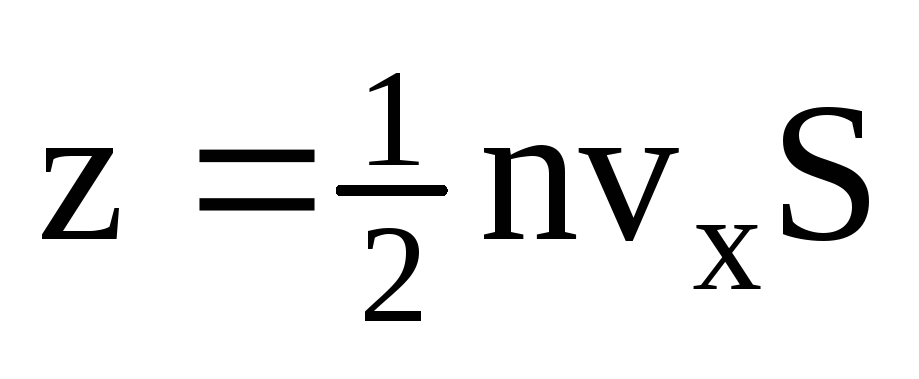 . سپس کل تکانه در 1 ثانیه به دیوار منتقل می شود:
. سپس کل تکانه در 1 ثانیه به دیوار منتقل می شود: 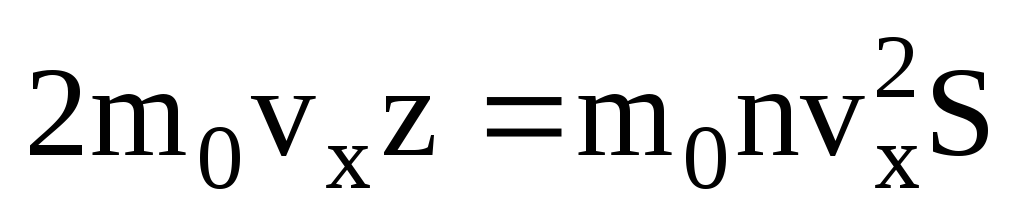 . طبق قانون دوم نیوتن، تغییر تکانه جسم در واحد زمان برابر با نیروی وارد بر آن است:
. طبق قانون دوم نیوتن، تغییر تکانه جسم در واحد زمان برابر با نیروی وارد بر آن است:
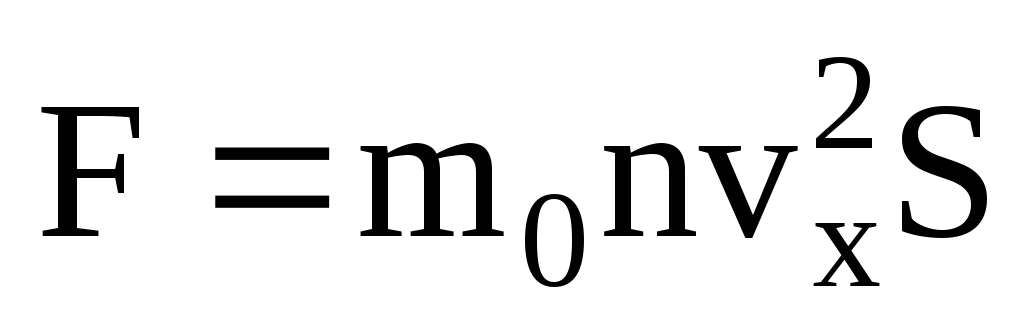
با توجه به اینکه سرعت همه مولکول ها یکسان نیست، نیروی وارد بر دیوار متناسب با مجذور میانگین سرعت خواهد بود. از آنجایی که مولکول ها در همه جهات حرکت می کنند، مقادیر میانگین مربع های پیش بینی سرعت برابر است. بنابراین، مجذور میانگین طرح سرعت برابر است با: 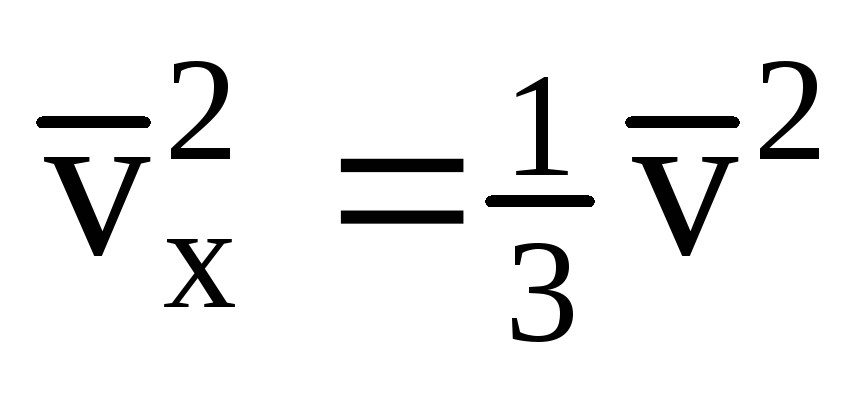 ;
;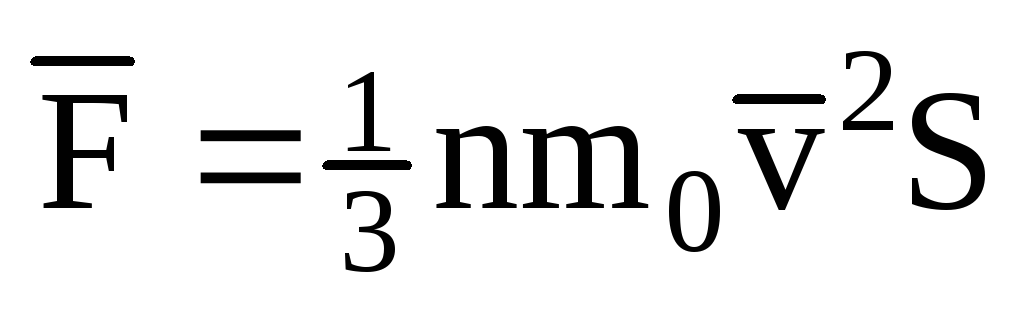 . سپس فشار گاز روی دیواره ظرف برابر است با:
. سپس فشار گاز روی دیواره ظرف برابر است با:
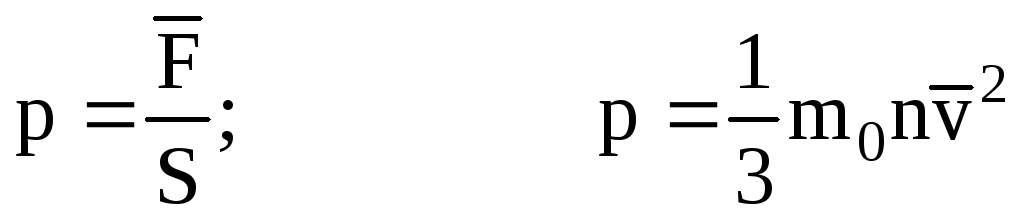 - معادله اصلی MKT.
- معادله اصلی MKT.
نشان دادن مقدار متوسط انرژی جنبشی حرکت انتقالی مولکول های گاز ایده آل:
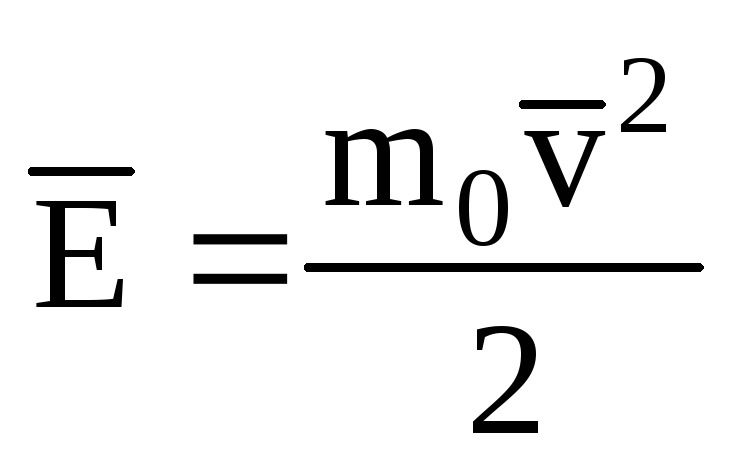 ، ما گرفتیم
، ما گرفتیم
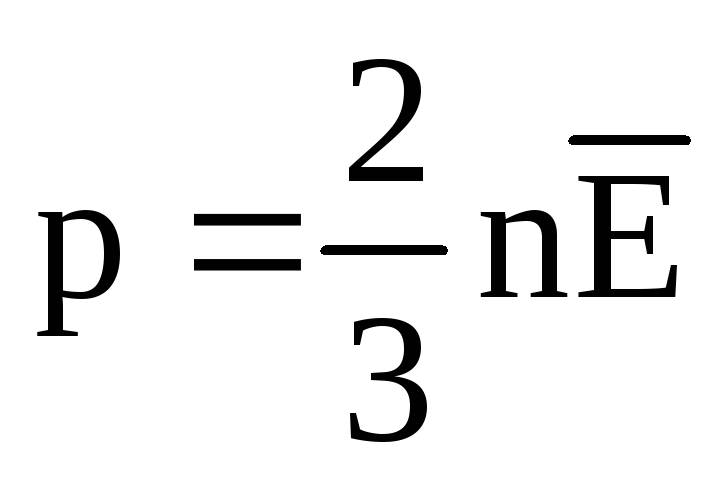
دما و اندازه گیری آن:
معادله اصلی MKT برای یک گاز ایده آل، یک پارامتر ماکروسکوپی به راحتی قابل اندازه گیری - فشار - را به پارامترهای میکروسکوپی گاز مانند میانگین انرژی جنبشی و غلظت مولکول ها مرتبط می کند. اما با اندازه گیری تنها فشار، نمی توانیم به طور جداگانه مقدار متوسط انرژی جنبشی مولکول ها یا غلظت آنها را بفهمیم. بنابراین، برای یافتن پارامترهای میکروسکوپی گاز، اندازه گیری برخی کمیت های فیزیکی دیگر مربوط به میانگین انرژی جنبشی مولکول ها مورد نیاز است. این مقدار است درجه حرارت.
هر جسم ماکروسکوپی یا گروهی از اجسام ماکروسکوپی، تحت شرایط خارجی ثابت، خود به خود به حالت تعادل حرارتی می رسد. تعادل گرمایی -این حالتی است که در آن تمام پارامترهای ماکروسکوپی برای مدت زمان دلخواه خودسرانه بدون تغییر باقی می مانند.
دما وضعیت تعادل حرارتی یک سیستم اجسام را مشخص می کند: تمام اجسام سیستم که در تعادل حرارتی با یکدیگر هستند دمای یکسانی دارند..
برای اندازه گیری دما، می توانید از تغییر در هر مقدار ماکروسکوپی بسته به دما استفاده کنید: حجم، فشار، مقاومت الکتریکی و غیره.
اغلب در عمل، از وابستگی حجم مایع (جیوه یا الکل) به دما استفاده می شود. هنگام کالیبره کردن دماسنج، دمای ذوب یخ معمولاً به عنوان نقطه مرجع (0) در نظر گرفته می شود. دومین نقطه ثابت (100) نقطه جوش آب در فشار اتمسفر معمولی (مقیاس سلسیوس) است. از آنجایی که مایعات مختلف هنگام گرم شدن به طور متفاوتی منبسط می شوند، مقیاس ایجاد شده تا حدی به خواص مایع داده شده بستگی دارد. البته 0 و 100 درجه سانتی گراد برای همه دماسنج ها مطابقت دارد، اما 50 درجه سانتی گراد مطابقت ندارد.
بر خلاف مایعات، همه گازهای کمیاب در هنگام گرم شدن به یک شکل منبسط می شوند و با تغییر دما فشار خود را به همان روش تغییر می دهند. بنابراین در فیزیک برای ایجاد یک مقیاس دمایی منطقی از تغییر فشار مقدار معینی گاز کمیاب در حجم ثابت یا تغییر حجم گاز در فشار ثابت استفاده می شود. این مقیاس گاهی اوقات نامیده می شود مقیاس دمای گاز ایده آل.
در تعادل حرارتی، میانگین انرژی جنبشی حرکت انتقالی مولکول های همه گازها یکسان است. فشار به طور مستقیم با میانگین انرژی جنبشی حرکت انتقالی مولکول ها متناسب است: 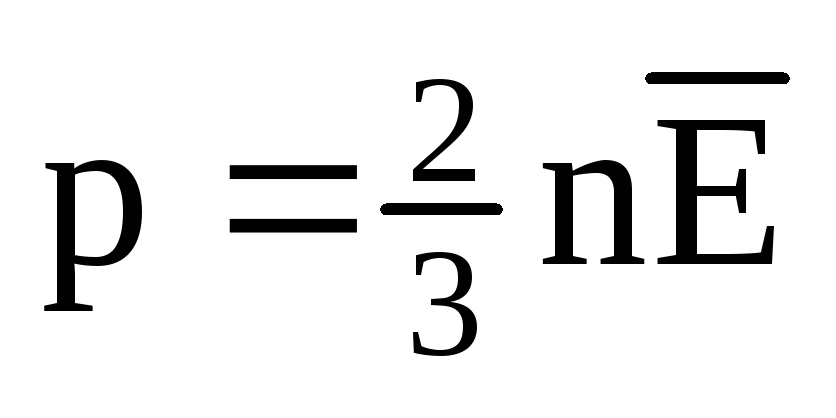 . در حالت تعادل حرارتی، اگر فشار یک گاز با جرم معین و حجم آن ثابت باشد، میانگین انرژی جنبشی مولکولهای گاز باید یک مقدار کاملاً مشخص مانند دما داشته باشد. زیرا
. در حالت تعادل حرارتی، اگر فشار یک گاز با جرم معین و حجم آن ثابت باشد، میانگین انرژی جنبشی مولکولهای گاز باید یک مقدار کاملاً مشخص مانند دما داشته باشد. زیرا 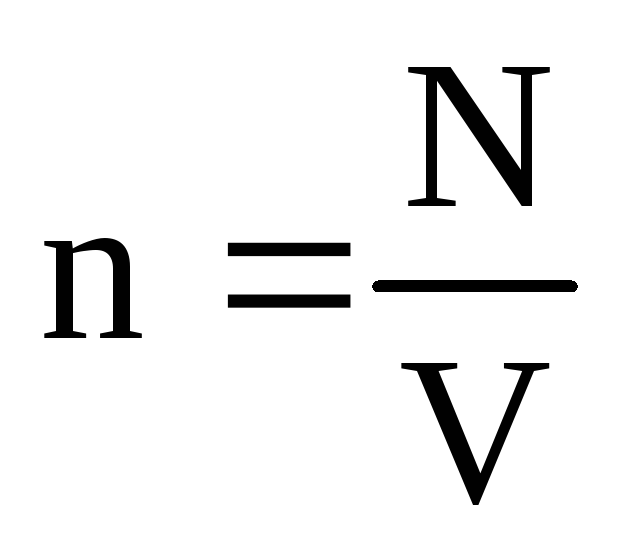 ، سپس
، سپس 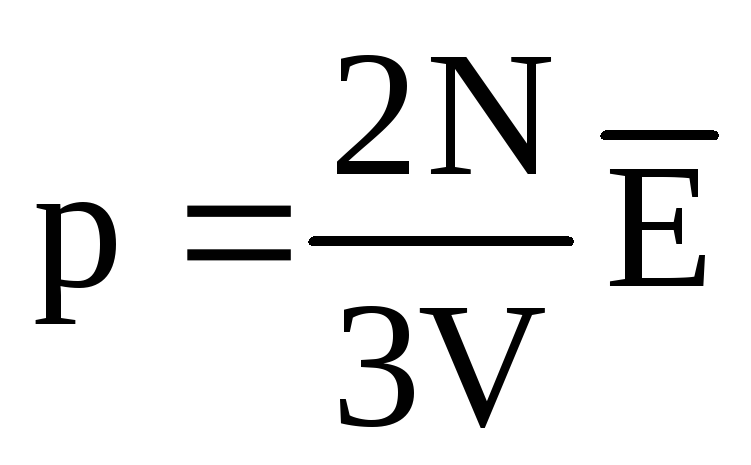 ، یا
، یا 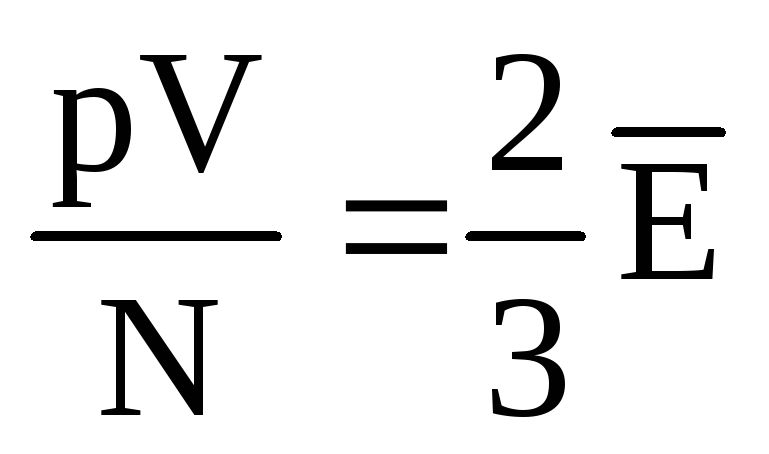 .
.
مشخص کن 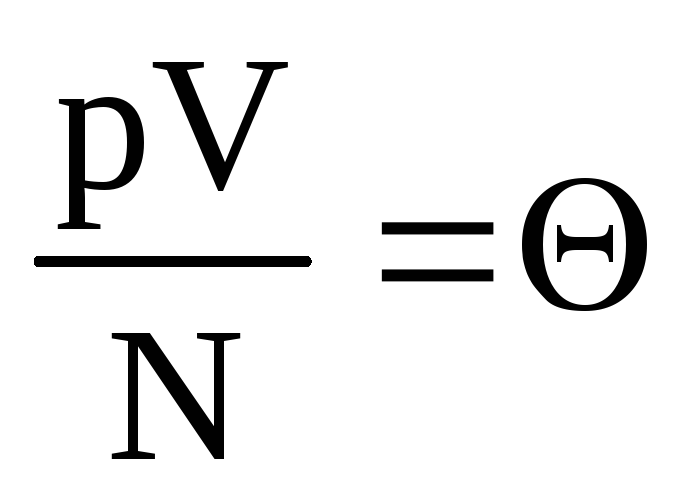 . ارزش
. ارزش  با دما افزایش می یابد و به چیزی غیر از دما بستگی ندارد. بنابراین می توان آن را معیار طبیعی دما در نظر گرفت.
با دما افزایش می یابد و به چیزی غیر از دما بستگی ندارد. بنابراین می توان آن را معیار طبیعی دما در نظر گرفت.
آیا میدانستید،
آزمایش فکری، آزمایش گدانکن چیست؟
این یک عمل وجود ندارد، یک تجربه ی ماورایی، تخیل چیزی است که واقعاً وجود ندارد. آزمایش های فکری مانند رویاهای روزانه هستند. آنها هیولا به دنیا می آورند. بر خلاف آزمایش فیزیکی، که یک آزمون آزمایشی فرضیهها است، یک «آزمایش فکری» به طور جادویی یک آزمایش تجربی را با نتیجهگیریهای مورد نظر و آزمایشنشده جایگزین میکند و ساختارهای منطقی را که در واقع خود منطق را نقض میکنند، با استفاده از مقدمات اثباتنشده بهعنوان موارد اثباتشده، دستکاری میکند. جایگزینی بنابراین، وظیفه اصلی متقاضیان "آزمایش های فکری" فریب شنونده یا خواننده با جایگزین کردن یک آزمایش فیزیکی واقعی با "عروسک" او است - استدلال ساختگی در آزادی مشروط بدون تأیید فیزیکی خود.
پر کردن فیزیک با "آزمایش های فکری" خیالی منجر به تصویری پوچ، سورئال و گیج کننده از جهان شده است. یک محقق واقعی باید اینگونه "لافی ها" را از ارزش های واقعی تشخیص دهد.
نسبیتگرایان و پوزیتیویستها استدلال میکنند که «آزمایش فکری» ابزار بسیار مفیدی برای آزمایش نظریهها (همچنین در ذهن ما) برای سازگاری است. در این کار آنها مردم را فریب می دهند، زیرا هر تأییدی فقط می تواند توسط منبعی مستقل از هدف تأیید انجام شود. خود متقاضی فرضیه نمی تواند تأییدی بر اظهارات خود باشد، زیرا دلیل این اظهارات خود عدم وجود تناقضات قابل مشاهده برای متقاضی در بیانیه است.
این را در مثال SRT و GTR می بینیم که به نوعی دین حاکم بر علم و افکار عمومی. هیچ مقدار واقعیتی که با آنها در تضاد باشد نمی تواند بر فرمول انیشتین غلبه کند: "اگر واقعیت با نظریه مطابقت ندارد، واقعیت را تغییر دهید" (در نسخه دیگری، "آیا واقعیت با نظریه مطابقت ندارد؟ - برای واقعیت خیلی بدتر است." ").
حداکثر چیزی که یک "آزمایش فکری" می تواند ادعا کند، فقط سازگاری درونی فرضیه در چارچوب منطق خود متقاضی است که اغلب به هیچ وجه درست نیست. رعایت تمرین این را بررسی نمی کند. یک آزمایش واقعی فقط می تواند در یک آزمایش فیزیکی واقعی انجام شود.
آزمایش یک آزمایش است، زیرا پالایش فکر نیست، بلکه آزمایش فکر است. فکری که در درون خود سازگار است نمی تواند خود را بیازماید. این را کورت گودل ثابت کرده است.
