ظرفیت گرمایی سولفید هیدروژن در دماهای مختلف. ظرفیت گرمایی ویژه گاز طبیعی
نه خاص، اما ظرفیت حرارتی کل، در مفهوم فیزیکی پذیرفته شده عمومی، توانایی یک ماده برای گرم شدن است. حداقل این چیزی است که هر کتاب درسی فیزیک حرارتی به ما می گوید - این هست تعریف کلاسیکظرفیت گرمایی(عبارت صحیح). در واقع این یک ویژگی فیزیکی جالب است. برای ما در زندگی روزمره "روی سکه" کمتر شناخته شده است. معلوم می شود که وقتی گرما از بیرون تامین می شود (گرم کردن، گرم کردن)، همه مواد به طور یکسان به گرما واکنش نشان نمی دهند. انرژی حرارتی) و متفاوت گرم می شود. توانایی گاز با منشاء طبیعی که به عنوان سوخت استفاده می شوددریافت، دریافت، حفظ و جمع آوری (انباشت) انرژی حرارتی ظرفیت گرمایی گازهای قابل احتراق طبیعی نامیده می شود. و خودش ظرفیت حرارتی متان، یک مشخصه فیزیکی است که خواص ترموفیزیکی سوخت گاز را توصیف می کند. در عین حال، در جنبه های مختلف کاربردی، بسته به یک مورد خاص عملی، ممکن است یک چیز برای ما مهم باشد. به عنوان مثال: توانایی یک ماده برای گرفتن گرمیا توانایی انباشته شدن انرژی حرارتییا "استعداد" برای حفظ آن. با این حال، علیرغم برخی تفاوت ها، در مفهوم فیزیکی، خواص مورد نیاز ما شرح داده خواهد شد ظرفیت حرارتی متان.
یک مشکل کوچک، اما بسیار "تند و زننده" با ماهیت اساسی این است که توانایی گرم کردن - ظرفیت حرارتی متان، به طور مستقیم نه تنها به ترکیب شیمیاییساختار مولکولی یک ماده، بلکه با کمیت آن (وزن، جرم، حجم). به دلیل چنین ارتباط «ناخوشایندی»، ژنرال ظرفیت حرارتی متانمشخصه فیزیکی بیش از حد نامناسب ماده می شود. از آنجا که، یک پارامتر اندازه گیری شده به طور همزمان "دو چیز متفاوت" را توصیف می کند. یعنی: واقعاً مشخص می کند خواص ترموفیزیکی گاز طبیعیاما «در گذر» کمیت آن را نیز در نظر می گیرد. شکل گیری یک نوع مشخصه انتگرال، که در آن فیزیک حرارتی "بالا" و مقدار "معمول" ماده (در مورد ما: سوخت گاز) به طور خودکار به هم متصل می شوند.
خوب، چرا ما به چنین ویژگی های ترموفیزیکی نیاز داریم که در آن «روان ناکافی» به وضوح ردیابی می شود؟ از نقطه نظر فیزیک، کل ظرفیت حرارتی متان(به ناشیانه ترین حالت)، سعی می کند نه تنها مقدار انرژی حرارتی را که می تواند در سوخت گاز انباشته شود، توصیف کند، بلکه "به ما اطلاع دهد" در مورد مقدار آن. گاز قابل احتراق طبیعی. به نظر می رسد پوچی، و نه روشن، قابل درک، پایدار، درست است ویژگی های ترموفیزیکی متان. به جای ثابت مفید مناسب برای عملی محاسبات ترموفیزیکی، یک پارامتر شناور به ما داده می شود که مجموع (انتگرال) مقدار گرمای دریافتی است گاز طبیعیو جرم یا حجم آن متان است.
البته از شما برای چنین "شوق"، اما مقدار گاز سوخت طبیعیمن می توانم خودم را اندازه گیری کنم. دریافت نتایج به شکل بسیار راحت تر و "انسانی". تعداد گاز قابل احتراق طبیعیمن نمی خواهم با روش های ریاضی و محاسبات با استفاده از یک فرمول پیچیده از کلی "استخراج" نکنم ظرفیت حرارتی متان، در دماهای مختلف، اما وزن (جرم) را بر حسب گرم (گرم، گرم)، کیلوگرم (کیلوگرم)، تن (تن)، مکعب (متر مکعب، متر مکعب، متر مکعب)، لیتر (l) یا میلی لیتر (میلی لیتر) دریابید. ). به خصوص از آنجایی که افراد باهوشمدتها پیش ابزارهای اندازه گیری کاملاً مناسب برای این اهداف ارائه شد. به عنوان مثال: ترازو یا وسایل دیگر.
به خصوص "طبیعت شناور مزاحم" پارامتر: عمومی ظرفیت گرمایی گاز طبیعی. خلق و خوی ناپایدار و متغیر او. هنگام تغییر "اندازه یا دوز مصرف"، ظرفیت گرمایی گاز طبیعی در دماهای مختلفبلافاصله تغییر می کند. مخلوط گاز قابل احتراق بیشتر، کمیت فیزیکی، مقدار مطلق ظرفیت حرارتی متان- افزایش. مقدار کمتر مخلوط گاز قابل احتراق، ارزش ظرفیت حرارتی متانکاهش می دهد. "بی آبرویی" برخی معلوم می شود! به عبارت دیگر، آنچه را که ما داریم به هیچ وجه نمیتوان توصیف ثابتی در نظر گرفت ویژگی های ترموفیزیکی گاز طبیعی در دماهای مختلف. و برای ما مطلوب است که یک ضریب قابل درک و ثابت، یک پارامتر مرجع که مشخص می کند "داشته باشیم" خواص حرارتیسوخت گاز، بدون «اشاره» به مقدار متان (وزن، جرم، حجم). چه باید کرد؟
اینجاست که یک روش بسیار ساده اما «بسیار علمی» به کمک ما می آید. نه تنها به ضابط دادگستری می رسد "ud. - خاص"، قبل از کمیت فیزیکی، اما به یک راه حل زیبا که شامل حذف مقدار ماده از بررسی است. به طور طبیعی، پارامترهای "ناراحت کننده، اضافی": جرم یا حجم گاز قابل احتراق طبیعیکاملا غیرممکن است که رد شود حداقل به این دلیل که اگر مقدار متان وجود نداشته باشد، خود «موضوع بحث» وجود نخواهد داشت. و ماده باید باشد. بنابراین، مقداری استاندارد مشروط جرم یا حجم را انتخاب می کنیم که می تواند واحدی مناسب برای تعیین مقدار ضریب "C" مورد نیاز ما در نظر گرفته شود. برای وزن سوخت گاز طبیعی، چنین واحد جرم متان که در استفاده عملی مناسب است، 1 کیلوگرم (کیلوگرم) است.
حالا ما یک کیلوگرم گاز طبیعی را 1 درجه گرم می کنیم و مقدار حرارت (انرژی حرارتی)باید گرم کنیم مخلوط گازیک درجه - این پارامتر فیزیکی صحیح ما است، ضریب "C"، خوب، به طور کامل و واضح یکی از آنها را توصیف می کند خواص ترموفیزیکی گاز طبیعی در دماهای مختلف. لطفاً توجه داشته باشید که اکنون ما با یک توصیف مشخصه سروکار داریم دارایی فیزیکیماده، اما تلاشی برای "اطلاع بیشتر" در مورد مقدار آن ندارد. راحت؟ هیچ حرفی نیست. موضوع کاملا متفاوت است. به هر حال، اکنون ما در مورد ژنرال صحبت نمی کنیم ظرفیت حرارتی متان. همه چیز تغییر کرده است. این گرمای خاص گاز طبیعی است، که گاهی با نام دیگری خوانده می شود. چگونه؟ فقط عظیم ظرفیت حرارتی گازهای قابل احتراق طبیعی. خاص (ud.) و جرم (m.) - در این مورد: مترادف ها، آنها در اینجا به معنای چیزی هستند که ما نیاز داریم. ضریب "C".
جدول 1. ضریب: ظرفیت حرارتی ویژه گاز طبیعی (sp.). ظرفیت حرارتی جرم گاز قابل احتراق طبیعی. داده های مرجع.
به عبارت ساده، ظرفیت گرمایی از جانببدن به مقدار گرمایی گفته می شود که باید در آن صرف شود این فرآیندتا بدن یک درجه گرم شود: .
معمولاً ظرفیت گرمایی به واحد مقدار یک ماده اطلاق می شود و بسته به واحد انتخابی، آنها را متمایز می کنند:
ظرفیت گرمایی جرم خاص با، به 1 کیلوگرم گاز، J/(kgK) اشاره می شود.
ظرفیت حرارتی حجمی خاص با´، به مقدار گاز موجود در 1 متر مکعب حجم در شرایط فیزیکی عادی، J / (m3 K) اشاره دارد.
ظرفیت گرمایی مولی ویژه μ با، به یک کیلو مول J / (kmolK) اطلاق می شود.
رابطه بین ظرفیت های گرمایی ویژه با روابط آشکار ایجاد می شود:
با= μ با/μ; با´= باρ n. (2.13)
در اینجا ρ n چگالی گاز در شرایط عادی است.
بنابراین، تغییر دمای بدن با همان مقدار گرمای عرضه شده به ماهیت فرآیند در حال انجام بستگی دارد ظرفیت گرمایی تابعی از فرآیند است. این بدان معناست که همان سیال عامل بسته به فرآیند، برای گرمایش 1 کیلو گرمای متفاوتی نیاز دارد. قدر عددی بااز + ∞ تا - ∞ متغیر است.
در محاسبات ترمودینامیکی پراهمیتدارند:
ظرفیت گرمایی در فشار ثابت
با p = δ qپ/ dT, (2.14)
q p ، در این فرآیند در فشار ثابت به بدن آورده می شود تا دمای بدن تغییر کند dT;
ظرفیت گرمایی در حجم ثابت
با v = δ q v /dT, (2.15)
برابر با نسبت مقدار گرما δ q v، در این فرآیند با حجم ثابت به بدن آورده می شود تا دمای بدن تغییر کند dT.
مطابق با قانون اول ترمودینامیک برای سیستم های بسته δ q = دو + پی دی وی.
با در نظر گرفتن این واقعیت که 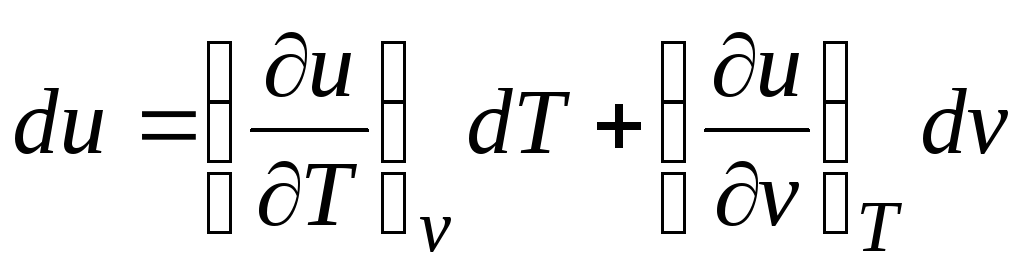 (روابط (2.1))
(روابط (2.1))
Δ q = (∂تو/∂تی) v dT + [(∂تو/∂v) تی + پ]dv. (2.16)
برای یک فرآیند ایزوکوریک ( v=const) این معادله شکل می گیرد 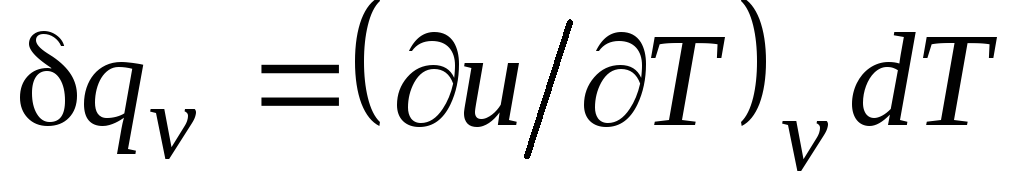 ، و با در نظر گرفتن (2.15) آن را بدست می آوریم
، و با در نظر گرفتن (2.15) آن را بدست می آوریم
ج v = (∂تو/∂تی) v . (2.17)
برای یک گاز ایده آل
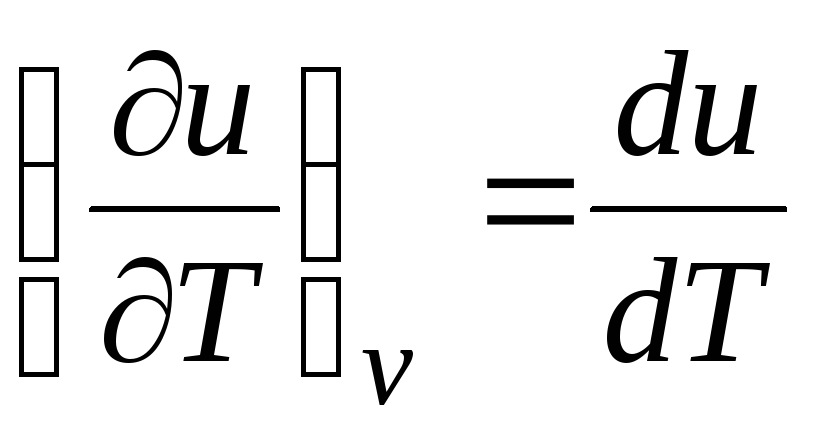 (معادله 2.2)، بنابراین
(معادله 2.2)، بنابراین
ج v = دو/dT. (2.18)
برای یک فرآیند ایزوباریک ( آر=const) از معادلات (2.16) و (2.14) بدست می آوریم
ج p = (∂ تو/∂تی) v + [(∂تو/∂v) تی + پ](dv/dT) پ
از آنجایی که انرژی درونی گاز ایده آلتنها با دمای آن تعیین می شود و به حجم خاص آن بستگی ندارد
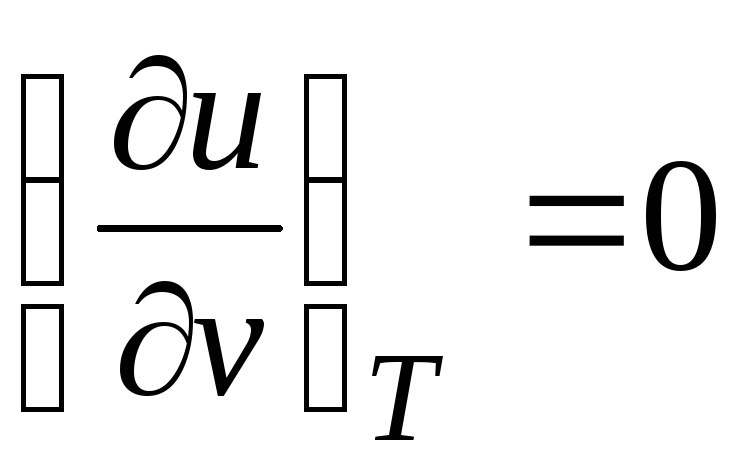 .
(2.19)
.
(2.19)
از معادله کلاپیرون (1.4) pv
= RT(1.3) به شرح زیر است 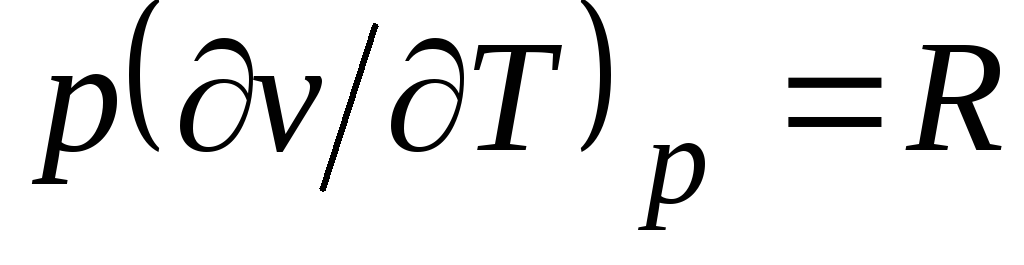 ، جایی که
، جایی که
ج p= با v + آر. (2.20)
رابطه (2.20) معادله مایر نامیده می شود و یکی از اصلی ترین ها در ترمودینامیک فنی گازهای ایده آل است.
در جریان است v\u003d const ، گرمای وارد شده به گاز فقط برای تغییر انرژی داخلی آن می رود ، در حالی که در فرآیند p \u003d const ، گرما هم برای افزایش انرژی داخلی و هم برای انجام کار انبساط صرف می شود. از همین رو ج p بیشتر با v با مقدار این کار.
فرمول ![]() به اصطلاح ظرفیت گرمایی واقعی را تعیین می کند، یعنی مقدار ظرفیت گرمایی در یک دمای معین. در عمل، ظرفیت گرمایی به طور گسترده ای برای محاسبه مقدار گرما استفاده می شود q 12، که باید برای گرم کردن بدن از یک درجه ( تی 1) به دیگری ( تی 2) (یا که پس از خنک شدن از آن آزاد می شود تی 2 به تی 1).
به اصطلاح ظرفیت گرمایی واقعی را تعیین می کند، یعنی مقدار ظرفیت گرمایی در یک دمای معین. در عمل، ظرفیت گرمایی به طور گسترده ای برای محاسبه مقدار گرما استفاده می شود q 12، که باید برای گرم کردن بدن از یک درجه ( تی 1) به دیگری ( تی 2) (یا که پس از خنک شدن از آن آزاد می شود تی 2 به تی 1).
اگر ظرفیت گرمایی در محدوده دمایی مشخص شده تغییر نکند، پس
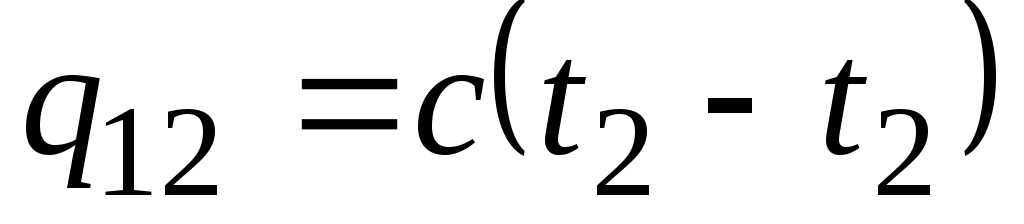 ، kJ/kg و
، kJ/kg و 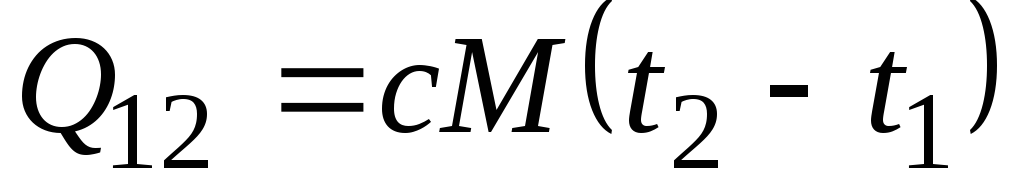 ، kJ. (2.21)
، kJ. (2.21)
از این فرمول می توان برای محاسبات تقریبی (نه خیلی دقیق) نیز استفاده کرد. به عنوان مثال، ظرفیت گرمایی ویژه آب در دمای اتاق 187/4 کیلوژول/(کیلوگرم C) و هوا 1 کیلوژول/(کیلوگرم C) است. از آنجایی که ظرفیت گرمایی تقریباً همه مواد با افزایش دما تغییر می کند (اغلب افزایش می یابد) ، به طور دقیق باید از فرمول استفاده کرد.
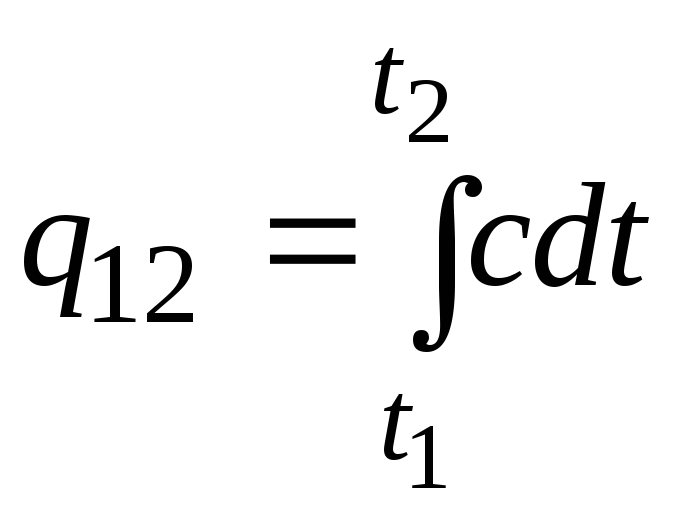 .
(2.21آ)
.
(2.21آ)
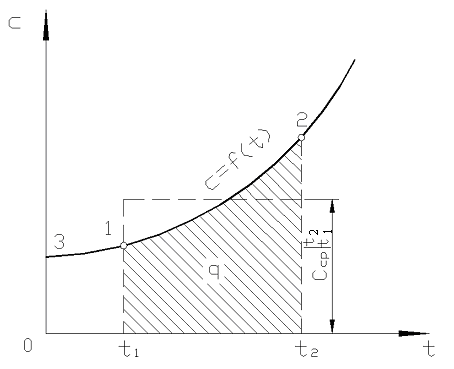
روی انجیر قدر 2.2 q 12 به عنوان یک منطقه سایه دار نشان داده شده است. به نظر می رسد که ساده ترین راه، با اعمال قضیه مقدار میانگین، نوشتن است
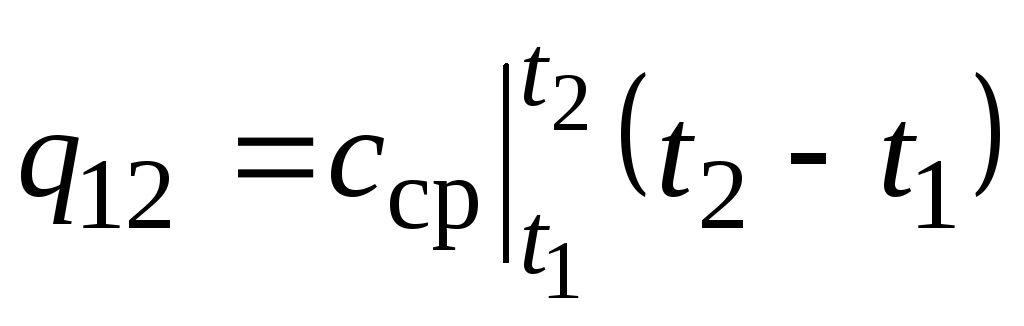 ,
(2.22)
,
(2.22)
جایی که 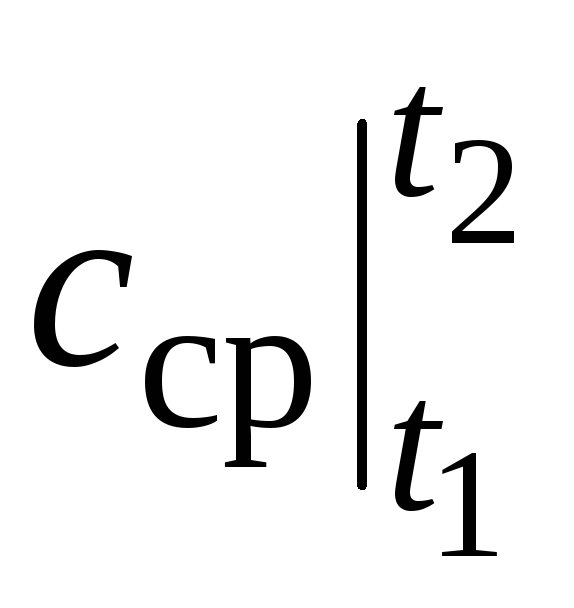 میانگین ظرفیت گرمایی در محدوده دما است تی 1 …تی 2 .
میانگین ظرفیت گرمایی در محدوده دما است تی 1 …تی 2 .
برنج. 2.2. وابستگی ظرفیت حرارتی واقعی به دما
با این حال، برای محاسبات واقعی، چنین نمادی بسیار ناخوشایند است، زیرا ظرفیت گرمایی از جداول انتخاب می شود، و  بستگی به نحوه تی 1 و از تی 2. یک جدول تابع از دو آرگومان بسیار دشوار خواهد بود.
بستگی به نحوه تی 1 و از تی 2. یک جدول تابع از دو آرگومان بسیار دشوار خواهد بود.
در عمل به صورت زیر عمل کنید. مقدار مورد نظر گرما به عنوان تفاوت بین مقادیر مورد نیاز برای گرم کردن بدن از 0 С تا دما ارائه می شود. تی 2 و تی 1 به ترتیب (شکل 2.2)
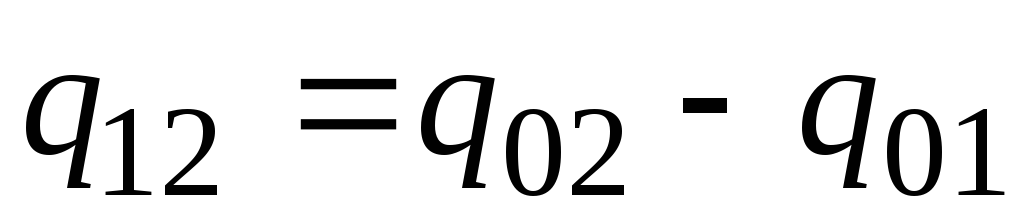 . (2.23)
. (2.23)
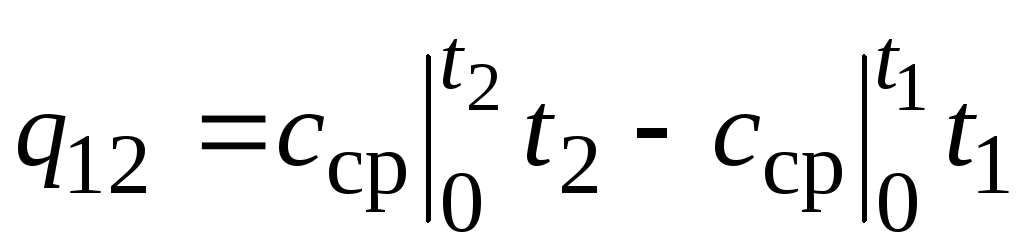 ,
(2.24)
,
(2.24)
جایی که  - ظرفیت گرمایی متوسط در محدوده دمایی 0… تیC.
- ظرفیت گرمایی متوسط در محدوده دمایی 0… تیC.
مقدار متوسط ظرفیت گرمایی  برای یک ماده معین (و یک فرآیند معین، به عنوان مثال. با آریا ج v) فقط به یک دما بستگی دارد تی. این ظرفیت های گرمایی است که در همه جداول با نام "میانگین" آورده شده است. آنچه گفته شد در مورد آن صادق است با
(با آرو ج v) و همچنین برای با و با. به عنوان مثال، جدول زیر ظرفیت گرمایی در مقابل دما را برای برخی از رایج ترین گازها نشان می دهد. لازم به تاکید است که در فرمول (2.24) دما بر حسب درجه سانتیگراد جایگزین شده است.
برای یک ماده معین (و یک فرآیند معین، به عنوان مثال. با آریا ج v) فقط به یک دما بستگی دارد تی. این ظرفیت های گرمایی است که در همه جداول با نام "میانگین" آورده شده است. آنچه گفته شد در مورد آن صادق است با
(با آرو ج v) و همچنین برای با و با. به عنوان مثال، جدول زیر ظرفیت گرمایی در مقابل دما را برای برخی از رایج ترین گازها نشان می دهد. لازم به تاکید است که در فرمول (2.24) دما بر حسب درجه سانتیگراد جایگزین شده است.
میانگین ظرفیت گرمایی مولی گازهای مختلف در آر=const
(به گفته M.P. Vukalovich، V.A. Kirillin، V.N. Timofeev)
|
تی، C |
با آر، kJ/(kmolK) |
|||||||
|
N 2 جوی | ||||||||
در این جدول مقادیر با p تا 100 С داده می شود. از آنجایی که آنها با دما تغییر زیادی نمی کنند، مقادیر میانی را می توان با برون یابی خطی پیدا کرد. به یاد بیاورید که چگونه این کار انجام می شود. مقادیر تابع جدولی وجود دارد y
= f(ایکس) در 1 (زمانی که ایکس= ایکس 1) و در 2 (زمانی که ایکس= ایکس 2). مقدار تابع در(ایکس) در ایکس 1 <ایکس<ایکس 2 برابر است 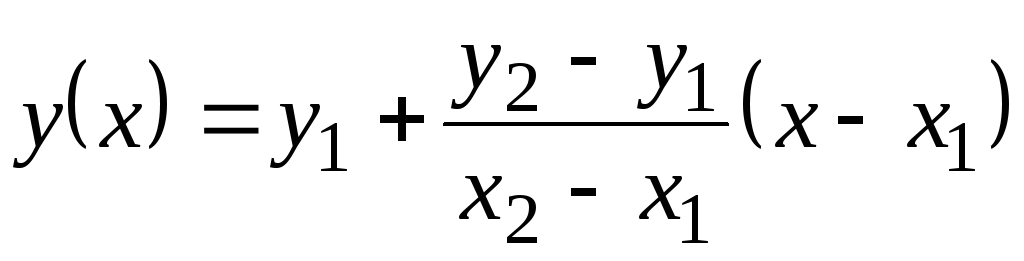 . این فرمول هم برای یک تابع افزایشی یکنواخت صادق است (زمانی که در 2 >در 1) و برای کاهش یکنواخت ( در 2 <دریک)؛ در این مورد، کسر منفی خواهد بود، زیرا ایکس 2 > ایکس 1 همیشه
. این فرمول هم برای یک تابع افزایشی یکنواخت صادق است (زمانی که در 2 >در 1) و برای کاهش یکنواخت ( در 2 <دریک)؛ در این مورد، کسر منفی خواهد بود، زیرا ایکس 2 > ایکس 1 همیشه
جدول مقادیر هدایت حرارتی گازها را بسته به دما و فشار نشان می دهد.
مقادیر هدایت حرارتی برای دماهایی در محدوده 20 کلوین (253- درجه سانتیگراد) تا 1500 کلوین (1227 درجه سانتیگراد) و فشار از 1 تا 1000 اتمسفر نشان داده شده است.
جدول با توجه به هدایت حرارتی گازهای زیر: , , freon-14 CF 4 , اتیلن C 2 H 4 . واحد هدایت حرارتی W/(m deg) است.
لازم به ذکر است که هدایت حرارتی گازها با افزایش دما و فشار افزایش می یابد. به عنوان مثال، رسانایی گرمایی گاز آمونیاک در دمای اتاق و فشار معمولی اتمسفر 0.024 W / (m deg) است و هنگامی که 300 درجه گرم می شود، هدایت حرارتی به مقدار 0.067 W / (m deg) افزایش می یابد. اگر فشار این گاز به 300 اتمسفر افزایش یابد، مقدار هدایت حرارتی حتی بیشتر شده و مقدار 0.108 W / (m deg) خواهد داشت.
توجه: مراقب باشید! هدایت حرارتی در جدول با ضریب 10 3 نشان داده شده است. تقسیم بر 1000 را فراموش نکنید!
هدایت حرارتی گازهای معدنی بسته به دما
جدول مقادیر هدایت حرارتی گازهای معدنی را بسته به دما در فشار معمولی اتمسفر نشان می دهد. مقادیر هدایت حرارتی گازها در دماهای 80 تا 1500 کلوین (-193 ... 1227 درجه سانتیگراد) نشان داده شده است.
جدول هدایت حرارتی گازهای زیر را نشان می دهد: اکسید نیتروژن N 2 O، هگزا فلوراید گوگرد SF 6، اکسید نیتریک NO، سولفید هیدروژن H 2 S، آمونیاک NH 3، دی اکسید گوگرد SO 2، بخار H 2 O، دی اکسید کربن CO 2 ، بخار آب سنگین D 2 O ، هوا.
لازم به ذکر است که هدایت حرارتی گازهای معدنی با افزایش دمای گاز افزایش می یابد.
نکته: هدایت حرارتی گازها در جدول با ضریب 10 3 نشان داده شده است. تقسیم بر 1000 را فراموش نکنید!
هدایت حرارتی گازهای آلی به عنوان تابعی از دما
جدول مقادیر هدایت حرارتی گازهای آلی و بخارات برخی مایعات را بسته به دما در فشار معمولی اتمسفر نشان می دهد. مقادیر هدایت حرارتی گازها در جدول در محدوده دمایی 120 تا 800 کلوین آورده شده است.
رسانایی حرارتی گازها و مایعات آلی زیر آورده شده است:استون CH 3 COCH 3، اکتان C 8 H 18، پنتان C 5 H 12، بوتان C 4 H 10، هگزان C 6 H 14، پروپیلن C 3 H 6، هپتان C 7 H 16، آمیل الکل C 5 H 11 OH، زایلن C 8 H 10 ، ایزوپروپیل الکل C 2 H 7 OH ، متان CH 4 ، متیل الکل CH 3 OH ، تتراکلرید کربن CCl 4 ، سیکلوهگزان C 6 H 12 ، اتان C 2 H 6 ، تترا فلوراید کربن CF 4 ، فرون-11 3، اتیل کلرید C 2 H 5 Cl، فرئون-12 CF 2 Cl 2، اتیلن C 2 H 4، فرئون-13 CF 3 Cl، اتیل فرمت HCOOC 2 H 5، فرئون-21 CHFCl 2، دی اتیل اتر (C 2 H 5) 2O.
همانطور که از جدول مشخص است، مقدار هدایت حرارتی گازهای آلی نیز با افزایش دمای گاز افزایش می یابد.
مراقب باش! هدایت حرارتی در جدول با ضریب 10 3 نشان داده شده است. تقسیم بر 1000 را فراموش نکنید!برای مثال، هدایت حرارتی بخار استون در دمای 400 کلوین (127 درجه سانتیگراد) 0.0204 W/(m deg) است.
