SI sistemindeki ısı miktarı ölçülür. Isı miktarını ölçme yöntemleri ve araçları
Sıcaklık- daha sıcak bir cisimden daha az ısıtılmış bir cisme doğrudan temas veya radyasyon yoluyla aktarılan enerji.
Sıcaklık, moleküler hareketin yoğunluğunun bir ölçüsüdür.
Belirli bir sıcaklıkta bir cismin sahip olduğu ısı miktarı kütlesine bağlıdır; Örneğin, aynı sıcaklıkta, büyük bir su bardağında küçük olandan daha fazla ısı depolanır ve bir kova soğuk suda bir bardak sudan daha fazla ısı depolanabilir. sıcak su(kovadaki suyun sıcaklığı daha düşük olmasına rağmen).
Isı, vücudunun işleyişi de dahil olmak üzere insan yaşamında önemli bir rol oynar. Gıdada bulunan kimyasal enerjinin bir kısmı, vücut sıcaklığının 37 ° C'ye yakın tutulması nedeniyle ısıya dönüştürülür. İnsan vücudunun ısı dengesi de sıcaklığa bağlıdır. çevre, ve insanlar kışın konut ve sanayi binalarını ısıtmak ve yazın soğutmak için çok fazla enerji harcamak zorunda kalıyorlar. Bu enerjinin çoğu, fosil yakıtlarla (kömür, petrol) çalışan ve elektrik üreten enerji santrallerinin kazan tesisleri ve buhar türbinleri gibi ısı motorlarından sağlanır.
18. yüzyılın sonuna kadar. Isı, bir cismin sıcaklığının miktarı tarafından belirlendiğine inanılarak, maddi bir madde olarak kabul edildi.<калорической жидкости>, veya<теплорода>. Daha sonra, B. Rumford, J. Joule ve o zamanın diğer fizikçileri, esprili deneyler ve akıl yürütme yoluyla,<калорическую>Teori, ısının ağırlıksız olduğunu ve sadece mekanik hareket nedeniyle herhangi bir miktarda elde edilebileceğini kanıtlıyor. Isı kendi başına bir madde değildir - sadece atomlarının veya moleküllerinin hareketinin enerjisidir. Modern fiziğin bağlı olduğu bu ısı anlayışıdır.
Bu yazıda, ısı ve sıcaklığın nasıl ilişkili olduğuna ve bu miktarların nasıl ölçüldüğüne bakacağız. Tartışmamızın konusu da şu sorular olacak: vücudun bir bölgesinden diğerine ısı transferi; vakumda ısı transferi (madde içermeyen bir boşluk); modern dünyada ısının rolü.
ısı ve sıcaklık
Bir maddedeki termal enerji miktarı, moleküllerinin her birinin ayrı ayrı hareketi gözlemlenerek belirlenemez. Aksine, yalnızca maddenin makroskopik özelliklerini inceleyerek, belirli bir süre boyunca ortalamaları alınmış birçok molekülün mikroskobik hareketinin özelliklerini bulabiliriz. Bir maddenin sıcaklığı, enerjisi belirli olan moleküllerin hareket yoğunluğunun ortalama göstergesidir. Termal enerji maddeler.
Sıcaklığı tahmin etmenin en tanıdık ama aynı zamanda en az doğru yollarından biri dokunmaktır. Bir nesneye dokunduğumuzda, duygularımıza odaklanarak sıcak mı yoksa soğuk mu olduğuna karar veririz. Tabii ki, bu duyumlar vücudumuzun sıcaklığına bağlıdır, bu da bizi sıcaklığın ölçülmesinde en önemlilerinden biri olan termal denge kavramına getirir.
Termal denge
A ve B cisimleri arasındaki termal denge
Açıkçası, iki A ve B gövdesi birbirine sıkıca bastırılırsa, yeterince uzun bir süre sonra onlara dokunduktan sonra sıcaklıklarının aynı olduğunu fark edeceğiz. Bu durumda A ve B cisimlerinin birbirleriyle termal dengede oldukları söylenir. Bununla birlikte, genel olarak konuşursak, cisimlerin aralarında termal dengenin olması için temas halinde olmaları gerekmez - sıcaklıklarının aynı olması yeterlidir. Bu, üçüncü C gövdesi kullanılarak doğrulanabilir, önce onu A gövdesi ile termal dengeye getirir ve ardından C ve B gövdelerinin sıcaklıklarını karşılaştırır. C gövdesi burada bir termometre rolünü oynar. Katı bir formülasyonda, bu ilke termodinamiğin sıfırıncı yasası olarak adlandırılır: A ve B cisimleri üçüncü bir C cisim ile termal dengedeyse, bu cisimler de birbirleriyle termal dengededir. Bu yasa, tüm sıcaklık ölçme yöntemlerinin temelini oluşturur.
Sıcaklık ölçümü

Sıcaklık ölçekleri

termometreler
Elektriksel etkilere dayalı termometreler
Doğru deneyler ve hesaplamalar yapmak istiyorsak, sıcak, ılık, soğuk, soğuk gibi sıcaklık derecelendirmeleri yeterli değildir - dereceli bir sıcaklık ölçeğine ihtiyacımız var. Bu tür birkaç ölçek vardır ve suyun donma ve kaynama noktaları genellikle referans noktaları olarak alınır. En yaygın dört ölçek şekilde gösterilmiştir. Suyun donma noktasının 0°'ye ve kaynama noktasının 100°'ye karşılık geldiği santigrat ölçeğine, adını 1742'de tanımlayan İsveçli astronom A. Celsius'tan alan Celsius ölçeği denir. İsveçli doğa bilimci K. Linnaeus bu ölçeği ilk kez uygulamıştır. Şimdi Celsius ölçeği dünyada en yaygın olanıdır. Suyun donma ve kaynama noktalarının son derece rahatsız edici 32 ve 212 ° sayılarına karşılık geldiği Fahrenheit sıcaklık ölçeği, 1724'te G. Fahrenheit tarafından önerildi. Fahrenheit ölçeği İngilizce konuşulan ülkelerde yaygın olarak kullanılmaktadır, ancak bilimsel literatürde pek kullanılmamaktadır. Santigrat sıcaklığını (°C) Fahrenheit sıcaklığına (°F) dönüştürmek için, °F = (9/5)°C + 32 formülü ve ters çevirme için - °C = (5/9) formülü vardır ( °F-32).
Her iki ölçek de - hem Fahrenheit hem de Celsius - sıcaklığın suyun donma noktasının altına düştüğü ve negatif bir sayı olarak ifade edildiği koşullarda deneyler yaparken çok sakıncalıdır. Bu gibi durumlar için, moleküler hareketin durması gereken nokta olan sözde mutlak sıfıra ekstrapolasyona dayanan mutlak sıcaklık ölçekleri getirildi. Bunlardan birine Rankin ölçeği, diğerine ise mutlak termodinamik ölçek denir; sıcaklıklar Rankine (°R) ve kelvin (K) dereceleriyle ölçülür. Her iki ölçek de mutlak sıfırdan başlar ve suyun donma noktası 491.7 ° R ve 273.16 K'ye karşılık gelir. Celsius ölçeğinde ve mutlak termodinamik ölçekte suyun donma ve kaynama noktaları arasındaki derece ve kelvin sayısı aynı ve eşittir. 100'e kadar; Fahrenheit ve Rankine ölçekleri için de aynıdır, ancak 180'e eşittir. Celsius dereceleri K \u003d ° C + 273.16 formülü kullanılarak kelvinlere dönüştürülür ve Fahrenheit dereceleri ° R \u003d formülü kullanılarak Rankine derecelerine dönüştürülür °F + 459.7.
Sıcaklığı ölçmek için tasarlanan cihazların çalışması, bir maddenin termal enerjisindeki bir değişiklikle ilişkili çeşitli fiziksel olaylara dayanır - elektrik direnci, hacim, basınç, radyasyon özellikleri, termoelektrik özelliklerdeki değişiklikler. En basit ve en tanıdık sıcaklık ölçüm cihazlarından biri, şekilde gösterilen cam termometredir. Termometrenin alt kısmındaki c bilyesi, sıcaklığı ölçülecek cisme karşı ortama yerleştirilir veya bastırılır ve bilyenin ısı almasına veya vermesine, genleşmesine veya büzülmesine bağlı olarak kolonu yükselir veya düşer. kılcal damar. Termometre önceden kalibre edilmişse ve bir ölçekle donatılmışsa, vücut sıcaklığını doğrudan öğrenebilirsiniz.
Eylemi termal genleşmeye dayanan bir diğer cihaz bimetal termometredir. Ana elemanı, farklı termal genleşme katsayılarına sahip iki lehimli metalden oluşan bir spiral plakadır. Isıtıldığında, metallerden biri diğerinden daha fazla genleşir, spiral bükülür ve oku ölçeğe göre döndürür. Bu tür cihazlar genellikle iç ve dış hava sıcaklığını ölçmek için kullanılır, ancak yerel sıcaklığı belirlemek için uygun değildir.
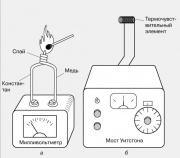
Yerel sıcaklık genellikle, bir ucunda lehimlenmiş iki farklı metal teli olan bir termokupl kullanılarak ölçülür. Böyle bir bağlantı ısıtıldığında, tellerin serbest uçlarında genellikle birkaç milivoltluk bir EMF ortaya çıkar. Termokupllar farklı metal çiftlerinden yapılır: demir ve konstantan, bakır ve konstantan, krom ve alümel. Termo-EMF'leri, geniş bir sıcaklık aralığında sıcaklıkla neredeyse doğrusal olarak değişir.
Başka bir termoelektrik etki de bilinmektedir - iletken bir malzemenin direncinin sıcaklığa bağımlılığı. Biri şekilde gösterilen elektrik dirençli termometrelerin çalışmasının temelini oluşturur. Küçük bir sıcaklık algılama elemanının (termokupl) - genellikle ince tel bobinleri - direnci, bir Wheatstone köprüsü kullanılarak kalibre edilmiş bir değişken direncin direnci ile karşılaştırılır. Çıkış enstrümanı doğrudan derece olarak derecelendirilebilir.
Optik pirometreler, görünür ışık yayan sıcak cisimlerin sıcaklığını ölçmek için kullanılır. Bu cihazın bir versiyonunda, vücut tarafından yayılan ışık, içinden yayan cismin görüntülendiği dürbünün odak düzlemine yerleştirilmiş bir akkor lamba filamanının radyasyonu ile karşılaştırılır. Lamba filamanını ısıtan elektrik akımı, filamanın ve gövdenin parlaklığını görsel olarak karşılaştırırken, aralarında termal dengenin kurulduğu bulunana kadar değiştirilir. Cihazın ölçeği doğrudan sıcaklık birimlerinde derecelendirilebilir.
Teknik gelişmeler son yıllar yeni sıcaklık sensörleri oluşturmaya izin verilir. Örneğin, özellikle yüksek hassasiyetin gerekli olduğu durumlarda, bir termokupl veya geleneksel bir dirençli termometre yerine, bir yarı iletken cihaz - termistör kullanılır. Faz durumlarını değiştiren boyalar ve sıvı kristaller, özellikle vücut yüzey sıcaklığının geniş bir aralıkta değiştiği durumlarda termal dönüştürücü olarak da kullanılır. Son olarak, her rengin belirli bir sıcaklığa karşılık geldiği koşullu renklerde bir nesnenin kızılötesi görüntüsünün elde edildiği kızılötesi termografi kullanılır. Bu sıcaklık ölçümü yöntemi en geniş uygulamayı bulur - tıbbi teşhis binaların ısı yalıtımını kontrol etmeden önce.
Isı miktarını ölçmek
su kalorimetresi
Bir cismin termal enerjisi (ısı miktarı) doğrudan kalorimetre denilen bir aletle ölçülebilir; Böyle bir cihazın basit bir versiyonu şekilde gösterilmiştir. İçindeki sıcaklığı ölçmek için cihazlarla donatılmış ve bazen su gibi bilinen özelliklere sahip bir çalışma sıvısı ile doldurulmuş, dikkatlice yalıtılmış kapalı bir kaptır. Isıtılmış küçük bir gövdedeki ısı miktarını ölçmek için bir kalorimetreye yerleştirilir ve sistemin termal dengeye gelmesini bekler. Kalorimetreye (daha doğrusu onu dolduran suya) aktarılan ısı miktarı, su sıcaklığındaki artışla belirlenir.
Yanma gibi bir kimyasal reaksiyon sırasında açığa çıkan ısı miktarı, küçük bir<бомбу>. AT<бомбе>ateşleme için elektrik kablolarının bağlı olduğu bir numune ve buna karşılık gelen oksijen miktarı bulunur. Numune tamamen yandıktan ve termal denge kurulduktan sonra kalorimetredeki suyun sıcaklığının ne kadar arttığı ve dolayısıyla açığa çıkan ısı miktarı belirlenir.
Isı birimleri
Isı bir enerji şeklidir ve bu nedenle enerji birimleriyle ölçülmelidir. Uluslararası SI sisteminde enerjinin birimi joule'dür (J). Isı - kalori miktarının sistem dışı birimlerinin kullanılmasına da izin verilir: uluslararası bir kalori 4.1868 J, bir termokimyasal kalori 4.1840 J'dir. Yabancı laboratuvarlarda, araştırma sonuçları genellikle sözde kullanılarak ifade edilir. 4.1855 J'ye eşit 15 derecelik bir kalori. Sistem dışı İngiliz Termal Birimi (BTU) kullanımdan kaldırılıyor: BTU ort = 1.055 J.
Isı kaynakları
Ana ısı kaynakları, kimyasal ve nükleer reaksiyonlar ile çeşitli enerji dönüşüm süreçleridir. Isının açığa çıktığı kimyasal reaksiyonların örnekleri, yanma ve gıda bileşenlerinin parçalanmasıdır. Dünya tarafından alınan ısının neredeyse tamamı, Güneş'in derinliklerinde meydana gelen nükleer reaksiyonlar tarafından sağlanır. İnsanoğlu, kontrollü nükleer fisyon süreçleri yardımıyla ısı elde etmeyi öğrenmiş ve şimdi de aynı amaç için termonükleer füzyon reaksiyonlarını kullanmaya çalışmaktadır. Mekanik iş ve elektrik enerjisi gibi diğer enerji türleri de ısıya dönüştürülebilir. Termal enerjinin (diğerleri gibi) yalnızca başka bir forma dönüştürülebileceğini, ancak elde edilemeyeceğini hatırlamak önemlidir.<из ничего>, ne de yok etmek. Bu, termodinamik denilen bilimin temel ilkelerinden biridir.
Termodinamik
Termodinamikısı, iş ve madde arasındaki ilişkinin bilimidir. Bu ilişkilerle ilgili modern fikirler, Carnot, Clausius, Gibbs, Joule, Kelvin ve diğerleri gibi geçmişin büyük bilim adamlarının çalışmaları temelinde oluşturulmuştur.Termodinamik, bir maddenin ısı kapasitesinin ve termal iletkenliğinin anlamını açıklar. cisimlerin termal genleşmesi ve faz geçişlerinin ısısı. Bu bilim, deneysel olarak oluşturulmuş birkaç yasaya - ilkeye dayanmaktadır.
Maddelerin ısısı ve özellikleri
Çeşitli maddeler termal enerji biriktirmek için farklı yeteneklere sahip olmak; moleküler yapılarına ve yoğunluklarına bağlıdır. Bir maddenin birim kütlesinin sıcaklığını bir derece artırmak için gereken ısı miktarına öz ısı kapasitesi denir. Isı kapasitesi, maddenin bulunduğu koşullara bağlıdır. Örneğin, bir balondaki bir gram havayı 1 K ısıtmak için, onu aynı şekilde sert duvarlı kapalı bir kapta ısıtmaktan daha fazla ısı gerekir, çünkü balona verilen enerjinin bir kısmı balonu genişletmek için harcanır. hava ve ısıtma değil. Bu nedenle, özellikle gazların ısı kapasitesi, sabit basınçta ve sabit hacimde ayrı ayrı ölçülür.
Sıcaklıktaki bir artışla, moleküllerin kaotik hareketinin yoğunluğu artar - çoğu madde ısıtıldığında genişler. Sıcaklığı 1 K artan bir maddenin genleşme derecesine denir. termal Genleşme katsayısı.
Bir maddenin bir fazdan diğerine, örneğin katıdan sıvıya (ve bazen hemen gaz haline) geçmesi için belirli bir miktarda ısı alması gerekir. ısıtılırsa sağlam sonra sıcaklığı erimeye başlayana kadar yükselir; erime tamamlanana kadar, ısı girdisine rağmen vücudun sıcaklığı sabit kalacaktır. Bir maddenin birim kütlesini eritmek için gereken ısı miktarına erime ısısı denir. Isı vermeye devam ederseniz, erimiş madde kaynama noktasına kadar ısınır. Bir sıvının birim kütlesini belirli bir sıcaklıkta buharlaştırmak için gereken ısı miktarına buharlaşma ısısı denir.
Isının rolü ve kullanımı
Bir buhar türbini santralinin çalışma şeması
Soğutma döngüsü şeması
Küresel ısı transferi süreçleri, güneş radyasyonu ile Dünya'yı ısıtmaya indirgenmez. Atmosferdeki büyük konveksiyon akımları, dünya genelinde hava koşullarındaki günlük değişiklikleri belirler. Ekvator ve kutup bölgeleri arasındaki atmosferdeki sıcaklık farklılıkları, Dünya'nın dönmesinden kaynaklanan Coriolis kuvvetleriyle birlikte, alize rüzgarları, jet akımları ve sıcak ve soğuk cepheler gibi sürekli değişen konveksiyon akımlarının ortaya çıkmasına neden olur.
Dünyanın erimiş çekirdeğinden yüzeyine ısı transferi (termal iletkenlik nedeniyle) volkanik patlamalara ve gayzerlerin ortaya çıkmasına neden olur. Bazı bölgelerde jeotermal enerji, alan ısıtma ve elektrik üretimi için kullanılmaktadır.
Sıcaklık, hemen hemen hepsinde vazgeçilmez bir katılımcıdır. üretim süreçleri. Metallerin eritilmesi ve işlenmesi, motorların çalışması, gıda üretimi, kimyasal sentez, petrol arıtma, tuğla ve tabaklardan arabalara ve elektronik cihazlara kadar çeşitli ürünlerin imalatı gibi en önemlilerinden bahsedeceğiz.
Termik santrallerin yanı sıra birçok endüstriyel üretim ve ulaşım, ısı motorları - ısıyı faydalı işe dönüştüren cihazlar - olmadan çalışamadı. Bu tür makinelere örnek olarak kompresörler, türbinler, buhar, benzin ve jet motorları verilebilir.
En iyi bilinen ısı motorlarından biri, modern enerji santrallerinde kullanılan Rankine döngüsünün bir bölümünü uygulayan buhar türbinidir. Bu döngünün basitleştirilmiş bir diyagramı şekilde gösterilmiştir. Çalışma sıvısı - su - fosil yakıtların (kömür, petrol veya doğal gaz) yakılmasıyla ısıtılan bir buhar kazanında aşırı ısıtılmış buhara dönüştürülür. Buhar yüksek
Gasovik - endüstriyel gaz ekipmanı GOST, SNiP, PB Dizini Fiziksel nicelik birimleri, fiziko-kimyasal kavramlar, oranlar, gazların bileşimi ve özellikleri
Sıcaklık ve ısı miktarı için ölçü birimleri
Sıcaklık ölçümünün temel birimi, pratikte Santigrat derecesine karşılık gelen Uluslararası Sıcaklık Ölçeğinin derecesiydi. Bu değer, 0 ile 100 °C arasındaki, yani 760 mm Hg basınçta buzun ve kaynayan suyun erime noktaları arasındaki sıcaklık aralığının 1/100'üne eşittir. Sanat.
Mutlak sıcaklık, mutlak sıfırdan, yani -273.16 ° C'den ölçülen ve Kelvin (° K) derece cinsinden ölçülen sıcaklıktır. Kelvin derecesi Celsius derecesi ile aynıdır. Bu nedenle, mutlak sıcaklık derece santigrat olarak aşağıdaki gibi ifade edilir:
T, °K = t, °C + 273.16
SI sisteminde sıcaklık birimi Kelvin'dir. Ölçekte orijine (sıfır konumu) bağlı olarak Kelvin derecesi ile birlikte Celsius derecesini kullanarak sıcaklık ölçümlerinin pratik sonuçlarını ifade etmesine izin verilir.
Örnek: 250 ±5 °С = 523,16 ±5 °K.
SI sisteminde iş, enerji ve ısı joule (J) cinsinden ölçülür. Bazen pratik amaçlar için daha büyük ve daha uygun bir birim kullanılır - 1000 J'ye eşit bir kilojoule (kJ). SI'daki bir iş birimi, 1 m'lik bir yer değiştirmede 1 N'lik bir kuvvet tarafından yapılan iştir. fiziksel miktar vücudun ne kadar iş yapabileceğini gösterir.
Kaloriler ve kilokaloriler sistem dışı ısı birimleri olarak kullanılabilir. Kalori, 1 gram suyun sıcaklığını 1°C (19,5 ila 20,5°C) yükseltmek için gereken ısı miktarıdır.
1 kalori (kalori) = 4,1868 J;
1 kcal (kilokalori) \u003d 1000 cal \u003d 4186.8 J \u003d 4.187 kJ;
1 Mcal (megakalori) \u003d 10 6 cal \u003d 4.1868 MJ;
1 Gcal (gigakalori) \u003d 10 9 cal \u003d 4186.8 MJ.
Karşılaştırma için, yakıtı değerlendirirken, hesaplama için kalorifik değerinin koşullu olarak 7 Mcal/kg veya 7 Gcal/t'ye eşit olduğu varsayılan koşullu ısı kullanılır. Bu gibi durumlarda sırasıyla 1 kg veya 1 ton standart yakıttan (t.c.f.) bahsedilir.
Isı, vücudunun işleyişi de dahil olmak üzere insan yaşamında önemli bir rol oynar. Yiyeceklerde bulunan kimyasal enerjinin bir kısmı, vücut sıcaklığının 37 civarında tutulması nedeniyle ısıya dönüştürülür.
° C. İnsan vücudunun ısı dengesi aynı zamanda ortam sıcaklığına da bağlıdır ve insanlar kışın konut ve endüstriyel binaları ısıtmak ve yazın soğutmak için çok fazla enerji harcamak zorunda kalırlar. Bu enerjinin çoğu, fosil yakıtlarla (kömür, petrol) çalışan ve elektrik üreten enerji santrallerinin kazan tesisleri ve buhar türbinleri gibi ısı motorlarından sağlanır.18. yüzyılın sonuna kadar. ısı, bir cismin sıcaklığının, içerdiği "kalorik sıvı" veya "kalori" miktarı tarafından belirlendiğine inanılarak maddi bir madde olarak kabul edildi. Daha sonra, B. Rumford, J. Joule ve o zamanın diğer fizikçileri, ustaca deneyler ve akıl yürütme yoluyla, ısının ağırlıksız olduğunu ve sadece mekanik hareket nedeniyle herhangi bir miktarda elde edilebileceğini kanıtlayarak "kalori" teorisini çürüttüler. Isının kendisi bir madde değildir, sadece atomlarının veya moleküllerinin hareketinin enerjisidir. Modern fiziğin bağlı olduğu bu ısı anlayışıdır. Ayrıca bakınız FİZİK.
Bu yazıda, ısı ve sıcaklığın nasıl ilişkili olduğuna ve bu miktarların nasıl ölçüldüğüne bakacağız. Tartışmamızın konusu da şu sorular olacak: vücudun bir bölgesinden diğerine ısı transferi; vakumda ısı transferi (madde içermeyen bir boşluk); modern dünyada ısının rolü.
ISI VE SICAKLIK Bir maddedeki termal enerji miktarı, moleküllerinin her birinin ayrı ayrı hareketi gözlemlenerek belirlenemez. Aksine, yalnızca maddenin makroskopik özelliklerini inceleyerek, belirli bir süre boyunca ortalamaları alınmış birçok molekülün mikroskobik hareketinin özelliklerini bulabiliriz. Bir maddenin sıcaklığı, enerjisi bir maddenin termal enerjisi olan moleküllerin hareket yoğunluğunun ortalama bir göstergesidir.Dokunarak sıcaklığı değerlendirmenin en tanıdık, ancak aynı zamanda en az doğru yollarından biri. Bir nesneye dokunduğumuzda, duygularımıza odaklanarak sıcak mı yoksa soğuk mu olduğuna karar veririz. Tabii ki, bu duyumlar vücudumuzun sıcaklığına bağlıdır, bu da bizi sıcaklığın ölçülmesinde en önemlilerinden biri olan termal denge kavramına getirir.
Termal denge. Açıkçası, eğer iki beden bir ve B (Şek. 1) Birbirlerine sıkıca bastırın, yeterince uzun bir süre sonra onlara dokunduktan sonra sıcaklıklarının aynı olduğunu fark edeceğiz. Bu durumda, cesetlerin olduğu söylenir. bir ve B birbirleriyle termal dengededir. Ancak cisimlerin genel olarak aralarında ısıl dengenin olması için temas halinde olmaları gerekmez, sıcaklıklarının aynı olması yeterlidir. Bu, üçüncü gövde kullanılarak doğrulanabilir C , vücut ile termal dengeye ilk getirerek A ve sonra vücutların sıcaklıklarını karşılaştırmak C ve b. Gövde C burada bir termometrenin rolünü oynar. Katı bir formülasyonda, bu ilkeye termodinamiğin sıfırıncı yasası denir: A ve B cisimleri üçüncü bir C cismi ile termal dengedeyse, bu cisimler de birbirleriyle termal dengededir. Bu yasa, tüm sıcaklık ölçme yöntemlerinin temelini oluşturur.Sıcaklık ölçümü. Doğru deneyler ve hesaplamalar yapmak istiyorsak, sıcak, ılık, soğuk, soğuk gibi sıcaklık derecelendirmeleri yeterli değil, dereceli bir sıcaklık ölçeğine ihtiyacımız var. Bu tür birkaç ölçek vardır ve suyun donma ve kaynama noktaları genellikle referans noktaları olarak alınır. En yaygın dört ölçek, Şek. 2. Santigrat ölçeği, suyun donma noktasının 0'a karşılık geldiğine göre° ve kaynama noktası 100° , adını 1742'de İsveçli gökbilimci A. Celsius'tan alan Celsius ölçeği olarak adlandırılır. Bu ölçeği ilk kullananın İsveçli doğa bilimci K. Linney olduğuna inanılır. Şimdi Celsius ölçeği dünyada en yaygın olanıdır. Suyun donma ve kaynama noktalarının son derece rahatsız edici 32 ve 212 sayılarına karşılık geldiği Fahrenheit sıcaklık ölçeği° , 1724 yılında G. Fahrenheit tarafından önerildi. Fahrenheit ölçeği İngilizce konuşulan ülkelerde yaygın olarak kullanılmaktadır, ancak bilimsel literatürde pek kullanılmamaktadır. Sıcaklığı Celsius'a çevirmek için (° C) Fahrenheit sıcaklığına (° F) bir formül var° F = (9/5) ° C + 32 ve ters çeviri formülü için°C = (5/9)(°F - 32). Hem Fahrenheit hem de Celsius ölçeği, sıcaklığın suyun donma noktasının altına düştüğü ve negatif bir sayı olarak ifade edildiği koşullarda deneyler yaparken çok sakıncalıdır. Bu gibi durumlar için, moleküler hareketin durması gereken nokta olan sözde mutlak sıfıra ekstrapolasyona dayanan mutlak sıcaklık ölçekleri getirilmiştir. Bunlardan birine Rankin ölçeği, diğerine ise mutlak termodinamik ölçek denir; sıcaklıklar derece Rankine (° R) ve kelvins (K). Her iki ölçek de mutlak sıfırdan başlar ve suyun donma noktası 491.7'dir.° R ve 273,16 K. Celsius ölçeğinde ve mutlak termodinamik ölçekte suyun donma ve kaynama noktaları arasındaki derece ve kelvin sayısı aynı ve 100'e eşittir; Fahrenheit ve Rankine ölçekleri için de aynıdır, ancak 180'e eşittir. Santigrat derece, K \u003d formülü kullanılarak kelvinlere dönüştürülür° C + 273.16 ve Fahrenheit derecesini Rankine derecesine göre formül kullanarak°R = °F + 459.7. Sıcaklığı ölçmek için tasarlanmış cihazların çalışması, bir maddenin termal enerjisindeki bir değişiklik, elektrik direncindeki, hacimdeki, basınçtaki, ışınımsal özelliklerdeki ve termoelektrik özelliklerdeki değişikliklerle ilişkili çeşitli fiziksel olaylara dayanır. Sıcaklığı ölçmek için en basit ve en bilinen araçlardan biri, Şekil 2'de gösterilen cam içinde cıva termometresidir. 3, a. Termometrenin alt kısmındaki cıvalı bilye, sıcaklığını ölçmek istediği cisme ortama yerleştirilir veya bastırılır ve topun ısı almasına veya vermesine bağlı olarak cıva genişler veya büzülür ve kolonu yükselir veya kılcal damara düşer. Termometre önceden kalibre edilmişse ve bir ölçekle donatılmışsa, vücut sıcaklığını doğrudan öğrenebilirsiniz.Çalışması ısıl genleşmeye dayalı olan bir diğer cihaz, Şekil 2'de gösterilen bimetal termometredir.
3, b. Ana unsuru farklı termal genleşme katsayılarına sahip iki lehimli metalden oluşan spiral plaka. Isıtıldığında, metallerden biri diğerinden daha fazla genleşir, spiral bükülür ve oku ölçeğe göre döndürür. Bu tür cihazlar genellikle iç ve dış hava sıcaklığını ölçmek için kullanılır, ancak yerel sıcaklığı belirlemek için uygun değildir.Yerel sıcaklık genellikle, bir ucunda lehimlenmiş iki farklı metal teli olan bir termokupl kullanılarak ölçülür (Şek.
4, a). Böyle bir bağlantı ısıtıldığında, tellerin serbest uçlarında genellikle birkaç milivoltluk bir emk ortaya çıkar. Termokupllar farklı metal çiftlerinden yapılır: demir ve konstantan, bakır ve konstantan, krom ve alümel. Termo-EMF'leri, geniş bir sıcaklık aralığında sıcaklıkla neredeyse doğrusal olarak değişir.Başka bir termoelektrik etki de bilinmektedir - iletken bir malzemenin direncinin sıcaklığa bağımlılığı. Biri Şekil 2'de gösterilen elektrik dirençli termometrelerin çalışmasının temelini oluşturur.
4, b. Küçük bir sıcaklığa duyarlı elemanın (termal sensör) direnci, genellikle ince tel bobinlerinin direnci, bir Wheatstone köprüsü kullanılarak kalibre edilmiş bir değişken direncin direnci ile karşılaştırılır. Çıkış enstrümanı doğrudan derece olarak derecelendirilebilir.Optik pirometreler, görünür ışık yayan akkor cisimlerin sıcaklığını ölçmek için kullanılır. Bu cihazın bir versiyonunda, vücut tarafından yayılan ışık, içinden yayan cismin görüntülendiği dürbünün odak düzlemine yerleştirilmiş bir akkor lamba filamanının radyasyonu ile karşılaştırılır. Lamba filamanını ısıtan elektrik akımı, filamanın ve gövdenin parlamasının görsel bir karşılaştırması, aralarında termal dengenin kurulduğunu ortaya çıkarana kadar değiştirilir. Cihazın ölçeği doğrudan sıcaklık birimlerinde derecelendirilebilir.
Son yıllardaki teknik gelişmeler, yeni sıcaklık sensörleri oluşturmayı mümkün kılmıştır. Örneğin, özellikle yüksek hassasiyetin gerekli olduğu durumlarda, termokupl veya konvansiyonel dirençli termometre yerine yarı iletken bir cihaz olan termistör kullanılır. Faz durumlarını değiştiren boyalar ve sıvı kristaller, özellikle vücut yüzey sıcaklığının geniş bir aralıkta değiştiği durumlarda termal dönüştürücü olarak da kullanılır. Son olarak, her rengin belirli bir sıcaklığa karşılık geldiği koşullu renklerde bir nesnenin kızılötesi görüntüsünün elde edildiği kızılötesi termografi kullanılır. Bu sıcaklık ölçümü yöntemi, tıbbi teşhisten odaların ısı yalıtımını kontrol etmeye kadar en geniş uygulamayı bulur. Ayrıca bakınız KATI HAL FİZİKLERİ; LİKİT KRİSTAL.
Isı miktarının ölçülmesi. Bir cismin termal enerjisi (ısı miktarı) doğrudan kalorimetre denilen bir aletle ölçülebilir; Böyle bir cihazın basit bir versiyonu Şekil 2'de gösterilmektedir. 5. Bu, içindeki sıcaklığı ölçmek için cihazlarla donatılmış ve bazen su gibi bilinen özelliklere sahip bir çalışma sıvısı ile doldurulmuş, dikkatlice yalıtılmış kapalı bir kaptır. Isıtılmış küçük bir gövdedeki ısı miktarını ölçmek için bir kalorimetreye yerleştirilir ve sistemin termal dengeye gelmesini bekler. Kalorimetreye (daha doğrusu onu dolduran suya) aktarılan ısı miktarı, su sıcaklığındaki artışla belirlenir.Yanma gibi bir kimyasal reaksiyon sırasında açığa çıkan ısı miktarı, kalorimetreye küçük bir "bomba" yerleştirerek ölçülebilir. "Bomba", ateşleme için elektrik kablolarının bağlı olduğu bir numune ve buna karşılık gelen oksijen miktarını içerir. Numune tamamen yandıktan ve termal denge kurulduktan sonra kalorimetredeki suyun sıcaklığının ne kadar arttığı ve dolayısıyla açığa çıkan ısı miktarı belirlenir. Ayrıca bakınız KALORİMETRİ.
Isı birimleri. Isı bir enerji şeklidir ve bu nedenle enerji birimleriyle ölçülmelidir. Uluslararası SI sisteminde enerjinin birimi joule'dür (J). Isı kalorisi miktarının sistemik olmayan birimlerinin kullanılmasına da izin verilir: uluslararası bir kalori 4.1868 J, bir termokimyasal kalori 4.1840 J'dir. Yabancı laboratuvarlarda, araştırma sonuçları genellikle sözde kullanılarak ifade edilir. 4.1855 J'ye eşit 15 derecelik bir kalori. Sistem dışı İngiliz Termal Birimi (BTU) kullanımdan kaldırılıyor: BTU ort = 1.055 J. Ana ısı kaynakları, kimyasal ve nükleer reaksiyonlar ile çeşitli enerji dönüşüm süreçleridir. Isının açığa çıktığı kimyasal reaksiyonların örnekleri, yanma ve gıda bileşenlerinin parçalanmasıdır. Dünya tarafından alınan ısının neredeyse tamamı, Güneş'in derinliklerinde meydana gelen nükleer reaksiyonlar tarafından sağlanır. İnsanoğlu, kontrollü nükleer fisyon süreçleri yardımıyla ısı elde etmeyi öğrenmiş ve şimdi de aynı amaç için termonükleer füzyon reaksiyonlarını kullanmaya çalışmaktadır. Mekanik iş ve elektrik enerjisi gibi diğer enerji türleri de ısıya dönüştürülebilir. Termal enerjinin (diğerleri gibi) yalnızca başka bir forma dönüştürülebileceğini, ancak "yoktan" elde edilemeyeceğini veya yok edilemeyeceğini hatırlamak önemlidir. Bu, termodinamik denilen bilimin temel ilkelerinden biridir. TERMODİNAMİK Termodinamik, ısı, iş ve madde arasındaki ilişkinin bilimidir. Bu ilişkilerle ilgili modern fikirler, Carnot, Clausius, Gibbs, Joule, Kelvin ve diğerleri gibi geçmişin büyük bilim adamlarının çalışmaları temelinde oluşturulmuştur.Termodinamik, bir maddenin ısı kapasitesinin ve termal iletkenliğinin anlamını açıklar. cisimlerin termal genleşmesi ve faz geçişlerinin ısısı. Bu bilim, deneysel olarak oluşturulmuş birkaç yasa ilkesine dayanmaktadır.Termodinamiğin başlangıcı. Yukarıda formüle edilen termodinamiğin sıfırıncı yasası, termal denge, sıcaklık ve termometri kavramlarını tanıtır. Termodinamiğin birinci yasası, bir bütün olarak tüm bilim için kilit öneme sahip bir ifadedir: enerji ne yok edilebilir ne de "yoktan" elde edilemez, bu nedenle Evrenin toplam enerjisi sabit bir değerdir. En basit haliyle, termodinamiğin birinci yasası şöyle ifade edilebilir: Sistemin aldığı enerji eksi verdiği enerji, sistemde kalan enerjiye eşittir. İlk bakışta, bu ifade açık görünüyor, ancak böyle değil, örneğin, Bir otomobil motorunun silindirlerinde benzinin yanması gibi durumlar: burada alınan enerji kimyasal, verilen enerji mekanik (iş) ve sistemde kalan enerji termaldir.Dolayısıyla enerjinin bir biçimden diğerine değişebileceği ve bu tür dönüşümlerin doğada ve teknolojide sürekli olarak gerçekleştiği açıktır. Yüz yıldan daha uzun bir süre önce, J. Joule, Şekil 2'de gösterilen cihazı kullanarak mekanik enerjinin termal enerjiye dönüştürülmesi durumunda bunu kanıtladı. 6, a. Bu cihazda, inen ve yükselen ağırlıklar, su ile dolu bir kalorimetrede bıçaklı bir şaftı döndürdü, bunun sonucunda su ısıtıldı. Kesin ölçümler, Joule'nin bir kalori ısının 4.186 J mekanik işe eşdeğer olduğunu belirlemesine izin verdi. Şekil l'de gösterilen cihaz.
6, b, elektrik enerjisinin termal eşdeğerini belirlemek için kullanıldı.Termodinamiğin birinci yasası birçok yaygın olayı açıklar. Örneğin, mutfağı açık bir buzdolabıyla soğutmanın neden imkansız olduğu ortaya çıkıyor. Mutfağı ısıl olarak ortamdan izole ettiğimizi varsayalım. Buzdolabının elektrik kablosu üzerinden sisteme sürekli olarak enerji verilir, ancak sistem herhangi bir enerji vermez. Böylece toplam enerjisi artar ve mutfak ısınır: sadece buzdolabının arkasındaki ısı eşanjörünün (kondansatör) borularına dokunun ve onun bir "soğutma" cihazı olarak yararsızlığını anlayacaksınız. Ancak bu borular sistemden çıkarılırsa (örneğin pencereden dışarı çıkarsa), mutfak aldığından daha fazla enerji verir, yani. soğutulacaktı ve buzdolabı bir pencere kliması olarak çalıştı.
Termodinamiğin birinci yasası, enerjinin yaratılmasını veya yok edilmesini engelleyen bir doğa yasasıdır. Ancak, doğada enerji transferi süreçlerinin nasıl ilerlediği hakkında hiçbir şey söylemez. Böylece, bu cisimler temas ettirilirse, sıcak bir cismin soğuk bir cismi ısıtacağını biliyoruz. Fakat soğuk bir cisim kendi ısı rezervini sıcak olana aktarabilir mi? Son Fırsat termodinamiğin ikinci yasası tarafından kategorik olarak reddedilir.
İlk yasa ayrıca katsayılı bir motor oluşturma olasılığını da dışlar. faydalı eylem(verimlilik) %100'den fazla (benzer
" sonsuz " motor keyfi olarak uzun bir süre için tükettiğinden daha fazla enerji yayabilir). %100'e eşit bir verimliliğe sahip bir motor inşa etmek imkansızdır, çünkü kendisine sağlanan enerjinin bir kısmı mutlaka daha az faydalı termal enerji şeklinde onun tarafından kaybolması gerekir. Böylece, enerji kaynağı olmadan tekerlek süresiz olarak dönmeyecektir, çünkü yataklardaki sürtünme nedeniyle, tekerlek durana kadar mekanik hareketin enerjisi kademeli olarak ısıya dönüşecektir."Yararlı" işi daha az yararlı enerji ısısına dönüştürme eğilimi, farklı gazlar içeren iki kap bağlandığında meydana gelen başka bir işlemle karşılaştırılabilir. Yeterince uzun bir süre bekledikten sonra, her iki kapta da homojen bir gaz karışımını, doğanın sistemin düzenini azaltacak şekilde hareket ettiğini görüyoruz. Bu düzensizliğin termodinamik ölçüsüne entropi denir ve termodinamiğin ikinci yasası farklı şekilde formüle edilebilir: Doğadaki süreçler her zaman sistemin ve çevresinin entropisi artacak şekilde ilerler. Böylece, Evrenin enerjisi sabit kalırken, entropisi sürekli büyür.
Maddelerin ısısı ve özellikleri. Farklı maddelerin termal enerjiyi depolamak için farklı yetenekleri vardır; moleküler yapılarına ve yoğunluklarına bağlıdır. Bir cismin birim kütlesinin sıcaklığını bir derece artırmak için gerekli olan ısı miktarına denir. özısı. Isı kapasitesi, maddenin bulunduğu koşullara bağlıdır. Örneğin, bir balondaki bir gram havayı 1 K ısıtmak için, onu aynı şekilde sert duvarlı kapalı bir kapta ısıtmaktan daha fazla ısı gerekir, çünkü balona verilen enerjinin bir kısmı balonu genişletmek için harcanır. hava ve ısıtma değil. Bu nedenle, özellikle gazların ısı kapasitesi, sabit basınçta ve sabit hacimde ayrı ayrı ölçülür.Sıcaklıktaki bir artışla, moleküllerin kaotik hareketinin yoğunluğu artar, çoğu madde ısıtıldığında genişler. Sıcaklığı 1 K artan bir maddenin genleşme derecesine termal genleşme katsayısı denir.
Bir maddenin bir fazdan diğerine, örneğin katıdan sıvıya (ve bazen hemen gaz haline) geçmesi için belirli bir miktarda ısı alması gerekir. Katı bir cisim ısıtılırsa, erimeye başlayana kadar sıcaklığı yükselir; erime tamamlanana kadar, ısı tedarikine rağmen vücudun sıcaklığı sabit kalacaktır. Bir maddenin birim kütlesini eritmek için gereken ısı miktarına erime ısısı denir. Isı vermeye devam ederseniz, erimiş madde kaynama noktasına kadar ısınır. Bir sıvının birim kütlesini belirli bir sıcaklıkta buharlaştırmak için gereken ısı miktarına buharlaşma ısısı denir.
Moleküler-kinetik teori. Moleküler kinetik teori, bir maddenin makroskopik özelliklerini, bu maddeyi oluşturan atomların ve moleküllerin davranışlarını mikroskobik düzeyde ele alarak açıklar. Bu durumda, istatistiksel bir yaklaşım kullanılır ve parçacıkların kendileri ve hareketlerinin doğası hakkında bazı varsayımlar yapılır. Bu nedenle, moleküller, gaz halindeki ortamlarda sürekli kaotik hareket halinde olan ve bir çarpışmadan diğerine önemli mesafeler kat eden katı toplar olarak kabul edilir. Çarpışmalar elastik olarak kabul edilir ve boyutu küçük ve sayısı çok büyük olan parçacıklar arasında meydana gelir. Gerçek gazların hiçbiri bu modele tam olarak karşılık gelmez, ancak çoğu gaz buna oldukça yakındır, bu da moleküler kinetik teorinin pratik değerinin nedenidir.Bu fikirlere dayanarak ve istatistiksel bir yaklaşım kullanarak Maxwell, gaz moleküllerinin hızlarının dağılımını, daha sonra kendi adıyla anılacak olan sınırlı bir hacimde elde etti. Bu dağılım Şekil 2'de grafiksel olarak sunulmuştur. 100 ve 1000 sıcaklıklarda belirli bir hidrojen kütlesi için 7
° C. Ordinat, apsis üzerinde belirtilen hızda hareket eden moleküllerin sayısını temsil eder. Toplam parçacık sayısı, her eğrinin altındaki alana eşittir ve her iki durumda da aynıdır. Grafikten, parçacıkların çoğunun belirli bir ortalama değere yakın hızlara sahip olduğu ve yalnızca çok az bir kısmının çok yüksek veya düşük hızlara sahip olduğu görülebilir. Bu sıcaklıklarda ortalama hızlar 2000-3000 m/s aralığındadır, yani. çok büyük.Bu kadar hızlı hareket eden çok sayıda gaz molekülü, çevreleyen cisimler üzerinde tamamen ölçülebilir bir kuvvetle hareket eder. Çok sayıda gaz molekülünün kabın duvarlarına çarptığı mikroskobik kuvvetler, basınç adı verilen makroskopik bir niceliği oluşturur. Bir gaza enerji verildiğinde (sıcaklık yükselir), moleküllerinin ortalama kinetik enerjisi artar, gaz parçacıkları duvarlara daha sık ve daha sert çarpar, basınç yükselir ve duvarlar tamamen sert değilse, gerilir ve gaz hacim artar. Böylece moleküler kinetik teorinin altında yatan mikroskobik istatistiksel yaklaşım, tartıştığımız termal genleşme olgusunu açıklamayı mümkün kılar.
Moleküler kinetik teorinin bir başka sonucu, yukarıda listelenen gereksinimleri karşılayan bir gazın özelliklerini tanımlayan bir yasadır. Bu sözde durum denklemidir. Ideal gaz bir mol gazın basıncını, hacmini ve sıcaklığını birbirine bağlar ve eşitlik şeklindedir.
PV = RT nerede P baskı yapmak, V hacmi, T sıcaklık ve R evrensel gaz sabiti (8.31441'e eşittir)± 0,00026) J/(mol H İLE). Ayrıca bakınız MOLEKÜLER-KİNETİK TEORİ; TERMODİNAMİK. ISI TRANSFERİ Isı transferi, bir vücut içinde veya bir vücuttan diğerine sıcaklık farkı nedeniyle ısının aktarılması işlemidir. Isı transferinin yoğunluğu, maddenin özelliklerine, sıcaklık farkına bağlıdır ve deneysel olarak belirlenmiş doğa yasalarına uyar. Verimli ısıtma veya soğutma sistemleri oluşturmak için çeşitli motorlar, enerji santralleri, ısı yalıtım sistemleri, ısı transferi prensiplerini bilmeniz gerekir. Bazı durumlarda, ısı değişimi istenmez (ergitme fırınlarının, uzay gemilerinin vb. ısı yalıtımı), diğerlerinde ise mümkün olduğu kadar büyük olmalıdır (buhar kazanları, ısı eşanjörleri, mutfak eşyaları).Üç ana ısı transferi türü vardır: iletim, konveksiyon ve radyan ısı transferi.
Termal iletkenlik. Vücut içinde bir sıcaklık farkı varsa, termal enerji daha sıcak olandan daha soğuk olana geçer. Moleküllerin termal hareketlerinden ve çarpışmalarından kaynaklanan bu tür ısı transferine termal iletkenlik denir; yeterince yüksek sıcaklıklar katılarda görsel olarak gözlemlenebilir. Bu nedenle, bir çelik çubuk bir gaz brülörünün alevinde bir uçtan ısıtıldığında, çubuk boyunca termal enerji aktarılır ve ısıtılmış uçtan belirli bir mesafede bir parıltı yayılır (yerden uzaklaştıkça daha az ve daha az yoğun). ısıtma).Termal iletkenlikten kaynaklanan ısı transferinin yoğunluğu, sıcaklık gradyanına bağlıdır, yani. ilişkiler
D T/D x çubuğun uçlarındaki sıcaklık farkı, aralarındaki mesafeye. Ayrıca çubuğun kesit alanına da bağlıdır (m cinsinden 2 ) ve malzemenin ısıl iletkenliği[ karşılık gelen birimlerde W/(m Ch K) ] . Bu nicelikler arasındaki ilişki, Fransız matematikçi J. Fourier tarafından türetilmiştir ve aşağıdaki forma sahiptir: nerede q ısı akışı, k termal iletkenlik katsayısı ve A kesit alanı. Bu ilişkiye Fourier'in ısı iletimi yasası denir; içindeki eksi işareti, ısının sıcaklık gradyanına ters yönde aktarıldığını gösterir.Fourier yasasından, ısıl iletkenlik katsayısı, alan veya sıcaklık gradyanı niceliklerinden birinin azaltılmasıyla ısı akışının azaltılabileceği sonucu çıkar. Kış koşullarında bir bina için, ikinci değerler pratik olarak sabittir ve bu nedenle, odada istenen sıcaklığı korumak için duvarların ısıl iletkenliğini azaltmak, yani. ısı yalıtımlarını iyileştirin.
Tablo, bazı madde ve malzemelerin ısıl iletkenlik katsayılarını göstermektedir. Tablo, bazı metallerin ısıyı diğerlerinden çok daha iyi ilettiğini, ancak hepsinin hava ve gözenekli malzemelerden çok daha iyi ısı iletkenleri olduğunu göstermektedir.
|
BAZI MADDE VE MALZEMELERİN ISI İLETKENLİĞİ |
|
|
Maddeler ve malzemeler |
Termal iletkenlik, W / (m × K) |
| Alüminyum | |
| Bronz | |
| Bizmut | |
| Tungsten | |
| Ütü | |
| Altın | |
| Kadmiyum | |
| Magnezyum | |
| Bakır | |
| Arsenik | |
| Nikel | |
| Platin | |
| Merkür | |
| Öncülük etmek | |
| Çinko | |
|
Diğer materyaller |
|
| Asbest | |
| Somut | |
| Hava | |
| Eider aşağı (gevşek) | |
| Ağaç fıstığı) | |
| Magnezya (MgO) | |
| Talaş | |
| Kauçuk (sünger) | |
| Mika | |
| Bardak | |
| Karbon (grafit) | |
Sıcaklık, sıvı helyum sıcaklığının (1.8 K) altına düştüğünde, birçok maddenin termal ve elektriksel direnci keskin bir şekilde azalır. Süper iletkenlik adı verilen bu fenomen, mikro elektronik cihazlardan elektrik hatlarına ve büyük elektromıknatıslara kadar birçok cihazın verimliliğini artırmak için kullanılır. Ayrıca bakınız SÜPERİLETKENLİK.
Konveksiyon. Daha önce de söylediğimiz gibi, bir sıvıya veya gaza ısı uygulandığında, moleküllerin hareketinin yoğunluğu artar ve bunun sonucunda basınç artar. Bir sıvı veya gazın hacmi sınırlı değilse, genleşirler; sıvının (gazın) yerel yoğunluğu azalır ve kaldırma kuvveti (Arşimet) kuvvetleri nedeniyle ortamın ısınan kısmı yukarı doğru hareket eder (odadaki sıcak havanın pillerden tavana yükselmesinin nedeni budur). Bu fenomene konveksiyon denir. Isıtma sisteminin ısısını boş yere boşa harcamamak için cebri hava sirkülasyonu sağlayan modern ısıtıcılar kullanmanız gerekir.Isıtıcıdan ısıtılan ortama konvektif ısı akışı, moleküllerin başlangıç hızına, yoğunluğa, viskoziteye, termal iletkenliğe ve ısı kapasitesine ve ortama bağlıdır; ısıtıcının boyutu ve şekli de çok önemlidir. Karşılık gelen miktarlar arasındaki oran Newton yasasına uyar
q = hA ( TW- TҐ ), nerede q ısı akışı (watt olarak ölçülür), A ısı kaynağının yüzey alanı (m cinsinden 2), TW ve T kaynağın ve çevresinin sıcaklığı (kelvin cinsinden). Konvektif ısı transfer katsayısı h ortamın özelliklerine, moleküllerinin başlangıç hızına ve ayrıca ısı kaynağının şekline bağlıdır ve W/(m) birimleriyle ölçülür. 2 saat İLE).Değer
h ısıtıcının etrafındaki havanın sabit olduğu (serbest konveksiyon) ve aynı ısıtıcının hava akımında olduğu (zorlanmış konveksiyon) durumlarda aynı değildir. Akışkanın bir borudan aktığı veya düz bir yüzeyin etrafında aktığı basit durumlarda, katsayı h teorik olarak hesaplanabilir. Ancak, türbülanslı bir ortamın akışı için konveksiyon problemine analitik bir çözüm bulmak henüz mümkün olmamıştır. Türbülans, moleküler olanları önemli ölçüde aşan bir ölçekte kaotik bir sıvının (gazın) karmaşık bir hareketidir.Isıtılmış (veya tersine soğuk) bir cisim sabit bir ortama veya bir akışa yerleştirilirse, çevresinde konvektif akımlar ve bir sınır tabakası oluşur. Bu katmandaki moleküllerin sıcaklığı, basıncı ve hızı, taşınımla ısı transferi katsayısının belirlenmesinde önemli bir rol oynar.
Isı eşanjörlerinin, iklimlendirme sistemlerinin, yüksek hızlı uçakların ve diğer birçok uygulamanın tasarımında konveksiyon dikkate alınmalıdır. Tüm bu sistemlerde ısı iletimi hem katılar arasında hem de ortamlarında konveksiyonla eş zamanlı olarak gerçekleşir. saat yüksek sıcaklıklar Radyan ısı transferi de önemli bir rol oynayabilir.
Radyan ısı transferi. Üçüncü tip ısı transferi radyan ısı transferi, bu durumda ısının bir vakum yoluyla aktarılabilmesi nedeniyle ısı iletimi ve taşınımdan farklıdır. Diğer ısı transferi yöntemleriyle benzerliği, sıcaklık farkından da kaynaklanmasıdır. Termal radyasyon türlerinden biridir Elektromanyetik radyasyon. Diğer türleri radyo dalgası, ultraviyole ve gama radyasyonu, sıcaklık farkı olmadığında meydana gelir.Şek. Şekil 8, termal (kızılötesi) radyasyon enerjisinin dalga boyuna bağımlılığını gösterir. Termal radyasyona, görünür ışığın emisyonu eşlik edebilir, ancak enerjisi, spektrumun görünmez kısmının radyasyon enerjisine kıyasla küçüktür.
Isı iletimi ve taşınım yoluyla ısı transferinin yoğunluğu sıcaklıkla orantılıdır ve radyan ısı akısı sıcaklığın dördüncü kuvvetiyle orantılıdır ve Stefan Boltzmann yasasına uyar.
Konut ve ofis alanları genellikle küçük elektrikli ısı yayıcılarla ısıtılır; spirallerinin kırmızımsı parıltısı, spektrumun kızılötesi kısmının kenarına yakın görünür termal radyasyondur. Oda, esas olarak radyasyonun görünmez, kızılötesi kısmı tarafından taşınan ısı ile ısıtılır. Gece görüş cihazlarında
^ Kamera, karanlıkta görmenizi sağlayan bir termal radyasyon kaynağı ve IR'ye duyarlı bir alıcı kullanır.Güneş, güçlü bir termal enerji yayıcıdır; 150 milyon km uzaklıkta bile Dünya'yı ısıtır. Dünyanın birçok yerinde bulunan istasyonlar tarafından her yıl kaydedilen güneş radyasyonunun yoğunluğu yaklaşık 1,37 W'dir.
/ m2 . Güneş enerjisi dünyadaki yaşamın kaynağıdır. En etkin şekilde kullanmanın yolları aranmaktadır. Evleri ısıtmak ve ev ihtiyaçları için elektrik üretmek için güneş panelleri oluşturulmuştur. ISININ ROLÜ VE KULLANIMI Küresel ısı transferi süreçleri, güneş radyasyonu ile Dünya'yı ısıtmaya indirgenmez. Atmosferdeki büyük konveksiyon akımları, dünya genelinde hava koşullarındaki günlük değişiklikleri belirler. Ekvator ve kutup bölgeleri arasındaki atmosferdeki sıcaklık farklılıkları, Dünya'nın dönmesinden kaynaklanan Coriolis kuvvetleriyle birlikte, alize rüzgarları, jet akımları ve sıcak ve soğuk cepheler gibi sürekli değişen konveksiyon akımlarının ortaya çıkmasına neden olur. Ayrıca bakınızİKLİM; METEOROLOJİ VE KLİMATOLOJİ.Dünyanın erimiş çekirdeğinden yüzeyine ısı transferi (termal iletkenlik nedeniyle) volkanik patlamalara ve gayzerlerin ortaya çıkmasına neden olur. Bazı bölgelerde jeotermal enerji, alan ısıtma ve elektrik üretimi için kullanılmaktadır.
Isı hemen hemen tüm üretim süreçlerinde vazgeçilmez bir katılımcıdır. Metallerin eritilmesi ve işlenmesi, motorların çalışması, gıda ürünlerinin üretimi, kimyasal sentez, petrol arıtma, tuğla ve tabaklardan arabalara kadar çok çeşitli nesnelerin üretimi gibi en önemlilerinden bahsedeceğiz. elektronik aletler.
Termik santrallerin yanı sıra birçok endüstriyel üretim ve ulaşım, ısı motorları - ısıyı faydalı işe dönüştüren cihazlar - olmadan çalışamadı. Bu tür makinelere örnek olarak kompresörler, türbinler, buhar, benzin ve jet motorları verilebilir.
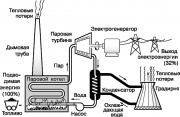
En ünlü ısı motorlarından biri, modern enerji santrallerinde kullanılan Rankine döngüsünün bir bölümünü uygulayan buhar türbinidir. Bu döngünün basitleştirilmiş bir diyagramı, Şek. 9. Çalışma sıvısı suyu, fosil yakıtların (kömür, petrol veya doğal gaz) yakılmasıyla ısıtılan bir buhar kazanında kızgın buhara dönüştürülür. Buhar yüksek basınç elektrik üreten bir jeneratörü çalıştıran bir buhar türbininin şaftını döndürür. Egzoz buharı, Rankine çevriminde kullanılmayan ısının bir kısmını emen akan su ile soğutulduğunda yoğunlaşır. Daha sonra su, ısının bir kısmının atmosfere bırakıldığı soğutma kulesine (soğutma kulesi) beslenir. Kondensat buhar kazanına geri pompalanır ve tüm döngü tekrarlanır.
Rankine çevrimindeki tüm işlemler, yukarıda açıklanan termodinamiğin ilkelerini gösterir. Özellikle ikinci yasaya göre santral tarafından tüketilen enerjinin bir kısmının ortamda ısı şeklinde dağılması gerekmektedir. Fosil yakıtlarda orijinal olarak bulunan enerjinin yaklaşık %68'inin bu şekilde kaybolduğu ortaya çıktı. Santralin verimliliğinde gözle görülür bir artış, ancak buhar kazanının sıcaklığının yükseltilmesiyle (malzemelerin ısı direnci ile sınırlıdır) veya ısının gittiği ortamın sıcaklığının düşürülmesiyle sağlanabilir, yani. atmosfer.
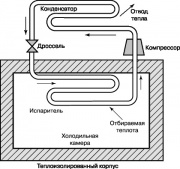
sahip olan başka bir termodinamik çevrim büyük önem bizim Gündelik Yaşam, şeması Şekil l'de gösterilen Rankin buhar kompresörü soğutma döngüsüdür. 10. Buzdolaplarında ve ev klimalarında, bunu sağlamak için dışarıdan enerji verilir. Kompresör, buzdolabı freon, amonyak veya karbondioksitin çalışma maddesinin sıcaklığını ve basıncını arttırır. Kızgın gaz, soğutulduğu ve yoğunlaştığı kondansatöre beslenir ve çevreye ısı verir. Kondenser memelerinden çıkan sıvı, kısma valfinden evaporatöre geçer ve bir kısmı buharlaşır, buna sıcaklıkta keskin bir düşüş eşlik eder. Evaporatör, nozullardaki çalışma sıvısını ısıtan buzdolabı bölmesinden ısı alır; bu sıvı kompresör tarafından kondensere verilir ve döngü tekrarlanır.
Şekil 2'de gösterilen soğutma döngüsü. 10 ısı pompasında da kullanılabilir. Bu tür ısı pompaları yazın sıcak atmosferik havaya ısı yayar ve odayı şartlandırır, kışın ise tam tersine soğuk havadan ısı alır ve odayı ısıtır.
Nükleer reaksiyonlar, enerji üretimi ve ulaşım gibi amaçlar için önemli bir ısı kaynağıdır. 1905'te A. Einstein, kütle ve enerjinin ilişki ile ilişkili olduğunu gösterdi.
E=mc2 , yani birbirine geçebilir. ışık hızı c çok büyük: 300 bin km/ İle birlikte. Bu, az miktarda maddenin bile büyük miktarda enerji sağlayabileceği anlamına gelir. Bu nedenle, 1 kg'lık bölünebilir malzemeden (örneğin, uranyum) teorik olarak, 1000 günlük sürekli çalışma için 1 MW kapasiteli bir elektrik santrali tarafından sağlanan enerji elde etmek mümkündür. Ayrıca bakınız ATOM YAPISI; FIRINLAR VE FIRINLAR TEKNOLOJİSİ; ELEKTROMANYETİK RADYASYON; ISI DEĞİŞTİRİCİ; TÜRBİN; FİZİKSEL MİKTARLARIN ÖLÇÜ BİRİMLERİ.EDEBİYAT Zemansky M. Sıcaklıklar çok yüksek ve çok düşük. M., 1968Paul R. Mekanik, akustik ve ısı doktrini. M., 1971
Smorodinsky Ya.A. Sıcaklık. M., 1981
Hayran J. Makineler, enerji ve entropi. M., 1986
Atkins P.V. Doğada düzen ve düzensizlik. M., 1987
Sıvı kalorimetreler
Teknolojide en yaygın olarak kullanılan bu tip kalorimetrenin tasarımı basittir ve bakımı kolaydır. Harici olarak indüklenen bir reaksiyon tarafından üretilen ısı miktarı, önce reaksiyon kabına (reaksiyonun gerçekleştiği) ve ardından sıvı banyosuna aktarılır. Banyodaki sıvı, sıcaklıkların eşitlenmesini hızlandıran bir çark, bir kaldırma vidası veya pompalar vasıtasıyla sürekli olarak çalkalanır. Banyo mümkün olduğunca çevreden ısıl olarak yalıtılmıştır (korumalı). Sıvı banyosunun sıcaklık değişimi, tespit edilen ısı miktarının bir ölçüsüdür. Isıtılacak kütlelerin ısı kapasitesi, yeterli bir sıcaklık değişimi sağlamak ve ölçüm işleminin çok uzun sürmemesi (ısı kayıplarının artması nedeniyle) için çok yüksek olmamalıdır.
Şekil Bir sıvı kalorimetre cihazı.
Ortam koşullarının sabitliği için yüksek gereksinimlerle, tüm kalorimetreyi başka bir banyoya yerleştirmek ve bir kontrol döngüsü kullanarak içindeki sıcaklığı yüksek doğrulukla stabilize etmek mümkündür. Bu, her şeyden önce, ortam sıcaklığından önemli ölçüde farklı sıcaklıklarda bir deney yapmanın gerekli olduğu durumlarda gereklidir.
Düşük sıcaklıklarda (yaklaşık -150°C'ye kadar) analiz için, soğutma ortamı olarak sıvı nitrojen kullanılır. Bu durumda, bunları değiştirirken, etrafındaki nemli havadan gelen donun numuneler veya numune kapları üzerinde çökelmemesine dikkat etmek gerekir, çünkü tabakası ölçüm sürecini etkileyebilir. Bunu önlemek için kalorimetre açıkken numune ve numune kabı soğuk nitrojen gazı ile temizlenir.
Metal gövdeli kalorimetreler
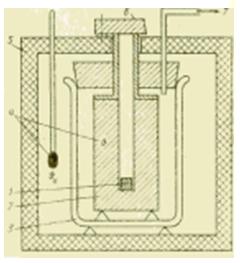
Metal kalorimetre cihazının şekil şeması.
Kalorimetrik çalışmaların daha geniş bir sıcaklık aralığında yapılması gerekiyorsa, sıvı kalorimetreler artık uygun değildir. Uygun metal gövdeli kalorimetrelerde aktarılan ısı miktarı genellikle ortam sıcaklığında olan bir metal blok (gümüş, bakır, alüminyum) tarafından alınır. Böyle bir kalorimetre esas olarak c, J / (kg * K), sıvı ve katı maddelerin özgül ısı kapasitesini belirlemeye yöneliktir.
Numune önce kalorimetrenin dışında soğutulur. soğutma tesisi veya bir fırında ısıtılır ve sabit bir duruma ulaştıktan sonra metal bir bloktaki bir deliğe indirilir (düşürülür). Çalışma yöntemine göre, böyle bir cihaza serbest düşüş kalorimetresi denir ve içindeki termodinamik süreçlerin doğasına göre bazen yer değiştirme kalorimetresi olarak adlandırılır.
Bu karıştırma sırasında numuneden (m1, c1 parametreleri ile) metal bloğa (m2, c2, ) aktarılan ısı miktarı, bloğun sıcaklığında ölçülebilir bir değişime neden olur. Bu, numunenin özgül ısı kapasitesinin genellikle bilinmeyen değerini belirlemeyi mümkün kılar. ideal koşullar(çevre ile ısı alışverişi olmadığında) ifadesinden:
Metal bloğun kendisi, boşaltılmış bir Dewar kabında ve bazen bir sıvı banyosunda bulunur. İkinci durumda, kalorimetre Ck'nin ısı kapasitesini elde etmek için, banyo Cw'nin ısı kapasitesi metal blok C2'nin ısı kapasitesine eklenmelidir:
CK=C2+CW=c2m2+cWmW .
KALORİMETRİK ÖLÇÜM YÖNTEMLERİ
Çoğu zaman, kalorimetreler sabit çevre koşulları modunda kullanılır. Bu, öncelikle reaksiyon süresinin çok kısa olduğu çoğu yanma kalorimetresi için geçerlidir.Reaksiyon nedeniyle kalorimetrenin iç parçalarının sıcaklığı değişirken, ortam hava sıcaklığı sabit kalır.Birçok durumda, sıcaklık kontrollü bir banyo dış parazitin ölçülen değeri üzerindeki etkiyi önlemek için ortam olarak kullanılır - odadaki sıcaklık dalgalanmaları, radyasyon, cereyan vb.
Bu ölçüm şemasının avantajı, kalorimetrik ölçümlerin baskın kısmını gerçekleştirmek için kullanılabilen nispeten düşük ekipman maliyetidir. Ana dezavantaj, sonuçların yorumlanmasını zorlaştıran kalorimetrenin çevre ile ısı değişimi olarak düşünülmelidir. Bu ölçüm yöntemine her zaman izoperibol (diyatermik) denir. Her durumda, özü, örneğin faz dönüşümlerini ölçmek için tasarlanmış kalorimetreler gibi, reaksiyon sırasında kalorimetrenin sıcaklığının sabit kalması gerçeğinde yatan izotermal olarak adlandırılamaz.
adyabatik yöntem
Çevre ile ısı alışverişini hariç tutmak, yani işlemin adyabatik akışını sağlamak mümkünse, o zaman sonuçların deney ve yorumlanması basitleştirilir ve sürekli kayıt yapmaya gerek olmadığından ölçüm sonucu daha doğrudur. sıcaklık değişimi ve düzeltmeleri hesaplayın. Ek olarak, bu durumda, kalorimetre kabındaki bir miktar daha fazla sıcaklık artışı tolere edilebilir; adyabatik olmayan cihazlar için, ısı kayıplarındaki artış nedeniyle bu kabul edilemez.
Kalorimetre kabı ile yakın çevresi (genellikle sıvı banyosu) arasındaki ısı alışverişini önlemek için, banyonun sıcaklığı, kap içindeki sıcaklık değişimlerine göre sürekli olarak düzeltilmelidir. Bir elektronik kontrolör (izleme devresi) yardımıyla, bu sıcaklıkların farkını pratikte sıfıra eşit sürekli tutmak mümkündür. Bu, gerekli ölçüm doğruluğuna bağlı olarak ölçüm ekipmanının maliyetini artırır.
Donanım elemanları uzun süre hızlı ve stabil olmalıdır (minimum sapmaya sahip olmalıdır). İzleme kontrol döngüsünün ölü bölgesi ±10-3 ila ±10-5 K aralığında olmalıdır. Ölçüm cihazları olarak, köprü devresine dahil edildiğinde herhangi bir hızlı tepki veren elektrik temaslı termometre kullanılabilir. ısıtma gücünü değiştirmek için kontrolöre bir dürtü. Isıtma, ya bir elektrik rezistans bobini vasıtasıyla ya da doğrudan, zayıf ayrışma nedeniyle bir ısıtma direnci görevi gören bir sıvı banyosunda (elektrolitik ısıtma olarak adlandırılır) gerçekleştirilir. Bu ikinci yöntem pratik olarak ataletsizdir. Sonuç, elektriksel sıcaklık ölçümü için halihazırda mevcut olan araçlar kullanılarak veya ek olarak monte edilmiş bir sıvı termometresi (Beckmann) kullanılarak elde edilebilir.
Adyabatik ölçüm yöntemi, esas olarak yavaş süreçleri ve termal etkileri incelemek için uygundur. Isı miktarındaki hızlı değişikliklerle (yanma kalorimetrelerinde), sıcaklık eşitleme ataletinin o kadar olumsuz bir etkisi vardır ki, geleneksel adyabatik olmayan yöntemlerin doğruluğu bile elde edilemez. Bununla birlikte, ısıtma elemanlarının ve sıcaklık sensörlerinin düşük bir ısı kapasitesi sağlayarak ve banyo sıvısının yoğun bir şekilde karıştırılmasıyla, çeşitli zaman sabitlerinin küçük değerlerinin elde edilmesi (ataletin azaltılması) mümkündür.
tazminat yöntemi
Kompanzasyon ilkesine dayalı diferansiyel veya çift kalorimetre kullanarak, ölçüm sürecindeki dış etkileri büyük ölçüde ortadan kaldırmak mümkündür. Aynı aksesuarlara sahip iki özdeş kalorimetrik kap, aynı koşullar altında bir ortama yerleştirilir. Bir kapta termal etki ile incelenen işlem gerçekleşir ve diğer kap bir servo kontrol sistemi yardımıyla her iki kap için de çevreye olan ısı kaybı aynı olacak şekilde ısıtılır. Bu nedenle, giriş ısıtma gücü, incelenen işlem sırasında açığa çıkan ısı miktarı ile doğru orantılı olarak konabilir. Bu durumda, deneysel ölçüm görevi başka bir alana girer ve sağlanan elektrikli ısıtma gücünün (W * s, J) çok doğru bir şekilde belirlenmesine indirgenir:
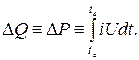
Diferansiyel kalorimetre, özellikle adyabatik ortam koşulları altında, özellikle ısı miktarında çok küçük veya çok yavaş değişiklikler beklendiğinde kullanılır. Endotermik proseslerde bir kalorimetrik kap olması yeterlidir. Isı girişi, kaptaki sıcaklık her zaman aynı kalacak şekilde kontrol edilir (izotermal yöntem). Diferansiyel kalorimetrelerin dezavantajı, ekipman ve ölçüm cihazlarının yüksek maliyetidir.
YANMA KALORİMETRELERİ
Isı ve enerji tesislerinde kullanılan yakıtın kalorifik değeri H (J/kg) tespiti için incelenir. Bu gösterge, verimlilik faktörlerini belirlemek, verimliliği incelemek ve çeşitli tesislerde tüketilen enerjiyi hesaplamak ve ayrıca yanma sürecinin optimal kontrolü için gereklidir. Yanıcı bileşenlerin bileşimindeki önemli dalgalanmalar genellikle kalorifik değerin sürekli olarak belirlenmesini gerektirir.
Bir madde tamamen yandığında, belirli bir miktarda ısı Q (yanma ısısı) açığa çıkar. Bunu m kütlesine (veya normal koşullar Vn altında hacme) bölersek, (özgül) yanma ısısını elde ederiz:
Yanma ürünlerinin durumuna bağlı olarak, iki tür kalorifik değer ayırt edilir: yanma ısısı ve kalorifik değer olarak da adlandırılan daha yüksek H0 ve daha düşük H. Ni'nin net kalorifik değeri belirlenirken, sırasında oluşan su kimyasal reaksiyonlar buhar halinde olmalıdır. Her iki ısı H0 - Ni arasındaki fark, 2.441 MJ / kg'a eşit olan yoğunlaştırılmış suyun buharlaşma ısısına (indeks KO - yoğuşma) r karşılık gelir.
Katı ve sıvı yakıtlar için, ortaya çıkan su miktarı, elementel analiz temelinde ve gaz halindeki yakıtları yakarken kondensat miktarı ölçülerek belirlenebilir.
Endüstriyel fırınlarda, yanma ürünlerinin sıcaklığı her zaman suyun kaynama noktasını aşar. Bu nedenle, suyun yoğuşma ısısı kullanılamadığından, genellikle yalnızca net kalorifik değer Ni ilgilenir.
Katılar ve Sıvılar için Yanma Kalorimetreleri
Hızlı yanma süreçleri için, Berthelot kalorimetrik bomba olarak adlandırılan özel bir sıvı kalorimetre formu geliştirilmiştir (Şekil 3).
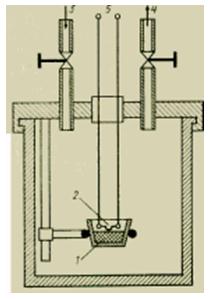
Şekil Kalorimetrik bomba cihazı.
Küçük, kesin olarak ölçülen bir maddenin yanması, ~30 atm (3 MPa) basınçta, mümkün olan en saf oksijenin bulunduğu bir atmosferde, kapalı bir bombada sabit bir hacimde meydana gelir. Doldurulan bomba, açığa çıkan yanma ısısını emen kalorimetrenin sıvı banyosuna yerleştirilir.
katılar genellikle küçük briketler (tabletler) halinde preslenir ve çok doğru bir şekilde tartılır. Az yanan maddelerin, iyi yanan sıvılarla, bilinen bir yanma ısısı (örneğin, benzoik asit) ile karıştırılması tavsiye edilir. Sıvı maddeler, platin veya kuvarsdan yapılmış kaplara (teknelere) veya küçük plastik kapsüllere yerleştirilir. Bombanın gövdesine cıvatalı kapakta, araştırma için gerekli tüm cihazlar vardır: oksijen sağlamak ve yanma ürünlerini çıkarmak için valfler, numune tutucular ve bir elektrikli ateşleyici. Ateşleme, ince bir platin tele elektrik verilerek gerçekleştirilir. Ateşleme için sağlanan ısı, deney sonuçlarını deşifre ederken dikkate alınabilmesi için doğru bir şekilde ölçülmelidir. Kalorimetrik bombada en yüksek kalorifik değer H0 belirlenir. Doğrulama sırasında, Ck kalorimetresinin termal eşdeğeri, bir referans maddeyi (örneğin, benzoik asit) yakarak veya bir elektrikli ısıtma cihazı kullanarak belirlenir.
Gaz halindeki maddeler için yanma kalorimetresi
Gaz halindeki ortamın yanma ısısını belirlemek için çeşitli yöntemler vardır. Hepsi, katı ve sıvı maddeler için kalorimetrik bombanın aksine, sürekli ölçüme dayanmaktadır. Kullanılan ölçüm prensibi oldukça basittir. Test gazı, sabit bir basınçta bir brülörde sürekli olarak yakılır. Yanma sırasında açığa çıkan tüm ısı, ya ısı eşanjöründeki (ıslak veya ısı değişim kalorimetresi) soğutma ortamının akışıyla ya da yanma ürünlerinin bilinen bir akış hızında (kuru veya karışım kalorimetresi) hava akışıyla karıştırılmasıyla emilir. Genellikle net kalorifik değer Hu'yu belirleyin. Brüt kalorifik değer H0'ı belirlemek için baca gazlarında bulunan su buharını (indeks KO) yoğuşturmak gerekir. Kalorimetrenin girişindeki (indeks e) ve çıkışındaki (indeks a) kütle akış hızlarını ve sıcaklık farkını bilerek, ısı dengesi denklemini kullanarak karşılık gelen kalorifik değeri hesaplamak mümkündür.
Gerekli gaz hazırlığı temel olarak tüm gaz kalorimetrelerinde aynıdır. Yanmadan önce, gaz (endeks G) önce katı mekanik safsızlıklardan (filtrede) temizlenir ve nemlendirilir (nem ile doygunluğa, %100) ve daha sonra belirtilen ön basınç değerlerine getirilir (bir basınç düşürücü kullanarak) valf) ve soğutma ortamının sıcaklığı (indeks K) . Yanma için gerekli hava (indeks L) de nemlendirilir ve soğutma ortamının sıcaklığına getirilir.
Gerekli doğruluk ve izin verilen enstrümantasyon maliyetlerine bağlı olarak, bu koşullardan bazıları karşılanmayabilir. Kalorimetrenin ideal durumu için denklemden sapmayı belirlemek için kalorimetreler bir referans gazla (örneğin hidrojen) doğrulanmalıdır. Bir ısı değişimi (ıslak) kalorimetresi için yukarıdaki denklem şu şekildedir:
soğutma ortamının ve yakıtın kütle akış hızları nerede ve nelerdir, kg/s; sk - soğutma ortamının özgül ısı kapasitesi, J / (kg * K); - soğutma ortamının sıcaklığındaki artış, K.
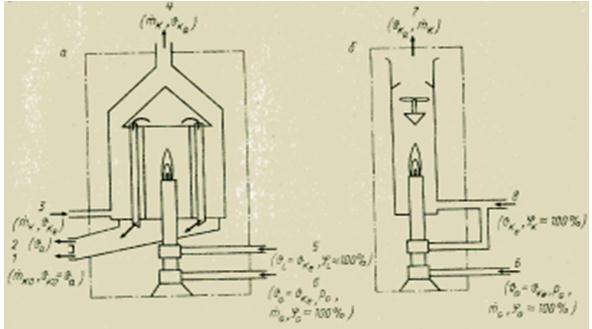
Şekil Gazlı yakıt için ıslak (a) ve kuru (b) kalorimetre cihazı.
Sıcaklık artışı tipik olarak 5-15 K'dir. Büyük termal kütle nedeniyle, ısı transfer kalorimetrelerinin çok uzun bir zaman sabiti vardır ve bu, birkaç dakikaya kadar çıkabilir. Bu nedenle, zaman sabiti yalnızca birkaç saniye olan kuru (karıştırma) kalorimetrelere göre sensör olarak kapalı bir kontrol döngüsünde kullanım için daha az uygundurlar. Öte yandan, ısı değişim kalorimetrelerinin ulaşılabilir doğruluğu nispeten yüksektir. Hataları ±0.25-1%'i geçmez, bu nedenle laboratuvar çalışmaları ve doğrulama için de kullanılabilirler. Kuru kalorimetreler (karıştırma), ölçüm aralığının üst sınırının ±1 ila ±%2'si arasında bir hataya sahiptir.
Çeşitli üreticilerin kalorimetrelerinin tasarım versiyonları, öncelikle yardımcı ve güvenlik cihazlarında, algılama elemanlarında ve hata kompanzasyonu sağlayan hesaplama devrelerinde farklılık gösterir. Bu nedenle, ısı değişim kalorimetrelerinde, gaz ve soğutma ortamı akış hızlarının oranı çeşitli şekillerde korunur (yukarıdaki kalorimetre denklemine bakın), çünkü daha yüksek kalorifik değer H0 doğrudan sadece sıcaklık artışına bağlıdır.
Kuru kalorimetrelerde, sıcaklık artışı ya doğrudan elektrik temaslı termometreler kullanılarak ya da dolaylı olarak bir dilatometrik sensör - egzoz gazı akışında bulunan genişleyen bir tüp kullanılarak ölçülür. ADOS kalorimetresinde, dilatometre tüpünün termal uzaması, doğrudan yanma ısısına karşılık gelir ve bir bağlantı ve bir uzunluk ölçer kullanılarak herhangi bir sinyale dönüştürülebilir. Reinecke kalorimetresinde, çubuğun uzantısı, sıcaklığındaki artış neredeyse sabit kalacak şekilde soğutma havasının akışını kontrol eden bir kontrol devresinde bir ölçüm sinyali olarak kullanılır. Bu durumda, kontrol döngüsünün tamamen orantılı olduğu ortaya çıkar, ancak içinde bir miktar artık sapma kaçınılmazdır. Bu durumda soğutma havasının tüketilmesi veya dilatometrik borunun (çubuk) uzaması, belirlenen kalorifik değerin bir ölçüsüdür. Tüm kuru kalorimetrelerde yeterli doğruluk elde etmek için bir ön koşul, soğutma havası ile yanma ürünlerinin iyi bir şekilde karıştırılmasıdır.
ISI AKIŞ ÖLÇÜMLERİ
Bir enerji biçimi olarak ısı üç şekilde aktarılır: katı bir cisim (termal iletim), sıvı veya gazlı ortam (konveksiyon) ve maddenin katılımı olmadan (radyasyon). Teknolojide, her üç bileşen de hemen hemen her zaman ısı transferinde yer alır; bununla birlikte, birçok durumda sadece bir bileşeni ölçerek kabul edilebilir doğrulukta sonuçlar elde etmek mümkündür.
Ölçüm ısı akışı termal iletkenlik ile
Isı ileten duvarlardan ısı transferi, teknolojinin birçok alanında (her türlü ısı eşanjörü, ısı yalıtımı vb.) Büyük önem taşımaktadır. Aynı zamanda, ilgi çekici olan üretim miktarlarının mevcut kontrolü değil, yükü değerlendirmek, garanti edilen göstergelerin yerine getirildiğini ve verimliliği doğrulamak için kullanılan tekli ölçümlerin sonuçlarıdır.
Sabit ısı iletimi yasalarına göre, ısı akısı aşağıdaki formüllerle (J/s) belirlenir:
Duvarın ısıl iletkenliği [J/(m*s*K)] ve geometrik boyutları bilindiğinden, ısı akısının ölçümü sıcaklık farkının ölçülmesine indirgenir. Ancak bu teknik, yüzey sıcaklıklarının çok hassas bir şekilde belirlenmesini gerektirir. Yüzeylere sıcaklığa duyarlı elemanlar takarken ısı transfer koşullarındaki değişikliklerle ilgili hatalar oldukça büyük olabilir. Bu nedenle, daha doğru ölçümler için hem ısıl iletkenlik hem de ısı transferinin aynı anda kullanıldığı aşağıdaki yöntemler önerilir.
Isı transferinde ısı akışlarının ölçümü (ısı iletimi ile birlikte ısı transferi)
Bir önceki bölümde bahsedilen düz duvar için aşağıdaki ısı transferi kanunu (J/s) geçerlidir:
![]() ,
,
burada ısı transfer katsayısı k 1J/(m2*s*K)], ısı transfer katsayısı [J/Dm*s*K)] ile birlikte, ısı transfer katsayıları ve [J/(m2*s*K) ] duvarın her iki tarafı da dikkate alınır.
Ölçülen ısı akışının içinden geçtiği düz bir duvara, yüzey sıcaklığı yerleşik ince film termokuplları tarafından belirlenen küçük bir ince plaka yerleştirilir. Bu şekilde ölçmenin avantajı, duvarın termal özelliklerinin bilinmesine gerek olmaması ve plakanın karşılık gelen özelliklerinin kalibrasyon sırasında tek bir sabit değere indirgenebilmesidir. Bu tür hassas elemanların boyutları yaklaşık olarak 30x30x0.5 mm'dir; ölçüm aralığı 10 ila 100.000 W/m2 arasındaki ısı akışlarını kapsar; hata %2-5'tir.
Şekil Isı akışı ölçerin çalışma prensibi.
Bu ölçüm yönteminin geliştirilmesiyle, üst üste bindirilmiş bir plaka yerine kauçuk paspaslar kullanılmaktadır. Bunları düzlemsel olmayan yüzeylere yapıştırarak veya kavisli bir yüzeyin etrafına sararak, nispeten geniş bir yüzeyden, örneğin bir borudan, kaptan, vb. ısı transferini belirlemek mümkündür. Termokupllar her iki yüzeye de yerleştirilmiştir. matı, sıcak ve soğuk bağlantı noktaları tam olarak karşı karşıya gelecek şekilde yerleştirin (Şek. 6). Ve bu durumda kalibrasyona göre ısı akısı yoğunluğu sıcaklık farkı ile orantılıdır. Bununla birlikte, uygulanan matlar, doğru ölçümlerle farkedilir hale gelen ilk ısı transferini biraz bozar. Bu nedenle, bu ölçüm yöntemi esas olarak, ısı akışının ihlali ölçüm sonucunu etkilemediğinde, bir maddenin termodinamik sabitlerini belirlemek için kullanılır.
Mevcut ortamlardaki ısı akışlarının ölçümü.
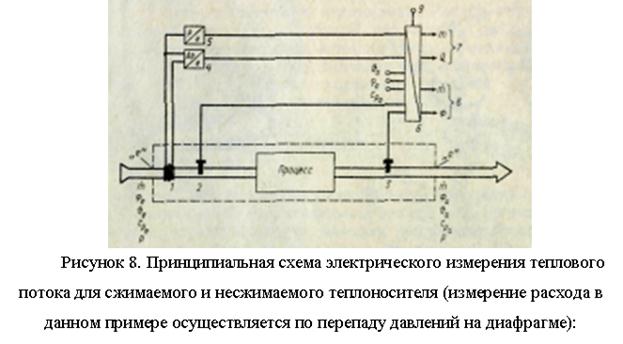
Termal enerjinin önemli bir kısmı, kapalı bir boru hattı ağı içinde hareket eden sıvı veya gaz halindeki ortamlar (su, buhar vb.) tarafından aktarılır. Bununla birlikte, elektrik enerjisinin telle iletilmesiyle karşılaştırıldığında, termal enerjinin iletilebileceği mesafe sınırlıdır. Her tür ısıtma ve soğutma sisteminin termoteknik çalışmaları için, ısı salınımını ve tüketimini ölçmek gerekir.
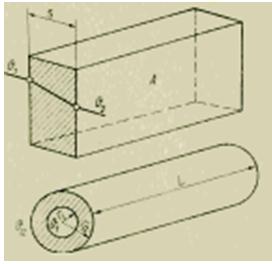
Ortam - ısı taşıyıcının (kg/s) akışıyla, ısı dengesinin derlendiği belirli bir bölgede A (m2) alanlı kontrol bölümünden iletilen ısı akısı F (J/s). proses bölgesi, Şekil 7), şuna eşittir:
t2 - t1 zaman aralığında salınan ısı miktarı bir integral (J) olarak belirlenir:
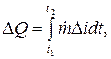
ısı dengesi bölgesinin girişindeki (endek e) ve çıkışındaki (indeks a) soğutucunun ısı içeriğindeki (entalpiler, J/kg) fark nerededir.
Genel durumda, entalpi değeri yalnızca belirli bir seviye ile, örneğin ortam sıcaklığındaki entalpi ile karşılaştırıldığında ilgilenildiğinden, tüm ısı akışı ölçümleri esasen fark ölçümleridir.
Genel denklemde yer alan bireysel entalpiler, karşılık gelen sıcaklıklar ve özgül ısı kapasiteleri cinsinden ifade edilebilir;
Böylece, ısı akışının ölçümü, doğrudan sıcaklıkların ve kütle akış hızlarının ölçümüne indirgenir. Çoğu durumda, soğutucunun kütlesi değil, hacimsel akışı ölçülür; bu durumda, elde edilen sonuç sadece soğutma sıvısı yoğunluğunun р değerine göre farklılık gösterecektir. Özgül ısı kapasiteleri, ci, sıcaklığın fonksiyonlarıdır. Bununla birlikte, birçok enstrümanın ölçüm aralığının dar olması nedeniyle, genellikle çok fazla doğruluk kaybı olmadan sabit değerler olarak kabul edilebilirler. Özgül ısı kapasitesi bilinmelidir. Sıvılar için, ısı akışı denklemi daha da basitleştirilmiştir, çünkü bunların özgül ısı kapasiteleri basınca bağımlı olmayın:
![]() , J/s.
, J/s.
Bu tür tüm denklemlerde, ısının verilip verilmediğine, işlemin endotermik veya ekzotermik olmasına, soğutma veya ısıtmanın olup olmamasına bağlı olarak miktarların işaretlerini dikkate almak gerekir.
