วัดปริมาณความร้อนในระบบ SI วิธีการและวิธีการวัดปริมาณความร้อน
ความร้อน- พลังงานที่ถ่ายโอนจากวัตถุที่ร้อนกว่าไปยังวัตถุที่มีความร้อนน้อยกว่าโดยการสัมผัสโดยตรงหรือการแผ่รังสี
อุณหภูมิเป็นตัววัดความเข้มของการเคลื่อนที่ของโมเลกุล
ปริมาณความร้อนที่ร่างกายได้รับในอุณหภูมิที่กำหนดขึ้นอยู่กับมวลของมัน ตัวอย่างเช่น ที่อุณหภูมิเดียวกัน ความร้อนจะถูกเก็บไว้ในถ้วยน้ำขนาดใหญ่มากกว่าในถ้วยเล็ก และในถังน้ำเย็น อาจมีมากกว่าในถ้วย น้ำร้อน(แม้ว่าอุณหภูมิของน้ำในถังจะต่ำกว่าก็ตาม)
ความร้อนมีบทบาทสำคัญในชีวิตมนุษย์ รวมทั้งในการทำงานของร่างกายด้วย ส่วนหนึ่งของพลังงานเคมีที่มีอยู่ในอาหารจะถูกเปลี่ยนเป็นความร้อนเนื่องจากอุณหภูมิของร่างกายจะอยู่ที่ 37 ° C สมดุลความร้อนของร่างกายมนุษย์ก็ขึ้นอยู่กับอุณหภูมิด้วย สิ่งแวดล้อมและผู้คนถูกบังคับให้ใช้พลังงานจำนวนมากเพื่อสร้างความร้อนให้กับอาคารพักอาศัยและโรงงานอุตสาหกรรมในฤดูหนาว และระบายความร้อนในฤดูร้อน พลังงานส่วนใหญ่นี้มาจากเครื่องยนต์ความร้อน เช่น โรงต้มน้ำและกังหันไอน้ำของโรงไฟฟ้าที่ใช้เชื้อเพลิงฟอสซิล (ถ่านหิน น้ำมัน) และผลิตกระแสไฟฟ้า
จนถึงปลายศตวรรษที่ 18 ความร้อนถือเป็นสสาร โดยเชื่อว่าอุณหภูมิของร่างกายกำหนดโดยปริมาณ<калорической жидкости>, หรือ<теплорода>. ต่อมา B. Rumford, J. Joule และนักฟิสิกส์คนอื่นๆ ในสมัยนั้น ได้หักล้างการทดลองและการใช้เหตุผลอย่างมีไหวพริบ<калорическую>ทฤษฎีที่พิสูจน์ว่าความร้อนไม่มีน้ำหนักและสามารถได้รับในปริมาณใด ๆ อันเนื่องมาจากการเคลื่อนไหวทางกล ความร้อนในตัวมันเองไม่ใช่สสาร แต่เป็นเพียงพลังงานของการเคลื่อนที่ของอะตอมหรือโมเลกุลของมัน นี่คือความเข้าใจเรื่องความร้อนที่ฟิสิกส์สมัยใหม่ยึดถือ
ในบทความนี้ เราจะพิจารณาว่าความร้อนและอุณหภูมิสัมพันธ์กันอย่างไร และวัดปริมาณเหล่านี้อย่างไร หัวข้อของการสนทนาของเราจะเป็นคำถามต่อไปนี้: การถ่ายเทความร้อนจากส่วนใดส่วนหนึ่งของร่างกายไปยังส่วนอื่น การถ่ายเทความร้อนในสุญญากาศ (ช่องว่างที่ไม่มีสสาร); บทบาทของความร้อนในโลกสมัยใหม่
ความร้อนและอุณหภูมิ
ปริมาณพลังงานความร้อนในสารไม่สามารถกำหนดได้โดยการสังเกตการเคลื่อนที่ของแต่ละโมเลกุลแยกกัน ในทางตรงกันข้าม โดยการศึกษาคุณสมบัติมหภาคของสสารเท่านั้น เราสามารถค้นหาลักษณะของการเคลื่อนที่ด้วยกล้องจุลทรรศน์ของโมเลกุลจำนวนมากโดยเฉลี่ยในช่วงระยะเวลาหนึ่ง อุณหภูมิของสารเป็นตัวบ่งชี้เฉลี่ยของความเข้มของการเคลื่อนที่ของโมเลกุล ซึ่งพลังงานคือ พลังงานความร้อนสาร
วิธีการประมาณค่าอุณหภูมิที่คุ้นเคยที่สุดวิธีหนึ่งแต่แม่นยำน้อยที่สุดก็คือการสัมผัส สัมผัสวัตถุเราตัดสินว่าร้อนหรือเย็นโดยเน้นที่ความรู้สึกของเรา แน่นอนว่าความรู้สึกเหล่านี้ขึ้นอยู่กับอุณหภูมิของร่างกาย ซึ่งทำให้เราได้แนวคิดเรื่องสมดุลความร้อน ซึ่งเป็นหนึ่งในสิ่งที่สำคัญที่สุดในการวัดอุณหภูมิ
สมดุลความร้อน
สมดุลความร้อนระหว่างวัตถุ A และ B
เห็นได้ชัดว่าถ้าทั้งสองร่าง A และ B ถูกกดทับกันอย่างแน่นหนา หลังจากสัมผัสพวกมันหลังจากผ่านไปนานพอสมควร เราจะสังเกตเห็นว่าอุณหภูมิของพวกมันเท่ากัน ในกรณีนี้ วัตถุ A และ B จะอยู่ในสภาวะสมดุลทางความร้อนซึ่งกันและกัน อย่างไรก็ตาม โดยทั่วไปแล้ว ร่างกายไม่จำเป็นต้องสัมผัสกันเพื่อให้มีสมดุลทางความร้อนอยู่ระหว่างร่างกาย - แค่อุณหภูมิของพวกมันจะเท่ากันก็เพียงพอแล้ว สิ่งนี้สามารถตรวจสอบได้โดยใช้วัตถุที่สาม C ขั้นแรกให้นำเข้าสู่สมดุลทางความร้อนกับร่างกาย A จากนั้นจึงเปรียบเทียบอุณหภูมิของร่างกาย C และ B ร่างกาย C ในที่นี้มีบทบาทเป็นเทอร์โมมิเตอร์ ในการกำหนดที่เข้มงวด หลักการนี้เรียกว่ากฎข้อที่ศูนย์ของอุณหพลศาสตร์: หากวัตถุ A และ B อยู่ในสมดุลความร้อนกับวัตถุที่สาม C วัตถุเหล่านี้ก็จะอยู่ในสมดุลความร้อนซึ่งกันและกัน กฎหมายนี้รองรับวิธีการวัดอุณหภูมิทั้งหมด
การวัดอุณหภูมิ

เครื่องวัดอุณหภูมิ

เทอร์โมมิเตอร์
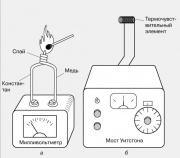
เทอร์โมมิเตอร์ตามเอฟเฟกต์ไฟฟ้า
หากเราต้องการทดลองและการคำนวณที่แม่นยำ การให้คะแนนอุณหภูมิเช่น ร้อน อุ่น เย็น และเย็นไม่เพียงพอ - เราจำเป็นต้องมีมาตราส่วนอุณหภูมิที่สำเร็จการศึกษา มีเกล็ดหลายขนาด และมักจะใช้จุดเยือกแข็งและจุดเดือดของน้ำเป็นจุดอ้างอิง เครื่องชั่งทั่วไปสี่เครื่องแสดงอยู่ในรูป มาตราส่วนเซนติเกรดตามจุดเยือกแข็งของน้ำเท่ากับ 0 ° และจุดเดือดถึง 100 ° เรียกว่าสเกลเซลเซียสซึ่งตั้งชื่อตามเอ. เซลเซียส นักดาราศาสตร์ชาวสวีเดนที่บรรยายไว้ในปี ค.ศ. 1742 เชื่อกันว่า นักธรรมชาติวิทยาชาวสวีเดน K. Linnaeus ใช้มาตราส่วนนี้เป็นครั้งแรก ตอนนี้มาตราส่วนเซลเซียสเป็นเรื่องธรรมดาที่สุดในโลก มาตราส่วนอุณหภูมิฟาเรนไฮต์ซึ่งจุดเยือกแข็งและจุดเดือดของน้ำสอดคล้องกับตัวเลขที่อึดอัดอย่างยิ่งที่ 32 และ 212 °ถูกเสนอในปี 1724 โดย G. Fahrenheit มาตราส่วนฟาเรนไฮต์ใช้กันอย่างแพร่หลายในประเทศที่พูดภาษาอังกฤษ แต่แทบจะไม่มีการใช้ในวรรณคดีทางวิทยาศาสตร์ ในการแปลงอุณหภูมิเซลเซียส (°C) เป็นอุณหภูมิฟาเรนไฮต์ (°F) มีสูตร °F = (9/5)°C + 32 และสำหรับการแปลย้อนกลับ - สูตร °C = (5/9) ( °F- 32).
เครื่องชั่งทั้งสอง - ทั้งฟาเรนไฮต์และเซลเซียส - ไม่สะดวกมากเมื่อทำการทดลองในสภาวะที่อุณหภูมิลดลงต่ำกว่าจุดเยือกแข็งของน้ำและแสดงเป็นจำนวนลบ ในกรณีเช่นนี้ มาตราส่วนอุณหภูมิสัมบูรณ์ถูกนำมาใช้ ซึ่งอิงจากการประมาณค่าเป็นศูนย์สัมบูรณ์ที่เรียกว่าจุดสัมบูรณ์ ซึ่งเป็นจุดที่การเคลื่อนที่ของโมเลกุลควรหยุด หนึ่งในนั้นเรียกว่าสเกลแรนกินและอีกอันเรียกว่าสเกลอุณหพลศาสตร์สัมบูรณ์ อุณหภูมิวัดเป็นองศาแรงคิน (°R) และเคลวิน (K) สเกลทั้งสองเริ่มต้นที่ศูนย์สัมบูรณ์และจุดเยือกแข็งของน้ำเท่ากับ 491.7 ° R และ 273.16 K จำนวนองศาและเคลวินระหว่างจุดเยือกแข็งและจุดเดือดของน้ำในระดับเซลเซียสและสเกลอุณหพลศาสตร์สัมบูรณ์จะเท่ากันและเท่ากัน ถึง 100; สำหรับมาตราส่วนฟาเรนไฮต์และแรงคินก็เหมือนกัน แต่เท่ากับ 180 องศาเซลเซียสจะถูกแปลงเป็นเคลวินโดยใช้สูตร K \u003d ° C + 273.16 และองศาฟาเรนไฮต์จะถูกแปลงเป็นองศาแรงคินโดยใช้สูตร ° R \u003d ° F + 459.7
การทำงานของอุปกรณ์ที่ออกแบบมาเพื่อวัดอุณหภูมิขึ้นอยู่กับปรากฏการณ์ทางกายภาพต่างๆ ที่เกี่ยวข้องกับการเปลี่ยนแปลงของพลังงานความร้อนของสาร - การเปลี่ยนแปลงความต้านทานไฟฟ้า ปริมาตร ความดัน ลักษณะการแผ่รังสี สมบัติทางเทอร์โมอิเล็กทริก เครื่องมือวัดอุณหภูมิที่ง่ายที่สุดและคุ้นเคยที่สุดคือเครื่องวัดอุณหภูมิแบบแก้วที่แสดงในรูป ลูกบอล c ที่ส่วนล่างของเทอร์โมมิเตอร์วางอยู่ในสื่อหรือกดทับวัตถุที่ต้องการวัดอุณหภูมิ และขึ้นอยู่กับว่าลูกบอลได้รับความร้อนหรือให้ออก ขยายหรือหดตัว และคอลัมน์ของลูกบอลจะขึ้นหรือตกใน เส้นเลือดฝอย หากเทอร์โมมิเตอร์ถูกปรับเทียบล่วงหน้าและติดตั้งเครื่องชั่ง คุณก็จะสามารถค้นหาอุณหภูมิของร่างกายได้โดยตรง
อุปกรณ์อื่นที่มีการกระทำตามการขยายตัวทางความร้อนคือเทอร์โมมิเตอร์แบบไบเมทัลแสดงในรูป องค์ประกอบหลักคือแผ่นเกลียวของโลหะบัดกรีสองชนิดที่มีค่าสัมประสิทธิ์การขยายตัวทางความร้อนต่างกัน เมื่อถูกความร้อน โลหะชนิดใดชนิดหนึ่งจะขยายตัวมากกว่าโลหะอื่น เกลียวจะบิดและหมุนลูกศรที่สัมพันธ์กับมาตราส่วน อุปกรณ์ดังกล่าวมักใช้ในการวัดอุณหภูมิอากาศในร่มและกลางแจ้ง แต่ไม่เหมาะสำหรับการกำหนดอุณหภูมิในท้องถิ่น
อุณหภูมิในพื้นที่มักจะวัดโดยใช้เทอร์โมคัปเปิล ซึ่งเป็นลวดโลหะสองเส้นที่บัดกรีที่ปลายด้านหนึ่ง เมื่อจุดเชื่อมต่อดังกล่าวได้รับความร้อน EMF จะเกิดขึ้นที่ปลายสายไฟที่ว่าง ซึ่งมักจะเป็นมิลลิโวลต์ เทอร์โมคัปเปิลทำจากโลหะหลายคู่ ได้แก่ เหล็กและคอนสแตนแทน ทองแดงและคอนสแตนแทน โครเมล และอลูเมล thermo-EMF ของพวกมันเปลี่ยนแปลงเกือบเป็นเส้นตรงตามอุณหภูมิในช่วงอุณหภูมิที่กว้าง
ผลกระทบเทอร์โมอิเล็กทริกอื่น ๆ เป็นที่รู้จักกัน - การพึ่งพาความต้านทานของวัสดุที่เป็นสื่อกระแสไฟฟ้าต่ออุณหภูมิ มันรองรับการทำงานของเทอร์โมมิเตอร์วัดความต้านทานไฟฟ้าซึ่งหนึ่งในนั้นแสดงไว้ในรูป ความต้านทานขององค์ประกอบการวัดอุณหภูมิขนาดเล็ก (เทอร์โมคัปเปิล) ซึ่งมักจะเป็นขดลวดบางๆ ถูกนำมาเปรียบเทียบกับความต้านทานของตัวต้านทานปรับเทียบที่ปรับเทียบแล้วโดยใช้สะพานวีทสโตน เครื่องมือส่งออกสามารถสำเร็จการศึกษาได้โดยตรงในหน่วยองศา
Optical pyrometers ใช้ในการวัดอุณหภูมิของวัตถุร้อนที่ปล่อยแสงที่มองเห็นได้ ในอุปกรณ์รุ่นหนึ่งนี้ แสงที่ปล่อยออกมาจากร่างกายจะถูกนำไปเปรียบเทียบกับการแผ่รังสีของหลอดไส้ที่วางอยู่ในระนาบโฟกัสของกล้องส่องทางไกลซึ่งมองเห็นตัวที่เปล่งแสง กระแสไฟฟ้าที่ให้ความร้อนแก่ไส้หลอดจะเปลี่ยนไป จนกระทั่งเมื่อเปรียบเทียบการเรืองแสงของไส้หลอดกับร่างกายด้วยสายตา จะพบว่ามีการสร้างสมดุลทางความร้อนระหว่างกัน สเกลของอุปกรณ์สามารถเลื่อนระดับได้โดยตรงในหน่วยอุณหภูมิ
ความก้าวหน้าทางเทคนิค ปีที่ผ่านมาได้รับอนุญาตให้สร้างเซ็นเซอร์อุณหภูมิใหม่ ตัวอย่างเช่น ในกรณีที่จำเป็นต้องมีความไวสูงเป็นพิเศษ แทนที่จะใช้เทอร์โมคัปเปิลหรือเทอร์โมมิเตอร์แบบต้านทานแบบธรรมดา จะใช้อุปกรณ์เซมิคอนดักเตอร์ - เทอร์มิสเตอร์ นอกจากนี้ สีย้อมและผลึกเหลวที่เปลี่ยนสถานะเฟสยังใช้เป็นตัวแปลงความร้อน โดยเฉพาะอย่างยิ่งในกรณีที่อุณหภูมิพื้นผิวของร่างกายแตกต่างกันไปในช่วงกว้าง ในที่สุด จะใช้การถ่ายภาพความร้อนอินฟราเรด ซึ่งได้ภาพอินฟราเรดของวัตถุในสีตามเงื่อนไข โดยที่แต่ละสีจะสอดคล้องกับอุณหภูมิที่แน่นอน วิธีการวัดอุณหภูมินี้พบการใช้งานที่กว้างที่สุด - จาก การวินิจฉัยทางการแพทย์ก่อนตรวจสอบฉนวนกันความร้อนของอาคาร
การวัดปริมาณความร้อน
เครื่องวัดความร้อนในน้ำ
พลังงานความร้อน (ปริมาณความร้อน) ของร่างกายสามารถวัดได้โดยตรงด้วยเครื่องวัดความร้อนที่เรียกว่า อุปกรณ์ดังกล่าวรุ่นง่าย ๆ จะแสดงในรูป เป็นภาชนะปิดสนิทที่มีฉนวนหุ้มอย่างดี ซึ่งติดตั้งอุปกรณ์สำหรับวัดอุณหภูมิภายใน และบางครั้งก็เต็มไปด้วยสารทำงานที่มีคุณสมบัติที่ทราบ เช่น น้ำ ในการวัดปริมาณความร้อนในตัวร้อนขนาดเล็ก จะถูกวางในเครื่องวัดปริมาณความร้อนและรอให้ระบบเข้าสู่สภาวะสมดุลทางความร้อน ปริมาณความร้อนที่ถ่ายเทไปยังแคลอรีมิเตอร์ (แม่นยำกว่านั้นคือการเติมน้ำ) ถูกกำหนดโดยอุณหภูมิของน้ำที่เพิ่มขึ้น
ปริมาณความร้อนที่ปล่อยออกมาระหว่างปฏิกิริยาเคมี เช่น การเผาไหม้ สามารถวัดได้โดยการใส่เครื่องหมาย<бомбу>. ที่<бомбе>ตัวอย่างตั้งอยู่ซึ่งเชื่อมต่อสายไฟสำหรับจุดระเบิดและปริมาณออกซิเจนที่สอดคล้องกัน หลังจากที่ตัวอย่างเผาไหม้หมดและสร้างสมดุลทางความร้อนแล้ว จะมีการพิจารณาว่าอุณหภูมิของน้ำในเครื่องวัดความร้อนเพิ่มขึ้นเท่าใด และด้วยเหตุนี้ปริมาณความร้อนที่ปล่อยออกมา
หน่วยความร้อน
ความร้อนเป็นพลังงานรูปแบบหนึ่ง ดังนั้นจึงต้องวัดเป็นหน่วยของพลังงาน ในระบบ SI สากล หน่วยของพลังงานคือจูล (J) นอกจากนี้ยังได้รับอนุญาตให้ใช้หน่วยนอกระบบของปริมาณความร้อน - แคลอรี่: แคลอรี่สากลคือ 4.1868 J, แคลอรี่เทอร์โมเคมีคือ 4.1840 J. ในห้องปฏิบัติการต่างประเทศผลการวิจัยมักแสดงโดยใช้สิ่งที่เรียกว่า แคลอรี 15 องศาเท่ากับ 4.1855 J. British Thermal Unit (BTU) นอกระบบกำลังถูกเลิกใช้: BTU avg = 1.055 J.
แหล่งความร้อน
แหล่งความร้อนหลักคือปฏิกิริยาเคมีและนิวเคลียร์ ตลอดจนกระบวนการแปลงพลังงานต่างๆ ตัวอย่างของปฏิกิริยาเคมีกับการปล่อยความร้อน ได้แก่ การเผาไหม้และการสลายส่วนประกอบอาหาร ความร้อนเกือบทั้งหมดที่โลกได้รับมาจากปฏิกิริยานิวเคลียร์ที่เกิดขึ้นในส่วนลึกของดวงอาทิตย์ มนุษยชาติได้เรียนรู้วิธีรับความร้อนด้วยความช่วยเหลือของกระบวนการควบคุมนิวเคลียร์ฟิชชัน และตอนนี้กำลังพยายามใช้ปฏิกิริยาเทอร์โมนิวเคลียร์ฟิวชันเพื่อจุดประสงค์เดียวกัน พลังงานประเภทอื่นยังสามารถแปลงเป็นความร้อนได้ เช่น งานเครื่องกลและพลังงานไฟฟ้า สิ่งสำคัญคือต้องจำไว้ว่าพลังงานความร้อน (เช่นเดียวกับพลังงานอื่นๆ) สามารถแปลงเป็นรูปแบบอื่นได้เท่านั้น แต่ไม่สามารถรับได้<из ничего>และไม่ทำลาย นี่เป็นหนึ่งในหลักการพื้นฐานของวิทยาศาสตร์ที่เรียกว่าเทอร์โมไดนามิกส์
อุณหพลศาสตร์
อุณหพลศาสตร์เป็นศาสตร์แห่งความสัมพันธ์ระหว่างความร้อน งาน และสสาร แนวคิดสมัยใหม่เกี่ยวกับความสัมพันธ์เหล่านี้เกิดขึ้นจากผลงานของนักวิทยาศาสตร์ผู้ยิ่งใหญ่ในอดีต เช่น Carnot, Clausius, Gibbs, Joule, Kelvin และอื่นๆ อุณหพลศาสตร์อธิบายความหมายของความจุความร้อนและการนำความร้อนของสสาร การขยายตัวทางความร้อนของร่างกาย และความร้อนของการเปลี่ยนเฟส วิทยาศาสตร์นี้มีพื้นฐานมาจากกฎหมาย - หลักการทดลองหลายฉบับ
ความร้อนและคุณสมบัติของสาร
สารต่างๆมีความสามารถที่แตกต่างกันในการสะสมพลังงานความร้อน ขึ้นอยู่กับโครงสร้างโมเลกุลและความหนาแน่น ปริมาณความร้อนที่ต้องใช้ในการเพิ่มอุณหภูมิของมวลหน่วยของสารหนึ่งองศาเรียกว่าความจุความร้อนจำเพาะ ความจุความร้อนขึ้นอยู่กับสภาวะของสาร ตัวอย่างเช่น ในการทำให้อากาศหนึ่งกรัมในบอลลูนร้อนขึ้น 1 K ต้องใช้ความร้อนมากกว่าการให้ความร้อนในลักษณะเดียวกันในภาชนะที่ปิดสนิทซึ่งมีผนังแข็ง เนื่องจากพลังงานส่วนหนึ่งที่ส่งไปยังบอลลูนจะใช้ไปในการขยาย อากาศและไม่ร้อน ดังนั้น โดยเฉพาะอย่างยิ่ง ความจุความร้อนของก๊าซจะถูกวัดแยกกันที่ความดันคงที่และที่ปริมาตรคงที่
เมื่ออุณหภูมิเพิ่มขึ้น ความเข้มข้นของการเคลื่อนที่ที่วุ่นวายของโมเลกุลจะเพิ่มขึ้น - สารส่วนใหญ่จะขยายตัวเมื่อถูกความร้อน ระดับการขยายตัวของสารที่มีอุณหภูมิเพิ่มขึ้น 1 K เรียกว่า ค่าสัมประสิทธิ์การขยายตัวทางความร้อน.
เพื่อให้สารผ่านจากสถานะหนึ่งไปยังอีกสถานะหนึ่งได้ ตัวอย่างเช่น จากของแข็งเป็นของเหลว (และบางครั้งก็เปลี่ยนเป็นก๊าซทันที) จะต้องได้รับความร้อนในปริมาณหนึ่ง ถ้าร้อน แข็งจากนั้นอุณหภูมิจะสูงขึ้นจนเริ่มละลาย จนกว่าการหลอมจะเสร็จสิ้น อุณหภูมิของร่างกายจะคงที่แม้จะป้อนความร้อน ปริมาณความร้อนที่ต้องใช้ในการหลอมมวลหน่วยมวลของสารเรียกว่าความร้อนของการหลอมรวม หากคุณยังคงให้ความร้อน สารที่หลอมเหลวจะร้อนขึ้นจนเดือด ปริมาณความร้อนที่จำเป็นในการทำให้มวลหน่วยมวลของของเหลวกลายเป็นไอที่อุณหภูมิที่กำหนดเรียกว่าความร้อนของการกลายเป็นไอ
บทบาทของความร้อนและการใช้งาน
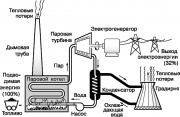
แผนการดำเนินงานของโรงไฟฟ้ากังหันไอน้ำ
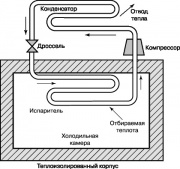
แผนภาพวงจรทำความเย็น
กระบวนการถ่ายเทความร้อนทั่วโลกไม่ได้ลดลงเพื่อทำให้โลกร้อนด้วยรังสีดวงอาทิตย์ กระแสการพาความร้อนขนาดใหญ่ในชั้นบรรยากาศเป็นตัวกำหนดการเปลี่ยนแปลงรายวันของสภาพอากาศทั่วโลก ความแตกต่างของอุณหภูมิในบรรยากาศระหว่างบริเวณเส้นศูนย์สูตรและบริเวณขั้วโลก ร่วมกับแรงโคริโอลิสอันเนื่องมาจากการหมุนของโลก นำไปสู่การปรากฏตัวของกระแสการพาความร้อนที่เปลี่ยนแปลงอย่างต่อเนื่อง เช่น ลมค้า กระแสน้ำไหลเชี่ยว และแนวหน้าที่อบอุ่นและเย็น
การถ่ายเทความร้อน (เนื่องจากการนำความร้อน) จากแกนกลางของโลกที่หลอมละลายไปยังพื้นผิวทำให้เกิดการระเบิดของภูเขาไฟและการปรากฏตัวของกีย์เซอร์ ในบางภูมิภาค พลังงานความร้อนใต้พิภพถูกใช้เพื่อให้ความร้อนในอวกาศและการผลิตไฟฟ้า
ความอบอุ่นเป็นส่วนร่วมที่ขาดไม่ได้ในแทบทั้งหมด กระบวนการผลิต. เราจะพูดถึงสิ่งสำคัญที่สุดของพวกเขา เช่น การถลุงและการแปรรูปโลหะ การทำงานของเครื่องยนต์ การผลิตอาหาร การสังเคราะห์ทางเคมี การกลั่นน้ำมัน การผลิตสิ่งของหลากหลาย - ตั้งแต่อิฐและจานไปจนถึงรถยนต์และอุปกรณ์อิเล็กทรอนิกส์ .
การผลิตและการขนส่งทางอุตสาหกรรมจำนวนมากรวมถึงโรงไฟฟ้าพลังความร้อนไม่สามารถทำงานได้หากไม่มีเครื่องยนต์ความร้อน - อุปกรณ์ที่เปลี่ยนความร้อนให้เป็นงานที่มีประโยชน์ ตัวอย่างของเครื่องจักรดังกล่าว ได้แก่ คอมเพรสเซอร์ เทอร์ไบน์ ไอน้ำ น้ำมันเบนซิน และเครื่องยนต์เจ็ท
เครื่องยนต์ความร้อนที่รู้จักกันดีที่สุดตัวหนึ่งคือกังหันไอน้ำ ซึ่งเป็นส่วนหนึ่งของวัฏจักรแรงคินที่ใช้ในโรงไฟฟ้าสมัยใหม่ แผนภาพอย่างง่ายของวัฏจักรนี้แสดงในรูป สารทำงาน - น้ำ - จะถูกแปลงเป็นไอน้ำร้อนยวดยิ่งในหม้อไอน้ำที่ให้ความร้อนโดยการเผาเชื้อเพลิงฟอสซิล (ถ่านหิน น้ำมัน หรือก๊าซธรรมชาติ) ไอน้ำสูง
Gasovik - ไดเรกทอรีอุปกรณ์ก๊าซอุตสาหกรรมของ GOST, SNiP, PB หน่วยของปริมาณทางกายภาพ, แนวคิดทางเคมีกายภาพ, อัตราส่วน, องค์ประกอบและลักษณะของก๊าซ
หน่วยวัดอุณหภูมิและปริมาณความร้อน
หน่วยพื้นฐานของการวัดอุณหภูมิคือระดับของมาตราส่วนอุณหภูมิสากล ซึ่งในทางปฏิบัติจะสอดคล้องกับองศาเซลเซียส ค่านี้เท่ากับ 1/100 ของช่วงอุณหภูมิระหว่าง 0 ถึง 100 ° C นั่นคือ ระหว่างจุดหลอมเหลวของน้ำแข็งกับน้ำเดือดที่ความดัน 760 มม. ปรอท ศิลปะ.
อุณหภูมิสัมบูรณ์คืออุณหภูมิที่วัดจากศูนย์สัมบูรณ์ นั่นคือตั้งแต่ -273.16 ° C และวัดเป็นองศาเคลวิน (° K) องศาเคลวินเท่ากับองศาเซลเซียส ดังนั้นอุณหภูมิสัมบูรณ์จะแสดงเป็นองศาเซนติเกรดดังนี้:
T, °K = t, °C + 273.16
ในระบบ SI หน่วยของอุณหภูมิคือเคลวิน อนุญาตให้แสดงผลลัพธ์เชิงปฏิบัติของการวัดอุณหภูมิโดยใช้องศาเซลเซียสพร้อมกับองศาเคลวิน ขึ้นอยู่กับจุดกำเนิด (ตำแหน่งศูนย์) บนมาตราส่วน
ตัวอย่าง: 250 ±5 °С = 523.16 ±5 °K
ในระบบ SI งาน พลังงาน และความร้อนมีหน่วยวัดเป็นจูล (J) บางครั้งใช้หน่วยที่ใหญ่กว่าและสะดวกกว่าสำหรับการใช้งานจริง - กิโลจูล (kJ) เท่ากับ 1,000 J หน่วยของงานใน SI คืองานที่ทำโดยแรง 1 N ที่การกระจัด 1 ม. พลังงาน - ปริมาณทางกายภาพแสดงให้เห็นว่าร่างกายสามารถทำงานได้ดีเพียงใด
แคลอรี่และกิโลแคลอรีสามารถใช้เป็นหน่วยความร้อนนอกระบบได้ แคลอรี่คือปริมาณความร้อนที่ต้องใช้ในการเพิ่มอุณหภูมิของน้ำ 1 กรัมขึ้น 1°C (19.5 ถึง 20.5°C)
1 แคลอรี (แคลอรี) = 4.1868 J;
1 กิโลแคลอรี (กิโลแคลอรี) \u003d 1,000 แคลอรี \u003d 4186.8 J \u003d 4.187 kJ;
1 Mcal (เมกะแคลอรี) \u003d 10 6 แคล \u003d 4.1868 MJ;
1 Gcal (gigacalorie) \u003d 10 9 cal \u003d 4186.8 MJ
สำหรับการเปรียบเทียบ เมื่อทำการประเมินเชื้อเพลิง จะเรียกว่าความร้อนตามเงื่อนไขซึ่งเรียกว่า ค่าความร้อน ซึ่งสำหรับการคำนวณจะถือว่ามีเงื่อนไขเท่ากับ 7 Mcal/kg หรือ 7 Gcal/t ในกรณีเช่นนี้ มีคนพูดถึงน้ำมันเชื้อเพลิงมาตรฐาน 1 กก. หรือ 1 ตันตามลำดับ (t.c.f.)
ความร้อนมีบทบาทสำคัญในชีวิตมนุษย์ รวมทั้งในการทำงานของร่างกายด้วย ส่วนหนึ่งของพลังงานเคมีที่มีอยู่ในอาหารจะถูกเปลี่ยนเป็นความร้อนเนื่องจากอุณหภูมิของร่างกายจะอยู่ที่ 37
° C. ความสมดุลของความร้อนในร่างกายมนุษย์นั้นขึ้นอยู่กับอุณหภูมิแวดล้อมด้วย และผู้คนถูกบังคับให้ใช้พลังงานจำนวนมากในการทำความร้อนในที่พักอาศัยและโรงงานอุตสาหกรรมในฤดูหนาว และระบายความร้อนในฤดูร้อน พลังงานส่วนใหญ่นี้มาจากเครื่องยนต์ความร้อน เช่น โรงต้มน้ำและกังหันไอน้ำของโรงไฟฟ้าที่ใช้เชื้อเพลิงฟอสซิล (ถ่านหิน น้ำมัน) และผลิตกระแสไฟฟ้าจนถึงปลายศตวรรษที่ 18 ความร้อนถือเป็นวัสดุโดยเชื่อว่าอุณหภูมิของร่างกายถูกกำหนดโดยปริมาณของ "ของเหลวแคลอรี่" หรือ "แคลอรี่" ที่บรรจุอยู่ในนั้น ต่อมา บี. รัมฟอร์ด เจ. จูลและนักฟิสิกส์คนอื่นๆ ในเวลานั้น ได้หักล้างทฤษฎี "แคลอรี่" ด้วยการทดลองและการใช้เหตุผลอันชาญฉลาด โดยพิสูจน์ว่าความร้อนไม่มีน้ำหนัก และสามารถรับได้ในปริมาณใดๆ อันเนื่องมาจากการเคลื่อนไหวทางกล ความร้อนไม่ใช่สสาร แต่เป็นเพียงพลังงานของการเคลื่อนที่ของอะตอมหรือโมเลกุลเท่านั้น นี่คือความเข้าใจเรื่องความร้อนที่ฟิสิกส์สมัยใหม่ยึดถือ ดูสิ่งนี้ด้วยฟิสิกส์.
ในบทความนี้ เราจะพิจารณาว่าความร้อนและอุณหภูมิสัมพันธ์กันอย่างไร และวัดปริมาณเหล่านี้อย่างไร หัวข้อของการสนทนาของเราจะเป็นคำถามต่อไปนี้: การถ่ายเทความร้อนจากส่วนใดส่วนหนึ่งของร่างกายไปยังส่วนอื่น การถ่ายเทความร้อนในสุญญากาศ (ช่องว่างที่ไม่มีสสาร); บทบาทของความร้อนในโลกสมัยใหม่
ความร้อนและอุณหภูมิ ปริมาณพลังงานความร้อนในสารไม่สามารถกำหนดได้โดยการสังเกตการเคลื่อนที่ของแต่ละโมเลกุลแยกกัน ในทางตรงกันข้าม โดยการศึกษาคุณสมบัติมหภาคของสสารเท่านั้น เราสามารถค้นหาลักษณะของการเคลื่อนที่ด้วยกล้องจุลทรรศน์ของโมเลกุลจำนวนมากโดยเฉลี่ยในช่วงระยะเวลาหนึ่ง อุณหภูมิของสารเป็นตัวบ่งชี้เฉลี่ยของความเข้มของการเคลื่อนที่ของโมเลกุล ซึ่งพลังงานนั้นเป็นพลังงานความร้อนของสารหนึ่งในวิธีที่คุ้นเคยที่สุด แต่ยังเป็นวิธีที่แม่นยำน้อยที่สุดในการประเมินอุณหภูมิด้วยการสัมผัส สัมผัสวัตถุเราตัดสินว่าร้อนหรือเย็นโดยเน้นที่ความรู้สึกของเรา แน่นอนว่าความรู้สึกเหล่านี้ขึ้นอยู่กับอุณหภูมิของร่างกาย ซึ่งทำให้เราได้แนวคิดเรื่องสมดุลความร้อน ซึ่งเป็นหนึ่งในปัจจัยที่สำคัญที่สุดในการวัดอุณหภูมิ
สมดุลความร้อน แน่นอน ถ้าสองร่าง A และ บี (รูปที่ 1) กดเข้าหากันแน่น ๆ จากนั้นเมื่อสัมผัสพวกมันเป็นเวลานานพอสมควรเราจะสังเกตเห็นว่าอุณหภูมิของพวกมันเท่ากัน ในกรณีนี้ร่างกายจะเรียกว่า A และ บี อยู่ในสภาวะสมดุลทางความร้อนซึ่งกันและกัน อย่างไรก็ตาม โดยทั่วไปแล้ว ร่างกายไม่จำเป็นต้องสัมผัสกันเพื่อให้สมดุลทางความร้อนมีอยู่ระหว่างกัน แค่อุณหภูมิของพวกมันจะเท่ากันก็เพียงพอแล้ว สามารถตรวจสอบได้โดยใช้ร่างกายที่สาม ค , นำเข้าสู่สมดุลความร้อนกับร่างกายก่อน อา แล้วเปรียบเทียบอุณหภูมิของร่างกาย C และ ข. ร่างกาย ค ที่นี่เล่นบทบาทของเทอร์โมมิเตอร์ ในการกำหนดที่เข้มงวด หลักการนี้เรียกว่ากฎข้อที่ศูนย์ของอุณหพลศาสตร์: ถ้าวัตถุ A และ B อยู่ในสมดุลความร้อนกับวัตถุที่สาม C วัตถุเหล่านี้ก็จะอยู่ในสมดุลความร้อนซึ่งกันและกันกฎหมายนี้รองรับวิธีการวัดอุณหภูมิทั้งหมดการวัดอุณหภูมิ หากเราต้องการทำการทดลองและการคำนวณที่แม่นยำ การให้คะแนนอุณหภูมิเช่น ร้อน อุ่น เย็น และเย็นนั้นไม่เพียงพอ เราจำเป็นต้องมีมาตราส่วนอุณหภูมิที่สำเร็จการศึกษา มีเกล็ดหลายขนาด และมักจะใช้จุดเยือกแข็งและจุดเดือดของน้ำเป็นจุดอ้างอิง เครื่องชั่งทั่วไปสี่เครื่องแสดงในรูปที่ 2. มาตราส่วนเซนติเกรดตามจุดเยือกแข็งของน้ำเท่ากับ0° และจุดเดือดคือ 100° เรียกว่ามาตราส่วนเซลเซียสซึ่งตั้งชื่อตามเอ. เซลเซียส นักดาราศาสตร์ชาวสวีเดนซึ่งอธิบายไว้ในปี ค.ศ. 1742 เชื่อกันว่า K. Linney นักธรรมชาติวิทยาชาวสวีเดนเป็นคนแรกที่ใช้มาตราส่วนนี้ ตอนนี้มาตราส่วนเซลเซียสเป็นเรื่องธรรมดาที่สุดในโลก มาตราส่วนอุณหภูมิฟาเรนไฮต์ซึ่งจุดเยือกแข็งและจุดเดือดของน้ำสอดคล้องกับตัวเลขที่อึดอัดอย่างยิ่ง 32 และ 212° , ถูกเสนอในปี 1724 โดย G. Fahrenheit. มาตราส่วนฟาเรนไฮต์ใช้กันอย่างแพร่หลายในประเทศที่พูดภาษาอังกฤษ แต่แทบจะไม่มีการใช้ในวรรณคดีทางวิทยาศาสตร์ เพื่อแปลงอุณหภูมิเป็นเซลเซียส (° C) ถึงอุณหภูมิฟาเรนไฮต์ (° F) มีสูตร° F = (9/5) ° C + 32 และสำหรับสูตรการแปลย้อนกลับ°C = (5/9)(°F - 32) เครื่องชั่งทั้งสอง ทั้งฟาเรนไฮต์และเซลเซียส ไม่สะดวกอย่างยิ่งเมื่อทำการทดลองในสภาวะที่อุณหภูมิลดลงต่ำกว่าจุดเยือกแข็งของน้ำและแสดงเป็นจำนวนลบ ในกรณีเช่นนี้ มาตราส่วนอุณหภูมิสัมบูรณ์ได้ถูกนำมาใช้ ซึ่งอิงจากการประมาณค่าถึงศูนย์สัมบูรณ์ที่เรียกว่าจุดสัมบูรณ์ ซึ่งเป็นจุดที่การเคลื่อนที่ของโมเลกุลต้องหยุดลง หนึ่งในนั้นเรียกว่าสเกลแรนกินและอีกอันเรียกว่าสเกลอุณหพลศาสตร์สัมบูรณ์ อุณหภูมิวัดเป็นองศา Rankine (° R) และเคลวิน (K) เกล็ดทั้งสองเริ่มต้นที่ศูนย์สัมบูรณ์และจุดเยือกแข็งของน้ำ 491.7° R และ 273.16 K จำนวนองศาและเคลวินระหว่างจุดเยือกแข็งและจุดเดือดของน้ำในระดับเซลเซียสและมาตราส่วนเทอร์โมไดนามิกสัมบูรณ์จะเท่ากันและเท่ากับ 100 สำหรับมาตราส่วนฟาเรนไฮต์และแรงคินก็เหมือนกัน แต่เท่ากับ 180 องศาเซลเซียสองศาเซลเซียสจะถูกแปลงเป็นเคลวินโดยใช้สูตร K \u003d° C + 273.16 และองศาฟาเรนไฮต์เป็นองศาแรงคินโดยใช้สูตร°R = °F + 459.7 การทำงานของอุปกรณ์ที่ออกแบบมาเพื่อวัดอุณหภูมิขึ้นอยู่กับปรากฏการณ์ทางกายภาพต่างๆ ที่เกี่ยวข้องกับการเปลี่ยนแปลงของพลังงานความร้อนของสาร การเปลี่ยนแปลงความต้านทานไฟฟ้า ปริมาตร ความดัน ลักษณะการแผ่รังสี และคุณสมบัติทางเทอร์โมอิเล็กทริก เครื่องมือวัดอุณหภูมิที่ง่ายและคุ้นเคยที่สุดอย่างหนึ่งคือเทอร์โมมิเตอร์แบบปรอทในแก้วที่แสดงในรูปที่ 3, ก. ลูกบอลที่มีปรอทในส่วนล่างของเทอร์โมมิเตอร์วางอยู่ในสื่อหรือกดทับวัตถุที่ต้องการวัดอุณหภูมิ และขึ้นอยู่กับว่าลูกบอลได้รับความร้อนหรือปล่อยออก ปรอทจะขยายตัวหรือหดตัวและคอลัมน์ของมันจะสูงขึ้นหรือ ตกอยู่ในเส้นเลือดฝอย หากเทอร์โมมิเตอร์ถูกปรับเทียบล่วงหน้าและติดตั้งเครื่องชั่ง คุณก็จะสามารถค้นหาอุณหภูมิของร่างกายได้โดยตรงอุปกรณ์อีกตัวหนึ่งที่ทำงานโดยอาศัยการขยายตัวทางความร้อนคือเทอร์โมมิเตอร์แบบไบเมทัลที่แสดงในรูปที่
3, ข. องค์ประกอบหลัก แผ่นเกลียวของโลหะบัดกรีสองอันที่มีค่าสัมประสิทธิ์การขยายตัวทางความร้อนต่างกัน เมื่อถูกความร้อน โลหะชนิดใดชนิดหนึ่งจะขยายตัวมากกว่าโลหะอื่น เกลียวจะบิดและหมุนลูกศรที่สัมพันธ์กับมาตราส่วน อุปกรณ์ดังกล่าวมักใช้ในการวัดอุณหภูมิอากาศในร่มและกลางแจ้ง แต่ไม่เหมาะสำหรับการกำหนดอุณหภูมิในท้องถิ่นอุณหภูมิในพื้นที่มักจะวัดโดยใช้เทอร์โมคัปเปิล ซึ่งเป็นสายโลหะสองเส้นที่บัดกรีที่ปลายด้านหนึ่ง (รูปที่
4, ก) เมื่อจุดเชื่อมต่อดังกล่าวถูกทำให้ร้อน แรงเคลื่อนไฟฟ้าจะเกิดขึ้นที่ปลายสายไฟที่ว่าง ซึ่งมักจะเป็นมิลลิโวลต์ เทอร์โมคัปเปิลทำจากโลหะหลายคู่ ได้แก่ เหล็กและคอนสแตนแทน ทองแดงและคอนสแตนแทน โครเมล และอลูเมล thermo-EMF ของพวกมันเปลี่ยนแปลงเกือบเป็นเส้นตรงตามอุณหภูมิในช่วงอุณหภูมิที่กว้างผลกระทบเทอร์โมอิเล็กทริกอื่น ๆ เป็นที่รู้จักกัน - การพึ่งพาความต้านทานของวัสดุที่เป็นสื่อกระแสไฟฟ้าต่ออุณหภูมิ มันรองรับการทำงานของเทอร์โมมิเตอร์วัดความต้านทานไฟฟ้า ซึ่งหนึ่งในนั้นแสดงไว้ในรูปที่
4, ข. ความต้านทานขององค์ประกอบที่ไวต่ออุณหภูมิขนาดเล็ก (เซ็นเซอร์ความร้อน) มักจะเป็นขดลวดของเส้นลวดบาง ๆ เปรียบเทียบกับความต้านทานของตัวต้านทานปรับเทียบที่ปรับเทียบแล้วโดยใช้สะพานวีทสโตน เครื่องมือส่งออกสามารถสำเร็จการศึกษาได้โดยตรงในหน่วยองศาOptical pyrometers ใช้ในการวัดอุณหภูมิของหลอดไส้ที่ปล่อยแสงที่มองเห็นได้ ในอุปกรณ์รุ่นหนึ่งนี้ แสงที่ปล่อยออกมาจากร่างกายจะถูกนำไปเปรียบเทียบกับการแผ่รังสีของหลอดไส้ที่วางอยู่ในระนาบโฟกัสของกล้องส่องทางไกลซึ่งมองเห็นตัวที่เปล่งแสง กระแสไฟฟ้าที่ให้ความร้อนแก่ไส้หลอดจะเปลี่ยนไป จนกระทั่งการเปรียบเทียบภาพของการเรืองแสงของไส้หลอดกับร่างกายเผยให้เห็นว่ามีการสร้างสมดุลทางความร้อนระหว่างกัน สเกลของอุปกรณ์สามารถเลื่อนระดับได้โดยตรงในหน่วยอุณหภูมิ
ความก้าวหน้าทางเทคนิคในช่วงไม่กี่ปีที่ผ่านมาทำให้สามารถสร้างเซ็นเซอร์อุณหภูมิใหม่ได้ ตัวอย่างเช่น ในกรณีที่จำเป็นต้องมีความไวสูงเป็นพิเศษ จะใช้อุปกรณ์เซมิคอนดักเตอร์ เทอร์มิสเตอร์ แทนเทอร์โมคัปเปิลหรือเทอร์โมมิเตอร์แบบต้านทานแบบธรรมดา นอกจากนี้ สีย้อมและผลึกเหลวที่เปลี่ยนสถานะเฟสยังใช้เป็นตัวแปลงความร้อน โดยเฉพาะอย่างยิ่งในกรณีที่อุณหภูมิพื้นผิวของร่างกายแตกต่างกันไปในช่วงกว้าง ในที่สุด จะใช้การถ่ายภาพความร้อนอินฟราเรด ซึ่งได้ภาพอินฟราเรดของวัตถุในสีตามเงื่อนไข โดยที่แต่ละสีจะสอดคล้องกับอุณหภูมิที่แน่นอน วิธีการวัดอุณหภูมินี้พบการใช้งานที่กว้างที่สุดตั้งแต่การวินิจฉัยทางการแพทย์ไปจนถึงการตรวจสอบฉนวนกันความร้อนของห้อง ดูสิ่งนี้ด้วยฟิสิกส์ของโซลิดสเตต; คริสตัลเหลว
การวัดปริมาณความร้อน พลังงานความร้อน (ปริมาณความร้อน) ของร่างกายสามารถวัดได้โดยตรงด้วยเครื่องวัดความร้อนที่เรียกว่า รุ่นง่าย ๆ ของอุปกรณ์ดังกล่าวแสดงในรูปที่ 5. นี่คือภาชนะปิดที่มีฉนวนอย่างดี ซึ่งติดตั้งอุปกรณ์สำหรับวัดอุณหภูมิภายใน และบางครั้งก็เต็มไปด้วยของเหลวทำงานที่มีคุณสมบัติที่ทราบ เช่น น้ำ ในการวัดปริมาณความร้อนในตัวร้อนขนาดเล็ก จะถูกวางในเครื่องวัดปริมาณความร้อนและรอให้ระบบเข้าสู่สภาวะสมดุลทางความร้อน ปริมาณความร้อนที่ถ่ายเทไปยังแคลอรีมิเตอร์ (แม่นยำกว่านั้นคือการเติมน้ำ) ถูกกำหนดโดยอุณหภูมิของน้ำที่เพิ่มขึ้นปริมาณความร้อนที่ปล่อยออกมาระหว่างปฏิกิริยาเคมี เช่น การเผาไหม้ สามารถวัดได้โดยการวาง "ระเบิด" ขนาดเล็กลงในเครื่องวัดปริมาณความร้อน "ระเบิด" ประกอบด้วยตัวอย่างซึ่งต่อสายไฟสำหรับการจุดระเบิดและปริมาณออกซิเจนที่เกี่ยวข้อง หลังจากที่ตัวอย่างเผาไหม้จนหมดและสร้างสมดุลทางความร้อนแล้ว จะมีการพิจารณาว่าอุณหภูมิของน้ำในเครื่องวัดปริมาณความร้อนเพิ่มขึ้นเท่าใด และด้วยเหตุนี้ปริมาณความร้อนที่ปล่อยออกมา ดูสิ่งนี้ด้วยแคลอรี่
หน่วยความร้อน ความร้อนเป็นพลังงานรูปแบบหนึ่ง ดังนั้นจึงต้องวัดเป็นหน่วยของพลังงาน ในระบบ SI สากล หน่วยของพลังงานคือจูล (J) นอกจากนี้ยังได้รับอนุญาตให้ใช้หน่วยที่ไม่เป็นระบบของปริมาณแคลอรี่ความร้อน: แคลอรี่สากลคือ 4.1868 J, แคลอรี่เทอร์โมเคมีคือ 4.1840 J. ในห้องปฏิบัติการต่างประเทศผลการวิจัยมักแสดงโดยใช้สิ่งที่เรียกว่า แคลอรี 15 องศาเท่ากับ 4.1855 J. British Thermal Unit (BTU) นอกระบบกำลังถูกเลิกใช้: BTU avg = 1.055 J. แหล่งความร้อนหลักคือปฏิกิริยาเคมีและนิวเคลียร์ ตลอดจนกระบวนการแปลงพลังงานต่างๆ ตัวอย่างของปฏิกิริยาเคมีกับการปล่อยความร้อน ได้แก่ การเผาไหม้และการสลายส่วนประกอบอาหาร ความร้อนเกือบทั้งหมดที่โลกได้รับมาจากปฏิกิริยานิวเคลียร์ที่เกิดขึ้นในส่วนลึกของดวงอาทิตย์ มนุษยชาติได้เรียนรู้วิธีรับความร้อนด้วยความช่วยเหลือของกระบวนการควบคุมนิวเคลียร์ฟิชชัน และตอนนี้กำลังพยายามใช้ปฏิกิริยาเทอร์โมนิวเคลียร์ฟิวชันเพื่อจุดประสงค์เดียวกัน พลังงานประเภทอื่นยังสามารถแปลงเป็นความร้อนได้ เช่น งานเครื่องกลและพลังงานไฟฟ้า สิ่งสำคัญคือต้องจำไว้ว่าพลังงานความร้อน (เหมือนอย่างอื่น) สามารถเปลี่ยนเป็นรูปแบบอื่นได้เท่านั้น แต่ไม่สามารถได้รับ "จากความว่างเปล่า" หรือไม่สามารถทำลายได้ นี่เป็นหนึ่งในหลักการพื้นฐานของวิทยาศาสตร์ที่เรียกว่าเทอร์โมไดนามิกส์ เทอร์โมไดนามิกส์ อุณหพลศาสตร์เป็นศาสตร์แห่งความสัมพันธ์ระหว่างความร้อน งาน และสสาร แนวคิดสมัยใหม่เกี่ยวกับความสัมพันธ์เหล่านี้เกิดขึ้นจากผลงานของนักวิทยาศาสตร์ผู้ยิ่งใหญ่ในอดีต เช่น Carnot, Clausius, Gibbs, Joule, Kelvin และอื่นๆ อุณหพลศาสตร์อธิบายความหมายของความจุความร้อนและการนำความร้อนของสสาร การขยายตัวทางความร้อนของร่างกาย และความร้อนของการเปลี่ยนเฟส วิทยาศาสตร์นี้มีพื้นฐานมาจากหลักการของกฎหมายที่จัดตั้งขึ้นโดยการทดลองหลายประการจุดเริ่มต้นของเทอร์โมไดนามิกส์ กฎข้อที่ศูนย์ของอุณหพลศาสตร์ที่กำหนดข้างต้นแนะนำแนวคิดของสมดุลทางความร้อน อุณหภูมิ และเทอร์โมมิเตอร์ กฎข้อที่หนึ่งของอุณหพลศาสตร์คือคำกล่าวที่มีความสำคัญต่อวิทยาศาสตร์ทั้งหมดโดยรวม: พลังงานไม่สามารถถูกทำลายหรือได้รับ "จากความว่างเปล่า" ดังนั้นพลังงานทั้งหมดของจักรวาลจึงเป็นค่าคงที่ ในรูปแบบที่ง่ายที่สุด กฎข้อที่หนึ่งของเทอร์โมไดนามิกส์สามารถระบุได้ดังนี้ พลังงานที่ระบบได้รับ ลบด้วยพลังงานที่สูญเสียไป เท่ากับพลังงานที่เหลืออยู่ในระบบ เมื่อมองแวบแรก ข้อความนี้ดูเหมือนชัดเจน แต่ไม่ชัดเจน ตัวอย่างเช่น, สถานการณ์อย่างเช่น การเผาไหม้ของน้ำมันเบนซินในกระบอกสูบของเครื่องยนต์รถยนต์ ในที่นี้ พลังงานที่ได้รับคือสารเคมี พลังงานที่จ่ายออกไปเป็นพลังงานกล (งาน) และพลังงานที่เหลืออยู่ในระบบคือความร้อนดังนั้นจึงเป็นที่ชัดเจนว่าพลังงานสามารถเปลี่ยนจากรูปแบบหนึ่งเป็นอีกรูปแบบหนึ่งได้ และการเปลี่ยนแปลงดังกล่าวเกิดขึ้นอย่างต่อเนื่องในธรรมชาติและเทคโนโลยี กว่าร้อยปีที่แล้ว J. Joule ได้พิสูจน์กรณีของการแปลงพลังงานกลเป็นพลังงานความร้อนโดยใช้อุปกรณ์ที่แสดงในรูปที่ 6, เอ. ในอุปกรณ์นี้ น้ำหนักที่ขึ้นและลงจะหมุนเพลาด้วยใบมีดในเครื่องวัดปริมาณความร้อนที่เติมน้ำ ซึ่งเป็นผลมาจากการที่น้ำได้รับความร้อน การวัดที่แม่นยำทำให้ Joule สามารถระบุได้ว่าแคลอรี่ความร้อน 1 แคลอรีเทียบเท่ากับ 4.186 J ของงานเครื่องกล อุปกรณ์ที่แสดงในรูป
6, ข ถูกใช้เพื่อหาค่าความร้อนเทียบเท่าพลังงานไฟฟ้ากฎข้อที่หนึ่งของอุณหพลศาสตร์อธิบายปรากฏการณ์ทั่วไปหลายอย่าง ตัวอย่างเช่น เป็นที่ชัดเจนว่าเหตุใดจึงเป็นไปไม่ได้ที่จะทำให้ห้องครัวเย็นลงด้วยตู้เย็นแบบเปิด สมมติว่าเราได้กันความร้อนในห้องครัวจากสิ่งแวดล้อม พลังงานถูกส่งไปยังระบบอย่างต่อเนื่องผ่านสายไฟของตู้เย็น แต่ระบบไม่ปล่อยพลังงานใดๆ ดังนั้นพลังงานทั้งหมดของตู้เย็นจะเพิ่มขึ้น และห้องครัวก็อุ่นขึ้น เพียงแค่แตะท่อของเครื่องแลกเปลี่ยนความร้อน (คอนเดนเซอร์) ที่ด้านหลังของตู้เย็น แล้วคุณจะเข้าใจว่าอุปกรณ์ "ทำความเย็น" นั้นไร้ประโยชน์ แต่ถ้าท่อเหล่านี้ถูกนำออกจากระบบ (เช่น ออกนอกหน้าต่าง) ห้องครัวก็จะให้พลังงานมากกว่าที่ได้รับ นั่นคือ จะเย็นลงและตู้เย็นทำงานเป็นเครื่องปรับอากาศแบบหน้าต่าง
กฎข้อที่หนึ่งของอุณหพลศาสตร์คือกฎแห่งธรรมชาติที่ขัดขวางการสร้างหรือการทำลายพลังงาน อย่างไรก็ตาม มันไม่ได้บอกอะไรเกี่ยวกับกระบวนการถ่ายโอนพลังงานที่ดำเนินไปในธรรมชาติ ดังนั้นเราจึงรู้ว่าร่างกายที่ร้อนจะทำให้ร่างกายร้อนขึ้นหากร่างกายเหล่านี้สัมผัสกัน แต่ร่างกายที่เย็นชาสามารถถ่ายเทความร้อนสำรองไปเป็นตัวร้อนได้หรือไม่? โอกาสสุดท้ายปฏิเสธอย่างเด็ดขาดโดยกฎข้อที่สองของอุณหพลศาสตร์
กฎข้อแรกยังไม่รวมความเป็นไปได้ในการสร้างเครื่องยนต์ที่มีค่าสัมประสิทธิ์ การกระทำที่เป็นประโยชน์(ประสิทธิภาพ) มากกว่า 100% (คล้ายกัน
"นิรันดร์" เครื่องยนต์สามารถให้พลังงานมากกว่าปกติเป็นเวลานานกว่าปกติ) เป็นไปไม่ได้ที่จะสร้างเครื่องยนต์แม้ว่าจะมีประสิทธิภาพเท่ากับ 100% เนื่องจากพลังงานบางส่วนที่จ่ายให้กับเครื่องยนต์จะต้องสูญเสียไปในรูปของพลังงานความร้อนที่มีประโยชน์น้อยกว่า ดังนั้นล้อจะไม่หมุนอย่างไม่มีกำหนดหากไม่มีการจ่ายพลังงาน เนื่องจากเนื่องจากแรงเสียดทานในตลับลูกปืน พลังงานของการเคลื่อนไหวทางกลจะค่อยๆ เปลี่ยนเป็นความร้อนจนกว่าล้อจะหยุดแนวโน้มที่จะเปลี่ยนงานที่ "มีประโยชน์" ให้เป็นพลังงานความร้อนที่มีประโยชน์น้อยกว่าสามารถเปรียบเทียบได้กับกระบวนการอื่นที่เกิดขึ้นเมื่อเรือสองลำที่มีก๊าซต่างกันเชื่อมต่อกัน หลังจากรอนานพอ เราพบว่าในเรือทั้งสองลำมีส่วนผสมที่เป็นเนื้อเดียวกันของก๊าซธรรมชาติทำหน้าที่ในลักษณะที่ลำดับของระบบลดลง การวัดทางอุณหพลศาสตร์ของความผิดปกตินี้เรียกว่าเอนโทรปี และกฎข้อที่สองของอุณหพลศาสตร์สามารถกำหนดได้แตกต่างกัน: กระบวนการในธรรมชาติมักจะดำเนินไปในลักษณะที่เอนโทรปีของระบบและสภาพแวดล้อมเพิ่มขึ้น ดังนั้นพลังงานของจักรวาลจึงคงที่ในขณะที่เอนโทรปีของมันเติบโตอย่างต่อเนื่อง
ความร้อนและคุณสมบัติของสาร สารต่าง ๆ มีความสามารถในการเก็บพลังงานความร้อนต่างกัน ขึ้นอยู่กับโครงสร้างโมเลกุลและความหนาแน่น ปริมาณความร้อนที่ต้องใช้ในการเพิ่มอุณหภูมิของมวลหน่วยของสารหนึ่งองศาเรียกว่าของมัน ความร้อนจำเพาะ. ความจุความร้อนขึ้นอยู่กับสภาวะของสาร ตัวอย่างเช่น ในการทำให้อากาศหนึ่งกรัมในบอลลูนร้อนขึ้น 1 K ต้องใช้ความร้อนมากกว่าการให้ความร้อนในลักษณะเดียวกันในภาชนะที่ปิดสนิทซึ่งมีผนังแข็ง เนื่องจากพลังงานส่วนหนึ่งที่ส่งไปยังบอลลูนจะใช้ไปในการขยาย อากาศและไม่ร้อน ดังนั้น โดยเฉพาะอย่างยิ่ง ความจุความร้อนของก๊าซจะถูกวัดแยกกันที่ความดันคงที่และที่ปริมาตรคงที่เมื่ออุณหภูมิเพิ่มขึ้น ความเข้มข้นของการเคลื่อนที่แบบโกลาหลของโมเลกุลจะเพิ่มสารส่วนใหญ่เมื่อถูกความร้อน ระดับการขยายตัวของสารที่มีอุณหภูมิเพิ่มขึ้น 1 K เรียกว่าสัมประสิทธิ์การขยายตัวทางความร้อน
เพื่อให้สารผ่านจากสถานะหนึ่งไปยังอีกสถานะหนึ่งได้ ตัวอย่างเช่น จากของแข็งเป็นของเหลว (และบางครั้งก็เปลี่ยนเป็นก๊าซทันที) จะต้องได้รับความร้อนในปริมาณหนึ่ง ถ้าวัตถุแข็งถูกทำให้ร้อน อุณหภูมิของมันจะเพิ่มขึ้นจนกระทั่งมันเริ่มละลาย จนกว่าการหลอมจะเสร็จสิ้น อุณหภูมิของร่างกายจะคงที่แม้จะมีความร้อน ปริมาณความร้อนที่ต้องใช้ในการหลอมมวลหน่วยมวลของสารเรียกว่าความร้อนของการหลอมรวม หากคุณยังคงให้ความร้อน สารที่หลอมเหลวจะร้อนขึ้นจนเดือด ปริมาณความร้อนที่จำเป็นในการทำให้มวลหน่วยมวลของของเหลวกลายเป็นไอที่อุณหภูมิที่กำหนดเรียกว่าความร้อนของการกลายเป็นไอ
ทฤษฎีโมเลกุล-จลนศาสตร์ ทฤษฎีจลนพลศาสตร์ของโมเลกุลอธิบายคุณสมบัติมหภาคของสารโดยพิจารณาในระดับจุลทรรศน์ถึงพฤติกรรมของอะตอมและโมเลกุลที่ประกอบขึ้นเป็นสารนี้ ในกรณีนี้ ใช้วิธีทางสถิติและมีการตั้งสมมติฐานเกี่ยวกับตัวอนุภาคเองและธรรมชาติของการเคลื่อนที่ของอนุภาค ดังนั้น โมเลกุลจึงถูกพิจารณาว่าเป็นลูกบอลแข็ง ซึ่งในตัวกลางที่เป็นก๊าซจะมีการเคลื่อนที่แบบโกลาหลอย่างต่อเนื่องและวิ่งเป็นระยะทางไกลจากการชนกันครั้งหนึ่งไปยังอีกที่หนึ่ง การชนกันถือเป็นการยืดหยุ่นและเกิดขึ้นระหว่างอนุภาคที่มีขนาดเล็กและมีจำนวนที่มาก ไม่มีก๊าซจริงชนิดใดที่สอดคล้องกับแบบจำลองนี้ทุกประการ แต่ก๊าซส่วนใหญ่ค่อนข้างใกล้เคียงกัน ซึ่งเป็นเหตุผลสำหรับมูลค่าเชิงปฏิบัติของทฤษฎีจลนพลศาสตร์ระดับโมเลกุลจากแนวคิดเหล่านี้และการใช้วิธีการทางสถิติ แมกซ์เวลล์ได้มาจากการกระจายความเร็วของโมเลกุลของแก๊สในปริมาตรที่จำกัด ซึ่งต่อมาได้รับการตั้งชื่อตามเขา การกระจายนี้ถูกนำเสนอแบบกราฟิกในรูปที่ 7 สำหรับมวลไฮโดรเจนที่กำหนดที่อุณหภูมิ 100 และ 1,000
° C. พิกัดแทนจำนวนโมเลกุลที่เคลื่อนที่ด้วยความเร็วที่ระบุบน abscissa จำนวนอนุภาคทั้งหมดเท่ากับพื้นที่ใต้เส้นโค้งแต่ละเส้น และเท่ากันในทั้งสองกรณี จากกราฟจะเห็นได้ว่าอนุภาคส่วนใหญ่มีความเร็วใกล้เคียงกับค่าเฉลี่ยบางค่า และมีเพียงไม่กี่อนุภาคเท่านั้นที่มีความเร็วสูงหรือต่ำมาก ความเร็วเฉลี่ยที่อุณหภูมิเหล่านี้อยู่ในช่วง 2,000-3,000 m/s กล่าวคือ มีขนาดใหญ่มาก.โมเลกุลของก๊าซที่เคลื่อนที่อย่างรวดเร็วจำนวนมากดังกล่าวทำหน้าที่ด้วยแรงที่วัดได้อย่างสมบูรณ์บนวัตถุโดยรอบ แรงระดับจุลภาคที่โมเลกุลของก๊าซจำนวนมากชนกับผนังของภาชนะเพิ่มเป็นปริมาณมหภาคที่เรียกว่าความดัน เมื่อพลังงานถูกส่งไปยังก๊าซ (อุณหภูมิสูงขึ้น) พลังงานจลน์เฉลี่ยของโมเลกุลจะเพิ่มขึ้น อนุภาคของก๊าซจะกระทบกับผนังบ่อยขึ้นและหนักขึ้น ความดันจะเพิ่มขึ้น และหากผนังไม่แข็งตัวเต็มที่ มันก็จะยืดออกและ ปริมาตรของก๊าซเพิ่มขึ้น ดังนั้น วิธีการทางสถิติด้วยกล้องจุลทรรศน์ที่อยู่ภายใต้ทฤษฎีจลนพลศาสตร์ของโมเลกุลทำให้สามารถอธิบายปรากฏการณ์ของการขยายตัวทางความร้อนที่เราได้พูดคุยกัน
ผลลัพธ์อีกประการหนึ่งของทฤษฎีจลนพลศาสตร์ระดับโมเลกุลคือกฎหมายที่อธิบายคุณสมบัติของก๊าซที่เป็นไปตามข้อกำหนดที่ระบุไว้ข้างต้น สมการนี้เรียกว่าสมการสถานะ ก๊าซในอุดมคติเชื่อมความดัน ปริมาตร และอุณหภูมิของก๊าซหนึ่งโมลและมีลักษณะเท่าเทียมกัน
PV = RT โดยที่ พี ความกดดัน, ปริมาณ V, ตู่ อุณหภูมิและ R ค่าคงที่แก๊สสากลเท่ากับ (8.31441± 0.00026) J/(โมล H ถึง). ดูสิ่งนี้ด้วยทฤษฎีโมเลกุล-จลนศาสตร์;เทอร์โมไดนามิกส์ การถ่ายเทความร้อน การถ่ายเทความร้อนเป็นกระบวนการถ่ายเทความร้อนภายในร่างกายหรือจากร่างกายหนึ่งไปยังอีกร่างกายหนึ่งเนื่องจากความแตกต่างของอุณหภูมิ ความเข้มของการถ่ายเทความร้อนขึ้นอยู่กับคุณสมบัติของสาร ความแตกต่างของอุณหภูมิ และเป็นไปตามกฎธรรมชาติที่สร้างโดยการทดลอง ในการสร้างระบบทำความร้อนหรือทำความเย็นที่มีประสิทธิภาพ เครื่องยนต์ต่างๆ โรงไฟฟ้า ระบบฉนวนกันความร้อน คุณจำเป็นต้องรู้หลักการถ่ายเทความร้อน ในบางกรณี การแลกเปลี่ยนความร้อนเป็นสิ่งที่ไม่พึงปรารถนา (ฉนวนกันความร้อนของเตาหลอม ยานอวกาศ ฯลฯ) ในขณะที่บางกรณีควรมีขนาดใหญ่ที่สุด (หม้อไอน้ำ เครื่องแลกเปลี่ยนความร้อน เครื่องครัว)การถ่ายเทความร้อนมีสามประเภทหลัก: การนำความร้อน การพาความร้อน และการถ่ายเทความร้อนแบบแผ่รังสี
การนำความร้อน หากอุณหภูมิในร่างกายแตกต่างกัน พลังงานความร้อนจะส่งผ่านจากส่วนที่ร้อนกว่าไปยังส่วนที่เย็นกว่า การถ่ายเทความร้อนประเภทนี้เนื่องจากการเคลื่อนที่ของความร้อนและการชนกันของโมเลกุล เรียกว่า การนำความร้อน พอแล้ว อุณหภูมิสูงในของแข็งสามารถมองเห็นได้ด้วยตาเปล่า ดังนั้น เมื่อแท่งเหล็กถูกทำให้ร้อนจากปลายด้านหนึ่งของเปลวไฟของหัวเตาแก๊ส พลังงานความร้อนจะถูกถ่ายเทผ่านแท่งเหล็ก และแสงจะกระจายออกไปในระยะที่กำหนดจากปลายที่ร้อน (รุนแรงน้อยลงเรื่อยๆ ด้วยระยะห่างจากสถานที่ ความร้อน)ความเข้มของการถ่ายเทความร้อนอันเนื่องมาจากการนำความร้อนขึ้นอยู่กับการไล่ระดับอุณหภูมิ กล่าวคือ ความสัมพันธ์
ดี T/D x ความแตกต่างของอุณหภูมิที่ปลายก้านถึงระยะห่างระหว่างพวกเขา นอกจากนี้ยังขึ้นอยู่กับพื้นที่หน้าตัดของแกน (เป็น m 2 ) และค่าการนำความร้อนของวัสดุ[ ในหน่วยที่สอดคล้องกัน W/(mช เค) ] . ความสัมพันธ์ระหว่างปริมาณเหล่านี้มาจากนักคณิตศาสตร์ชาวฝรั่งเศส J. Fourier และมีรูปแบบดังต่อไปนี้:ที่ไหน q การไหลของความร้อน k ค่าสัมประสิทธิ์การนำความร้อนและ อา พื้นที่หน้าตัด. ความสัมพันธ์นี้เรียกว่ากฎการนำความร้อนของฟูริเยร์ เครื่องหมายลบแสดงว่าความร้อนถูกถ่ายโอนไปในทิศทางตรงกันข้ามกับการไล่ระดับอุณหภูมิเป็นไปตามกฎฟูริเยร์ที่ว่าฟลักซ์ความร้อนสามารถลดลงได้โดยการลดปริมาณหนึ่งของค่าสัมประสิทธิ์การนำความร้อน พื้นที่ หรือการไล่ระดับอุณหภูมิ สำหรับอาคารในสภาพฤดูหนาวค่าหลังจะคงที่ในทางปฏิบัติดังนั้นเพื่อรักษาอุณหภูมิที่ต้องการในห้องจึงยังคงลดค่าการนำความร้อนของผนังเช่น ปรับปรุงฉนวนกันความร้อน
ตารางแสดงค่าสัมประสิทธิ์การนำความร้อนของสารและวัสดุบางชนิด ตารางแสดงให้เห็นว่าโลหะบางชนิดนำความร้อนได้ดีกว่าโลหะอื่นมาก แต่ทั้งหมดเป็นตัวนำความร้อนได้ดีกว่าอากาศและวัสดุที่มีรูพรุนมาก
|
การนำความร้อนของสารและวัสดุบางชนิด |
|
|
สารและวัสดุ |
การนำความร้อน W / (m × K) |
| อลูมิเนียม | |
| บรอนซ์ | |
| บิสมัท | |
| ทังสเตน | |
| เหล็ก | |
| ทอง | |
| แคดเมียม | |
| แมกนีเซียม | |
| ทองแดง | |
| สารหนู | |
| นิกเกิล | |
| แพลตตินั่ม | |
| ปรอท | |
| ตะกั่ว | |
| สังกะสี | |
|
วัสดุอื่นๆ |
|
| แร่ใยหินชนิดหนึ่ง | |
| คอนกรีต | |
| อากาศ | |
| Eider ลง (หลวม) | |
| ถั่วต้นไม้) | |
| แมกนีเซีย (MgO) | |
| ขี้เลื่อย | |
| ยาง (ฟองน้ำ) | |
| ไมกา | |
| กระจก | |
| คาร์บอน (กราไฟท์) | |
ความต้านทานความร้อนและไฟฟ้าของสารหลายชนิดลดลงอย่างรวดเร็วเมื่ออุณหภูมิลดลงต่ำกว่าอุณหภูมิของฮีเลียมเหลว (1.8 K) ปรากฏการณ์นี้เรียกว่าตัวนำยิ่งยวด ใช้ในการปรับปรุงประสิทธิภาพของอุปกรณ์ต่างๆ ตั้งแต่อุปกรณ์ไมโครอิเล็กทรอนิกส์ไปจนถึงสายไฟและแม่เหล็กไฟฟ้าขนาดใหญ่ ดูสิ่งนี้ด้วยความเป็นตัวนำยิ่งยวด
การพาความร้อน ดังที่เราได้กล่าวไปแล้ว เมื่อความร้อนถูกนำไปใช้กับของเหลวหรือก๊าซ ความเข้มของการเคลื่อนที่ของโมเลกุลจะเพิ่มขึ้น และเป็นผลให้ความดันเพิ่มขึ้น ถ้าของเหลวหรือแก๊สไม่จำกัดปริมาตร มันก็จะขยายตัว ความหนาแน่นของของเหลว (ก๊าซ) ในท้องถิ่นจะน้อยลง และเนื่องจากแรงลอยตัว (อาร์คิมีดีน) ส่วนที่ให้ความร้อนของตัวกลางจะเคลื่อนขึ้น (ซึ่งเป็นสาเหตุที่อากาศอุ่นในห้องเพิ่มขึ้นจากแบตเตอรี่สู่เพดาน) ปรากฏการณ์นี้เรียกว่าการพาความร้อน เพื่อไม่ให้สูญเสียความร้อนของระบบทำความร้อนโดยเปล่าประโยชน์คุณต้องใช้เครื่องทำความร้อนที่ทันสมัยซึ่งให้การไหลเวียนของอากาศแบบบังคับการไหลของความร้อนหมุนเวียนจากฮีตเตอร์ไปยังตัวกลางที่ให้ความร้อนขึ้นอยู่กับความเร็วเริ่มต้นของโมเลกุล ความหนาแน่น ความหนืด การนำความร้อนและความจุความร้อน และตัวกลาง ขนาดและรูปร่างของเครื่องทำความร้อนก็มีความสำคัญเช่นกัน อัตราส่วนระหว่างปริมาณที่สอดคล้องกันเป็นไปตามกฎของนิวตัน
q = hA ( ที วาย- TҐ ) โดยที่ q การไหลของความร้อน (วัดเป็นวัตต์) อา พื้นที่ผิวของแหล่งความร้อน (เป็น m 2), ที วายและ ตู่ อุณหภูมิของแหล่งกำเนิดและสภาพแวดล้อม (เป็นเคลวิน) ค่าสัมประสิทธิ์การพาความร้อน ชม. ขึ้นอยู่กับคุณสมบัติของตัวกลาง ความเร็วเริ่มต้นของโมเลกุล และรูปร่างของแหล่งความร้อนด้วย และวัดเป็นหน่วย W/(m 2 ชั่วโมง ถึง).ค่า
ชม. ไม่เหมือนกันสำหรับกรณีที่อากาศรอบๆ เครื่องทำความร้อนอยู่กับที่ (การพาความร้อนแบบอิสระ) และเมื่อเครื่องทำความร้อนเดียวกันอยู่ในกระแสลม (การพาความร้อนแบบบังคับ) ในกรณีง่ายๆ ของไหลผ่านท่อหรือไหลรอบพื้นผิวเรียบ สัมประสิทธิ์ ชม. สามารถคำนวณได้ตามทฤษฎี อย่างไรก็ตาม ยังไม่สามารถหาวิธีวิเคราะห์ปัญหาการพาความร้อนสำหรับการไหลปั่นป่วนของตัวกลางได้ ความปั่นป่วนเป็นการเคลื่อนที่ที่ซับซ้อนของของเหลว (แก๊ส) ซึ่งเกิดความวุ่นวายในระดับที่มากกว่าโมเลกุลอย่างมีนัยสำคัญหากวางวัตถุที่ให้ความร้อน (หรือในทางกลับกัน เย็น) ในตัวกลางที่อยู่นิ่งหรือในกระแส กระแสหมุนเวียนและชั้นขอบจะก่อตัวขึ้นรอบๆ อุณหภูมิ ความดัน และความเร็วของโมเลกุลในชั้นนี้มีบทบาทสำคัญในการกำหนดค่าสัมประสิทธิ์การถ่ายเทความร้อนแบบพาความร้อน
การพาความร้อนจะต้องพิจารณาในการออกแบบเครื่องแลกเปลี่ยนความร้อน ระบบปรับอากาศ เครื่องบินความเร็วสูง และการใช้งานอื่นๆ อีกมากมาย ในระบบดังกล่าวทั้งหมด การนำความร้อนเกิดขึ้นพร้อมกันกับการพาความร้อน ทั้งระหว่างของแข็งและในสภาพแวดล้อม ที่ อุณหภูมิที่สูงขึ้นการถ่ายเทความร้อนจากการแผ่รังสีก็มีบทบาทสำคัญเช่นกัน
การถ่ายเทความร้อนแบบแผ่รังสี ประเภทที่สามของการถ่ายเทความร้อนแบบแผ่กระจายความร้อนแตกต่างจากการนำความร้อนและการพาความร้อนในกรณีนี้สามารถถ่ายโอนผ่านสุญญากาศ ความคล้ายคลึงกันกับวิธีการถ่ายเทความร้อนแบบอื่นคือเนื่องจากความแตกต่างของอุณหภูมิ การแผ่รังสีความร้อนเป็นหนึ่งในประเภท รังสีแม่เหล็กไฟฟ้า. คลื่นวิทยุประเภทอื่น ๆ รังสีอัลตราไวโอเลตและรังสีแกมมาเกิดขึ้นโดยไม่มีความแตกต่างของอุณหภูมิในรูป 8 แสดงการพึ่งพาพลังงานของรังสีความร้อน (อินฟราเรด) ต่อความยาวคลื่น การแผ่รังสีความร้อนสามารถมาพร้อมกับการปล่อยแสงที่มองเห็นได้ แต่พลังงานของแสงนั้นมีขนาดเล็กเมื่อเทียบกับพลังงานรังสีของส่วนที่มองไม่เห็นของสเปกตรัม
ความเข้มของการถ่ายเทความร้อนโดยการนำความร้อนและการพาความร้อนเป็นสัดส่วนกับอุณหภูมิ และฟลักซ์ความร้อนจากการแผ่รังสีเป็นสัดส่วนกับกำลังที่สี่ของอุณหภูมิ และเป็นไปตามกฎของสเตฟาน โบลซ์มันน์
พื้นที่ที่อยู่อาศัยและสำนักงานมักถูกทำให้ร้อนด้วยตัวปล่อยความร้อนไฟฟ้าขนาดเล็ก แสงสีแดงของเกลียวของพวกมันคือรังสีความร้อนที่มองเห็นได้ใกล้กับขอบของส่วนอินฟราเรดของสเปกตรัม ห้องได้รับความร้อนจากความร้อนซึ่งส่วนใหญ่ดำเนินการโดยส่วนที่มองไม่เห็นและอินฟราเรดของรังสี ในอุปกรณ์มองเห็นตอนกลางคืน
^ กล้องใช้แหล่งกำเนิดรังสีความร้อนและตัวรับที่ไวต่อแสงอินฟราเรดซึ่งช่วยให้คุณมองเห็นได้ในที่มืดดวงอาทิตย์เป็นตัวปล่อยพลังงานความร้อนที่ทรงพลัง มันทำให้โลกร้อนแม้ในระยะทาง 150 ล้านกม. ความเข้มของรังสีดวงอาทิตย์ที่บันทึกปีแล้วปีเล่าโดยสถานีต่างๆ ที่ตั้งอยู่ในส่วนต่างๆ ของโลก อยู่ที่ประมาณ 1.37 W
/ ม. 2 . พลังงานแสงอาทิตย์เป็นแหล่งของสิ่งมีชีวิตบนโลก มีการค้นหาวิธีใช้งานให้มีประสิทธิภาพสูงสุด แผงเซลล์แสงอาทิตย์ถูกสร้างขึ้นเพื่อให้ความร้อนแก่บ้านเรือนและผลิตกระแสไฟฟ้าสำหรับความต้องการใช้ในประเทศ บทบาทของความร้อนและการใช้งาน กระบวนการถ่ายเทความร้อนทั่วโลกไม่ได้ลดลงเพื่อทำให้โลกร้อนด้วยรังสีดวงอาทิตย์ กระแสการพาความร้อนขนาดใหญ่ในชั้นบรรยากาศเป็นตัวกำหนดการเปลี่ยนแปลงรายวันของสภาพอากาศทั่วโลก ความแตกต่างของอุณหภูมิในบรรยากาศระหว่างบริเวณเส้นศูนย์สูตรและบริเวณขั้วโลก ร่วมกับแรงโคริโอลิสอันเนื่องมาจากการหมุนของโลก นำไปสู่การปรากฏตัวของกระแสการพาความร้อนที่เปลี่ยนแปลงอย่างต่อเนื่อง เช่น ลมค้า กระแสน้ำไหลเชี่ยว และแนวหน้าที่อบอุ่นและเย็น ดูสิ่งนี้ด้วยภูมิอากาศ; อุตุนิยมวิทยาและภูมิอากาศการถ่ายเทความร้อน (เนื่องจากการนำความร้อน) จากแกนกลางของโลกที่หลอมละลายไปยังพื้นผิวทำให้เกิดการระเบิดของภูเขาไฟและการปรากฏตัวของกีย์เซอร์ ในบางภูมิภาค พลังงานความร้อนใต้พิภพถูกใช้เพื่อให้ความร้อนในอวกาศและการผลิตไฟฟ้า
ความร้อนเป็นส่วนสำคัญที่ขาดไม่ได้ในกระบวนการผลิตเกือบทั้งหมด ให้เราพูดถึงสิ่งสำคัญที่สุด เช่น การถลุงและการแปรรูปโลหะ การทำงานของเครื่องยนต์ การผลิตอาหาร การสังเคราะห์ทางเคมี การกลั่นน้ำมัน การผลิตวัตถุที่หลากหลายตั้งแต่อิฐ จาน รถยนต์ และอุปกรณ์อิเล็กทรอนิกส์
การผลิตและการขนส่งทางอุตสาหกรรมจำนวนมากรวมถึงโรงไฟฟ้าพลังความร้อนไม่สามารถทำงานได้หากไม่มีเครื่องยนต์ความร้อน - อุปกรณ์ที่เปลี่ยนความร้อนให้เป็นงานที่มีประโยชน์ ตัวอย่างของเครื่องจักรดังกล่าว ได้แก่ คอมเพรสเซอร์ เทอร์ไบน์ ไอน้ำ น้ำมันเบนซิน และเครื่องยนต์เจ็ท
เครื่องยนต์ความร้อนที่มีชื่อเสียงที่สุดตัวหนึ่งคือกังหันไอน้ำซึ่งเป็นส่วนหนึ่งของวัฏจักร Rankine ที่ใช้ในโรงไฟฟ้าสมัยใหม่ แผนภาพอย่างง่ายของวงจรนี้แสดงในรูปที่ 9. น้ำของไหลที่ใช้งานได้จะถูกแปลงเป็นไอน้ำร้อนยวดยิ่งในหม้อไอน้ำที่ให้ความร้อนโดยการเผาเชื้อเพลิงฟอสซิล (ถ่านหิน น้ำมัน หรือก๊าซธรรมชาติ) ไอน้ำ ความดันสูงหมุนเพลาของกังหันไอน้ำซึ่งขับเคลื่อนเครื่องกำเนิดไฟฟ้าที่ผลิตกระแสไฟฟ้า ไอน้ำเสียจะควบแน่นเมื่อระบายความร้อนด้วยน้ำไหล ซึ่งจะดูดซับความร้อนบางส่วนที่ไม่ได้ใช้ในวงจรแรงคิน ถัดไป น้ำจะถูกป้อนเข้าสู่หอทำความเย็น (cooling tower) จากจุดที่ความร้อนบางส่วนถูกปล่อยสู่ชั้นบรรยากาศ คอนเดนเสทถูกสูบกลับไปที่หม้อไอน้ำและทำซ้ำทั้งหมด
กระบวนการทั้งหมดในวัฏจักร Rankine แสดงให้เห็นถึงหลักการของอุณหพลศาสตร์ที่อธิบายไว้ข้างต้น โดยเฉพาะอย่างยิ่ง ตามกฎหมายข้อที่สอง ส่วนหนึ่งของพลังงานที่โรงไฟฟ้าใช้ต้องถูกกระจายไปในสิ่งแวดล้อมในรูปของความร้อน ปรากฎว่าประมาณ 68% ของพลังงานที่มีอยู่เดิมในเชื้อเพลิงฟอสซิลสูญเสียไปในลักษณะนี้ ประสิทธิภาพที่เพิ่มขึ้นอย่างเห็นได้ชัดของโรงไฟฟ้าสามารถทำได้โดยการเพิ่มอุณหภูมิของหม้อไอน้ำ (ซึ่งถูกจำกัดโดยความต้านทานความร้อนของวัสดุ) หรือโดยการลดอุณหภูมิของตัวกลางที่ความร้อนออกไป กล่าวคือ บรรยากาศ.
วงจรอุณหพลศาสตร์อื่นที่มี สำคัญมากในของเรา ชีวิตประจำวันคือวัฏจักรการทำความเย็นของคอมเพรสเซอร์ไอระเหยของแรนกิน แผนภาพแสดงในรูปที่ 10. ในตู้เย็นและเครื่องปรับอากาศในครัวเรือน พลังงานจากภายนอกจะจ่ายให้ คอมเพรสเซอร์เพิ่มอุณหภูมิและความดันของสารทำงานของฟรีออนตู้เย็น แอมโมเนียหรือคาร์บอนไดออกไซด์ ก๊าซที่มีความร้อนสูงเกินไปจะถูกป้อนเข้าไปในคอนเดนเซอร์ ซึ่งจะถูกทำให้เย็นลงและควบแน่น ทำให้เกิดความร้อนต่อสิ่งแวดล้อม ของเหลวที่ออกจากหัวฉีดคอนเดนเซอร์จะไหลผ่านวาล์วควบคุมปริมาณเข้าไปในเครื่องระเหย และส่วนหนึ่งของมันจะระเหยไป ซึ่งมาพร้อมกับอุณหภูมิที่ลดลงอย่างรวดเร็ว เครื่องระเหยใช้ความร้อนจากห้องเย็นซึ่งให้ความร้อนกับของเหลวที่ใช้ในหัวฉีด คอมเพรสเซอร์จ่ายของเหลวนี้ไปยังคอนเดนเซอร์ และวงจรจะทำซ้ำอีกครั้ง
รอบการทำความเย็นที่แสดงในรูปที่ 10 สามารถใช้กับปั๊มความร้อนได้ ปั๊มความร้อนดังกล่าวในฤดูร้อนจะปล่อยความร้อนให้กับอากาศที่ร้อนจัดและปรับสภาพห้องและในฤดูหนาวในทางกลับกันพวกเขาจะดึงความร้อนจากอากาศเย็นและทำให้ห้องร้อน
ปฏิกิริยานิวเคลียร์เป็นแหล่งความร้อนที่สำคัญสำหรับวัตถุประสงค์ เช่น การผลิตกระแสไฟฟ้าและการขนส่ง ในปี 1905 A. Einstein แสดงให้เห็นว่ามวลและพลังงานสัมพันธ์กันโดยความสัมพันธ์
อี=mc2 , เช่น. สามารถผ่านเข้ามาหากันได้ ความเร็วของแสง ค ใหญ่มาก: 300,000 km/ กับ. ซึ่งหมายความว่าแม้สสารเพียงเล็กน้อยก็สามารถให้พลังงานได้มาก ดังนั้นจากวัสดุฟิชไซล์ 1 กิโลกรัม (เช่น ยูเรเนียม) เป็นไปได้ในทางทฤษฎีที่จะได้รับพลังงานซึ่งโรงไฟฟ้าที่มีกำลังการผลิต 1 เมกะวัตต์สำหรับการทำงานต่อเนื่อง 1,000 วัน ดูสิ่งนี้ด้วยโครงสร้างอะตอม เทคโนโลยีเตาหลอมและเตาหลอม; การแผ่รังสีแม่เหล็กไฟฟ้า;เครื่องแลกเปลี่ยนความร้อน; กังหัน; หน่วยวัดปริมาณทางกายภาพวรรณกรรม เซมันสกี้ เอ็ม อุณหภูมิสูงมากและต่ำมาก. ม., 2511พอล อาร์ กลศาสตร์ อะคูสติก และหลักคำสอนเรื่องความร้อน. ม., 1971
Smorodinsky Ya.A. อุณหภูมิ. ม., 1981
แฟนเจ เครื่องจักร พลังงาน และเอนโทรปี. ม., 2529
แอตกินส์ พี.วี. ระเบียบและความไม่เป็นระเบียบในธรรมชาติม., 2530
แคลอรีมิเตอร์เหลว
แคลอรีมิเตอร์ชนิดนี้เป็นเทคโนโลยีที่ใช้กันอย่างแพร่หลายมากที่สุด ออกแบบเรียบง่ายและบำรุงรักษาง่าย ปริมาณความร้อนที่เกิดจากปฏิกิริยาภายนอกจะถูกถ่ายโอนไปยังถังปฏิกิริยา (ซึ่งปฏิกิริยาเกิดขึ้น) ก่อน จากนั้นจึงส่งไปยังอ่างของเหลว ของเหลวในอ่างจะถูกกวนอย่างต่อเนื่องโดยใช้ใบพัด สกรูหรือปั๊มยกระดับ ซึ่งเร่งความเร็วให้อุณหภูมิเท่ากัน อ่างมีฉนวนป้องกันความร้อน (ป้องกัน) จากสิ่งแวดล้อมให้มากที่สุด การเปลี่ยนแปลงอุณหภูมิของอ่างของเหลวเป็นการวัดปริมาณความร้อนที่ตรวจพบ ความจุความร้อนของมวลที่จะให้ความร้อนต้องไม่สูงเกินไปเพื่อให้แน่ใจว่ามีการเปลี่ยนแปลงอุณหภูมิที่เพียงพอและเพื่อให้กระบวนการวัดใช้เวลาไม่นานเกินไป (เนื่องจากการสูญเสียความร้อนเพิ่มขึ้น)
รูป อุปกรณ์ของเครื่องวัดความร้อนเหลว
ด้วยข้อกำหนดที่สูงสำหรับความคงตัวของสภาวะแวดล้อม จึงเป็นไปได้ที่จะวางแคลอรีมิเตอร์ทั้งหมดไว้ในอ่างอื่น และทำให้อุณหภูมิในอ่างคงที่ด้วยความแม่นยำสูงโดยใช้ลูปควบคุม นี่เป็นสิ่งจำเป็นตั้งแต่แรกในกรณีที่จำเป็นต้องทำการทดลองที่อุณหภูมิที่แตกต่างอย่างมากจากอุณหภูมิแวดล้อม
สำหรับการวิเคราะห์ที่อุณหภูมิต่ำ (ลดลงประมาณ -150 องศาเซลเซียส) ไนโตรเจนเหลวจะใช้เป็นตัวกลางในการทำความเย็น ในกรณีนี้ จำเป็นต้องให้ความสนใจกับข้อเท็จจริงที่ว่าเมื่อทำการเปลี่ยนแปลง น้ำค้างแข็งจากอากาศชื้นโดยรอบจะไม่ตกตะกอนบนตัวอย่างหรือภาชนะเก็บตัวอย่าง เนื่องจากชั้นของมันสามารถส่งผลต่อกระบวนการวัดได้ เพื่อหลีกเลี่ยงปัญหานี้ เมื่อเปิดเครื่องวัดปริมาณความร้อน ตัวอย่างและภาชนะเก็บตัวอย่างจะถูกกำจัดด้วยก๊าซไนโตรเจนเย็น
แคลอรีมิเตอร์ตัวโลหะ
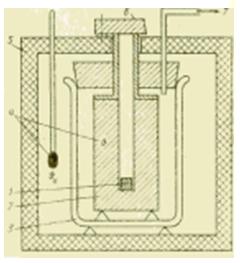
รูปโครงร่างของอุปกรณ์ของเครื่องวัดความร้อนด้วยโลหะ
หากจำเป็นต้องทำการศึกษาแคลอรีเมตริกในช่วงอุณหภูมิที่กว้างขึ้น แคลอรีมิเตอร์เหลวจะไม่เหมาะอีกต่อไป ในแคลอรีมิเตอร์ของตัวเครื่องโลหะที่เหมาะสมสำหรับจุดประสงค์นี้ ปริมาณความร้อนที่ถ่ายเทจะถูกนำขึ้นโดยบล็อกโลหะ (เงิน ทองแดง อะลูมิเนียม) ซึ่งมักจะอยู่ที่อุณหภูมิแวดล้อม แคลอรีมิเตอร์ดังกล่าวมีวัตถุประสงค์หลักเพื่อกำหนดความจุความร้อนจำเพาะ c, J / (kg * K), ของเหลวและสารที่เป็นของแข็ง
ตัวอย่างจะถูกทำให้เย็นลงก่อนจากเครื่องวัดปริมาณความร้อนใน โรงงานทำความเย็นหรือให้ความร้อนในเตาเผาและหลังจากเข้าสู่สภาวะคงตัวแล้ว (ลดลง) ลงในรูในบล็อกโลหะ ตามวิธีการใช้งานอุปกรณ์ดังกล่าวเรียกว่าเครื่องวัดความร้อนแบบอิสระและตามลักษณะของกระบวนการทางอุณหพลศาสตร์ในนั้นบางครั้งเรียกว่าเครื่องวัดปริมาณความร้อนแบบกระจัดกระจาย
ปริมาณความร้อนที่ถ่ายเทระหว่างการผสมนี้จากตัวอย่าง (ด้วยพารามิเตอร์ m1, c1, ) ไปยังบล็อกโลหะ (m2, c2, ) ทำให้เกิดการเปลี่ยนแปลงอุณหภูมิของบล็อกที่วัดได้ ซึ่งทำให้สามารถระบุค่าความจุความร้อนจำเพาะของตัวอย่างที่มักจะไม่ทราบค่าได้สำหรับ เงื่อนไขในอุดมคติ(ในกรณีที่ไม่มีการแลกเปลี่ยนความร้อนกับสิ่งแวดล้อม) จากนิพจน์:
ตัวบล็อกโลหะนั้นตั้งอยู่ในภาชนะ Dewar ที่อพยพแล้ว และบางครั้งก็อยู่ในอ่างของเหลว ในกรณีหลัง เพื่อให้ได้ความจุความร้อนของแคลอรีมิเตอร์ Ck จะต้องเพิ่มความจุความร้อนของอ่าง Cw ลงในความจุความร้อนของบล็อกโลหะ C2:
CK=C2+CW=c2m2+cWmW .
วิธีการวัดแคลอรีเมตริก
ส่วนใหญ่มักใช้เครื่องวัดความร้อนในโหมดสภาวะแวดล้อมคงที่ สิ่งนี้ใช้ได้กับเครื่องวัดปริมาณความร้อนจากการเผาไหม้ส่วนใหญ่ตั้งแต่แรก ซึ่งเวลาในการทำปฏิกิริยาสั้นมาก ในขณะที่อุณหภูมิของชิ้นส่วนภายในของเครื่องวัดความร้อนจะเปลี่ยนแปลงไปเนื่องจากปฏิกิริยา อุณหภูมิแวดล้อมจะคงที่ ในหลายกรณี ตัวควบคุมอุณหภูมิแบบควบคุมอุณหภูมิ อ่างอาบน้ำถูกใช้เป็นสิ่งแวดล้อมเพื่อหลีกเลี่ยงอิทธิพลต่อค่าที่วัดได้ของการรบกวนจากภายนอก - ความผันผวนของอุณหภูมิในห้อง การแผ่รังสี กระแสลม ฯลฯ
ข้อดีของรูปแบบการวัดนี้คืออุปกรณ์ที่มีราคาค่อนข้างต่ำ ซึ่งสามารถนำไปใช้ทำส่วนที่โดดเด่นของการวัดค่าความร้อนได้ ข้อเสียเปรียบหลักควรพิจารณาการแลกเปลี่ยนความร้อนของเครื่องวัดความร้อนกับสิ่งแวดล้อม ซึ่งทำให้การตีความผลลัพธ์ซับซ้อน วิธีการวัดนี้เรียกว่า isoperibol (diathermic) เสมอ ไม่ว่าในกรณีใด ๆ จะไม่สามารถเรียก isothermal ได้ สาระสำคัญอยู่ที่ข้อเท็จจริงที่ว่าอุณหภูมิของแคลอรีมิเตอร์ยังคงที่ในระหว่างการทำปฏิกิริยา เช่น แคลอรีมิเตอร์ที่ออกแบบมาเพื่อวัดการเปลี่ยนแปลงเฟส
วิธีอะเดียแบติก
หากสามารถแยกการแลกเปลี่ยนความร้อนกับสิ่งแวดล้อมได้ เช่น เพื่อให้แน่ใจว่ากระบวนการอะเดียแบติกของกระบวนการ การทดลองและการตีความผลลัพธ์จะง่ายขึ้น และผลการวัดมีความแม่นยำมากขึ้น เนื่องจากไม่จำเป็นต้องบันทึกอย่างต่อเนื่อง การเปลี่ยนแปลงของอุณหภูมิและการคำนวณการแก้ไข นอกจากนี้ ในกรณีนี้ อุณหภูมิที่เพิ่มขึ้นเล็กน้อยในภาชนะวัดปริมาณความร้อนสามารถทนได้ สำหรับอุปกรณ์ที่ไม่ใช่อะเดียแบติก เป็นสิ่งที่ยอมรับไม่ได้เนื่องจากการสูญเสียความร้อนที่เพิ่มขึ้น
เพื่อหลีกเลี่ยงไม่ให้ถ่ายเทความร้อนระหว่างถังเก็บความร้อนและบริเวณโดยรอบ (โดยปกติคืออ่างของเหลว) อุณหภูมิของอ่างต้องปรับตลอดเวลาตามการเปลี่ยนแปลงของอุณหภูมิภายในถัง ด้วยความช่วยเหลือของตัวควบคุมอิเล็กทรอนิกส์ (วงจรติดตาม) เป็นไปได้ที่จะรักษาความแตกต่างของอุณหภูมิเหล่านี้ให้เท่ากับศูนย์อย่างต่อเนื่อง สิ่งนี้จะเพิ่มต้นทุนของอุปกรณ์วัดขึ้นอยู่กับความแม่นยำในการวัดที่ต้องการ
องค์ประกอบของฮาร์ดแวร์จะต้องรวดเร็วและเสถียรเป็นเวลานาน (มีการเบี่ยงเบนน้อยที่สุด) โซนตายของลูปควบคุมการติดตามควรอยู่ในช่วงตั้งแต่ ±10-3 ถึง ±10-5 K ในฐานะอุปกรณ์วัด คุณสามารถใช้เทอร์โมมิเตอร์แบบสัมผัสไฟฟ้าที่ตอบสนองเร็ว ซึ่งเมื่อรวมอยู่ในวงจรบริดจ์แล้ว แรงกระตุ้นไปยังตัวควบคุมเพื่อเปลี่ยนพลังงานความร้อน การให้ความร้อนทำได้โดยใช้ขดลวดต้านทานไฟฟ้าหรือในอ่างของเหลวโดยตรง ซึ่งทำหน้าที่เป็นตัวต้านทานความร้อนเนื่องจากการแตกตัวที่อ่อน (เรียกว่าความร้อนด้วยไฟฟ้า) วิธีที่สองนี้ไม่เฉื่อยในทางปฏิบัติ สามารถหาผลลัพธ์ได้โดยใช้วิธีการที่มีอยู่แล้วสำหรับการวัดอุณหภูมิทางไฟฟ้า หรือใช้เทอร์โมมิเตอร์เหลวที่ติดตั้งเพิ่มเติม (Beckmann)
วิธีการวัดแบบอะเดียแบติกเหมาะสำหรับการศึกษากระบวนการที่ช้าและผลกระทบจากความร้อนเป็นหลัก ด้วยการเปลี่ยนแปลงอย่างรวดเร็วของปริมาณความร้อน (ในแคลอรีมิเตอร์ของการเผาไหม้) ความเฉื่อยของการปรับอุณหภูมิให้เท่ากันมีผลเสียดังกล่าว ซึ่งแม้แต่ความแม่นยำของวิธีการแบบไม่ใช้อะเดียแบติกทั่วไปก็ไม่สามารถทำได้ อย่างไรก็ตาม การให้ความร้อนต่ำขององค์ประกอบความร้อนและเซ็นเซอร์อุณหภูมิ และการผสมของเหลวในอ่างอย่างเข้มข้น เป็นไปได้ที่จะได้ค่าคงที่เวลาต่างๆ เพียงเล็กน้อย (เพื่อลดความเฉื่อย)
วิธีการชดเชย
การใช้ดิฟเฟอเรนเชียลหรือแคลอรีมิเตอร์คู่ตามหลักการชดเชย ทำให้สามารถขจัดอิทธิพลภายนอกส่วนใหญ่ในกระบวนการวัดได้ ภาชนะวัดปริมาณความร้อนที่เหมือนกันสองถังพร้อมอุปกรณ์เสริมเหมือนกันจะถูกวางไว้ในสภาพแวดล้อมภายใต้เงื่อนไขเดียวกัน ในเรือลำหนึ่ง กระบวนการตรวจสอบที่มีผลกระทบจากความร้อนจะเกิดขึ้น และอีกถังหนึ่งจะถูกทำให้ร้อนด้วยความช่วยเหลือของระบบควบคุมเซอร์โวในลักษณะที่การสูญเสียความร้อนต่อสิ่งแวดล้อมสำหรับเรือทั้งสองลำจะเหมือนกัน ดังนั้นพลังงานความร้อนที่ป้อนเข้าสามารถใส่ในสัดส่วนโดยตรงกับปริมาณความร้อนที่ปล่อยออกมาระหว่างกระบวนการภายใต้การศึกษา ในกรณีนี้ งานทดลองของการวัดจะเข้าสู่พื้นที่อื่นและลดลงเป็นการหาค่าพลังงานความร้อนไฟฟ้าที่ให้มาอย่างแม่นยำ (W * s, J):
โดยเฉพาะอย่างยิ่ง ดิฟเฟอเรนเชียลแคลอริมิเตอร์ใช้ภายใต้สภาวะแวดล้อมแบบอะเดียแบติก โดยเฉพาะอย่างยิ่งเมื่อคาดว่าจะมีการเปลี่ยนแปลงปริมาณความร้อนเพียงเล็กน้อยหรือช้ามาก ในกระบวนการดูดความร้อน การมีภาชนะเก็บความร้อนหนึ่งถังก็เพียงพอแล้ว อินพุตความร้อนถูกควบคุมเพื่อให้อุณหภูมิในภาชนะยังคงเหมือนเดิมตลอดเวลา (วิธีเก็บอุณหภูมิ) ข้อเสียของดิฟเฟอเรนเชียลแคลอรีมิเตอร์คืออุปกรณ์และเครื่องมือวัดที่มีราคาสูง
แคลอรี่ในการเผาไหม้
เชื้อเพลิงที่ใช้ในโรงงานความร้อนและพลังงานได้รับการตรวจสอบเพื่อกำหนดค่าความร้อน H (J/kg) ตัวบ่งชี้นี้จำเป็นในการกำหนดปัจจัยด้านประสิทธิภาพ ศึกษาประสิทธิภาพและการคำนวณสำหรับพลังงานที่ใช้ในการติดตั้งต่างๆ รวมทั้งเพื่อการควบคุมกระบวนการเผาไหม้ที่เหมาะสมที่สุด ความผันผวนที่มีนัยสำคัญในองค์ประกอบของส่วนประกอบที่ติดไฟได้มักจำเป็นต้องกำหนดค่าความร้อนอย่างต่อเนื่อง
เมื่อสารถูกเผาไหม้จนหมด ความร้อน Q (ความร้อนจากการเผาไหม้) จำนวนหนึ่งจะถูกปล่อยออกมา ถ้าเราหารด้วยมวล m (หรือโดยปริมาตรภายใต้สภาวะปกติ Vn) เราจะได้ความร้อนจากการเผาไหม้ (จำเพาะ):
ขึ้นอยู่กับสถานะของผลิตภัณฑ์การเผาไหม้ ค่าความร้อนสองประเภทมีความโดดเด่น: H0 ที่สูงขึ้นและ H ที่ต่ำกว่าซึ่งเรียกอีกอย่างว่าความร้อนของการเผาไหม้และค่าความร้อน เมื่อหาค่าความร้อนสุทธิของ Ni น้ำจะเกิดระหว่าง ปฏิกริยาเคมีต้องอยู่ในสถานะไอ ความแตกต่างระหว่างความร้อนทั้งสอง H0 - Ni สอดคล้องกับความร้อนของการระเหยของน้ำควบแน่น (ดัชนี KO - คอนเดนเสท) r ซึ่งเท่ากับ 2.441 MJ / kg
สำหรับเชื้อเพลิงแข็งและเชื้อเพลิงเหลว สามารถกำหนดปริมาณน้ำที่ได้บนพื้นฐานของการวิเคราะห์ธาตุ และเมื่อเผาไหม้เชื้อเพลิงก๊าซ โดยการวัดปริมาณคอนเดนเสท
ในเตาเผาอุตสาหกรรม อุณหภูมิของผลิตภัณฑ์ที่เผาไหม้จะสูงกว่าจุดเดือดของน้ำเสมอ ดังนั้นมักจะสนใจเฉพาะค่าความร้อนสุทธิ Ni เนื่องจากความร้อนของการควบแน่นของน้ำไม่สามารถใช้งานได้
เครื่องวัดปริมาณความร้อนจากการเผาไหม้สำหรับของแข็งและของเหลว
สำหรับกระบวนการเผาไหม้ที่รวดเร็ว ได้มีการพัฒนารูปแบบพิเศษของเครื่องวัดความร้อนเหลว ซึ่งเรียกว่า Berthelot calorimetric bomb (รูปที่ 3)
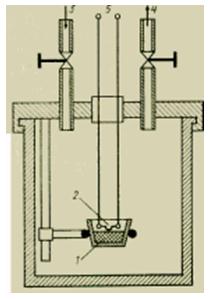
รูป อุปกรณ์ของระเบิดความร้อน
การเผาไหม้ของสารจำนวนเล็กน้อยที่วัดได้อย่างแม่นยำจะเกิดขึ้นที่ปริมาตรคงที่ในระเบิดที่ปิดสนิทในบรรยากาศของออกซิเจนบริสุทธิ์ที่สุดที่เป็นไปได้ที่ความดัน ~30 atm (3 MPa) ระเบิดที่บรรจุอยู่ในอ่างของเหลวของเครื่องวัดความร้อนซึ่งดูดซับความร้อนที่ปล่อยออกมาจากการเผาไหม้
ของแข็งมักจะอัดเป็นก้อนเล็กๆ (เม็ด) และชั่งน้ำหนักได้อย่างแม่นยำมาก ขอแนะนำให้ผสมสารที่เผาไหม้ได้ไม่ดีกับของเหลวที่เผาไหม้ได้ดีกับความร้อนจากการเผาไหม้ที่ทราบ (เช่น กรดเบนโซอิก) ของเหลวจะถูกใส่ลงในถ้วย (เรือ) ที่ทำจากแพลตตินั่มหรือควอทซ์หรือในแคปซูลพลาสติกขนาดเล็ก มีอุปกรณ์ทั้งหมดที่จำเป็นสำหรับการวิจัยบนหน้าปก: วาล์วสำหรับจ่ายออกซิเจนและกำจัดผลิตภัณฑ์จากการเผาไหม้ ที่จับตัวอย่าง และเครื่องจุดไฟไฟฟ้า การจุดไฟทำได้โดยการจ่ายกระแสไฟฟ้าให้กับลวดแพลตตินั่มแบบบาง ต้องวัดความร้อนที่จ่ายสำหรับการจุดระเบิดอย่างแม่นยำเพื่อให้สามารถนำมาพิจารณาเมื่อถอดรหัสผลลัพธ์ของการทดสอบ ในระเบิดแคลอรี่ ค่าความร้อนสูงสุด H0 จะถูกกำหนด ระหว่างการตรวจสอบ ค่าเทียบเท่าทางความร้อนของแคลอรีมิเตอร์ Ck ถูกกำหนดโดยการเผาไหม้สารอ้างอิง (เช่น กรดเบนโซอิก) หรือใช้อุปกรณ์ทำความร้อนไฟฟ้า
แคลอรีมิเตอร์เผาไหม้สำหรับสารที่เป็นก๊าซ
การหาค่าความร้อนจากการเผาไหม้ของตัวกลางที่เป็นก๊าซนั้นมีหลายวิธี ตรงกันข้ามกับระเบิดความร้อนสำหรับสารที่เป็นของแข็งและของเหลวนั้นขึ้นอยู่กับการวัดอย่างต่อเนื่อง หลักการวัดที่ใช้ค่อนข้างง่าย ก๊าซทดสอบถูกเผาอย่างต่อเนื่องในเตาเผาที่แรงดันคงที่ ความร้อนทั้งหมดที่ปล่อยออกมาระหว่างการเผาไหม้จะถูกดูดซับโดยการไหลของตัวกลางทำความเย็นในตัวแลกเปลี่ยนความร้อน (แคลอริมิเตอร์แบบเปียกหรือแบบแลกเปลี่ยนความร้อน) หรือโดยการผสมผลิตภัณฑ์ที่เผาไหม้กับการไหลของอากาศที่อัตราการไหลที่ทราบ (เครื่องวัดความร้อนแบบแห้งหรือแบบผสม) มักจะกำหนดมูลค่าความร้อนสุทธิหู ในการกำหนดค่าความร้อนรวม H0 จำเป็นต้องควบแน่นไอน้ำ (ดัชนี KO) ที่มีอยู่ในก๊าซไอเสีย เมื่อทราบอัตราการไหลของมวลและความแตกต่างของอุณหภูมิที่ขาเข้า (ดัชนี e) และทางออก (ดัชนี a) ของเครื่องวัดความร้อน การคำนวณค่าความร้อนที่สอดคล้องกันโดยใช้สมการสมดุลความร้อน
การเตรียมก๊าซที่จำเป็นนั้นโดยพื้นฐานแล้วในเครื่องวัดปริมาณความร้อนของก๊าซทั้งหมด ก่อนการเผาไหม้ก๊าซ (ดัชนี G) จะถูกทำความสะอาดก่อนสิ่งสกปรกเชิงกลที่เป็นของแข็ง (ในตัวกรอง) และชุบ (เพื่อให้อิ่มตัวด้วยความชื้น 100%) จากนั้นจึงนำแรงดันเบื้องต้นไปยังค่าที่กำหนด (โดยใช้การลดแรงดัน วาล์ว) และอุณหภูมิของตัวกลางทำความเย็น (ดัชนี K) อากาศที่จำเป็นสำหรับการเผาไหม้ (ดัชนี L) จะได้รับความชื้นและนำไปที่อุณหภูมิของตัวกลางระบายความร้อนด้วย
ขึ้นอยู่กับความแม่นยำที่จำเป็นและต้นทุนเครื่องมือที่อนุญาต เงื่อนไขเหล่านี้บางอย่างอาจไม่เป็นไปตามข้อกำหนด แคลอรีมิเตอร์ควรได้รับการตรวจสอบด้วยก๊าซอ้างอิง (เช่น ไฮโดรเจน) เพื่อกำหนดความเบี่ยงเบนจากสมการสำหรับสถานะในอุดมคติของแคลอรีมิเตอร์ สำหรับเครื่องวัดความร้อนแบบแลกเปลี่ยนความร้อน (เปียก) สมการข้างต้นมีรูปแบบ
โดยที่และคืออัตราการไหลของมวลสารทำความเย็นและเชื้อเพลิง kg/s; sk - ความจุความร้อนจำเพาะของตัวกลางระบายความร้อน J / (กก. * K); - เพิ่มอุณหภูมิของตัวกลางทำความเย็น K.
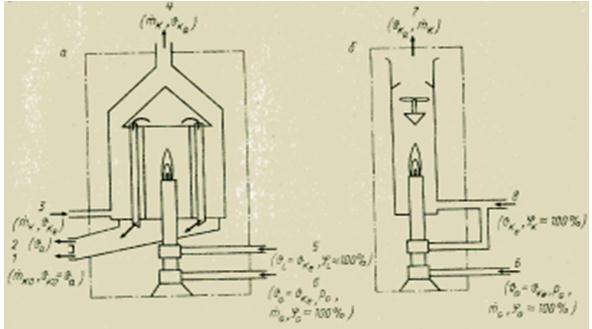
รูปอุปกรณ์ของเครื่องวัดความร้อนแบบเปียก (a) และแบบแห้ง (b) สำหรับเชื้อเพลิงก๊าซ
อุณหภูมิที่เพิ่มขึ้นโดยทั่วไปคือ 5-15 เค เนื่องจากมวลความร้อนจำนวนมาก แคลอรีมิเตอร์การถ่ายเทความร้อนจึงมีค่าคงที่เวลานานมาก ซึ่งอาจนานถึงหลายนาที ดังนั้นจึงไม่เหมาะที่จะใช้ในวงจรควบคุมแบบปิดในฐานะเซ็นเซอร์ เมื่อเทียบกับเครื่องวัดปริมาณความร้อนแบบแห้ง (แบบผสม) ซึ่งค่าคงที่เวลาเพียงไม่กี่วินาที ในทางกลับกัน ความแม่นยำที่ทำได้ของเครื่องวัดปริมาณความร้อนจากการแลกเปลี่ยนความร้อนนั้นค่อนข้างสูง ข้อผิดพลาดไม่เกิน ±0.25-1% ดังนั้นจึงสามารถใช้กับห้องปฏิบัติการและสำหรับการตรวจสอบได้ เครื่องวัดความร้อนแห้ง (การผสม) มีข้อผิดพลาด ±1 ถึง ±2% ของขีดจำกัดบนของช่วงการวัด
เวอร์ชันการออกแบบของเครื่องวัดปริมาณความร้อนจากผู้ผลิตหลายรายแตกต่างกันไปในอุปกรณ์ช่วยเสริมและอุปกรณ์ความปลอดภัย องค์ประกอบการตรวจจับ และวงจรคำนวณที่ให้การชดเชยข้อผิดพลาด ดังนั้นในเครื่องวัดปริมาณความร้อนที่แลกเปลี่ยนความร้อน อัตราส่วนของก๊าซและอัตราการไหลของตัวกลางในการทำความเย็นจะคงอยู่ในรูปแบบต่างๆ (ดูสมการของแคลอรีมิเตอร์ด้านบน) เนื่องจากค่าความร้อนสูง H0 ขึ้นอยู่กับการเพิ่มขึ้นของอุณหภูมิโดยตรงเท่านั้น
ในแคลอรีมิเตอร์แบบแห้ง อุณหภูมิที่เพิ่มขึ้นจะถูกวัดโดยตรงโดยใช้เทอร์โมมิเตอร์แบบสัมผัสทางไฟฟ้า หรือโดยอ้อมโดยใช้เซ็นเซอร์ไดลาโตเมตริก ซึ่งเป็นท่อขยายที่อยู่ในกระแสก๊าซไอเสีย ในเครื่องวัดปริมาณความร้อน ADOS การยืดตัวด้วยความร้อนของท่อไดลาโทมิเตอร์จะสัมพันธ์โดยตรงกับความร้อนจากการเผาไหม้ และสามารถแปลงเป็นสัญญาณใดๆ ก็ได้โดยใช้ตัวเชื่อมโยงและมาตรวัดความยาว ในเครื่องวัดปริมาณความร้อน Reinecke ส่วนขยายของแท่งจะใช้เป็นสัญญาณการวัดในวงจรควบคุมที่ควบคุมการไหลของอากาศเย็นในลักษณะที่การเพิ่มขึ้นของอุณหภูมิยังคงเกือบคงที่ ในกรณีนี้ ลูปควบคุมจะกลายเป็นสัดส่วนอย่างหมดจด แต่ส่วนเบี่ยงเบนที่เหลือบางส่วนนั้นหลีกเลี่ยงไม่ได้ ในกรณีนี้ ปริมาณการใช้อากาศเย็นหรือการยืดตัวของท่อไดลาโตเมตริก (แกน) เป็นการวัดค่าความร้อนที่กำหนด ข้อกำหนดเบื้องต้นเพื่อให้ได้มาซึ่งความแม่นยำที่เพียงพอในเครื่องวัดปริมาณความร้อนแบบแห้งทั้งหมดคือการผสมกันของอากาศเย็นและผลิตภัณฑ์การเผาไหม้ที่ดี
การวัดการไหลของความร้อน
ความร้อนในรูปของพลังงานจะถูกถ่ายโอนในสามวิธี: ผ่านร่างกายของแข็ง (การนำความร้อน) สื่อของเหลวหรือก๊าซ (การพาความร้อน) และไม่มีการมีส่วนร่วมของสสาร (รังสี) ในเทคโนโลยี ส่วนประกอบทั้งสามมักจะเกี่ยวข้องกับการถ่ายเทความร้อน อย่างไรก็ตาม ในหลายกรณี เป็นไปได้ที่จะได้ผลลัพธ์ของความแม่นยำที่ยอมรับได้โดยการวัดส่วนประกอบเพียงชิ้นเดียว
การวัด การไหลของความร้อนด้วยค่าการนำความร้อน
การถ่ายเทความร้อนผ่านผนังนำความร้อนมีความสำคัญอย่างยิ่งในหลาย ๆ ด้านของเทคโนโลยี (เครื่องแลกเปลี่ยนความร้อนทุกชนิด ฉนวนกันความร้อน ฯลฯ) ในเวลาเดียวกัน การควบคุมปริมาณการผลิตในปัจจุบันไม่น่าสนใจมากนัก แต่ผลลัพธ์ของการวัดเดี่ยวที่ใช้เพื่อประเมินโหลด ตรวจสอบการปฏิบัติตามตัวบ่งชี้ที่รับประกันและประสิทธิภาพ
ตามกฎของการนำความร้อนคงที่ ฟลักซ์ความร้อนถูกกำหนดโดยสูตรต่อไปนี้ (J/s):
เนื่องจากทราบค่าการนำความร้อนของผนัง [J/(m*s*K)] และมิติทางเรขาคณิต การวัดค่าฟลักซ์ความร้อนจึงลดลงเพื่อวัดความแตกต่างของอุณหภูมิ อย่างไรก็ตาม เทคนิคนี้จำเป็นต้องมีการกำหนดอุณหภูมิพื้นผิวที่แม่นยำมาก ข้อผิดพลาดที่เกี่ยวข้องกับการเปลี่ยนแปลงในสภาวะการถ่ายเทความร้อนเมื่อติดตั้งองค์ประกอบที่ไวต่ออุณหภูมิบนพื้นผิวอาจมีขนาดค่อนข้างใหญ่ ดังนั้น สำหรับการวัดที่แม่นยำยิ่งขึ้น ขอแนะนำให้ใช้วิธีการด้านล่าง ซึ่งใช้ทั้งค่าการนำความร้อนและการถ่ายเทความร้อนพร้อมกัน
การวัดการไหลของความร้อนในการถ่ายเทความร้อน (การถ่ายเทความร้อนรวมกับการนำความร้อน)
สำหรับผนังเรียบที่กล่าวถึงในส่วนก่อนหน้านี้ กฎหมายการถ่ายเทความร้อน (J/s) ต่อไปนี้มีผลบังคับใช้:
![]() ,
,
โดยที่สัมประสิทธิ์การถ่ายเทความร้อน k 1J/(m2*s*K)] ร่วมกับสัมประสิทธิ์การถ่ายเทความร้อน [J/Dm*s*K)] สัมประสิทธิ์การถ่ายเทความร้อนและ [J/(m2*s*K) ] ของผนังทั้งสองด้านก็นำมาพิจารณาด้วย
บนผนังเรียบที่ฟลักซ์ความร้อนที่วัดได้ผ่านไป จะมีแผ่นบางๆ วางอยู่ อุณหภูมิพื้นผิวที่กำหนดโดยเทอร์โมคัปเปิลแบบฟิล์มบางในตัว ข้อดีของการวัดด้วยวิธีนี้คือไม่จำเป็นต้องทราบคุณสมบัติทางความร้อนของผนัง และคุณสมบัติที่สอดคล้องกันของเพลตสามารถลดลงเป็นค่าคงที่เดียวในระหว่างการสอบเทียบ องค์ประกอบที่ละเอียดอ่อนดังกล่าวมีขนาดประมาณ 30x30x0.5 มม. ช่วงการวัดครอบคลุมฟลักซ์ความร้อนตั้งแต่ 10 ถึง 100,000 W/m2; ข้อผิดพลาดคือ 2-5%
รูป หลักการทำงานของเครื่องวัดความร้อน
ด้วยการปรับปรุงวิธีการวัดนี้ เสื่อยางจึงถูกนำมาใช้แทนแผ่นที่ซ้อนทับกัน โดยการติดกาวบนพื้นผิวที่ไม่มีระนาบหรือพันไว้รอบพื้นผิวโค้ง ก็สามารถระบุการถ่ายเทความร้อนจากพื้นผิวที่มีขนาดค่อนข้างใหญ่ได้ เช่น จากท่อ ภาชนะ ฯลฯ เทอร์โมคัปเปิลถูกสร้างไว้บนพื้นผิวทั้งสองของ เสื่อเพื่อให้จุดเชื่อมต่อร้อนและเย็นของพวกเขาตั้งอยู่ตรงข้ามกัน (รูปที่ 6) และในกรณีนี้ ความหนาแน่นของฟลักซ์ความร้อนตามการสอบเทียบจะเป็นสัดส่วนกับความแตกต่างของอุณหภูมิ อย่างไรก็ตาม เสื่อที่ใช้ค่อนข้างรบกวนการถ่ายเทความร้อนเริ่มต้น ซึ่งจะเห็นได้ชัดเจนเมื่อวัดค่าที่แม่นยำ ดังนั้น วิธีการวัดนี้จึงใช้เป็นหลักในการกำหนดค่าคงที่ทางอุณหพลศาสตร์ของสาร เมื่อการละเมิดการไหลของความร้อนไม่ส่งผลต่อผลการวัด
การวัดการไหลของความร้อนในสภาพแวดล้อมปัจจุบัน
ส่วนสำคัญของพลังงานความร้อนจะถูกถ่ายโอนโดยตัวกลางที่เป็นของเหลวหรือก๊าซ (น้ำ ไอน้ำ ฯลฯ) ซึ่งเคลื่อนที่ในเครือข่ายท่อส่งแบบปิด อย่างไรก็ตาม เมื่อเทียบกับการส่งพลังงานไฟฟ้าด้วยสายไฟ ระยะทางที่สามารถส่งพลังงานความร้อนได้นั้นมีจำกัด สำหรับการศึกษาทางอุณหพลศาสตร์ของระบบทำความร้อนและทำความเย็นทุกประเภท จำเป็นต้องวัดการปล่อยและการใช้ความร้อน
ฟลักซ์ความร้อน F (J/s) ที่ส่งผ่านโดยการไหลของตัวพาความร้อนปานกลาง (kg/s) ผ่านส่วนควบคุมที่มีพื้นที่ A (m2) ในบางโซน ซึ่งรวบรวมสมดุลความร้อน (ใน โซนกระบวนการ รูปที่ 7) เท่ากับ
ปริมาณความร้อนที่ปล่อยออกมาในช่วงเวลา t2 - t1 ถูกกำหนดเป็นอินทิกรัล (J):
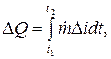
ความแตกต่างของปริมาณความร้อน (เอนทาลปี, J/กก.) ของสารหล่อเย็นที่ทางเข้า (ดัชนี e) และที่ทางออก (ดัชนี a) ของโซนสมดุลความร้อนอยู่ที่ไหน
เนื่องจากในกรณีทั่วไป ค่าของเอนทาลปีเป็นที่สนใจเมื่อเปรียบเทียบกับระดับหนึ่งเท่านั้น ตัวอย่างเช่น กับเอนทาลปีที่อุณหภูมิแวดล้อม การวัดค่าฟลักซ์ความร้อนทั้งหมดจึงเป็นการวัดที่แตกต่างกันโดยพื้นฐานแล้ว
เอนทาลปีแต่ละตัวที่รวมอยู่ในสมการทั่วไปสามารถแสดงในรูปของอุณหภูมิที่สอดคล้องกันและความจุความร้อนจำเพาะ
ดังนั้น การวัดการไหลของความร้อนจะลดลงโดยตรงกับการวัดอุณหภูมิและอัตราการไหลของมวล ในหลายกรณี ไม่ได้วัดปริมาณมวล แต่วัดการไหลของน้ำหล่อเย็น ในกรณีนี้ ผลลัพธ์ที่ได้จะแตกต่างไปตามค่าความหนาแน่นของสารหล่อเย็น р เท่านั้น ความจุความร้อนจำเพาะ ci เป็นหน้าที่ของอุณหภูมิ อย่างไรก็ตาม เนื่องจากช่วงการวัดที่แคบของเครื่องมือหลายชนิด จึงสามารถพิจารณาค่าคงที่ได้โดยไม่สูญเสียความแม่นยำไปมากนัก ต้องทราบความจุความร้อนจำเพาะ สำหรับของเหลว สมการการไหลของความร้อนจะง่ายขึ้น เนื่องจาก ความจุความร้อนจำเพาะไม่ขึ้นอยู่กับแรงกดดัน:
![]() , เจ/ส.
, เจ/ส.
ในสมการประเภทนี้ทั้งหมด จำเป็นต้องคำนึงถึงสัญญาณของปริมาณโดยขึ้นอยู่กับว่าความร้อนถูกจ่ายหรือกำจัดออกไป ไม่ว่ากระบวนการจะดูดความร้อนหรือคายความร้อน ไม่ว่าจะเย็นลงหรือร้อนขึ้นก็ตาม
