가스 혼합물. 가스의 열용량. 연료, 가스 혼합물 및 열용량
1.3. 이상 기체 상태 방정식
실제 물질에 대한 상태 방정식(1.1)의 형식은 다소 복잡합니다.
이와 관련하여 열역학에서는 작업체의 단순화된 물리적 모델이 사용됩니다.
기체 상태의 작동 유체에 대해 가장 간단하고 역사적으로 첫 번째 모델은 다음과 같습니다. 이상 기체. 이상기체는 분자간 상호작용의 힘(끌어당김과 반발력)이 없고 분자 자체가 다음과 같이 간주되는 기체입니다. 재료 포인트. 이상기체는 복종한다 클레이페론 방정식– 멘델레예프
어디 중시스템의 가스 질량입니다. μ는 기체의 몰질량입니다. 아르 자형μ = 8314 J/(kmol K)는 보편적인 기체 상수이며 기체의 유형이나 존재 조건에 의존하지 않습니다. 상태 (1.2)의 방정식은 다음을 결합하여 얻습니다. 보일-마리오트 법칙그리고 게이 루삭고려 아보가드로의 법칙.
몰 질량 μ = m/N, kg/mol은 1몰의 양으로 취한 물질의 질량이다. 1몰탄소 12g만큼 많은 입자를 포함하는 물질의 양의 단위입니다. 물질의 양– n = N/N ㅏ, 두더지, 어디에 N입자(원자, 분자)의 수, N ㅏ ≈ 6.02 10 23 - 탄소 12g의 원자 수( 아보가드로 수). 수치적으로 μ = Мr 10 -3 , 여기서 Mr는 물질의 상대 분자량( 탭. 멘델레예프) (예: =2kg/kmol).
특정 용어(즉, 1kg의 가스)에서 방정식(1.2)은 다음과 같은 형식을 갖습니다.
어디 아르 자형– 특정 기체 상수, J/(kg·K).
특정 기체 상수의 물리적 의미를 설명하겠습니다. 아르 자형. 첫 번째 상태 방정식(1.2)의 경우 , 같은 압력에서 두 번째 상태의 경우 - . 두 번째 방정식에서 첫 번째 방정식을 빼고 , 즉 비기체상수는 기체 1kg을 일정한 압력에서 1도 가열했을 때 한 일이다.
실험 데이터에 따르면 실제 가스는 이상적인 가스에 가까울수록 밀도가 낮아집니다. 즉, 압력의 증가 또는 온도의 감소로 인해 주어진 양의 기체의 부피가 감소하면 모든 기체는 이상 기체의 특성에서 점점 더 많은 편차를 줄 것입니다. 따라서 "이상 기체"라는 개념 아래 고온 및 저압의 모든 실제 기체에 적합합니다.
1.4. 믹스 이상 기체
실제로 작동 유체는 균질한 기체(예: 공기)의 혼합물인 경우가 많으며, 각 기체는 이상적인 것으로 간주될 수 있으며 화학 반응.
이러한 혼합물은 또한 이상 기체이며 혼합물에 대한 상태 방정식(1.2)을 따릅니다.
어디 R=R μ / μ는 혼합물의 기체 상수입니다. μ 혼합물의 평균(겉보기) 몰 질량(분자수와 전체 질량이 혼합물의 분자수와 질량과 동일한 균질한 대표 기체를 나타내는 조건부 값).
혼합물의 질량은 모든 구성 성분의 질량과 같습니다.
기체 혼합물의 거동을 결정하는 주요 법칙은 다음과 같습니다. 달튼의 법칙:
각 개별 기체는 기체 혼합물에서 단독으로 혼합물의 온도에서 혼합물의 전체 부피를 차지하는 것처럼 거동합니다.
기체 혼합물에 들어가는 각각의 개별 기체는 기체 혼합물의 전체 부피를 단독으로 차지할 때와 동일한 압력을 갖습니다.
따라서 가치 아르 자형(절대 혼합물 압력)은 다음과 같이 정의됩니다.
어디 아르 자형 나 – 부분 압력 나 th 구성 요소, 즉 압력 나 th 성분, 단독으로 동일한 온도에서 혼합물의 전체 부피를 차지하는 경우().
혼합물의 조성은 혼합물의 구성 성분의 질량 또는 몰 분율과 부피 분율(농도)로 표시됩니다.
질량 분율혼합물의 총 질량에 대한 각 가스의 질량 비율: .
식 (1.3)은 .
부피 분율비율이라고 한다 부분 볼륨(기체의 압력과 온도가 기체 혼합물의 압력 및 온도와 같을 때 기체가 차지하는 부피, 즉) 기체 혼합물의 총 부피: . 분압과 부피의 정의와 온도의 불변성은 다음과 같습니다.
![]() (1.5)
(1.5)
혼합물의 모든 구성 요소에 대한 마지막 평등을 요약하면 , 즉 혼합물을 구성하는 기체의 부분 부피의 합은 기체 혼합물의 부피와 같습니다.
부피 분율의 합은 1과 같습니다. .
몰 분율성분을 각 기체의 물질량의 비율이라고 합니다. N 나 가스 혼합물의 물질 양 N. 관계와 그리고 아보가드로의 법칙(동일한 온도와 동일한 압력에서 서로 다른 이상 기체의 동일한 부피에는 동일한 수의 분자가 포함됩니다. 즉) 다음과 같습니다.
저것들. 몰 분율로 혼합물을 지정하는 것은 부피 분율을 지정하는 것과 같습니다.
질량 및 부피 분율은 다음 비율과 관련이 있습니다.
![]() .
.
혼합물이 질량 분율로 주어지면 g 나, 혼합물의 기체 상수와 혼합물의 몰 질량은 다음과 같이 계산됩니다.
![]()
![]()
혼합물이 부피 분율로 주어지면 아르 자형 나, 혼합물의 몰 질량과 혼합물의 기체 상수를 계산하는 공식은 다음과 같습니다.
![]() (1.6)
(1.6)
기체의 부분압과 부피는 다음과 같이 결정됩니다. 보일의 법칙–마리오뜨(일정한 기체 온도에서 기체 압력과 부피의 곱은 일정한 값, 즉):
![]() .
.
시험 문제
국제 단위계(SI) 및 기본 단위.
기본 열역학 매개변수 및 치수.
열역학 시스템의 평형 상태는 무엇을 의미합니까?
평형 및 비평형 상태의 개념.
시스템의 상태 방정식은 무엇입니까?
시스템 상태의 기하학적 해석, 열역학적 과정.
이상기체란? 이상 기체와 실제 기체의 차이점은 무엇입니까?
기체 상수는 무엇입니까? 물리적 의미, 차원 및 정의 방법.
2. 열용량
모든 공정에서 작업체에 대한 열의 메시지는 상태의 변화를 일으키고 일반적으로 온도의 변화를 동반합니다. 작동 유체 상태의 다른 매개 변수뿐만 아니라 온도 변화는 공정 유형에 의존하지 않고 초기에 의존합니다 ( 1 ) 및 최종( 2 ) 상태, 즉 (기본 프로세스의 경우 매개변수의 변경은 미분으로 대체됨).
열량의 비율 δ 큐체온의 변화를 몸에 전달 dT기본 열역학 과정에서 실제 열용량이 과정에서 신체:
여기 아래 첨자는 열과 마찬가지로 열용량이 공정의 특성에 달려 있다는 사실을 나타냅니다. 또한 열용량은 신체의 양과 열역학적 상태에 따라 다릅니다. 또한 이 과정에서 신체의 화학적 조성은 변하지 않고, 한 응집 상태에서 다른 응집 상태로 물질의 전이가 없으며, 구성 요소의 용해 등이 없다는 점에 유의해야 합니다.
물질의 선택한 수량 단위에 따라 질량, 부피 및 몰 비열 용량이 구별됩니다.
질량 열용량의 개념은 실제로 가장 자주 사용됩니다.
2.1. 실제 및 평균 열용량
실제 물질의 열용량은 일정한 값이 아닙니다. 그것은 온도에 따라 변하며 이 의존성은 매우 중요할 수 있습니다(그림 2.1).
특정 공정 열량은 다음 공식으로 계산됩니다.
이 값을 결정하기 위해 다음 방법이 사용됩니다.
실험 결과에 따르면 온도에 대한 열용량의 의존성은 근사 다항식으로 표시됩니다.
근사 계수는 어디에 있습니까? 이러한 계수는 참고 문헌에 나와 있습니다. 그 다음에
온도 범위에서 실제 계산 티 1 , 티 2 열용량은 다음과 같은 일정한 값으로 간주됩니다.
~라고 불리는 평균 열용량이 간격에서는 (2.1)에 소개된 실제 열용량과 대조됩니다. 참조 데이터는 0에서 고정 온도까지의 평균 열용량을 제공합니다. 티경험적으로 얻은, 즉
온도 범위의 평균 열용량 티 1 , 티 2 이러한 참조 데이터에 따라 다음 공식으로 계산할 수 있습니다.
그 다음에 특정 수량공정 열은 다음과 같이 정의됩니다.
2.2. 등온성 및 등압성 열용량
열역학에서 매우 중요합니다.
등코릭열용량
체온 변화에 대한 일정한 부피의 과정에서 열량의 비율과 동일,
등압열용량
체온 변화에 대한 일정한 압력에서 과정의 열량의 비율과 같습니다.
열 공학 계산에서는 온도에 따른 다양한 물질의 특정 등압 및 등온 열용량에 대해 실험적으로 얻은 수치를 보여주는 표가 사용됩니다.
2.3. 가스 혼합물의 열용량
계산에서 가스 혼합물을 처리해야 하는 경우가 많으며 열용량은 개별 가스에 대해서만 표에 나와 있습니다.
기체 혼합물이 질량 분율로 주어지면 g 나, 혼합물의 비 질량 열용량은 공식에 의해 결정됩니다
![]()
기체 혼합물이 부피 분율로 주어지면 아르 자형 나, 혼합물의 비 체적 열용량은 공식에 의해 결정됩니다
![]()
시험 문제
비열 용량의 단위를 기록하십시오.
평균 열용량의 개념은 어떻게 도입됩니까?
3. 에너지 보존과 변환의 법칙
에너지의 개념은 물질의 움직임과 관련이 있습니다.
에너지는 기계적 작업, 열, 화학 에너지, 전기장 및 자기장의 에너지와 같은 다양한 형태를 취할 수 있습니다.
열역학 과정에서 환경과 닫힌 열역학 시스템의 상호 작용은 열과 기계적 작업의 형태로 에너지를 교환하여 수행됩니다.
3.1. 내부 에너지
모든 환경에는 약간의 여유가 있습니다. 내부 에너지유(J), 이것은 기술 열역학에서 분자와 매질의 원자의 운동 에너지와 잠재적 에너지의 합으로 표현됩니다. 이러한 입자의 운동 에너지는 속도와 질량에 의해 결정되는 반면, 위치 에너지는 상대 위치에 따라 달라지는 입자 간의 상호 작용력에 의해 결정됩니다. 시스템의 내부 에너지는 시스템 자체에 포함된 에너지입니다. 이것은 내부 에너지가 양과 함께 신체의 상태를 특성화할 수 있음을 의미합니다. 아르 자형, V, 티.
내부 에너지에는 가산성 속성이 있습니다. 복잡한 시스템의 내부 에너지는 구성 요소의 내부 에너지의 합과 같습니다.
물질 1kg의 내부 에너지를 특정 내부 에너지 유= 유/ 중 (J/kg).
열역학의 대부분의 기술적 응용에서 중요한 것은 절대값이 아닙니다. 유, 그리고 이 값의 변화. 따라서 균질 시스템의 내부 에너지에 대한 정량적 정의는 일반적으로 선택된 일부 표준 상태와 관련하여 종종 결정됩니다.
3.2. 열역학에서 에너지 보존 법칙
열역학적 과정을 수행하는 닫힌 시스템은 외부 환경(외부 본체 및 필드)과 상호 작용합니다. 에너지를 교환합니다. 기술 열역학에서는 열 전달과 기계적 작업 수행이라는 두 가지 유형의 에너지 전달이 고려됩니다.
열전달은 온도가 다른 물체와 접촉하는 물체 사이 또는 멀리 떨어져 있는 온도가 다른 물체 사이에서 전자기파에 의해 발생합니다. 열복사). 방송 따뜻함신체의 가시적인 움직임 없이 분자(미세물리적) 수준에서 발생합니다.
작업 형태의 에너지 전달은 공간에서 몸 전체 또는 부분의 움직임으로 발생합니다. 이 방법을 사용하면 몸체가 힘장 내에서 움직이거나 외부 압력의 영향으로 부피가 변경됩니다. 일하다에너지 전달의 거시적 형태입니다.
신체의 에너지와 달리 열과 일은 그 상태의 기능이 아니라 과정의 유형에 따라이 과정을 결정한다는 점에 유의해야합니다. 프로세스 자체의 기능입니다.
수많은 실험과 관찰로 자연의 기본 법칙인 에너지 보존 법칙이 발견되었습니다. 자연의 에너지는 무에서 생겨나지 않고 사라지지 않으며,또는 에너지의 양은 변하지 않고 한 형태에서 다른 형태로 변할 뿐,또는
어디 큐프로세스에 관련된 열입니다. 엘- 수행 중인 작업 △ 이자형시스템 에너지의 변화입니다. 여기와 아래에서 우리는 다음 사항을 고려하는 데 동의합니다.
일하다 긍정적인이 작업이 작업 기관에서 수행되는 경우 부정적인, 작업이 시스템의 작업 본체에서 수행되는 경우
몸에 공급되는 열 긍정적인, 그리고 할당된 - 부정적인
또한 최종 프로세스에서 상태 매개변수의 변경은 기호 Δ(델타)로 표시되고 기본 프로세스에서는 - 디(해당 매개변수의 미분). 모든 유한 열역학 과정에서 상태 매개변수(압력, 온도, 내부 에너지, 엔탈피, 엔트로피 등)의 변화는 과정 유형에 의존하지 않고 초기 및 최종 상태에 의해 결정됩니다.
일반적으로 열역학 시스템은 내부 에너지가 유, 운동 에너지(열역학에서 시스템은 속도로 움직이는 전체로 간주됩니다. 승) – 음 2/2, 잠재력 - mgz (지시스템이 위치한 높이). 과정의 총 에너지 변화 1 –2 다음과 같이 상상할 수 있습니다.
이 과정에서 하는 일은 일의 합이다. 엘약, 시스템의 작동 유체 체적 변화와 관련된 (변형 작업), 작업 엘공간에서 시스템의 움직임에 대한 dv, 기술 작업 L 그것들(엔진, 증기 보일러, 압축기 등과 같은 다양한 기술 장치에서 시스템을 이동할 때)은 마찰력에 대해 작동합니다. 엘트:
L \u003d L 약 + L dv + L 그 + L tr.
과정에 포함된 열은 열의 합입니다. 큐외부, 외부 환경과의 교환에 관여, 마찰열 큐트:
큐 = 큐외부 + 큐트.
을 고려하면 큐트르 = 엘 tr (많은 실험에서 마찰을 극복하는 데 소비 된 흐름의 작업이 흐름에 의해 감지되는 열로 완전히 변환됨을 보여주었습니다), 작동하는 균질 물질 1kg에 대한 열역학 에너지 보존 법칙 (즉, 특정 질량 값 ) 기본 프로세스에서 다음과 같이 작성할 수 있습니다.
![]() , (3.1)
, (3.1)
(외부 인덱스는 불필요하므로 생략).
미분 기호 아래 (3.1)의 오른쪽에는 상태 함수가 있고 나머지는 열역학 과정의 특성에 따라 달라지는 양이라는 점을 강조해야 합니다. 일과 열은 상태 함수가 아니라 과정 함수이기 때문에 기호 δ는 기본 과정에서 뒤따르는 양이 임의의 극소수이며 특정 함수의 증분이 아님을 나타냅니다. 따라서 δ 큐및 δ 엘-원소(즉, 시스템 상태의 극미한 변화에 해당)의 열과 일의 양.
열역학 시스템이 공간에서 위치를 변경하지 않고 유일한 유형의 작업이 시스템 부피의 변화와 관련된 작업인 경우 방정식 (3.1)은 더 간단한 형식을 취합니다.
직업 δ 엘~에 대한 외부 압력의 힘에 대항하여 수행 된 다음 작동 유체의 부피가 팽창하거나 반대로 외부 환경이 신체에 작업을 수행하여 압축합니다. 평형 과정의 경우 매체의 압력이 작동 유체의 압력과 같을 때 이 일은 다음과 같이 계산됩니다. 아르 자형DVD, 어디 V작업 물질의 특정 부피입니다.
방정식
~라고 불리는 열역학 제1법칙: 정지해 있는 닫힌 열역학 시스템에 공급된 열은 시스템의 내부 에너지를 변경하고 시스템의 체적을 변경하는 작업을 수행하는 데 사용됩니다.. 균형 관계(3.2)는 강의라고도 합니다. ~에이론 문헌. 1. 바로크: ...
L. A. Eliseeva © 2013년 러시아 과학 아카데미 시베리아 지부의 주립 공공 과학 및 기술 도서관 연방 주예산 연구소
바늘랜덤 워크 / A.N. 보로딘, I. A. Ibragimov; under... 241. Dorogokupets P.I. 열역학미네랄 및 미네랄 평형 ... 카탈로그: 개요 강의 ~에코스 "참조 ... 상태 전문인대학교. 시리즈, 전문인과학. - ...
N. V. Basova [및 기타], ed. N.V. 바소바. 로스토프 해당 없음: 피닉스, 2008
교과서과정) 서면 D. T. 시놉시스 강의 ~에고등 수학 [텍스트]: ... 전문인 열역학 Rudobashta, S.P. 열 공학 [텍스트]: 학생을 위한 교과서. 공부하는 대학 ~에... 2008. - 204p. 십 보로딘, I.F. 기술 프로세스의 자동화...
2008년부터 2013년 6월 1일까지 재무부의 과학 작품 목록 (1)
문서... "X선 연구 방법" 강의 ~에임상 종양학. 두 번째 법칙의 알마티... 열역학» 2-국제... 및 전문가 리뷰 전문인의료 기관 장비 ... 러시아 의학 아카데미의 학자 Yu.I. 보로딘, 비슈케크, 2009, p. ...
엔지니어링 실무에서 종종 균질한 가스가 아니라 화학적으로 관련이 없는 가스의 혼합물을 다루어야 합니다. 가스 혼합물의 예는 대기, 천연 가스, 연료 연소의 가스 생성물 등입니다.
가스 혼합물의 경우 다음 조항이 유효합니다.
1. 혼합물에 들어가는 각 가스에는 온도가 있고, 온도와 동일혼합물.
2. 혼합물에 포함된 모든 기체는 혼합물의 부피 전체에 분포하므로 각 기체의 부피는 전체 혼합물의 부피와 같습니다.
3. 혼합물에 포함된 각 가스는 자체 상태 방정식을 따릅니다.
4. 혼합물 전체는 새로운 기체와 같으며 자체 상태 방정식을 따릅니다.
기체 혼합물에 대한 연구는 Dalton의 법칙을 기반으로 하며, 이에 따르면 일정한 온도에서 혼합물의 압력은 혼합물에 포함된 기체의 분압의 합과 같습니다.
여기서 p cm는 혼합물의 압력입니다.
p i - 혼합물에 포함된 i 번째 가스의 분압;
n은 혼합물에 포함된 기체의 수입니다.
분압은 혼합물에 들어가는 가스가 동일한 온도에서 혼합물의 전체 부피를 단독으로 차지할 때 가하는 압력입니다.
가스 혼합물 설정 방법
기체 혼합물의 조성은 질량, 부피 및 몰 분율로 지정할 수 있습니다.
질량 분율. 혼합물에 포함된 모든 기체의 질량 분율은 혼합물의 질량에 대한 이 기체의 질량의 비율입니다.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ...........; m n \u003d M n / M cm,
어디서? m 1 , m 2 , ..., m n - 가스의 질량 분율;
M 1 , M 2 , ..., M n - 개별 가스의 질량;
M cm는 혼합물의 질량입니다.
그것은 쉽게 볼 수 있습니다  그리고
그리고  (100%).
(100%).
볼륨 공유.혼합물에 포함된 모든 가스의 부피 분율은 혼합물의 부피에 대한 이 가스의 감소된(부분) 부피의 비율입니다.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ......., r n = V n / V cm;
어디서? V 1 , V 2 , ..., V n - 가스의 감소된 부피;
V cm는 혼합물의 부피입니다.
r 1 , r 2 , ..., r n - 가스의 부피 분율.
감소된 부피는 혼합물의 조건(혼합물의 온도 및 압력에서) 하에서의 기체 부피입니다.
감소된 부피는 다음과 같이 나타낼 수 있습니다. 하나를 제외한 모든 가스가 혼합물을 포함하는 용기에서 제거되고 나머지 가스가 온도를 유지하면서 혼합물의 압력으로 압축되면 부피는 감소되거나 부분적일 것입니다.
혼합물의 부피는 감소된 기체 부피의 합과 같다는 것을 증명할 수 있습니다.
 (100%).
(100%).
몰 분수.혼합물에 포함된 모든 기체의 몰 분율은 혼합물의 킬로몰 수에 대한 이 기체의 킬로몰 수의 비율입니다.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ......., r n \u003d n n / n cm,
어디서? r 1 , r 2 , ..., r n - 기체의 몰 분율;
n cm는 혼합물의 킬로몰 수입니다.
n 1 , n 2 , ..., n n은 기체의 킬로몰 수입니다.
혼합물을 몰분율로 지정하는 것은 혼합물을 부피분율로 지정하는 것과 동일합니다. 몰 및 부피 분율은 혼합물에 포함된 각 가스에 대해 동일한 수치를 갖습니다.
기체 상수 및 혼합물의 겉보기(평균) 분자량.질량 분율로 주어진 가스 혼합물 상수를 계산하기 위해 상태 방정식을 작성합니다.
혼합물을 위해
p cm × V cm = M cm R cm T; (1.9)
가스용
 .
(1.10)
.
(1.10)
방정식의 왼쪽 부분과 오른쪽 부분을 합산합니다(1.10).
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
왜냐하면  ,
,
그런 다음 p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
방정식 (1.9) 및 (1.11)은 다음을 의미합니다.
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
남 1 R 1 + m 2 R 2 + ...... + m n R n
또는  ,
(1.12)
,
(1.12)
여기서 R cm는 혼합물의 기체 상수입니다.
i 번째 기체의 기체 상수 때문에
RI = 8314 / m 나는 ,
방정식(1.12)은 다음과 같이 다시 작성됩니다.
 .
(1.13)
.
(1.13)
기체 혼합물의 매개변수를 결정할 때 기체 혼합물의 겉보기(평균) 분자량이라고 하는 특정 조건 값을 사용하는 것이 편리합니다. 혼합물의 겉보기 분자량 개념을 통해 우리는 일반적으로 혼합물을 균질한 기체로 간주할 수 있으므로 계산이 크게 단순화됩니다.
별도의 기체의 경우 식
유추하여 혼합물에 대해 다음과 같이 쓸 수 있습니다.
m cm R cm = 8314, (1.14)
여기서 m cm는 혼합물의 겉보기 분자량입니다.
식 (1.14)에서 식 (1.12) 및 (1.13)을 사용하여 다음을 얻습니다.
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
이런 식으로 논하면 체적 분율을 통해 R cm 및 m cm를 계산하는 공식, 질량 분율을 체적 분율로 변환하는 공식, 역으로 부피 분율을 질량 분율로 변환하는 공식, 혼합물의 특정 부피를 계산하는 공식 u cm 및 혼합물 밀도 r cm 질량 및 부피 분율, 마지막으로 혼합물에 포함된 기체의 분압 계산 공식, 부피 및 질량 분율. 우리는 표에서 파생 없이 이러한 공식을 제시합니다.
가스 혼합물 계산 공식
|
혼합물의 조성 설정 |
한 구성에서 다른 구성으로 전송 |
혼합물의 밀도 및 특정 부피 |
혼합물의 겉보기 분자량 |
가스 혼합물 상수 |
부분 압력 |
|
질량 분율 |
|
|
|
|
|
|
부피 분율 |
|
|
|
|
|
가스의 열용량
물체의 열용량은 물체를 1K 가열하거나 냉각하는 데 필요한 열량입니다. 물질의 단위량 열용량을 비열용량이라고 합니다.
따라서 물질의 비열용량은 이 과정에서 물질의 온도를 1K만큼 변화시키기 위해 물질의 단위에서 전달되거나 제거되어야 하는 열의 양입니다.
다음에서는 비열용량만 고려하므로 비열용량을 단순히 열용량이라고 합니다.
기체의 양은 질량, 부피 및 킬로몰 수로 나타낼 수 있습니다. 가스 체적을 설정할 때 이 체적은 정상 상태가 되고 일반 입방 미터(nm 3)로 측정됩니다.
가스의 양을 설정하는 방법에 따라 다음과 같은 열용량이 구별됩니다.
c - 질량 열용량, J / (kg × K);
c¢ - 체적 열용량, J / (nm 3 × K);
c m - 몰 열용량, J / (kmol × K).
이러한 열용량 사이에는 다음과 같은 관계가 있습니다.
c = cm / m; m = × m;
с¢ = с m / 22.4; m = s¢ × 22.4,
여기에서  ; s¢ = s × r n,
; s¢ = s × r n,
어디서? u n 및 rn n - 정상 조건에서의 비체적 및 밀도.
등압 및 등압 열용량
작동 유체에 전달되는 열의 양은 열역학적 과정의 특성에 따라 다릅니다. 열역학적 과정에 따라 두 가지 유형의 열용량이 실질적으로 중요합니다: 등변성 및 등압성.
u = const에서의 열용량은 등변성입니다.
c u - 질량 isochoric 열용량,
센트 유체적 등변량 열용량,
센티미터 유는 어금니 등코릭 열용량입니다.
p = const에서의 열용량은 등압입니다.
c p - 질량 등압 열용량,
c¢ р - 체적 등압 열용량,
c m p - 몰 등압 열용량.
p = const에서 수행되는 프로세스의 동일한 온도 변화로 u = const에서 프로세스보다 더 많은 열이 소비됩니다. 이것은 u = const에서 신체에 전달된 열이 내부 에너지를 변경하는 데만 소비되는 반면, p = const에서 열은 내부 에너지를 증가시키고 팽창 작업을 수행하는 데 모두 소비된다는 사실에 의해 설명됩니다. Mayer 방정식에 따른 질량 등압 열용량과 질량 등압 열용량의 차이
c 피 - c 유=R. (1.17)
방정식 (1.17)의 왼쪽과 오른쪽에 킬로몰 질량 m을 곱하면 다음을 얻습니다.
씨엠피 - 씨엠 유= 8314J/(kmol×K) (1.18)
열역학 및 그 응용 분야에서 등압 열용량과 등핵 열용량의 비율은 매우 중요합니다.
 ,
(1.19)
,
(1.19)
여기서 k는 단열 지수입니다.
계산에 따르면 단원자 기체 k » 1.67, 이원자 기체 k » 1.4, 삼원자 기체 k » 1.29입니다.
값임을 쉽게 알 수 있다. 에게온도 의존적. 실제로 방정식 (1.17)과 (1.19)에서 다음과 같이 나옵니다.
 ,
(1.20)
,
(1.20)
및 방정식 (1.18) 및 (1.19)에서
 .
(1.21)
.
(1.21)
열용량은 가스 온도가 증가함에 따라 증가하기 때문에 k 값은 감소하여 1에 가까워지지만 항상 그보다 큰 상태를 유지합니다.
k 값을 알면 해당 열용량의 값을 결정할 수 있습니다. 예를 들어, 방정식 (1.20)에서 우리는
 ,
(1.22)
,
(1.22)
이후 p = k × s 유, 그럼 우리는
 .
(1.23)
.
(1.23)
유사하게, 몰 열용량의 경우 식 (1.21)에서 우리는 다음을 얻습니다.
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
평균 및 실제 열용량
가스의 열용량은 온도와 어느 정도 압력에 따라 달라집니다. 압력에 대한 열용량의 의존성은 작고 대부분의 계산에서 무시됩니다. 온도에 대한 열용량의 의존성은 중요하며 반드시 고려해야 합니다. 이 의존성은 방정식으로 매우 정확하게 표현됩니다.
c = a + 안에 t + et 2 , (1.26)
어디, 안에 e는 주어진 가스에 대해 일정한 값입니다.
종종 열 공학 계산에서 비선형 종속성(1.26)은 선형 종속성으로 대체됩니다.
c = a + 안에티. (1.27)
|
방정식 (1.26)에 따라 온도에 대한 열용량의 의존성을 그래픽으로 구성하면 이것은 곡선 의존성이 될 것입니다 (그림 1.4). 그림과 같이 각 온도 값에는 고유한 열용량 값이 있으며 일반적으로 실제 열용량이라고 합니다. 수학적으로 실제 열용량에 대한 식은 다음과 같이 작성됩니다.
|
|
|
|
따라서 실제 열용량은 극미한 온도 dt에 대한 극미량 열량 dq의 비율입니다. 즉, 실제 열용량은 주어진 온도에서 기체의 열용량입니다. 무화과에. 1.4에서 온도 t 1에서의 실제 열용량은 t1으로 표시되고 온도 t 2에서 세그먼트 1-4로 표시되며 t2로 표시되며 세그먼트 2-3으로 표시됩니다. 방정식 (1.28)에서 우리는 dq=cdt. (1.29) 실제 계산에서 우리는 항상 최종 변화에서의 열량 |
온도. t 1 에서 t 2 로 가열될 때 물질의 단위량으로 보고되는 열량 q 는 t 1 에서 t 2 로 적분하여 (1.29) 구할 수 있음은 자명합니다.
 .
(1.30)
.
(1.30)
그래픽으로 적분(1.30)은 4-1-2-3 영역으로 표현됩니다. 식 (1.30)에서 선형 의존성 (1.27)에 따라 실제 열용량 값을 대입하면 다음을 얻습니다.
 (1.31)
(1.31)
어디  - t 1 ~ t 2의 온도 범위에서 평균 열용량.
- t 1 ~ t 2의 온도 범위에서 평균 열용량.
 ,
(1.32)
,
(1.32)
따라서 평균 열용량은 최종 온도 변화 t 2 - t 1 에 대한 최종 열량 q의 비율입니다.
 .
(1.33)
.
(1.33)
4-3(그림 1.4)에 기초하여 직사각형 4-1¢-2¢-3이 구성되고 크기가 그림 4-1-2-3과 같으면 이 직사각형의 높이는 평균 열용량과 같아야 합니다.  온도 범위 t 1 - t 2 에 있습니다.
온도 범위 t 1 - t 2 에 있습니다.
일반적으로 평균 열용량 값은 물질의 열역학적 특성 표에 나와 있습니다. 그러나이 표의 부피를 줄이기 위해 0 ° C ~ t ° C의 온도 범위에서 결정된 평균 열용량 값을 제공합니다.
주어진 온도 범위 t 1 - t 2에서 평균 열용량 값을 계산해야 하는 경우 다음과 같이 수행할 수 있습니다.
곡선 c \u003d f (t) (그림 1.4) 아래의 면적 0a14는 가스 온도를 0 ° C에서 t 1 ° C로 높이는 데 필요한 열량 q 1에 해당합니다.

유사하게, 영역 0a23은 온도가 0 o C에서 t 2 o C로 상승할 때 q 2에 해당합니다.

따라서 q \u003d q 2 - q 1(영역 4123)은 다음과 같이 나타낼 수 있습니다.
![]() (1.34)
(1.34)
(1.34)에 따른 q 값을 식 (1.33)에 대입하면 모든 온도 범위에서 평균 열용량에 대한 공식을 얻습니다.
 .
(1.35)
.
(1.35)
따라서 평균 열용량은 식 (1.35)를 사용하여 표의 평균 열용량에서 계산할 수 있습니다. 또한 비선형 종속성 c = f(t)를 얻습니다. 선형 관계를 사용하여 식 (1.32)를 사용하여 평균 열용량을 찾을 수도 있습니다. 값 a 및 안에다양한 가스에 대한 방정식 (1.32)은 문헌에 나와 있습니다.
작동 유체에서 공급되거나 제거된 열의 양은 다음 방정식 중 하나를 사용하여 계산할 수 있습니다.
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
어디 

 - 각각 평균 질량, 부피 및 몰 열용량; M은 기체의 질량입니다. n은 가스의 킬로몰 수입니다. V n - 정상 조건에서 가스의 부피.
- 각각 평균 질량, 부피 및 몰 열용량; M은 기체의 질량입니다. n은 가스의 킬로몰 수입니다. V n - 정상 조건에서 가스의 부피.
기체의 부피 V n 은 다음과 같이 구할 수 있습니다. 주어진 조건: pV = MRT 및 정상 조건: p n V n = MRT n에 대한 상태 방정식을 작성한 후, 우리는 두 번째 방정식을 첫 번째 방정식에 귀속시킵니다.
 ,
,
여기에서  .
(1.39)
.
(1.39)
가스 혼합물의 열용량
기체 혼합물의 열용량은 혼합물의 조성이 주어지고 혼합물에 포함된 성분의 열용량을 알면 계산할 수 있습니다.
질량 M cm 의 혼합물을 1K 가열하려면 각 성분의 온도도 1K 증가해야 합니다. 동시에, c i Mi 와 같은 열량은 혼합물의 i 번째 성분을 질량 М i 로 가열하는 데 소비됩니다. 전체 혼합물에 대한 열량  ,
,
여기서 c i 및 c cm는 i 번째 성분과 혼합물의 질량 열용량입니다.
마지막 식을 M cm로 나누면 혼합물의 질량 열용량에 대한 계산 공식을 얻습니다.
 ,
(1.40)
,
(1.40)
여기서 m i는 i번째 성분의 질량 분율입니다.
유사하게 논증하면 혼합물의 체적 열용량 c ¢ cm 와 몰 열용량 c m cm 를 찾습니다.
 (1.41)
(1.41)
여기서 c¢ i - i 번째 구성 요소의 체적 열용량, r i - i 번째 구성 요소의 체적 비율,
 ,
(1.42)
,
(1.42)
여기서 c m i 는 i 번째 성분의 몰 열용량이고,
r i - i 번째 성분의 몰(부피) 분율.
열 엔진(기계)에서 작동 유체는 다양한 가스의 혼합물입니다. 혼합물의 구성 요소가 서로 화학 반응을 일으키지 않고 각 구성 요소가 Claiperon 상태 방정식을 따르는 경우 이러한 혼합물을 이상 기체로 간주합니다.
혼합물을 계산하려면 μ cm - 평균 몰 질량 및 R c m - 혼합물의 특정 기체 상수를 결정해야 합니다. 그것들을 결정하려면 혼합물의 조성, 즉 어떤 성분과 어떤 양으로이 혼합물을 형성하는지, 혼합물에 포함 된 각 성분이 갖는 매개 변수를 알아야합니다.
혼합물의 각 성분은 혼합물에 다른 기체가 없는 것처럼 행동하고 혼합물이 있는 전체 사용 가능한 부피를 차지하며 자체 상태 방정식을 따르고 벽에 소위 부분압을 가하는 반면 온도는 혼합물의 모든 성분의 온도는 혼합물 온도와 동일하고 동일합니다.
Dalton의 법칙에 따르면 혼합물 P의 압력은 혼합물에 포함된 개별 성분의 분압의 합과 같습니다.
여기서 n은 혼합물 성분의 수입니다.
Amag의 법칙에 따르면 혼합물의 부피 V는 혼합물의 온도와 압력에서 혼합물에 포함된 개별 성분의 부분 부피의 합과 같습니다.
 , (1.21)
, (1.21)
어디서 - 부분 부피, m 3; V- 혼합물의 부피, m 3
혼합물의 조성은 부피(몰) 또는 질량 분율로 표시됩니다.
i번째 성분의 부피 분율혼합물의 부피에 대한 성분의 부분 부피의 비율입니다. 즉, 혼합물 성분의 부피 분율의 합은 1, 즉 . 값이 %로 주어지면 그 합은 100%입니다.
i번째 성분의 몰분율 n i는 성분 Ni의 킬로몰 수 대 혼합물 N의 킬로몰 수의 비율입니다. 즉, 여기서 ![]() , , 즉 각 성분과 혼합물 전체의 킬로몰 수는 1킬로몰이 차지하는 부피에 대한 해당 성분과 혼합물 전체의 비율과 같습니다.
, , 즉 각 성분과 혼합물 전체의 킬로몰 수는 1킬로몰이 차지하는 부피에 대한 해당 성분과 혼합물 전체의 비율과 같습니다.
동일한 조건에서 이상 기체가 동일한 부피의 킬로몰을 갖는다는 것을 고려하면 대체 후 우리는 다음을 얻습니다. 즉, 이상 기체의 경우 몰 및 부피 분율은 수치적으로 동일합니다.
i번째 성분의 질량 분율혼합물의 질량에 대한 성분의 질량의 비율: , 혼합물의 질량은 성분의 질량의 합과 같고 또한 성분의 질량 분율의 합은 같음 1(또는 100%).
부피 분율을 질량 분율로 또는 그 반대로 변환하는 것은 다음 비율을 기반으로 합니다.
![]() ,
,
여기서 ρ = μ / 22.4, kg / m 3입니다.
따라서 i 번째 구성 요소의 질량 분율은 다음 관계에서 결정됩니다.
 ,
,
여기서 혼합물의 밀도, kg / m 3은 i 번째 성분의 부피 분율입니다.
앞으로는 부피 분율을 통해 결정할 수 있습니다.
 .
.
밀도부피 분율에 대한 혼합물은 관계식에서 결정됩니다.
 , 어디
, 어디  , (1.22)
, (1.22)
 .
.
부분 압력은 다음 공식에 의해 결정됩니다.
![]() 또는
또는  (1.23)
(1.23)
구성 요소와 혼합물 전체의 상태 방정식은 다음과 같은 형식을 갖습니다.
![]() ;
;
![]() ,
,
변환 후 우리는 다음을 얻습니다. 엄청난주식
 ,
,  . (1.24)
. (1.24)
혼합물의 밀도 및 특정 부피 엄청난공유하다:
;  . (1.25)
. (1.25)
부분 압력을 계산하기 위해 다음 공식이 사용됩니다.
 . (1.26)
. (1.26)
질량 분율을 부피 분율로 변환하는 것은 다음 공식에 따라 수행됩니다.
 .
.
기체 혼합물의 열용량을 결정할 때 기체 혼합물을 가열(냉각)하려면 혼합물의 각 성분을 가열(냉각)해야 한다고 가정합니다.
여기서 Q i =M i c i ∆t는 혼합물의 i번째 성분의 온도를 변경하는 데 소비된 열이고, c i는 혼합물의 i번째 성분의 질량 열용량입니다.
혼합물의 열용량은 비율에서 결정됩니다(혼합물이 질량 분율로 주어진 경우)
 , 유사하게
, 유사하게  . (1.28)
. (1.28)
부피 분율로 주어진 혼합물의 몰 및 부피 열용량은 다음과 같이 결정됩니다.
 ;
;  ;
;
 ;
; 
실시예 1.5질량으로 건조한 공기는 g O2 \u003d 23.3% 산소와 g N 2 \u003d 76.6% 질소로 구성됩니다. 공기의 조성(r O2 및 r N 2)과 혼합물의 기체 상수를 결정합니다.
해결책.
1. 표 1에서 kg/kmol 및 kg/kmol을 찾습니다.
2. 산소와 질소의 부피 분율을 결정하십시오.
1. 공기(혼합물)의 기체 상수는 다음 공식에 의해 결정됩니다.
 , J/kg K
, J/kg K
실시예 1.6. 질량이 M = 2 kg인 기체 혼합물을 P = const에서 가열하는 데 필요한 열량을 결정하십시오. 중량%로 구성됩니다. , , , , 온도가 t 1 =900 °C에서 t 2 = 1200으로 변할 때 ° C
해결책:
1. P=const 및 t1=900oC(P2에서)에서 기체 혼합물을 구성하는 성분의 평균 질량 열용량을 결정합니다.
1.0258kJ/kg K; =1.1045kJ/kg K;
1.1078kJ/kg K; =2.1097kJ/kg K;
2. P = const 및 t 1 = 1200 o C (P2에서)에서 가스 혼합물을 구성하는 구성 요소의 평균 질량 열용량을 결정합니다.
1.0509kJ/kg K; =1.153kJ/kg K;
1.1359kJ/kg K; =2.2106kJ/kg K;
3. 온도 범위에 대한 혼합물의 평균 질량 열용량을 결정합니다. t 2 \u003d 1200 ° C 및 t 1 \u003d 900 ° C:
4. P=const에서 혼합물 2kg을 가열하기 위한 열량:
열역학 제1법칙작동 유체에 열을 공급한 결과 시스템의 내부 에너지 변화와 환경의 외부 압력에 대해 수행되는 기계적 작업 사이의 양적 관계를 설정합니다.
닫힌 열역학 시스템의 경우 첫 번째 법칙의 방정식은 다음과 같은 형식을 갖습니다.
작동유체(또는 계)에 가해지는 열은 체온 상승으로 내부에너지(dU)를 증가시키고 작동유체의 팽창과 온도상승에 따른 외부일(dL)을 수행하는 데 사용된다. 용량.
첫 번째 법칙은 dH=dq+VdP=dq-dL 0 ,
여기서 dL 0 \u003d VdP - 압력 변화의 기본 작업을 유용한 외부 (기술) 작업이라고합니다.
dU는 분자의 열 운동(병진, 회전 및 진동) 에너지와 분자 상호작용의 위치 에너지를 포함하는 작동 유체(시스템)의 내부 에너지 변화입니다.
따라서 열 공급의 결과로 시스템이 한 상태에서 다른 상태로 전환되기 때문에 작동 유체가 가열되고 온도가 dT만큼 상승하고 부피가 dV만큼 증가합니다.
체온의 증가는 입자의 운동 에너지를 증가시키고 체적의 증가는 입자의 위치 에너지의 변화를 초래합니다. 결과적으로 신체의 내부 에너지는 dU만큼 증가하므로 내부 에너지 U는 신체 상태의 함수이며 두 개의 독립적인 매개변수 U=f 1 (P,V)의 함수로 나타낼 수 있습니다. U=f2(P,T), U=f3(υ,T). 열역학적 과정에서 내부 에너지의 변화는 초기(U 1) 및 최종(U 2) 상태에 의해서만 결정됩니다.
미분 형식으로 내부 에너지의 변화가 기록됩니다.
a) 특정 부피와 온도의 함수

b) 온도의 함수로서, , 그 다음에
온도에 따른 C v의 변화를 고려해야 하는 실제 계산을 위해 실험식과 특정 내부 에너지 표(종종 몰)가 있습니다. 이상 기체의 경우 혼합물의 몰 내부 에너지 U m은 다음 공식에 의해 결정됩니다.
 , J/kmol
, J/kmol
질량 분율로 주어진 혼합물의 경우. 이런 식으로 내부 에너지있다 시스템의 속성과 시스템의 상태를 특성화.
엔탈피 Kamerling-Onnes가 도입한 열 상태 함수(승자 노벨상, 1913), 시스템 U의 내부 에너지와 시스템 P의 압력과 부피 V의 곱입니다.
여기에 포함 된 양은 상태 함수이므로 H도 상태 함수입니다. 즉 H \u003d f 1 (P, V); H=f2(V,T); H=f3(P, T).
열역학적 과정에서 엔탈피 dH의 변화는 초기 H 1 및 최종 H 2 상태에 의해 결정되며 과정의 특성에 의존하지 않습니다. 시스템에 1kg의 물질이 포함되어 있으면 특정 엔탈피 J/kg이 사용됩니다.
이상 기체의 경우 미분 방정식은 다음과 같은 형식을 갖습니다.
따라서 특정 엔탈피는 다음 공식에 의해 결정됩니다.
열역학 제1법칙의 방정식은 dq=dU+Pdυ, 일의 유형이 팽창일 Pdυ=d(Pυ)-υdP일 때, dq=d(U+Pυ)-υdP일 때
실무№ 2
주제: 열용량, 엔탈피, 이상 기체의 혼합물, 내부 에너지, 일, 열역학적 과정.
작업 목적 : 이론 교육 중에 얻은 지식의 통합, 열 공학 계산 구현 기술 습득.
나.기본 정의, 공식 및 방정식
1. 이상기체의 혼합물
기체 혼합물은 서로 화학적으로 상호 작용하지 않는 여러 기체의 기계적 혼합물입니다. 혼합물의 각 가스를 가스 성분이라고 합니다. 혼합물에 다른 가스가 없는 것처럼 행동합니다. 혼합물 전체에 고르게 분포됩니다. 혼합물의 각 기체가 용기 벽에 가하는 압력을 부분압이라고 합니다. 이상 기체의 혼합물에 대한 기본 법칙은 Dalton의 법칙이며, 이에 따라 혼합물의 압력은 혼합물을 구성하는 기체의 분압의 합과 같습니다.
2. 내부 에너지
신체의 내부 에너지는 신체를 구성하는 미세 입자의 운동 운동 에너지와 그 위치 에너지의 조합입니다. 상호 작용이 정의되었습니다. 서로 끌어당기는 힘 또는 반발력. 내부 에너지의 절대값을 결정하는 것은 불가능하므로 열역학 계산에서 계산되는 내부 에너지의 절대값이 아니라 그 변화, 즉
![]() 또는
또는 ![]()
어디서? U 1 및 U 2 - 작동 유체(가스)의 초기 및 최종 상태의 내부 에너지;
u 1 및 2 - 비트. 작동 유체의 초기 및 최종 상태의 내부 에너지.
이로부터 내부 에너지의 변화는 과정의 성질과 경로에 의존하지 않고 변화 과정의 시작과 끝에서 작동 유체의 상태에 의해 결정된다는 것을 알 수 있습니다.
이상 기체의 특징은 그 안에 분자 상호 작용의 힘이 없기 때문에 내부 위치 에너지가 없다는 것입니다. U n \u003d 0 및 U „ \u003d 0. 따라서 이상 기체의 내부 에너지는 다음과 같습니다.
유=유케이=f(T) 유=유=f(T).
H. 가스 작업.
열역학에서 에너지 교환의 결과로 작동 유체 상태의 모든 변화 환경프로세스라고 합니다. 이 경우 작업 기관의 주요 매개 변수가 변경됩니다.
열을 기계적 작업으로 변환하는 것은 작동 유체의 상태를 변경하는 과정과 관련이 있습니다. 기체의 상태를 변화시키는 과정은 팽창과 수축 과정일 수 있다. 임의의 기체 질량 M(kg)에 대해 작업은 다음과 같습니다.
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
여기서 l \u003d p (v 2 -v 1) J / kg은 1kg의 가스 또는 특정 작업의 작업입니다.
4. 가스 엔탈피,
엔탈피는 작동 유체(가스)와 환경의 연결 위치 에너지를 특성화하는 매개변수입니다. 엔탈피 및 특정 엔탈피:
I \u003d U + pV, J 및 i i \u003d 및 + pv, J / kg.
5. 열용량.
비열용량은 주어진 온도 범위에서 1°C 가열하기 위해 1kg의 가스에 공급해야 하는 열량입니다.
비열 용량은 질량, 부피 및 킬로몰입니다. 질량 C, 부피 C 및 킬로몰 C 열용량 사이에는 연결이 있습니다.
 ;
; 
어디서 Vo 22.4 m 3 / kmol - 박동. 정상 조건에서 기체의 부피.
질량 ud. 가스 혼합물의 열용량:

체적 비열가스 혼합물:

기체 혼합물의 킬로몰 비열:

6. 열량 결정식
작동 유체(기체)가 방출하거나 흡수하는 열의 양은 다음 방정식으로 결정할 수 있습니다.
Q \u003d M C m (t 2 -t 1), J 또는 Q \u003d VC (t-t), J, 여기서 M과 V는 가스의 중량 또는 부피, kg 또는 m 3입니다.
t u t - 프로세스가 끝날 때와 시작될 때의 가스 온도 ° С;
C 및 C - 질량 및 부피 평균 비트. 가스의 열용량
t cp \u003d J / kgK 또는 J / m 3 K에서
7. 열역학 제1법칙
이 법칙은 열과 기계적 작업의 상호 변환을 고려합니다. 이 법칙에 따르면 열은 기계적 일로 변환되고 그 반대의 경우도 마찬가지입니다. 기계적 일은 엄밀히 동일한 양으로 열로 변환됩니다. 열과 일에 대한 등가 방정식의 형식은 다음과 같습니다.
열과 일의 등가 원리를 고려하여 임의의 가스 질량에 대한 열 균형 방정식:
Q \u003d U + L 및 q \u003d u + l \u003d u -u + l
문제 해결II
작업 #1(#1)
대기의 건조한 공기는 대략적인 질량 조성이 다음과 같습니다. g 02 =23.2%, g N 2 =76.8%.
공기가 P = 101325 Pa인 경우 기압계를 사용하여 공기의 부피 조성, 기체 상수, 겉보기 분자량, 산소와 질소의 부분압을 결정합니다.
나는 공기의 체적 구성을 결정합니다.
 ;
; ;
;
여기서 r은 질량 분율입니다.
m은 상대 분자량이고;
g는 부피 분율입니다.
엠 에어. =m O2 r O2 +m N2 r N2 = 32 0.209 + 28 0.7908=6.688+22.14=28.83;

 ;
;
여기서 R 0 은 기체 상수입니다.
다양한 가스의 분압을 결정합니다.
P O 2 \u003d P cm r O2 \u003d 101325 0.209 \u003d 21176.9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0.7908 \u003d 80127.81 (Pa);
어디서 PO 2 , P N 2 - 분압;
P cm는 혼합물의 압력입니다.
작업 #2(#2)
용기는 파티션에 의해 두 부분으로 나뉘며, 그 부피는 V 1 = 1.5 m 3 및 V 2 = 1.0 m 3 입니다. 부피 V 1 의 첫 번째 부분은 P 1 = 0.5 MPa 및 t 1 = 30°C에서 CO 2를 포함합니다. 부피 V 2 의 두 번째 부분은 P 2 =0.2 MPa 및 t 2 =57°C에서 O 2를 포함합니다. CO 2 와 O 2 의 질량 및 부피 분율, 혼합물의 겉보기 분자량 및 분배가 제거되고 혼합 과정이 완료된 후의 기체 상수를 결정하십시오.
개별 가스 상수를 결정합니다.
이를 위해 상대 분자량을 결정합니다. m (CO 2) \u003d 32 + 12 \u003d 44; m(O2)=32;

 ;
;
![]()
 ;
;
Klaiperon의 특성 방정식에 따라 기체의 질량을 결정합니다.
 (킬로그램);
(킬로그램);
 (킬로그램);
(킬로그램);
나는 질량 분율을 결정합니다.


부피 분율을 결정합니다.


공기의 겉보기 분자량을 결정하십시오.
엠 에어. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0.21 + 44 0.79 \u003d 6.72 + 34.74 \u003d 41.48;
공기(R)에 대한 개별 기체 상수를 결정합니다.

 ;
;
작업 #3(#6)
부피가 300 l 인 용기에는 압력 P 1 \u003d 0.2 MPa 및 t 1 \u003d 20 0 C에서 산소가 있습니다. 산소 온도가 t 2 \u003d 300 0 C로 상승하기 위해 얼마나 많은 열을 공급해야합니까? ? 용기에 어떤 압력이 설정됩니까? 계산을 위해 n.o.에서 산소의 평균 체적 비열을 취하십시오. C 02 \u003d 0.935 
Charles의 법칙에 따라 프로세스의 최종 압력을 결정합니다.
;  (아빠);
(아빠);
여기서 P, T는 가스 매개변수입니다.
나는 산소(R)에 대한 개별 기체 상수를 결정합니다.

 ;
;
공정은 등코릭이므로 적절한 공식에 따라 공급해야 하는 열의 양을 결정합니다. Q v \u003d M C cv (T 2 -T 1) 이에 대한 Claiperon 특성 방정식에 따라 질량을 결정합니다. 가스
 (킬로그램); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
(킬로그램); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
작업 #4(#7)
일정한 과압 P ex에서 2m 3 의 공기를 가열하기 위해 소비해야 하는 열량. \u003d 100 0 C의 온도에서 500 0 C의 온도까지 0.2 MPa. 이 경우 공기는 어떤 일을 할까요? 계산을 위해 다음을 취하십시오. 대기압 P at. \u003d 0.1 MPa, 공기의 평균 질량 등압 열용량 C pm \u003d 1.022  ; 공기 M 공기의 겉보기 분자량을 염두에 두고 기체 상수를 계산합니다. =29.
; 공기 M 공기의 겉보기 분자량을 염두에 두고 기체 상수를 계산합니다. =29.
공기에 대한 개별 기체 상수를 결정합니다.

 ;
;
절대 압력은 초과 및 대기 P=P est의 합과 같습니다. + P at. =0.1+0.2=0.3MPa
 (킬로그램);
(킬로그램);
프로세스가 등압이므로 해당 공식에 따라 Q와 L을 결정합니다.
Gay-Lussac 법칙에 따라 최종 볼륨을 결정합니다.
 m3;
m3;
Q \u003d M C pm (T 2 -T 1) \u003d 5.56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2.15 \u003d 645000 (J).
작업 #5(#8)
압력 P=0.5 MPa 및 온도 t 1 = 400 0 C에서 실린더에 공기가 있습니다. P=const에서 공기로부터 열이 제거되어 공정이 끝날 때 온도 t 2 =0 0 C는 다음과 같습니다. 공기 V 1 \u003d 400l가 들어있는 실린더의 부피.
제거된 열의 양, 최종 부피, 내부 에너지의 변화 및 압축의 완전한 작업을 결정하십시오 C pm =1.028  .
.
프로세스가 등압이므로 Gay-Lussac 법칙에 따라 최종 볼륨을 결정합니다.
 m3;
m3;
Klaiperon의 특성 방정식에 따라 기체의 질량을 결정합니다.
이전 문제에서 R=286.7 
 (킬로그램);
(킬로그램);
나는 방출되는 열의 양을 결정합니다.
Q=MCpm(T2-T1)=1.03 1028(273-673)=-423536(J);
내가 소비한 작업량을 결정합니다.
L=P(V2-V1)= 500,000(0.16-0.4)=-120,000(J);
총량이 결정되는 방정식에서 내부 에너지 양의 변화를 결정합니다.
![]() ; (제이)
; (제이)
문제 #6(#9)
압력 P 1 = 1.1 MPa 및 t 1 = 25 s에서 부피 V 1 = 0.02 m3인 공기는 피스톤이 가동되는 실린더에서 압력 P 2 = 0.11 MPa로 팽창합니다. 실린더에서 팽창이 발생하면 최종 부피 V 2, 최종 온도 t 2 , 공기가 한 일, 공급된 열을 구하십시오.
a) 등온
b) 단열 지수 k=1.4인 단열
c) 폴리트로픽 지수 n=1.3인 폴리트로픽
등온 과정:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0.02 1.1 / 0.11 \u003d 0.2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1.1 10 6 0.02Ln(0.2/0.02)=22000J
단열 과정:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0.02 / (0.11 / 1.1) 1 / 1.4 \u003d 0.1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0.11 / 1.1) 1.4-1 / 1.4 298 \u003d 20.32k
C v \u003d 727.4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1)=2.0275 10 6 J
폴리트로픽 프로세스:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0.02 / (0.11 / 1.1) 1 / 1.3 \u003d 0.118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0.11 / 1.1) 1.3-1 / 1.3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118) = 30000J
Q=(k-n/k-1) l M=((1.4-1.3)/(1.4-1)) 30000=7500J
문학:
1. 에너지, 모스크바, 1975.
2. 리트빈 A.M. "열 공학의 이론적 기초", 출판사 "에너지", 모스크바, 1969년.
3. Tugunov P.I., Samsonov A.A., "열 공학, 열 엔진 및 증기 발전 설비의 기초", Nedra 출판사, 모스크바, 1970년.
4. Krutov V.I., "열 공학", 출판사 "엔지니어링", 모스크바, 1986.
가스 혼합물. 가스의 열용량
가스 혼합물은 서로 화학적으로 상호 작용하지 않는 여러 가스의 기계적 혼합물로 이해됩니다. 이상 기체의 혼합물은 다음과 관련된 모든 법칙을 준수합니다. 이상 기체. 기체 혼합물의 조성은 혼합물에 포함된 각 기체의 양에 의해 결정되며 질량 또는 부피 분율로 지정할 수 있습니다.
여기서 는 -번째 성분의 질량, 는 -번째 성분의 부피, 및 는 각각 전체 혼합물의 질량 및 부피입니다.
그것은 분명하다
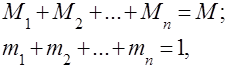
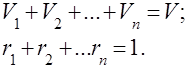
가스 혼합물의 실제 문제를 쉽게 해결할 수 있도록 혼합물의 개별 구성 요소의 실제 분자량의 평균 질량인 가스 혼합물의 겉보기 분자량 개념이 도입되었습니다.
기체 혼합물의 상태 방정식은 다음과 같은 형식을 갖습니다.
기체 혼합물은 보편적 기체 상수의 개념을 따릅니다.
기체 혼합물의 압력과 혼합물에 포함된 개별 성분의 분압 사이의 관계는 Dalton의 법칙에 의해 설정됩니다.
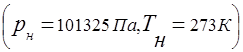
1 기체는 압력과 온도에 따라 질량이 다릅니다. 이와 관련하여 체적 열용량은 항상 정상 조건에서 1로 둘러싸인 기체의 질량을 나타냅니다. 이 경우 각종 기체 1kmole의 부피는 22.4/kmol이고 보편적 기체상수는 이다. 가스에 열을 공급하는 방법에 따라 등압 열용량과 등압 열용량이 있습니다. 이 양의 비율을 단열 지수라고 합니다.
열용량은 Mayer 관계와도 관련이 있습니다.
~의 온도 범위에서 1kg의 가스를 가열하는 과정에서 소비되어야 하는 열량은 다음 공식에 의해 결정됩니다.
여기서 및 는 각각 0°- 및 0°- 내의 평균 열용량입니다.
(kg) 또는 () 가스가 공정에 포함되는 경우
가스 혼합물의 열용량은 다음 공식에 의해 결정되어야 합니다.
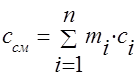
대량의 - ;
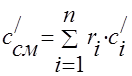
체적 -;
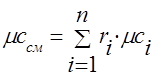
어금니 - .
연료 연소 생성물인 가스의 열을 보일러 유닛에서 사용하기 위해 연료 연소에 필요한 공기의 에어 히터가 후자의 가스 덕트에 설치됩니다(그림 1). 보일러를 떠나는 가스는 온도와 함께 공기 히터로 들어가 냉각되어 공기에 열을 발산합니다. 보일러 장치의 가스 덕트에서는 연기 배출기 작동의 영향으로 압력이 대기보다 약간 낮게 설정됩니다. 공기 히터의 공기는 온도에서 온도로 가열됩니다.
연도 가스
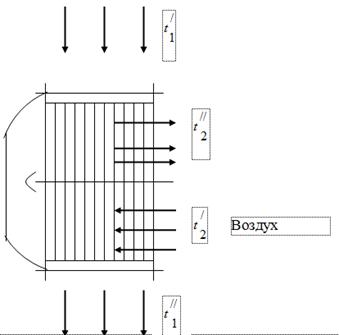
보일러 장치를 테스트할 때 다음 데이터를 얻었습니다.
에어 히터 입구의 가스 온도 = 450 °C.
에어 히터 출구의 가스 온도 = 150 ° C
에어 히터 입구의 공기 온도 = 26 ° C
에어 히터 출구의 공기 온도 = 260 ° C
연도 가스의 체적 구성 - = 11.5%; = 6.5%; = 17.2%; = 64.8%
시간당 가스 소비량은 50 ·/h입니다.
가스 덕트의 진공 - 15mm의 물. 미술.
기압 760mmHg. 미술.
정의하다:
연도 가스의 겉보기 분자량;
연도 가스 상수;
연도 가스를 구성하는 개별 구성 요소의 중량(질량) 분율;
구성 요소의 부분 압력:
시간당 공기 흐름.
기체가 발산하는 모든 열은 공기가 흡수한다고 가정합니다.
온도에 대한 열용량의 의존성은 곡선으로 간주됩니다.
1. 배가스의 겉보기 분자량
0.115 44 + 0.065 18 + 0.172 32 + 0.648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. 연도 가스 상수
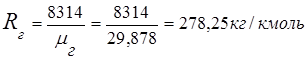
3. 질량 분율가스 성분
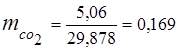
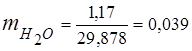
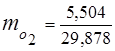
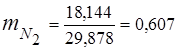
4. 부품의 부분압
계산 결과가 테이블에 입력됩니다.
|
옵션 |
가스 혼합물 |
|||
|
|
||||
|
|
||||
|
|
5. 시간당 공기 소비량
공기 소비량은 에어 히터의 열 균형 방정식에서 결정됩니다.
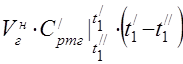
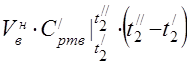
450 °C에서 평균 어금니 열용량
온도 범위 0 ... 450 ° C에서 구성 요소의 평균 비열 용량.













 .
(1.28)
.
(1.28)