Capacité calorifique du sulfure d'hydrogène à différentes températures. Capacité calorifique spécifique du gaz naturel
La capacité thermique non spécifique, mais totale, au sens physique généralement accepté, est la capacité d'une substance à se réchauffer. C'est du moins ce que nous dit n'importe quel manuel de physique thermique - c'est définition classique capacité thermique(formulation correcte). En fait, c'est une caractéristique physique intéressante. Peu connu de nous dans la vie de tous les jours "côté de la médaille". Il s'avère que lorsque la chaleur est fournie de l'extérieur (chauffage, échauffement), toutes les substances ne réagissent pas de la même manière à la chaleur ( l'énérgie thermique) et chauffe différemment. Capacité GAZ d'origine naturelle utilisé comme combustible recevoir, recevoir, retenir et accumuler (accumuler) de l'énergie thermique s'appelle la capacité calorifique du gaz combustible NATUREL. Et elle-même capacité calorifique du méthane, est une caractéristique physique décrivant les propriétés thermophysiques du combustible gazeux. En même temps, dans différents aspects appliqués, en fonction d'un cas pratique spécifique, une chose peut s'avérer importante pour nous. Par exemple : la capacité d'une substance à absorber chaleureux ou la capacité d'accumuler l'énérgie thermique ou "talent" pour le garder. Cependant, malgré quelques différences, au sens physique, les propriétés dont nous avons besoin seront décrites capacité calorifique du méthane.
Un petit, mais très "méchant hic" de nature fondamentale est que la capacité de chauffer - capacité thermique du méthane, est directement lié non seulement à composition chimique, la structure moléculaire d'une substance, mais aussi sa quantité (poids, masse, volume). En raison d'une telle connexion "désagréable", le général capacité calorifique du méthane devient une caractéristique physique trop gênante de la substance. Depuis, un paramètre mesuré décrit simultanément "deux choses différentes". A savoir : caractérise vraiment propriétés thermophysiques du GAZ NATUREL, cependant, "en passant" tient également compte de sa quantité. Formant une sorte de caractéristique intégrale, dans laquelle une physique thermique "élevée" et une quantité "banale" de matière (dans notre cas : le gaz combustible) sont automatiquement connectées.
Eh bien, pourquoi avons-nous besoin de telles caractéristiques thermophysiques, dans lesquelles une "psyché inadéquate" est clairement tracée? D'un point de vue physique, le total capacité calorifique du méthane(de la manière la plus maladroite), essaie non seulement de décrire la quantité d'énergie thermique qui peut s'accumuler dans le gaz combustible, mais aussi "nous informer au passage" de la quantité GAZ NATUREL COMBUSTIBLE. Il s'avère absurde, et non clair, compréhensible, stable, correct caractéristique thermophysique du méthane. Au lieu d'une constante utile adaptée à la pratique calculs thermophysiques, on nous donne un paramètre flottant, qui est la somme (intégrale) de la quantité de chaleur reçue GAZ NATUREL et sa masse ou son volume de méthane.
Merci, bien sûr, pour cet "enthousiasme", mais la quantité GAZ COMBUSTIBLE NATUREL Je peux me mesurer. Avoir reçu des résultats sous une forme "humaine" beaucoup plus pratique. Quantité GAZ NATUREL COMBUSTIBLE Je voudrais ne pas "extraire" par des méthodes mathématiques et des calculs utilisant une formule complexe du général capacité calorifique du méthane, à différentes températures, mais découvrez le poids (masse) en grammes (g, g), kilogrammes (kg), tonnes (tonnes), cubes (mètres cubes, mètres cubes, m3), litres (l) ou millilitres (ml ). Spécialement depuis personnes intelligentes depuis longtemps des instruments de mesure tout à fait adaptés à ces fins. Par exemple : balances ou autres appareils.
Notamment le "caractère flottant ennuyeux" du paramètre : général capacité calorifique du GAZ naturel. Son "humeur" instable et changeante. Lors du changement de "portion ou dose", capacité calorifique du GAZ NATUREL à différentes températures change immédiatement. Mélange de gaz plus combustible, grandeur physique, valeur absolue capacité calorifique du méthane- augmente. Moins de quantité de mélange de gaz combustible, valeur capacité thermique du méthane diminue. "Honte" certains s'avèrent! En d'autres termes, ce que nous « avons » ne peut en aucun cas être considéré comme une constante décrivant caractéristiques thermophysiques du GAZ NATUREL à différentes températures. Et il est souhaitable pour nous d'"avoir" un coefficient compréhensible et constant, un paramètre de référence qui caractérise propriétés thermiques gaz combustible, sans "références" à la quantité de méthane (poids, masse, volume). Ce qu'il faut faire?
C'est là qu'une méthode très simple mais "très scientifique" vient à notre rescousse. Il ne s'agit pas seulement d'huissier "ud. - spécifique", de face quantité physique, mais à une solution élégante impliquant l'exclusion de la quantité de matière de considération. Naturellement, paramètres « inconfortables, superflus » : masse ou volume GAZ NATUREL COMBUSTIBLE absolument impossible à exclure. Au moins pour la raison que s'il n'y a pas de quantité de méthane, alors il n'y aura pas de "sujet de discussion" lui-même. Et la substance devrait être. Par conséquent, nous choisissons une norme conditionnelle de masse ou de volume, qui peut être considérée comme une unité appropriée pour déterminer la valeur du coefficient "C" dont nous avons besoin. Pour poids du carburant GAZ NATUREL, une telle unité de masse de méthane, pratique à utiliser, s'est avérée être 1 kilogramme (kg).
Maintenant nous nous chauffons un kilogramme de GAZ NATUREL de 1 degré, et la quantité de chaleur (énergie thermique) nous avons besoin de chauffer mélange de gaz un degré - c'est notre paramètre physique correct, coefficient "C", eh bien, décrivant assez complètement et clairement l'un des propriétés thermophysiques du GAZ NATUREL à différentes températures. Veuillez noter qu'il s'agit maintenant d'une caractéristique décrivant propriété physique substance, mais sans essayer de "nous informer en plus" de sa quantité. Commodément? Il n'y a pas de mots. C'est une toute autre affaire. Soit dit en passant, maintenant nous ne parlons pas du général capacité thermique du méthane. Tout a changé. C'EST LA CHALEUR SPÉCIFIQUE DU GAZ NATUREL, qui est parfois appelé par un autre nom. Comment? Juste MASSIF CAPACITÉ CALORIFIQUE DU GAZ NATUREL COMBUSTIBLE. Spécifique (ud.) Et masse (m.) - dans ce cas : synonymes, ils désignent ici celui dont nous avons besoin coefficient "C".
Tableau 1. Coefficient : capacité calorifique spécifique du GAZ NATUREL (sp.). Capacité thermique massique du GAZ NATUREL combustible. Donnée de référence.
En termes simples, la capacité calorifique À PARTIR DE corps s'appelle la quantité de chaleur qui doit être dépensée dans ce processus chauffer le corps d'un degré : .
Habituellement, la capacité calorifique se réfère à une unité de quantité d'une substance et, selon l'unité choisie, on distingue:
capacité thermique massique spécifique Avec, rapporté à 1 kg de gaz, J/(kgK);
capacité calorifique volumétrique spécifique Avec´, rapportée à la quantité de gaz contenue dans 1 m 3 de volume dans des conditions physiques normales, J / (m 3 K) ;
capacité thermique molaire spécifique μ Avec, rapporté à un kilomole, J / (kmolK).
La relation entre les capacités calorifiques spécifiques est établie par les relations évidentes :
Avec= μ Avec/μ; Avec´= Avecρ n. (2.13)
Ici ρ n est la densité de gaz dans des conditions normales.
Le changement de température corporelle avec la même quantité de chaleur fournie dépend de la nature du processus en cours, donc la capacité calorifique est fonction du processus. Cela signifie que le même fluide de travail, selon le processus, nécessite une quantité de chaleur différente pour son chauffage de 1 K. Magnitude numérique Avec varie de + ∞ à – ∞.
Dans les calculs thermodynamiques grande importance avoir:
capacité calorifique à pression constante
Avec p = δ q p/ dT, (2.14)
q p , apporté au corps dans le processus à pression constante, à un changement de température corporelle dT;
capacité calorifique à volume constant
Avec v = δ q v /dT, (2.15)
égal au rapport de la quantité de chaleur δ q v, apporté au corps dans le processus à un volume constant, à un changement de température corporelle dT.
Conformément à la première loi de la thermodynamique pour les systèmes fermés δ q = du + pdv.
Tenant compte du fait que 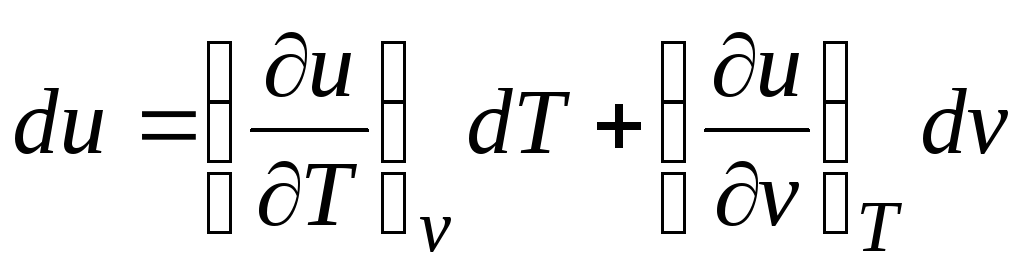 (relations (2.1))
(relations (2.1))
Δ q = (∂tu/∂J) v dT + [(∂tu/∂v) J + p]DV. (2.16)
Pour un processus isochore ( v=const) cette équation prend la forme 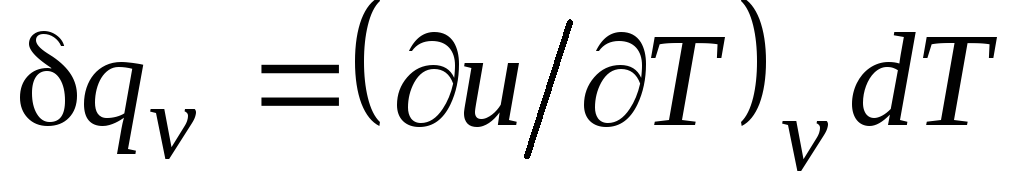 , et compte tenu de (2.15), on obtient que
, et compte tenu de (2.15), on obtient que
c v = (∂tu/∂J) v . (2.17)
Pour un gaz parfait
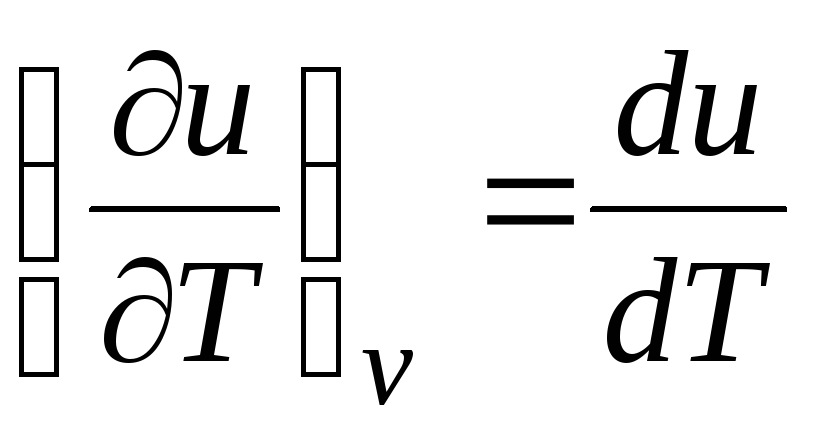 (équation 2.2), donc
(équation 2.2), donc
c v = du/dT. (2.18)
Pour un processus isobare ( R=const) à partir des équations (2.16) et (2.14) on obtient
c p = (∂ tu/∂J) v + [(∂tu/∂v) J + p](DV/dT) p
Puisque l'énergie interne gaz parfait est déterminé uniquement par sa température et ne dépend pas du volume spécifique, alors
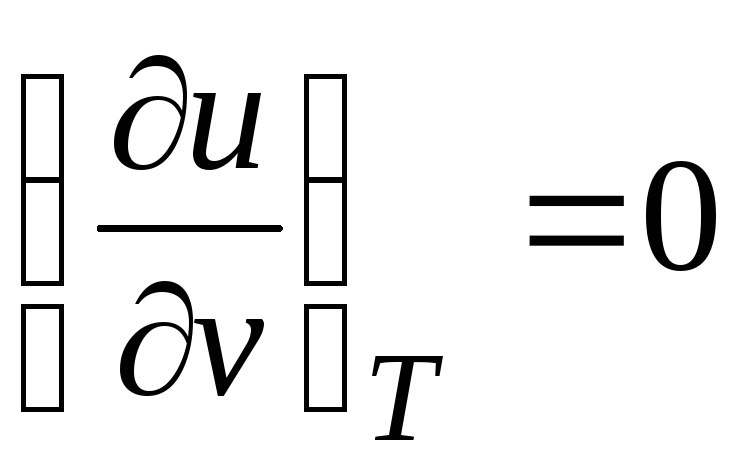 .
(2.19)
.
(2.19)
De l'équation de Clapeyron (1.4) PV
= RT(1.3) suit 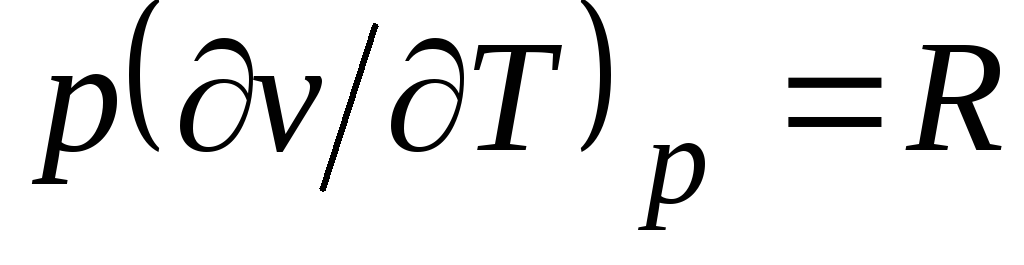 , où
, où
c p= Avec v + R. (2.20)
La relation (2.20) est appelée équation de Mayer et est l'une des principales en thermodynamique technique des gaz parfaits.
Durant v\u003d const, la chaleur transmise au gaz ne sert qu'à modifier son énergie interne, tandis que dans le processus p \u003d const, la chaleur est dépensée à la fois pour augmenter l'énergie interne et pour effectuer le travail d'expansion. ainsi c p plus Avec v par le montant de ces travaux.
Formule ![]() détermine la capacité thermique dite vraie, c'est-à-dire la valeur de la capacité thermique à une température donnée. En pratique, la capacité calorifique est largement utilisée pour calculer la quantité de chaleur q 12 , qui doit être dépensé pour chauffer le corps d'une température ( t 1) à un autre ( t 2) (ou qui sera libéré lors du refroidissement de t 2 à t 1).
détermine la capacité thermique dite vraie, c'est-à-dire la valeur de la capacité thermique à une température donnée. En pratique, la capacité calorifique est largement utilisée pour calculer la quantité de chaleur q 12 , qui doit être dépensé pour chauffer le corps d'une température ( t 1) à un autre ( t 2) (ou qui sera libéré lors du refroidissement de t 2 à t 1).
Si la capacité calorifique ne change pas dans la plage de température indiquée, alors
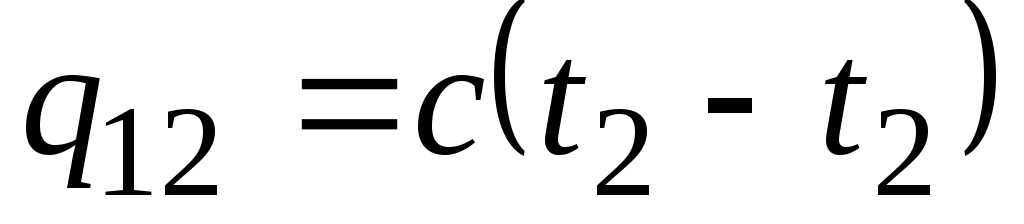 , kJ/kg et
, kJ/kg et 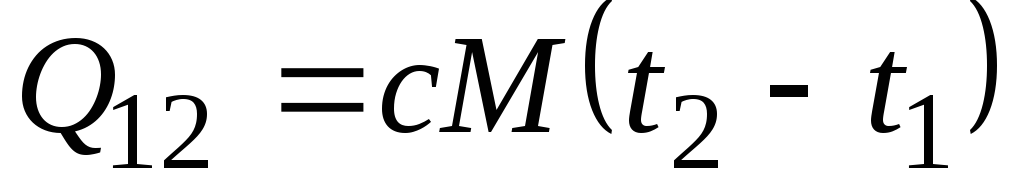 , kJ. (2.21)
, kJ. (2.21)
Cette formule peut également être utilisée pour des calculs approximatifs (pas très précis). Par exemple, la capacité calorifique spécifique de l'eau à température ambiante est de 4,187 kJ/(kgC) et celle de l'air de 1 kJ/(kgC). Étant donné que la capacité thermique de presque toutes les substances change (le plus souvent augmente) avec l'augmentation de la température, il est nécessaire, à proprement parler, d'utiliser la formule
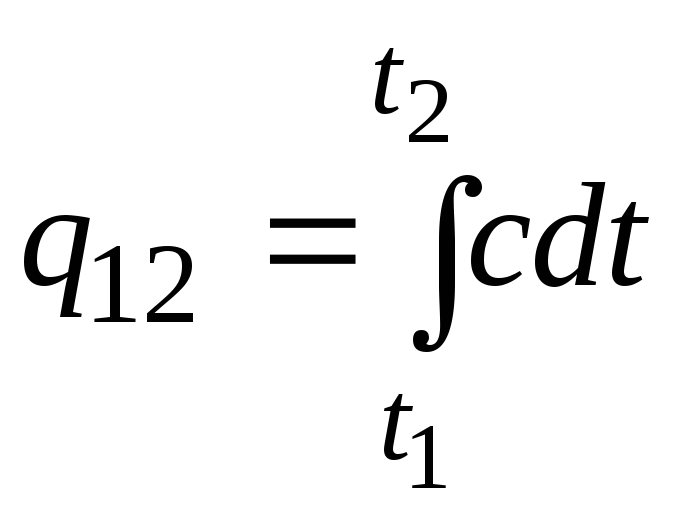 .
(2.21un)
.
(2.21un)
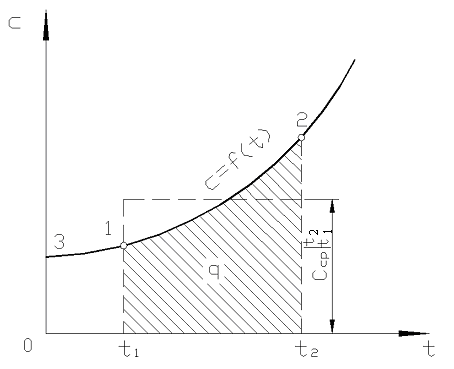
Sur la fig. 2,2 magnitude q 12 est représenté par une zone ombrée. Il semblerait que la manière la plus simple, en appliquant le théorème de la valeur moyenne, soit d'écrire
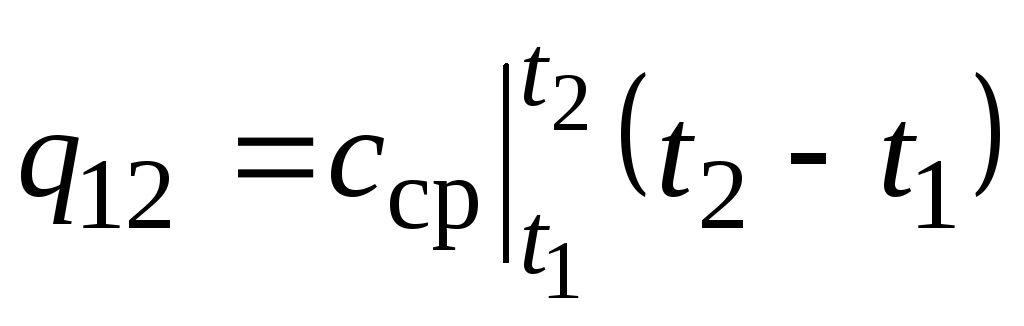 ,
(2.22)
,
(2.22)
où 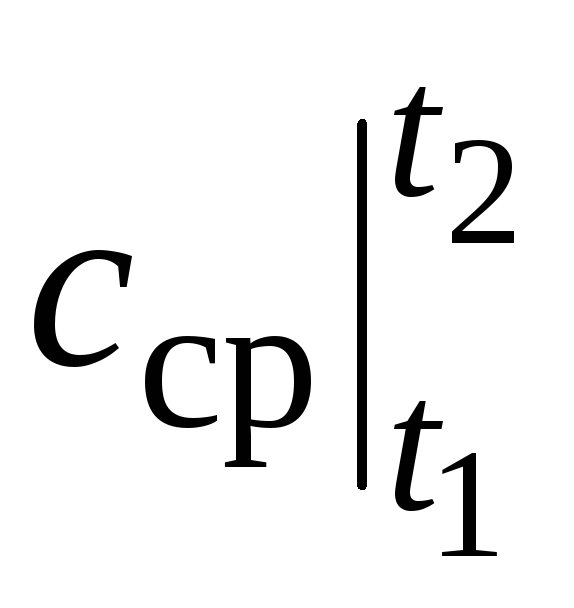 est la capacité calorifique moyenne dans la plage de température t 1 …t 2 .
est la capacité calorifique moyenne dans la plage de température t 1 …t 2 .
Riz. 2.2. Dépendance de la capacité calorifique réelle à la température
Cependant, pour de vrais calculs, une telle notation est très gênante, car la capacité thermique est choisie dans des tableaux, et 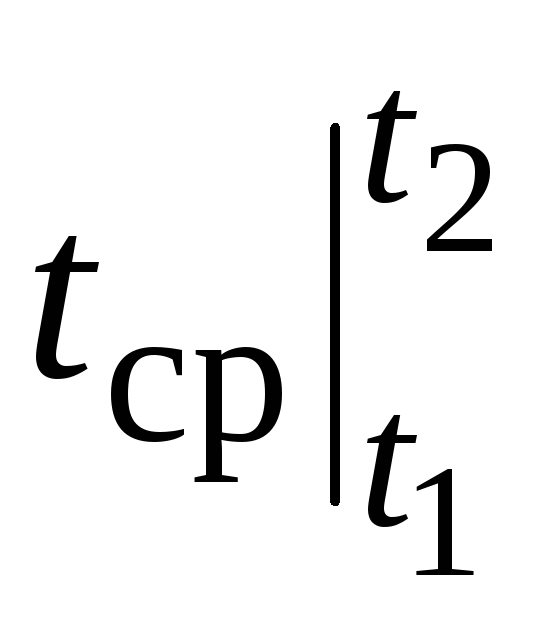 dépend comment t 1 et de t 2. Une table de fonctions à deux arguments serait très encombrante.
dépend comment t 1 et de t 2. Une table de fonctions à deux arguments serait très encombrante.
En pratique, procédez comme suit. La quantité de chaleur souhaitée est présentée comme la différence entre ses quantités nécessaires pour chauffer le corps de 0 С à des températures t 2 et t 1 respectivement (Fig. 2.2)
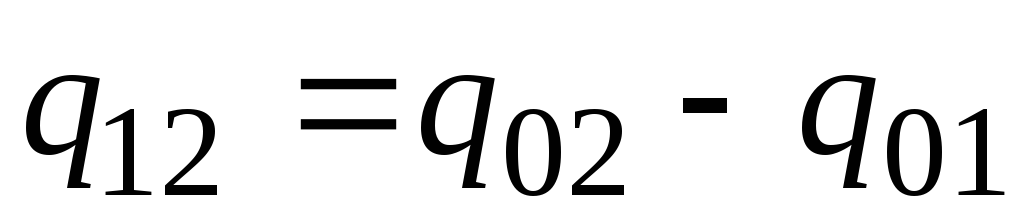 . (2.23)
. (2.23)
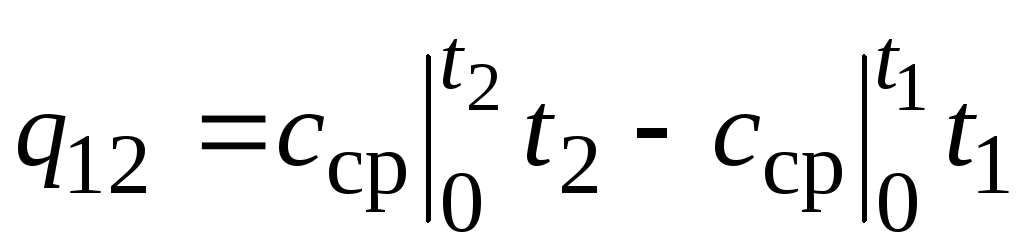 ,
(2.24)
,
(2.24)
où  - capacité calorifique moyenne dans la plage de température 0… tC.
- capacité calorifique moyenne dans la plage de température 0… tC.
La valeur de la capacité calorifique moyenne  pour une substance donnée (et un procédé donné, c'est-à-dire Avec R ou alors c v) ne dépend que d'une seule température t. Ce sont ces capacités calorifiques qui sont données dans tous les tableaux sous le nom de "moyenne". Ce qui a été dit est vrai pour Avec
(Avec R et c v), ainsi que pour Avec et Avec. À titre d'exemple, le tableau ci-dessous montre la capacité calorifique en fonction de la température pour certains des gaz les plus courants. Il convient de souligner que dans la formule (2.24), la température est remplacée en degrés Celsius.
pour une substance donnée (et un procédé donné, c'est-à-dire Avec R ou alors c v) ne dépend que d'une seule température t. Ce sont ces capacités calorifiques qui sont données dans tous les tableaux sous le nom de "moyenne". Ce qui a été dit est vrai pour Avec
(Avec R et c v), ainsi que pour Avec et Avec. À titre d'exemple, le tableau ci-dessous montre la capacité calorifique en fonction de la température pour certains des gaz les plus courants. Il convient de souligner que dans la formule (2.24), la température est remplacée en degrés Celsius.
La capacité calorifique molaire moyenne de divers gaz à R=const
(selon M.P. Vukalovich, V.A. Kirillin, V.N. Timofeev)
|
t, C |
Avec R, kJ/(kmolK) |
|||||||
|
N2 atmosphérique | ||||||||
Dans ce tableau, les valeurs Avec p sont donnés par 100 С. Comme elles évoluent peu avec la température, des valeurs intermédiaires peuvent être trouvées par extrapolation linéaire. Rappelez-vous comment cela est fait. Il existe des valeurs de fonction tabulaires y
= F(X) à 1 (quand X= X 1) et à 2 (quand X= X 2). Valeur de la fonction à(X) à X 1 <X<X 2 égaux 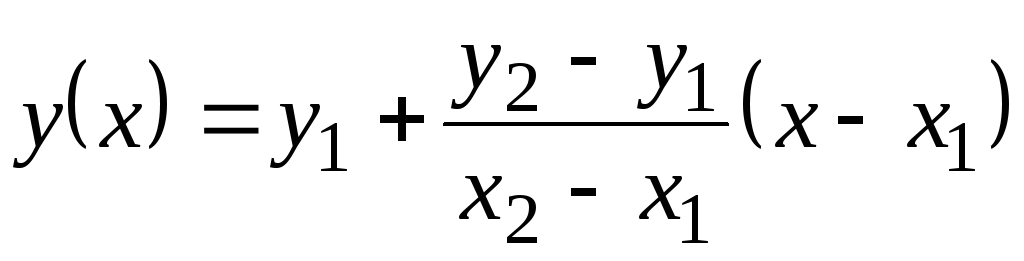 . Cette formule est vraie à la fois pour une fonction monotone croissante (lorsque à 2 >à 1) et pour la décroissance monotone ( à 2 <à 1); Dans ce cas, la fraction sera négative, puisque X 2 > X 1 toujours.
. Cette formule est vraie à la fois pour une fonction monotone croissante (lorsque à 2 >à 1) et pour la décroissance monotone ( à 2 <à 1); Dans ce cas, la fraction sera négative, puisque X 2 > X 1 toujours.
Le tableau montre les valeurs de conductivité thermique des gaz en fonction de la température et de la pression.
Les valeurs de conductivité thermique sont indiquées pour des températures comprises entre 20 K (-253 °C) et 1500 K (1227 °C) et une pression de 1 à 1000 atmosphères.
Tableau compte tenu de la conductivité thermique des gaz suivants: , , fréon-14 CF 4 , éthylène C 2 H 4 . L'unité de conductivité thermique est W/(m deg).
Il convient de noter que la conductivité thermique des gaz augmente avec l'augmentation de la température et de la pression. Par exemple, la conductivité thermique du gaz ammoniac à température ambiante et à pression atmosphérique normale est de 0,024 W / (m deg), et lorsqu'il est chauffé à 300 degrés, la conductivité thermique augmente jusqu'à une valeur de 0,067 W / (m deg). Si la pression de ce gaz est augmentée à 300 atmosphères, la valeur de conductivité thermique deviendra encore plus élevée et aura une valeur de 0,108 W / (m deg).
Remarque : Soyez prudent ! La conductivité thermique dans le tableau est indiquée avec un facteur de 10 3 . N'oubliez pas de diviser par 1000 !
Conductivité thermique des gaz inorganiques en fonction de la température
Le tableau donne les valeurs de la conductivité thermique des gaz inorganiques en fonction de la température à pression atmosphérique normale. Les valeurs de conductivité thermique des gaz sont indiquées à des températures de 80 à 1500 K (-193 ... 1227 ° C).
Le tableau montre la conductivité thermique des gaz suivants : protoxyde d'azote N 2 O, hexafluorure de soufre SF 6, monoxyde d'azote NO, sulfure d'hydrogène H 2 S, ammoniac NH 3, dioxyde de soufre SO 2, vapeur H 2 O, dioxyde de carbone CO 2 , vapeur d'eau lourde D 2 O, air.
Il convient de noter que la conductivité thermique des gaz inorganiques augmente avec l'augmentation de la température du gaz.
Remarque : La conductivité thermique des gaz dans le tableau est indiquée avec un facteur de 10 3 . N'oubliez pas de diviser par 1000 !
Conductivité thermique des gaz organiques en fonction de la température
Le tableau montre les valeurs de conductivité thermique des gaz organiques et des vapeurs de certains liquides en fonction de la température à la pression atmosphérique normale. Les valeurs de la conductivité thermique des gaz sont données dans le tableau dans la plage de température de 120 à 800 K.
La conductivité thermique des gaz et liquides organiques suivants est donnée : acétone CH 3 COCH 3, octane C 8 H 18, pentane C 5 H 12, butane C 4 H 10, hexane C 6 H 14, propylène C 3 H 6, heptane C 7 H 16, alcool amylique C 5 H 11 OH, xylène C 8 H 10, alcool isopropylique C 2 H 7 OH, méthane CH 4, alcool méthylique CH 3 OH, tétrachlorure de carbone CCl 4, cyclohexane C 6 H 12, éthane C 2 H 6, tétrafluorure de carbone CF 4, fréon-11 CFCl 3, chlorure d'éthyle C 2 H 5 Cl, fréon-12 CF 2 Cl 2, éthylène C 2 H 4, fréon-13 CF 3 Cl, formiate d'éthyle HCOOC 2 H 5, fréon-21 CHFCl 2, éther diéthylique (C 2 H 5 ) 2O.
Comme on peut le voir sur le tableau, la valeur de la conductivité thermique des gaz organiques augmente également avec l'augmentation de la température des gaz.
Fais attention! La conductivité thermique dans le tableau est indiquée avec un facteur de 10 3 . N'oubliez pas de diviser par 1000 ! Par exemple, la conductivité thermique de la vapeur d'acétone à une température de 400 K (127°C) est de 0,0204 W/(m deg).
