L'unité de mesure de la quantité de chaleur est la formule. Quantité de chaleur. Unités de chauffage. Chaleur spécifique

Quel processus est appelé conduction thermique ? Dans quels environnements est-ce possible ? Est-ce la même chose pour diverses substances? Quel processus s'appelle la convection ? Dans quels environnements est-ce possible ? Qu'est-ce qui détermine le taux de convection ? Quel processus est appelé rayonnement. Quelles caractéristiques de ce type de transfert de chaleur connaissez-vous ?

L'énergie que la chaleur reçoit ou perd pendant le transfert de chaleur s'appelle la quantité de chaleur. Symbole : Q Unités : joule (J) (kJ) calorie (cal) 1 cal=4,19 J 1 kcal= 4190 J 4,2 kJ La calorie est la quantité de chaleur nécessaire pour chauffer 1 g d'eau de 1°C .

Etape 1 de l'expérience 1. Versez de l'eau dans les flacons : le second est 2 fois plus que le premier. 2. Fixez les flacons dans les pieds des trépieds 3. Mesurez la température initiale du liquide dans chaque flacon. 4. Lampes à alcool légères. 5. Commencez simultanément à chauffer les flacons. 6. Mesurer la température dans chaque flacon après 2 minutes. 7. Faites une conclusion.
![]()
Une expérience pour déterminer la dépendance de la quantité de chaleur transférée à une substance sur la masse de cette substance. m 1 
Étape 2 de l'expérience 1. Versez une quantité égale d'eau dans 2 flacons. 2. Fixez les flacons dans les pieds des trépieds 3. Mesurez la température initiale du liquide dans chaque flacon. 4. Lampes à alcool légères. 5. Commencez simultanément à chauffer les flacons. 6. Sans retirer le thermomètre du liquide, arrêtez de chauffer lorsque la température dans le premier ballon augmente de 20°C, et dans le second de 25°C. 7. Mesurez le temps qu'il a fallu pour chaque processus. 8. Tirez des conclusions.

Une expérience pour déterminer la dépendance de la quantité de chaleur transférée à une substance sur un changement de sa température. m 1 = m t 1 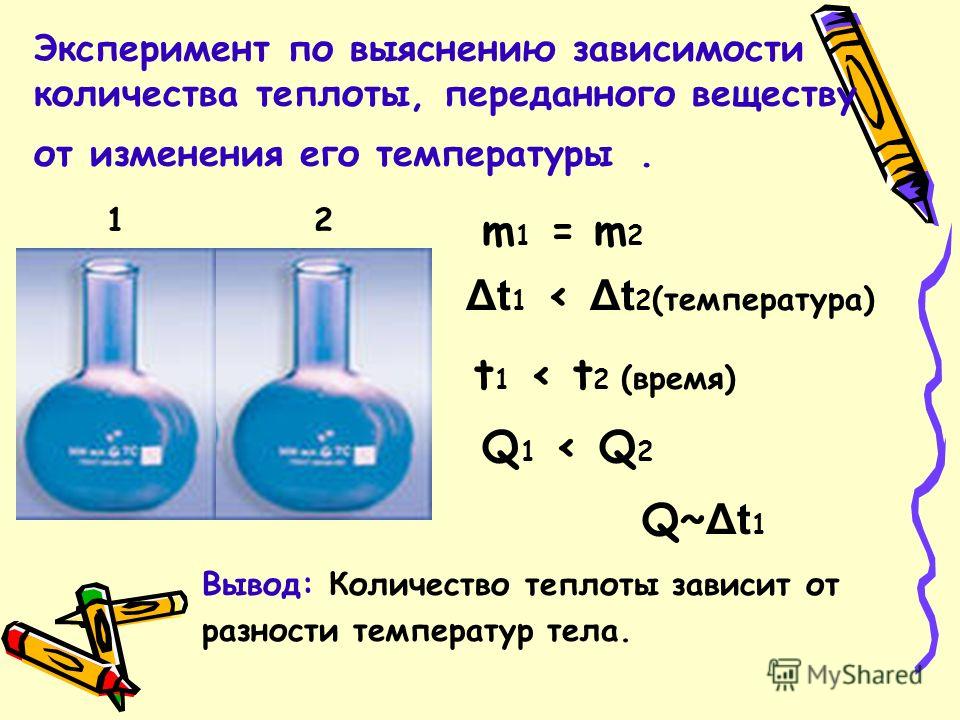
Étape 3 de l'expérience 1. Versez une quantité égale d'eau et d'huile dans 2 flacons. 2. Fixez les flacons dans les pieds des trépieds 3. Mesurez la température initiale du liquide dans chaque flacon. 4. Lampes à alcool légères. 5. Commencez simultanément à chauffer les flacons. 6. Mesurer la température dans chaque flacon après 2 minutes. 7. Faites une conclusion.

T 2 (temps) Δt 1 = Δt 2 (température) Q 1 > Q 2 transféré de son espèce m 1 = m 2 1 2 t 1 > t 2 (temps) Δt 1 = Δt 2 (température) Q 1 > Q 2 Conclusion : la quantité de chaleur nécessaire pour chauffer (refroidir) le corps dépend du type de substance" class="link_thumb"> 11 !} Une expérience pour déterminer la dépendance de la quantité de chaleur transférée sur son type. m 1 = m t 1 > t 2 (temps) Δt 1 = Δt 2 (température) Q 1 > Q 2 Conclusion : la quantité de chaleur nécessaire pour chauffer (refroidir) le corps dépend du type de substance. 1 2 Q ~ sur le type de substance t 2 (temps) Δt 1 = Δt 2 (température) Q 1 > Q 2 Conclusion : la quantité de chaleur nécessaire pour chauffer (refroidir) le corps dépend du type de substance "> t 2 (temps) Δt 1 = Δt 2 (température) Q 1 > Q 2 Conclusion : la quantité de chaleur nécessaire pour chauffer (refroidir) le corps dépend du type de substance. 1 2 Q ~ du type de substance "> t 2 (temps) Δt 1 = Δt 2 (température) Q 1 > Q 2 Conclusion : la quantité de chaleur nécessaire pour chauffer (refroidir) le corps dépend du type de substance" title="(!LANG : Une expérience pour déterminer la dépendance de la quantité de chaleur transférée sur son genre m 1 = m 2 1 2 t 1 > t 2 ( temps) Δt 1 = Δt 2 (température) Q 1 > Q 2 Conclusion : la quantité de chaleur nécessaire pour chauffer (refroidir) le corps dépend du type de substance"> title="Une expérience pour déterminer la dépendance de la quantité de chaleur transférée sur son type. m 1 \u003d m 2 1 2 t 1\u003e t 2 (temps) Δt 1 \u003d Δt 2 (température) Q 1 > Q 2 Conclusion: la quantité de chaleur nécessaire pour chauffer (refroidir) le corps dépend de la type de substance"> !}
Désigné : s unité de mesure : J/kg °C Quantité physique, numériquement égal à la quantité de chaleur qui doit être transférée à un corps de masse 1 kg pour que sa température change de 1 ° C, s'appelle chaleur spécifique substances. Chaleur spécifique substances.

La capacité calorifique spécifique de l'acier est égale à 500 J/kg °C. Cela signifie que pour chauffer (refroidir) l'acier m = 1 kg par 1ºС, il faut une quantité de chaleur égale à 500 J. La capacité thermique spécifique d'une substance dans différents états d'agrégation est différente. par exemple, pour l'eau c = 4200 J/kg °C ; pour la glace c = 2100 J/kg °C


Fixation Quelle est la quantité de chaleur ? Qu'est-ce qui est mesuré ? Qu'est-ce qui détermine la quantité de chaleur? Quelle est la capacité calorifique spécifique d'une substance? Quelle est l'unité de capacité thermique spécifique. La capacité calorifique spécifique du plomb est de 140 J/kg °C. Qu'est-ce que cela signifie?

Quelle est la capacité calorifique spécifique du zinc, de la brique, de l'eau ? Quelle quantité de chaleur doit être transmise à ces substances d'une masse de 1 kg pour se réchauffer de 1 ºС. Calculez la quantité de chaleur (en calories et en kilocalories). Nécessaire pour chauffer de l'eau de 1°C dont la masse est de 3 ; 4 kg.


