ظرفیت حرارتی با چه واحدهایی اندازه گیری می شود؟ ظرفیت حرارتی گازها انواع ظرفیت های حرارتی
ظرفیت گرمایی یک جسم مقدار گرمایی است که باید به یک جسم داده شود تا دمای آن یک درجه افزایش یابد. هنگامی که یک درجه خنک شود، بدن همان مقدار گرما را از خود ساطع می کند. ظرفیت گرمایی متناسب با جرم بدن است. ظرفیت گرمایی یک واحد جرم یک جسم را خاص و حاصل ضرب گرمای مخصوص جرم اتمی یا مولکولی را به ترتیب اتمی یا مولی می گویند.
ظرفیت های حرارتی مواد مختلفتفاوت زیادی با یکدیگر دارند بنابراین، گرمای ویژهآب در 20 درجه سانتیگراد 4200 J / کیلوگرم K، چوب کاج - 1700، هوا - 1010 است. برای فلزات، آن کمتر است: آلومینیوم - 880 J / کیلوگرم K، آهن - 460، مس - 385، سرب - 130. گرمای ویژه. با دما کمی افزایش مییابد (در دمای 90 درجه سانتیگراد، ظرفیت گرمایی آب 4220 ژول بر کیلوگرم کلوین است) و در طول تبدیلهای فازی بسیار تغییر میکند: ظرفیت گرمایی یخ در 0 درجه سانتیگراد 2 برابر کمتر از آب است. ظرفیت گرمایی بخار آب در 100 درجه سانتیگراد حدود 1500 ژول بر کیلوگرم کلوین است.
ظرفیت گرمایی بستگی به شرایطی دارد که در آن دمای بدن تغییر می کند. اگر ابعاد بدن تغییر نکند، تمام گرما به سمت تغییر انرژی درونی می رود. در اینجا ما در مورد ظرفیت گرمایی در حجم ثابت صحبت می کنیم. در فشار خارجی ثابت، به دلیل انبساط حرارتی، کار مکانیکی در برابر نیروهای خارجی انجام می شود و گرمایش تا دمای خاص به گرمای بیشتری نیاز دارد. بنابراین ظرفیت گرمایی در فشار ثابت همیشه بیشتر از . برای گازهای ایده آل(شکل را ببینید)، که در آن R ثابت گاز، برابر با 8.32 J / mol K است.
معمولا اندازه گیری می شود. روش کلاسیکاندازه گیری ظرفیت گرمایی به شرح زیر است: جسمی که قرار است ظرفیت گرمایی آن اندازه گیری شود، تا دمای معینی گرم می شود و در یک گرماسنجی با دمای اولیه 0 قرار می گیرد، پر از آب یا مایع دیگری با ظرفیت گرمایی شناخته شده و - ظرفیت گرمایی کالری سنج و مایع).
با اندازه گیری دما در کالری متر پس از برقراری تعادل حرارتی، ظرفیت گرمایی بدن را می توان با استفاده از فرمول محاسبه کرد:
![]()
جرمهای بدن، مایع و کالریسنج کجا و هستند.
توسعه یافته ترین نظریه ظرفیت گرمایی گازها است. در دماهای معمولی، گرمایش عمدتاً منجر به تغییر در انرژی حرکت انتقالی و چرخشی مولکولهای گاز میشود. برای ظرفیت حرارتی مولی گازهای تک اتمی، نظریه دو اتمی و چند اتمی - و . در دماهای بسیار پایین، ظرفیت گرمایی به دلیل اثرات کوانتومی تا حدودی کمتر است (شکل 2 را ببینید). مکانیک کوانتومی). در دمای بالاانرژی ارتعاشی اضافه می شود و ظرفیت گرمایی گازهای چند اتمی با افزایش دما افزایش می یابد.
ظرفیت گرمایی اتمی بلورها، طبق نظریه کلاسیک، برابر است با قانون تجربی Dulong و Petit (که در سال 1819 توسط دانشمندان فرانسوی P. Dulong و A. Petit ایجاد شد) مطابقت دارد. نظریه کوانتومظرفیت گرمایی در دماهای بالا به همین نتیجه منجر می شود، اما کاهش ظرفیت گرمایی را با کاهش دما پیش بینی می کند. نزدیک به صفر مطلق، ظرفیت گرمایی تمام اجسام به صفر میل می کند (قانون سوم ترمودینامیک).
ظرفیت گرمایی بدن- این هست کمیت فیزیکی، با نسبت مقدار گرمای جذب شده توسط بدن هنگام گرم شدن به تغییر دمای آن تعیین می شود:
معنی فیزیکی ظرفیت گرمایی یک جسم: ظرفیت گرمایی یک جسم برابر است با مقدار گرمایی که بدن هنگام گرم شدن جذب می کند یا وقتی که با 1K سرد می شود آزاد می شود.
از آنجایی که ظرفیت های حرارتی متغیر هستند، بین ظرفیت گرمایی متوسط و واقعی تمایز قائل می شوند. تحت ظرفیت گرمایی متوسط، نسبت مقدار گرما را درک کنید q خلاصه شده به واحد مقدار یک ماده (گاز)، به تغییر دمای آن از تی 1 قبل از تی 2 مشروط بر اینکه اختلاف دما تی 2 - تی 1 یک مقدار محدود است میانگین جرم، حجم و ظرفیت حرارتی مولی به ترتیب با نشان داده می شود ج متر ، ج متر ' و متر . از تعریف ظرفیت گرمایی متوسط چنین بر می آید که اگر دمای گاز از تی 1 قبل از تی 2 سپس میانگین ظرفیت گرمایی آن [کیلوژول / (کیلوگرم * K)]
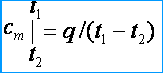
تحت ظرفیت گرمایی واقعی، ظرفیت گرمایی گاز را درک کنید، مربوط به یک تغییر بی نهایت کوچک در دمای گاز، مربوط به یک تغییر بی نهایت کوچک در دما. dt ، یعنی
c = dq/dt،
جایی که dq=cdt.
گرمای خاصتوانایی مواد مختلف برای جذب گرما هنگام گرم شدن است. ظرفیت گرمایی ویژه یک ماده با نسبت مقدار گرمای دریافتی توسط آن هنگام گرم شدن به جرم ماده و تغییر دمای آن تعیین می شود، اگر: ![]()
رابطه بیان کننده رابطه بین ظرفیت حرارتی مولی Cp و CV به شکل (فرمول مایر) است: Cp = CV + R. یا ظرفیت گرمایی افزایش یافته بیشتر گاز ایده آلاگر در اثر انتقال حرارت، مقدار معینی گرما به بدن منتقل شود، انرژی درونی بدن و دمای آن تغییر می کند. مقدار گرمای Q که برای گرم کردن 1 کیلوگرم یک ماده به میزان 1 K لازم است را گرمای مخصوص ماده c می گویند. c = Q / (mΔT). در بسیاری از موارد، استفاده از ظرفیت حرارتی مولی C: C = Mc راحت است، که در آن M جرم مولی ماده است. ظرفیت گرمایی تعیین شده به این ترتیب مشخصه واضح یک ماده نیست. طبق قانون اول ترمودینامیک، تغییر انرژی درونی یک جسم نه تنها به مقدار گرمای دریافتی، بلکه به کار انجام شده توسط بدن نیز بستگی دارد. بسته به شرایطی که فرآیند انتقال حرارت در آن انجام می شد، بدن می توانست کارهای مختلفی را انجام دهد. بنابراین همان مقدار گرمای منتقل شده به بدن می تواند تغییرات متفاوتی در انرژی درونی آن و در نتیجه دما ایجاد کند. چنین ابهامی در تعیین ظرفیت گرمایی فقط برای یک ماده گازی معمول است. هنگامی که اجسام مایع و جامد گرم می شوند، حجم آنها عملا تغییر نمی کند و کار انبساط برابر با صفر می شود. بنابراین، کل گرمای دریافتی بدن به سمت تغییر انرژی درونی آن می رود. برخلاف مایعات و مواد جامد، گاز در فرآیند انتقال حرارت می تواند حجم خود را تا حد زیادی تغییر دهد و کار کند. بنابراین، ظرفیت گرمایی یک ماده گازی به ماهیت فرآیند ترمودینامیکی بستگی دارد. معمولاً دو مقدار از ظرفیت حرارتی گازها در نظر گرفته می شود: CV ظرفیت گرمایی مولی در یک فرآیند ایزوکوریک (V = const) و Cp ظرفیت گرمایی مولی در یک فرآیند همسان (p = const) است. در فرآیند در یک حجم ثابت، گاز هیچ کاری انجام نمی دهد: A = 0. از قانون اول ترمودینامیک برای 1 مول گاز به دنبال QV = CVΔT = ΔU است. تغییر ΔU انرژی داخلی گاز با تغییر ΔT دمای گاز نسبت مستقیم دارد. برای فرآیندی در فشار ثابت، قانون اول ترمودینامیک به دست میدهد: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV، که در آن ΔV تغییر حجم 1 مول از یک گاز ایدهآل است که دمای آن با ΔT تغییر میکند. از این نتیجه می شود: نسبت ΔV / ΔT را می توان از معادله حالت یک گاز ایده آل که برای 1 مول نوشته شده است پیدا کرد: pV = RT، که در آن R ثابت گاز جهانی است. در p = const بنابراین، رابطه بیانکننده رابطه بین ظرفیتهای حرارتی مولی Cp و CV به شکل (فرمول مایر) است: Cp = CV + R.
ثابت گاز از نظر عددی برابر است با کار انبساط 1 مول از یک گاز ایده آل تحت فشار ثابت وقتی با 1 K گرم شود. R = pV/T = 1.01 K = 8.31 (44) Dzh/ (مول K)
ثابت گاز جهانی یک ثابت فیزیکی اساسی و جهانی R است که برابر با حاصلضرب ثابت بولتزمن k و ثابت آووگادرو است.
معنای فیزیکی: گاز ثابت i از نظر عددی برابر است با کار انبساط یک مول از گاز ایده آل در یک فرآیند همسان با افزایش دما به میزان 1 K.
در سیستم CGS، ثابت گاز به صورت زیر است:
ثابت گاز خاص:
توان آدیاباتیک(گاهی اوقات تماس می گیرد ضریبپواسون) - نسبت ظرفیت گرمایی در فشار ثابت () به ظرفیت گرمایی در حجم ثابت (). گاهی به آن نیز گفته می شود عامل همسانتروپیک پسوندها. با حرف یونانی (گاما) یا (کاپا) مشخص می شود. نماد حرف عمدتا در رشته های مهندسی شیمی استفاده می شود. در مهندسی حرارت از حرف لاتین استفاده می شود.
مخلوطی از گازها مجموعه ای از چندین گاز غیرمشابه است که در شرایط مورد بررسی وارد واکنش های شیمیایی با یکدیگر نمی شوند.
مخلوطی از گازها یک سیستم ترمودینامیکی همگن است (که در آن هیچ رابطی وجود ندارد که بخش های ماکروسکوپی سیستم را از یکدیگر جدا کند و در خواص و ترکیب آنها متفاوت باشد).
فشار جزئی P i گاز i ام در مخلوط فشاری است که اگر همه گازهای دیگر از مخلوط خارج شوند، این گاز تحت آن قرار می گیرد و V و T ثابت می مانند.
قانون دالتون - فشار مخلوطی از گازهایی که از نظر شیمیایی با یکدیگر برهمکنش ندارند برابر است با مجموع فشارهای جزئی این گازها.
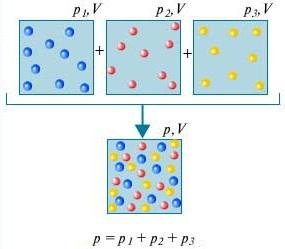
برای اینکه بفهمیم چیست قانون دالتونبرای این کار هوای اتاق را در نظر بگیرید. این مخلوطی از چندین گاز است: نیتروژن (80٪)، اکسیژن (20٪). فشار جزئی هر یک از این گازها فشاری است که گاز به تنهایی کل حجم را اشغال می کرد. به عنوان مثال، اگر همه گازها به جز نیتروژن از اتاق خارج شوند، فشار چیزی که باقی مانده است، فشار جزئی نیتروژن خواهد بود. قانون دالتونبیان می کند که فشار کل همه گازها با هم برابر است با مجموع فشارهای جزئی هر گاز به طور جداگانه. (به بیان دقیق، این قانون فقط برای گازهای ایده آل اعمال می شود، اما در یک تقریب به اندازه کافی خوب، گازهای واقعی را نیز توصیف می کند.)
قانون اول ترمودینامیک تعمیم قانون بقا و تبدیل انرژی برای یک سیستم ترمودینامیکی است. به صورت زیر فرموله شده است:
تغییر ΔU انرژی داخلی یک سیستم ترمودینامیکی غیر ایزوله برابر است با تفاوت بین مقدار گرماس به سیستم منتقل می شود و کار می کندآ ، یک سیستم کامل بر اجسام خارجی.
|
رابطه ای که قانون اول ترمودینامیک را بیان می کند اغلب به شکل دیگری نوشته می شود:
|
مقدار گرمای دریافتی سیستم برای تغییر انرژی داخلی آن و انجام کار بر روی اجسام خارجی استفاده می شود.
قانون اول ترمودینامیک تعمیم واقعیات تجربی است. بر اساس این قانون، انرژی نمی تواند ایجاد یا از بین برود. از یک سیستم به سیستم دیگر منتقل می شود و از شکلی به شکل دیگر تبدیل می شود. یکی از نتایج مهم قانون اول ترمودینامیک این ادعاست که ایجاد ماشینی که قادر به انجام کارهای مفید بدون مصرف انرژی از خارج و بدون هیچ تغییری در داخل خود ماشین باشد غیرممکن است. چنین ماشین فرضی نامیده می شود دستگاه حرکت دائمی (perpetuum mobile) از نوع اول . تلاش های متعدد برای ایجاد چنین ماشینی همیشه با شکست انجامید. هر ماشینی می تواند کار مثبتی انجام دهد آبر روی اجسام خارجی فقط با بدست آوردن مقدار معینی گرما ساز اجسام اطراف یا کاهش Δ Uانرژی درونی آن
اجازه دهید قانون اول ترمودینامیک را برای فرآیندهای همسان در گازها اعمال کنیم.
با انبساط ایزوباریک س> 0 - گرما توسط گاز جذب می شود و گاز کار مثبت انجام می دهد. با فشرده سازی ایزوباریک س < 0 – тепло отдается внешним телам. В этом случае آ < 0. Температура газа при изобарном сжатии уменьшается, تی 2 < تییک ؛ انرژی داخلی کاهش می یابد، Δ U < 0.
AT فرآیند همدمادمای گاز تغییر نمی کند، بنابراین، انرژی داخلی گاز، Δ U = 0.
AT فرآیند همحجم (V= const) گاز کار نمی کند، آ= 0. بنابراین،
قانون اول ترمودینامیک برای یک فرآیند ایزوباریک به دست می دهد:
|
قانون اول ترمودینامیک برای یک فرآیند همدما با رابطه بیان می شود
|
مقدار گرما س، که توسط گاز در فرآیند انبساط همدما به دست می آید، به کار روی اجسام خارجی تبدیل می شود. تحت فشار همدما، کار نیروهای خارجی تولید شده روی گاز به گرما تبدیل می شود که به اجسام اطراف منتقل می شود.
همراه با فرآیندهای ایزوکوریک، ایزوباریک و همدما، ترمودینامیک اغلب فرآیندهایی را در نظر می گیرد که در غیاب تبادل حرارت با اجسام اطراف رخ می دهند. ظروف با دیواره های عایق نامیده می شوند پوسته های آدیاباتیک، و فرآیندهای انبساط یا فشرده سازی گاز در چنین مخازنی نامیده می شود آدیاباتیک.
AT فرآیند آدیاباتیکس= 0; بنابراین قانون اول ترمودینامیک شکل می گیرد
|
|
|
قانون اول ترمودینامیک در معنای فیزیکی آن قانون بقای (تغییر) انرژی در ترمودینامیک است. اگر طبق قانون تغییر انرژی در مکانیک، کار نیروهای غیرمحافظه برابر با افزایش انرژی مکانیکی سیستم باشد (به ویژه، کار نیروهای اصطکاک دارای علامت منفی برابر است با کاهش انرژی مکانیکی سیستم)، سپس طبق قانون اول ترمودینامیک، افزایش انرژی درونی سیستم ترمودینامیکی برابر است با مجموع کار نیروهای خارجی که بر روی سیستم کامل می شود و انرژی به سیستم منتقل می شود. سیستم با انتقال حرارت آنتالپی(از یونانی. آنتالپو- گرم کردن) است خاصیت ماده، میزان انرژی قابل تبدیل به گرما را نشان می دهد. آنتالپیخاصیت ترمودینامیکی یک ماده است که سطح انرژی ذخیره شده در ساختار مولکولی آن را نشان می دهد. این بدان معناست که در حالی که ماده می تواند بر اساس دما و فشار انرژی داشته باشد، اما نمی توان همه آن را به گرما تبدیل کرد. بخشی از انرژی درونی همیشه در ماده باقی می ماند و ساختار مولکولی آن را حفظ می کند. زمانی که دمای یک ماده به دمای محیط نزدیک شود، بخشی از انرژی جنبشی یک ماده در دسترس نیست. در نتیجه، آنتالپیمقدار انرژی است که برای تبدیل به گرما در دما و فشار معین در دسترس است. واحدهای آنتالپی BTU یا ژول برای انرژی و Btu/lbm یا J/kg برای انرژی ویژه هستند. 11 سوال |

هدف، واقعگرایانه:تعیین تجربی ظرفیت حرارتی مواد.
تجهیزات:ترازو، وزن، کالری سنج، استوانه فلزی با ظرفیت گرمایی مشخص، لیوان، بخاری، قلاب.
نظریه مختصر:
تمام اجسام و سیستم های ماکروسکوپیک اجسام، علاوه بر انرژی مکانیکی به دلیل حرکت و تعامل، دارای انرژی هستند که به حالت درونی آنها بستگی دارد. این انرژی که انرژی حرکت و تعامل بین تمام ذرات تشکیل دهنده بدن است، درونی نامیده می شود.
انرژی داخلی شامل انرژی جنبشی حرکت حرارتی مولکول ها و اتم هایی است که یک جسم معین را می سازند، انرژی جنبشی الکترون هایی که در اتم ها در اطراف هسته حرکت می کنند، انرژی پتانسیل برهمکنش بین مولکول ها، اتم ها، الکترون ها و هسته ها، نوکلئون ها در هسته. ، و غیره. مفهوم انرژی درونی شامل انرژی جنبشی و پتانسیل یک جسم معین به عنوان یک کل نمی شود.
انرژی داخلی به طور منحصر به فردی توسط مجموعه پارامترهایی که وضعیت سیستم داده شده را مشخص می کند، تعیین می شود. یک تابع تک ارزشی از وضعیت این سیستم است.
انرژی داخلی معمولا با حرف U نشان داده می شود.
در پدیدههای حرارتی که در دماهای دور از دمای انتقال فاز رخ میدهند، تغییر در انرژی داخلی DU با تغییر در انرژی جنبشی و پتانسیل مولکولها همراه است، در حالی که اجزای باقیمانده انرژی داخلی تغییر نمیکنند. بنابراین، در چنین فرآیندهایی میتوان فرض کرد که انرژی درونی یک جسم برابر است با مجموع انرژیهای جنبشی حرکت حرارتی آشفته همه مولکولها نسبت به مرکز جرم این جسم و انرژیهای بالقوه برهمکنش همه مولکولها. مولکول ها با یکدیگر
هنگامی که وضعیت بدن تغییر می کند، انرژی درونی آن تغییر می کند. به عنوان مثال، هنگامی که دمای جسم افزایش می یابد، انرژی درونی آن افزایش می یابد، زیرا میانگین انرژی جنبشی حرکت مولکول های این جسم افزایش می یابد. با کاهش دما، انرژی درونی بدن کاهش می یابد.
انرژی درونی اجسام می تواند تغییر کند روش های مختلف. به عنوان مثال، انرژی درونی زمانی که کار مکانیکی توسط نیروهای خارجی بر روی جسم معینی در طول تغییر شکل آن انجام میشود، و همچنین بدون انجام کار، زمانی که جسم با جسم دیگری (یا محیطی) در تماس است که دمای آن بالاتر یا پایینتر از آن است، تغییر میکند. بدن داده شده
فرآیند تغییر انرژی درونی بدن بدون انجام کار مکانیکی را انتقال حرارت یا انتقال حرارت می نامند. سه نوع انتقال حرارت وجود دارد: همرفت، هدایت و تابش.
در هنگام تبادل حرارت، انرژی از یک نوع به نوع دیگر تبدیل نمی شود. فرآیند انتقال گرما شامل این واقعیت است که بخشی از انرژی داخلی یک جسم داغتر به جسم کمتر داغ (یا متوسط) منتقل می شود.
برای توصیف فرآیندهای انتقال حرارت، مفهوم مقدار گرما معرفی شده است که به آن کمیتی می گویند که معیار کمی از تغییر انرژی داخلی بدن در فرآیند انتقال حرارت است.
باید به خاطر داشت که یک جسم فقط می تواند انرژی بدهد یا دریافت کند و مقدار گرمای Q فقط معادل عددی انرژی است که بدن در فرآیند انتقال حرارت داده یا دریافت می کند.
مقدار گرما بستگی به نوع فرآیند دارد و تابعی از وضعیت سیستم نیست.
مقدار گرمای مورد نیاز برای گرم کردن بدن که بدون تغییر فاز (بدون تغییر حالت تجمع ماده) اتفاق میافتد:
که در آن c ظرفیت گرمایی ویژه بدن است که با نسبت مقدار گرمای منتقل شده به جرم m بدن و تغییر دمای حاصله در DT تعیین می شود، m جرم بدن است، DT تفاوت بین نهایی است. و دمای اولیه جسم داده شده
مقدار گرمایی که باید به بدن منتقل شود تا دمای آن یک کلوین افزایش یابد، ظرفیت گرمایی این ماده نامیده می شود. وقتی با یک کلوین خنک شود، بدن همان مقدار گرما را از خود ساطع می کند. ظرفیت گرمایی یک جسم متناسب با جرم بدن است و به ماده ای که از آن تشکیل شده است بستگی دارد. در سیستم واحدهای SI، ظرفیت گرمایی با J/K اندازه گیری می شود.
برای مشخص کردن خواص حرارتی یک ماده، ظرفیت گرمایی یک واحد جرم این ماده گرفته می شود. این ویژگی ظرفیت گرمایی ویژه نامیده می شود. برابر است با نسبت ظرفیت گرمایی یک جسم معین به جرم آن. ظرفیت گرمایی ویژه با سیستم SI بر حسب J / (kg × K) اندازه گیری می شود.
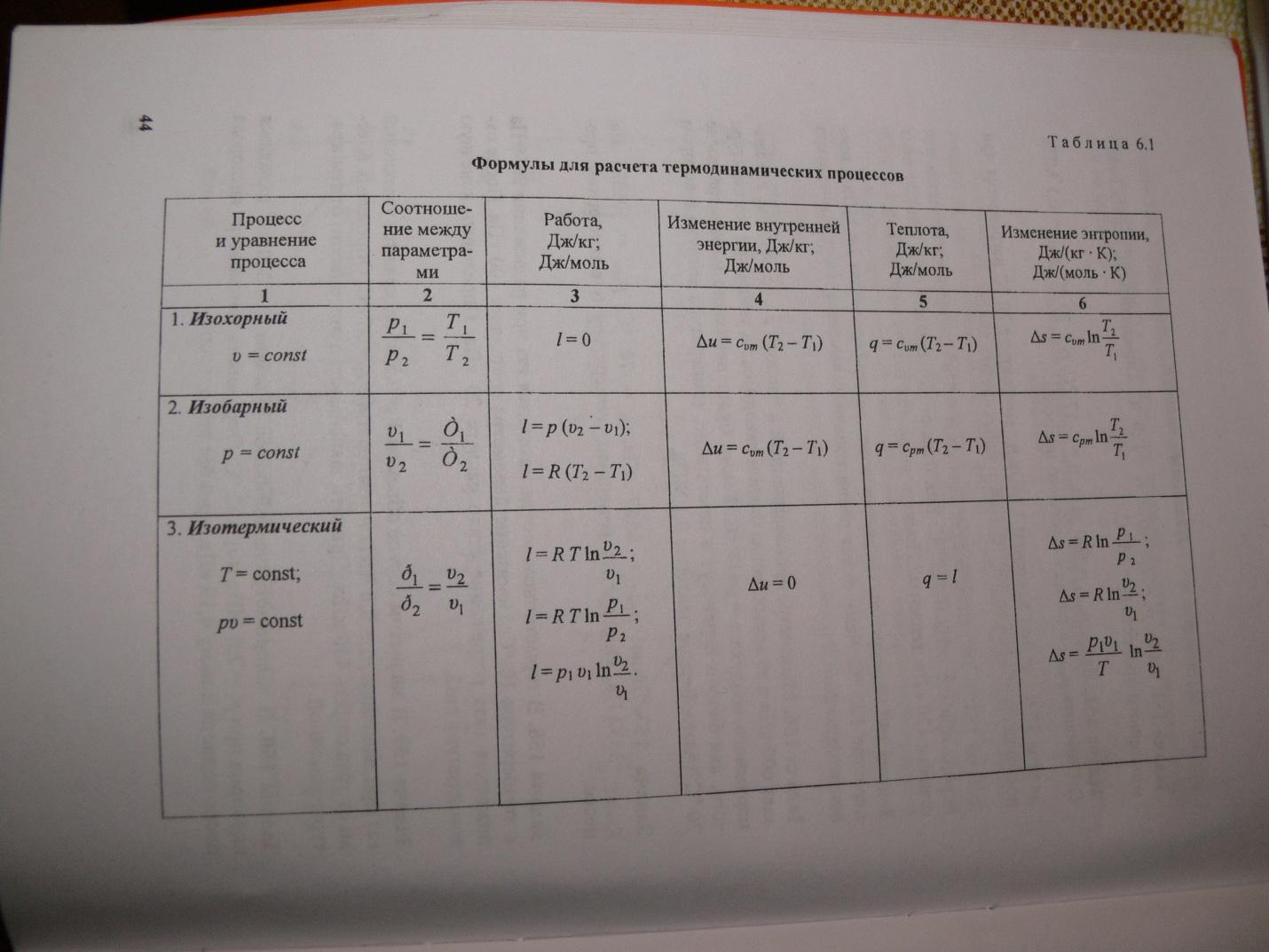
به طور تجربی، گرمای ویژه یک جسم فلزی با استفاده از گرماسنج و دماسنج تعیین می شود. سادهترین کالریسنج شامل یک شیشهی فلزی صیقلی است که در داخل شیشهای دیگر روی درپوشها (به منظور عایقکاری حرارتی) قرار میگیرد. لیوان داخلی با آب یا مایع دیگری با ظرفیت گرمایی مشخص پر شده است. جسمی که تا دمای معین t گرم می شود به یک کالریمتر پایین می آید. بگذارید دمای مایع در کالریسنج قبل از پایین آمدن جسم t 1 باشد و پس از برقراری تعادل حرارتی مایع و جسم پایینآمده در آن، دمای کل آنها برابر q میشود.
از قانون بقای انرژی چنین می شود که:
Q \u003d Q 1 + Q 2،(2)
مقدار گرما کجاست س، که توسط یک جسم گرم داده می شود، برابر است با مجموع مقدار گرما Q1،به دست آمده از آب، و Q2،دریافت شده توسط کالریمتر
با در نظر گرفتن (1)، (2) را به صورت زیر بازنویسی می کنیم:
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
جایی که ج 1و متر 1- ظرفیت گرمایی ویژه و جرم آب در کالری متر، ج 2و متر مربع- ظرفیت گرمایی ویژه و جرم کالری سنج. این معادله معادله تعادل حرارتی نامیده می شود. از آن ظرفیت گرمایی ویژه بدن را می یابیم:
می توان به روش دیگری به حل این مشکل نزدیک شد، فرض کنید تلفات انرژی در چارچوب یک آزمایش یکسان باشد. بدن باظرفیت گرمایی خاص شناخته شده، تا دمای معینی گرم می شود تی، به یک کالری متر کاهش می یابد که دمای آن تغییر می کند. سپس معادله تعادل حرارتی به شکل زیر در می آید:
cm(t-q) = c 1 m 1 (q-t 1) + Q افت،(5)
جایی که از دست دادن Qمقدار گرمای دریافتی توسط کالری سنج و محیط، در نتیجه:
از دست دادن Q، = cm(t-q) - c 1 m 1 (q-t 1). (6)
اگر جسمی با ظرفیت گرمایی ویژه ناشناخته که تا همان دما گرم شود، به یک کالریمتر کاهش یابد، معادله تعادل حرارتی به شکل زیر در میآید:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + تلفات Q،(7)
جایی که m¢ 1جرم آب در کالریمتر است و t¢ 1- دمای آب در این آزمایش. سپس:
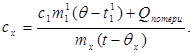 (8)
(8)
با جایگزینی مقدار (6) به (8) دریافت می کنیم:
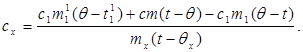 (9)
(9)
مقدار اولیه گرما کجاست - تغییر اولیه دما
ظرفیت حرارتی از نظر عددی برابر با مقدار گرمایی است که باید به سیستم داده شود تا در شرایط داده شده دمای آن 1 درجه افزایش یابد. از آنجایی که واحد گرما در SI ژول و دما درجه K است، واحد ظرفیت گرمایی J/K است.
بسته به واحد کمی بدن که گرما در ترمودینامیک به آن عرضه می شود، جرم، حجم و ظرفیت گرمای مولی متمایز می شود.
ظرفیت گرمای انبوهظرفیت گرمایی در واحد جرم سیال کار است،
حجم و چگالی بدن در شرایط عادی فیزیکی کجا و هستند.
ظرفیت گرمایی حجمی بر حسب J/(m3 K) اندازه گیری می شود.
ظرفیت گرمایی مولی- ظرفیت گرمایی که به مقدار سیال عامل (گاز) در مول اشاره دارد.
| , |
که در آن m3/mol حجم مولی گاز در شرایط عادی است.
با توجه به اینکه ظرفیت حرارتی ثابت نیست، بلکه به دما و سایر پارامترهای حرارتی بستگی دارد، بین ظرفیت گرمایی واقعی و متوسط تمایز قائل میشویم. معمولاً ظرفیت گرمایی واقعی به عنوان نسبت مقدار اولیه گرمایی که به یک سیستم ترمودینامیکی در هر فرآیندی گزارش می شود به افزایش بی نهایت کوچک در دمای این سیستم ناشی از گرمای ارسالی درک می شود. ما ظرفیت گرمایی واقعی سیستم ترمودینامیکی را در دمای سیستم برابر و - درست در نظر خواهیم گرفت ظرفیت گرمایی ویژهسیال کار در دمای آن برابر است. سپس میانگین ظرفیت گرمایی ویژه سیال عامل هنگامی که دمای آن از به تغییر می کند را می توان تعیین کرد
تعیین انرژی درونی بدن
انرژی درونیبدن (به عنوان Eیا U) مجموع انرژی های برهمکنش های مولکولی و حرکات حرارتی یک مولکول است. به طور خاص، انرژی داخلی یک گاز ایده آل برابر است با مجموع انرژی جنبشی همه ذرات گاز در حرکت حرارتی پیوسته و تصادفی. از این قانون ژول پیروی می کند که توسط آزمایش های متعدد تأیید شده است.
نظریه جنبشی مولکولی منجر به بیان زیر برای انرژی داخلی یک مول از گاز یک اتمی ایده آل (هلیوم، نئون و غیره) می شود که مولکول های آن فقط حرکت انتقالی را انجام می دهند:
به این ترتیب، انرژی درونی Uبدن به طور منحصر به فردی توسط پارامترهای ماکروسکوپی مشخص کننده وضعیت بدن تعیین می شود. این بستگی به چگونگی تحقق وضعیت داده شده ندارد. مرسوم است که می گویند انرژی داخلی یک تابع حالت است.
در TD از تغییر انرژی درونی استفاده می شود و نه قدر مطلق آن.
کار توسعه چیست. قانون اول TD.
کار انبساط - کار مکانیکی انجام شده توسط وسیله نقلیه در برابر نیروهای فشار خارجی در فرآیند انبساط آن. وقتی حجم تغییر می کند، گاز کار می کند، علامت تغییر در V با علامت کار منطبق است
قانون اول TD: گرمای وارد شده به سیستم برای تبدیل انرژی داخلی و انجام کار استفاده می شود.
از نقطه نظر توانایی آن در دریافت (یا دادن) انرژی به شکل گرما، مرسوم است که یک سیستم ترمودینامیکی را با ظرفیت گرمایی آن مشخص کنیم.
ظرفیت گرمایی یک جسم (سیستم) یک کمیت فیزیکی است که از نظر عددی برابر با مقدار گرمایی است که باید به بدن (سیستم) داده شود تا دمای آن یک کلوین تغییر کند.
اگر به بدن بی نهایت گرما داده شود س، که باعث افزایش بی نهایت کم دما شد دتی،سپس ظرفیت گرمایی آن از جانبطبق تعریف برابر است با
واحد SI ظرفیت حرارتی ژول تقسیم بر کلوین ( جی/به).
آزمایش ها و محاسبات نظری نشان می دهد که ظرفیت گرمایی یک جسم به ترکیب شیمیایی، جرم و حالت ترمودینامیکی آن بستگی دارد(به عنوان مثال، در مورد دما)، و همچنین در مورد نوع فرآیند تغییر وضعیت بدن هنگام انتقال گرما به آن.
ظرفیت گرمایی ویژه ظرفیت گرمایی در واحد جرم یک ماده است.یعنی برای یک ماده همگن
![]() , (25.2)
, (25.2)
جایی که با- ظرفیت گرمایی ویژه، مجرم ماده است.
واحد SI گرمای ویژه ژول تقسیم بر کلوین کیلوگرم [( جی/(به . کیلوگرم)].
ظرفیت گرمایی مولی ظرفیت گرمایی یک مول از یک ماده است،به این معنا که
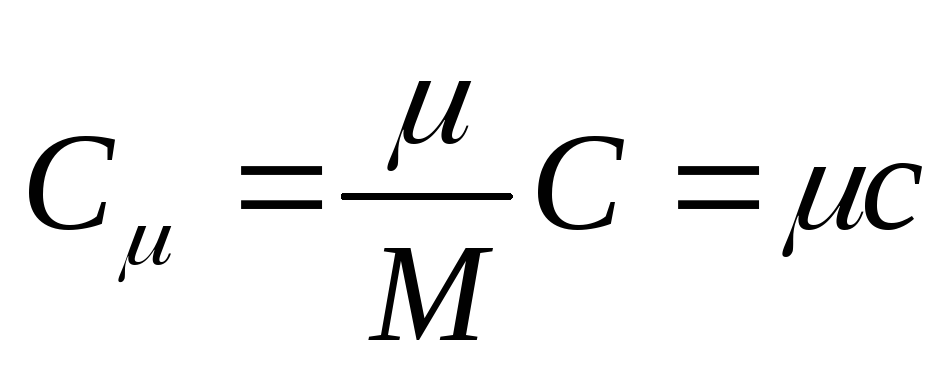 , (25.3)
, (25.3)
جایی که از جانب - ظرفیت حرارتی مولی؛ جرم مولی ماده است.
واحد ظرفیت گرمایی مولی در SI ژول تقسیم بر کلوین-مول [ جی/(به . خال)].
مقدار اولیه گرما س, برای تغییر دمای بدن لازم است دتی، به عنوان ... تعریف شده است
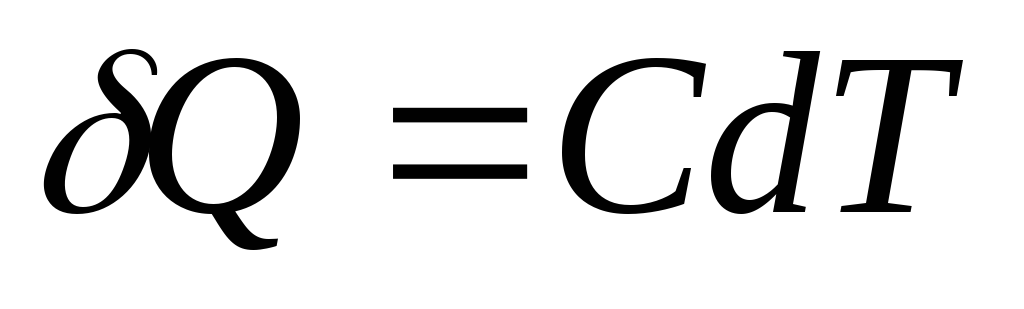 ,
,
و برای یک بدن همگن
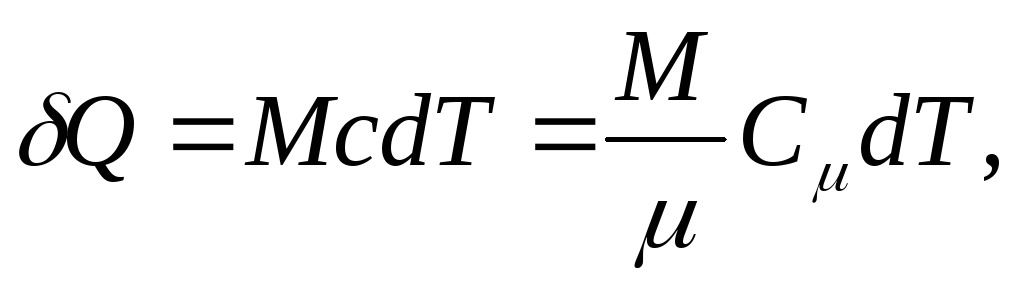 (25.4)
(25.4)
جایی که م/ - مقدار ماده (تعداد خال).
§26. قانون اول ترمودینامیک
قانون اول (قانون اول) ترمودینامیک بیانی ریاضی از قانون بقا و تبدیل انرژی است که در سیستم های ترمودینامیکی اعمال می شود. در نتیجه تحقیقات تجربی و نظری در زمینه فیزیک و شیمی تأسیس شد که مرحله نهایی آن کشف هم ارزی گرما و کار بود، یعنی کشف تبدیل گرما به کار و کار به گرما همیشه در همان نسبت کمی ثابت انجام می شود.
در §24 اشاره شد که انرژی داخلی یک سیستم را می توان به دو طریق تغییر داد: با انجام کار و با انتقال گرما. بنابراین، می توانیم بنویسیم:
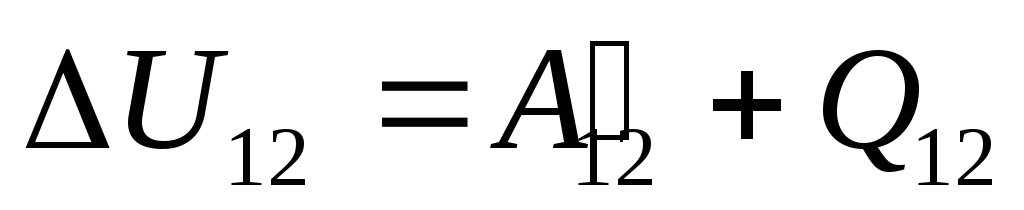 ,
(26.1)
,
(26.1)
جایی که
U 12
-
تغییر در انرژی داخلی سیستم در طول انتقال آن از حالت 1
به یک حالت 2
در نتیجه کار روی آن  از اجسام خارجی و انتقال مقدار معینی گرما از خارج به آن
از اجسام خارجی و انتقال مقدار معینی گرما از خارج به آن  .
.
ما آن کار را می دانیم  انجام شده توسط خود سیستم بر روی اجسام خارجی از نظر عددی برابر و مخالف علامت کار است
انجام شده توسط خود سیستم بر روی اجسام خارجی از نظر عددی برابر و مخالف علامت کار است  اجسام خارجی بالای سیستم، یعنی
اجسام خارجی بالای سیستم، یعنی
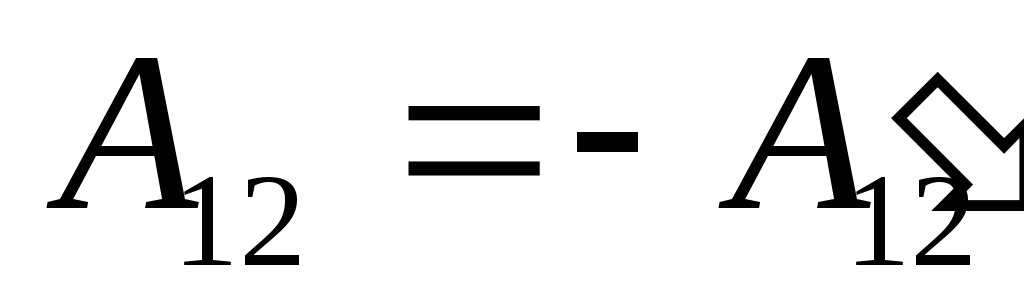 ,
(26.2)
,
(26.2)
بنابراین عبارت (26.1) را می توان به صورت بازنویسی کرد
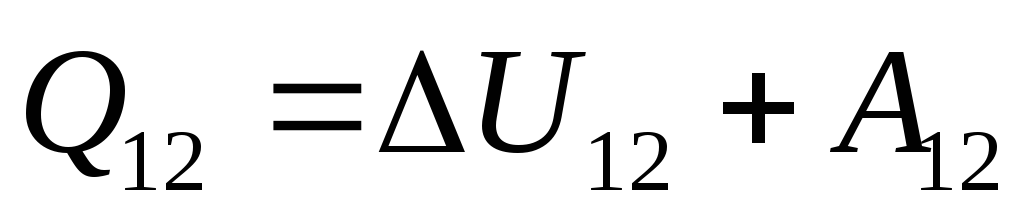 . (26.3)
. (26.3)
این معادله یک رکورد ریاضی از قانون اول ترمودینامیک است: مقدار گرمای ارسال شده به سیستم صرف تغییر انرژی داخلی آن و انجام کار روی اجسام خارجی توسط سیستم می شود.
با تغییر بی نهایت کوچک در وضعیت سیستم، معادله (26.3) شکل می گیرد
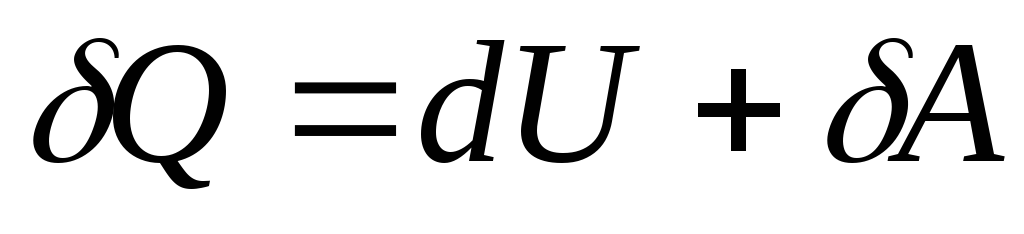 , (26.4)
, (26.4)
جایی که 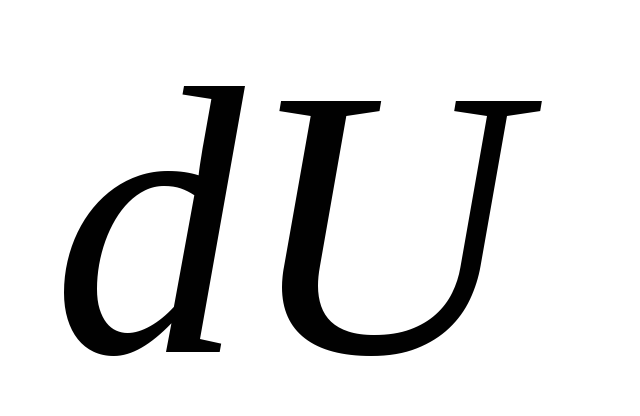 - تغییر بی نهایت کوچک در انرژی داخلی سیستم زمانی که مقدار اولیه گرما به آن داده می شود.
سو انجام کارهای ابتدایی توسط سیستم
ولیبر روی اجسام خارجی
- تغییر بی نهایت کوچک در انرژی داخلی سیستم زمانی که مقدار اولیه گرما به آن داده می شود.
سو انجام کارهای ابتدایی توسط سیستم
ولیبر روی اجسام خارجی
