Katı bir cismin ısı kapasitesini belirleme yöntemi
ISI KAPASİTESİ Nedir?
Isı verildiğinde, sistemin sıcaklığı yükselir. Sıcaklıkta sonsuz küçük bir değişiklik olması durumunda orantı geçerlidir.
dT=δQ veya dT=constδQ
Bu bağıntıyı şu şekilde yazmak daha uygundur: δQ=СdT veya
C değerine sistemin gerçek ısı kapasitesi denir.
Isı kapasitesi, sisteme verilen ısı miktarının meydana gelen sıcaklık değişimine oranıdır.
Gerçeğe ek olarak, ortalama bir ısı kapasitesi de vardır:
Isı kapasitesi
Isı kapasitesi bir maddenin birim kütlesine (mol) atfedilirse, tüm sistemin kütlesinden bağımsız hale gelir ve yoğun bir parametrenin özelliklerini kazanır. Isı kapasitesi, bir maddenin birim kütlesine atıfta bulunursa, buna spesifik denir ve J / (mol * k) boyutunda 1 mol - ısı kapasitesi olarak adlandırılır.
Sadece molar ısı kapasitelerini dikkate alacağız, çünkü onlar için tüm düzenlilikler, belirli ısı kapasitesinden çok daha basittir.
Isı kapasitesi, sisteme ısı transferinin gerçekleştiği koşullara bağlıdır. Sistem sabit bir hacim içindeyse, Cv'nin sabit hacimdeki ısı kapasitesi olduğu CvdT'ye eşit ısı etkisi altında sıcaklıkta dT'lik bir artış meydana gelecektir. Sistemin genişlemesi sırasında sabit basınç durumunda, sıcaklığı dT arttırmak için, Cp'nin sabit basınçtaki ısı kapasitesi olduğu yerde, ısı CpdT gerekli olacaktır.
Bir veya daha fazla değişken sabit tutulduğunda ve diğerleri değiştiğinde, ısı transferinin koşulları göz önüne alındığında, ısı kapasitesi kısmi türevler kullanılarak ifade edilebilir: ![]() . δQ v = dU olduğundan,
. δQ v = dU olduğundan,
δQ p =dH, şunu yazabiliriz:
![]() (1)
(1)
Cv, gazların izokorik ısı kapasitesi, Cp, gazların izobarik ısı kapasitesidir.
İzokorik ve izobarik ısı kapasiteleri arasındaki farklar, iç enerji ve entalpi farkından kaynaklanmaktadır. Entalpi ve iç enerjideki değişiklikler, sistem tarafından yapılan iş miktarına göre değişir.
δW=∆nRT, ∆H-∆U=∆nRT
Bu nedenle, sabit hacim Cv ve sabit basınç Cp'deki ısı kapasiteleri de iş miktarına göre farklılık gösterir: Cp - Cv = δW
(1) numaralı ifadelere dayanarak şunları yazabiliriz:
Bu eşitlikleri ∆H- ∆U=∆nRT denkleminde yerine koymak
ve ∆n= 1 olduğunu dikkate alarak, gazların molar ısı kapasiteleri arasındaki ilişkiyi bulacağız:
Cp– Cv= R veya Cp= Cv+ R
Görülebileceği gibi, gaz sabitinin değerine göre farklılık gösterirler.
Cp= Cv+ R koşulundan, Cp˃Cv, yani izobarik bir süreçte, P=const olduğunda, sistemin sıcaklığını arttırmak için gereklidir. büyük miktar izokorik bir süreçten daha fazla ısı.
Gazların molar ısı kapasitesi R mertebesinde değerlere sahiptir, bu nedenle Cp ve Cv arasındaki fark çok önemlidir. Yani, 25 0 C'de karbondioksit CO2 için Cp = 37, 14; ve Cv = 28.83 J / (mol * K)
Cp - Cv farkı, bir molün izobarik genişlemesinin işidir. Ideal gaz sıcaklık bir derece arttığında. Vücudun sıvıları ve katıları, ısıtıldığında hacimde hafif bir artış ile karakterize edilir. Bu nedenle, yoğun cisimler için Ср ≈ Сv olduğunu varsayabiliriz.
KIRCHHOFF DENKLEMİ. ISI ETKİLERİNİN SICAKLIK ÜZERİNE BAĞIMLILIĞI.
Oluşum ve yanma ısısı için Hess yasasına dayanan termal etkilerin önceden düşünülen hesaplamaları, standart koşullarla sınırlıdır. Pratik amaçlar için, standart olanlar dışındaki özel koşullar için termal etkilerin hesaplanması gereklidir.
Standart koşullar altında bilinen termal etkilerden uzaklaşın, ör. 25 0 C (298.15 K) sıcaklıkta ve 1 atm basınçta. (1.013 * 10 5 Pa), kullanarak ilgilendiğimiz herhangi bir sıcaklıkta termal etkileri hesaplamak mümkündür. Kirchhoff yasası. Endüstriyel koşullardaki prosesler, aralığı sadece teknolojinin koşullarına göre değil, aynı zamanda mevsime göre de belirlenen önemli bir sıcaklık değişimi ile karakterize edilir.Bu aralık yüzlerce dereceye ulaşabilir - termal etkilerin olması doğaldır. önemli ölçüde farklıdır ve sıcaklığa bağlıdır.
Kirchhoff yasasını diferansiyel formda düşünün. Bunu yapmak için, izobarik süreçlerde entalpi ve izokorik süreçlerde iç enerjideki değişiklikleri yazıyoruz.
∆H \u003d H2 -H1; ∆U \u003d U 2 -U 1.
Bu denklemleri sıcaklığa göre ayırt edin ve şunu elde edin:
Kirchhoff denklemleri:

Ve - sırasıyla izobarik ve izokorik süreçlerin termal etkisinin sıcaklık katsayıları; ve - sırasıyla izobarik ve izokorik süreçlerin bir sonucu olarak sistemin ısı kapasitesindeki değişiklik.
Kirchhoff denklemi temelinde, Kirchhoff yasası diferansiyel biçimde formüle edilir: sürecin termal etkisinin sıcaklık katsayısı, bu işlem sonucunda oluşan sistemin ısı kapasitesindeki değişime eşittir.
Böylece, diferansiyel formdaki Kirchhoff yasası, termal etkinin kendisinin büyüklüğünü değil, yalnızca termal etkinin sıcaklıkla değişimini belirlemeyi mümkün kılar.
Kirchhoff denklemini analiz edelim
Reaksiyon için: aA + bB = dD + rR izobarik bir süreçte (р=const), Kirchhoff yasasına göre, sistemdeki ısı kapasitesindeki değişiklik şu şekilde olacaktır:
Bir izokorik süreç için benzer bir ifade elde edilebilir:
Kirchhoff yasası, sıcaklıktaki bir değişiklikle sürecin termal etkisindeki değişiklikleri belirlemenize izin verdiğinden, bir grafik oluşturuyoruz:
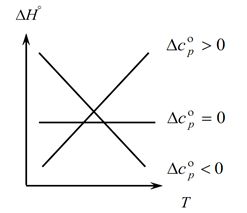
1. ∆Ср(∆Сv)˃0 olduğunda ilk durumu düşünün, çünkü ∆Ср=∑С con. -∑С başlangıç, dolayısıyla, reaksiyon ürünlerinin ısı kapasitelerinin toplamının, başlangıç maddelerinin ısı kapasitelerinin toplamından daha büyük olduğu sonucu çıkar: ∑С con. ˃∑En başından Bu durumda grafikte eğri 1 elde ederiz, yani sıcaklık arttıkça sürecin termal etkisindeki değişim de artar (T ve ∆H);
2. İkinci durum, ∆Ср(∆Сv)˂0 olduğunda. Birinci yasaya benzer şekilde, ∑С con var. ˂∑Erkenden (nihai ürünlerin ısı kapasitelerinin toplamı, ilk maddelerin ısı kapasitelerinin toplamından azdır). Sonra grafikte bir eğri elde ederiz, bu da sıcaklıktaki bir artışla işlemin termal etkisindeki değişimin azaldığı anlamına gelir (Т→∆H↓)
3. Ve üçüncü durumda, sistemin ısı kapasitelerindeki değişim sıfıra eşit olduğunda ∆Ср(∆Сv)=0. Daha sonra reaksiyonların nihai ürünlerinin ısı kapasitelerinin toplamı, başlangıç malzemelerinin ısı kapasitelerinin toplamına eşittir ∑С con. \u003d ∑ En baştan. Bu durumda, reaksiyonun termal etkisi sıcaklığın (∆H ≠ f(T)) bir fonksiyonu değildir ve grafikte düz bir çizgi elde ederiz.
VERİLEN BİRİ İÇİN TERMAL ETKİLERİN HESAPLANMASI
SICAKLIK. KIRCHHOFF DENKLEMİNİN ENTEGRASYONU
Termal etkinin değerini sıcaklığın bir fonksiyonu olarak bulmak için denklemleri entegre etmek gerekir.

T'den T 0'a (T gerekli sıcaklıktır, T 0 standart sıcaklıktır), ∆H'den ∆H 0'a veya ∆U'dan ∆U 0'a (burada ∆H ve ∆U, aşağıdaki entalpi ve iç enerjidir) standarttan farklı koşullar). Entegrasyon iki durumda gerçekleştirilir:
için değil organik madde: Organik maddeler için:
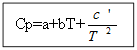
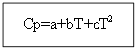
Örnek: H 2 (g) için - inorganik madde
| Ср=f(T) | T | |||
| a | b*10 3 | c'*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H 2 (g)) \u003d 27.28 + 3.26 * 10 -3 T +.
a) Yaklaşık entegrasyon:
izobarik süreç için
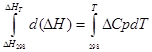
∆H T - ∆H 298 =∆Cp*(T-298)
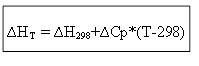
izokorik süreç için:
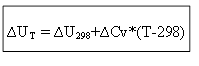
Bu nedenle, herhangi bir T sıcaklığındaki termal etki ∆H veya iç enerji ∆U'yu belirlemek için, standart koşullar ∆H 0 (∆U 0) altında işlemin ısısını ve ısı kapasitelerindeki değişimi ∆Ср, ∆ bilmek gerekir. Özgeçmiş.
Örnek. Asetilenden benzen elde etme işleminin termal etkisini ∆H hesaplayın:
3C 2H2 (g) → C6H6 (g) 75 0 C'de (348K).
1. Tablolardan benzen ve asetilenin ortalama molar izobarik ısı kapasitelerini buluyoruz:
Ср С6Н6 (g) \u003d 81.67 J / (mol * K);
Cp C2H2 (g) \u003d 43.93 J / (mol * K).
2. Sürecin ısı kapasitesindeki değişimi buluyoruz:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) başlangıç \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81.67 - 3 * 43.93 \u003d - 50.12 J / (mol * K) .
3. Tablo verilerine göre, standart koşullar altında termal etkiyi buluyoruz:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82.93 - 3 * 226.73 \u003d - 597.26 kJ / mol
4. Belirli bir sıcaklıktaki termal etkiyi bulun:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 J / mol
b) Tam entegrasyon:
Isı kapasitesindeki değişimin sıcaklığa bağlı olduğu, yani daha karmaşık ikinci durumu ele alalım. Ср=f(T), Cv=f(T).
Genel formdaki reaksiyon denklemine dönelim
dD + rR = qQ + pP
| a | b*10 3 | c'*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) - ;
∆b=q*b(Q) + p*b(P) - ;
∆c'= q*c'(Q) + p*c'(P) - ;
![]()
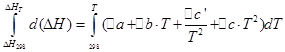
Aynı işlemleri izokorik süreç için de uygulayacağız:
ÇÖZÜNME ISI
Katı, sıvı veya gaz halindeki bir maddenin çözeltiye geçişi sırasında ısı değişimine ne ad verilir? termal veya çözünme entalpisi.
Çözünme ısısı genellikle kristal kafesin yıkım ısısını içerir (çünkü katılar), iyonlaşma ve çözünme.
Kristal bir tuzun iyonları arasındaki bağı kırmak için enerji gereklidir, yani. ısı emilirken. Aynı zamanda sulu çözeltide iyon hidrasyonu meydana gelir; H 2 O'nun iyonları ve molekülleri arasında bir bağ oluşur. Çözünme ısısının işareti, enerjisel olarak daha belirgin olan süreç tarafından belirlenir.
LiBr: ∆H dist = - 49.02 kJ / mol - ısı açığa çıkar
KCl: ∆H dist = 7.23 kJ/mol - ısı emilir
Ayırt etme: integral çözünme ısısı, belirli bir konsantrasyonda bir çözelti oluşturmak için belirli bir maddenin 1 molünün çözünmesi sırasında salınan veya emilen ısıdır. İntegral çözünme ısısı, çözünen maddenin miktarına bağlı olarak değişir.
Ayırt: diferansiyel çözünme ısısı - bu, belirli bir maddenin 1 molünün sonsuz olarak çözünmesine eşlik eden ısıdır. büyük hacimli Bu maddenin çözeltisi. İntegral ısılar, Hess yasasına göre oluşum ısılarının ve diğer reaksiyonların ısılarının hesaplanmasında yaygın olarak kullanılmaktadır. Diferansiyel çözünme ısıları, çözeltilerin termodinamik özelliklerini ve bunların oluşum sürecini karakterize eder.
Laboratuvar #8
KATI CİSİMLERİN ISI KAPASİTESİ TESPİTİ
Aletler ve aksesuarlar: deneysel kurulum FPT1-8.
Amaç: elektrikli ısıtma kullanılarak kalorimetrik yöntemle metal numunelerin ısı kapasitesinin belirlenmesi.
Kısa teori
Bir maddenin özgül ısı kapasitesi - 1 kg bir maddeyi 1 K ısıtmak için gereken ısı miktarına eşit bir değer:
Molar ısı kapasitesi - 1 K başına 1 mol maddeyi ısıtmak için gereken ısı miktarına eşit bir değer:
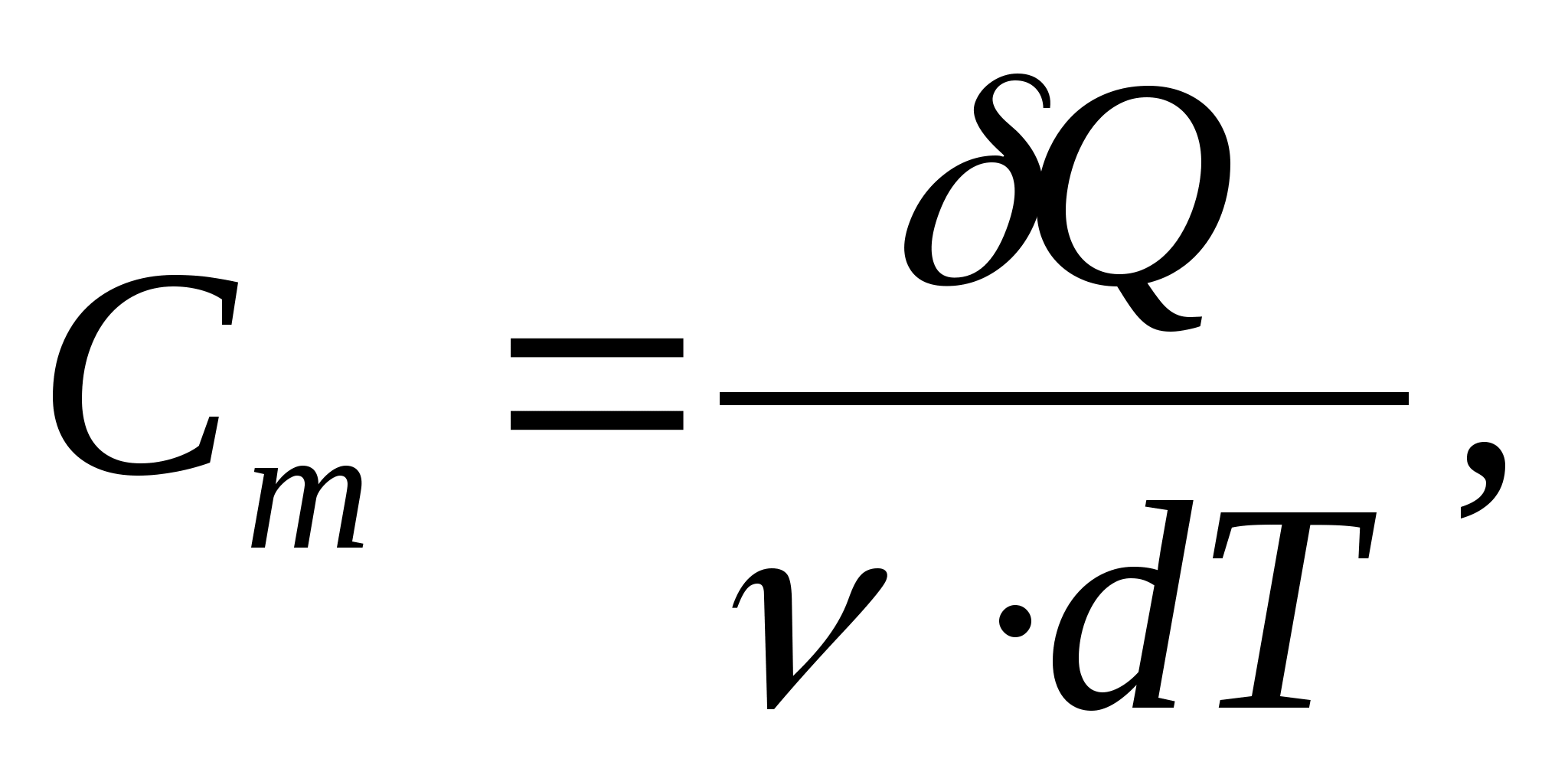
nerede 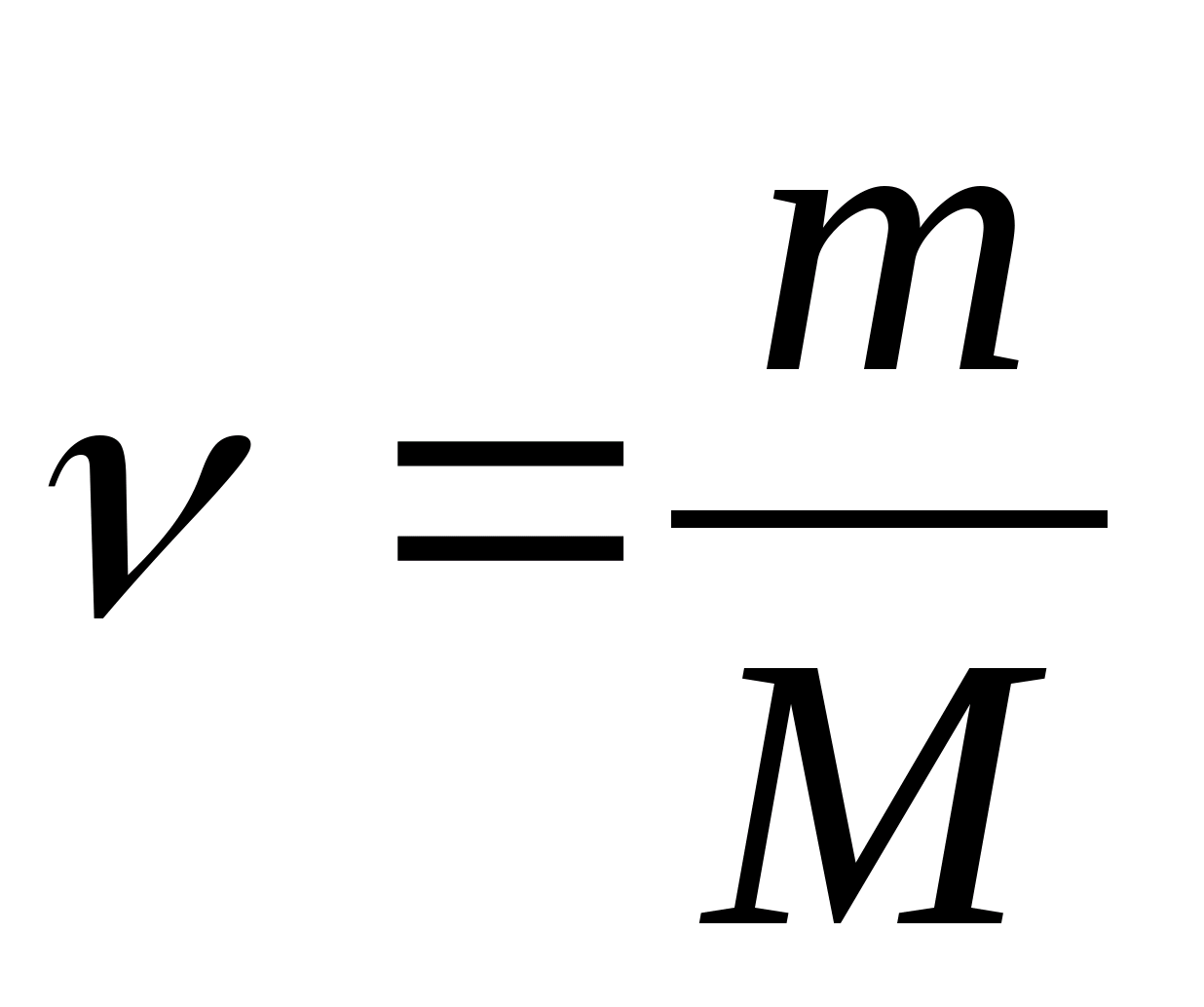 - madde miktarı.
- madde miktarı.
Özısı c molar ile ilişkili C m oran

nerede M maddenin molar kütlesidir.
Ayırt etmek sabit hacimde ısı kapasitesi ve sabit basınç, bir maddenin ısıtılması sürecinde hacmi veya basıncı sabit tutulursa.
Sistemin uzaydaki konumunu tam olarak belirleyen en küçük bağımsız değişken (koordinat) sayısına denir. serbestlik derecesi sayısı .
Boltzmann'ın enerjinin moleküllerin serbestlik dereceleri üzerinde düzgün dağılımı yasasına göre, her öteleme ve dönme serbestlik derecesinin ortalama kinetik enerjisi eşittir.
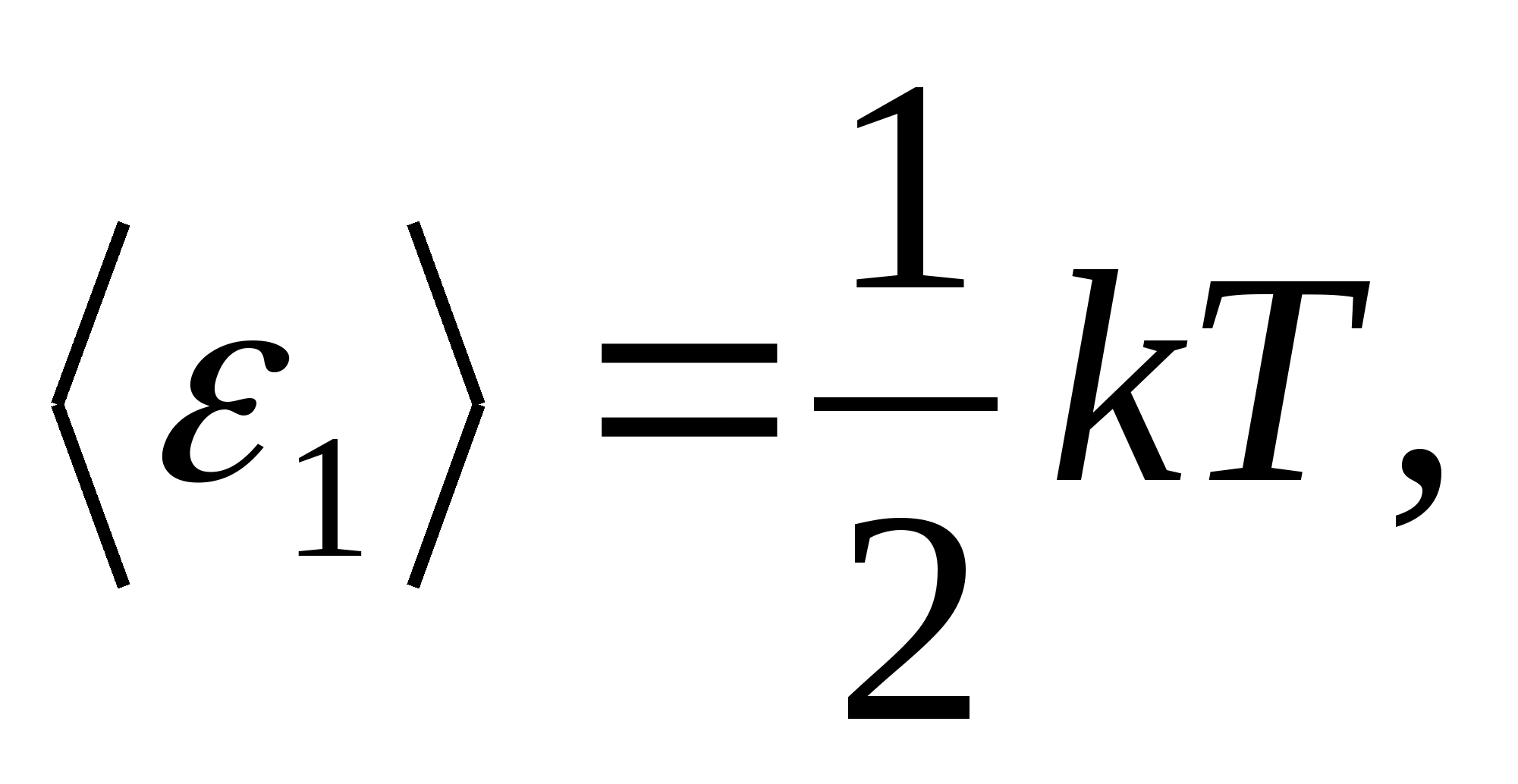
(nerede k Boltzmann sabitidir) ve her titreşim serbestlik derecesi için ortalama olarak enerji şuna eşittir:
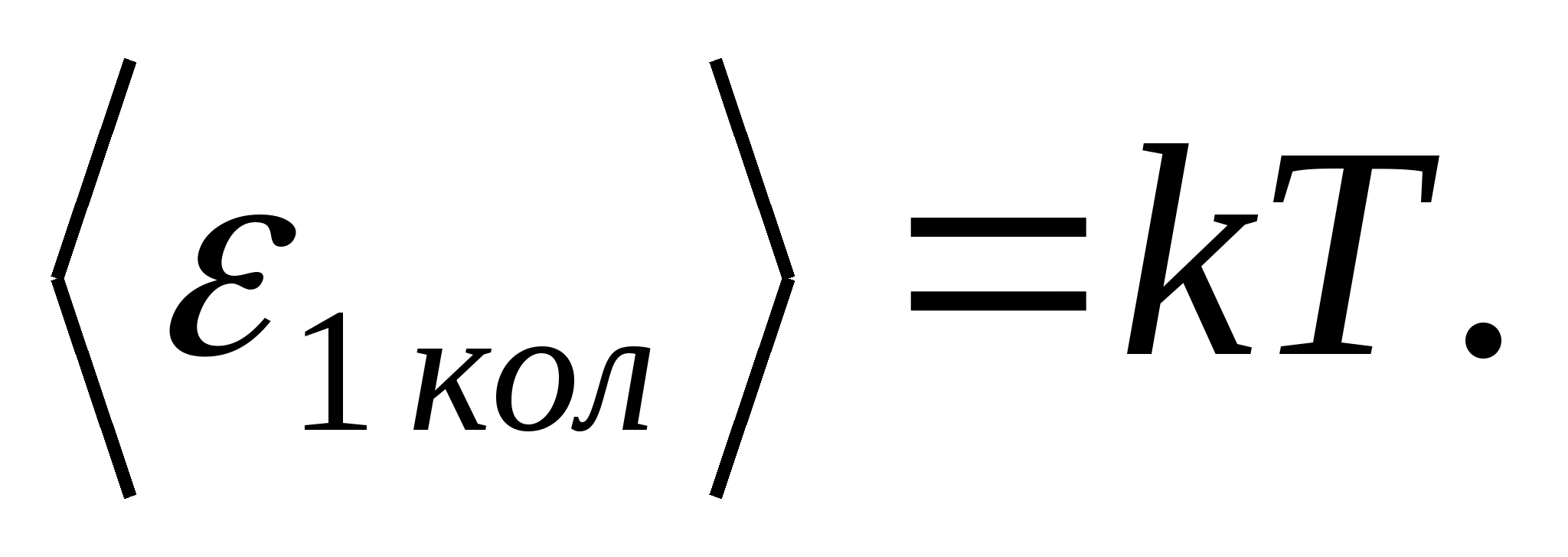
Böylece, bir molekülün ortalama enerjisi
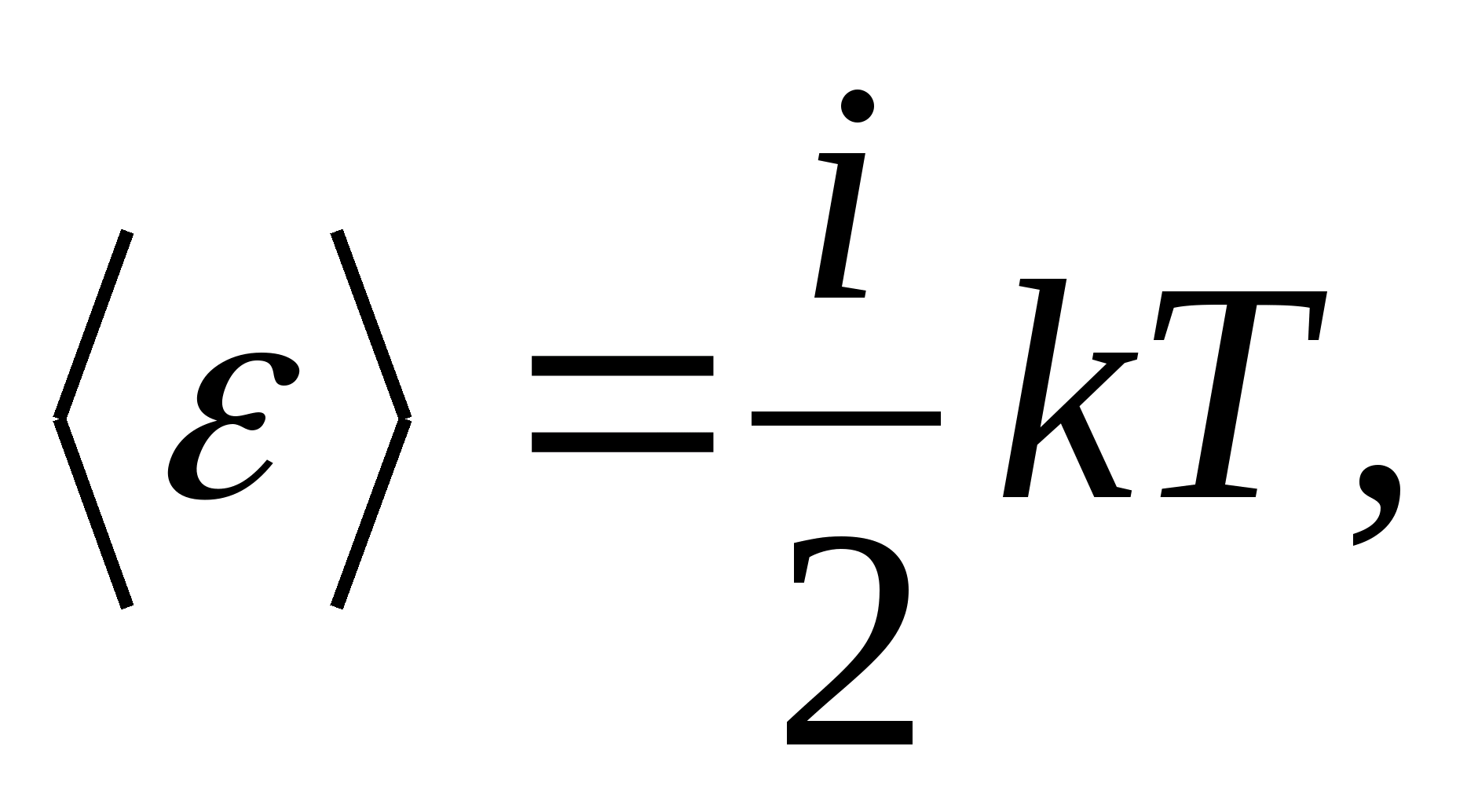
nerede i molekülün öteleme sayısı, dönme sayısı ve titreşim serbestlik derecesi sayısının iki katı toplamıdır:
![]()
Örneğin, tek atomlu ideal gaz moleküllerinin ortalama kinetik enerjisi ( 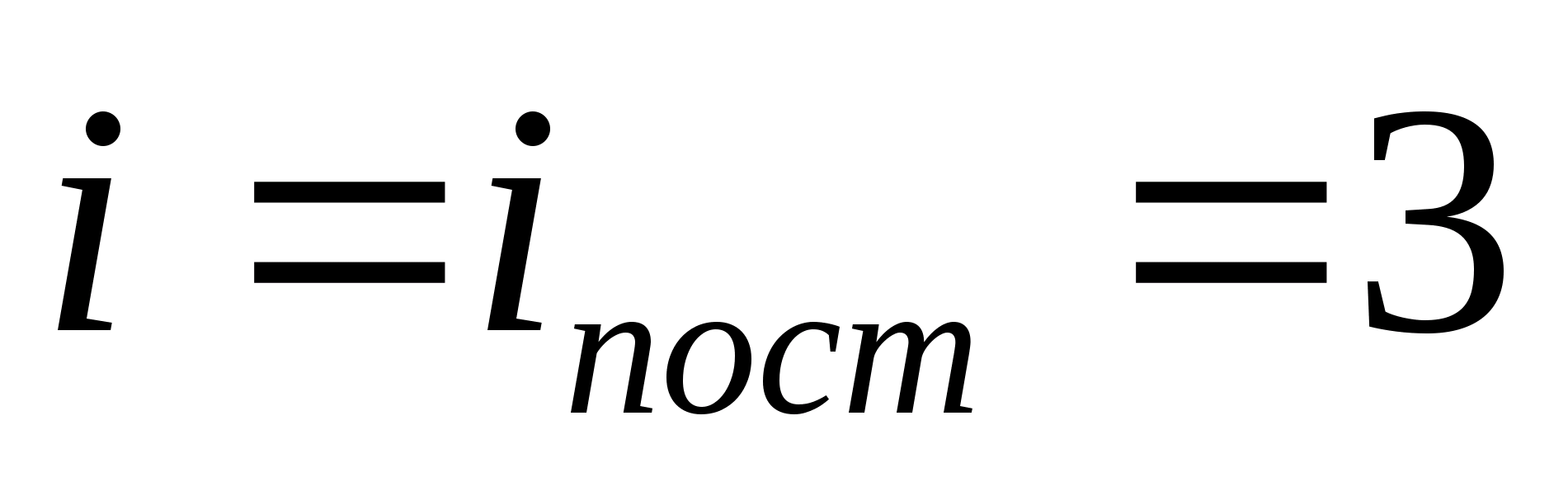 ) eşittir
) eşittir
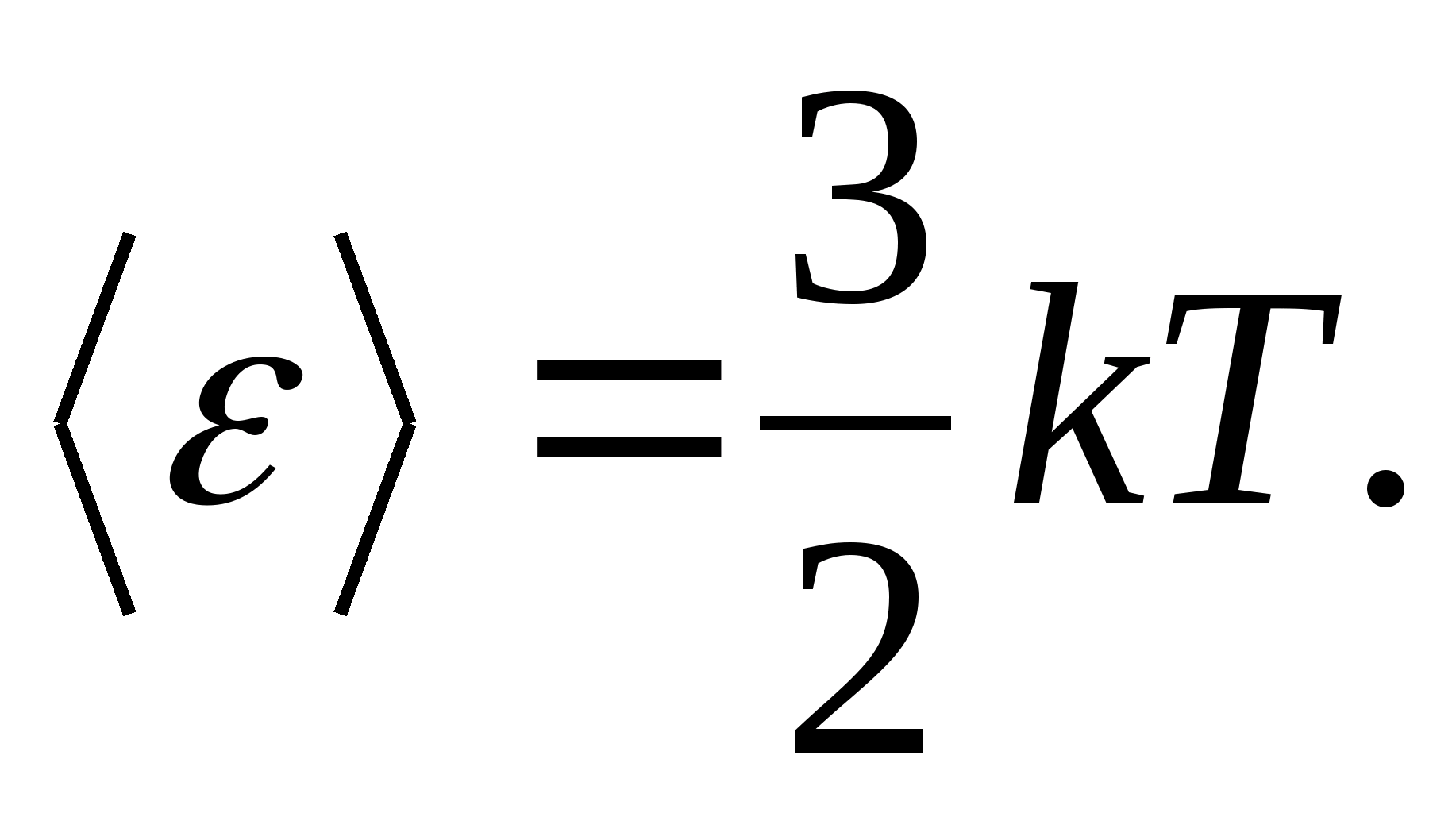
Olarak modeller Katı bir cismin düğümlerinde parçacıkların (atomlar, iyonlar, moleküller) olarak alındığı, doğru şekilde oluşturulmuş bir kristal kafes düşünün. maddi noktalar, denge konumları etrafında salınım - kafes düğümleri - birbirine dik üç yönde. Böylece, kristal kafesi oluşturan her bir parçacığa üç titreşim serbestlik derecesi atanır, bunların her biri, enerjinin serbestlik derecelerine göre düzgün dağılımı yasasına göre, enerjiye sahiptir. kT.
Daha sonra kristal kafesteki salınım hareketi sırasında parçacığın toplam enerjisinin ortalama değeri
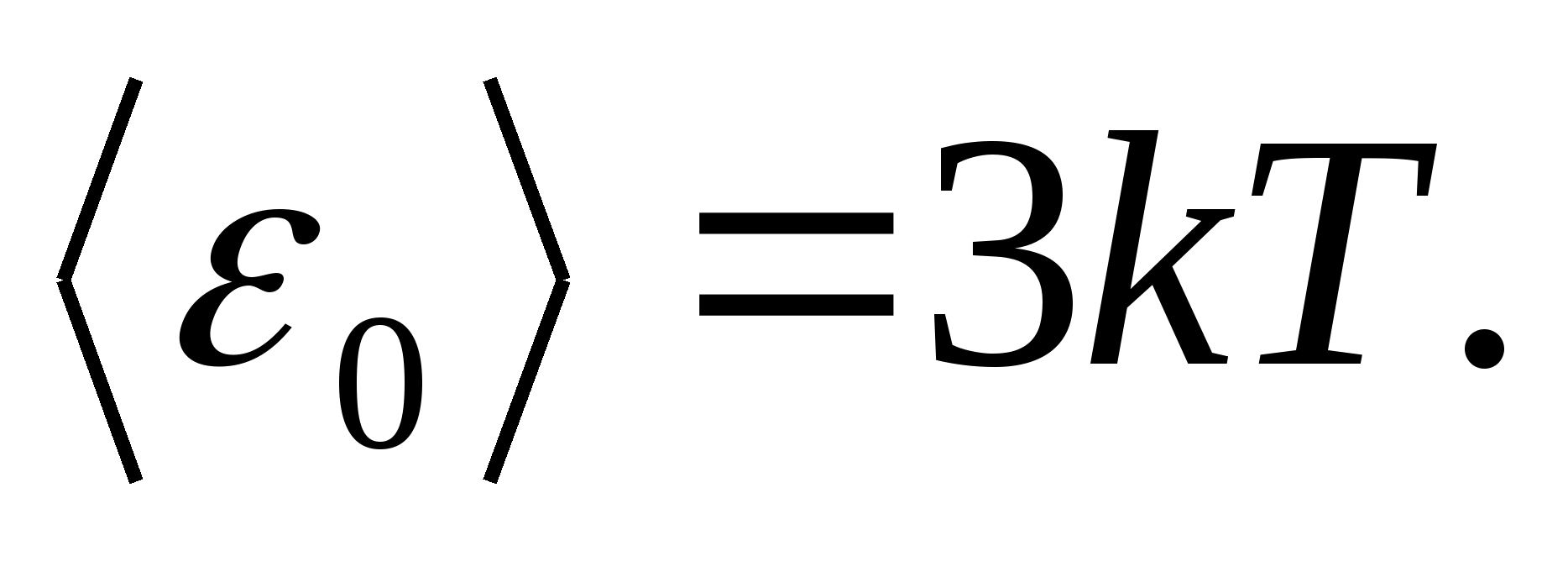
Bir katı cismin bir molünün toplam iç enerjisi, bir parçacığın ortalama enerjisinin, bir molün içerdiği bağımsız titreşen parçacıkların sayısı ile çarpılmasıyla elde edilir, yani. Avogadro sabitine N A :
nerede R=N A k evrensel (molar) gaz sabitidir, R= 8.31 J/(molK).
Katılar için, küçük termal genleşme katsayısı nedeniyle, sabit basınç ve sabit hacimdeki ısı kapasiteleri pratik olarak farklılık göstermez. Bu nedenle, (8.1) dikkate alındığında, bir katının molar ısı kapasitesi
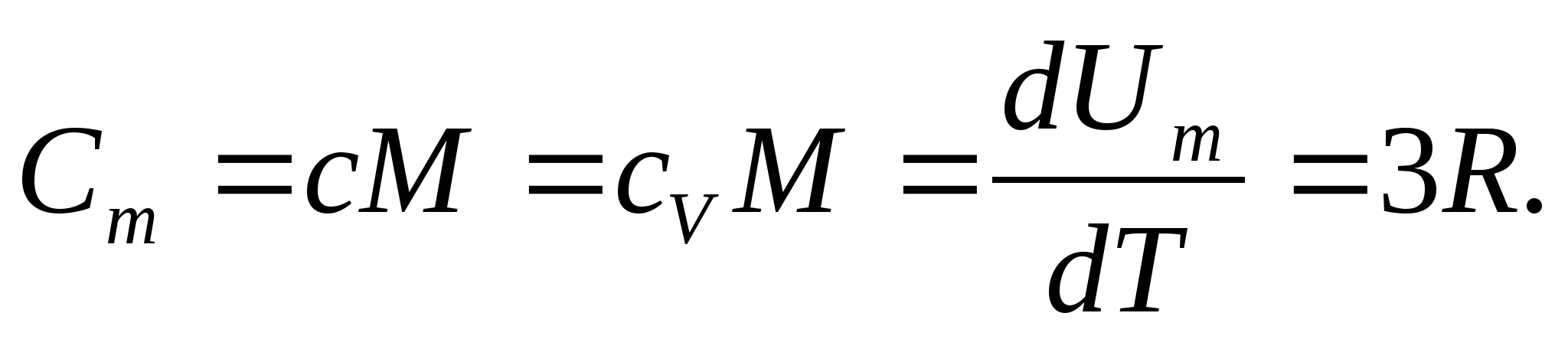 (8.2)
(8.2)
Molar gaz sabitinin sayısal değerini değiştirerek şunu elde ederiz:
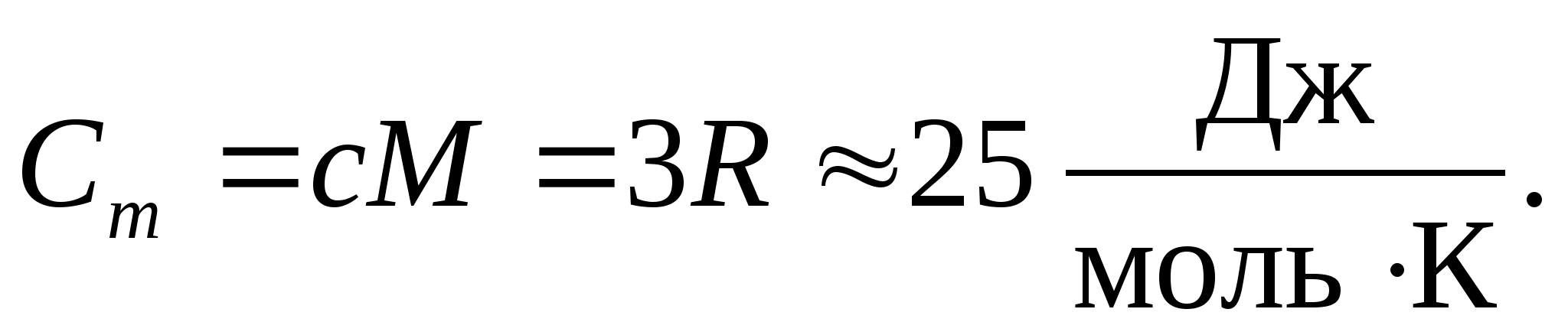
Bu eşitlik, oda sıcaklığındaki birçok madde için oldukça iyi bir yaklaşıma sahiptir ve denir. Dulong ve Petit hukuku : tüm kimyasal olarak basit kristalin molar ısı kapasitesi katılar yaklaşık olarak 25 J/(mol İLE). Sıcaklık azaldıkça, tüm katıların ısı kapasiteleri azalır ve sıfıra yaklaşır. T0. Mutlak sıfıra yakın, tüm cisimlerin molar ısı kapasitesi T3 ile orantılıdır ve sadece her maddenin yeterince yüksek bir sıcaklık özelliğinde eşitlik (8.2) korunmaya başlar. Katıların düşük sıcaklıklardaki ısı kapasitelerinin bu özellikleri, Einstein ve Debye tarafından oluşturulan kuantum ısı kapasitesi teorisi kullanılarak açıklanabilir.
Isı kapasitesini deneysel olarak belirlemek için, incelenen vücut bir elektrik akımı ile ısıtılan bir kalorimetreye yerleştirilir. Test numunesi ile kalorimetrenin sıcaklığı başlangıçtan itibaren çok yavaş artarsa T 0 ila T, daha sonra elektrik akımının enerjisi numuneyi ve kalorimetreyi ısıtmak için kullanılacaktır:
nerede ben ve sen- ısıtıcı akımı ve voltajı; - ısıtma süresi; m 0 ve m kalorimetre ve test numunesinin kütleleri, İle birlikte 0 ve İle birlikte- Kalorimetrenin ve test numunesinin özgül ısı kapasiteleri, Q- Kalorimetrenin ısı yalıtımına ve çevredeki alana ısı kaybı.
Kalorimetreyi ısıtmak için harcanan ısı miktarını ve çevredeki alana ısı kaybını denklem (8.3) dışında bırakmak için, aynı ısıtıcı gücünde, boş kalorimetreyi (numunesiz) ilk sıcaklıktan ısıtmak gerekir. T Aynı sıcaklık farkı için 0 T. Her iki durumda da kalorimetrenin koruyucu mahfazasının sıcaklığı sabit ve oda sıcaklığına eşitse, her iki durumda da ısı kaybı hemen hemen aynı ve çok küçük olacaktır:
Denklemler (8.3) ve (8.4) şu anlama gelir:
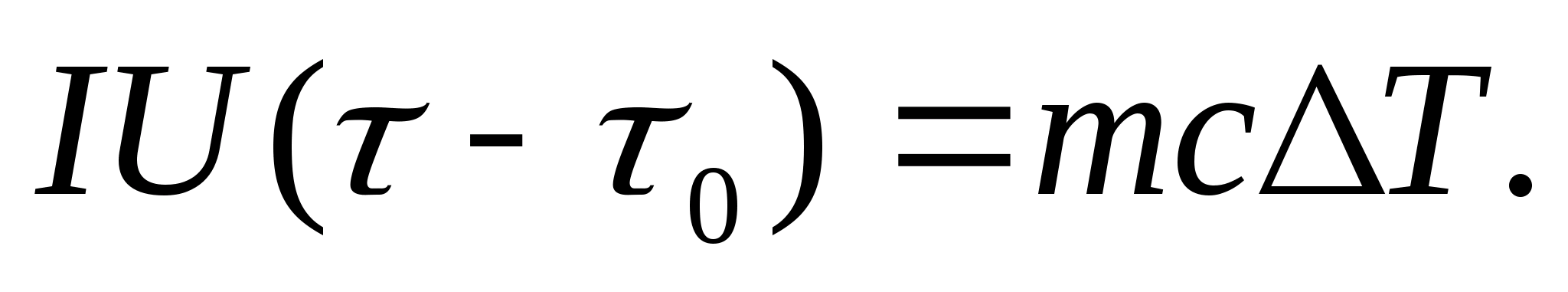 (8.5)
(8.5)
Denklem (8.5), test numunesinin malzemesinin özgül ısı kapasitesini deneysel olarak belirlemek için kullanılabilir. Kalorimetrenin sıcaklığını değiştirerek, ısıtma süresindeki farkın test örneğinin sıcaklığındaki değişime bağımlılığını çizmek gerekir: (
−
0)=f(T), açısal katsayısına göre 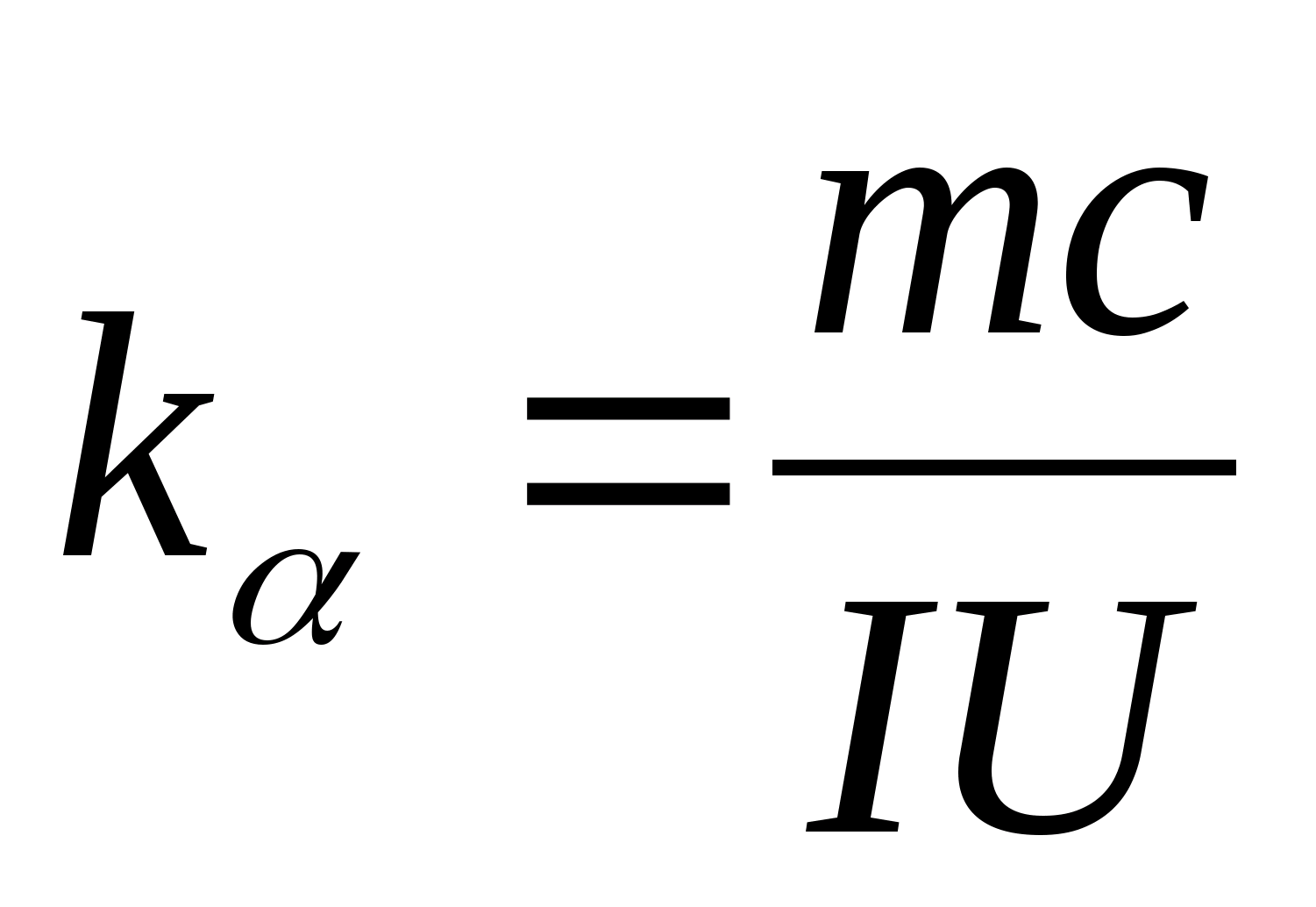 örneğin özgül ısı kapasitesi belirlenebilir.
örneğin özgül ısı kapasitesi belirlenebilir.
Laboratuvar kurulumunun açıklaması
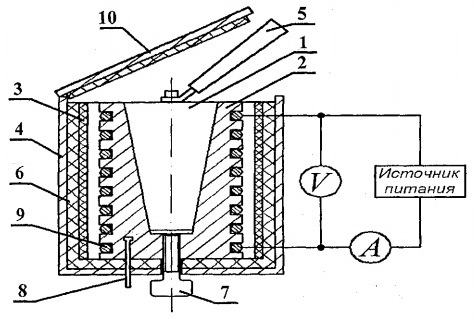
Katıların ısı kapasitesini belirlemek için, genel görünümü Şekil 1'de gösterilen FPT1-8 deney düzeneği tasarlanmıştır. 8.1. Kurulum üç ana bölümden oluşur: alet ünitesi 1, çalıştırma elemanı ünitesi 2 ve raf 3.
Kontrol ünitesi 1'in ön panelinde şunlar bulunur: üniteyi besleme gerilimi ağına bağlayan “AĞ” geçiş anahtarı; ısıtıcıyı açan "ISITMA" geçiş anahtarı; ısıtıcı gücünün ayarlandığı “ISITMA” regülatörü; ısıtıcı devresindeki voltajı ve akımı ölçen voltmetre ve ampermetre; kalorimetrenin ısıtma süresini ölçen kronometre. Kronometre, alet ünitesi açıldığında etkinleştirilir.
Çalışma elemanının 2 bloğu, org'dan çıkarılabilir bir ekranla önden kapatılır. bardak. İş yaparken, ekran, çalışma elemanı bloğunun arka duvarına asılır. Çalışma elemanının panel bloğunda sıcaklığı ölçmek için bir dijital termometre 6 bulunur. Altta, folluklarda çeşitli malzemelerden yapılmış 5 adet test numunesi ve numuneleri ısıtıcıya yerleştirmek için kulp bulunmaktadır.
Isıtıcı 4, metal bir kasa, ısı yalıtım malzemesi ve bir kalorimetreden oluşur.

Numuneler, şeması Şekil 2'de gösterilen bir kalorimetrede ısıtılır. 8.2.
Kalorimetre, test numunesi 1'in yerleştirildiği, konik delikli bir pirinç kasa 2'dir. Kasanın dış yüzeyinde, özel oluklara bir ısıtma bobini 9 yerleştirilmiştir.Dışarıda, kalorimetre kasası asbest katmanları ile termal olarak yalıtılmıştır. 3 ve cam elyaf 6 ve alüminyum kasa 4 ile kapatılmıştır. Kalorimetre, ısı yalıtıcı bir kapak 10 ile kapatılmıştır. Deneyin bitiminden sonra numune, kalorimetre gövdesinin konik deliğinden dışarı itilebilir. vida 7. Isıtılmış numuneyi kalorimetreden çıkarmak ve numuneyi ısıtıcıya takmak için, incelenen numunelerin yanındaki özel bir sokette bulunan kol 5 kullanılır.
Kalorimetrenin sıcaklığı, sıcaklık sensörü (8) kalorimetrenin mahfazasında (2) bulunan bir dijital termometre ile ölçülür.
Emniyet
İş yaparken, mekanik laboratuvarındaki genel güvenlik gereksinimleri gözlenir.
İş emri
DİKKAT! Kalorimetrenin soğuması uzun zaman alır, bu nedenle tüm zaman değerlerini ölçtükten sonra 0 boş kalorimetrenin ısıtılması, ısıtmayı hemen kapatın (aşağıdaki 4. maddeye bakın). Bu ünite için maksimum ısıtma sıcaklığı +44С'dir.
1. Tesisatın çalışma elemanı ünitesinin şeffaf kapağını çıkarın ve arka panel vidalarına asın. ISITMA kontrol düğmesini minimuma ayarlayın. "AĞ" geçiş anahtarı ile kurulumu açın.
2. Boş kalorimetrenin kapağını sıkıca kapatın. "ISITMA" geçiş anahtarını açın. HEAT regülatörünü kullanarak voltajı 10-20 V'a ayarlayın (voltaj ne kadar yüksek olursa, ısıtma o kadar hızlı olur). Tabloya yazın. 8.1 seçilen voltaj değerleri sen ve akım ben.
3. Kalorimetrenin sıcaklığından başlayarak tÖğretmen tarafından belirtilen 0, 1С aralığından sonra tabloya girin. 8.1 zaman değerleri 0, ulaşılan her sıcaklığa karşılık gelir t.
4. "ISITMA" geçiş anahtarını kapatın, kapağı açın ve kalorimetreyi başlangıç sıcaklığına soğutun t 0 . Kalorimetreyi hızlı bir şekilde soğutmak için öğretmen tarafından belirtilen hariç numunelerden birini kalorimetreye indirebilirsiniz (numuneyi kalorimetreye takarken kalorimetrenin altındaki vidayı sola çevirin). Sıcaklık düşmeye başlayacak. Soğutma hızı düştüğünde, ısıtılmış numuneyi çıkarın ve öğretmen tarafından belirtilen hariç bir sonraki (soğuk) numuneyi yerleştirin. Numuneyi çıkarmak için kalorimetrenin altındaki vidayı sağa (saat yönünde) çevirin ve ardından numuneyi tutamaçla dışarı çekin.
Tablo 8.1
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C m =İle birlikteM, J/(molK) |
||||||||
5. Vidayı sola çevirerek, öğretmenin talimatına göre alınan test numunelerinden birini kalorimetreye yerleştirin. Kalorimetrenin kapağını sıkıca kapatın ve kalorimetre ile numune sıcaklıklarının eşitlenmesi için 2-3 dakika bekleyin.
6. "ISITMA" geçiş anahtarını açın ve devrede boş kalorimetreyi ısıtırken olduğu gibi aynı voltajı ayarlayın.
7. Aynı başlangıç kalorimetre sıcaklığından başlayarak t 0, 1С aralığından sonra tabloya girin. 8.1 zaman değerleri ulaşılan her sıcaklığa karşılık gelen t.
8. “ISITMA” regülatörünü en sol konuma (minimum) ayarlayın, “ISITMA” geçiş anahtarını kapatın, kalorimetrenin kapağını açın. Numuneyi kalorimetreden çıkarmak için vidayı sağa çevirin, ardından tutamağı kullanarak ısıtılmış numuneyi çıkarın.
9. Üniteyi "AĞ" geçiş anahtarıyla kapatın.
10. Miktarların tüm değerlerini çevirin 0 ve saniye cinsinden (dakika olmadan) değerlere dönüştürün ve tabloya girin. 8.1. Tablonun her satırı için. 8.1 değerlerini hesaplayın = − 0 ve T= t− t 0 .
11. Formülü kullanarak numunenin özgül ısı kapasitesinin tahmini bir hesaplamasını yapın 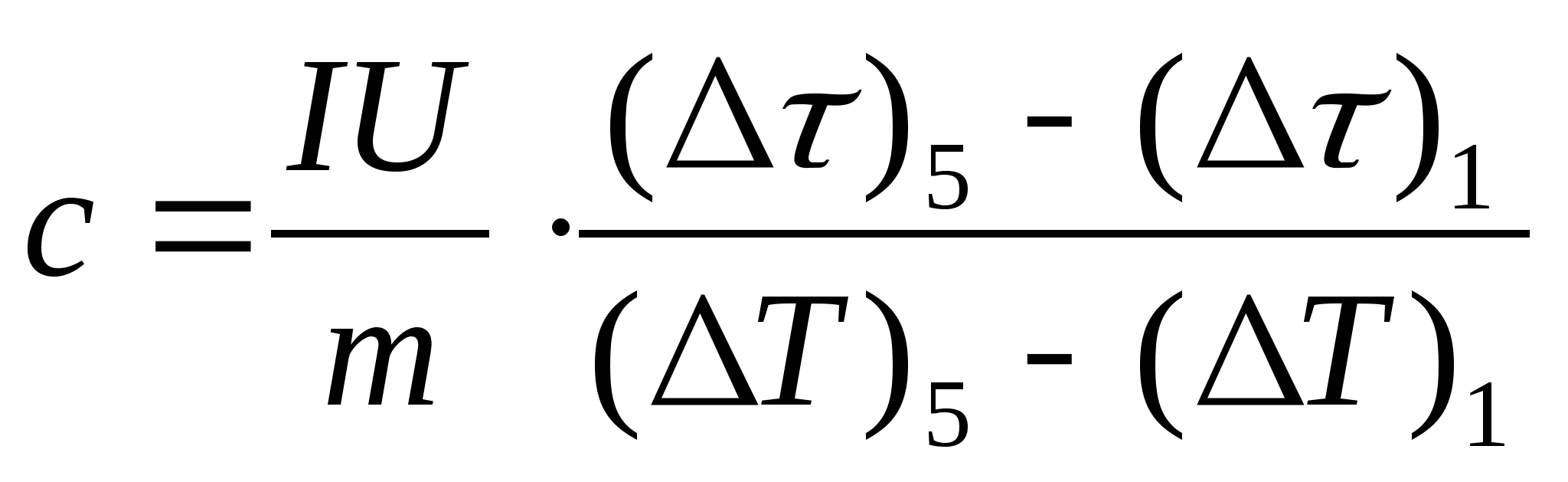 , numunenin kütlesi nerede m=139,5 g (pirinç) veya m=129,7 g (çelik) veya
m=46.05 g (duralumin). Doğrulama için öğretmene gelin.
, numunenin kütlesi nerede m=139,5 g (pirinç) veya m=129,7 g (çelik) veya
m=46.05 g (duralumin). Doğrulama için öğretmene gelin.
Ölçüm sonuçları işleniyor
1. Konu
=f(T) Kalorimetrenin numune ve boş kalorimetre ile ısıtma süresindeki farkın kalorimetrenin sıcaklık değişimine bağımlılığı, grafikte herhangi iki noktayı seçin ve formülü kullanarak düz çizginin eğimini belirleyin 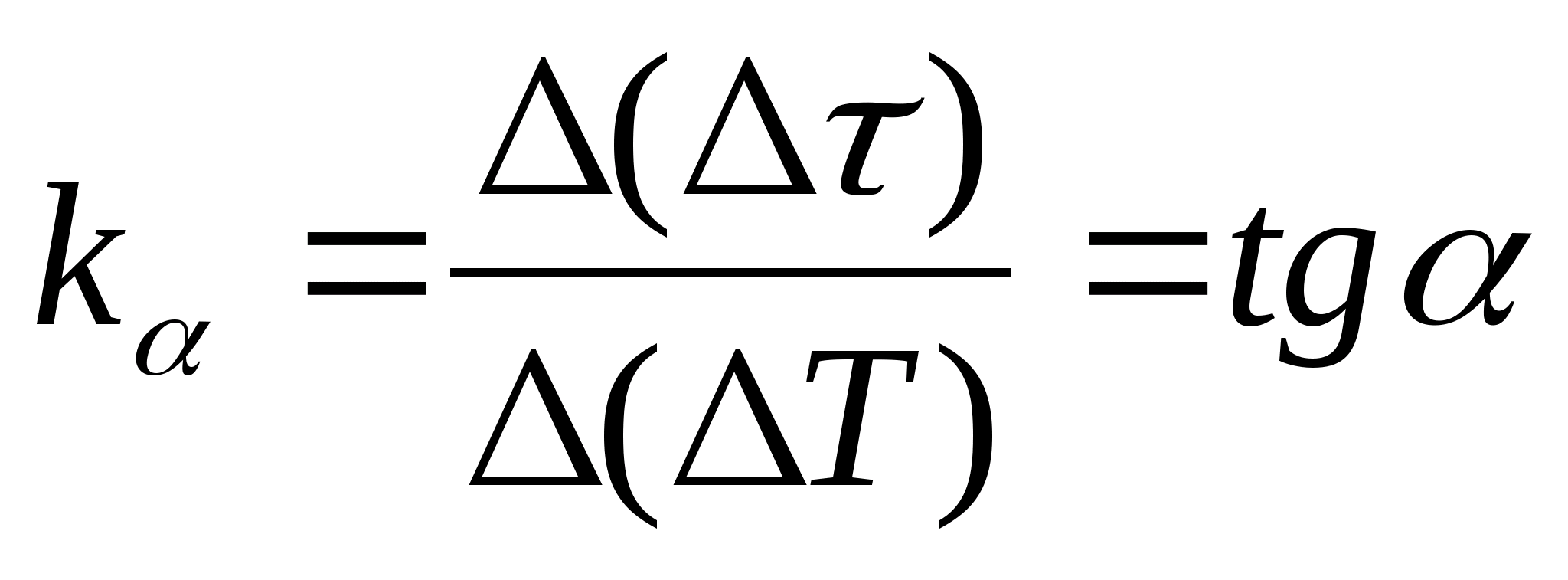 , nerede
− grafiğin eksene olan eğim açısı T
(eğer birimleri
ve T her iki eksende de aynı uzunlukta segmentler olarak gösterilir).
, nerede
− grafiğin eksene olan eğim açısı T
(eğer birimleri
ve T her iki eksende de aynı uzunlukta segmentler olarak gösterilir).
2. Eğim değerini kullanma k
, formülü kullanarak numunenin özgül ısı kapasitesini belirleyin 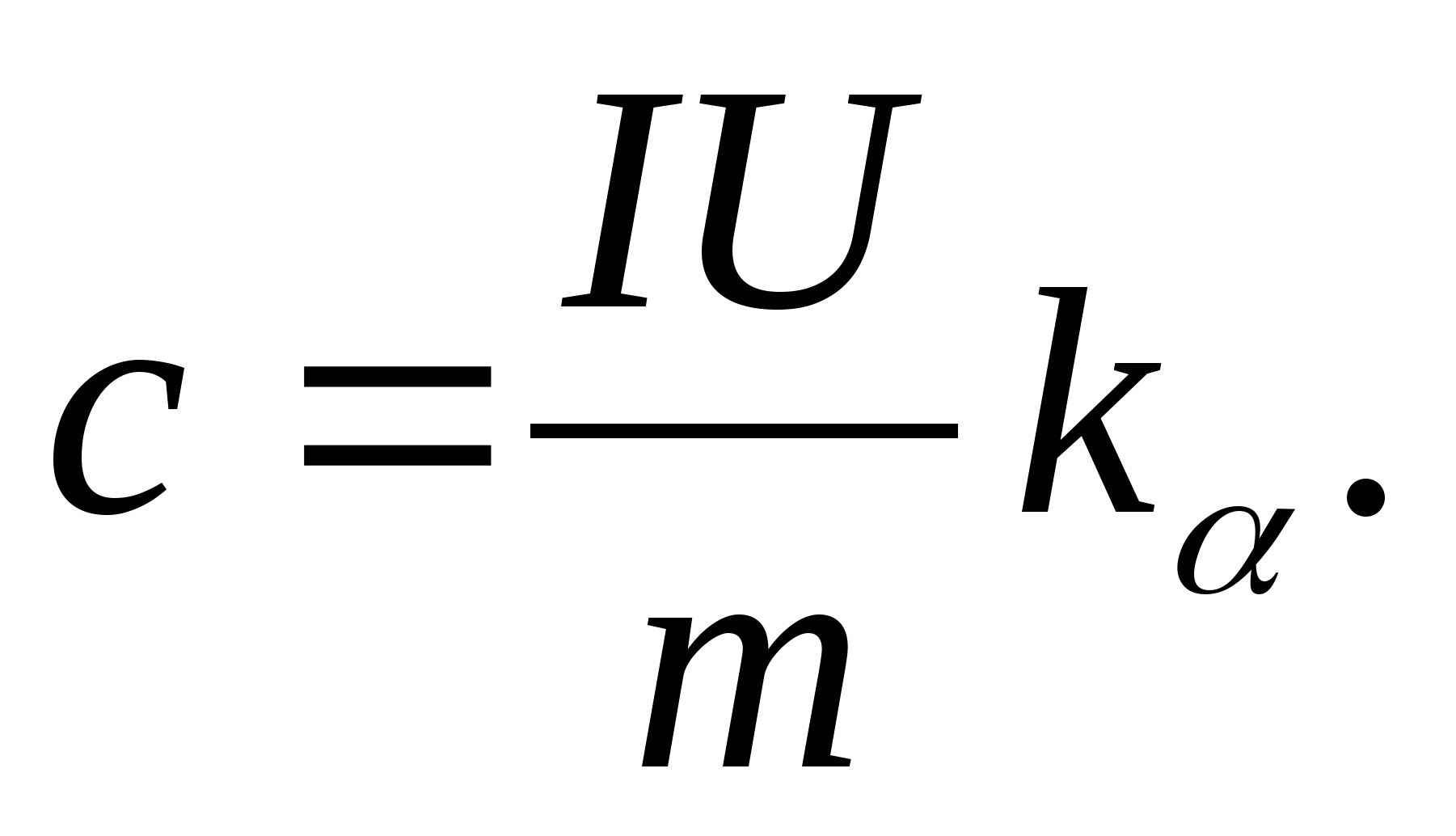
3. Tablo 8.2'deki (veya periyodik tablodaki) verileri kullanarak, formülü kullanarak numunenin molar ısı kapasitesini belirleyin. C m =İle birlikteM.
Tablo 8.2
|
Örnek malzeme |
Atom kütlesi, kg/mol |
|
Katı bir cismin modeli olarak, düğümlerinde maddesel noktalar olarak alınan parçacıkların (atomlar, iyonlar, moleküller) denge konumları - kafes düğümleri - etrafında karşılıklı olarak dik üç yönde salındığı, doğru şekilde oluşturulmuş bir kristal kafes düşünelim. . Böylece, kristal kafesi oluşturan her bir parçacığa, her biri, enerjinin serbestlik derecelerine göre eşit bölünmesi yasasına göre (bkz. § 50) üç titreşimsel serbestlik derecesi atanır. kT.
Katı bir cismin bir molünün iç enerjisi
U m \u003d 3N A kT \u003d 3RT,
burada NA, Avogadro sabitidir; N A k= R (R molar gaz sabitidir).
Bir katının molar ısı kapasitesi
yani molar (atomik) ısı kapasitesi kimyasal olarak basit cisimler kristal durumda aynıdır (eşittir 3 R) ve sıcaklığa bağlı değildir. Bu yasa, Fransız bilim adamları P. Dulong (1785-1838) ve L. Petit (1791-1820) tarafından ampirik olarak elde edildi ve BaşlıkDulong ve Petit kanunu.
Katı kimyasal bir bileşikse (örneğin NaCl), o zaman molün içindeki parçacıkların sayısı Avogadro sabitine eşit değildir, ancak şuna eşittir: nN A , nerede n - bir moleküldeki atom sayısı (NaCl için bir molün içindeki tanecik sayısı 2'dir) N ve böylece, bir mol NaCl, N A Na atomu ve N A Cl atomu içerir). Böylece molar ısı kapasitesi katı kimyasal bileşikler
C V \u003d 3R25n J / (mol K),
yani, bu bileşiği oluşturan elementlerin atomik ısı kapasitelerinin toplamına eşittir.
Deneysel verilerin gösterdiği gibi (Tablo 4), bazı maddelerin (C, Be, B) hesaplanan ısı kapasitelerinden önemli sapmalara sahip olmasına rağmen, birçok madde için Dulong ve Petit yasası oldukça iyi bir yaklaşımla karşılanmaktadır. Ek olarak, gazlarda olduğu gibi (bkz. § 53), düşük sıcaklıklarda katıların ısı kapasitesini ölçme deneyleri, bunun sıcaklığa bağlı olduğunu göstermiştir (Şekil 113). Sıfır Kelvin'e yakın, cisimlerin ısı kapasitesi T3 ile orantılıdır ve sadece yeterince yüksek sıcaklıklarda, her maddenin özelliği, koşul (73.1) karşılanır. Örneğin elmasın ısı kapasitesi 3 R 1800 K'da! Ancak çoğu katı için oda sıcaklığı zaten yeterince yüksektir.
Hesaplanan ısı kapasitelerinin deneysel ve teorik değerleri arasındaki tutarsızlık
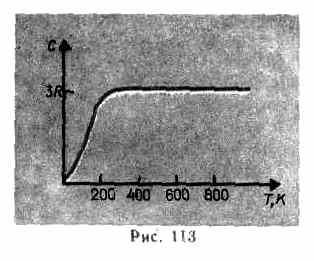
ısı kapasitelerinin kuantum teorisine dayanan klasik teorinin temeli, A. Einstein ve P. Debye (1884-1966).
§ 74. Buharlaşma, süblimleşme, erime ve kristalleşme. amorf cisimler
Hem sıvılarda hem de katılarda, enerjisi diğer moleküllere olan çekimin üstesinden gelmek için yeterli olan ve bir sıvının veya katının yüzeyinden ayrılabilen ve onları çevreleyen boşluğa geçebilen belirli sayıda molekül her zaman vardır. Sıvı için bu işleme denir buharlaşma(veya buharlaşma), katılar için - süblimasyon(veya süblimasyon).
Sıvıların buharlaşması herhangi bir sıcaklıkta gerçekleşir, ancak artan sıcaklıkla yoğunluğu artar. Buharlaşma süreci ile birlikte bir dengeleme süreci gerçekleşir. yoğunlaşma buhardan sıvıya. Birim yüzeyden birim zamanda sıvıyı terk eden moleküllerin sayısı, buhardan sıvıya geçen moleküllerin sayısına eşitse, o zaman dinamik denge Buharlaşma ve yoğuşma süreçleri arasında. Sıvısı ile dengede olan buhara denir. zengin(ayrıca bkz. § 62).
Çoğu katı için, normal sıcaklıklarda süblimleşme süreci ihmal edilebilir ve katının yüzeyindeki buhar basıncı düşüktür; artan sıcaklıkla artar. Keskin, karakteristik bir koku ile algılanan naftalin, kafur gibi maddeleri yoğun bir şekilde süblimleştirir. Süblimleşme, özellikle vakumda yoğun bir şekilde gerçekleşir - bu, ayna yapmak için kullanılır. İyi bilinen bir süblimasyon örneği, buzun buhara dönüşmesidir - ıslak çamaşırlar soğukta kurur.
Katı bir cisim ısıtılırsa, o zaman içsel enerji(kafes bölgelerindeki parçacıkların titreşimlerinin enerjisinin toplamı ve bu parçacıkların etkileşim enerjisinin toplamı) artar. Sıcaklık arttıkça, parçacık salınımlarının genliği
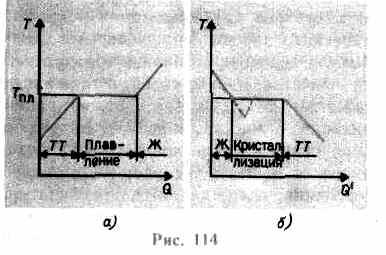
kristal kafes çökene kadar artar - katı erir. Şek. 114 a yaklaşık bir bağımlılık gösterilir T(Q), nerede Q- erime sırasında vücut tarafından alınan ısı miktarı. katı mesaj olarak sıcaklık vücut sıcaklığı yükselir ve erime noktasında T pl vücudun katı halden sıvı hale geçişini başlatır. Sıcaklık T lütfen tüm kristal eriyene kadar sabit kalır ve ancak o zaman sıvının sıcaklığı tekrar yükselmeye başlar.
Bir katıyı ısıtmak T lütfen henüz sıvı bir duruma dönüştürmez, çünkü maddenin parçacıklarının enerjisi kristal kafesi yok etmek için yeterli olmalıdır. Erime sürecinde, maddeye verilen ısı, kristal kafesin yok edilmesi üzerinde iş yapmak için kullanılır ve bu nedenle, tüm kristal eriyene kadar T pl = sabittir. Daha sonra verilen ısı tekrar sıvının parçacıklarının enerjisini artırmak için gidecek ve sıcaklığı yükselmeye başlayacaktır. 1 kg cismi eritmek için gereken ısı miktarına ne denir özgül füzyon ısısı.
Sıvı soğutulursa, işlem ters yönde ilerler (Şekil 114, b; Q" - kristalleşme sırasında vücut tarafından verilen ısı miktarı): önce sıvının sıcaklığı düşer, ardından T pl'ye eşit sabit bir sıcaklıkta başlar kristalizasyon, tamamlanmasından sonra kristalin sıcaklığı düşmeye başlar. Bir maddenin kristalleşmesi için, sözde varlığı kristalizasyon merkezleri - sadece oluşan maddenin kristalleri değil, aynı zamanda safsızlıklar, ayrıca toz, kurum vb. olabilen kristal çekirdekler. Saf bir sıvıda kristalleşme merkezlerinin olmaması, mikroskobik kristallerin ve maddenin oluşumunu zorlaştırır, sıvı halde kalır, kristalleşme sıcaklığından daha düşük bir sıcaklığa soğur, böylece aşırı soğutulmuş sıvı(114'te, b kesikli eğriye karşılık gelir). Güçlü aşırı soğutma ile kristalleşme merkezlerinin kendiliğinden oluşumu başlar ve madde oldukça hızlı bir şekilde kristalleşir.
Genellikle, eriyiğin aşırı soğutulması, fraksiyonlardan onlarca dereceye kadar gerçekleşir, ancak bir dizi madde için yüzlerce dereceye ulaşabilir. Yüksek viskoziteden dolayı aşırı soğutulmuş sıvılar, katılar gibi şekillerini koruyarak akışkanlıklarını kaybederler. Bu bedenlere denir amorf katılar; bunlara reçineler, mum, sızdırmazlık mumu, cam dahildir. Amorf cisimler, bu nedenle aşırı soğutulmuş sıvılar, izotropik, yani, özellikleri her yönden aynıdır; onlar için olduğu kadar sıvılar için de karakteristiktir kısa menzilli sipariş parçacıkların düzenlenmesinde; içlerinde sıvıların aksine parçacıkların hareketliliği oldukça küçüktür. Amorf cisimlerin bir özelliği, belirli bir erime noktasına sahip olmamalarıdır, yani üzerinde bir sıvı halin tespit edilebileceği ve bir katı halin altında belirli bir sıcaklığın belirtilmesi imkansızdır. Deneyimlerden, amorf cisimlerde kristalleşme sürecinin zamanla gözlemlenebildiği bilinmektedir, örneğin kristaller camda görünür; şeffaflığı kaybederek bulanıklaşmaya ve polikristal bir gövdeye dönüşmeye başlar.
Son zamanlarda yaygın olarak kullanılan ulusal ekonomi var polimerler- molekülleri kimyasal (değerlik) bağlarla birbirine bağlanan çok sayıda özdeş uzun moleküler zincirden oluşan organik amorf cisimler. Polimerler hem doğal (nişasta, protein, kauçuk, lif vb.) hem de yapay (plastik, kauçuk, polistiren, lavsan, naylon vb.) organik maddeleri içerir. Polimerler, doğal güç ve esnekliktir; bazı polimerler, orijinal uzunluklarının 5-10 katı kadar esnemeye dayanır. Bu, uzun moleküler zincirlerin deformasyon altında ya yoğun toplar halinde katlanabilmeleri ya da düz çizgiler halinde esneyebilmeleri gerçeğiyle açıklanmaktadır. Polimerlerin esnekliği, yalnızca altında sert ve kırılgan hale geldikleri ve yukarıda plastik olan belirli bir sıcaklık aralığında kendini gösterir. Pek çok sentetik polimerik malzeme (yapay lifler, deri ikameleri, yapı malzemeleri, metal ikameleri vb.) oluşturulmuş olmasına rağmen, polimer teorisi henüz tam olarak geliştirilmemiştir. Gelişimi, önceden belirlenmiş özelliklere sahip polimerlerin sentezini gerektiren modern teknolojinin talepleri ile belirlenir.
Bir maddenin özgül ısı kapasitesi, değeri olarak anlaşılmaktadır.
, (1)
vücuda verilen ısı miktarı nerede.
meydana gelen sıcaklık değişimidir
ısının vücuda aktarılması sonucunda,
m ısıtılan cismin kütlesidir.
Deneyim genellikle ortalamayı belirler özısı c maddesi, sıcaklığını yükseltmek için bu maddenin birim kütlesine verilmesi gereken ısı miktarına sayısal olarak eşittir:
(2),
incelenen vücudun son ve ilk sıcaklıkları arasındaki fark nerede.
Isı kapasitesini deneysel olarak belirlemek için çeşitli kalorimetrik yöntemler kullanılır. Bu yöntemlerin çeşitliliği, vücuda verilen ısı miktarının doğru bir şekilde ölçülmesinin, incelenen vücut ısıtılırken dikkate alınmayan ısı kayıplarının ortadan kaldırılmasını gerektirmesinden kaynaklanmaktadır.
Genellikle, izotermal kabuklu kalorimetrelerde, radyasyon için hesaplanmış veya deneysel olarak belirlenmiş bir düzeltme, yani kalorimetrenin deney sırasında radyasyonla aldığı veya dış ortama verdiği ısı miktarı eklenir.
Bununla birlikte, iyi bir ısı yalıtımı sağlayarak veya ısı kayıplarının artacağı numunenin yüksek bir ısıtma hızıyla elde edilen deney süresini azaltarak ısı kayıplarını önemli ölçüde azaltmak mümkündür ~ (ısı kapasitesini ölçmek için darbe yöntemi). sağlanan toplam ısı miktarına kıyasla küçük olmalıdır.
Isı kapasitesini belirlemek için en doğru yöntemlerden biri adyabatik kalorimetre yöntemidir. Bu tip kalorimetrelerde ısı kayıplarını hesaba katma ihtiyacı ile ilgili zorluklar, ölçümlerin termal denge koşulları altında, yani incelenen numunenin ve numuneyi çevreleyen bloğun eşit sıcaklıkları koşulları altında yapılması gerçeğiyle ortadan kalkar. . Bu yöntemin avantajları, yüksek doğrulukla birlikte, katıların ısı kapasitesini geniş bir sıcaklık aralığında belirleme olasılığını da içerir; bu, özellikle maddeler faz dönüşümlerine maruz kalıyorsa önemlidir.
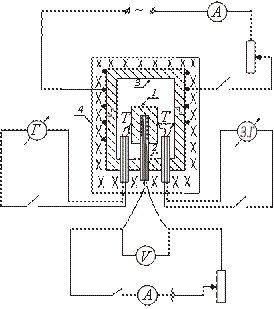
Adyabatik kalorimetre türlerinden birinin cihazı şekilde şematik olarak gösterilmiştir. Test numunesi 1 bakır blok 3'e yerleştirilir ve bununla birlikte fırın 4'te ısıtılır. Numunenin içine ısıtıcı 2 yerleştirilir, bu da numunenin ilave olarak ısıtılmasını sağlar.
Numuneli bloğun yerleştirildiği fırın 4'ü açtıktan sonra, numunenin sıcaklığı yükselmeye başlar ve bloğun sıcaklığının altında kalır. Numune ve bloğun sıcaklıkları arasında eşitlik sağlamak için numunenin içine yerleştirilmiş ısıtıcıyı açın. Numune sıcaklığı blok sıcaklığının biraz üzerinde olduğunda dahili ısıtıcı kapatılır.
Daha sonra bu ısıtıcı periyodik olarak açılıp kapatılır, böylece numune ile blok arasındaki sıcaklık farkı her zaman işaret değiştirir.
Sıfıra eşit olduğu anda (dahili ısıtıcı açıkken), numune ile blok arasında ısı alışverişi yoktur ve dahili ısıtıcı tarafından salınan ısının tamamı sadece numunenin ısıtılması için harcanır; bu durumda özgül ısı formül (2) ile belirlenebilir.
Dahili ısıtıcı tarafından salınan ısı miktarı aşağıdaki formülle belirlenir:
nerede ben dahili ısıtıcının akımı;
V, üzerindeki voltaj düşüşüdür;
- sıcaklığın arttığı zaman aralığı.
O zamanlar
(4)
Numunenin sıcaklığının değiştiği süre .
Diferansiyel formda, formül (4) şu şekildedir:
(5)
Numunenin sıcaklığı bir T termokupl ile ölçülür.Blok ile numune arasındaki sıcaklık farkı bir diferansiyel termokupl ile ölçülür. Numune sıcaklığını belirlemek için, bir termokupl kalibrasyon eğrisi T kullanılır.Blok ve numune arasındaki sıcaklık farkı, galvanometre ölçeğinin bölümlerinde belirlenir (çünkü sadece blok ve blok arasındaki sıcaklık farkının olduğu anı sabitlemek gerekir). örnek değişiklik işareti).
İşin tamamlanması.
Numune, bakır bir blok içine yerleştirilmiş bir ısıtıcıya konur. Termokupl bağlantıları T ve numuneye ve bloğa bağlanır. Fırın bir kapakla kapatılır. Bloğun yerleştirildiği fırının elektrik sargısı açılır. Numune içerisine yerleştirilen ısıtıcı periyodik olarak açılıp kapatılır ve dahili ısıtıcının devresine I ve V değerleri kaydedilir.
Ölçümlere başlamadan önce aynalı galvanometrenin sıfır konumunu kontrol etmek gerekir. Bunu yapmak için, termokuplun galvanometreden bağlantısını keserek tavşanın ölçek boyunca dalgalanmayı durdurmasını beklerler. Bundan sonra ipliğin görüntüsü sıfırla çakışmazsa, ölçeği hareket ettirerek bu çakışma elde edilir.
T ve zamana bağlı bağımlılık eğrileri çizilir.
T(t) eğrisinin işaret değiştirdiği noktadaki eğiminden (yani, termal denge kurulduğunda) özgül ısı formül (5) kullanılarak hesaplanır. Bu ısı kapasitesi, blok ve numune arasındaki sıcaklık farkının işaret değiştirdiği anda T(t) eğrisinden okunacak sıcaklığa atıfta bulunur.
