Metodă de determinare a capacității termice a unui corp solid
Ce este CAPACITATEA DE CALDURA
Când este furnizată căldură, temperatura sistemului crește. În cazul unei schimbări infinit de mici a temperaturii, proporționalitatea este valabilă
dT=δQ, sau dT=constδQ
Este mai convenabil să scrieți această relație sub forma: δQ=СdT sau
Valoarea C se numește adevărata capacitate termică a sistemului.
Capacitatea termică este raportul dintre cantitatea de căldură furnizată sistemului și schimbarea temperaturii care are loc.
În plus față de adevărat, există și o capacitate medie de căldură:
Capacitate termica
Dacă capacitatea termică este atribuită unei unități de masă (mol) a unei substanțe, atunci aceasta devine independentă de masa întregului sistem și dobândește proprietățile unui parametru intensiv. Dacă capacitatea termică se referă la o unitate de masă a unei substanțe, se numește specifică, iar la 1 mol - capacitatea termică cu dimensiunea J / (mol * k)
Vom lua în considerare numai capacitățile de căldură molare, deoarece pentru ei, toate regularitățile sunt mult mai simple decât pentru capacitatea termică specifică.
Capacitatea termică depinde de condițiile în care are loc transferul de căldură către sistem. Dacă sistemul este închis într-un volum constant, atunci o creștere a temperaturii cu dT va avea loc sub acțiunea căldurii egală cu CvdT, unde Cv este capacitatea termică la volum constant. În cazurile de presiune constantă în timpul expansiunii sistemului, pentru a crește temperatura cu dT, va fi necesară căldura CpdT, unde Cp este capacitatea termică la presiune constantă.
Având în vedere condițiile de transfer de căldură, atunci când una sau mai multe variabile sunt menținute constante, în timp ce altele se modifică, capacitatea termică poate fi exprimată folosind derivate parțiale: ![]() . Deoarece δQ v = dU,
. Deoarece δQ v = dU,
δQ p =dH, putem scrie:
![]() (1)
(1)
Cv este capacitatea termică izocoră a gazelor, Cp este capacitatea termică izobară a gazelor.
Diferențele dintre capacitățile termice izocorice și izobare se datorează diferenței de energie internă și de entalpie. Modificările entalpiei și ale energiei interne diferă în funcție de cantitatea de muncă efectuată de sistem.
δW=∆nRT, ∆H-∆U=∆nRT
Prin urmare, capacitățile termice la volum constant Cv și presiune constantă Cp diferă și prin cantitatea de lucru: Cp - Cv = δW
Pe baza expresiilor (1), putem scrie:
Înlocuirea acestor egalități în ecuația ∆H- ∆U=∆nRT
și ținând cont de faptul că ∆n= 1, vom găsi relația dintre capacitățile termice molare ale gazelor:
Cp– Cv= R sau Cp= Cv+ R
După cum se poate observa, ele diferă prin valoarea constantei gazului.
Din condiția Cp= Cv+ R rezultă că Cp˃Cv, adică într-un proces izobaric, când P=const, pentru a crește temperatura sistemului, se cere cantitate mare căldură decât într-un proces izocor.
Capacitatea termică molară a gazelor are valori de ordinul lui R, deci diferența dintre Cp și Cv este foarte semnificativă. Deci, pentru dioxid de carbon CO 2 la 25 0 C Cp = 37, 14 și Cv = 28,83 J / (mol * K)
Diferența Cp - Cv este opera expansiunii izobare a unui mol gaz ideal când temperatura crește cu un grad. Lichidele și solidele corpului se caracterizează printr-o ușoară creștere a volumului atunci când sunt încălzite. Prin urmare, pentru corpurile condensate, putem presupune că Ср ≈ Сv.
ECUAȚIA KIRCHHOFF. DEPENDENȚA EFECTELOR TERMICE DE TEMPERATURĂ.
Calculele considerate anterior ale efectelor termice bazate pe legea Hess pentru căldura de formare și ardere sunt limitate de condiții standard. În scopuri practice, este necesar să se calculeze efectele termice pentru condiții specifice, altele decât cele standard.
Treceți de la efectele termice cunoscute în condiții standard, de exemplu. la o temperatură de 25 0 C (298,15 K) şi o presiune de 1 atm. (1,013 * 10 5 Pa), este posibil să se calculeze efectele termice la orice temperatură de interes pentru noi folosind legea lui Kirchhoff. Procesele în condiții industriale se caracterizează printr-o variație semnificativă de temperatură, a cărei gamă este determinată nu numai de condițiile tehnologiei, ci și de sezon.Acest interval poate ajunge la sute de grade - este firesc ca efectele termice să fie semnificativ diferite și depind de temperatură.
Luați în considerare legea lui Kirchhoff în formă diferențială. Pentru a face acest lucru, notăm modificările de entalpie în energia izobară și internă în procesele izocorice.
∆H \u003d H2-H1; ∆U \u003d U 2 -U 1.
Diferențiați aceste ecuații în funcție de temperatură și obțineți:
Ecuații Kirchhoff:

Și - coeficienții de temperatură ai efectului termic al proceselor izobare și, respectiv, izocorice; și - modificarea capacității termice a sistemului ca urmare a proceselor izobare și, respectiv, izocorice.
Pe baza ecuației Kirchhoff, legea Kirchhoff este formulată în formă diferențială: coeficientul de temperatură al efectului termic al procesului este egal cu modificarea capacității termice a sistemului care are loc ca urmare a acestui proces.
Astfel, legea lui Kirchhoff în formă diferențială face posibilă determinarea doar a modificării efectului termic cu temperatura, și nu a mărimii efectului termic în sine.
Să analizăm ecuația lui Kirchhoff
Pentru reacția: aA + bB = dD + rR într-un proces izobaric (р=const), conform legii Kirchhoff, modificarea capacității termice în sistem va avea forma:
O expresie similară poate fi obținută pentru un proces izocor:
Deoarece legea lui Kirchhoff vă permite să determinați modificările efectului termic al procesului cu o schimbare a temperaturii, construim un grafic:
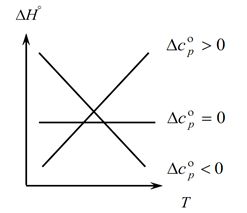
1. Considerăm primul caz, când ∆Ср(∆Сv)˃0, deoarece ∆Ср=∑С con. -∑С initial, de unde rezulta ca suma capacitatilor termice ale produselor de reactie este mai mare decat suma capacitatilor termice ale substantelor de pornire: ∑С con. ˃∑De la început În acest caz, obținem curba 1 pe grafic, ceea ce înseamnă că pe măsură ce temperatura crește, crește și modificarea efectului termic al procesului (T și ∆H);
2. Al doilea caz, când ∆Ср(∆Сv)˂0. Similar cu prima lege, avem ∑С con. ˂∑De devreme (suma capacităților termice ale produselor finite este mai mică decât suma capacităților termice ale substanțelor inițiale). Apoi obținem o curbă pe grafic, ceea ce înseamnă că odată cu creșterea temperaturii, modificarea efectului termic al procesului scade (Т→∆H↓)
3. Și al treilea caz, când modificarea capacităților termice ale sistemului este egală cu zero ∆Ср(∆Сv)=0. Atunci suma capacităților termice ale produselor finale ale reacțiilor este egală cu suma capacităților termice ale materiilor prime ∑С con. \u003d ∑ De la început. În acest caz, efectul termic al reacției nu este o funcție de temperatură (∆H ≠ f(T)) și obținem o linie dreaptă pe grafic.
CALCULUL EFECTELOR TERMICE PENTRU UN DAT
TEMPERATURA. INTEGRAREA ECUAȚIEI KIRCHHOFF
Pentru a găsi valoarea efectului termic în funcție de temperatură, este necesar să se integreze ecuațiile

De la T la T 0 (unde T este temperatura necesară, T 0 este temperatura standard), de la ∆H la ∆H 0 sau de la ∆U la ∆U 0 (unde ∆H și ∆U sunt entalpia și energia internă sub condiţii care diferă de standard). Integrarea se realizează în două cazuri:
Pentru nu materie organică: Pentru substanțele organice:
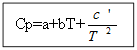
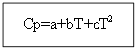
Exemplu: pentru H 2 (g) - substanță anorganică
| Ср=f(T) | T | |||
| A | b*10 3 | c’*10 -5 | 289-3000 | |
| 27,28 | 3,26 | 0,50 | ||
Cp (H2 (g)) \u003d 27,28 + 3,26 * 10 -3 T +.
A) Integrare aproximativă:
pentru procesul izobar
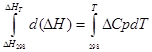
∆H T - ∆H 298 =∆Cp*(T-298)
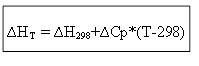
pentru procesul izocor:
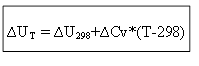
Astfel, pentru a determina efectul termic ∆H sau energia internă ∆U la orice temperatură T, este necesar să se cunoască căldura procesului în condiții standard ∆H 0 (∆U 0) și modificarea capacităților termice ∆Ср, ∆ CV.
Exemplu. Calculați efectul termic ∆H al procesului de obținere a benzenului din acetilenă:
3C2H2 (g) → C6H6 (g) la 75°C (348K).
1. Găsim din tabele capacitățile termice izobarice medii ale benzenului și acetilenei:
Ср С6Н6 (g) \u003d 81,67 J / (mol * K);
Cp C2H2 (g) \u003d 43,93 J / (mol * K).
2. Găsim modificarea capacității termice a procesului:
∆Cp \u003d ∑ (nCp) con - ∑ (nCp) inițial \u003d Cp C6H6 (g) - 3 * Cp C2H2 (g) \u003d 81,67 - 3 * 43,93 \u003d - 50,12 K. / (mol)
3. Conform datelor tabelare, constatăm efectul termic în condiții standard:
∆H 0 \u003d ∆H 0 arr C6H6 (g) - ∆H 0 arr C2H2 (g) \u003d 82,93 - 3 * 226,73 \u003d - 597,26 kJ / mol
4. Găsiți efectul termic la o temperatură dată:
∆H = ∆H 0 + ∆Ср (Т-Т 0) = - 597,26 * 10 3 + (-50,12) * (348- 298) = -599766 J / mol
b) Integrare exactă:
Să luăm în considerare al doilea caz, mai complicat, când modificarea capacității termice depinde de temperatură, adică. Ср=f(T), Cv=f(T).
Să ne întoarcem la ecuația reacției în formă generală
dD + rR = qQ + pP
| A | b*10 3 | c’*10 -5 | C*10 6 | |
| D | + | + | - | + |
| R | + | + | + | - |
| Q | + | + | + | - |
| P | + | + | + | - |
∆a=q*a(Q) + p*a(P) -;
∆b=q*b(Q) + p*b(P) -;
∆c’= q*c’(Q) + p*c’(P) - ;
![]()
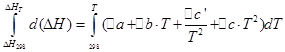
Vom efectua aceleași operații pentru procesul izocor:
Căldura de dizolvare
Se numește modificarea entalpiei în timpul tranziției unei substanțe solide, lichide sau gazoase într-o soluție termica sau entalpia de dizolvare.
Căldura de dizolvare include, în general, căldura de distrugere a rețelei cristaline (de exemplu solide), ionizare și solvatare.
Pentru a rupe legătura dintre ionii unei sări cristaline, este nevoie de energie, adică. în timp ce căldura este absorbită. În același timp, în soluția apoasă are loc hidratarea ionică; se formează o legătură între ionii şi moleculele de H 2 O. Semnul căldurii de dizolvare este determinat de procesul care este energetic mai pronunţat.
LiBr: ∆H dist = - 49,02 kJ / mol - se eliberează căldură
KCl: ∆H dist = 7,23 kJ/mol - se absoarbe căldură
Distinge: căldura integrală de dizolvare este căldura care este eliberată sau absorbită atunci când 1 mol dintr-o substanță dată este dizolvat pentru a forma o soluție de o concentrație dată. Căldura integrală de dizolvare variază în funcție de cantitatea de substanță dizolvată.
Distinge: căldură diferențială de dizolvare - aceasta este căldura care însoțește dizolvarea a 1 mol dintr-o substanță dată la infinit volum mare soluție a acestei substanțe. Călzirile integrale sunt utilizate pe scară largă în calcularea căldurilor de formare și a celorlalte reacții conform legii Hess. Căldura diferențială de dizolvare caracterizează proprietățile termodinamice ale soluțiilor și procesul de formare a acestora.
LAB #8
DETERMINAREA CAPACITĂȚII DE CĂLDURĂ A CORPURILOR SOLIDE
Instrumente si accesorii: configurație experimentală FPT1-8.
Obiectiv: determinarea capacităţii termice a probelor de metal prin metoda calorimetrică prin încălzire electrică.
Scurtă teorie
Capacitatea termică specifică a unei substanțe - o valoare egală cu cantitatea de căldură necesară pentru a încălzi 1 kg dintr-o substanță cu 1 K:
Capacitate de căldură molară - o valoare egală cu cantitatea de căldură necesară pentru a încălzi 1 mol de substanță la 1 K:
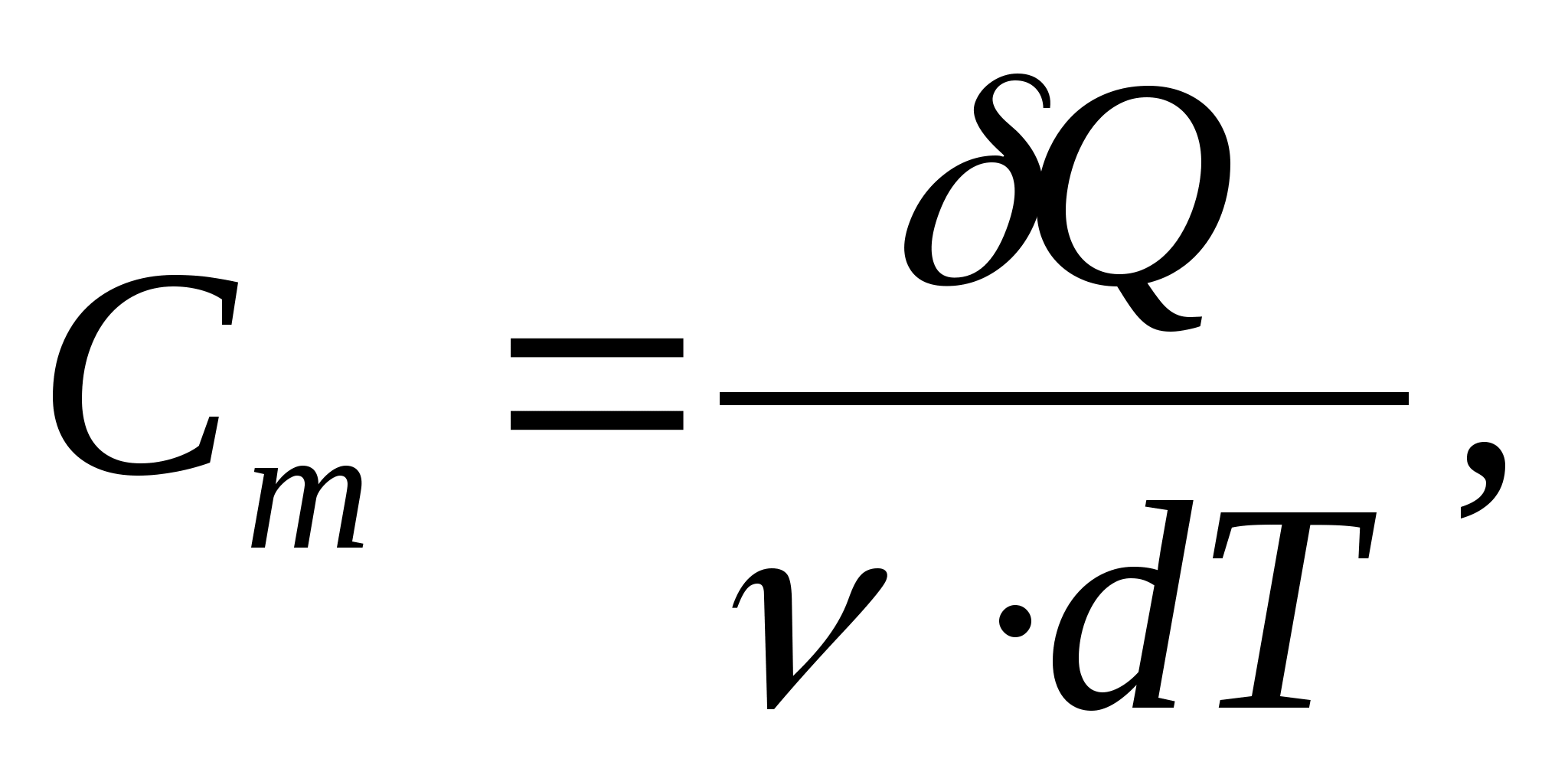
Unde 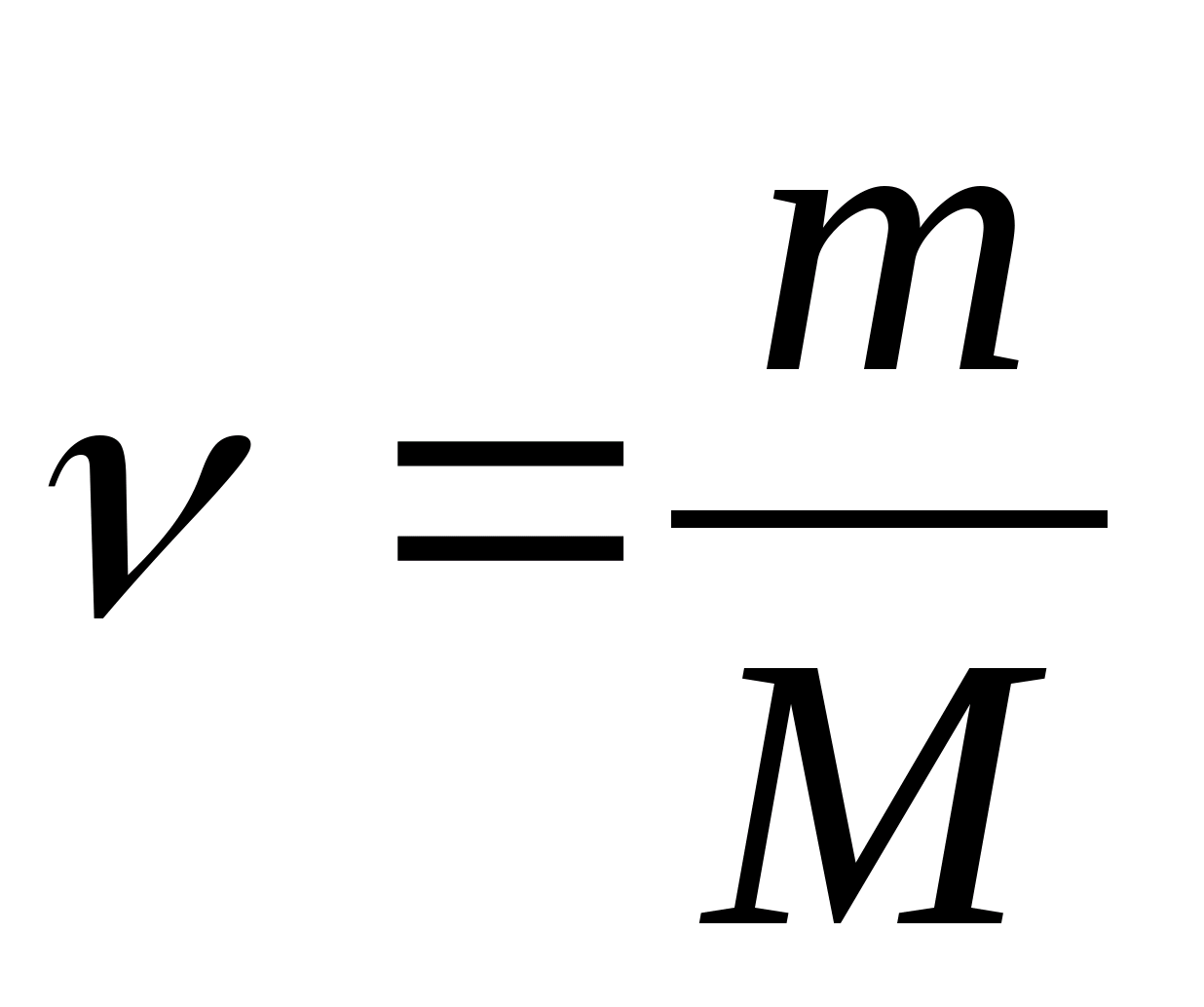 − cantitatea de substanţă.
− cantitatea de substanţă.
Căldura specifică c asociat cu molar C m raport

Unde M este masa molară a substanței.
Distinge capacitatea termică la volum constantși presiune constantă, dacă în procesul de încălzire a unei substanțe volumul sau presiunea acesteia este menținută constantă.
Se numește cel mai mic număr de variabile independente (coordonate) care determină complet poziția sistemului în spațiu numărul de grade de libertate .
Conform legii lui Boltzmann privind distribuția uniformă a energiei pe gradele de libertate ale moleculelor, fiecare grad de libertate de translație și rotație are o energie cinetică medie egală cu
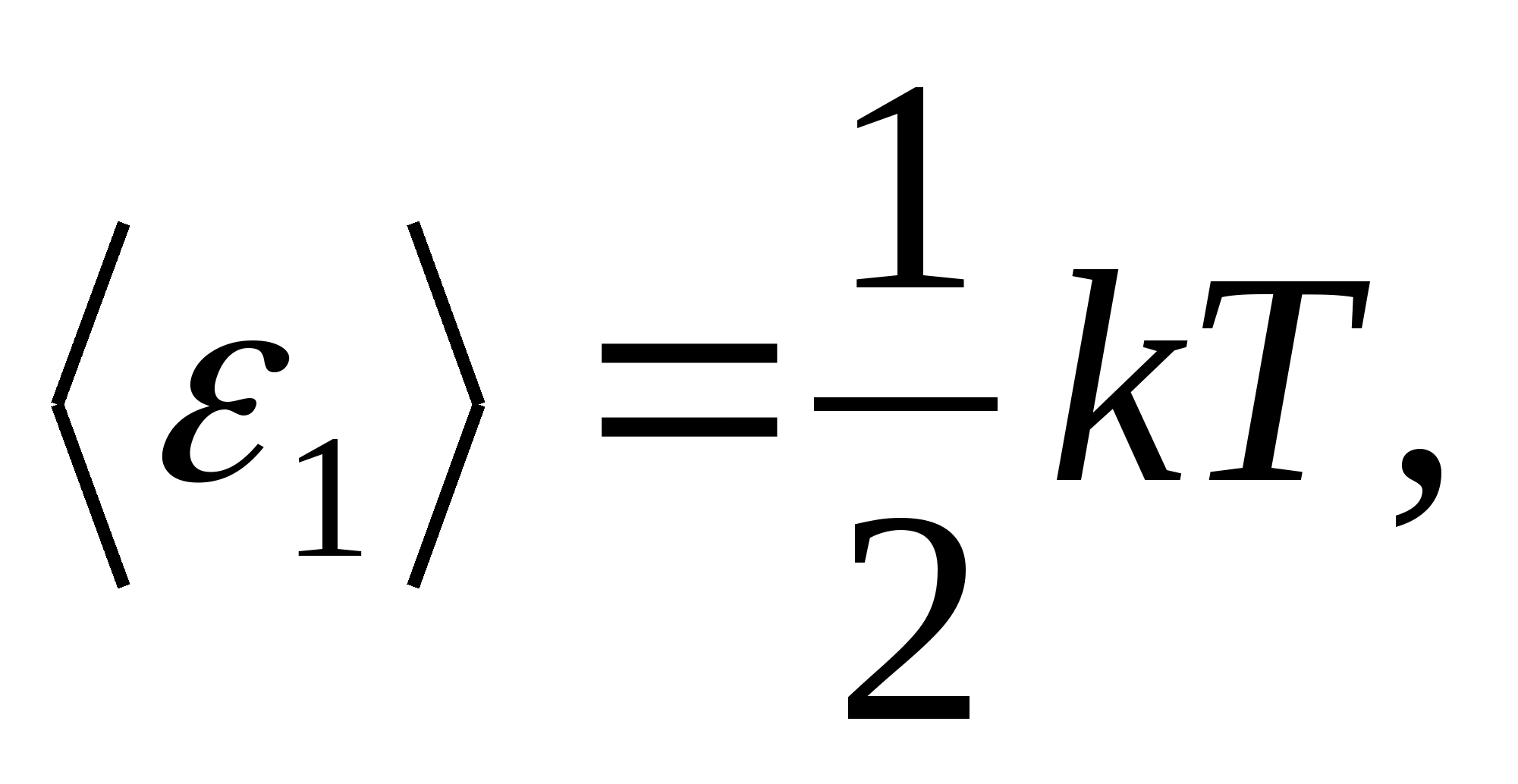
(Unde k este constanta Boltzmann), iar pentru fiecare grad de libertate vibrațional, în medie, energia egală cu
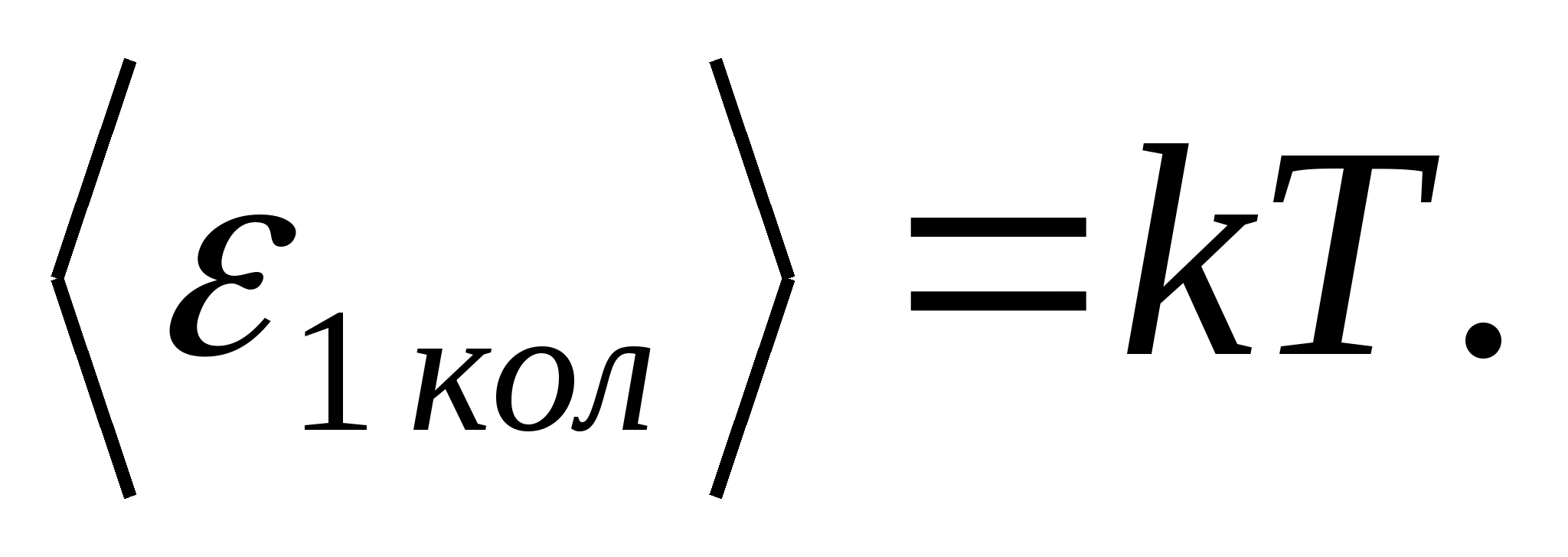
Astfel, energia medie a unei molecule
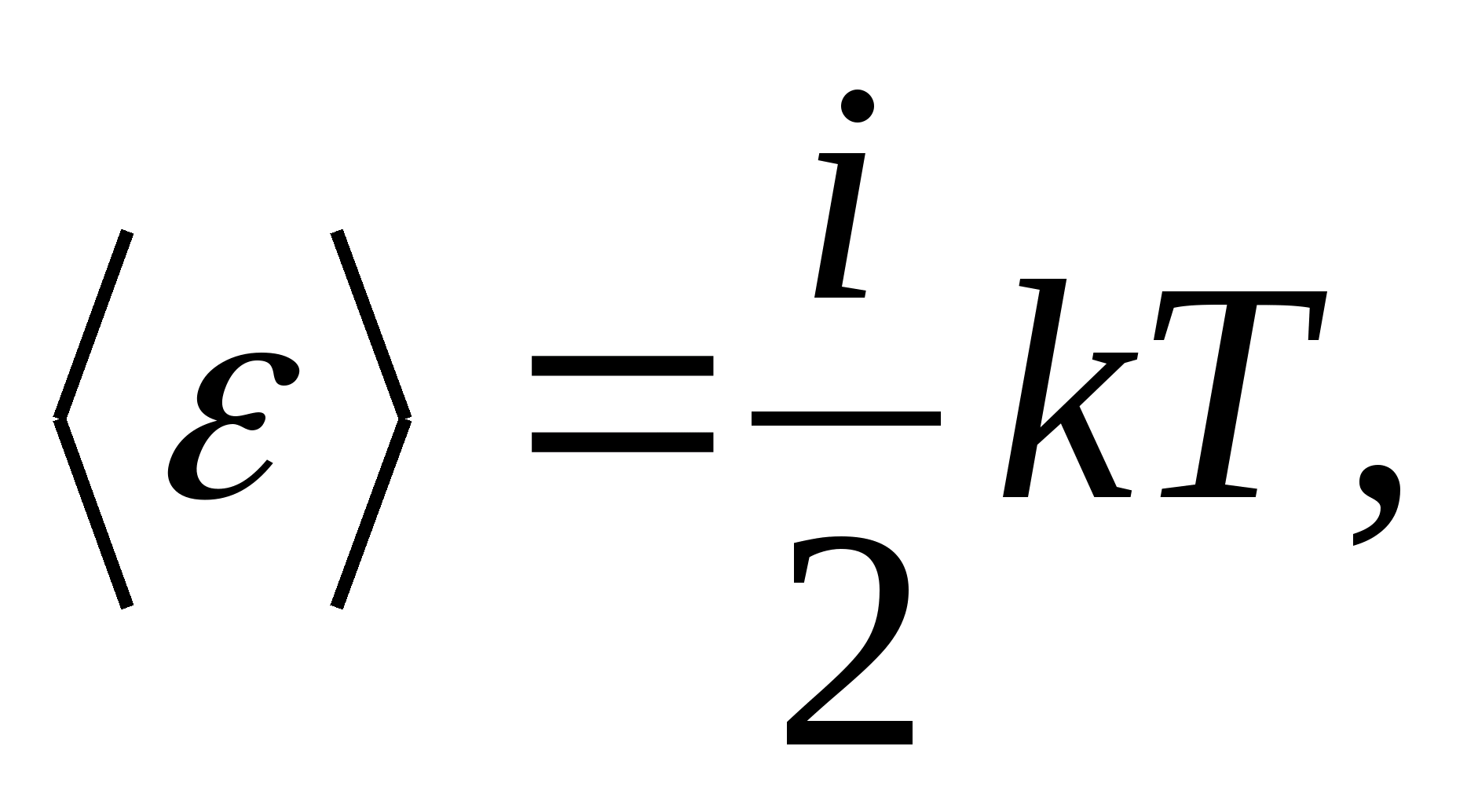
Unde i este suma numărului de translație, a numărului de rotație și de două ori a numărului de grade de libertate vibraționale ale moleculei:
![]()
De exemplu, energia cinetică medie a moleculelor de gaz ideal monoatomic ( 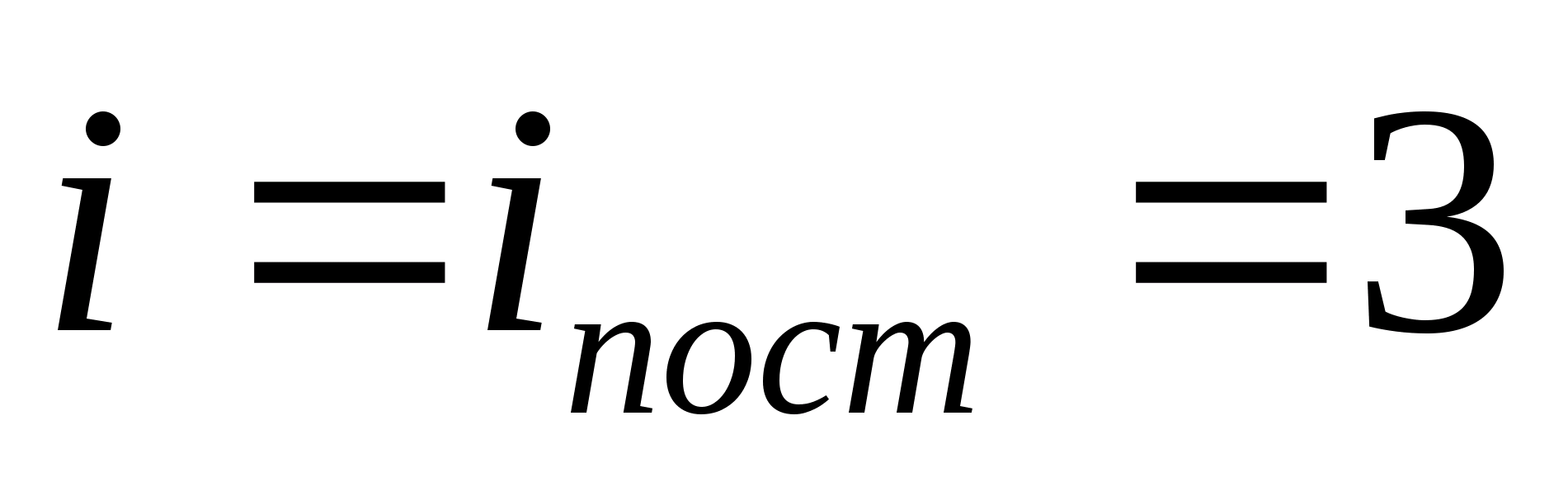 ) este egal cu
) este egal cu
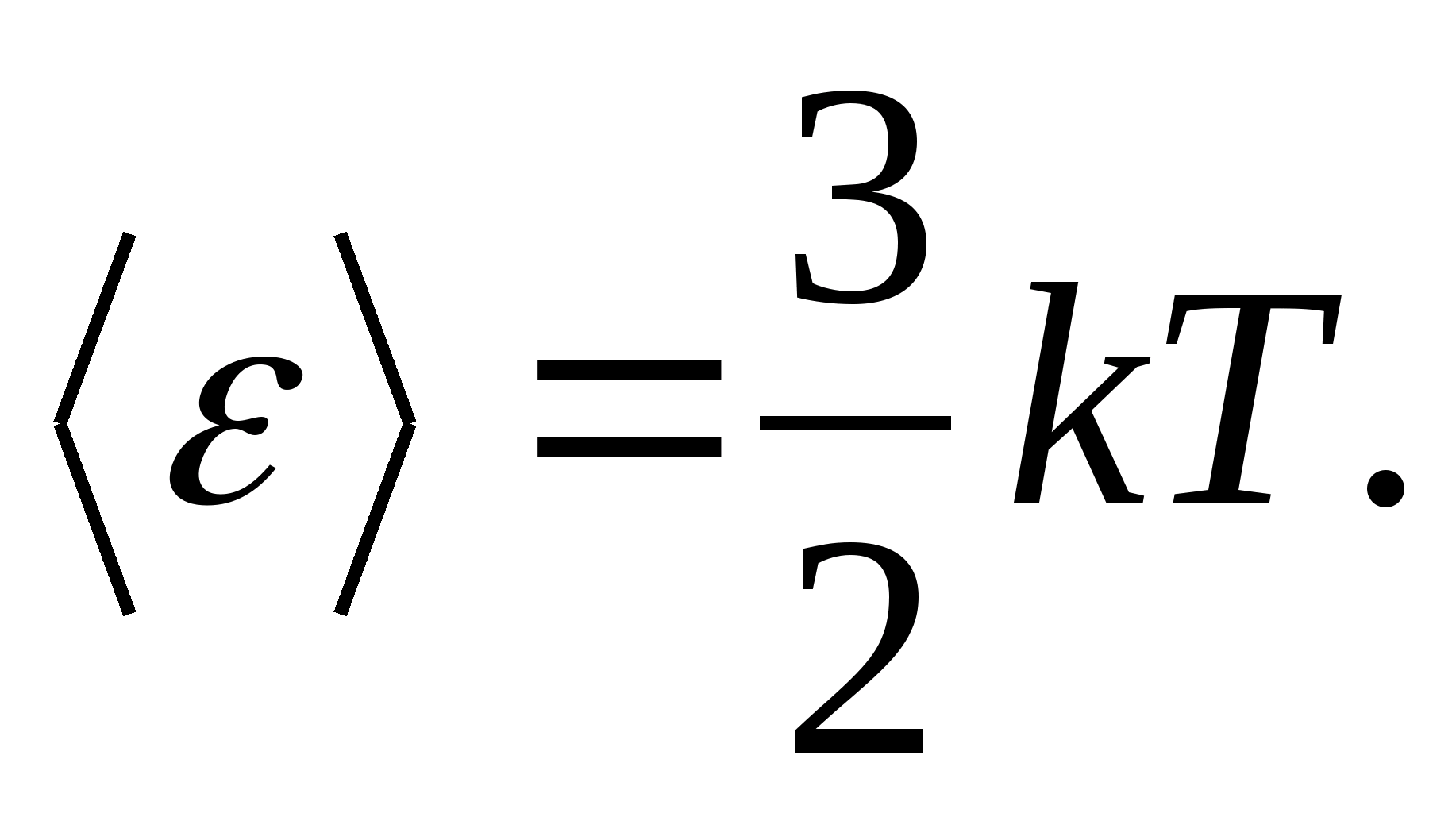
La fel de modele a unui corp solid, luați în considerare o rețea cristalină corect construită, în nodurile căreia particulele (atomi, ioni, molecule) sunt luate ca puncte materiale, oscilează în jurul pozițiilor lor de echilibru - noduri de zăbrele -în trei direcții reciproc perpendiculare. Astfel, fiecărei particule care constituie rețeaua cristalină i se atribuie trei grade vibraționale de libertate, fiecare dintre acestea, conform legii privind distribuția uniformă a energiei pe grade de libertate, are energia kT.
Apoi valoarea medie a energiei totale a particulei în timpul mișcării oscilatorii în rețeaua cristalină
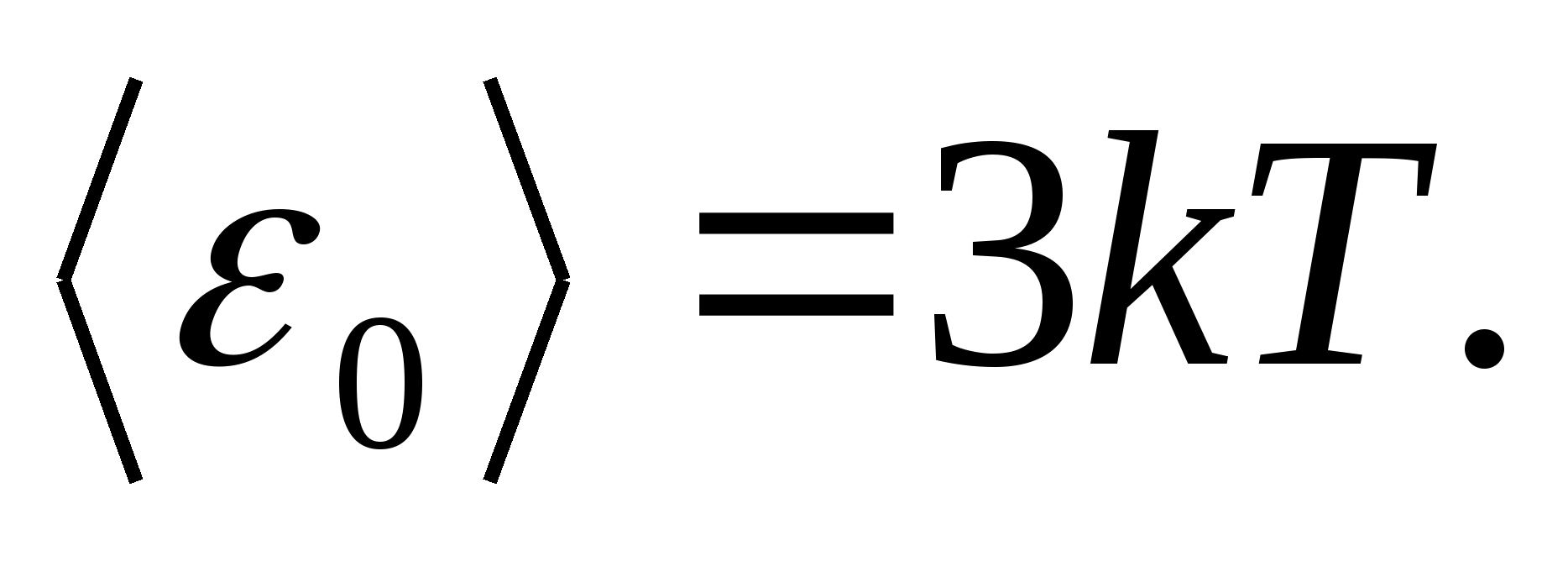
Energia internă totală a unui mol dintr-un corp solid se obține prin înmulțirea energiei medii a unei particule cu numărul de particule care vibrează independent conținute într-un mol, adică. la constanta Avogadro N A :
Unde R=N A k este constanta universală (molară) a gazului, R= 8,31 J/(molK).
Pentru solide, datorită coeficientului mic de dilatare termică, capacitățile termice la presiune constantă și volum constant practic nu diferă. Prin urmare, ținând cont de (8.1), capacitatea de căldură molară a unui solid
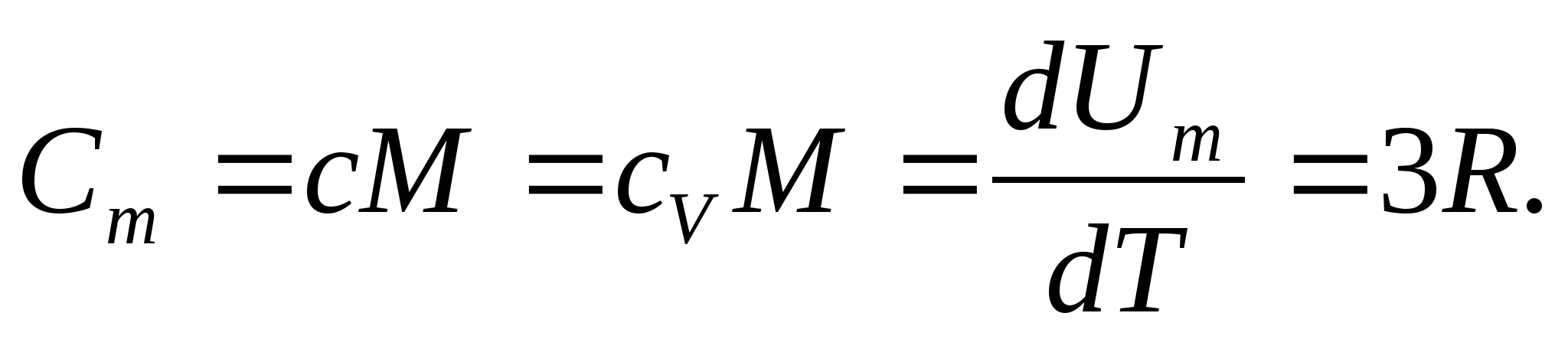 (8.2)
(8.2)
Înlocuind valoarea numerică a constantei molare a gazelor, obținem:
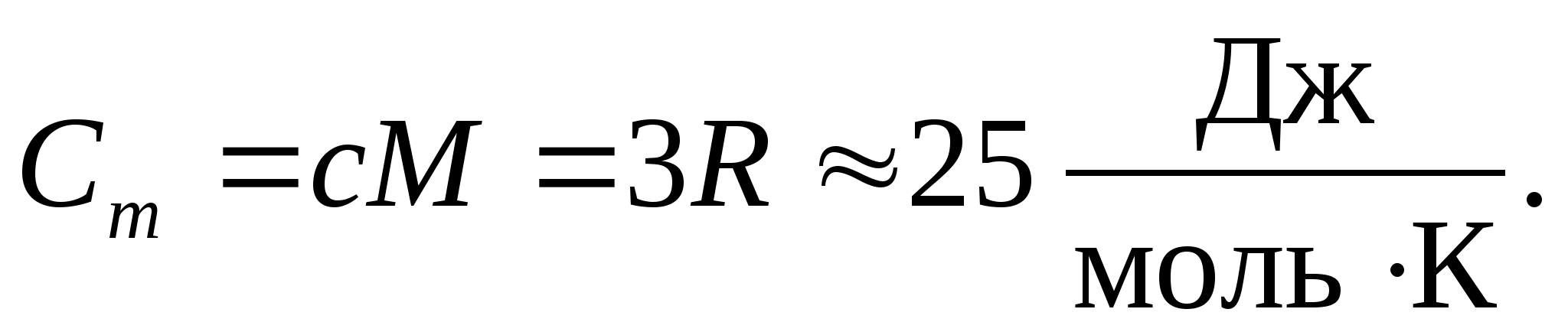
Această egalitate se menține la o aproximare destul de bună pentru multe substanțe la temperatura camerei și se numește Legea Dulong și Petit : capacitatea de căldură molară a tuturor cristalinelor simple din punct de vedere chimic solide aproximativ egal cu 25 J/(mol LA). Pe măsură ce temperatura scade, capacitățile termice ale tuturor solidelor scad, apropiindu-se de zero la T0. Aproape de zero absolut, capacitatea de căldură molară a tuturor corpurilor este proporțională cu T 3 și numai la o temperatură suficient de ridicată caracteristică fiecărei substanțe egalitatea (8.2) începe să se mențină. Aceste caracteristici ale capacităților termice ale solidelor la temperaturi scăzute pot fi explicate folosind teoria cuantică a capacității termice creată de Einstein și Debye.
Pentru a determina experimental capacitatea termică, corpul studiat este plasat într-un calorimetru, care este încălzit de un curent electric. Dacă temperatura calorimetrului cu proba de testat crește foarte lent față de cea inițială T de la 0 la T, atunci energia curentului electric va fi folosită pentru a încălzi proba și calorimetrul:
Unde euși U− curentul și tensiunea încălzitorului; − timpul de încălzire; m 0 și m sunt masele calorimetrului și ale probei de testat, Cu 0 și Cu− capacități termice specifice ale calorimetrului și probei de testare, Q− pierderi de căldură la izolația termică a calorimetrului și la spațiul înconjurător.
Pentru a exclude din ecuația (8.3) cantitatea de căldură consumată la încălzirea calorimetrului și pierderea de căldură în spațiul înconjurător, este necesar, la aceeași putere a încălzitorului, să se încălzească calorimetrul gol (fără probă) de la temperatura inițială. T 0 pentru aceeași diferență de temperatură T. Pierderea de căldură în ambele cazuri va fi aproape aceeași și foarte mică, dacă temperatura carcasei de protecție a calorimetrului în ambele cazuri este constantă și egală cu temperatura camerei:
Ecuațiile (8.3) și (8.4) implică
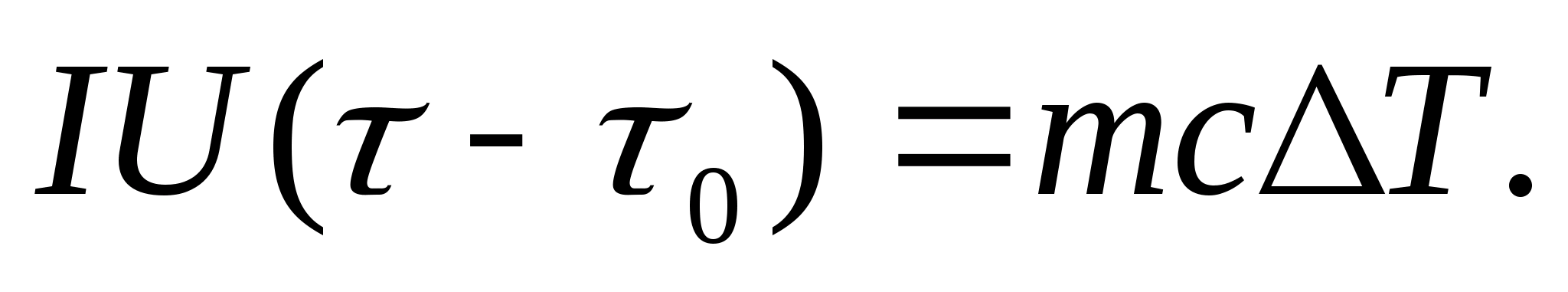 (8.5)
(8.5)
Ecuația (8.5) poate fi utilizată pentru a determina experimental capacitatea termică specifică a materialului probei de testat. Prin modificarea temperaturii calorimetrului, este necesar să se grafice dependența diferenței de timp de încălzire de modificarea temperaturii probei de testat: (
−
0)=f(T), conform coeficientului unghiular al căruia 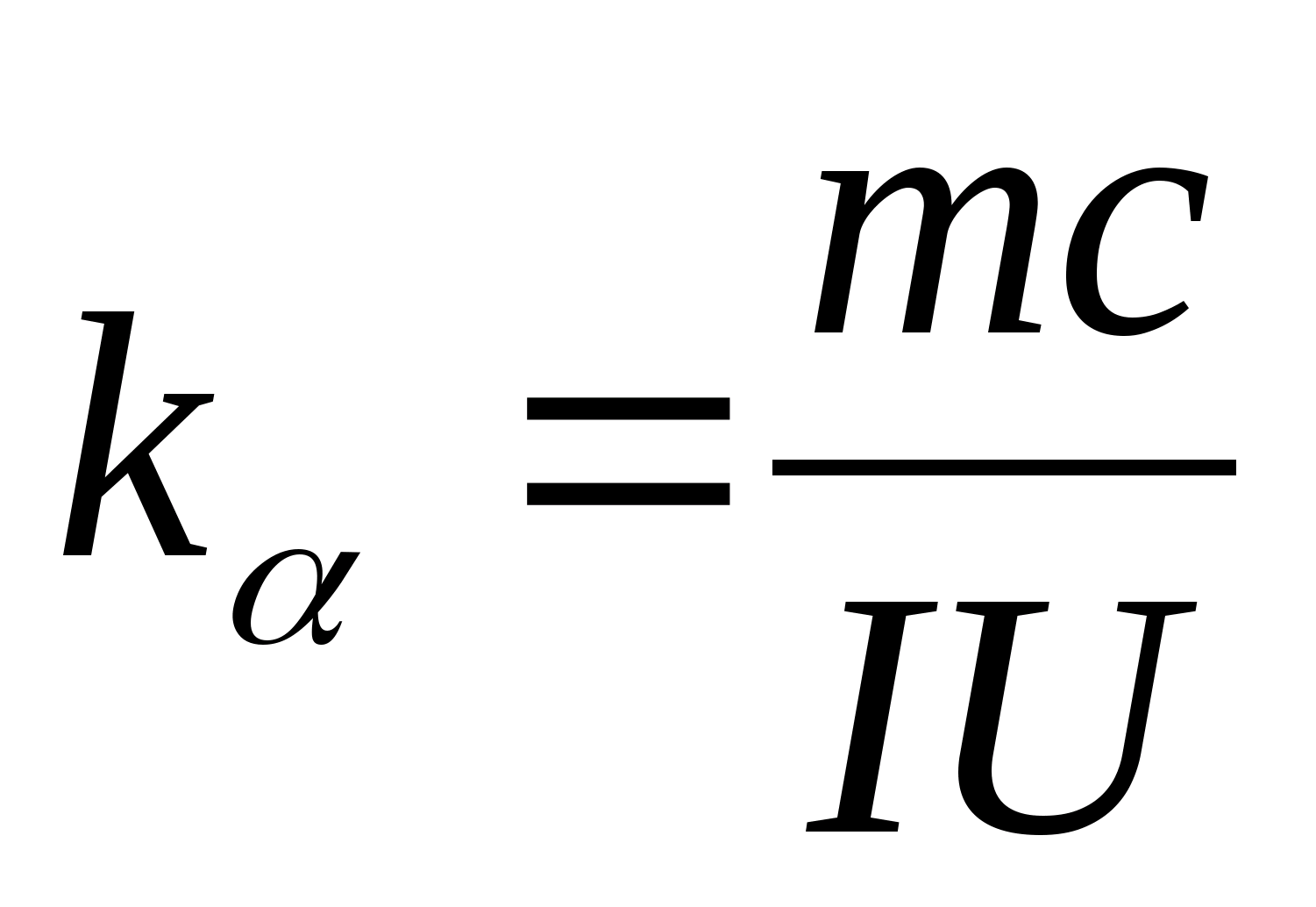 se poate determina capacitatea termică specifică a probei.
se poate determina capacitatea termică specifică a probei.
Descrierea configurației laboratorului
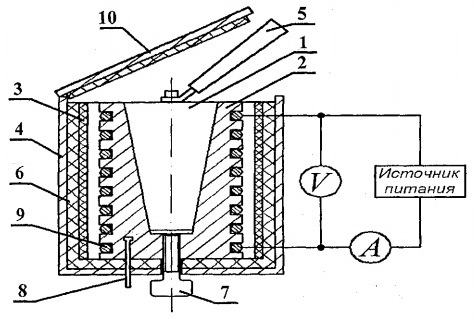
Pentru a determina capacitatea termică a solidelor, este proiectată configurația experimentală FPT1-8, a cărei vedere generală este prezentată în Fig. 8.1. Instalația constă din trei părți principale: unitatea instrumentală 1, unitatea elementului de operare 2 și rack 3.
Pe panoul frontal al unității de comandă 1 se află: comutatorul basculant „NETWORK”, care conectează unitatea la rețeaua de alimentare cu tensiune; comutator basculant „ÎNCĂLZIRE”, care pornește încălzitorul; regulatorul „ÎNCĂLZIRE”, cu ajutorul căruia se reglează puterea încălzitorului; voltmetru și ampermetru, care măsoară tensiunea și curentul în circuitul de încălzire; cronometru, care măsoară timpul de încălzire al calorimetrului. Cronometrul este activat când instrumentul este pornit.
Blocul elementului de lucru 2 este închis în față cu un ecran detașabil de la org. sticlă. La efectuarea lucrărilor, ecranul este atârnat pe peretele din spate al blocului elementului de lucru. Pe blocul panoului elementului de lucru se află un termometru digital 6 pentru măsurarea temperaturii. În partea de jos, în cuiburi, se află 5 probe de testare din diverse materiale și un mâner pentru introducerea probelor în încălzitor.
Încălzitorul 4 constă dintr-o carcasă metalică, material termoizolant și un calorimetru.

Probele sunt încălzite într-un calorimetru, a cărui schemă este prezentată în Fig. 8.2.
Calorimetrul este o carcasă de alamă 2 cu orificiu conic, în care se introduce proba de testare 1. Pe suprafața exterioară a carcasei, în caneluri speciale este plasată o bobină de încălzire 9. În exterior, carcasa calorimetrului este izolată termic cu straturi de azbest. 3 și fibră de sticlă 6 și închis cu o carcasă de aluminiu 4. Calorimetrul este închis cu un capac termoizolant 10. După terminarea experimentului, proba poate fi împinsă în afara orificiului conic al corpului calorimetrului cu ajutorul șurubul 7. Pentru a scoate proba încălzită din calorimetru și a instala proba în încălzitor, se folosește mânerul 5, situat într-o priză specială lângă probele studiate.
Temperatura calorimetrului este măsurată de un termometru digital, al cărui senzor de temperatură 8 se află în carcasa 2 a calorimetrului.
Siguranță
La efectuarea lucrărilor se respectă cerințele generale de siguranță din laboratorul de mecanică.
Comandă de lucru
ATENŢIE! Calorimetrul durează mult să se răcească, deci după măsurarea tuturor valorilor de timp 0 încălzirea unui calorimetru gol, opriți imediat încălzirea (vezi punctul 4 de mai jos). Temperatura maximă de încălzire pentru această unitate este de +44°С.
1. Scoateți capacul transparent al unității elementului de lucru al instalației și agățați-l de șuruburile panoului din spate. Setați butonul de control HEAT la minim. Porniți instalarea cu comutatorul comutator „NETWORK”.
2. Închideți bine capacul calorimetrului gol. Porniți comutatorul de comutare „ÎNCĂLZIRE”. Folosind regulatorul de încălzire, setați tensiunea la 10-20 V (cu cât tensiunea este mai mare, cu atât încălzirea este mai rapidă). Scrieți în tabel. 8.1 valori ale tensiunii selectate U si curent eu.
3. Pornind de la temperatura calorimetrului t 0 specificat de profesor, după un interval de 1С intra în tabel. 8.1 valori de timp 0 corespunzător fiecărei temperaturi atinse t.
4. Opriți comutatorul „HEAT”, deschideți capacul și răciți calorimetrul la temperatura inițială t 0 . Pentru a răci rapid calorimetrul, puteți coborî una dintre probe în calorimetru, cu excepția celei indicate de profesor (când instalați proba în calorimetru, rotiți șurubul din partea de jos a calorimetrului spre stânga). Temperatura va începe să scadă. Când viteza de răcire scade, scoateți proba încălzită și introduceți următoarea (rece), cu excepția celei indicate de profesor. Pentru a scoate proba, rotiți șurubul din partea de jos a calorimetrului spre dreapta (în sensul acelor de ceasornic), apoi trageți proba cu mânerul.
Tabelul 8.1
|
T= t− t 0 , |
= − 0 , |
J/(kgK) |
C m =CuM, J/(molK) |
||||||||
5. Rotind șurubul spre stânga, plasați una dintre probele de testare, prelevate conform instrucțiunilor profesorului, în calorimetru. Închideți bine capacul calorimetrului și așteptați 2-3 minute pentru ca calorimetrul și temperaturile probei să se egaleze.
6. Porniți comutatorul „HEAT” și setați aceeași tensiune în circuit ca atunci când încălziți calorimetrul gol.
7. Pornind de la aceeași temperatură inițială a calorimetrului t 0, după un interval de 1С intră în tabel. 8.1 valori de timp corespunzătoare fiecărei temperaturi atinse t.
8. Setați regulatorul „ÎNCĂLZIRE” în poziția extremă din stânga (la minim), opriți comutatorul „ÎNCĂLZIRE”, deschideți capacul calorimetrului. Pentru a scoate proba din calorimetru, rotiți șurubul spre dreapta, apoi scoateți proba încălzită folosind mânerul.
9. Opriți unitatea cu comutatorul comutator „NETWORK”.
10. Traduceți toate valorile cantităților 0 și în valori în secunde (fără minute) și introduceți-le în tabel. 8.1. Pentru fiecare linie a tabelului. 8.1 se calculează valorile lui = − 0 și T= t− t 0 .
11. Efectuați un calcul estimativ al capacității termice specifice a probei folosind formula 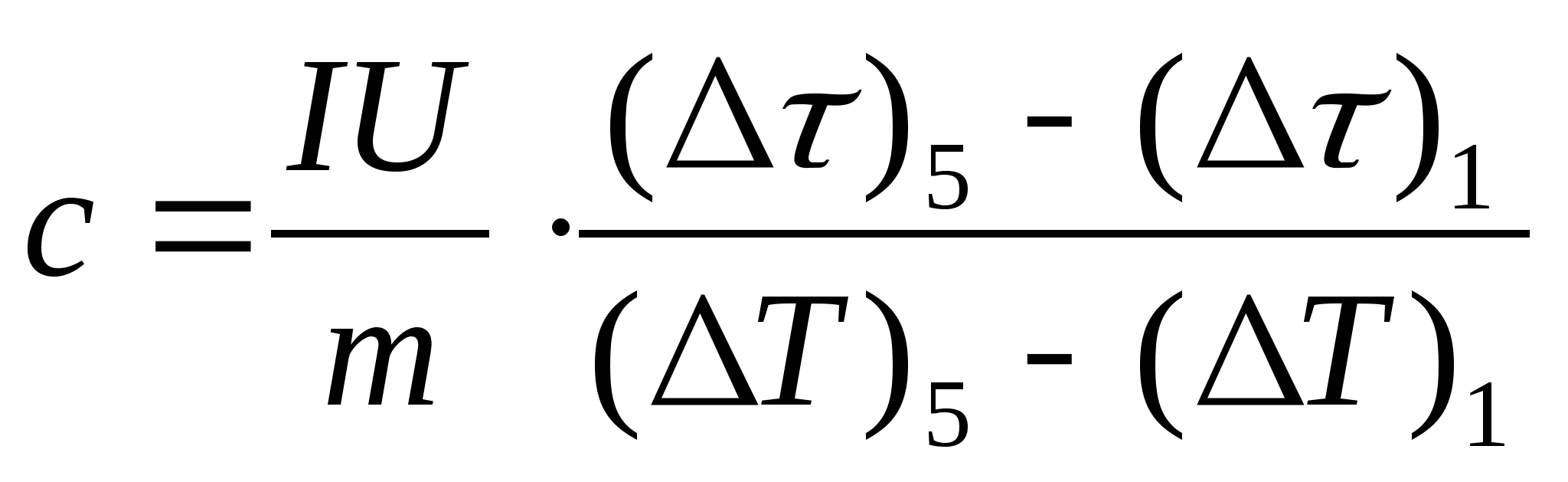 , unde masa probei m=139,5 g (alama) sau m=129,7 g (oțel) sau
m= 46,05 g (duralumin). Vino la profesor pentru verificare.
, unde masa probei m=139,5 g (alama) sau m=129,7 g (oțel) sau
m= 46,05 g (duralumin). Vino la profesor pentru verificare.
Prelucrarea rezultatelor măsurătorilor
1. Plot
=f(T) dependența diferenței de timp de încălzire a calorimetrului cu proba și calorimetrul gol de modificarea temperaturii calorimetrului, selectați oricare două puncte din grafic și determinați panta dreptei folosind formula 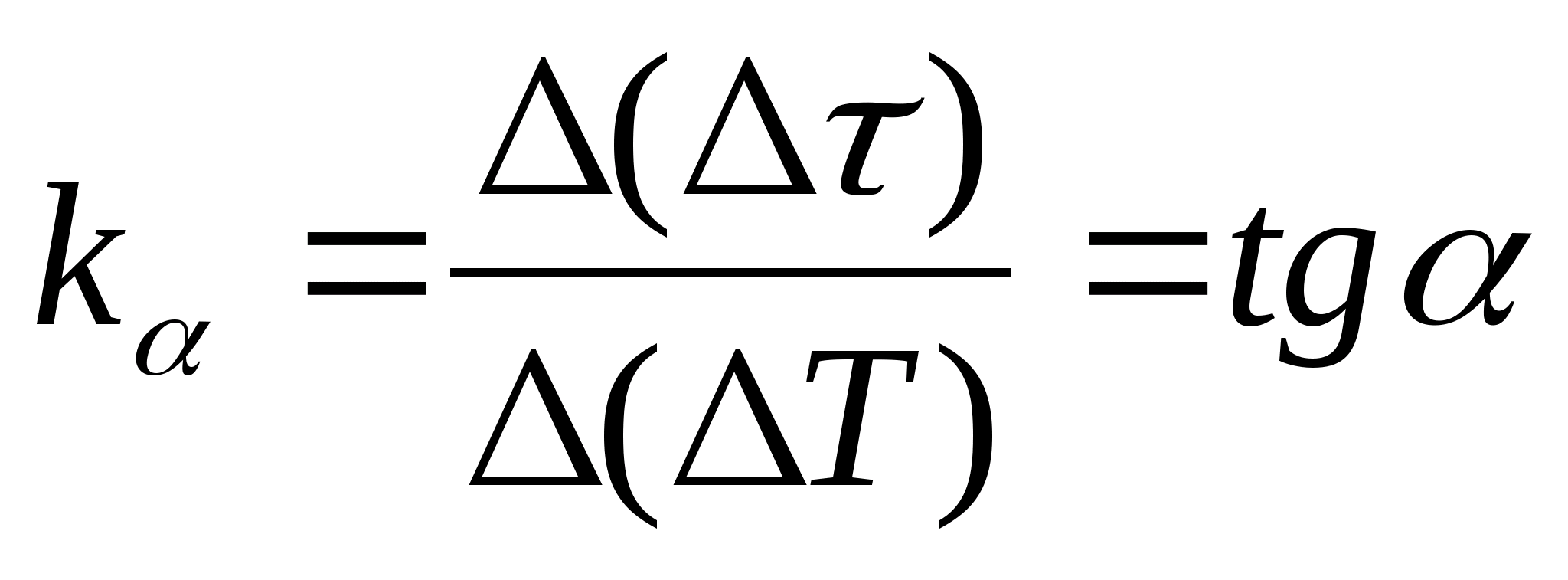 , Unde
− unghiul de înclinare a graficului faţă de axa T
(dacă unitățile lui
și T sunt prezentate pe ambele axe ca segmente de aceeași lungime).
, Unde
− unghiul de înclinare a graficului faţă de axa T
(dacă unitățile lui
și T sunt prezentate pe ambele axe ca segmente de aceeași lungime).
2. Folosind valoarea pantei k
, determinați capacitatea termică specifică a probei folosind formula 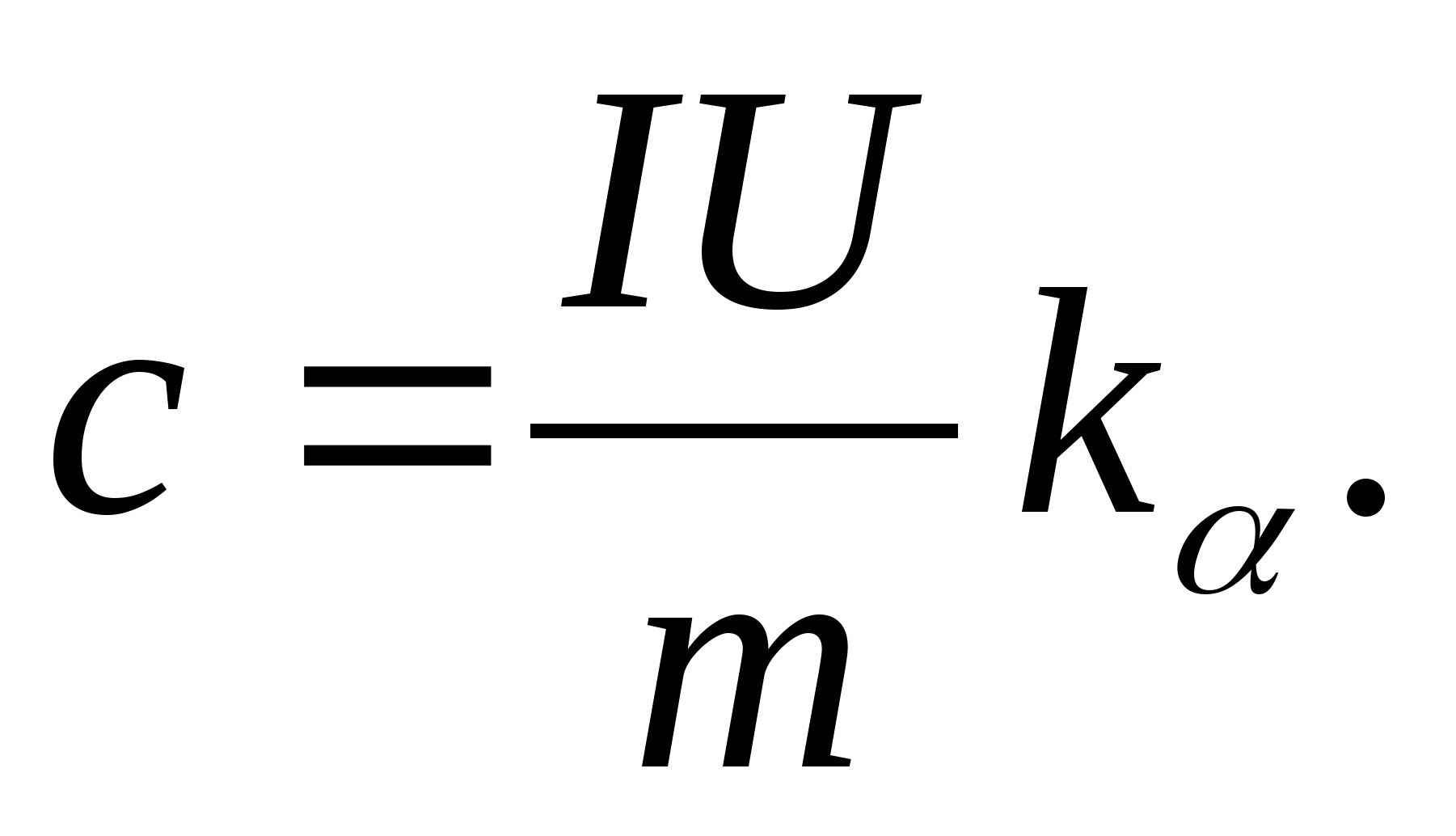
3. Folosind datele din tabelul 8.2 (sau tabelul periodic), determinați capacitatea de căldură molară a probei folosind formula C m =CuM.
Tabelul 8.2
|
Material de probă |
Masa atomică, kg/mol |
|
Ca model al unui corp solid, să considerăm o rețea cristalină corect construită, în nodurile căreia particulele (atomi, ioni, molecule), luate ca puncte materiale, oscilează în jurul pozițiilor lor de echilibru - nodurile rețelei - în trei direcții reciproc perpendiculare. . Astfel, fiecărei particule care constituie rețeaua cristalină i se atribuie trei grade vibraționale de libertate, fiecare dintre acestea, conform legii echipartiției energiei în grade de libertate (vezi § 50), având energia kT.
Energia internă a unui mol dintr-un corp solid
U m \u003d 3N A kT \u003d 3RT,
unde N A este constanta lui Avogadro; N A k= R (R este constanta molară a gazului).
Capacitatea termică molară a unui solid
adică capacitatea de căldură molară (atomică). corpuri simple din punct de vedere chimicîn stare cristalină este aceeași (egal cu 3 R) și nu depinde de temperatură. Această lege a fost obținută empiric de oamenii de știință francezi P. Dulong (1785-1838) și L. Petit (1791-1820) și este titluLegea Dulong și Petit.
Dacă solidul este un compus chimic (de exemplu, NaCl), atunci numărul de particule din mol nu este egal cu constanta Avogadro, dar este egal cu nN A , Unde n - numărul de atomi dintr-o moleculă (pentru NaCl, numărul de particule dintr-un mol este 2 Nși, deci, un mol de NaCl conține atomi de Na Na și atomi de N A Cl). Deci capacitatea de căldură molară compuși chimici solizi
C V \u003d 3R25n J / (mol K),
adică egală cu suma capacităților termice atomice ale elementelor care alcătuiesc acest compus.
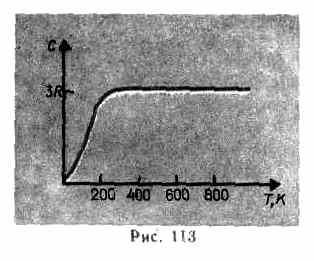
După cum arată datele experimentale (Tabelul 4), pentru multe substanțe legea Dulong și Petit se mulțumește cu o aproximare destul de bună, deși unele substanțe (C, Be, B) au abateri semnificative de la capacitățile termice calculate. În plus, ca și în cazul gazelor (vezi § 53), experimentele privind măsurarea capacității termice a solidelor la temperaturi scăzute au arătat că aceasta depinde de temperatură (Fig. 113). Aproape de zero Kelvin, capacitatea de căldură a corpurilor este proporțională cu T 3 și numai la temperaturi suficient de ridicate, caracteristice fiecărei substanțe, condiția (73.1) este îndeplinită. Diamantul, de exemplu, are o capacitate termică de 3 R la 1800 K! Cu toate acestea, pentru majoritatea solidelor, temperatura camerei este deja suficient de ridicată.
Discrepanța dintre valorile experimentale și teoretice ale capacităților termice calculate pe
baza teoriei clasice, explicat, bazat pe teoria cuantică a capacităților termice, A. Einstein și P. Debye (1884-1966).
§ 74. Evaporare, sublimare, topire si cristalizare. Corpuri amorfe
Atât în lichide, cât și în solide, există întotdeauna un anumit număr de molecule a căror energie este suficientă pentru a depăși atracția față de alte molecule și care sunt capabile să se desprindă de suprafața unui lichid sau solid și să treacă în spațiul din jurul lor. Acest proces pentru lichid se numește evaporare(sau vaporizare), pentru solide - sublimare(sau sublimare).
Evaporarea lichidelor are loc la orice temperatură, dar intensitatea acesteia crește odată cu creșterea temperaturii. Odată cu procesul de evaporare are loc un proces de compensare condensare vapori la lichid. Dacă numărul de molecule care părăsesc lichidul pe unitatea de timp printr-o unitate de suprafață este egal cu numărul de molecule care trec de la vapori la lichid, atunci echilibru dinamicîntre procesele de evaporare şi condensare. Un vapor aflat în echilibru cu lichidul său se numește bogat(vezi și § 62).
Pentru majoritatea solidelor, procesul de sublimare la temperaturi obișnuite este neglijabil și presiunea vaporilor pe suprafața solidului este scăzută; crește odată cu creșterea temperaturii. Sublimează intens substanțe precum naftalina, camforul, care este detectat de un miros ascuțit, caracteristic. Sublimarea are loc mai ales intens în vid - aceasta este folosită pentru a face oglinzi. Un exemplu binecunoscut de sublimare este transformarea gheții în abur - rufele umede se usucă la frig.
Dacă un corp solid este încălzit, atunci acesta energie interna(suma energiei vibrațiilor particulelor la locurile rețelei și a energiei de interacțiune a acestor particule) crește. Pe măsură ce temperatura crește, amplitudinea oscilațiilor particulelor
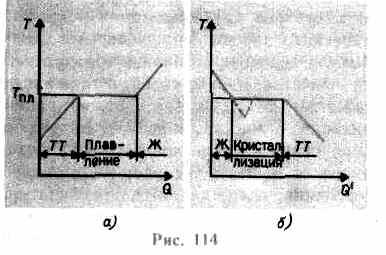
crește până când rețeaua cristalină se prăbușește - solidul se topește. Pe fig. 114 A este prezentată o dependență aproximativă T(Q), Unde Q- cantitatea de căldură primită de organism în timpul topirii. Ca mesaj către solid caldura corpului temperatura acestuia crește, iar la punctul de topire T pl începe trecerea corpului de la starea solidă la starea lichidă. Temperatura T pl rămâne constantă până când întregul cristal este topit și abia atunci temperatura lichidului începe să crească din nou.
Încălzirea unui solid până la T pl nu îl transformă încă într-o stare lichidă, deoarece energia particulelor substanței trebuie să fie suficientă pentru a distruge rețeaua cristalină. În procesul de topire, căldura transmisă substanței este utilizată pentru a efectua lucrări de distrugere a rețelei cristaline și, prin urmare, T pl =const până când întregul cristal este topit. Apoi căldura furnizată va merge din nou pentru a crește energia particulelor de lichid și temperatura acestuia va începe să crească. Se numește cantitatea de căldură necesară pentru a topi 1 kg dintr-o substanță căldură specifică de fuziune.
Dacă lichidul este răcit, atunci procesul se desfășoară în direcția opusă (Fig. 114, b; Q" - cantitatea de căldură degajată de organism în timpul cristalizării): mai întâi, temperatura lichidului scade, apoi la o temperatură constantă egală cu T pl, începe cristalizare, după terminarea sa, temperatura cristalului începe să scadă. Pentru cristalizarea unei substanțe, prezența așa-numitelor centre de cristalizare - nuclee cristaline, care pot fi nu numai cristale ale substanței formate, ci și impurități, precum și praf, funingine etc. Absența centrelor de cristalizare într-un lichid pur face dificilă formarea de cristale microscopice, iar substanța, rămânând în stare lichidă, se răcește la o temperatură mai mică decât temperatura de cristalizare, formându-se astfel lichid suprarăcit(la 114, b corespunde curbei punctate). Odată cu suprarăcirea puternică, începe formarea spontană a centrilor de cristalizare, iar substanța cristalizează destul de repede.
De obicei, suprarăcirea topiturii are loc de la fracțiuni la zeci de grade, dar pentru un număr de substanțe poate ajunge la sute de grade. Datorită vâscozității mari, lichidele foarte suprarăcite își pierd fluiditatea, păstrându-și forma, ca și solidele. Aceste corpuri sunt numite solide amorfe; acestea includ rășini, ceară, ceară de etanșare, sticlă. Corpuri amorfe, fiind astfel lichide suprarăcite, izotrop, adică proprietățile lor sunt aceleași în toate direcțiile; pentru ei, ca și pentru lichide, este caracteristic comanda pe raza scurtaîn aranjarea particulelor; în ele, spre deosebire de lichide, mobilitatea particulelor este destul de mică. O caracteristică a corpurilor amorfe este că nu au un punct de topire specific, adică este imposibil să se indice o anumită temperatură peste care ar putea fi constatată o stare lichidă și sub o stare solidă. Din experiență se știe că în corpurile amorfe procesul de cristalizare poate fi observat în timp, de exemplu, cristalele apar în sticlă; acesta, pierzând transparența, începe să devină tulbure și să se transforme într-un corp policristalin.
Recent, utilizarea pe scară largă în economie nationala a primit polimeri- corpuri organice amorfe, ale căror molecule constau dintr-un număr mare de lanțuri moleculare lungi identice legate prin legături chimice (de valență). Polimerii includ atât substanțe organice naturale (amidon, proteine, cauciuc, fibre etc.), cât și artificiale (plastic, cauciuc, polistiren, lavsan, nailon etc.). Polimerii sunt rezistență și elasticitate inerente; unii polimeri rezistă la întindere de 5-10 ori lungimea lor inițială. Acest lucru se explică prin faptul că lanțurile moleculare lungi pot, sub deformare, fie să se plieze în bile dense, fie să se întindă în linii drepte. Elasticitatea polimerilor se manifestă numai într-un anumit interval de temperatură, sub care devin tari și fragili, iar deasupra - plastic. Deși au fost create o mulțime de materiale polimerice sintetice (fibre artificiale, înlocuitori de piele, materiale de construcție, înlocuitori de metale etc.), teoria polimerilor nu a fost încă pe deplin dezvoltată. Dezvoltarea sa este determinată de cerințele tehnologiei moderne, care necesită sinteza polimerilor cu proprietăți predeterminate.
Capacitatea termică specifică a unei substanțe este înțeleasă ca valoare
, (1)
unde este cantitatea de căldură transmisă corpului.
este modificarea temperaturii care are loc în
ca urmare a transferului de căldură către organism,
m este masa corpului încălzit.
De obicei, experiența determină media căldura specifică substanța c, numeric egală cu cantitatea de căldură care trebuie transmisă unei unități de masă a acestei substanțe pentru a-i crește temperatura cu:
(2),
unde este diferența dintre temperaturile finale și inițiale ale corpului studiat.
Pentru determinarea experimentală a capacității termice sunt utilizate diferite metode calorimetrice. Varietatea acestor metode se datorează faptului că măsurarea precisă a cantității de căldură transmisă corpului necesită eliminarea pierderilor de căldură care nu sunt luate în considerare la încălzirea corpului studiat.
De obicei, în așa-numitele calorimetre cu înveliș izotermă se introduce o corecție calculată sau determinată experimental pentru radiație, adică cantitatea de căldură pe care calorimetrul o primește sau o degajă mediului extern prin radiație în timpul experimentului.
Cu toate acestea, este posibilă reducerea semnificativă a pierderilor de căldură prin introducerea unei bune izolații termice sau prin reducerea duratei experimentului, ceea ce se realizează printr-o viteză mare de încălzire a probei ~ (metoda cu impulsuri pentru măsurarea capacității termice), la care pierderile de căldură vor fi mic în comparație cu cantitatea totală de căldură furnizată.
Una dintre cele mai precise metode de determinare a capacității termice este metoda calorimetrului adiabatic. Dificultățile asociate cu necesitatea luării în considerare a pierderilor de căldură în calorimetrele de acest tip sunt eliminate prin faptul că măsurătorile se fac în condiții de echilibru termic, adică în condiții de temperatură egală a probei studiate și a blocului din jurul probei. . Avantajele acestei metode, împreună cu precizia ridicată, includ și posibilitatea de a determina capacitatea termică a solidelor într-un interval larg de temperatură, ceea ce este deosebit de important dacă substanțele suferă transformări de fază.
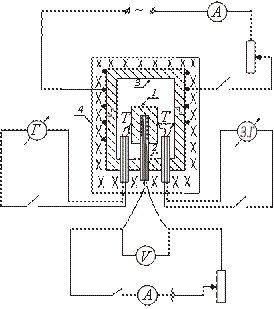
Dispozitivul unuia dintre tipurile de calorimetru adiabatic este prezentat schematic în figură. Proba de testare 1 este plasată în blocul de cupru 3 și împreună cu aceasta este încălzită în cuptorul 4. În interiorul probei se introduce încălzitorul 2, care permite încălzirea suplimentară a probei.
După pornirea cuptorului 4, în care este plasat blocul cu proba, temperatura probei începe să crească, rămânând sub temperatura blocului. Pentru a stabili egalitatea între temperaturile probei și ale blocului, porniți încălzitorul plasat în interiorul probei. Când temperatura probei este puțin peste temperatura blocului, încălzitorul intern este oprit.
Ulterior, acest încălzitor este pornit și oprit periodic, astfel încât diferența de temperatură dintre probă și bloc își schimbă semnul tot timpul.
În momentul în care este egal cu zero (când încălzitorul intern este pornit), nu există schimb de căldură între probă și bloc, iar întreaga cantitate de căldură eliberată de încălzitorul intern este cheltuită doar pentru încălzirea probei; căldura specifică în acest caz poate fi determinată prin formula (2).
Cantitatea de căldură eliberată de încălzitorul intern este determinată de formula:
unde I este curentul încălzitorului intern;
V este căderea de tensiune pe el;
- intervalul de timp în care temperatura a crescut cu .
Apoi
(4)
unde este timpul în care temperatura probei s-a modificat cu .
În formă diferenţială, formula (4) are forma
(5)
Temperatura probei se măsoară cu un termocuplu T. Diferența de temperatură dintre bloc și probă se măsoară cu un termocuplu diferențial. Pentru a determina temperatura probei, se folosește o curbă de calibrare a termocuplului T. Diferența de temperatură dintre bloc și probă se determină în diviziuni ale scalei galvanometrului (deoarece este necesar doar să se stabilească momentul în care diferența de temperatură dintre bloc și semnul modificărilor eșantionului).
Finalizarea lucrării.
Proba este pusă pe un încălzitor plasat în interiorul unui bloc de cupru. Joncțiunile termocuplului T și sunt conectate la probă și bloc. Cuptorul se inchide cu un capac. Înfășurarea electrică a cuptorului, în care este plasat blocul, este pornită. Încălzitorul plasat în interiorul probei este pornit și oprit periodic, iar valorile lui I și V sunt înregistrate în circuitul încălzitorului intern.
Înainte de a începe măsurătorile, este necesar să verificați poziția zero a galvanometrului oglinzii. Pentru a face acest lucru, prin deconectarea termocuplului de la galvanometru, se așteaptă ca iepurașul să nu mai fluctueze de-a lungul scalei. Dacă după aceasta imaginea firului nu coincide cu zero, atunci prin mutarea scării se realizează această coincidență.
Sunt reprezentate curbele de dependență ale lui T și în timp.
Din panta curbei T(t) în punctul în care aceasta își schimbă semnul (adică când se stabilește echilibrul termic), căldura specifică se calculează folosind formula (5). Această capacitate termică se referă la temperatura care trebuie citită de pe curba T(t) în momentul în care diferența de temperatură dintre bloc și probă își schimbă semnul.
