Capacitatea termică a hidrogenului sulfurat la diferite temperaturi. Capacitate termică specifică a gazelor naturale
Nu specifică, dar capacitatea termică totală, în sensul fizic general acceptat, este capacitatea unei substanțe de a se încălzi. Cel puțin așa ne spune orice manual de fizică termică - aceasta este definiție clasică capacitate termică(formulare corectă). De fapt, aceasta este o caracteristică fizică interesantă. Puțin cunoscut de noi în viața de zi cu zi „partea monedei”. Se pare că atunci când căldura este furnizată din exterior (încălzire, încălzire), nu toate substanțele reacționează în mod egal la căldură ( energie termală) și se încălzesc diferit. Abilitatea GAZ de origine naturală folosit ca combustibil primiți, primiți, rețin și acumulează (acumulează) energie termică se numeste capacitatea termica a gazului NATURAL combustibil. Și ea însăși capacitatea termică a metanului, este o caracteristică fizică care descrie proprietățile termofizice ale combustibilului gazos. În același timp, în diferite aspecte aplicate, în funcție de un caz practic concret, un lucru se poate dovedi important pentru noi. De exemplu: capacitatea unei substanțe de a lua cald sau capacitatea de a acumula energie termală sau „talent” să-l păstreze. Cu toate acestea, în ciuda unor diferențe, în sens fizic, proprietățile de care avem nevoie vor fi descrise capacitatea termică a metanului.
Un mic, dar foarte „neplăcut” de natură fundamentală este că capacitatea de a se încălzi - capacitatea termică a metanului, este direct legată nu numai de compoziție chimică, structura moleculară a unei substanțe, dar și cu cantitatea ei (greutate, masă, volum). Din cauza unei astfel de legături „neplăcute”, generalul capacitatea termică a metanului devine o caracteristică fizică prea incomodă a substanței. Deoarece, un parametru măsurat descrie simultan „două lucruri diferite”. Și anume: caracterizează cu adevărat proprietățile termofizice ale GAZULUI NATURAL, însă, „în treacăt” ține cont și de cantitatea acesteia. Formând un fel de caracteristică integrală, în care fizica termică „înaltă” și o cantitate „banală” de materie (în cazul nostru: combustibil gazos) sunt conectate automat.
Ei bine, de ce avem nevoie de asemenea caracteristici termofizice, în care „psihicul inadecvat” este clar urmărit? Din punct de vedere al fizicii, totalul capacitatea termică a metanului(în cel mai stângaci mod), încearcă nu numai să descrie cantitatea de energie termică capabilă să se acumuleze în combustibilul gazos, ci și „în treacăt să ne informeze” despre cantitatea GAZ NATURAL COMBUSTIBILE. Se dovedește absurd, și nu un clar, de înțeles, stabil, corect caracteristica termofizică a metanului. În loc de o constantă utilă potrivită pentru practică calcule termofizice, ni se dă un parametru plutitor, care este suma (integrala) cantității de căldură primită GAZ NATURALși masa sau volumul său de metan.
Mulțumesc, desigur, pentru așa „entuziasm”, dar pentru cantitate GAZ COMBUSTIBIL NATURAL Mă pot măsura. După ce a primit rezultate într-o formă mult mai convenabilă, „umană”. Cantitate GAZ NATURAL COMBUSTIBILE Aș vrea să nu „extrag” prin metode și calcule matematice folosind o formulă complexă din general capacitatea termică a metanului, la diferite temperaturi, și aflați greutatea (masa) în grame (g, g), kilograme (kg), tone (tone), cuburi (metri cubi, metri cubi, m3), litri (l) sau mililitri (ml). ). Mai ales că oameni destepti cu mult timp în urmă a venit cu instrumente de măsură destul de potrivite pentru aceste scopuri. De exemplu: cântare sau alte dispozitive.
Mai ales „natura plutitoare enervantă” a parametrului: general capacitatea termică a gazelor naturale. „Dispoziția” lui instabilă și schimbătoare. Când schimbați „dimensiunea sau doza porției”, capacitatea termică a GAZULUI NATURAL la diferite temperaturi se schimba imediat. Mai mult amestec de gaz combustibil, cantitate fizică, valoare absolută capacitatea termică a metanului- creste. Cantitate mai mică de amestec de gaz combustibil, valoare capacitatea termică a metanului scade. „Rușine” se dovedește unii! Cu alte cuvinte, ceea ce „avem” nu poate fi în niciun fel considerat o descriere constantă caracteristicile termofizice ale GAZULUI NATURAL la diferite temperaturi. Și este de dorit să „avem” un coeficient de înțeles, constant, un parametru de referință care caracterizează proprietati termice combustibil gazos, fără „referințe” la cantitatea de metan (greutate, masă, volum). Ce să fac?
Aici ne vine în ajutor o metodă foarte simplă, dar „foarte științifică”. Se reduce nu numai la executorul judecătoresc "ud. - specific", inainte de cantitate fizica, ci la o soluție elegantă care implică excluderea cantității de materie din considerare. Desigur, parametri „incomozi, de prisos”: masă sau volum GAZ NATURAL COMBUSTIBILE absolut imposibil de exclus. Cel puțin pentru motivul că, dacă nu există o cantitate de metan, atunci nu va exista nici un „subiect de discuție” în sine. Și substanța ar trebui să fie. Prin urmare, alegem un standard condiționat de masă sau volum, care poate fi considerat o unitate potrivită pentru determinarea valorii coeficientului „C” de care avem nevoie. Pentru greutatea combustibilului GAZ NATURAL, o astfel de unitate de masă a metanului, convenabilă în utilizare practică, sa dovedit a fi de 1 kilogram (kg).
Acum noi încălzim un kilogram de GAZ NATURAL cu 1 grad și cantitatea de căldură (energie termică) trebuie să ne încălzim amestec de gaze un grad - acesta este parametrul nostru fizic corect, coeficientul "C", bine, destul de complet și clar descriind unul dintre proprietățile termofizice ale GAZULUI NATURAL la diferite temperaturi. Vă rugăm să rețineți că acum avem de-a face cu o descriere caracteristică proprietate fizică substanță, dar fără a încerca să ne „informeze suplimentar” despre cantitatea acesteia. Confortabil? Nu sunt cuvinte. Este o cu totul altă chestiune. Apropo, acum nu mai vorbim de general capacitatea termică a metanului. Totul s-a schimbat. ACEASTA ESTE CĂLDURA SPECIFĂ A GAZULUI NATURAL, care uneori este numit cu un alt nume. Cum? Doar MASIV CAPACITATEA TERMICA A GAZ NATURAL COMBUSTIBILE. Specific (ud.) Și masa (m.) - în acest caz: sinonime, ele înseamnă aici cel de care avem nevoie coeficientul "C".
Tabel 1. Coeficient: capacitatea termică specifică a GAZULUI NATURAL (sp.). Capacitatea termică de masă a GAZ NATURAL combustibil. Date de referință.
Mai simplu spus, capacitatea de căldură DIN corpul se numește cantitatea de căldură care trebuie consumată acest proces a încălzi corpul cu un grad: .
De obicei, capacitatea termică se referă la o unitate a cantității de substanță și, în funcție de unitatea aleasă, se disting:
capacitatea termică a masei specifice Cu, referitor la 1 kg de gaz, J/(kgK);
capacitatea termică volumetrică specifică Cu´, referitor la cantitatea de gaz conținută în 1 m 3 de volum în condiții fizice normale, J / (m 3 K);
capacitatea de căldură molară specifică μ Cu, referit la un kilomol, J / (kmolK).
Relația dintre capacitățile termice specifice se stabilește prin relațiile evidente:
Cu= μ Cu/μ; Cu´= Cuρ n. (2,13)
Aici ρ n este densitatea gazului în condiții normale.
Prin urmare, modificarea temperaturii corpului cu aceeași cantitate de căldură furnizată depinde de natura procesului care are loc capacitatea termică este o funcție a procesului. Aceasta înseamnă că același fluid de lucru, în funcție de proces, necesită o cantitate diferită de căldură pentru încălzirea sa cu 1 K. Mărimea numerică Cu variază de la + ∞ la – ∞.
În calculele termodinamice mare importanță avea:
capacitatea termică la presiune constantă
Cu p = δ q p/ dT, (2.14)
q p , adus în organism în proces la presiune constantă, la o modificare a temperaturii corpului dT;
capacitatea termică la volum constant
Cu v = δ q v /dT, (2.15)
egal cu raportul dintre cantitatea de căldură δ q v, adusă în organism în proces la un volum constant, la o modificare a temperaturii corpului dT.
În conformitate cu prima lege a termodinamicii pentru sistemele închise δ q = du + pdv.
Ținând cont de faptul că 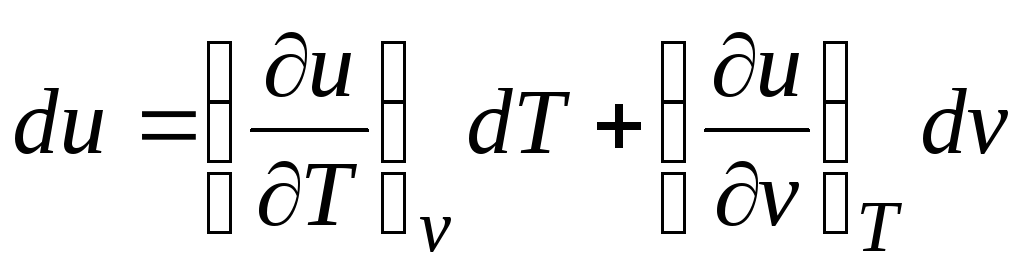 (relații (2.1))
(relații (2.1))
Δ q = (∂u/∂T) v dT + [(∂u/∂v) T + p]dv. (2.16)
Pentru un proces izocor ( v=const) această ecuație ia forma 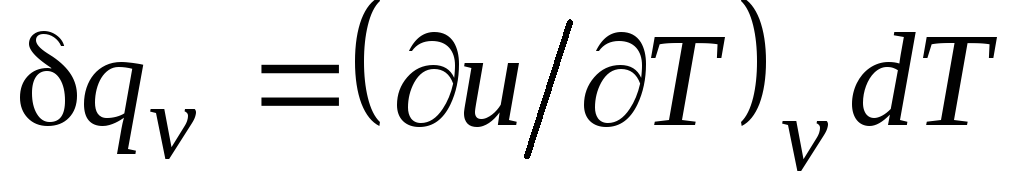 , și, ținând cont de (2.15), obținem că
, și, ținând cont de (2.15), obținem că
c v = (∂u/∂T) v . (2.17)
Pentru un gaz ideal
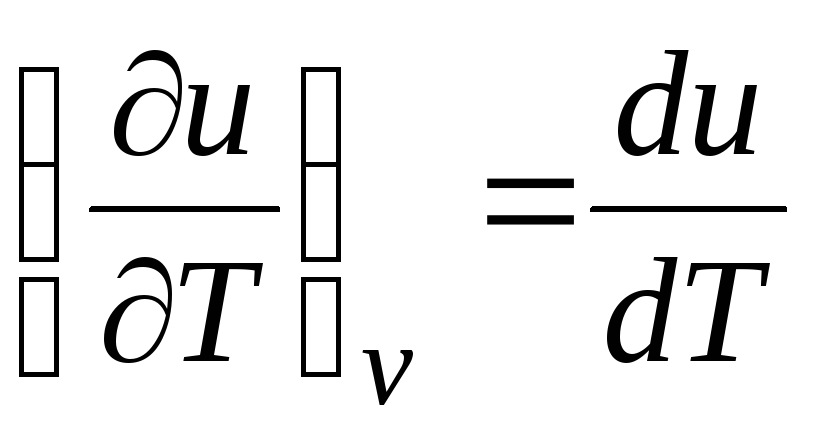 (ecuația 2.2), deci
(ecuația 2.2), deci
c v = du/dT. (2.18)
Pentru un proces izobaric ( R=const) din ecuațiile (2.16) și (2.14) obținem
c p = (∂ u/∂T) v + [(∂u/∂v) T + p](dv/dT) p
Din moment ce energia internă gaz ideal este determinată doar de temperatura sa și nu depinde de volumul specific, atunci
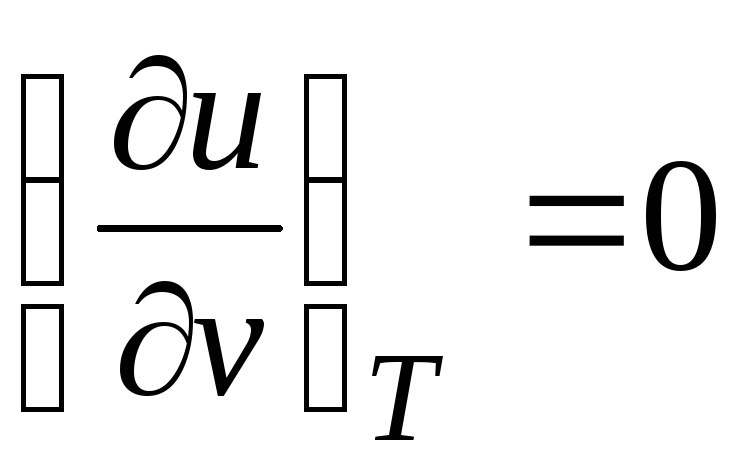 .
(2.19)
.
(2.19)
Din ecuația Clapeyron (1.4) pv
= RT(1.3) urmează 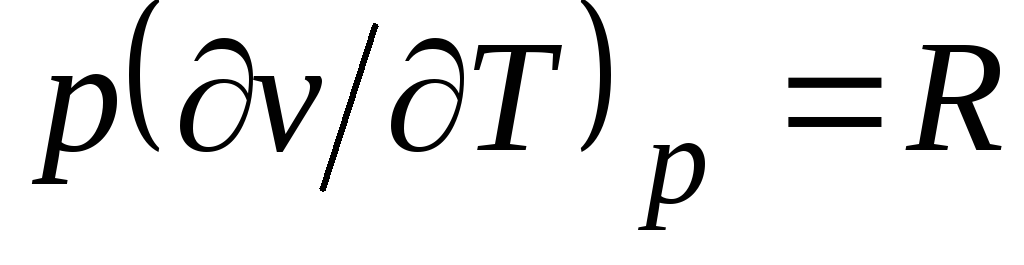 , Unde
, Unde
c p= Cu v + R. (2.20)
Relația (2.20) se numește ecuația lui Mayer și este una dintre principalele din termodinamica tehnică a gazelor ideale.
În procesul v\u003d const, căldura transmisă gazului merge doar pentru a-și schimba energia internă, în timp ce în procesul p \u003d const, căldura este cheltuită atât pentru a crește energia internă, cât și pentru a efectua munca de dilatare. De aceea c p mai mult Cu v prin cantitatea acestei lucrări.
Formulă ![]() determină așa-numita capacitate termică adevărată, adică valoarea capacității termice la o anumită temperatură. În practică, capacitatea termică este utilizată pe scară largă pentru a calcula cantitatea de căldură q 12, care trebuie cheltuit pentru a încălzi corpul de la o temperatură ( t 1) la altul ( t 2) (sau care va fi eliberat la răcire din t 2 la t 1).
determină așa-numita capacitate termică adevărată, adică valoarea capacității termice la o anumită temperatură. În practică, capacitatea termică este utilizată pe scară largă pentru a calcula cantitatea de căldură q 12, care trebuie cheltuit pentru a încălzi corpul de la o temperatură ( t 1) la altul ( t 2) (sau care va fi eliberat la răcire din t 2 la t 1).
Dacă capacitatea de căldură nu se modifică în intervalul de temperatură indicat, atunci
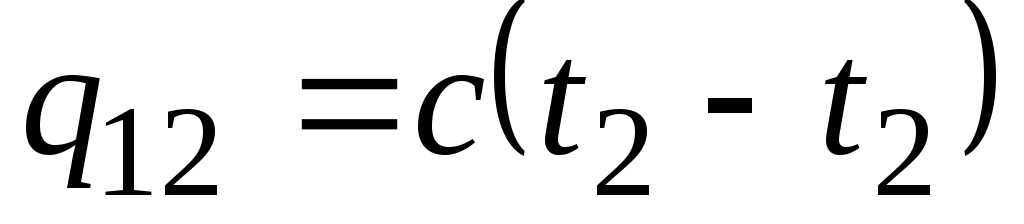 , kJ/kg și
, kJ/kg și 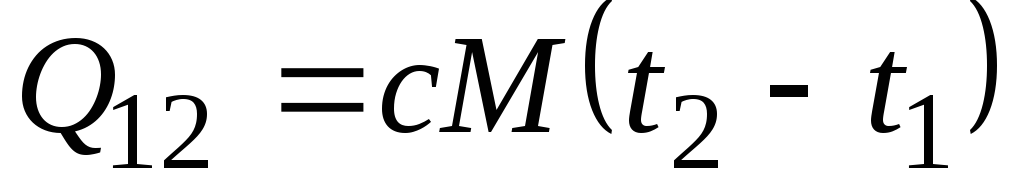 , kJ. (2,21)
, kJ. (2,21)
Această formulă poate fi folosită și pentru calcule aproximative (nu foarte precise). De exemplu, capacitatea termică specifică a apei la temperatura camerei este de 4,187 kJ/(kgC), iar aerul 1 kJ/(kgC). Deoarece capacitatea termică a aproape tuturor substanțelor se modifică (cel mai adesea crește) odată cu creșterea temperaturii, este necesar, strict vorbind, să folosiți formula
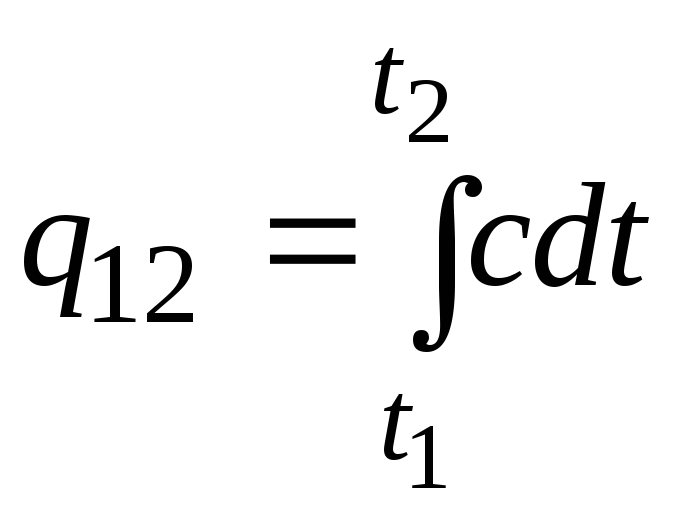 .
(2.21A)
.
(2.21A)
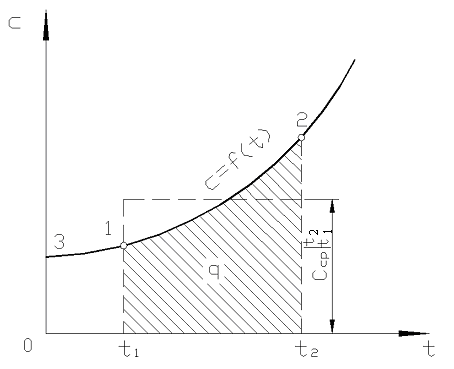
Pe fig. 2,2 magnitudine q 12 este prezentată ca o zonă umbrită. S-ar părea că cel mai simplu mod, prin aplicarea teoremei valorii medii, este să scrieți
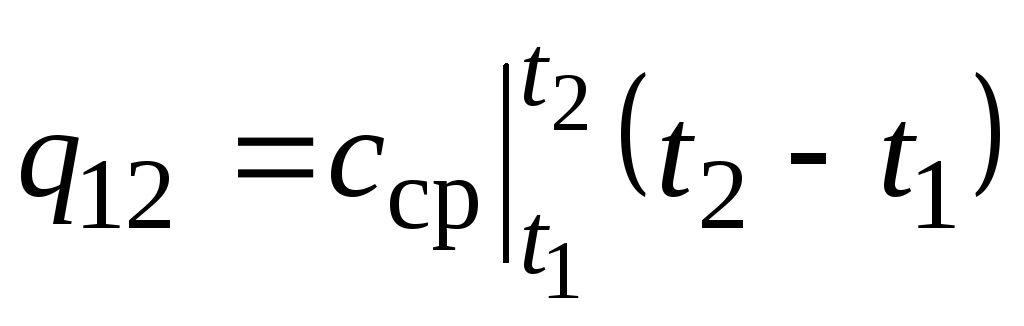 ,
(2.22)
,
(2.22)
Unde 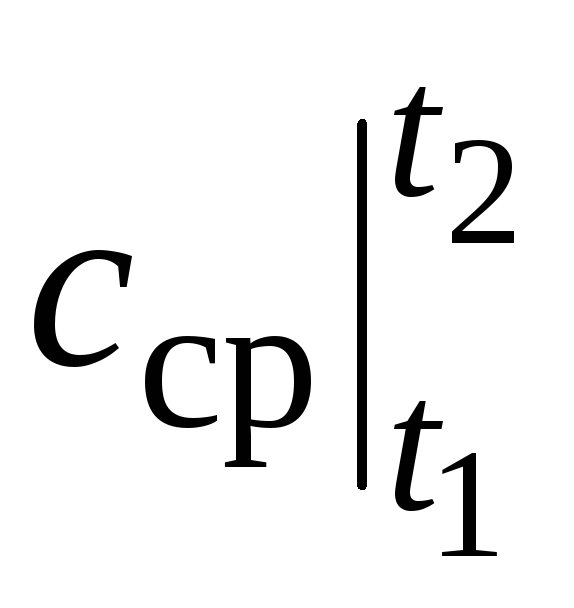 este capacitatea termică medie în intervalul de temperatură t 1 …t 2 .
este capacitatea termică medie în intervalul de temperatură t 1 …t 2 .
Orez. 2.2. Dependența capacității reale de căldură de temperatură
Cu toate acestea, pentru calcule reale, o astfel de notație este foarte incomod, deoarece capacitatea de căldură este aleasă din tabele și 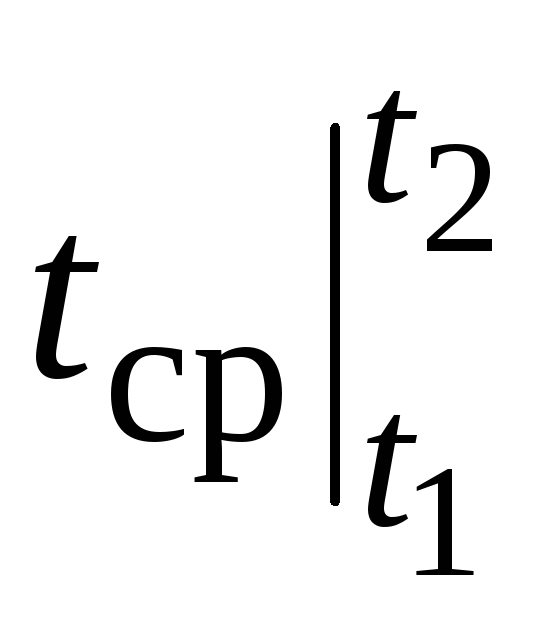 depinde cum t 1 și de la t 2. Un tabel de funcții cu două argumente ar fi foarte greoi.
depinde cum t 1 și de la t 2. Un tabel de funcții cu două argumente ar fi foarte greoi.
În practică, procedați după cum urmează. Cantitatea dorită de căldură este prezentată ca diferența dintre cantitățile necesare pentru încălzirea corpului de la 0 С la temperaturi t 2 și t 1 respectiv (Fig. 2.2)
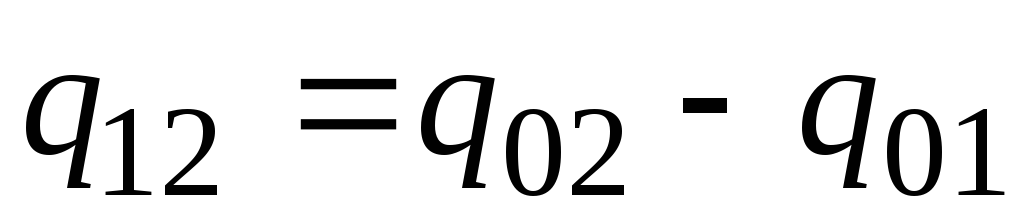 . (2.23)
. (2.23)
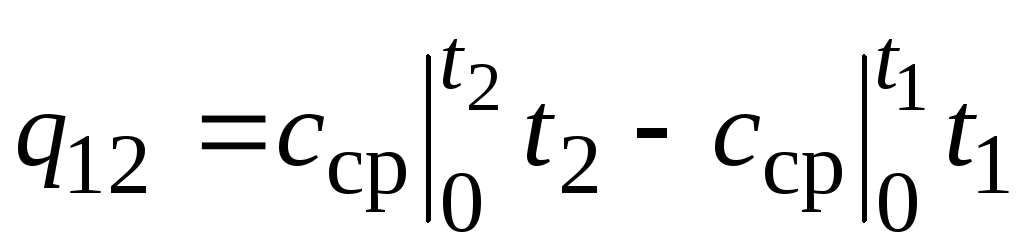 ,
(2.24)
,
(2.24)
Unde  - capacitate termică medie în domeniul de temperatură 0... tC.
- capacitate termică medie în domeniul de temperatură 0... tC.
Valoarea capacității termice medii  pentru o substanță dată (și un proces dat, de ex. Cu R sau c v) depinde doar de o singură temperatură t. Aceste capacități termice sunt date în toate tabelele sub denumirea de „medie”. Ceea ce s-a spus este adevărat pentru Cu
(Cu Rși c v), precum și pentru Cu și Cu. Ca exemplu, tabelul de mai jos arată capacitatea de căldură în funcție de temperatură pentru unele dintre cele mai comune gaze. Trebuie subliniat că în formula (2.24) temperatura este substituită în grade Celsius.
pentru o substanță dată (și un proces dat, de ex. Cu R sau c v) depinde doar de o singură temperatură t. Aceste capacități termice sunt date în toate tabelele sub denumirea de „medie”. Ceea ce s-a spus este adevărat pentru Cu
(Cu Rși c v), precum și pentru Cu și Cu. Ca exemplu, tabelul de mai jos arată capacitatea de căldură în funcție de temperatură pentru unele dintre cele mai comune gaze. Trebuie subliniat că în formula (2.24) temperatura este substituită în grade Celsius.
Capacitatea termică medie molară a diferitelor gaze la R=const
(conform lui M.P. Vukalovich, V.A. Kirillin, V.N. Timofeev)
|
t, C |
Cu R, kJ/(kmolK) |
|||||||
|
N 2 atmosferic | ||||||||
În acest tabel, valorile Cu p sunt date prin 100 С. Deoarece nu se schimbă mult cu temperatura, valorile intermediare pot fi găsite prin extrapolare liniară. Amintiți-vă cum se face acest lucru. Există valori ale funcției tabelare y
= f(X) la 1 (când X= X 1) și la 2 (când X= X 2). Valoarea funcției la(X) la X 1 <X<X 2 egal 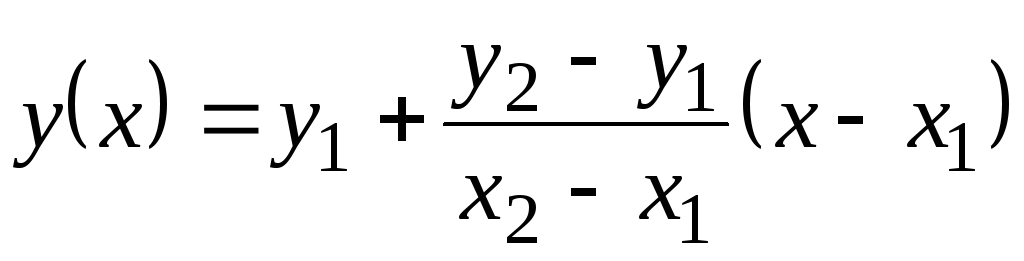 . Această formulă este valabilă atât pentru o funcție crescătoare monotonă (când la 2 >la 1) și pentru scădere monoton ( la 2 <la unu); În acest caz, fracția va fi negativă, deoarece X 2 > X 1 mereu.
. Această formulă este valabilă atât pentru o funcție crescătoare monotonă (când la 2 >la 1) și pentru scădere monoton ( la 2 <la unu); În acest caz, fracția va fi negativă, deoarece X 2 > X 1 mereu.
Tabelul prezintă valorile conductivității termice a gazelor în funcție de temperatură și presiune.
Valorile conductivității termice sunt indicate pentru temperaturi în intervalul de la 20 K (-253 °C) la 1500 K (1227 °C) și presiunea de la 1 la 1000 atmosfere.
Masa dată fiind conductivitatea termică a următoarelor gaze:,, freon-14CF4, etilenă C2H4. Unitatea de unitate de conductivitate termică este W/(m deg).
Trebuie remarcat faptul că conductivitatea termică a gazelor crește odată cu creșterea temperaturii și presiunii. De exemplu, conductivitatea termică a gazului de amoniac la temperatura camerei și presiunea atmosferică normală este de 0,024 W / (m deg), iar atunci când este încălzit cu 300 de grade, conductivitatea termică crește la o valoare de 0,067 W / (m deg). Daca presiunea acestui gaz creste la 300 de atmosfere, atunci valoarea conductibilitatii termice va deveni si mai mare si va avea o valoare de 0,108 W/(m deg).
Notă: Fii atent! Conductivitatea termică din tabel este indicată cu un factor de 10 3 . Nu uitați să împărțiți la 1000!
Conductibilitatea termică a gazelor anorganice în funcție de temperatură
Tabelul oferă valorile conductivității termice a gazelor anorganice în funcție de temperatura la presiunea atmosferică normală. Valorile conductivității termice a gazelor sunt indicate la temperaturi de la 80 la 1500 K (-193 ... 1227 ° C).
Tabelul arată conductivitatea termică a următoarelor gaze: protoxid de azot N 2 O, hexafluorura de sulf SF 6, oxid nitric NO, hidrogen sulfurat H 2 S, amoniac NH 3, dioxid de sulf SO 2, abur H 2 O, dioxid de carbon CO 2 , abur de apă greu D 2 O, aer.
Trebuie remarcat faptul că conductivitatea termică a gazelor anorganice crește odată cu creșterea temperaturii gazului.
Notă: Conductivitatea termică a gazelor din tabel este indicată cu un factor de 10 3 . Nu uitați să împărțiți la 1000!
Conductibilitatea termică a gazelor organice în funcție de temperatură
Tabelul prezintă valorile conductivității termice ale gazelor organice și vaporilor unor lichide în funcție de temperatura la presiunea atmosferică normală. Valorile conductivității termice a gazelor sunt date în tabel în intervalul de temperatură de la 120 la 800 K.
Conductivitatea termică a următoarelor gaze și lichide organice este dată: acetonă CH 3 COCH 3, octan C 8 H 18, pentan C 5 H 12, butan C 4 H 10, hexan C 6 H 14, propilen C 3 H 6, heptan C 7 H 16, alcool amilic C 5 H 11 OH, xilen C 8 H 10, alcool izopropilic C 2 H 7 OH, metan CH 4, alcool metilic CH 3 OH, tetraclorura de carbon CCl 4, ciclohexan C 6 H 12, etan C 2 H 6, tetrafluorura de carbon CF 4, freon-11 CFCl 3, clorură de etil C 2 H 5 Cl, freon-12 CF 2 Cl 2, etilenă C 2 H 4, freon-13 CF 3 Cl, formiat de etil HCOOC 2 H 5, freon-21 CHFCl 2, dietil eter (C 2 H 5) 2O.
După cum se vede din tabel, valoarea conductivității termice a gazelor organice crește și ea odată cu creșterea temperaturii gazului.
Atenție! Conductivitatea termică din tabel este indicată cu un factor de 10 3 . Nu uitați să împărțiți la 1000! De exemplu, conductivitatea termică a vaporilor de acetonă la o temperatură de 400 K (127°C) este de 0,0204 W/(m grad).
