Em que unidades a capacidade calorífica é medida? Capacidade térmica dos gases. Tipos de capacidades de calor
A capacidade térmica de um corpo é a quantidade de calor que deve ser transmitida a um determinado corpo para aumentar sua temperatura em um grau. Quando resfriado em um grau, o corpo emite a mesma quantidade de calor. A capacidade térmica é proporcional à massa do corpo. A capacidade calorífica de uma unidade de massa de um corpo é chamada específica, e o produto do calor específico pela massa atômica ou molecular é chamado atômico ou molar, respectivamente.
Capacidades Caloríficas várias substâncias diferem muito entre si. Então, calor específicoágua a 20 ° C é 4200 J / kg K, madeira de pinho - 1700, ar - 1010. Para metais, é menor: alumínio - 880 J / kg K, ferro - 460, cobre - 385, chumbo - 130. Calor específico aumenta ligeiramente com a temperatura (a 90°C, a capacidade calorífica da água é 4220 J/kg K) e varia muito durante as transformações de fase: a capacidade calorífica do gelo a 0°C é 2 vezes menor que a da água; a capacidade térmica do vapor de água a 100°C é de cerca de 1500 J/kg K.
A capacidade de calor depende das condições em que a temperatura do corpo muda. Se as dimensões do corpo não mudam, então todo o calor vai mudar a energia interna. Aqui estamos falando sobre a capacidade de calor a volume constante. A pressão externa constante, devido à expansão térmica, o trabalho mecânico é realizado contra as forças externas e o aquecimento a uma determinada temperatura requer mais calor. Portanto, a capacidade calorífica a pressão constante é sempre maior que . Por gases ideais(ver figura), onde R é a constante dos gases, igual a 8,32 J / mol K.
Geralmente medido. Maneira clássica As medidas de capacidade calorífica são as seguintes: um corpo cuja capacidade calorífica deve ser medida é aquecido a uma certa temperatura e colocado em um calorímetro com temperatura inicial de , cheio de água ou outro líquido com capacidade calorífica conhecida e - a capacidade calorífica de calorímetro e líquido).
Ao medir a temperatura no calorímetro após o equilíbrio térmico ter sido estabelecido, a capacidade de calor do corpo pode ser calculada usando a fórmula:
![]()
onde e são as massas do corpo, líquido e calorímetro.
A teoria mais desenvolvida é a capacidade calorífica dos gases. Em temperaturas normais, o aquecimento leva principalmente a uma mudança na energia do movimento translacional e rotacional das moléculas de gás. Para a capacidade de calor molar de gases monoatômicos, a teoria dá , diatômico e poliatômico - e . Em temperaturas muito baixas, a capacidade de calor é um pouco menor devido a efeitos quânticos (ver Fig. Mecânica quântica). No temperaturas altas a energia vibracional é adicionada e a capacidade térmica dos gases poliatômicos aumenta com o aumento da temperatura.
A capacidade térmica atômica dos cristais, segundo a teoria clássica, é igual a , o que é consistente com a lei empírica de Dulong e Petit (estabelecida em 1819 pelos cientistas franceses P. Dulong e A. Petit). Teoria quântica capacidade de calor leva à mesma conclusão em altas temperaturas, mas prevê uma diminuição na capacidade de calor com a diminuição da temperatura. Perto do zero absoluto, a capacidade térmica de todos os corpos tende a zero (a terceira lei da termodinâmica).
Capacidade térmica do corpo- isto é quantidade física, determinado pela razão entre a quantidade de calor absorvida pelo corpo quando aquecido e a mudança em sua temperatura:
O significado físico da capacidade de calor de um corpo: a capacidade de calor de um corpo é igual à quantidade de calor absorvida pelo corpo quando aquecida ou liberada quando é resfriada em 1K.
Como as capacidades de calor são variáveis, eles distinguem entre as capacidades de calor médias e verdadeiras. Sob a capacidade média de calor, entenda a proporção da quantidade de calor q , somado a uma unidade da quantidade de uma substância (gás), a uma mudança em sua temperatura de t 1 antes da t 2 desde que a diferença de temperatura t 2 – t 1 é um valor finito. As capacidades médias de massa, volume e calor molar, respectivamente, são denotadas por c m , c m ' e m . Da definição da capacidade calorífica média segue-se que se a temperatura do gás aumenta de t 1 antes da t 2 então sua capacidade térmica média [kJ / (kg * K)]
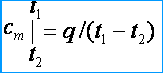
Sob a verdadeira capacidade de calor, entenda a capacidade de calor do gás, correspondendo a uma mudança infinitesimal na temperatura do gás, correspondendo a uma mudança infinitesimal na temperatura dt , ou seja
c = dq/dt,
Onde dq=cdt.
Calor específicoé a capacidade de diferentes substâncias de absorver calor quando são aquecidas. A capacidade específica de calor de uma substância é determinada pela razão entre a quantidade de calor recebida por ela quando aquecida para a massa da substância e a mudança em sua temperatura, se: ![]()
a relação que expressa a relação entre as capacidades caloríficas molares Cp e CV tem a forma (fórmula de Mayer): Cp = CV + R. OU MAIS EXPANDIDO Capacidade térmica gás ideal Se, como resultado da transferência de calor, uma certa quantidade de calor é transferida para o corpo, a energia interna do corpo e sua temperatura mudam. A quantidade de calor Q necessária para aquecer 1 kg de uma substância em 1 K é chamada de calor específico da substância c. c = Q / (mΔT). Em muitos casos, é conveniente usar a capacidade calorífica molar C: C = M c, onde M é a massa molar da substância. A capacidade de calor determinada dessa maneira não é uma característica inequívoca de uma substância. De acordo com a primeira lei da termodinâmica, a variação da energia interna de um corpo depende não apenas da quantidade de calor recebida, mas também do trabalho realizado pelo corpo. Dependendo das condições em que o processo de transferência de calor foi realizado, o corpo pode realizar vários trabalhos. Portanto, a mesma quantidade de calor transferida para o corpo pode causar diferentes variações em sua energia interna e, conseqüentemente, em sua temperatura. Essa ambigüidade na determinação da capacidade de calor é típica apenas para uma substância gasosa. Quando corpos líquidos e sólidos são aquecidos, seu volume praticamente não muda e o trabalho de expansão acaba sendo igual a zero. Portanto, toda a quantidade de calor recebida pelo corpo vai alterar sua energia interna. Ao contrário dos líquidos e sólidos, o gás no processo de transferência de calor pode alterar muito seu volume e realizar trabalho. Portanto, a capacidade de calor de uma substância gasosa depende da natureza do processo termodinâmico. Normalmente, dois valores da capacidade térmica dos gases são considerados: CV é a capacidade térmica molar em um processo isocórico (V = const) e Cp é a capacidade térmica molar em um processo isobárico (p = const). No processo a volume constante, o gás não realiza trabalho: A = 0. Da primeira lei da termodinâmica para 1 mol de gás segue QV = CVΔT = ΔU. A variação ΔU da energia interna de um gás é diretamente proporcional à variação ΔT de sua temperatura. Para um processo a pressão constante, a primeira lei da termodinâmica dá: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV, onde ΔV é a variação de volume de 1 mol de um gás ideal quando sua temperatura muda de ΔT. Segue-se disso: A razão ΔV / ΔT pode ser encontrada a partir da equação de estado de um gás ideal escrita para 1 mol: pV = RT, onde R é a constante universal dos gases. Em p = const Assim, a relação que expressa a relação entre as capacidades térmicas molares Cp e CV tem a forma (fórmula de Mayer): Cp = CV + R.
A constante do gás é numericamente igual ao trabalho de expansão de 1 mol de um gás ideal sob pressão constante quando aquecido por 1 K. R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K =8,31(44) Dzh/ (mol K)
A constante universal dos gases é uma constante física fundamental universal R, igual ao produto da constante de Boltzmann k e a constante de Avogadro
Significado físico: Constante do gás i é numericamente igual ao trabalho de expansão de um mol de um gás ideal em um processo isobárico com aumento de temperatura de 1 K
No sistema CGS, a constante do gás é:
A constante específica do gás é:
Expoente adiabático(as vezes chamado coeficientePoisson) - a razão entre a capacidade de calor a pressão constante () e a capacidade de calor a volume constante (). Às vezes também é chamado fator isentrópico extensões. Denotado pela letra grega (gamma) ou (kappa). O símbolo da letra é usado principalmente em disciplinas de engenharia química. Na engenharia de calor, a letra latina é usada.
Uma mistura de gases é uma coleção de vários gases diferentes que, nas condições consideradas, não entram em reações químicas entre si.
Uma mistura de gases é um sistema termodinâmico homogêneo (dentro do qual não existem interfaces que separem as partes macroscópicas do sistema umas das outras, diferindo em suas propriedades e composição).
Pressão parcial Pi do i-ésimo gás na mistura é a pressão sob a qual este gás estaria se todos os outros gases fossem removidos da mistura, e V e T permanecessem os mesmos.
Lei de Dalton - A pressão de uma mistura de gases que não interagem quimicamente entre si é igual à soma das pressões parciais desses gases.
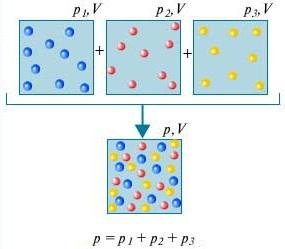
Para entender o que é lei de dalton, considere para isso o ar da sala. É uma mistura de vários gases: nitrogênio (80%), oxigênio (20%). A pressão parcial de cada um desses gases é a pressão que o gás teria se ocupasse sozinho todo o volume. Por exemplo, se todos os gases, exceto o nitrogênio, fossem removidos da sala, a pressão do que sobraria seria a pressão parcial do nitrogênio. Lei de Dalton afirma que a pressão total de todos os gases tomados em conjunto é igual à soma das pressões parciais de cada gás tomado separadamente. (Estritamente falando, a lei se aplica apenas a gases ideais, mas, com uma boa aproximação, ela também descreve gases reais.)
Primeira lei da termodinâmica é uma generalização da lei de conservação e transformação de energia para um sistema termodinâmico. É formulado da seguinte forma:
Alterar Δvocê A energia interna de um sistema termodinâmico não isolado é igual à diferença entre a quantidade de calorQ transferidos para o sistema, e trabalhoUMA , um sistema perfeito sobre corpos externos.
|
A relação que expressa a primeira lei da termodinâmica é muitas vezes escrita de uma forma diferente:
|
A quantidade de calor recebida pelo sistema é usada para alterar sua energia interna e realizar trabalho em corpos externos.
A primeira lei da termodinâmica é uma generalização de fatos experimentais. De acordo com esta lei, a energia não pode ser criada ou destruída; é transferido de um sistema para outro e é transformado de uma forma em outra. Uma consequência importante da primeira lei da termodinâmica é a afirmação de que é impossível criar uma máquina capaz de realizar um trabalho útil sem consumir energia externa e sem nenhuma alteração interna da própria máquina. Tal máquina hipotética é chamada máquina de movimento perpétuo (perpetuum mobile) do primeiro tipo . Numerosas tentativas de criar tal máquina invariavelmente terminaram em fracasso. Qualquer máquina pode fazer um trabalho positivo UMA sobre corpos externos apenas obtendo uma certa quantidade de calor Q de corpos circundantes ou uma diminuição no Δ você sua energia interna.
Apliquemos a primeira lei da termodinâmica a isoprocessos em gases.
Com expansão isobárica Q> 0 - o calor é absorvido pelo gás e o gás realiza um trabalho positivo. Com compressão isobárica Q < 0 – тепло отдается внешним телам. В этом случае UMA < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T 1 ; a energia interna diminui, Δ você < 0.
NO processo isotérmico a temperatura do gás não varia, portanto, a energia interna do gás, Δ você = 0.
NO processo isocórico (V= const) o gás não realiza trabalho, UMA= 0. Portanto,
A primeira lei da termodinâmica para um processo isobárico dá:
|
A primeira lei da termodinâmica para um processo isotérmico é expressa pela relação
|
Quantidade de calor Q, obtido pelo gás no processo de expansão isotérmica, se transforma em trabalho sobre corpos externos. Sob compressão isotérmica, o trabalho das forças externas produzidas no gás é convertido em calor, que é transferido para os corpos circundantes.
Juntamente com os processos isocóricos, isobáricos e isotérmicos, a termodinâmica geralmente considera processos que ocorrem na ausência de troca de calor com os corpos circundantes. Vasos com paredes isolantes são chamados conchas adiabáticas, e os processos de expansão ou compressão de gás nesses vasos são chamados adiabático.
NO processo adiabáticoQ= 0; então a primeira lei da termodinâmica assume a forma
|
|
|
Em seu significado físico, a primeira lei da termodinâmica é a lei da conservação (mudança) de energia na termodinâmica. Se, de acordo com a lei da mudança de energia na mecânica, o trabalho das forças não conservativas é igual ao incremento da energia mecânica do sistema (em particular, o trabalho das forças de atrito com sinal negativo é igual à diminuição no a energia mecânica do sistema), então de acordo com a primeira lei da termodinâmica, o incremento da energia interna do sistema termodinâmico é igual à soma do trabalho das forças externas, perfeitas sobre o sistema, e a energia transferida para o sistema sistema por transferência de calor. Entalpia(do grego. entalpo- aquecer) é propriedade da matéria, indicando a quantidade de energia que pode ser convertida em calor. Entalpiaé uma propriedade termodinâmica de uma substância que indica o nível de energia armazenada em sua estrutura molecular. Isso significa que, embora a matéria possa ter energia com base na temperatura e na pressão, nem toda ela pode ser convertida em calor. Parte da energia interna sempre permanece na substância e mantém sua estrutura molecular. Parte da energia cinética de uma substância não está disponível quando sua temperatura se aproxima da temperatura ambiente. Consequentemente, entalpiaé a quantidade de energia disponível para conversão em calor a uma determinada temperatura e pressão. As unidades de entalpia são BTU ou Joule para energia e Btu/lbm ou J/kg para energia específica. 11 pergunta |

Objetivo: Determinação experimental da capacidade calorífica dos materiais.
Equipamento: Balança, peso, calorímetro, cilindro de metal com capacidade calorífica conhecida, béquer, aquecedor, gancho.
Breve teoria:
Todos os corpos macroscópicos e sistemas de corpos, além da energia mecânica devido ao seu movimento e interação, possuem energia que depende do seu estado interno. Essa energia, que é a energia de movimento e interação entre todas as partículas que compõem o corpo, é chamada de interna.
A energia interna inclui a energia cinética do movimento térmico das moléculas e átomos que compõem um determinado corpo, a energia cinética dos elétrons que se movem nos átomos ao redor dos núcleos, a energia potencial das interações entre moléculas, átomos, elétrons e núcleos, núcleos no núcleo , etc O conceito de energia interna não inclui a energia cinética e potencial de um determinado corpo como um todo.
A energia interna é determinada exclusivamente pelo conjunto de parâmetros que caracterizam o estado do sistema dado, ou seja, é uma função de valor único do estado deste sistema.
A energia interna é geralmente denotada pela letra U.
Em fenômenos térmicos que ocorrem em temperaturas distantes das temperaturas de transição de fase, uma mudança na energia interna DU está associada a uma mudança na energia cinética e potencial das moléculas, enquanto os demais componentes da energia interna não mudam. Portanto, em tais processos, podemos assumir que a energia interna de um corpo é igual à soma das energias cinéticas do movimento térmico caótico de todas as moléculas em relação ao centro de massa desse corpo e as energias potenciais de interação de todos moléculas entre si.
Quando o estado do corpo muda, sua energia interna muda. Por exemplo, quando a temperatura de um corpo aumenta, sua energia interna aumenta, pois a energia cinética média do movimento das moléculas desse corpo aumenta. À medida que a temperatura diminui, a energia interna do corpo diminui.
A energia interna dos corpos pode variar jeitos diferentes. Por exemplo, a energia interna varia quando o trabalho mecânico é realizado por forças externas sobre um determinado corpo durante sua deformação, e também sem trabalho, quando o corpo está em contato com outro corpo (ou meio) que tem uma temperatura maior ou menor do que o corpo dado.
O processo de mudança da energia interna de um corpo sem realizar trabalho mecânico é chamado de transferência de calor ou transferência de calor. Existem três tipos de transferência de calor: convecção, condução e radiação.
Durante a troca de calor, não há conversão de energia de um tipo para outro. O processo de transferência de calor consiste no fato de que parte da energia interna de um corpo mais quente é transferida para um corpo (ou meio) menos quente.
Para caracterizar os processos de transferência de calor, é introduzido o conceito de quantidade de calor, que é chamada de quantidade que é uma medida quantitativa da mudança na energia interna do corpo no processo de transferência de calor.
Deve ser lembrado que um corpo só pode dar ou receber energia, e a quantidade de calor Q é apenas um equivalente numérico da energia dada ou recebida pelo corpo no processo de transferência de calor.
A quantidade de calor depende do tipo de processo e não é uma função do estado do sistema.
A quantidade de calor necessária para aquecer o corpo que ocorre sem transformações de fase (sem alterar o estado de agregação da substância):
onde c é a capacidade específica de calor do corpo, determinada pela razão entre a quantidade de calor transferida para a massa m do corpo e a mudança resultante na temperatura DT, m é a massa corporal, DT é a diferença entre a temperatura final e as temperaturas iniciais do corpo dado.
A quantidade de calor que precisa ser transmitida ao corpo para elevar sua temperatura em um Kelvin é chamada de capacidade térmica dessa substância. Quando resfriado por um Kelvin, o corpo emite a mesma quantidade de calor. A capacidade térmica de um corpo é proporcional à massa do corpo e depende da substância de que é composto. No sistema SI de unidades, a capacidade térmica é medida em J/K.
Para caracterizar as propriedades térmicas de uma substância, toma-se a capacidade calorífica de uma unidade de massa dessa substância. Essa característica é chamada de capacidade térmica específica. É igual à razão entre a capacidade térmica de um determinado corpo e sua massa. A capacidade de calor específico com o sistema SI é medida em J / (kg × K).
Experimentalmente, o calor específico de um corpo metálico é determinado usando um calorímetro e um termômetro. O calorímetro mais simples consiste num vidro de metal polido colocado dentro de outro vidro sobre rolhas (para efeito de isolamento térmico). O copo interno é preenchido com água ou outro líquido com um calor específico conhecido. Um corpo aquecido a uma certa temperatura t é colocado em um calorímetro. Deixe a temperatura do líquido no calorímetro ser t 1 antes que o corpo seja abaixado, e depois que o equilíbrio térmico do líquido e do corpo abaixado nele for estabelecido, sua temperatura total se tornará igual a q.
Da lei da conservação da energia segue que:
Q \u003d Q 1 + Q 2,(2)
onde está a quantidade de calor Q, dada por um corpo aquecido, é igual à soma da quantidade de calor Q1, obtido pela água e Q2, recebido pelo calorímetro.
Considerando (1), reescrevemos (2) como:
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
Onde c 1 e m 1- calor específico e massa de água no calorímetro, c 2 e m2- calor específico e massa do calorímetro. Esta equação é chamada de equação de balanço térmico. A partir dele encontramos a capacidade de calor específico do corpo:
É possível abordar a solução desse problema de uma maneira diferente, suponha que as perdas de energia no âmbito de um experimento sejam as mesmas. Corpo Com calor específico conhecido, aquecido a uma certa temperatura t, baixado para um calorímetro, cuja temperatura muda. Então a equação de balanço de calor terá a forma:
cm(t-q) = c 1 m 1 (q-t 1) + Q perda,(5)
Onde Q perdaé a quantidade de calor recebida pelo calorímetro e meio Ambiente, Consequentemente:
Q perda, = cm(t-q) - c 1 m 1 (q-t 1). (6)
Se um corpo com calor específico desconhecido, aquecido à mesma temperatura, for colocado em um calorímetro, a equação do balanço de calor assumirá a forma:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q perdas,(7)
Onde m¢ 1é a massa de água no calorímetro, e t¢ 1- temperatura da água neste experimento. Então:
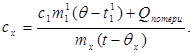 (8)
(8)
Substituindo o valor (6) em (8) obtemos:
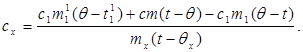 (9)
(9)
onde é a quantidade elementar de calor; - uma mudança elementar de temperatura.
A capacidade térmica é numericamente igual à quantidade de calor que deve ser fornecida ao sistema para aumentar sua temperatura em 1 grau sob determinadas condições. Como a unidade de calor no SI é o joule e a temperatura é o grau K, a unidade de capacidade térmica é J/K.
Dependendo da unidade quantitativa do corpo para a qual o calor é fornecido em termodinâmica, as capacidades de massa, volume e calor molar são distinguidas.
Capacidade de calor em massaé a capacidade térmica por unidade de massa do fluido de trabalho,
onde e são o volume e a densidade do corpo em condições físicas normais.
A capacidade calorífica volumétrica é medida em J/(m3 K).
Capacidade térmica molar- capacidade térmica, referente à quantidade de fluido de trabalho (gás) em moles,
| , |
onde m3/mol é o volume molar do gás em condições normais.
Considerando que a capacidade térmica não é constante, mas depende da temperatura e de outros parâmetros térmicos, é feita uma distinção entre capacidade térmica real e média. Normalmente, a verdadeira capacidade de calor é entendida como a razão da quantidade elementar de calor que é relatada a um sistema termodinâmico em qualquer processo para um aumento infinitesimal na temperatura desse sistema causado pelo calor transmitido. Vamos considerar a verdadeira capacidade de calor do sistema termodinâmico a uma temperatura do sistema igual a , e - true capacidade de calor específico fluido de trabalho em sua temperatura igual a . Então, a capacidade média de calor específico do fluido de trabalho quando sua temperatura muda de para pode ser determinada como
Determinação da energia interna do corpo.
Energia interna corpo (referido como E ou você) é a soma das energias das interações moleculares e movimentos térmicos de uma molécula. Em particular, a energia interna de um gás ideal é igual à soma das energias cinéticas de todas as partículas de gás em movimento térmico contínuo e aleatório. Disto segue a lei de Joule, confirmada por numerosos experimentos.
A teoria cinética molecular leva à seguinte expressão para a energia interna de um mol de um gás monoatômico ideal (hélio, néon, etc.), cujas moléculas realizam apenas movimento translacional:
Nesse caminho, energia interna você corpo é determinado exclusivamente por parâmetros macroscópicos que caracterizam o estado do corpo. Não depende de como o estado dado foi realizado. Costuma-se dizer que a energia interna é uma função de estado.
Em TD, é utilizada a variação da energia interna, e não seu valor absoluto.
O que é trabalho de expansão. A primeira lei do TD.
Trabalho de expansão - o trabalho mecânico realizado pelo veículo contra as forças de pressão externas no processo de sua expansão. Quando o volume varia, o gás realiza trabalho, o sinal da variação em V coincide com o sinal do trabalho.
A primeira lei do TD: o calor transmitido ao sistema é usado para converter energia interna e realizar trabalho.
Do ponto de vista de sua capacidade de receber (ou dar) energia na forma de calor, costuma-se caracterizar um sistema termodinâmico por sua capacidade calorífica.
A capacidade térmica de um corpo (sistema) é uma quantidade física numericamente igual à quantidade de calor que deve ser transmitida ao corpo (sistema) para alterar sua temperatura em um Kelvin.
Se o corpo recebe uma quantidade infinitesimal de calor Q, o que causou um aumento infinitesimal na temperatura dT, então sua capacidade térmica A PARTIR DEé por definição igual a
A unidade SI de capacidade térmica é o joule dividido pelo kelvin ( J/Para).
Experimentos e cálculos teóricos mostram que a capacidade térmica de um corpo depende de sua composição química, massa e estado termodinâmico(por exemplo, na temperatura), bem como no tipo de processo de mudança do estado do corpo quando o calor é transmitido a ele.
A capacidade de calor específico é a capacidade de calor por unidade de massa de uma substância, isto é, para uma substância homogênea
![]() , (25.2)
, (25.2)
Onde Com- capacidade térmica específica, Mé a massa da substância.
A unidade SI de calor específico é o joule dividido por um kelvin-quilograma [( J/(Para . kg)].
A capacidade térmica molar é a capacidade térmica de um mol de uma substância, isso é
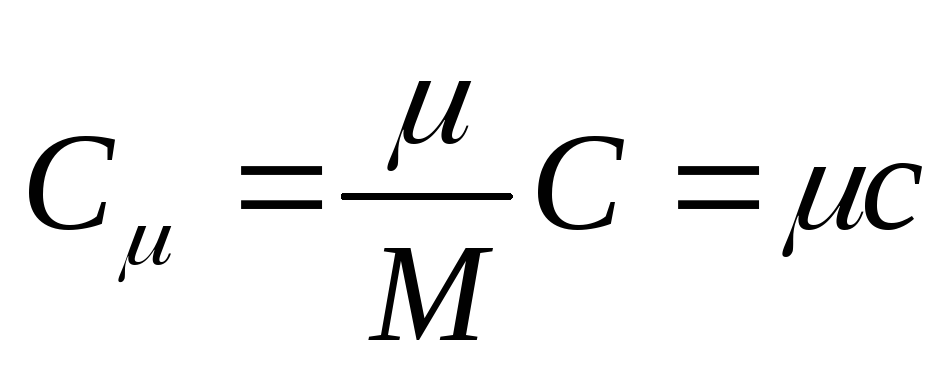 , (25.3)
, (25.3)
Onde A PARTIR DE - capacidade térmica molar; é a massa molar da substância.
A unidade de capacidade molar de calor no SI é o joule dividido pelo kelvin-mol [ J/(Para . toupeira)].
Quantidade elementar de calor Q, necessário para alterar a temperatura do corpo dT, é definido como
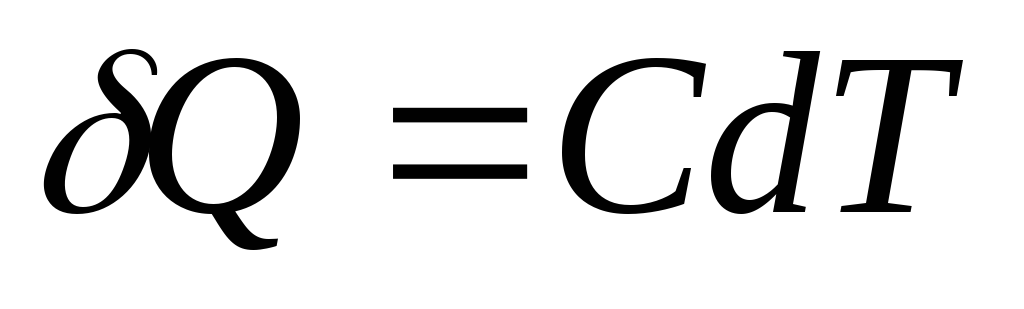 ,
,
e para um corpo homogêneo
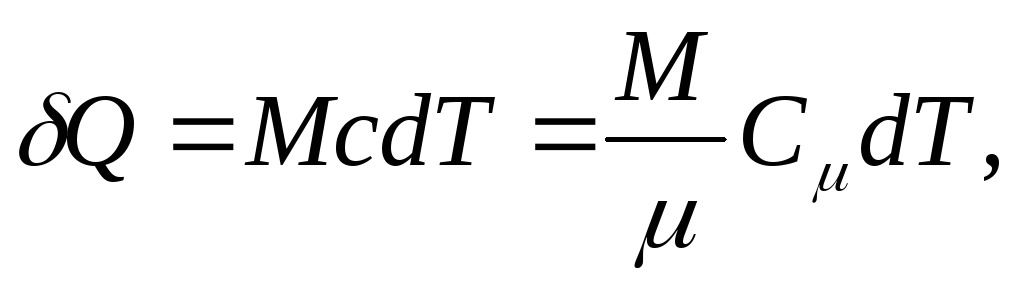 (25.4)
(25.4)
Onde M/ - quantidade de substância (número de moles).
§26. Primeira lei da termodinâmica
A primeira lei (primeira lei) da termodinâmica é uma expressão matemática da lei de conservação e transformação de energia aplicada a sistemas termodinâmicos. Foi estabelecido como resultado de pesquisas experimentais e teóricas no campo da física e da química, cuja etapa final foi a descoberta da equivalência entre calor e trabalho, ou seja, a descoberta de que a conversão de calor em trabalho e trabalho em o calor é sempre realizado na mesma proporção quantitativa estritamente constante.
No §24 observou-se que a energia interna de um sistema pode ser alterada de duas maneiras: realizando trabalho e transferindo calor. Portanto, podemos escrever:
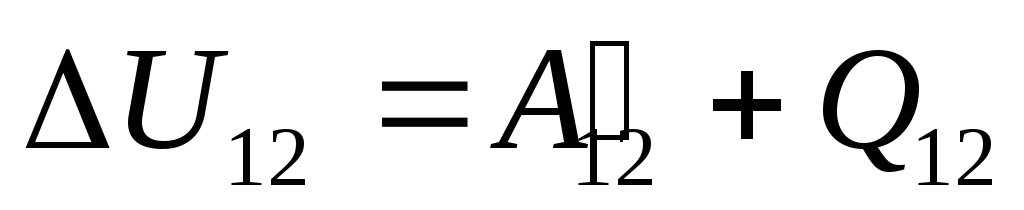 ,
(26.1)
,
(26.1)
Onde
você 12
-
variação na energia interna do sistema durante sua transição do estado 1
em um estado 2
como resultado do trabalho nele 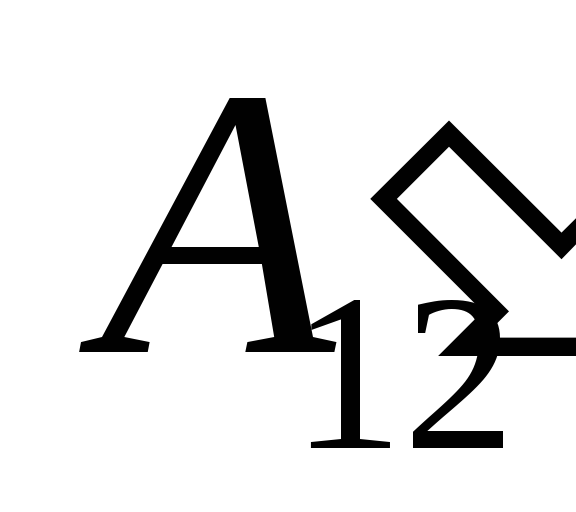 de corpos externos e transferindo para ele de fora uma certa quantidade de calor
de corpos externos e transferindo para ele de fora uma certa quantidade de calor  .
.
Nós sabemos que o trabalho 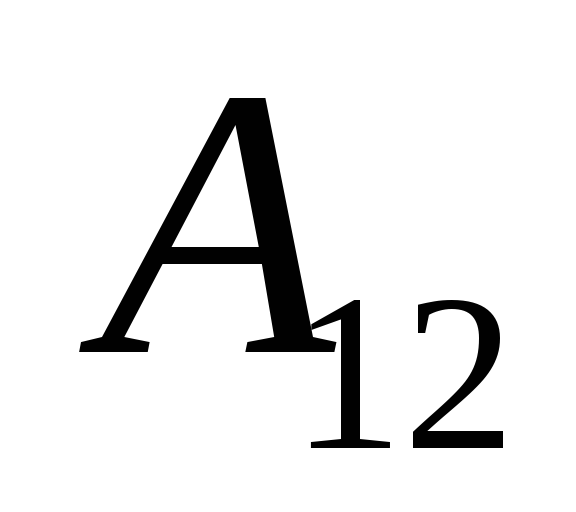 realizada pelo próprio sistema em corpos externos é numericamente igual e oposta em sinal ao trabalho
realizada pelo próprio sistema em corpos externos é numericamente igual e oposta em sinal ao trabalho  corpos externos acima do sistema, ou seja
corpos externos acima do sistema, ou seja
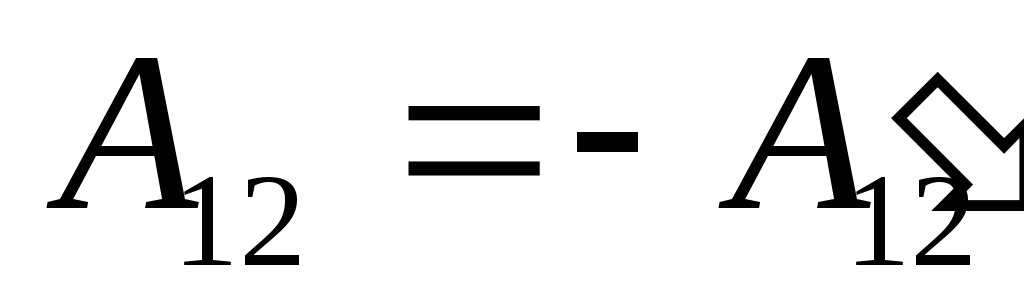 ,
(26.2)
,
(26.2)
portanto, a expressão (26.1) pode ser reescrita como
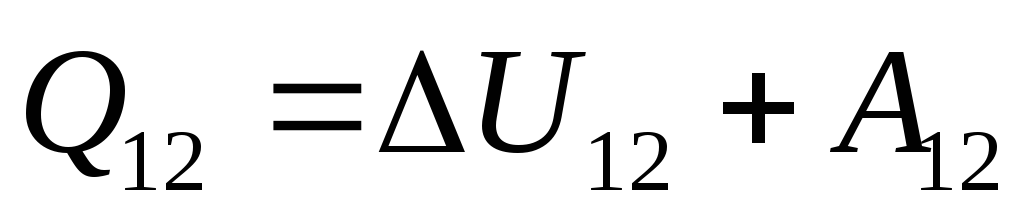 . (26.3)
. (26.3)
Essa equação é um registro matemático da primeira lei da termodinâmica: a quantidade de calor comunicada ao sistema é gasta na mudança de sua energia interna e na realização de trabalho em corpos externos pelo sistema.
Com uma mudança infinitesimal no estado do sistema, a equação (26.3) assume a forma
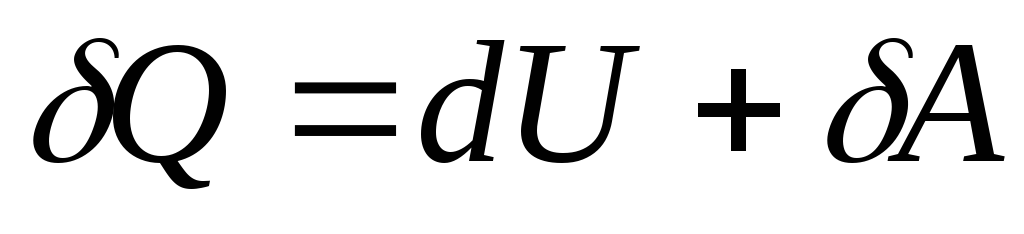 , (26.4)
, (26.4)
Onde 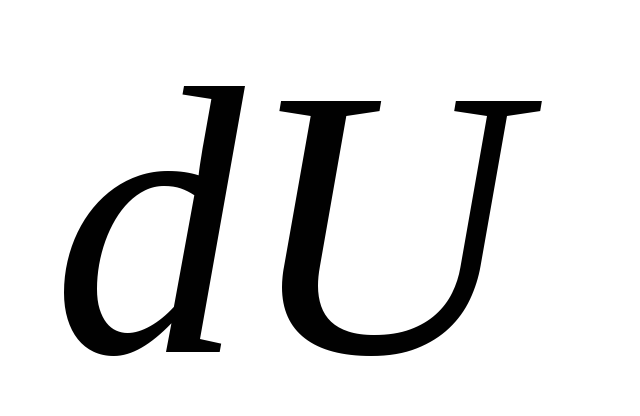 - uma variação infinitesimal na energia interna do sistema quando uma quantidade elementar de calor é transmitida a ele
Q e realizando trabalho elementar pelo sistema
MAS sobre corpos externos.
- uma variação infinitesimal na energia interna do sistema quando uma quantidade elementar de calor é transmitida a ele
Q e realizando trabalho elementar pelo sistema
MAS sobre corpos externos.
