Teoria Molecular-Cinética dos Gases Ideais
Você sabia,
o que é um experimento mental, experimento gedanken?
É uma prática inexistente, uma experiência de outro mundo, a imaginação do que realmente não existe. Experimentos mentais são como devaneios. Eles dão à luz monstros. Ao contrário de um experimento físico, que é um teste experimental de hipóteses, um “experimento de pensamento” substitui magicamente um teste experimental pelas conclusões desejadas e não testadas, manipulando construções lógicas que na verdade violam a própria lógica ao usar premissas não provadas como provadas, ou seja, por substituição. Assim, a principal tarefa dos requerentes de "experimentos mentais" é enganar o ouvinte ou leitor, substituindo um experimento físico real por sua "boneca" - raciocínio fictício em liberdade condicional sem verificação física propriamente dita.
Preencher a física com "experimentos mentais" imaginários levou a uma imagem absurda, surreal e confusa do mundo. Um pesquisador real deve distinguir tais "invólucros" de valores reais.
Relativistas e positivistas argumentam que o "experimento de pensamento" é uma ferramenta muito útil para testar a consistência de teorias (também surgindo em nossas mentes). Nisso eles enganam as pessoas, pois qualquer verificação só pode ser realizada por uma fonte independente do objeto da verificação. O próprio requerente da hipótese não pode ser um teste de sua própria declaração, uma vez que o motivo dessa declaração em si é a ausência de contradições visíveis para o requerente na declaração.
Vemos isso no exemplo do SRT e do GTR, que se transformaram em uma espécie de religião que rege a ciência e opinião pública. Nenhuma quantidade de fatos que os contradizem pode superar a fórmula de Einstein: "Se o fato não corresponde à teoria, mude o fato" (Em outra versão, "O fato não corresponde à teoria? - Tanto pior para o fato ").
O máximo que um "experimento de pensamento" pode reivindicar é apenas a consistência interna da hipótese dentro da estrutura da própria lógica do requerente, muitas vezes de forma alguma verdadeira. A conformidade com a prática não verifica isso. Um teste real só pode ocorrer em um experimento físico real.
Um experimento é um experimento, porque não é um refinamento do pensamento, mas um teste de pensamento. O pensamento que é consistente consigo mesmo não pode testar a si mesmo. Isso foi comprovado por Kurt Gödel.
Em um gás rarefeito, a distância entre as moléculas é muitas vezes maior que seu tamanho. Nesse caso, a interação entre as moléculas é desprezível e a energia cinética das moléculas é muito maior que a energia potencial de sua interação.
Para explicar as propriedades de uma substância no estado gasoso, em vez de um gás real, é usado seu modelo físico - um gás ideal. O modelo assume:
a distância entre as moléculas é ligeiramente maior que seu diâmetro;
as moléculas são bolas elásticas;
não há forças atrativas entre as moléculas;
quando as moléculas colidem entre si e com as paredes do vaso, atuam forças repulsivas;
O movimento molecular obedece às leis da mecânica.
A equação básica para um gás ideal mkt:
A equação básica do MKT permite calcular a pressão de um gás se a massa da molécula, o valor médio do quadrado da velocidade e a concentração das moléculas são conhecidos.
Pressão de gás ideal reside no fato de que as moléculas em colisão com as paredes do vaso interagem com elas de acordo com as leis da mecânica como corpos elásticos. Quando uma molécula colide com a parede do vaso, a projeção da velocidade v x do vetor velocidade no eixo OX, perpendicular à parede, muda seu sinal para o oposto, mas permanece constante em valor absoluto. Portanto, como resultado das colisões de uma molécula com uma parede, a projeção de seu momento no eixo OX muda de mv 1x = -mv x para mv 2x =mv x . Uma mudança no momento de uma molécula após a colisão com uma parede causa uma força F 1 agindo sobre ela do lado da parede. A mudança no momento de uma molécula é igual ao momento dessa força:
Durante a colisão, de acordo com a terceira lei de Newton, a molécula atua na parede com uma força F 2 igual em valor absoluto à força F 1 e com direção oposta.
Existem muitas moléculas, e cada uma transmite o mesmo momento à parede após a colisão. Em um segundo eles transmitem um impulso 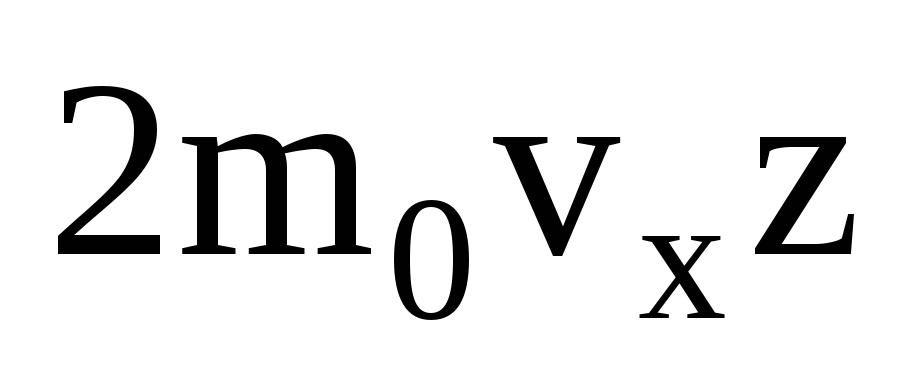 , onde z é o número de colisões de todas as moléculas com a parede, que é proporcional à concentração de moléculas no gás, à velocidade das moléculas e à área da superfície da parede:
, onde z é o número de colisões de todas as moléculas com a parede, que é proporcional à concentração de moléculas no gás, à velocidade das moléculas e à área da superfície da parede: 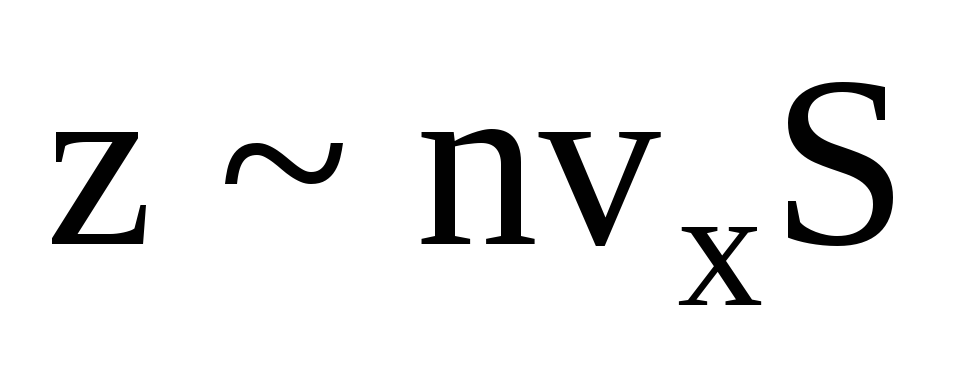 . Apenas metade das moléculas se move em direção à parede, o restante se move na direção oposta:
. Apenas metade das moléculas se move em direção à parede, o restante se move na direção oposta: 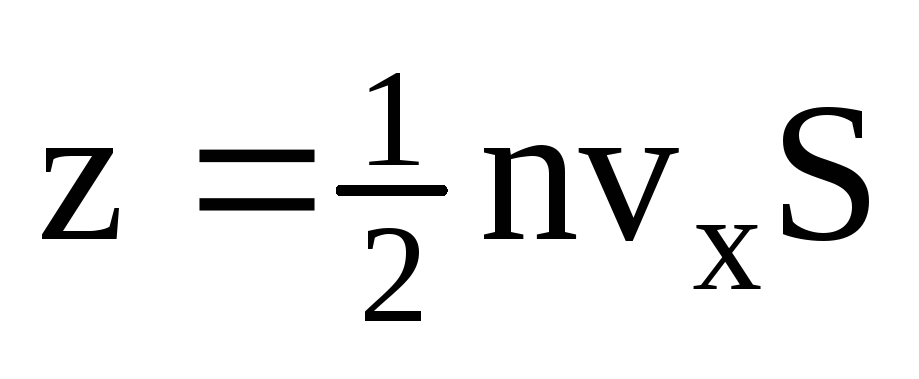 . Então o momento total transferido para a parede em 1 segundo:
. Então o momento total transferido para a parede em 1 segundo: 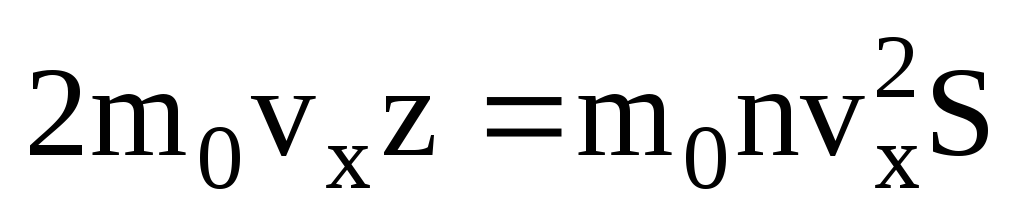 . De acordo com a segunda lei de Newton, a mudança no momento de um corpo por unidade de tempo é igual à força que age sobre ele:
. De acordo com a segunda lei de Newton, a mudança no momento de um corpo por unidade de tempo é igual à força que age sobre ele:
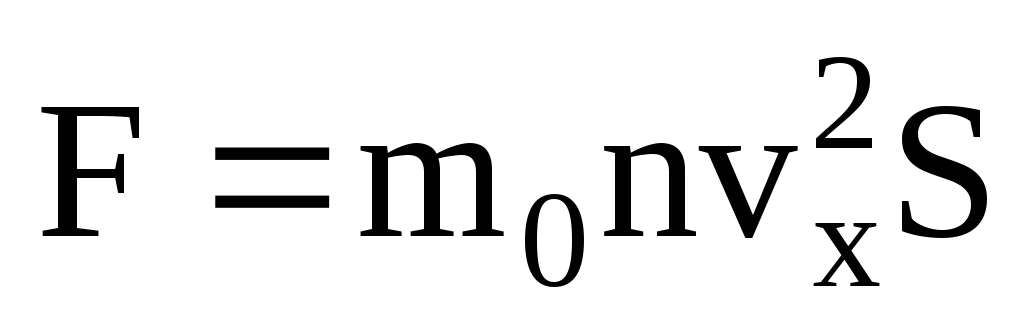
Dado que nem todas as moléculas têm a mesma velocidade, a força que atua na parede será proporcional ao quadrado médio da velocidade. Como as moléculas se movem em todas as direções, os valores médios dos quadrados das projeções de velocidade são iguais. Portanto, o quadrado médio da projeção de velocidade é: 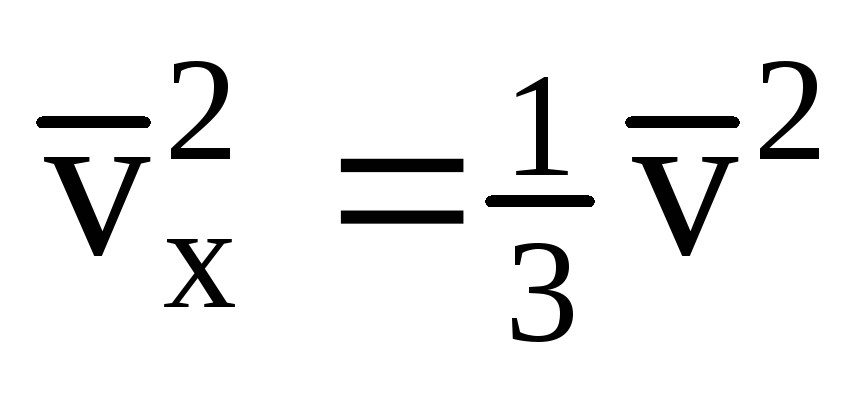 ;
;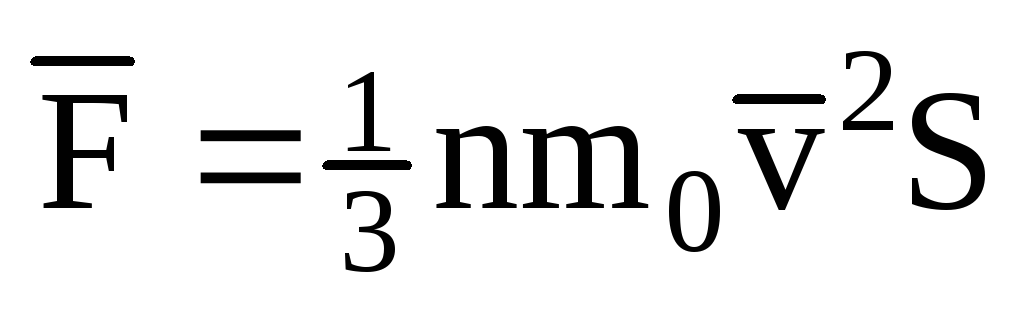 . Então a pressão do gás na parede do vaso é:
. Então a pressão do gás na parede do vaso é:
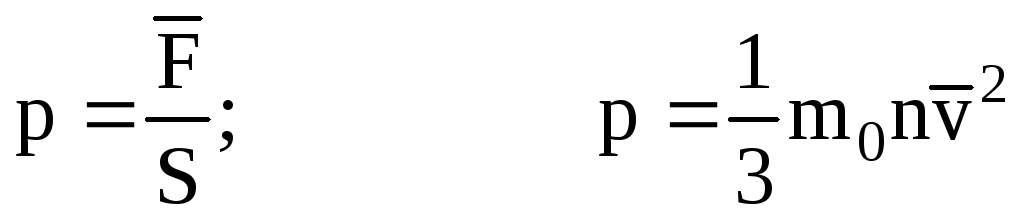 - a equação básica do MKT.
- a equação básica do MKT.
Denotando o valor médio da energia cinética do movimento translacional das moléculas gás ideal:
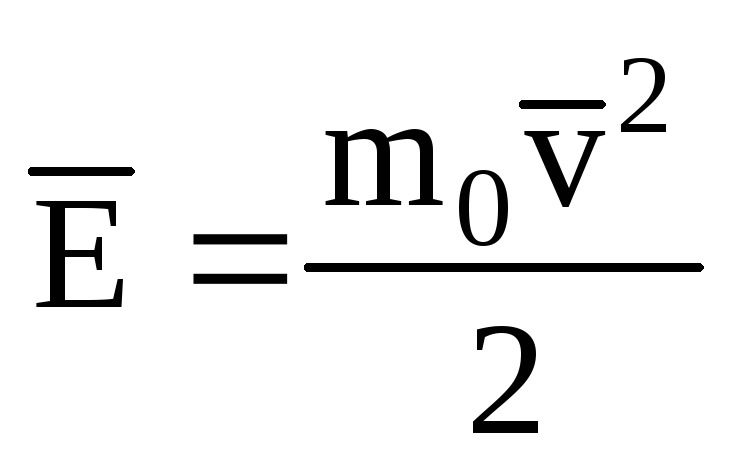 , Nós temos
, Nós temos
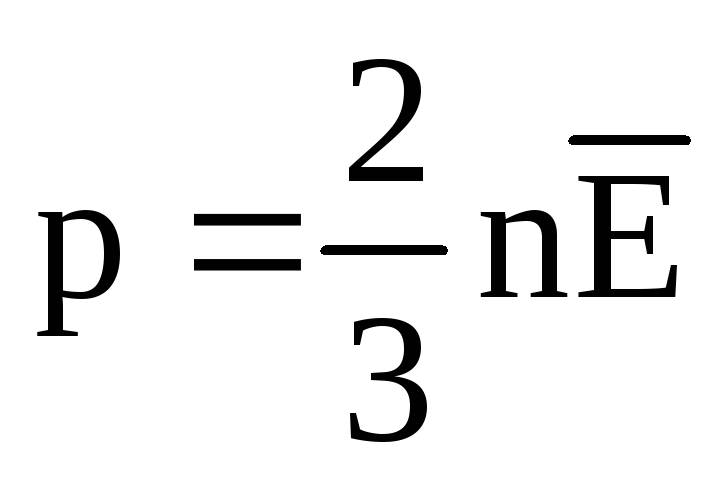
Temperatura e sua medição:
A equação MKT básica para um gás ideal relaciona um parâmetro macroscópico facilmente mensurável - a pressão - a parâmetros de gás microscópicos como a energia cinética média e a concentração de moléculas. Mas, tendo medido apenas a pressão, não podemos descobrir nem o valor médio da energia cinética das moléculas separadamente nem sua concentração. Portanto, para encontrar os parâmetros microscópicos do gás, são necessárias medições de alguma outra quantidade física relacionada à energia cinética média das moléculas. Este valor é temperatura.
Qualquer corpo macroscópico ou grupo de corpos macroscópicos, sob condições externas constantes, passa espontaneamente para um estado de equilíbrio térmico. Equilíbrio térmico - este é um estado no qual todos os parâmetros macroscópicos permanecem inalterados por um tempo arbitrariamente longo.
A temperatura caracteriza o estado de equilíbrio térmico de um sistema de corpos: todos os corpos do sistema que estão em equilíbrio térmico entre si têm a mesma temperatura.
Para medir a temperatura, você pode usar a variação de qualquer grandeza macroscópica dependendo da temperatura: volume, pressão, resistência elétrica, etc.
Na maioria das vezes, na prática, é usada a dependência do volume de líquido (mercúrio ou álcool) da temperatura. Ao calibrar um termômetro, a temperatura do gelo derretido geralmente é tomada como ponto de referência (0); o segundo ponto constante (100) é o ponto de ebulição da água à pressão atmosférica normal (escala Celsius). Como diferentes líquidos se expandem de maneira diferente quando aquecidos, a escala assim estabelecida dependerá em certa medida das propriedades do líquido em questão. Obviamente, 0 e 100°C corresponderão a todos os termômetros, mas 50°C não.
Ao contrário dos líquidos, todos os gases rarefeitos se expandem da mesma maneira quando aquecidos e mudam sua pressão da mesma maneira com uma mudança de temperatura. Portanto, na física, para estabelecer uma escala de temperatura racional, é usada uma mudança na pressão de uma certa quantidade de gás rarefeito a um volume constante ou uma mudança no volume de um gás a uma pressão constante. Essa escala às vezes é chamada escala de temperatura do gás ideal.
No equilíbrio térmico, a energia cinética média do movimento translacional das moléculas de todos os gases é a mesma. A pressão é diretamente proporcional à energia cinética média do movimento translacional das moléculas: 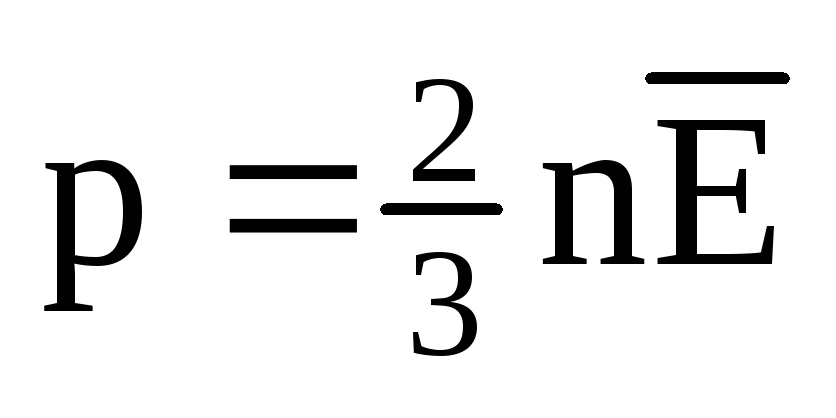 . No equilíbrio térmico, se a pressão de um gás de uma determinada massa e seu volume são fixos, a energia cinética média das moléculas do gás deve ter um valor estritamente definido, como a temperatura. Porque
. No equilíbrio térmico, se a pressão de um gás de uma determinada massa e seu volume são fixos, a energia cinética média das moléculas do gás deve ter um valor estritamente definido, como a temperatura. Porque 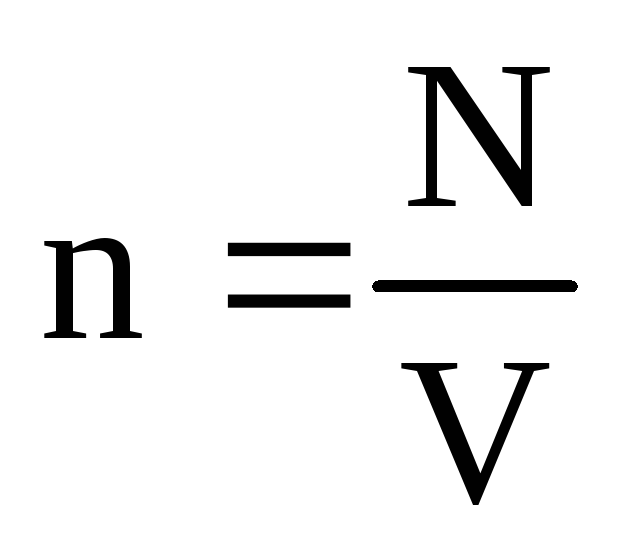 , Que
, Que 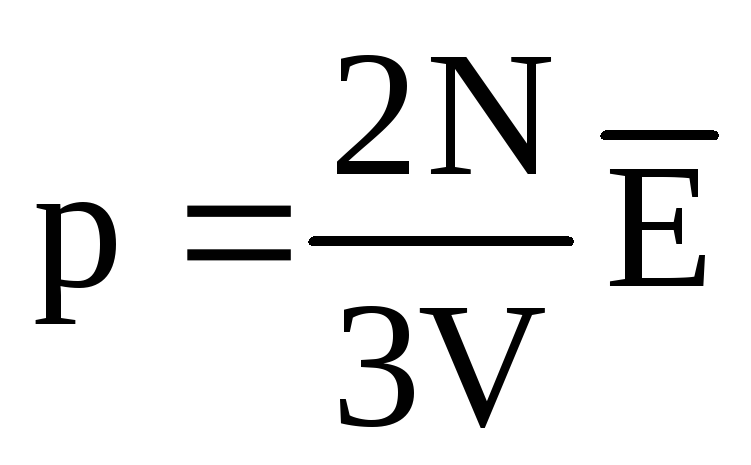 , ou
, ou 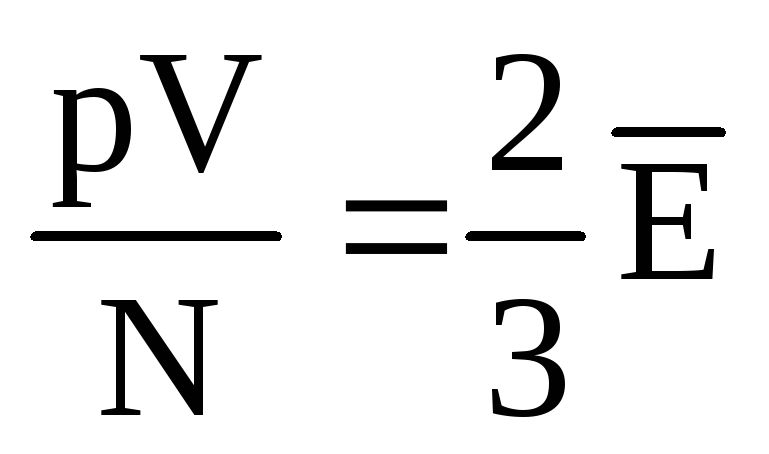 .
.
denotar 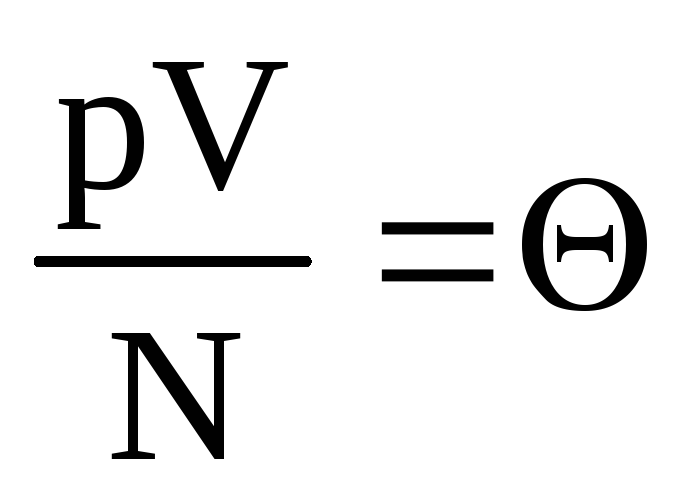 . Valor
. Valor  aumenta com a temperatura e não depende de nada além da temperatura. Portanto, pode ser considerada uma medida natural de temperatura.
aumenta com a temperatura e não depende de nada além da temperatura. Portanto, pode ser considerada uma medida natural de temperatura.
A teoria cinética molecular descreve o comportamento e as propriedades de um objeto ideal especial chamado gás ideal. Este modelo físico é baseado na estrutura molecular da matéria. A criação da teoria molecular está associada aos trabalhos de R. Clausius, J. Maxwell, D. Joule e L. Boltzmann.
Gás ideal. Teoria cinética molecular do gás ideal é construído sobre as seguintes premissas:
átomos e moléculas podem ser vistos como pontos materiais, que estão em movimento contínuo;
o volume intrínseco das moléculas de gás é insignificante em comparação com o volume do recipiente;
todos os átomos e moléculas são distinguíveis, ou seja, é possível, em princípio, seguir o movimento de cada partícula;
antes da colisão das moléculas de gás entre elas, não há forças de interação, e as colisões das moléculas entre si e com as paredes do vaso são consideradas absolutamente elásticas;
o movimento de cada átomo ou molécula de um gás é descrito pelas leis da mecânica clássica.
As leis obtidas para um gás ideal podem ser utilizadas no estudo de gases reais. Para isso, são criados modelos experimentais de um gás ideal, nos quais as propriedades de um gás real são próximas às de um gás ideal (por exemplo, a baixas pressões e altas temperaturas).
Leis dos gases ideais
lei de Boyle-Mariotte:
para uma dada massa de gás a uma temperatura constante, o produto da pressão do gás e seu volume é um valor constante: pV = const , (1.1)
no T = const , m = const .
Curva mostrando a relação entre quantidades R E V, caracteriza as propriedades de uma substância a uma temperatura constante, e é chamado isotérmica esta é uma hipérbole (Fig. 1.1.), e o processo que ocorre a uma temperatura constante é chamado isotérmico.
Leis de Gay-Lussac:
O volume de uma dada massa de gás a pressão constante varia linearmente com a temperatura
V = V 0 (1 + t ) no P = constante , m = const . (1.2)

p = p 0 (1 + t ) no V = constante , m = const . (1.3)
Nas equações (1.2) e (1.3), a temperatura é expressa na escala Celsius, pressão e volume - em
0 С, enquanto
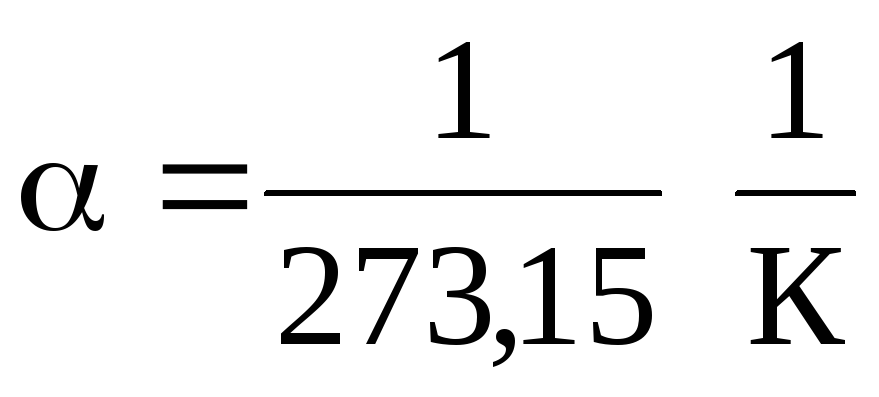 .
.
Um processo que ocorre a pressão constante é chamado isobárica, pode ser representado como uma função linear (Fig. 1.2.).
Um processo que ocorre a volume constante é chamado isocórico(Fig. 1.3.).
Segue das equações (1.2) e (1.3) que isóbaras e isócoras interceptam o eixo da temperatura no ponto t =1/ \u003d - 273,15 С . Se movermos a origem para este ponto, passamos para a escala Kelvin.
Introduzindo nas fórmulas (1.2) e (1.3) temperatura termodinâmica, as leis de Gay-Lussac podem ser dadas de uma forma mais conveniente:
V = V 0 (1+t) = = V 0 = =V 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
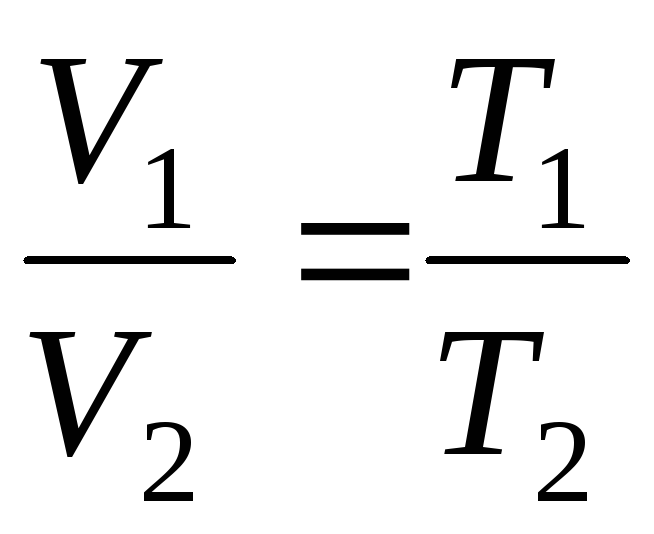 no
p=const, m=const
;
(1.4)
no
p=const, m=const
;
(1.4)
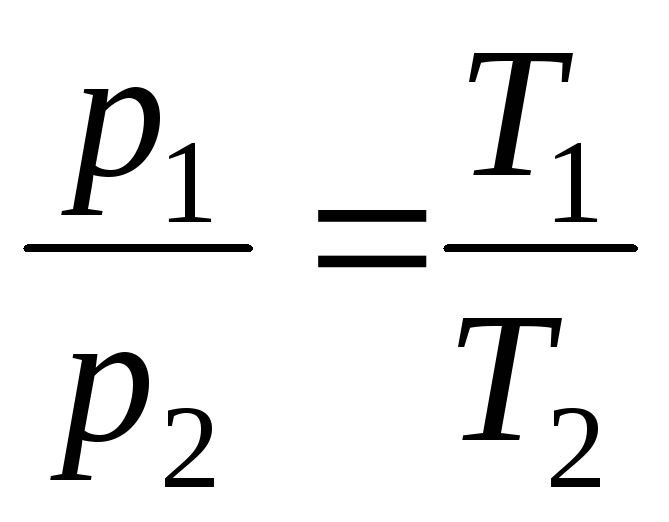 no V = constante, m = constante
,
(1.5)
no V = constante, m = constante
,
(1.5)
onde os índices 1 e 2 referem-se a estados arbitrários situados na mesma isóbara ou isócora .
Lei de Avogadro:
moles de quaisquer gases nas mesmas temperaturas e pressões ocupam os mesmos volumes.
Em condições normais, esse volume é igual a V,0 \u003d 22,4110 -3 m 3 / mol . Por definição, em um mol várias substâncias contém o mesmo número de moléculas, igual a Avogadro constante:N A = 6,02210 23 mol -1 .
Lei de Dalton:
pressão da mistura gases ideais igual à soma das pressões parciais R 1 , R 2 , R 3 … R n, gases nele incluídos:
p = p 1 + p 2 + R 3 + …+p n .
Pressão parcial – Esse a pressão que o gás na composição produziria mistura de gases se ele sozinho ocupasse um volume igual ao volume da mistura na mesma temperatura.
Equação de estado do gás ideal
(Equação de Clapeyron-Mendeleev)
Existe uma relação definida entre temperatura, volume e pressão. Esse relacionamento pode ser representado por uma dependência funcional:
f(p, V, T)= 0.
Por sua vez, cada uma das variáveis ( p,v,t) é uma função de duas outras variáveis. O tipo de dependência funcional para cada estado de fase de uma substância (sólido, líquido, gasoso) é encontrado experimentalmente. Este é um processo muito trabalhoso e a equação de estado foi estabelecida apenas para gases que estão em estado rarefeito, e de forma aproximada para alguns gases comprimidos. Para substâncias que não estão em estado gasoso, esse problema ainda não foi resolvido.
O físico francês B. Clapeyron trouxe equação de estado do gás ideal, combinando as leis de Boyle-Mariotte, Gay-Lussac, Charles:
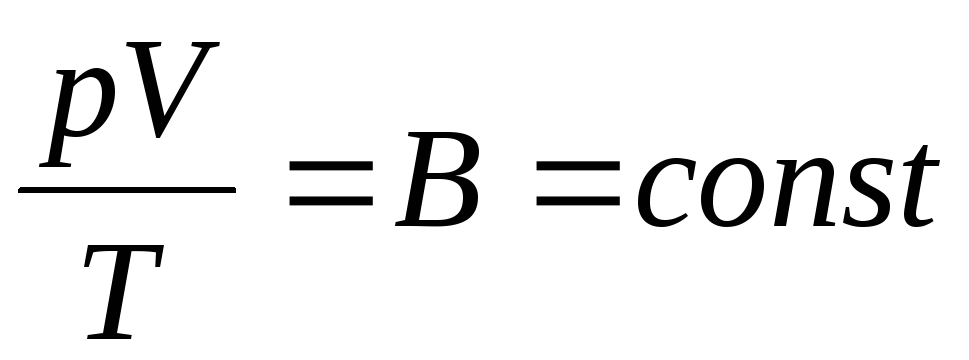 . (1.6)
. (1.6)
A expressão (1.6) é a equação de Clapeyron, onde EMé a constante do gás. É diferente para diferentes gases.
D.I. Mendeleev combinou a equação de Clapeyron com a lei de Avogadro, referindo a equação (1.6) a um mol e usando o volume molar V . De acordo com a lei de Avogadro, para o mesmo R E T moles de todos os gases ocupam o mesmo volume molar V .
.
Portanto, a constante EM será a mesma para todos os gases ideais. Esta constante é geralmente denotada R e igual a R=
8,31
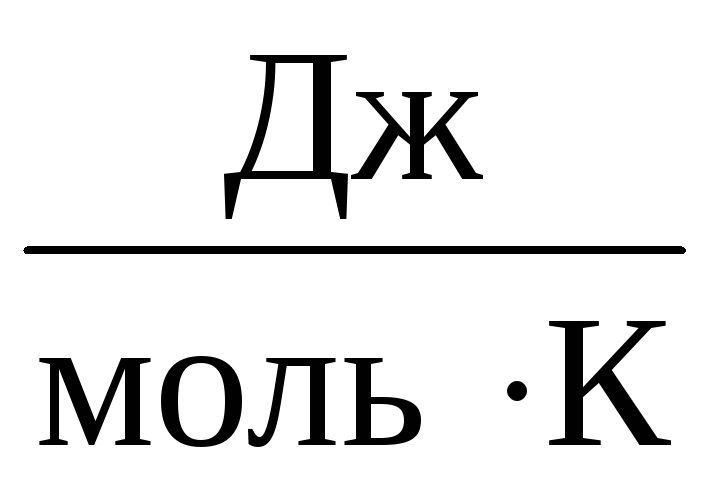 .
.
Equação de Clapeyron-Mendeleev tem a seguinte forma:
p V . = R T.
Da equação (1.7) para um mol de gás, pode-se ir para à equação de Clapeyron-Mendeleev para uma massa arbitrária de gás:
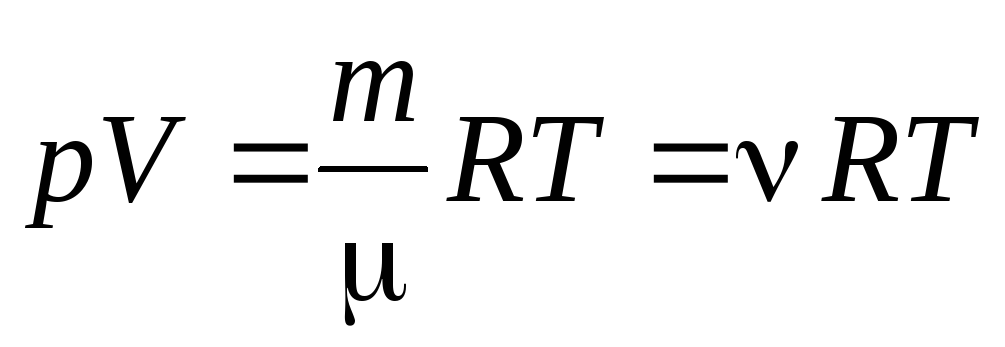 , (1.7)
, (1.7)
Onde
–
massa molar
(massa de um mol de substância, kg/mol); m
massa de gás;
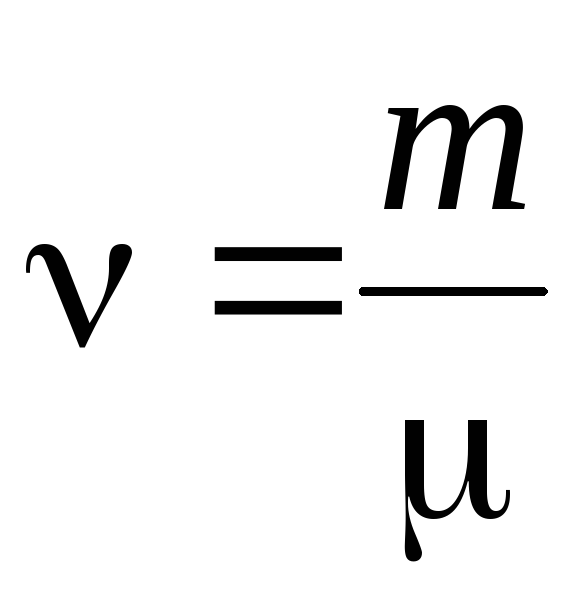 - quantidade de matéria .
- quantidade de matéria .
Mais frequentemente, outra forma da equação de estado do gás ideal é usada, introduzindo constante de Boltzmann: 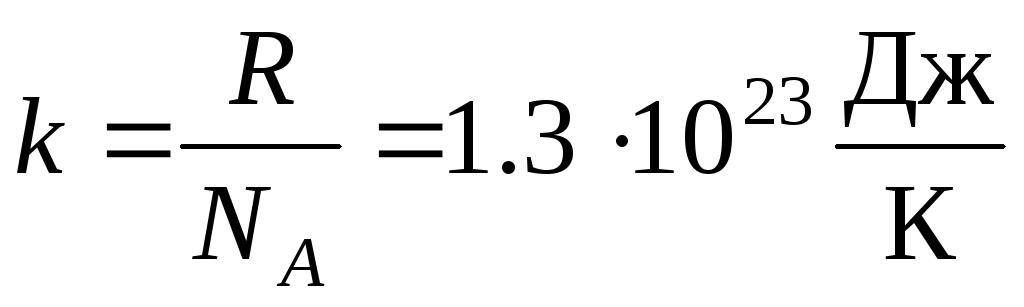 .
.
Então a equação (1.7) fica assim:
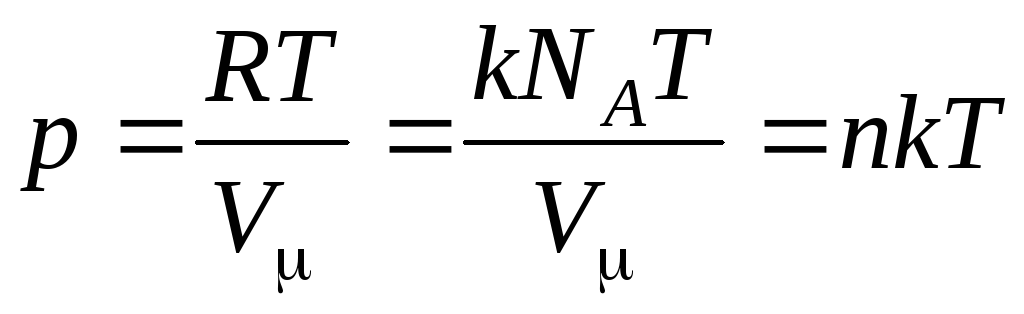 ,
(1.8)
,
(1.8)
Onde
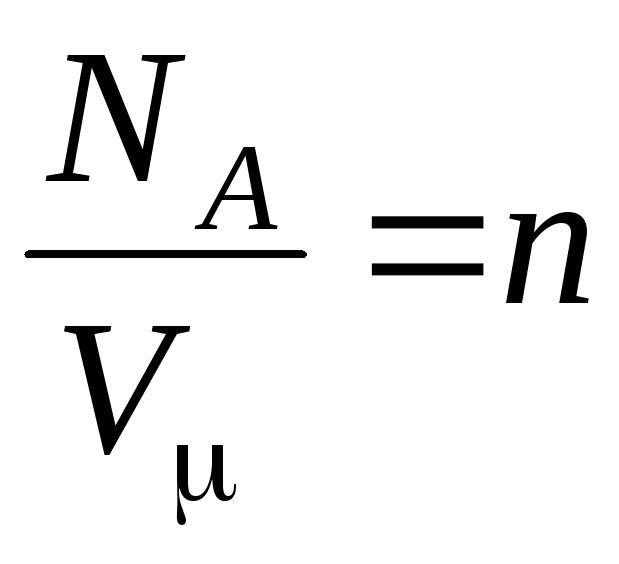 –
concentração de moléculas (número de moléculas por unidade de volume). Segue-se dessa expressão que a pressão de um gás ideal é diretamente proporcional à concentração de suas moléculas ou à densidade do gás. Nas mesmas temperaturas e pressões, todos os gases contêm o mesmo número de moléculas por unidade de volume. O número de moléculas contidas em 1 m 3 em condições normais é chamado
número Loschmidt:
–
concentração de moléculas (número de moléculas por unidade de volume). Segue-se dessa expressão que a pressão de um gás ideal é diretamente proporcional à concentração de suas moléculas ou à densidade do gás. Nas mesmas temperaturas e pressões, todos os gases contêm o mesmo número de moléculas por unidade de volume. O número de moléculas contidas em 1 m 3 em condições normais é chamado
número Loschmidt:
N eu = 2,68 10 25 m -3.
Equação básica da cinética molecular
teoria dos gases ideais
A tarefa mais importante A teoria cinética dos gases é o cálculo teórico da pressão de um gás ideal baseado em conceitos de cinética molecular. A equação básica da teoria cinética molecular de gases ideais é derivada usando Métodos estatísticos.
Supõe-se que as moléculas de gás se movem aleatoriamente, o número de colisões mútuas entre as moléculas de gás é insignificante em comparação com o número de impactos nas paredes do recipiente e essas colisões são absolutamente elásticas. Na parede do vaso, alguma área elementar S e calcule a pressão que as moléculas de gás exercerão nessa área.
É necessário levar em consideração o fato de que, na realidade, as moléculas podem se mover para o local em diferentes ângulos e podem ter várias velocidades, que, além disso, pode mudar a cada colisão. Nos cálculos teóricos, o movimento caótico das moléculas é idealizado, elas são substituídas pelo movimento ao longo de três direções mutuamente perpendiculares.
Se considerarmos um vaso em forma de cubo, no qual N moléculas de gás em seis direções, é fácil ver que a qualquer momento 1/3 do número de todas as moléculas se move ao longo de cada uma delas e metade delas (ou seja, 1/6 do número de todas as moléculas) se move em uma direção e a segunda metade (também 1/6) - na direção oposta. A cada colisão, uma molécula individual movendo-se perpendicularmente ao local, refletindo, transfere momento para ela, enquanto seu momento (momentum) muda na quantidade
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
O número de impactos de moléculas que se movem em uma determinada direção no local será igual a: N = 1/6 n Svt. Ao colidir com a plataforma, essas moléculas irão transferir momento para ela.
P= N P 1 =2 m 0 vnSvt = m 0 v 2 nSt,
Onde né a concentração de moléculas. Então a pressão que o gás exerce na parede do vaso será igual a:
p = 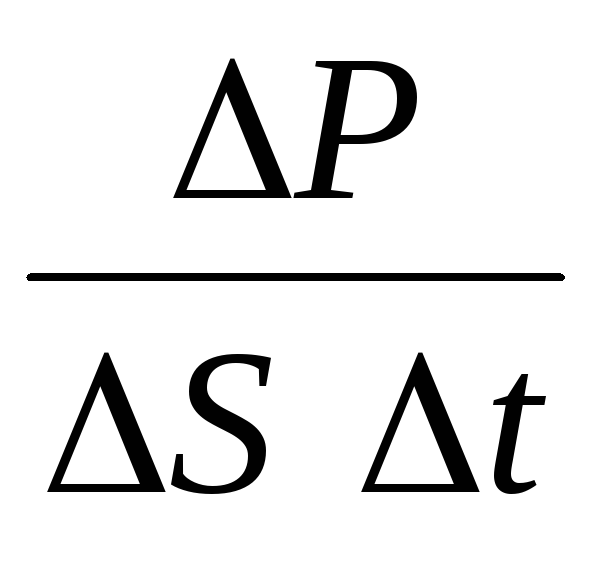 =
n m 0
v 2
.
(1.9)
=
n m 0
v 2
.
(1.9)
No entanto, as moléculas de gás se movem em velocidades diferentes: v 1 , v 2 , …,v n, então as velocidades devem ser calculadas em média. A soma dos quadrados das velocidades das moléculas de gás, dividido pelo seu número, determina a raiz quadrada média da velocidade:
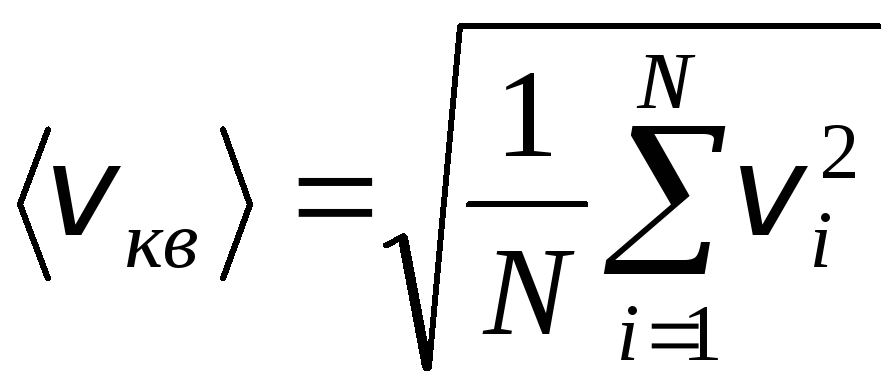 .
.
Equação (1.9) terá a forma:
![]() (1.10)
(1.10)
a expressão (1.10) é chamada a equação básica da teoria cinética molecular gases ideais.
Dado que 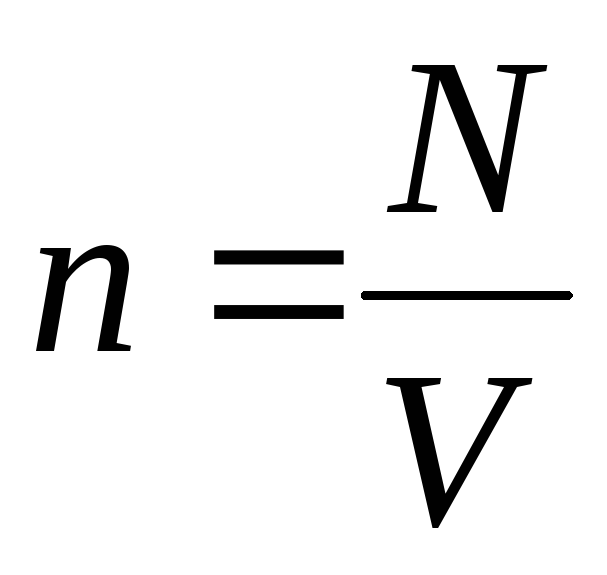 , Nós temos:
, Nós temos:
p V = N 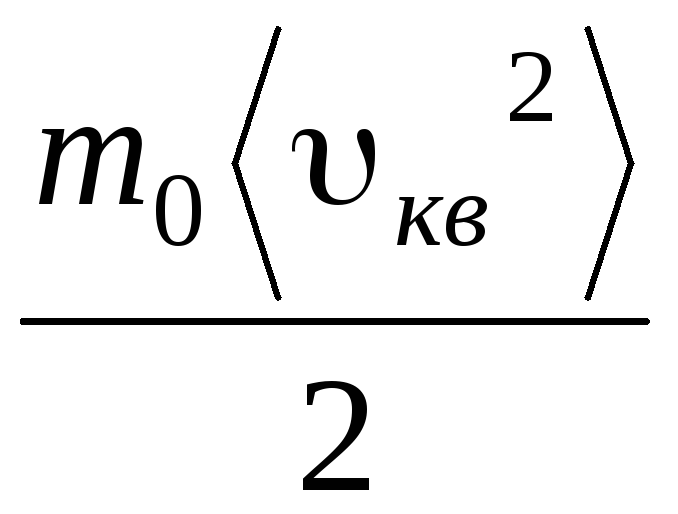 =E,
(1.11)
=E,
(1.11)
Onde Eé a energia cinética total do movimento translacional de todas as moléculas de gás. Portanto, a pressão do gás é diretamente proporcional à energia cinética do movimento translacional das moléculas do gás.
Para um mol de gás m =, e a equação de Clapeyron-Mendeleev tem a seguinte forma:
p V . = R T,
e como segue de (1.11) que p V . = v quadrado 2 , obtemos:
R.T.= v quadrado 2 .
Portanto, a raiz quadrada média da velocidade das moléculas de gás é igual a
v
quadrado
=
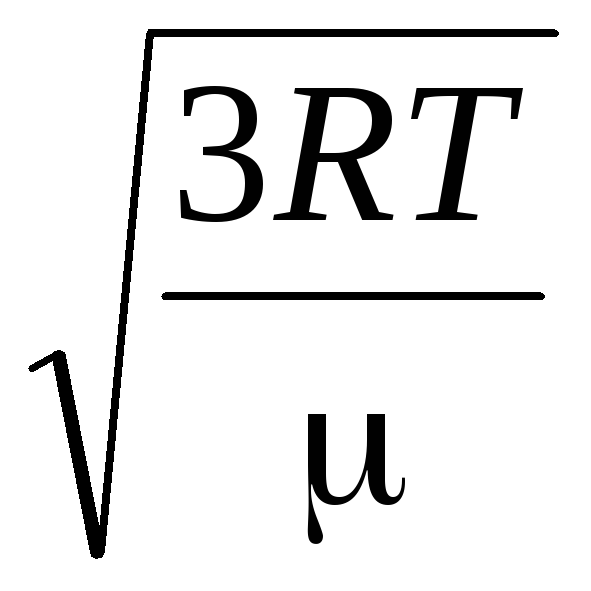 =
=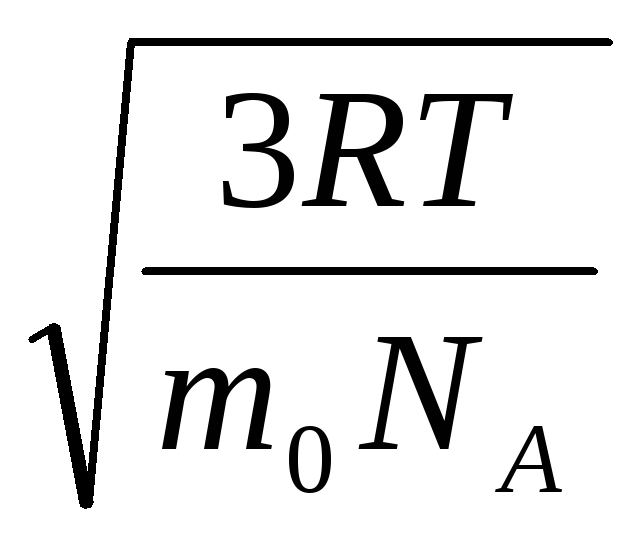 =
= ,
,
Onde k = R/N A = 1,3810 -23 J/K – constante de Boltzmann. A partir daqui você pode encontrar a velocidade média quadrada das moléculas de oxigênio à temperatura ambiente - 480 m/s, hidrogênio - 1900 m/s.
Significado molecular-cinético da temperatura
A temperatura é uma medida quantitativa de quão quente é um corpo. Para esclarecer o significado físico da temperatura termodinâmica absoluta T Vamos comparar a equação básica da teoria molecular-cinética dos gases (1.14) com a equação de Clapeyron-Mendeleev p V = R.T.
Equacionando as partes certas dessas equações, encontramos o valor médio da energia cinética 0 de uma molécula ( = N/N A , k=R/N A):
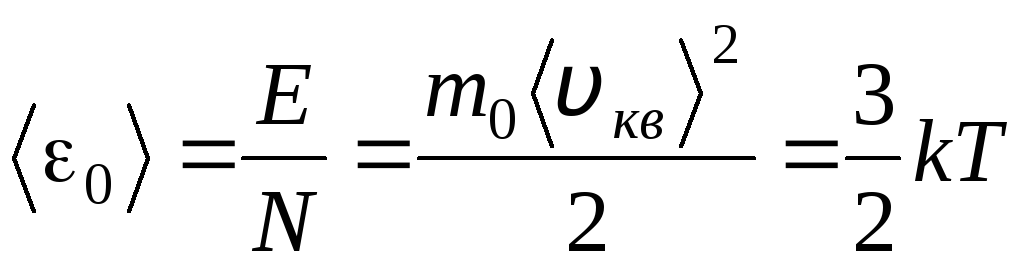 .
.
A conclusão mais importante da teoria cinética molecular decorre desta equação: a energia cinética média do movimento translacional de uma molécula de um gás ideal depende apenas da temperatura, enquanto é diretamente proporcional à temperatura termodinâmica. Assim, a escala de temperatura termodinâmica adquire um significado físico direto: em T= 0 a energia cinética das moléculas de gás ideal é zero. Portanto, com base nessa teoria, o movimento de translação das moléculas de gás será interrompido e sua pressão será igual a zero.
Teoria das propriedades de equilíbrio de um gás ideal
Número de graus de liberdade das moléculas. A teoria cinética molecular de gases ideais leva a uma consequência muito importante: as moléculas de gás se movem aleatoriamente e a energia cinética média do movimento translacional da molécula é determinada apenas pela temperatura.
A energia cinética do movimento molecular não é esgotada pela energia cinética energia de movimento para a frente: também consiste em cinética energias rotação E flutuações moléculas. Para calcular a energia que entra em todos os tipos de movimento molecular, é necessário definir número de graus de liberdade.
Sob número de graus de liberdade (eu) do corpo está implícito o número de coordenadas independentes que devem ser inseridas para determinar a posição do corpo no espaço.
H  Por exemplo, um ponto material tem três graus de liberdade, pois sua posição no espaço é determinada por três coordenadas: x, y E z. Portanto, uma molécula monoatômica tem três graus de liberdade de movimento translacional.
Por exemplo, um ponto material tem três graus de liberdade, pois sua posição no espaço é determinada por três coordenadas: x, y E z. Portanto, uma molécula monoatômica tem três graus de liberdade de movimento translacional.
D 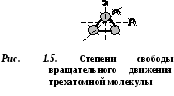 uma molécula bucatômica tem 5 graus de liberdade (Fig. 1.4): 3 graus de liberdade de movimento translacional e 2 graus de liberdade de movimento rotacional.
uma molécula bucatômica tem 5 graus de liberdade (Fig. 1.4): 3 graus de liberdade de movimento translacional e 2 graus de liberdade de movimento rotacional.
Moléculas de três ou mais átomos têm 6 graus de liberdade: 3 graus de liberdade de movimento translacional e 3 graus de liberdade de movimento rotacional (Fig. 1.5).
Cada molécula de gás tem um certo número de graus de liberdade, três dos quais correspondem ao seu movimento de translação.
Regulamento sobre a distribuição igualitária de energia
por graus de liberdade
A premissa básica da teoria molecular-cinética dos gases é a suposição de completa aleatoriedade no movimento das moléculas. Isso se aplica a movimentos oscilatórios e rotacionais, e não apenas translacionais. Supõe-se que todas as direções de movimento das moléculas em um gás são igualmente prováveis. Portanto, pode-se supor que para cada grau de liberdade de uma molécula, em média, existe a mesma quantidade de energia - esta é a posição na equipartição de energia em graus de liberdade. A energia por um grau de liberdade de uma molécula é:
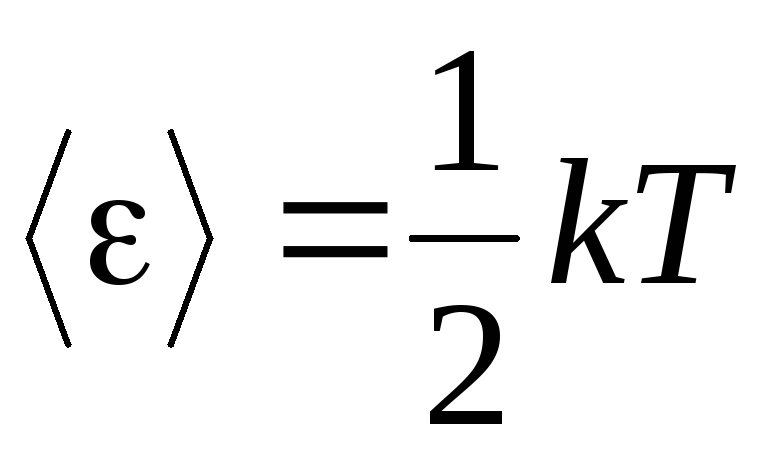 . (1.12)
. (1.12)
Se a molécula tiver eu graus de liberdade, então para cada grau de liberdade existe em média:
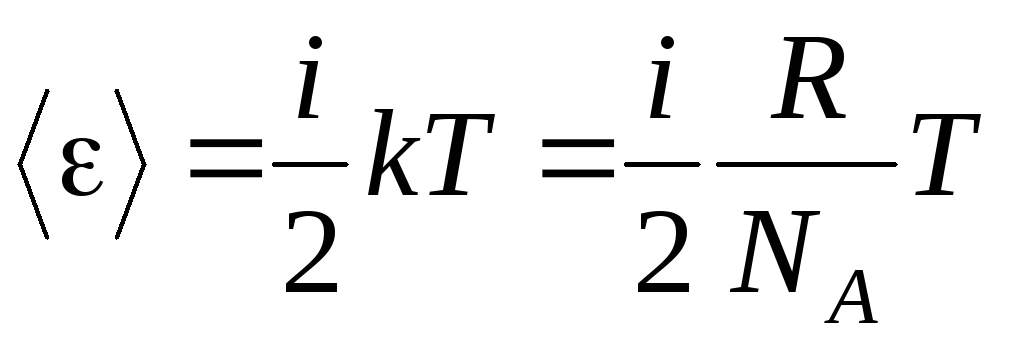 .
(1.13)
.
(1.13)
Energia interna de um gás ideal
Se atribuirmos a oferta total de energia interna do gás a um mol, obtemos seu valor multiplicando pelo número de Avogadro:
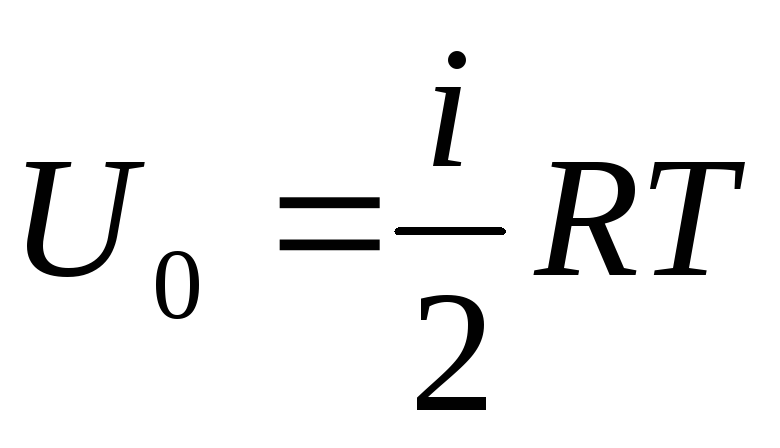 .
(1.14)
.
(1.14)
Segue-se que a energia interna de um mol de um gás ideal depende apenas da temperatura e do número de graus de liberdade das moléculas do gás.
Distribuições de Maxwell e Boltzmann
Distribuição das moléculas de um gás ideal em termos de velocidades e energias de movimento térmico (distribuição de Maxwell). A uma temperatura constante do gás, todas as direções do movimento molecular são consideradas igualmente prováveis. Nesse caso, a raiz quadrada média da velocidade de cada molécula permanece constante e é igual a
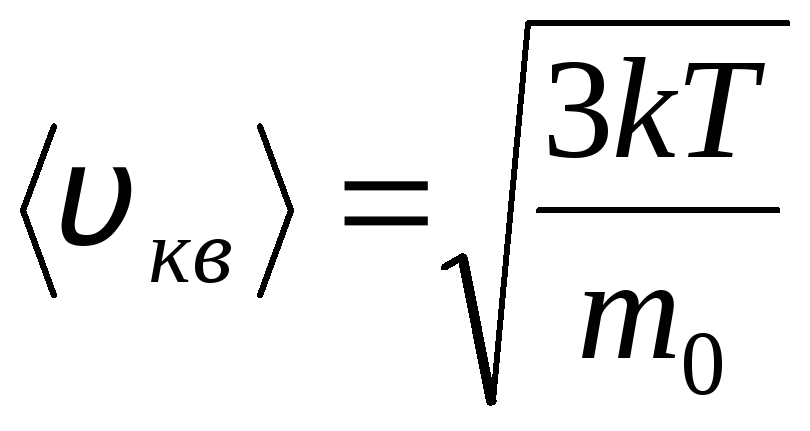 .
.
Isso é explicado pelo fato de que em um gás ideal, que está em estado de equilíbrio, é estabelecida uma certa distribuição de velocidade estacionária das moléculas que não muda com o tempo. esta distribuição está sujeita a uma certa lei estatística, que foi derivada teoricamente por J. Maxwell. A lei de Maxwell é descrita pela função
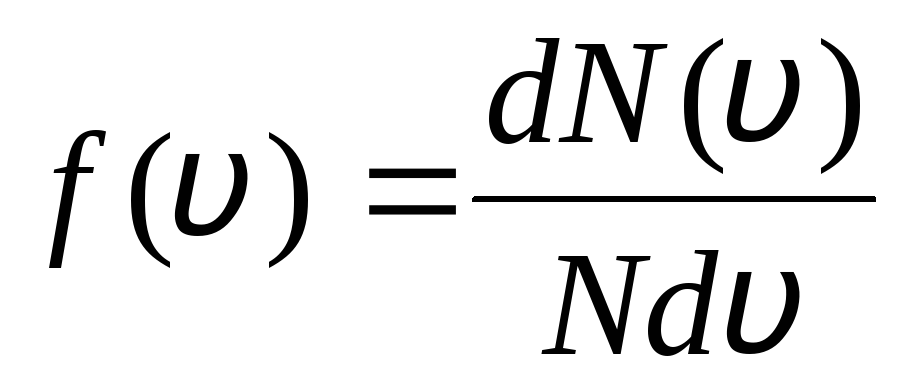 ,
,
essa é a função f(v) determina o número relativo de moléculas  , cujas velocidades estão no intervalo de v
antes v+dv. Aplicando os métodos da teoria da probabilidade, Maxwell descobriu a lei de distribuição de moléculas de um gás ideal em termos de velocidades:
, cujas velocidades estão no intervalo de v
antes v+dv. Aplicando os métodos da teoria da probabilidade, Maxwell descobriu a lei de distribuição de moléculas de um gás ideal em termos de velocidades:
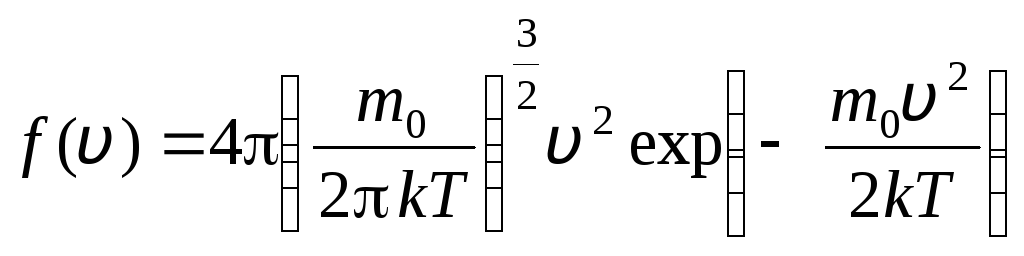 . (1.15)
. (1.15)
A função de distribuição é mostrada graficamente na fig. 1.6. A área delimitada pela curva de distribuição e o eixo x é igual a um. Isso significa que a função f(v) satisfaz a condição de normalização:
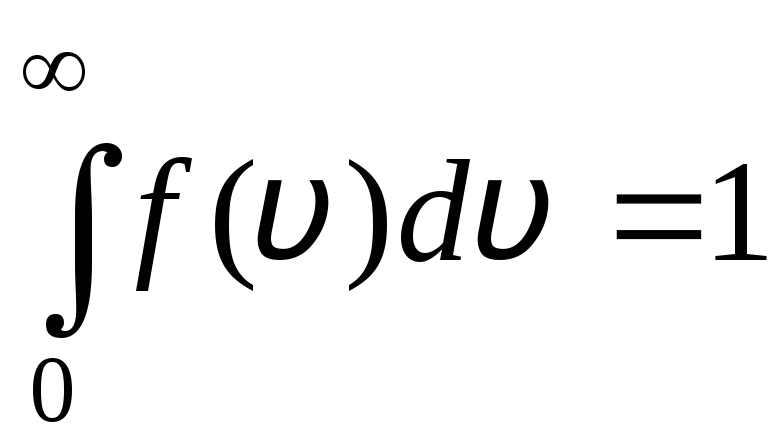 .
.
COM  velocidade na qual a função de distribuição de moléculas de gás ideal em termos de velocidades f(v) é máximo, é chamado provavelmente
velocidade
v B .
velocidade na qual a função de distribuição de moléculas de gás ideal em termos de velocidades f(v) é máximo, é chamado provavelmente
velocidade
v B .
valores v = 0 E v = correspondem ao mínimo de expressão (1.15). A velocidade mais provável pode ser encontrada diferenciando a expressão (1.23) e igualando-a a zero:
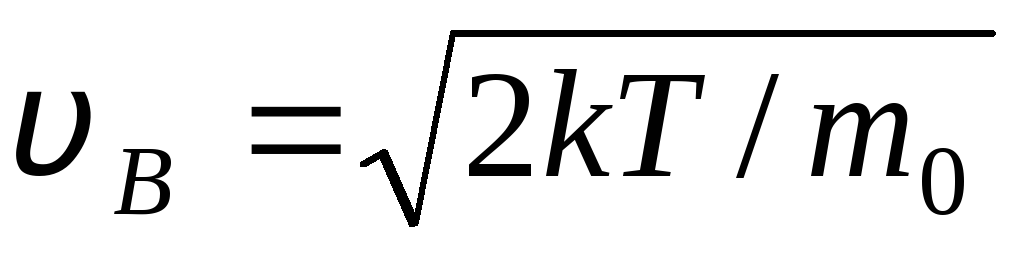 =
=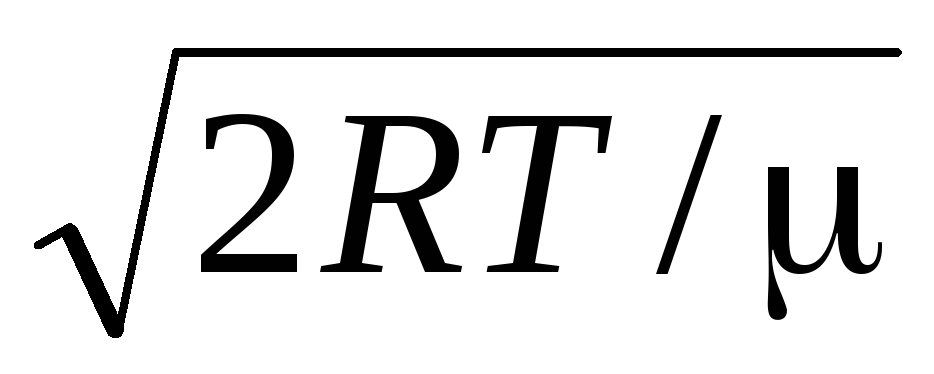 =
1,41
=
1,41
Com o aumento da temperatura, o máximo da função se deslocará para a direita (Fig. 1.6), ou seja, com o aumento da temperatura, a velocidade mais provável também aumenta, porém a área delimitada pela curva permanece inalterada. Deve-se notar que em gases e em baixas temperaturas há sempre um pequeno número de moléculas que se movem em altas velocidades. A presença de tais moléculas "quentes" grande importância durante muitos processos.
velocidade média aritmética moléculas é determinado pela fórmula
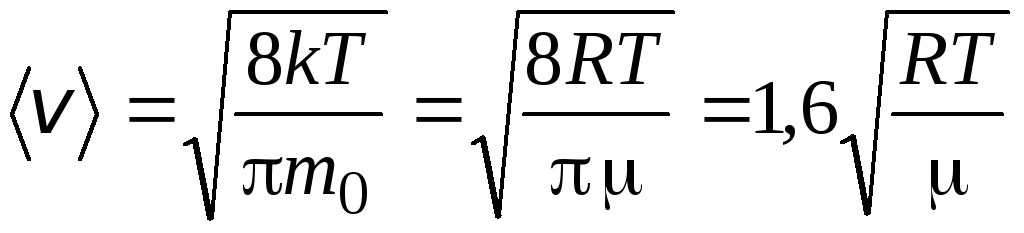 .
.
Raiz da velocidade média quadrática
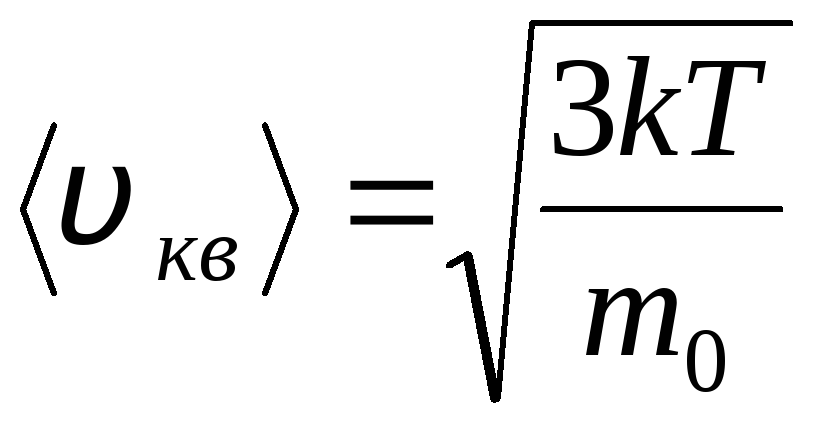 =
1,73
=
1,73 .
.
A razão dessas velocidades não depende da temperatura ou do tipo de gás.
Função de distribuição de moléculas por energias de movimento térmico. Essa função pode ser obtida substituindo o valor da energia cinética em vez da velocidade na equação de distribuição de moléculas (1.15):
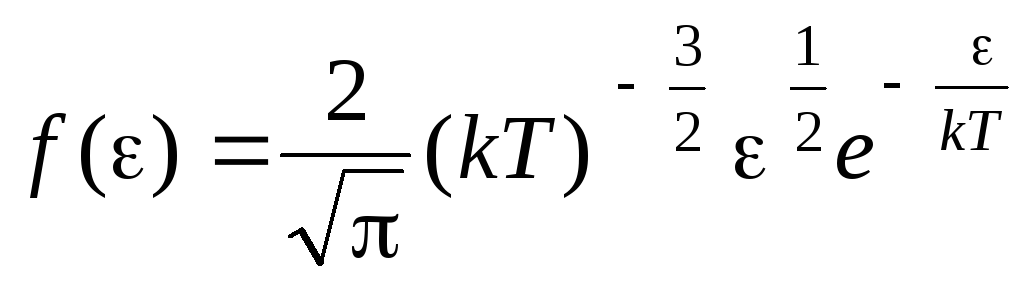 .
.
Tendo integrado a expressão sobre os valores de energia de  antes
antes 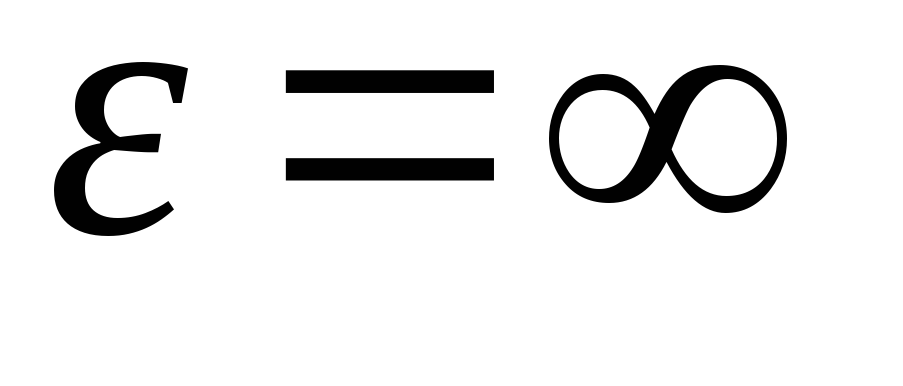
 , Nós temos energia cinética média moléculas de gás ideal:
, Nós temos energia cinética média moléculas de gás ideal:
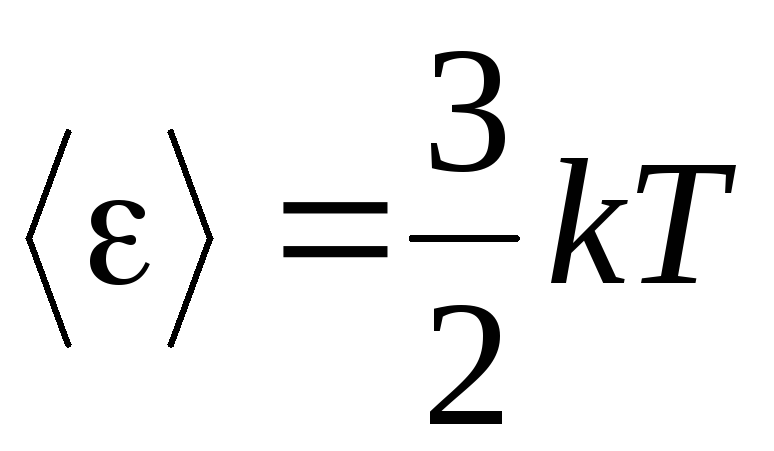 .
.
fórmula barométrica. distribuição de Boltzmann. Ao derivar a equação básica da teoria cinética molecular dos gases e a distribuição de Maxwell das moléculas por velocidades, assumiu-se que as moléculas de um gás ideal não são afetadas por forças externas, portanto as moléculas são distribuídas uniformemente ao longo do volume. No entanto, as moléculas de qualquer gás estão no campo gravitacional da Terra. Ao derivar a lei da dependência da pressão com a altura, assume-se que o campo gravitacional é uniforme, a temperatura é constante e a massa de todas as moléculas é a mesma:
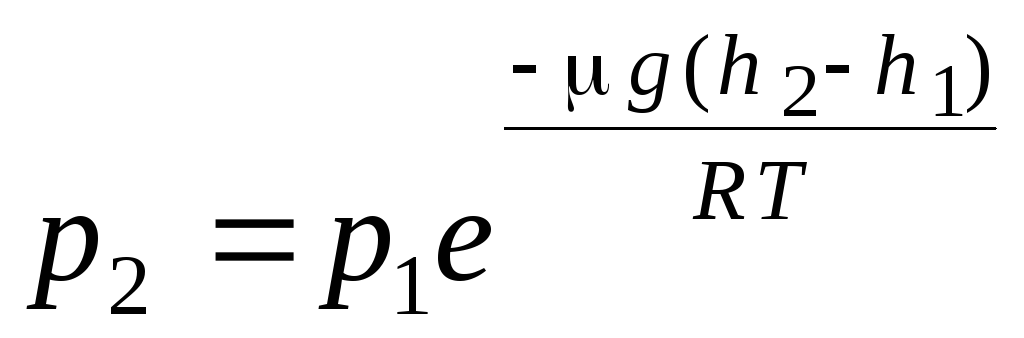 . (1.16)
. (1.16)
A expressão (1.16) é chamada fórmula barométrica. Ele permite que você encontre a pressão atmosférica dependendo da altitude, ou medindo a pressão, você pode encontrar a altitude. Porque h 1 é a altura acima do nível do mar, onde a pressão é considerada normal, então a expressão pode ser modificada:
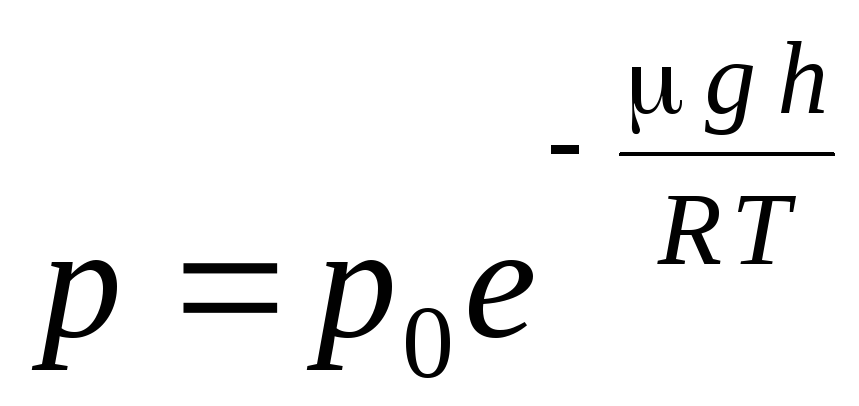 .
.
A fórmula barométrica pode ser convertida usando a expressão p = nkT:
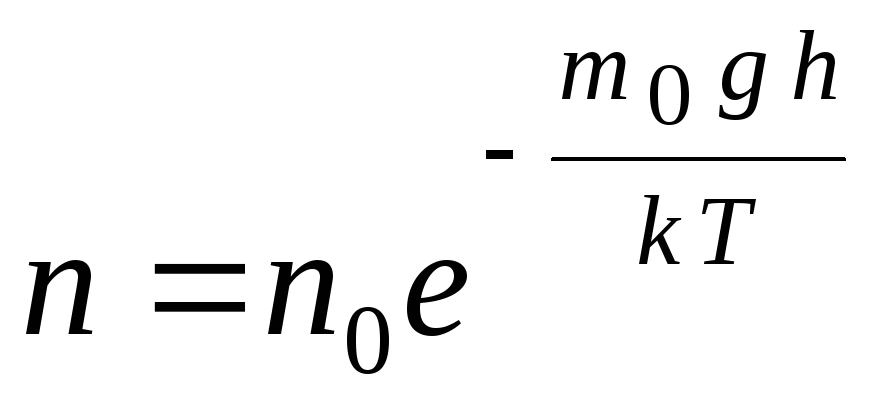 ,
,
G  de n
–
concentração de moléculas em altitude h,
m 0
gh=P–
energia potencial de uma molécula em um campo gravitacional. A temperatura constante, a densidade do gás é maior onde a energia potencial da molécula é menor. Graficamente, a lei da diminuição do número de partículas por unidade de volume com altura se parece com a mostrada na Fig. 1.7.
de n
–
concentração de moléculas em altitude h,
m 0
gh=P–
energia potencial de uma molécula em um campo gravitacional. A temperatura constante, a densidade do gás é maior onde a energia potencial da molécula é menor. Graficamente, a lei da diminuição do número de partículas por unidade de volume com altura se parece com a mostrada na Fig. 1.7.
Para um campo de potencial externo arbitrário, escrevemos a seguinte expressão geral
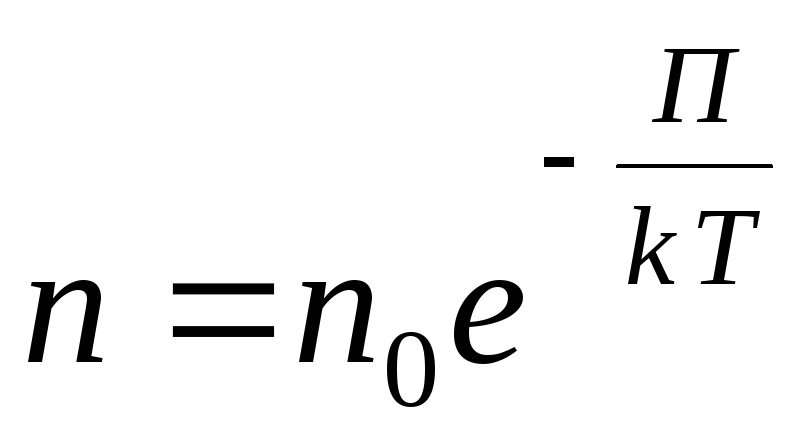 ,
,
