Capacidade calorífica do sulfeto de hidrogênio em várias temperaturas. Capacidade calorífica específica do gás natural
Não específica, mas a capacidade térmica total, no sentido físico geralmente aceito, é a capacidade de uma substância se aquecer. Pelo menos é o que qualquer livro de física térmica nos diz - isto é definição clássica capacidade de calor(texto correto). Na verdade, esta é uma característica física interessante. Pouco conhecido por nós na vida cotidiana "lado da moeda". Acontece que quando o calor é fornecido do lado de fora (aquecimento, aquecimento), nem todas as substâncias reagem igualmente ao calor ( energia térmica) e aquecer de forma diferente. Habilidade GÁS de origem natural utilizado como combustível receber, receber, reter e acumular (acumular) energia térmica é chamado a capacidade de calor do gás combustível NATURAL. E ela mesma capacidade calorífica do metano, é uma característica física que descreve as propriedades termofísicas do gás combustível. Ao mesmo tempo, em diferentes aspectos aplicados, dependendo de um caso prático específico, uma coisa pode vir a ser importante para nós. Por exemplo: a capacidade de uma substância tomar caloroso ou a capacidade de acumular energia térmica ou "talento" para mantê-lo. No entanto, apesar de alguma diferença, no sentido físico, as propriedades que precisamos serão descritas capacidade calorífica do metano.
Um pequeno, mas muito "problema" de natureza fundamental é que a capacidade de aquecer - capacidade térmica do metano, está diretamente relacionado não só composição química, a estrutura molecular de uma substância, mas também com sua quantidade (peso, massa, volume). Devido a uma ligação tão "desagradável", o general capacidade calorífica do metano torna-se muito inconveniente característica física da substância. Desde então, um parâmetro medido descreve simultaneamente "duas coisas diferentes". A saber: realmente caracteriza propriedades termofísicas do GÁS NATURAL, no entanto, "de passagem" também leva em conta sua quantidade. Formando uma espécie de característica integral, na qual a física térmica "alta" e uma quantidade "banal" de matéria (no nosso caso: gás combustível) se conectam automaticamente.
Bem, por que precisamos de tais características termofísicas, nas quais a "psique inadequada" é claramente traçada? Do ponto de vista da física, o total capacidade calorífica do metano(da forma mais desajeitada), tenta não só descrever a quantidade de energia térmica que pode se acumular no gás combustível, mas também "informar-nos de passagem" sobre a quantidade GÁS COMBUSTÍVEL NATURAL. Acontece absurdo, e não um claro, compreensível, estável, correto característica termofísica do metano. Em vez de uma constante útil adequada para cálculos termofísicos, recebemos um parâmetro flutuante, que é a soma (integral) da quantidade de calor recebida GÁS NATURAL e sua massa ou volume de metano.
Obrigado, claro, por tanto "entusiasmo", mas a quantidade GÁS COMBUSTÍVEL NATURAL Eu posso me medir. Tendo recebido resultados de forma muito mais conveniente, "humana". Quantidade GÁS COMBUSTÍVEL NATURAL Eu gostaria de não "extrair" por métodos matemáticos e cálculos usando uma fórmula complexa do capacidade calorífica do metano, em diferentes temperaturas, mas descubra o peso (massa) em gramas (g, g), quilogramas (kg), toneladas (toneladas), cubos (metros cúbicos, metros cúbicos, m3), litros (l) ou mililitros (ml ). Especialmente desde pessoas pequenas há muito tempo surgiu com instrumentos de medição bastante adequados para esses fins. Por exemplo: balanças ou outros dispositivos.
Especialmente a "natureza flutuante irritante" do parâmetro: geral capacidade calorífica do GÁS natural. Seu "humor" instável e mutável. Ao alterar o "tamanho ou dose da dose", capacidade calorífica do GÁS NATURAL em diferentes temperaturas muda imediatamente. Mistura de gases mais combustíveis, quantidade física, valor absoluto capacidade calorífica do metano- aumenta. Menor quantidade de mistura de gases combustíveis, valor capacidade térmica do metano diminui. "Desgraça" alguns despeja! Em outras palavras, o que "temos" não pode de forma alguma ser considerado uma constante descrevendo características termofísicas do GÁS NATURAL em diferentes temperaturas. E é desejável que "tenhamos" um coeficiente constante e compreensível, um parâmetro de referência que caracteriza propriedades térmicas combustível gasoso, sem "referências" à quantidade de metano (peso, massa, volume). O que fazer?
É aqui que um método muito simples, mas "muito científico" vem em nosso socorro. Isso se resume não apenas ao oficial de justiça "ud. - específico", antes da quantidade física, mas a uma solução elegante envolvendo a exclusão da quantidade de matéria da consideração. Naturalmente, parâmetros "desconfortáveis, supérfluos": massa ou volume GÁS COMBUSTÍVEL NATURAL absolutamente impossível de descartar. Pelo menos pela razão de que, se não houver quantidade de metano, não haverá “tema de discussão” em si. E a substância deve ser. Portanto, escolhemos algum padrão condicional de massa ou volume, que pode ser considerado uma unidade adequada para determinar o valor do coeficiente “C” que precisamos. Por peso do combustível GÁS NATURAL, tal unidade de massa de metano, conveniente no uso prático, acabou sendo 1 quilograma (kg).
Agora nós aquecemos um quilograma de GÁS NATURAL em 1 grau, e a quantidade de calor (energia térmica) precisamos aquecer mistura de gás um grau - este é o nosso parâmetro físico correto, coeficiente "C", bem, bastante completa e claramente descrevendo um dos propriedades termofísicas do GÁS NATURAL em diferentes temperaturas. Observe que agora estamos lidando com uma característica que descreve propriedade física substância, mas não tentando "nos informar adicionalmente" sobre sua quantidade. Confortável? Não há palavras. É uma questão completamente diferente. By the way, agora não estamos falando sobre o geral capacidade térmica do metano. Tudo mudou. ESTE É O CALOR ESPECÍFICO DO GÁS NATURAL, que às vezes é chamado por outro nome. Como? Simplesmente MASSIVO CAPACIDADE DE CALOR DO GÁS COMBUSTÍVEL NATURAL. Específico (ud.) E massa (m.) - neste caso: sinônimos, eles significam aqui o que precisamos coeficiente "C".
Tabela 1. Coeficiente: capacidade calorífica específica do GÁS NATURAL (sp.). Capacidade térmica de massa de GÁS COMBUSTÍVEL NATURAL. Data de referência.
Simplificando, a capacidade de calor A PARTIR DE corpo é chamado a quantidade de calor que precisa ser gasto em Este processo para aquecer o corpo em um grau: .
Normalmente, a capacidade calorífica é referida a uma unidade da quantidade de uma substância e, dependendo da unidade escolhida, distinguem-se:
capacidade de calor de massa específica Com, referente a 1 kg de gás, J/(kgK);
capacidade calorífica volumétrica específica Com´, referente à quantidade de gás contida em 1 m 3 de volume em condições físicas normais, J / (m 3 K);
capacidade de calor específico molar μ Com, referido a um quilomole, J / (kmolK).
A relação entre as capacidades de calor específicas é estabelecida pelas relações óbvias:
Com= μ Com/μ; Com´= Comρ n. (2.13)
Aqui ρ n é a densidade do gás em condições normais.
A mudança na temperatura do corpo com a mesma quantidade de calor fornecida depende da natureza do processo que está ocorrendo, portanto A capacidade calorífica é uma função do processo. Isso significa que o mesmo fluido de trabalho, dependendo do processo, requer uma quantidade diferente de calor para seu aquecimento de 1 K. Numericamente magnitude Com varia de + ∞ a – ∞.
Em cálculos termodinâmicos grande importância tenho:
capacidade calorífica a pressão constante
Com p = δ q p/ dT, (2.14)
q p , trazido ao corpo no processo a pressão constante, a uma mudança na temperatura do corpo dT;
capacidade calorífica a volume constante
Com v = δ q v /dT, (2.15)
igual à razão entre a quantidade de calor δ q v, trazido ao corpo no processo a um volume constante, a uma mudança na temperatura do corpo dT.
De acordo com a primeira lei da termodinâmica para sistemas fechados δ q = du + pdv.
Levando em conta o fato de que 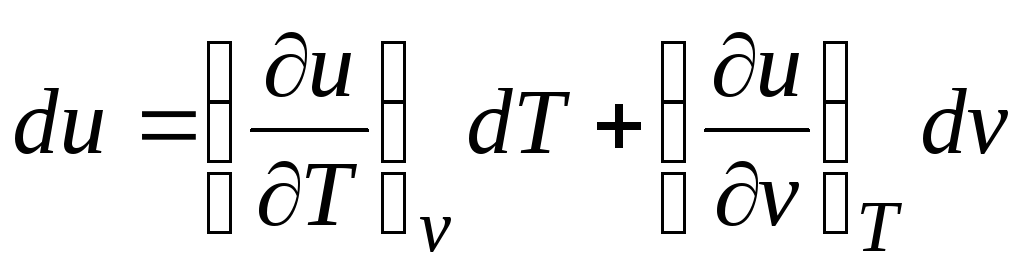 (relações (2.1))
(relações (2.1))
Δ q = (∂você/∂T) v dT + [(∂você/∂v) T + p]DVD. (2.16)
Para um processo isocórico ( v=const) esta equação assume a forma 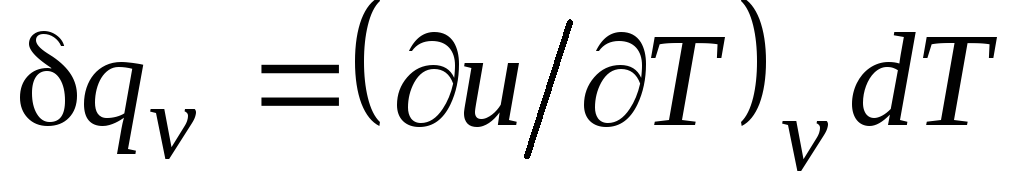 , e, levando em conta (2.15), obtemos que
, e, levando em conta (2.15), obtemos que
c v = (∂você/∂T) v . (2.17)
Para um gás ideal
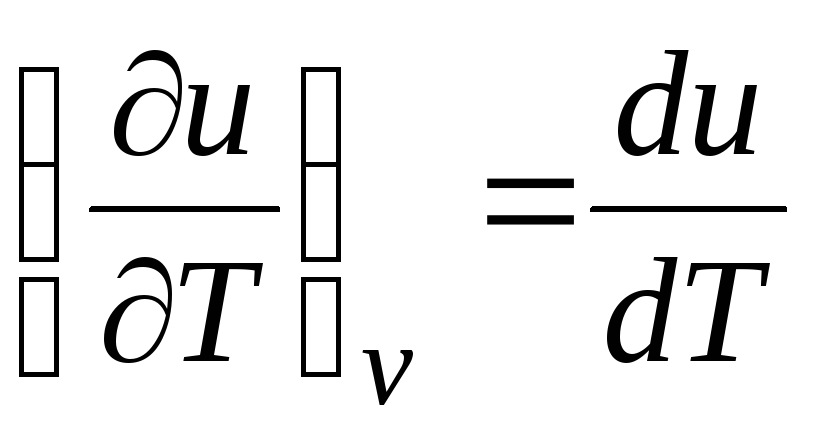 (equação 2.2), então
(equação 2.2), então
c v = du/dT. (2.18)
Para um processo isobárico ( R=const) das equações (2.16) e (2.14) obtemos
c p = (∂ você/∂T) v + [(∂você/∂v) T + p](DVD/dT) p
Como a energia interna gás idealé determinado apenas por sua temperatura e não depende do volume específico, então
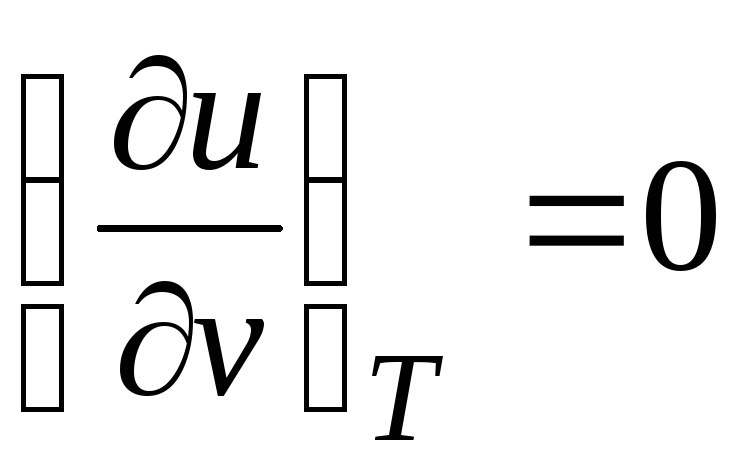 .
(2.19)
.
(2.19)
Da equação de Clapeyron (1.4) pv
= RT(1.3) segue 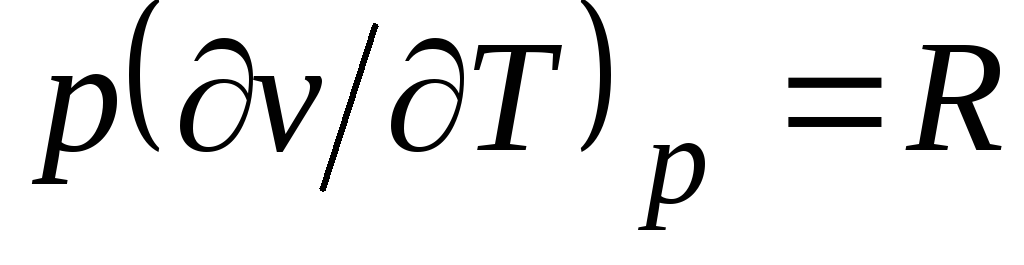 , Onde
, Onde
c p= Com v + R. (2.20)
A relação (2.20) é chamada de equação de Mayer e é uma das principais na termodinâmica técnica de gases ideais.
No processo v\u003d const, o calor transmitido ao gás vai apenas para alterar sua energia interna, enquanto no processo p \u003d const, o calor é gasto tanto para aumentar a energia interna quanto para realizar o trabalho de expansão. É por isso c p mais Com v pela quantidade deste trabalho.
Fórmula ![]() determina a chamada capacidade calorífica verdadeira, ou seja, o valor da capacidade calorífica a uma dada temperatura. Na prática, a capacidade calorífica é amplamente utilizada para calcular a quantidade de calor q 12, que deve ser gasto para aquecer o corpo de uma temperatura ( t 1) para outro ( t 2) (ou que será liberado após o resfriamento de t 2 a t 1).
determina a chamada capacidade calorífica verdadeira, ou seja, o valor da capacidade calorífica a uma dada temperatura. Na prática, a capacidade calorífica é amplamente utilizada para calcular a quantidade de calor q 12, que deve ser gasto para aquecer o corpo de uma temperatura ( t 1) para outro ( t 2) (ou que será liberado após o resfriamento de t 2 a t 1).
Se a capacidade calorífica não mudar na faixa de temperatura indicada, então
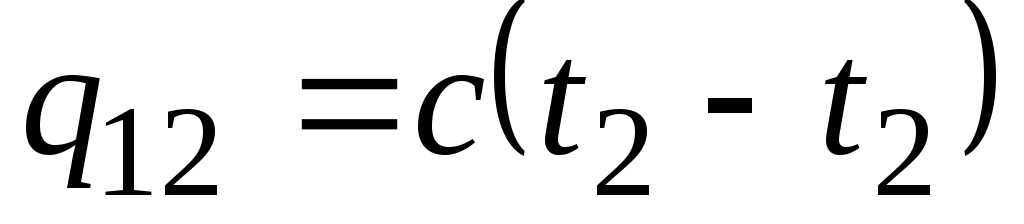 , kJ/kg e
, kJ/kg e 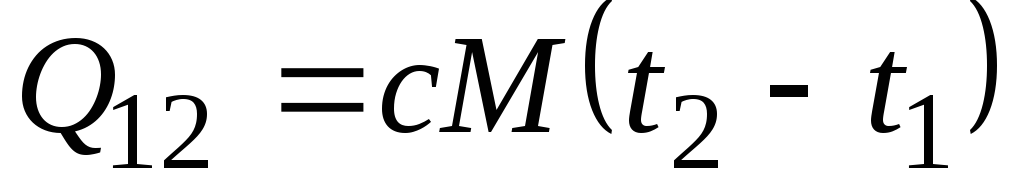 , kJ. (2.21)
, kJ. (2.21)
Essa fórmula também pode ser usada para cálculos aproximados (não muito precisos). Por exemplo, a capacidade calorífica específica da água à temperatura ambiente é 4,187 kJ/(kgC), e do ar 1 kJ/(kgC). Como a capacidade calorífica de quase todas as substâncias muda (na maioria das vezes aumenta) com o aumento da temperatura, é necessário, estritamente falando, usar a fórmula
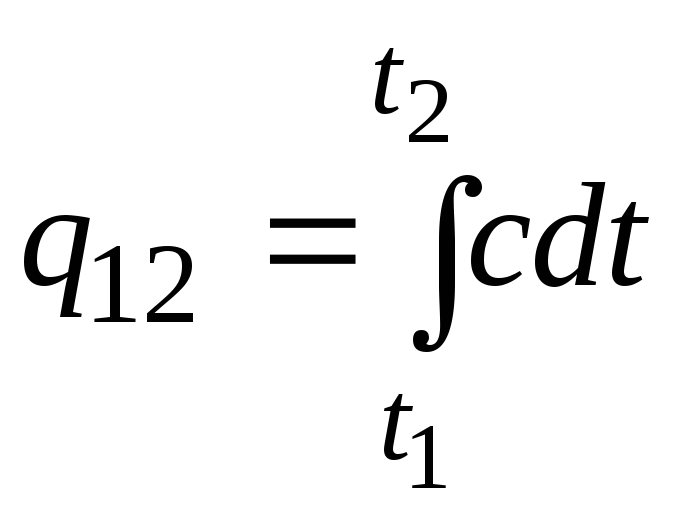 .
(2.21uma)
.
(2.21uma)
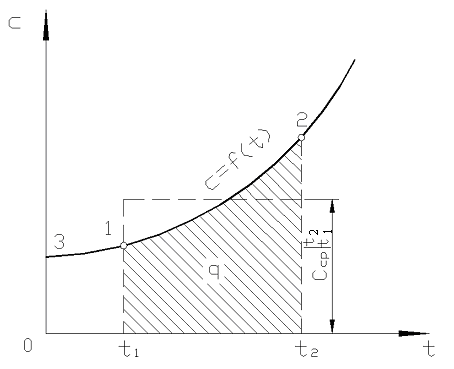
Na fig. 2,2 magnitude q 12 é mostrado como uma área sombreada. Parece que a maneira mais fácil, aplicando o teorema do valor médio, é escrever
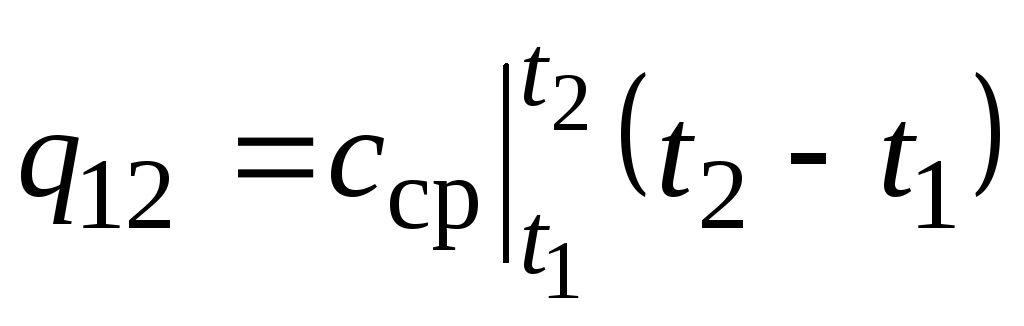 ,
(2.22)
,
(2.22)
Onde 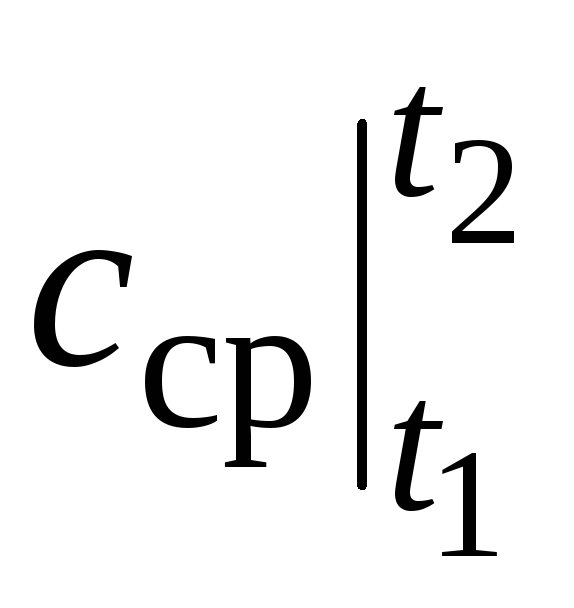 é a capacidade calorífica média na faixa de temperatura t 1 …t 2 .
é a capacidade calorífica média na faixa de temperatura t 1 …t 2 .
Arroz. 2.2. Dependência da capacidade calorífica real da temperatura
No entanto, para cálculos reais, essa notação é muito inconveniente, pois a capacidade de calor é escolhida a partir de tabelas e  depende de como t 1 e de t 2. Uma tabela de funções de dois argumentos seria muito complicada.
depende de como t 1 e de t 2. Uma tabela de funções de dois argumentos seria muito complicada.
Na prática, proceda da seguinte forma. A quantidade desejada de calor é apresentada como a diferença entre suas quantidades necessárias para aquecer o corpo de 0 С até temperaturas t 2 e t 1 respectivamente (Fig. 2.2)
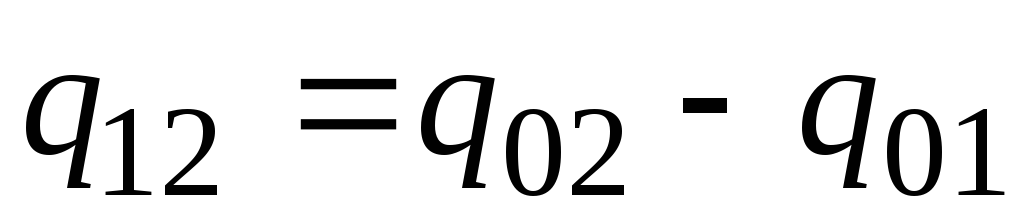 . (2.23)
. (2.23)
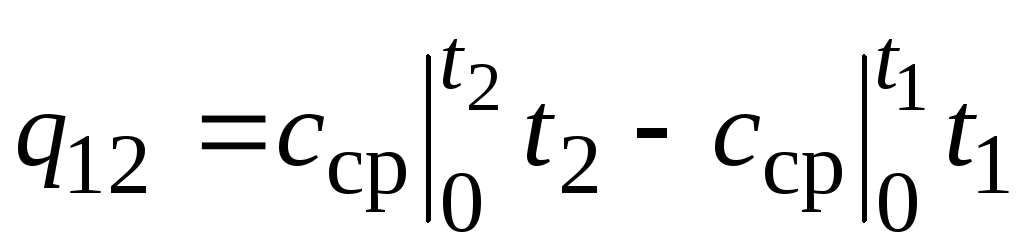 ,
(2.24)
,
(2.24)
Onde  - capacidade calorífica média na faixa de temperatura 0… tC.
- capacidade calorífica média na faixa de temperatura 0… tC.
O valor da capacidade calorífica média  para uma determinada substância (e um determinado processo, ou seja, Com R ou c v) depende apenas de uma temperatura t. São essas capacidades de calor que são fornecidas em todas as tabelas sob o nome "média". O que foi dito é verdade para Com
(Com R e c v), bem como para Com e Com. Como exemplo, a tabela abaixo mostra a capacidade de calor versus temperatura para alguns dos gases mais comuns. Ressalta-se que na fórmula (2.24) a temperatura é substituída em graus Celsius.
para uma determinada substância (e um determinado processo, ou seja, Com R ou c v) depende apenas de uma temperatura t. São essas capacidades de calor que são fornecidas em todas as tabelas sob o nome "média". O que foi dito é verdade para Com
(Com R e c v), bem como para Com e Com. Como exemplo, a tabela abaixo mostra a capacidade de calor versus temperatura para alguns dos gases mais comuns. Ressalta-se que na fórmula (2.24) a temperatura é substituída em graus Celsius.
A capacidade calorífica molar média de vários gases em R=const
(de acordo com M.P. Vukalovich, V.A. Kirillin, V.N. Timofeev)
|
t, C |
Com R, kJ/(kmolK) |
|||||||
|
N 2 atmosférico | ||||||||
Nesta tabela, os valores Com p são dados por 100 С. Como não mudam muito com a temperatura, valores intermediários podem ser encontrados por extrapolação linear. Lembre-se de como isso é feito. Existem valores de função tabulares y
= f(x) no 1 (quando X= X 1) e no 2 (quando X= X 2). Valor da função no(X) no X 1 <X<X 2 iguais 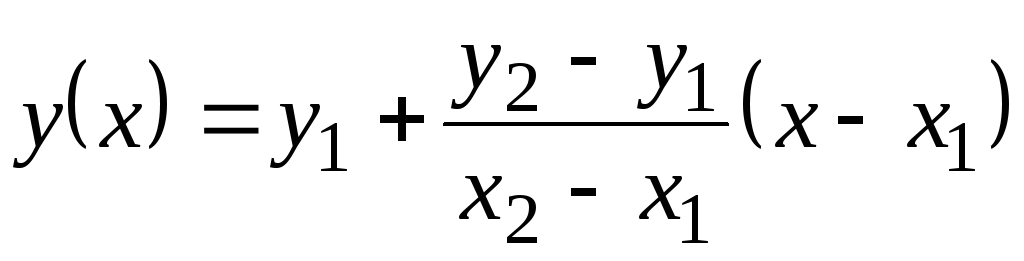 . Esta fórmula é verdadeira tanto para uma função monotonicamente crescente (quando no 2 >no 1) e para diminuir monotonicamente ( no 2 <no 1); Nesse caso, a fração será negativa, pois X 2 > X 1 sempre.
. Esta fórmula é verdadeira tanto para uma função monotonicamente crescente (quando no 2 >no 1) e para diminuir monotonicamente ( no 2 <no 1); Nesse caso, a fração será negativa, pois X 2 > X 1 sempre.
A tabela mostra os valores de condutividade térmica dos gases dependendo da temperatura e pressão.
Os valores de condutividade térmica são indicados para temperaturas na faixa de 20 K (-253 °C) a 1500 K (1227 °C) e pressão de 1 a 1000 atmosferas.
Mesa dada a condutividade térmica dos seguintes gases: , , freon-14 CF 4 , etileno C 2 H 4 . A unidade de condutividade térmica é W/(m graus).
Deve-se notar que a condutividade térmica dos gases aumenta com o aumento da temperatura e pressão. Por exemplo, a condutividade térmica do gás de amônia à temperatura ambiente e pressão atmosférica normal é de 0,024 W / (m graus), e quando é aquecido em 300 graus, a condutividade térmica aumenta para um valor de 0,067 W / (m graus). Se a pressão desse gás for aumentada para 300 atmosferas, o valor da condutividade térmica se tornará ainda maior e terá um valor de 0,108 W / (m graus).
Nota: Cuidado! A condutividade térmica na tabela é indicada com um fator de 10 3 . Não se esqueça de dividir por 1000!
Condutividade térmica de gases inorgânicos dependendo da temperatura
A tabela fornece os valores da condutividade térmica dos gases inorgânicos, dependendo da temperatura à pressão atmosférica normal. Os valores de condutividade térmica dos gases são indicados em temperaturas de 80 a 1500 K (-193 ... 1227 ° C).
A tabela mostra a condutividade térmica dos seguintes gases: óxido nitroso N 2 O, hexafluoreto de enxofre SF 6, óxido nítrico NO, sulfeto de hidrogênio H 2 S, amônia NH 3, dióxido de enxofre SO 2, vapor H 2 O, dióxido de carbono CO 2 , vapor de água pesada D 2 O, ar.
Deve-se notar que a condutividade térmica dos gases inorgânicos aumenta com o aumento da temperatura do gás.
Nota: A condutividade térmica dos gases na tabela é indicada com um fator de 10 3 . Não se esqueça de dividir por 1000!
Condutividade térmica de gases orgânicos em função da temperatura
A tabela mostra os valores de condutividade térmica de gases e vapores orgânicos de alguns líquidos dependendo da temperatura à pressão atmosférica normal. Os valores da condutividade térmica dos gases são fornecidos na tabela na faixa de temperatura de 120 a 800 K.
A condutividade térmica dos seguintes gases e líquidos orgânicos é dada: acetona CH 3 COCH 3, octano C 8 H 18, pentano C 5 H 12, butano C 4 H 10, hexano C 6 H 14, propileno C 3 H 6, heptano C 7 H 16, álcool amílico C 5 H 11 OH, xileno C 8 H 10, álcool isopropílico C 2 H 7 OH, metano CH 4, álcool metílico CH 3 OH, tetracloreto de carbono CCl 4, ciclohexano C 6 H 12, etano C 2 H 6, tetrafluoreto de carbono CF 4, freon-11 CFCl 3, cloreto de etila C 2 H 5 Cl, freon-12 CF 2 Cl 2, etileno C 2 H 4, freon-13 CF 3 Cl, formato de etil HCOOC 2 H 5, freon-21 CHFCl 2, éter dietílico (C 2 H 5) 2O.
Como pode ser visto na tabela, o valor da condutividade térmica dos gases orgânicos também aumenta com o aumento da temperatura do gás.
Tome cuidado! A condutividade térmica na tabela é indicada com um fator de 10 3 . Não se esqueça de dividir por 1000! Por exemplo, a condutividade térmica do vapor de acetona a uma temperatura de 400 K (127°C) é 0,0204 W/(m graus).
