Pojemność cieplna siarkowodoru w różnych temperaturach. Ciepło właściwe gazu ziemnego
Nie konkretna, ale całkowita pojemność cieplna, w ogólnie przyjętym sensie fizycznym, to zdolność substancji do nagrzewania się. Przynajmniej tak mówi nam każdy podręcznik fizyki cieplnej — to jest klasyczna definicja pojemność cieplna(prawidłowe sformułowanie). W rzeczywistości jest to interesująca cecha fizyczna. Mało znana nam w życiu codziennym „strona medalu”. Okazuje się, że gdy ciepło jest dostarczane z zewnątrz (ogrzewanie, rozgrzewanie), nie wszystkie substancje reagują jednakowo na ciepło ( energia cieplna) i podgrzewać inaczej. Umiejętność GAZ pochodzenia naturalnego stosowany jako paliwo odbierać, odbierać, zatrzymywać i akumulować (akumulować) energię cieplną nazywana jest pojemnością cieplną gazu palnego NATURALNEGO. I siebie pojemność cieplna metanu, to cecha fizyczna opisująca termofizyczne właściwości paliwa gazowego. Jednocześnie w różnych aspektach aplikacyjnych, w zależności od konkretnego przypadku praktycznego, jedna rzecz może okazać się dla nas ważna. Na przykład: zdolność substancji do przyjmowania ciepły czyli zdolność do akumulacji energia cieplna lub „talent”, aby go zatrzymać. Jednak pomimo pewnej różnicy, w sensie fizycznym, zostaną opisane właściwości, których potrzebujemy pojemność cieplna metanu.
Mały, ale bardzo „przykry szkopuł” o fundamentalnym charakterze polega na tym, że zdolność do nagrzewania się - pojemność cieplna metanu, ma bezpośredni związek nie tylko z skład chemiczny, struktura molekularna substancji, ale także jej ilość (masa, masa, objętość). Ze względu na takie „nieprzyjemne” połączenie generał pojemność cieplna metanu staje się zbyt niewygodną cechą fizyczną substancji. Ponieważ jeden mierzony parametr jednocześnie opisuje „dwie różne rzeczy”. Mianowicie: naprawdę charakteryzuje właściwości termofizyczne GAZU ZIEMNEGO jednak „przelotnie” uwzględnia również jego ilość. Tworząc rodzaj integralnej charakterystyki, w której automatycznie łączy się „wysoka” fizyka cieplna i „banalna” ilość materii (w naszym przypadku: paliwa gazowego).
No cóż, po co nam takie termofizyczne cechy, w których wyraźnie widać „nieadekwatną psychikę”? Z fizycznego punktu widzenia suma pojemność cieplna metanu(w najbardziej niezgrabny sposób) stara się nie tylko opisać ilość energii cieplnej, jaka może skumulować się w paliwie gazowym, ale także „przy okazji poinformować nas” o jej ilości GAZ ZIEMNY PALNY. Okazuje się absurdem, a nie jasną, zrozumiałą, stabilną, poprawną charakterystyka termofizyczna metanu. Zamiast użytecznej stałej odpowiedniej do praktycznego obliczenia termofizyczne, otrzymujemy zmienny parametr, który jest sumą (całką) ilości otrzymanego ciepła GAZU ZIEMNEGO oraz jego masa lub objętość metanu.
Dziękuję oczywiście za taki "entuzjazm", ale ilość GAZ ZIEMNY Mogę się zmierzyć. Otrzymane wyniki w znacznie wygodniejszej, „ludzkiej” formie. Ilość GAZ ZIEMNY PALNY Nie chciałbym "wyciągać" metodami matematycznymi i obliczeniami za pomocą złożonej formuły z ogólnego pojemność cieplna metanu, w różnych temperaturach, ale podaj wagę (masę) w gramach (g, g), kilogramach (kg), tonach (tonach), kostkach (metry sześcienne, metry sześcienne, m3), litry (l) lub mililitry (ml ). Zwłaszcza odkąd mądrzy ludzie dawno temu wymyślił przyrządy pomiarowe całkiem odpowiednie do tych celów. Na przykład: wagi lub inne urządzenia.
Zwłaszcza „irytujący pływający charakter” parametru: general pojemność cieplna naturalnie występującego GAZU. Jego niestabilny, zmienny „nastrój”. Zmieniając „wielkość porcji lub porcję”, pojemność cieplna GAZU ZIEMNEGO w różnych temperaturach zmiany natychmiast. Bardziej palna mieszanina gazów, wielkość fizyczna, wartość bezwzględna pojemność cieplna metanu- wzrosty. Mniejsza ilość palnej mieszanki gazów, wartość pojemność cieplna metanu zmniejsza się. „Hańba” niektórych okazuje się! Innymi słowy, to, co „mamy” nie może być w żaden sposób uważane za ciągłe opisywanie właściwości termofizyczne GAZU ZIEMNEGO w różnych temperaturach. I pożądane jest, abyśmy „mieli” zrozumiały, stały współczynnik, parametr odniesienia, który charakteryzuje Właściwości termiczne paliwo gazowe, bez „odniesień” do ilości metanu (masa, masa, objętość). Co robić?
Tu z pomocą przychodzi nam bardzo prosta, ale „bardzo naukowa” metoda. Sprowadza się to nie tylko do komornika "ud - specyficzny", zanim wielkość fizyczna, ale do eleganckiego rozwiązania polegającego na wyłączeniu ilości materii z rozważania. Oczywiście „niewygodne, zbędne” parametry: masa czy objętość GAZ ZIEMNY PALNY absolutnie niemożliwe do wykluczenia. Przynajmniej z tego powodu, że jeśli nie ma metanu, to nie będzie samego „przedmiotu dyskusji”. A istota powinna być. Dlatego wybieramy jakiś warunkowy wzorzec masy lub objętości, który można uznać za jednostkę odpowiednią do określenia wartości potrzebnego nam współczynnika „C”. Do masa paliwa GAZ ZIEMNY, taką jednostką masy metanu, wygodną w praktycznym użyciu, okazał się 1 kilogram (kg).
Teraz my podgrzewamy jeden kilogram GAZU ZIEMNEGO o 1 stopień, a ilość ciepła (energii cieplnej) musimy się ogrzać mieszanka gazowa jeden stopień - to nasz prawidłowy parametr fizyczny, współczynnik "C", no cóż, całkiem wyczerpująco i jasno opisując jeden z właściwości termofizyczne GAZU ZIEMNEGO w różnych temperaturach. Należy pamiętać, że teraz mamy do czynienia z charakterystyką opisującą własność fizyczna substancji, ale nie próbując „dodatkowo poinformować nas” o jej ilości. Wygodna? Brak słów. To zupełnie inna sprawa. Nawiasem mówiąc, teraz nie mówimy o generale pojemność cieplna metanu. Wszystko się zmieniło. TO SPECYFICZNE CIEPŁO GAZU ZIEMNEGO, który jest czasami nazywany inną nazwą. Jak? Po prostu MASYWNE ZDOLNOŚĆ CIEPLNA GAZU ZIEMNEGO PALNEGO. Konkretny (ud.) I masa (m.) - w tym przypadku: synonimy, oznaczają tutaj ten, którego potrzebujemy współczynnik "C".
Tabela 1. Współczynnik: ciepło właściwe GAZU ZIEMNEGO (sp.). Masowa pojemność cieplna GAZU ZIEMNEGO palnego. Dane referencyjne.
Mówiąc najprościej, pojemność cieplna Z ciało nazywa się ilością ciepła, która musi być wydatkowana w ten proces ogrzać ciało o jeden stopień: .
Zwykle pojemność cieplna odnosi się do jednostki ilości substancji i w zależności od wybranej jednostki rozróżnia się:
właściwa pojemność cieplna masy Z, w odniesieniu do 1 kg gazu, J/(kgK);
właściwa wolumetryczna pojemność cieplna Z´, w odniesieniu do ilości gazu zawartego w 1 m 3 objętości w normalnych warunkach fizycznych, J / (m 3 K);
właściwa pojemność cieplna molowa μ Z, w odniesieniu do jednego kilomola, J / (kmolK).
Zależność między właściwymi pojemnościami cieplnymi wynika z oczywistych zależności:
Z= μ Z/μ; Z´= Zρ n. (2.13)
Tutaj ρ n jest gęstością gazu w normalnych warunkach.
Zmiana temperatury ciała przy tej samej ilości dostarczonego ciepła zależy zatem od charakteru zachodzącego procesu pojemność cieplna jest funkcją procesu. Oznacza to, że ten sam płyn roboczy, w zależności od procesu, wymaga różnej ilości ciepła do podgrzania o 1 K. Wielkość liczbowa Z waha się od + ∞ do – ∞.
W obliczeniach termodynamicznych bardzo ważne mieć:
pojemność cieplna przy stałym ciśnieniu
Z p = q p/ dT, (2.14)
q p , doprowadzony do ciała w procesie pod stałym ciśnieniem, do zmiany temperatury ciała dT;
pojemność cieplna przy stałej objętości
Z v = δ q v /dT, (2.15)
równy stosunkowi ilości ciepła δ q v, doprowadzony do ciała w procesie w stałej objętości, do zmiany temperatury ciała dT.
Zgodnie z pierwszą zasadą termodynamiki dla układów zamkniętych δ q = du + pdv.
Biorąc pod uwagę fakt, że 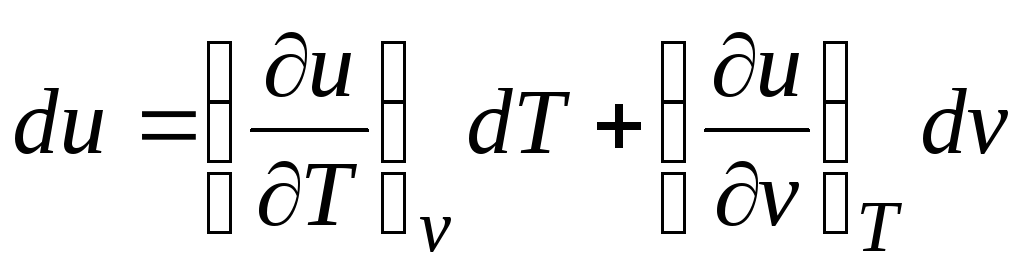 (relacje (2.1))
(relacje (2.1))
Δ q = (∂ty/∂T) v dT + [(∂ty/∂v) T + p]dv. (2.16)
Dla procesu izochorycznego ( v=const) to równanie przyjmuje postać 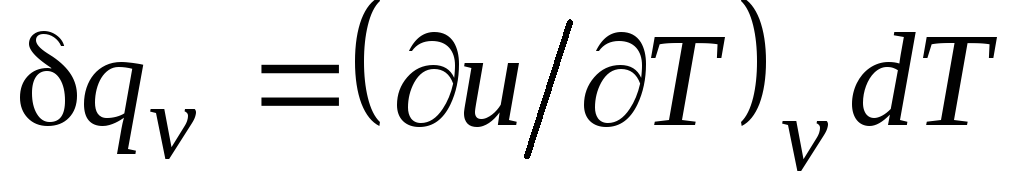 , a biorąc pod uwagę (2.15) otrzymujemy, że
, a biorąc pod uwagę (2.15) otrzymujemy, że
c v = (∂ty/∂T) v . (2.17)
Dla idealnego gazu
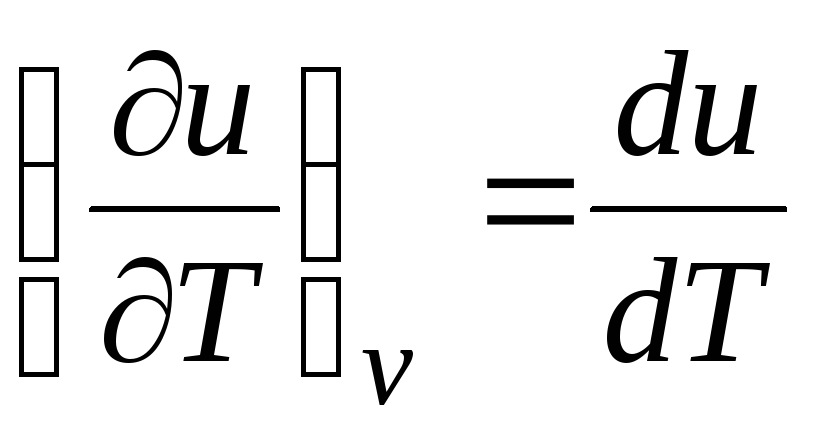 (równanie 2.2), więc
(równanie 2.2), więc
c v = du/dT. (2.18)
Dla procesu izobarycznego ( R=const) z równań (2.16) i (2.14) otrzymujemy
c p = (∂ ty/∂T) v + [(∂ty/∂v) T + p](dv/dT) p
Ponieważ energia wewnętrzna gaz doskonały zależy tylko od jego temperatury i nie zależy od objętości właściwej, więc
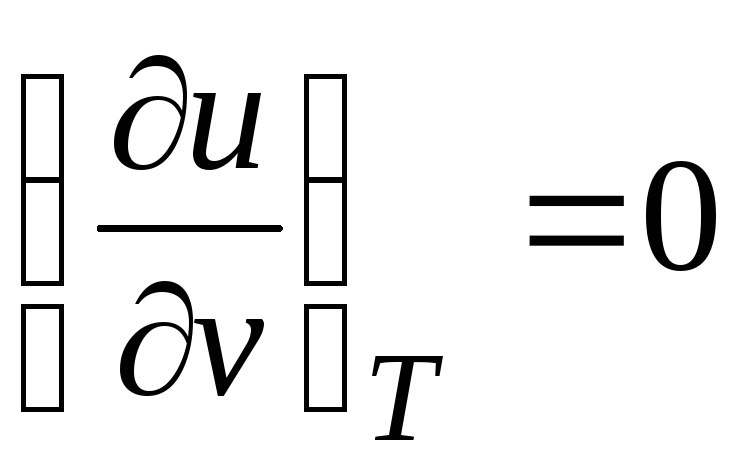 .
(2.19)
.
(2.19)
Z równania Clapeyrona (1.4) pv
= RT(1.3) następuje 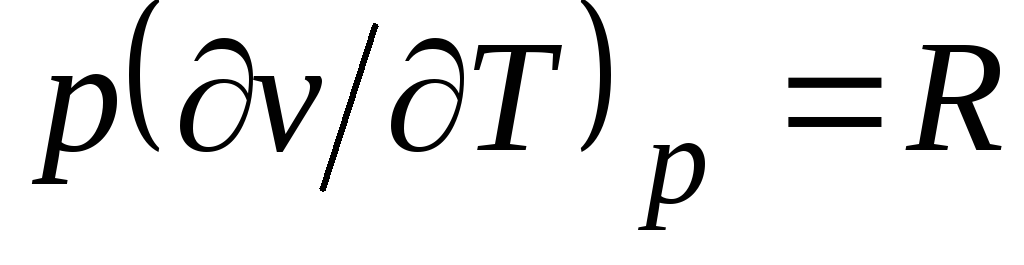 , gdzie
, gdzie
c p= Z v + R. (2.20)
Zależność (2.20) nazywana jest równaniem Mayera i jest jednym z głównych w termodynamice technicznej gazów doskonałych.
W trakcie v\u003d const, ciepło przekazywane gazowi zmienia się tylko w celu zmiany jego energii wewnętrznej, podczas gdy w procesie p \u003d const ciepło jest zużywane zarówno w celu zwiększenia energii wewnętrznej, jak i wykonania pracy rozszerzania. Dlatego c p więcej Z v przez ilość tej pracy.
Formuła ![]() określa tzw. rzeczywistą pojemność cieplną, czyli wartość pojemności cieplnej w danej temperaturze. W praktyce pojemność cieplna jest szeroko stosowana do obliczania ilości ciepła q 12 , które należy wydać na ogrzanie ciała z jednej temperatury ( t 1) drugiemu ( t 2) (lub które zostaną uwolnione po ochłodzeniu z t 2 do t 1).
określa tzw. rzeczywistą pojemność cieplną, czyli wartość pojemności cieplnej w danej temperaturze. W praktyce pojemność cieplna jest szeroko stosowana do obliczania ilości ciepła q 12 , które należy wydać na ogrzanie ciała z jednej temperatury ( t 1) drugiemu ( t 2) (lub które zostaną uwolnione po ochłodzeniu z t 2 do t 1).
Jeżeli pojemność cieplna nie zmienia się we wskazanym zakresie temperatur, to
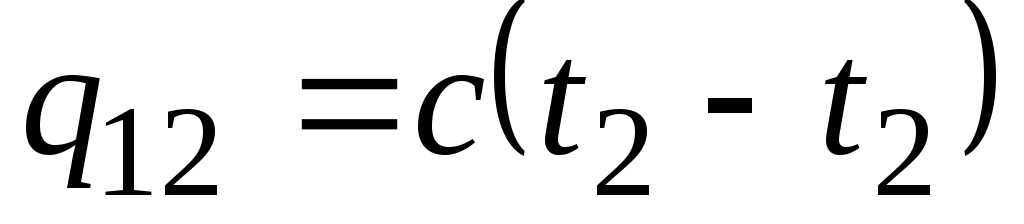 , kJ/kg i
, kJ/kg i 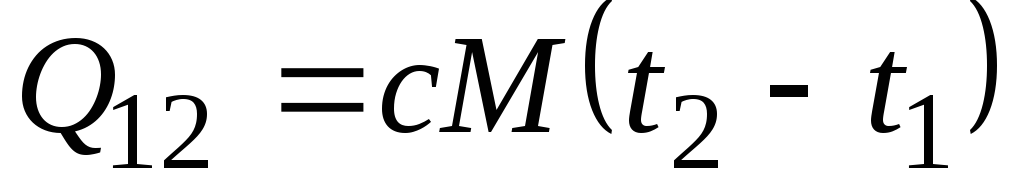 , kJ. (2.21)
, kJ. (2.21)
Ta formuła może być również używana do obliczeń przybliżonych (niezbyt dokładnych). Na przykład właściwa pojemność cieplna wody w temperaturze pokojowej wynosi 4,187 kJ/(kgC), a powietrza 1 kJ/(kgC). Ponieważ pojemność cieplna prawie wszystkich substancji zmienia się (najczęściej wzrasta) wraz ze wzrostem temperatury, konieczne jest, ściśle mówiąc, zastosowanie wzoru
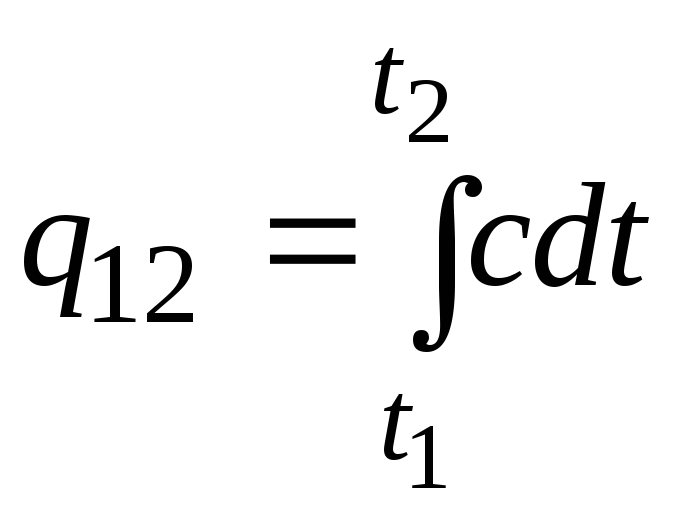 .
(2.21a)
.
(2.21a)
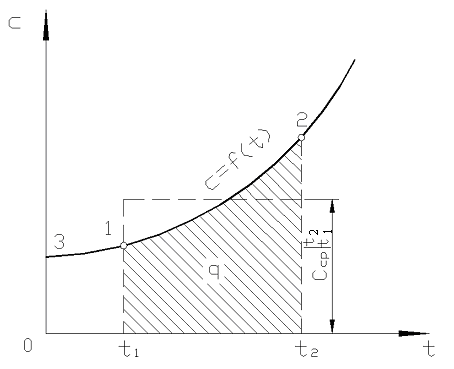
Na ryc. 2,2 magnitudo q 12 jest pokazany jako zacieniony obszar. Wydawałoby się, że najprostszym sposobem, stosując twierdzenie o wartości średniej, jest napisanie
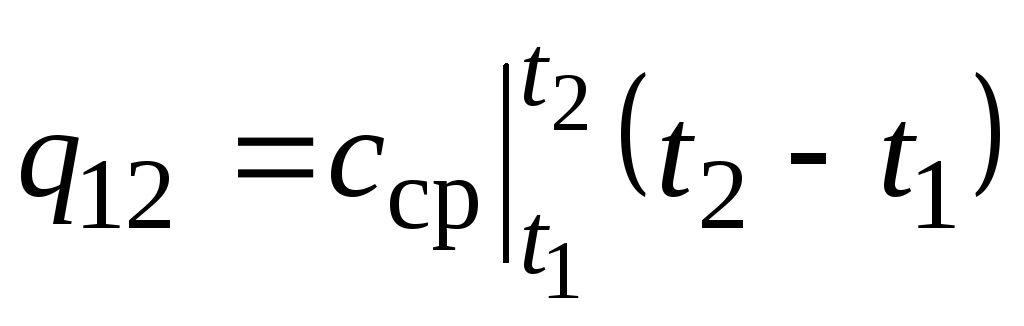 ,
(2.22)
,
(2.22)
gdzie 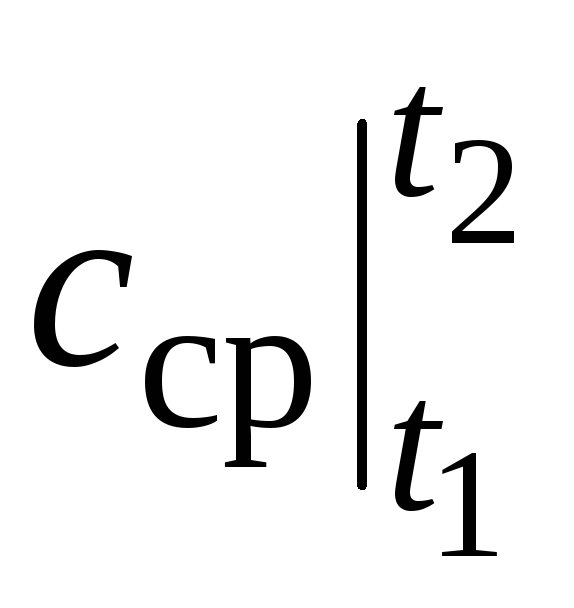 to średnia pojemność cieplna w zakresie temperatur t 1 …t 2 .
to średnia pojemność cieplna w zakresie temperatur t 1 …t 2 .
Ryż. 2.2. Zależność rzeczywistej pojemności cieplnej od temperatury
Jednak w przypadku rzeczywistych obliczeń taki zapis jest bardzo niewygodny, ponieważ pojemność cieplna jest wybierana z tabel i  zależy jak t 1 i od t 2. Tabela funkcji z dwoma argumentami byłaby bardzo kłopotliwa.
zależy jak t 1 i od t 2. Tabela funkcji z dwoma argumentami byłaby bardzo kłopotliwa.
W praktyce postępuj w następujący sposób. Pożądaną ilość ciepła przedstawia się jako różnicę między jego ilością potrzebną do ogrzania ciała od 0 С do temperatur t 2 i t 1 odpowiednio (rys. 2.2)
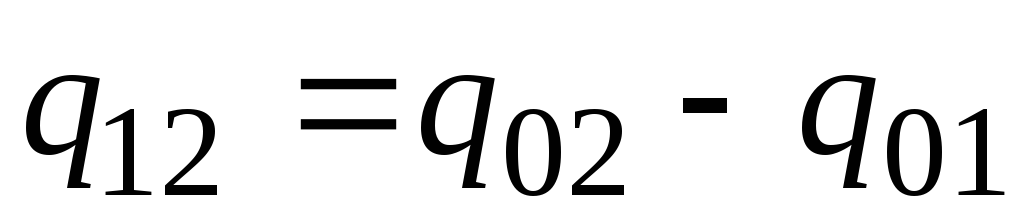 . (2.23)
. (2.23)
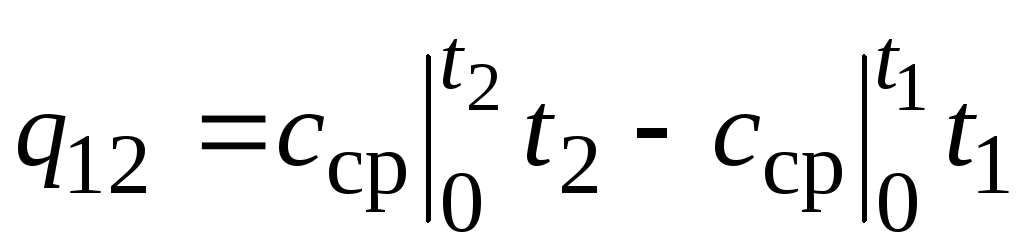 ,
(2.24)
,
(2.24)
gdzie  - średnia pojemność cieplna w zakresie temperatur 0… t C.
- średnia pojemność cieplna w zakresie temperatur 0… t C.
Wartość średniej pojemności cieplnej  dla danej substancji (i danego procesu, tj. Z R lub c v) zależy tylko od jednej temperatury t. To właśnie te pojemności cieplne podane są we wszystkich tabelach pod nazwą „średnia”. To, co zostało powiedziane, jest prawdą Z
(Z R oraz c v), jak również dla Z i Z. Jako przykład, poniższa tabela przedstawia pojemność cieplną w funkcji temperatury dla niektórych z najpopularniejszych gazów. Należy podkreślić, że we wzorze (2.24) temperatura jest podstawiona w stopniach Celsjusza.
dla danej substancji (i danego procesu, tj. Z R lub c v) zależy tylko od jednej temperatury t. To właśnie te pojemności cieplne podane są we wszystkich tabelach pod nazwą „średnia”. To, co zostało powiedziane, jest prawdą Z
(Z R oraz c v), jak również dla Z i Z. Jako przykład, poniższa tabela przedstawia pojemność cieplną w funkcji temperatury dla niektórych z najpopularniejszych gazów. Należy podkreślić, że we wzorze (2.24) temperatura jest podstawiona w stopniach Celsjusza.
Średnia molowa pojemność cieplna różnych gazów przy R=stała
(według M.P. Vukalovicha, V.A. Kirillina, V.N. Timofiejewa)
|
t, C |
Z R, kJ/(kmolK) |
|||||||
|
N 2 atmosferyczne | ||||||||
W tej tabeli wartości Z p są podane przez 100 С. Ponieważ nie zmieniają się one zbytnio wraz z temperaturą, wartości pośrednie można znaleźć przez ekstrapolację liniową. Przypomnij sobie, jak to się robi. Istnieją tabelaryczne wartości funkcji tak
= f(x) w 1 (kiedy X= X 1) i w 2 (kiedy X= X 2). Wartość funkcji w(X) w X 1 <X<X 2 równe 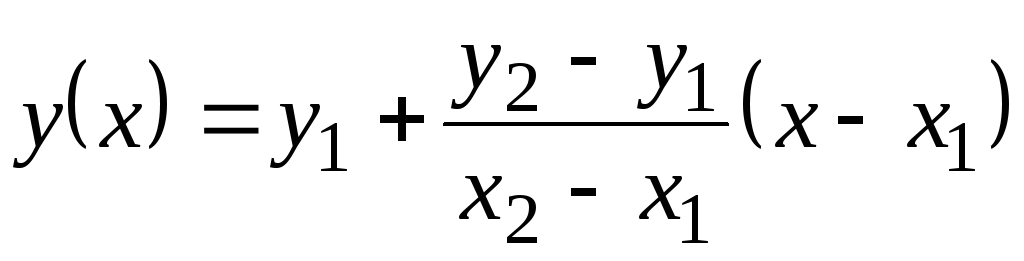 . Ten wzór jest prawdziwy zarówno dla funkcji monotonicznie rosnącej (gdy w 2 >w 1) i dla monotonicznie malejącej ( w 2 <w jeden); W tym przypadku ułamek będzie ujemny, ponieważ X 2 > X 1 zawsze.
. Ten wzór jest prawdziwy zarówno dla funkcji monotonicznie rosnącej (gdy w 2 >w 1) i dla monotonicznie malejącej ( w 2 <w jeden); W tym przypadku ułamek będzie ujemny, ponieważ X 2 > X 1 zawsze.
W tabeli przedstawiono wartości przewodności cieplnej gazów w zależności od temperatury i ciśnienia.
Wartości przewodnictwa cieplnego są wskazane dla temperatur w zakresie od 20 K (-253 °C) do 1500 K (1227 °C) i ciśnienia od 1 do 1000 atmosfer.
Stół biorąc pod uwagę przewodność cieplną następujących gazów: , , freon-14 CF4, etylen C2H4. Jednostką przewodności cieplnej jest W/(m deg).
Należy zauważyć że przewodność cieplna gazów wzrasta wraz ze wzrostem temperatury i ciśnienia. Na przykład przewodność cieplna gazowego amoniaku w temperaturze pokojowej i normalnym ciśnieniu atmosferycznym wynosi 0,024 W/(m st.), a po podgrzaniu o 300 stopni przewodność cieplna wzrasta do wartości 0,067 W/(m st.). Jeśli ciśnienie tego gazu wzrośnie do 300 atmosfer, to wartość przewodności cieplnej będzie jeszcze wyższa i będzie miała wartość 0,108 W/(m st.).
Uwaga: bądź ostrożny! Przewodność cieplna w tabeli jest wskazana ze współczynnikiem 10 3 . Nie zapomnij podzielić przez 1000!
Przewodność cieplna gazów nieorganicznych w zależności od temperatury
Tabela podaje wartości przewodności cieplnej gazów nieorganicznych w zależności od temperatury przy normalnym ciśnieniu atmosferycznym. Wartości przewodności cieplnej gazów są wskazane w temperaturach od 80 do 1500 K (-193 ... 1227 ° C).
W tabeli przedstawiono przewodność cieplną następujących gazów: podtlenek azotu N 2 O, sześciofluorek siarki SF 6, tlenek azotu NO, siarkowodór H 2 S, amoniak NH 3, dwutlenek siarki SO 2, para wodna H 2 O, dwutlenek węgla CO 2 , ciężka para wodna D 2 O, powietrze.
Należy zauważyć że przewodność cieplna gazów nieorganicznych wzrasta wraz ze wzrostem temperatury gazu.
Uwaga: Przewodność cieplna gazów w tabeli jest wskazana ze współczynnikiem 10 3 . Nie zapomnij podzielić przez 1000!
Przewodność cieplna gazów organicznych w funkcji temperatury
W tabeli przedstawiono wartości przewodności cieplnej gazów organicznych i par niektórych cieczy w zależności od temperatury przy normalnym ciśnieniu atmosferycznym. Wartości przewodności cieplnej gazów podano w tabeli w zakresie temperatur od 120 do 800 K.
Podano przewodność cieplną następujących gazów i cieczy organicznych: aceton CH 3 COCH 3, oktan C 8 H 18, pentan C 5 H 12, butan C 4 H 10, heksan C 6 H 14, propylen C 3 H 6, heptan C 7 H 16, alkohol amylowy C 5 H 11 OH, ksylen C 8 H 10, alkohol izopropylowy C 2 H 7 OH, metan CH 4, alkohol metylowy CH 3 OH, tetrachlorek węgla CCl 4, cykloheksan C 6 H 12, etan C 2 H 6, tetrafluorek węgla CF 4, freon-11 CFCl 3, chlorek etylu C 2 H 5 Cl, freon-12 CF 2 Cl 2, etylen C 2 H 4, freon-13 CF 3 Cl, mrówczan etylu HCOOC 2 H 5, freon-21 CHFCl 2, eter dietylowy (C 2 H 5) 2O.
Jak widać ze stołu, wartość przewodności cieplnej gazów organicznych również wzrasta wraz ze wzrostem temperatury gazu.
Bądź ostrożny! Przewodność cieplna w tabeli jest wskazana ze współczynnikiem 10 3 . Nie zapomnij podzielić przez 1000! Na przykład przewodność cieplna pary acetonu w temperaturze 400 K (127°C) wynosi 0,0204 W/(m °C).
