mieszanki gazowe. Pojemność cieplna gazów. Paliwo, mieszanki gazowe i pojemność cieplna
1.3. Równanie stanu gazu doskonałego
Postać równań stanu (1.1) dla substancji rzeczywistych jest dość skomplikowana.
W związku z tym w termodynamice stosuje się uproszczone modele fizyczne ciał roboczych.
Dla płynów roboczych w stanie gazowym najprostszym i historycznie pierwszym modelem jest model gaz doskonały. Gaz doskonały to gaz, w którym nie występują siły oddziaływania międzycząsteczkowego (przyciągania i odpychania), a same cząsteczki są uważane za punkty materialne. Gaz doskonały jest posłuszny równanie Claiperona– Mendelejew
Gdzie M to masa gazu w układzie; μ to masa molowa gazu; Rμ = 8314 J/(kmol K) to uniwersalna stała gazowa, która nie zależy od rodzaju gazu ani warunków jego istnienia. Równanie stanu (1.2) uzyskuje się przez łączenie Prawa Boyle'a-Mariotte'a I Gay Lussac biorąc pod uwagę Prawo Avogadra.
Masa cząsteczkowa μ = m/N, kg/mol, to masa substancji pobrana w ilości jednego mola. 1 mol to jednostka ilości substancji, która zawiera tyle cząstek, ile wynosi 12 gramów węgla. Ilość substancji– n = N/N A, kret, gdzie N to liczba cząstek (atomów, cząsteczek), N A ≈ 6,02 10 23 - liczba atomów w 12 gramach węgla ( liczba Avogadra). Liczbowo μ = Мr 10 -3 , gdzie Mr jest względną masą cząsteczkową substancji ( patka. Mendelejew) (na przykład: =2 kg/kmol).
W ujęciu szczegółowym (tj. dla 1 kg gazu) równanie (1.2) będzie miało postać
Gdzie R– właściwa stała gazowa, J/(kg·K).
Wyjaśnijmy fizyczne znaczenie określonej stałej gazowej R. Dla stanu pierwszego równanie (1.2) zapiszemy jako , dla stanu drugiego przy tym samym ciśnieniu - . Odejmij pierwsze równanie od drugiego równania i znajdź, że , tj. Właściwa stała gazowa to praca wykonana przez 1 kg gazu, gdy jest on ogrzewany o 1 stopień przy stałym ciśnieniu.
Dane eksperymentalne pokazują, że gaz rzeczywisty jest im bliższy gazowi idealnemu, tym mniejsza jest jego gęstość. Innymi słowy, wraz ze spadkiem objętości danej ilości gazu, spowodowanym wzrostem ciśnienia lub spadkiem temperatury, każdy gaz będzie dawał coraz większe odchylenia od właściwości gazu doskonałego. Tak więc pod pojęciem „gazu doskonałego” mieszczą się wszystkie gazy rzeczywiste w wysokich temperaturach i niskich ciśnieniach.
1.4. Mieszanki gazy doskonałe
W praktyce płyn roboczy jest często mieszaniną jednorodnych gazów (na przykład powietrza), z których każdy można uznać za idealny i które nie wchodzą w reakcje chemiczne.
Taka mieszanina jest również gazem doskonałym i spełnia równanie stanu (1.2) dla tej mieszaniny
Gdzie R=R μ / μ to stała gazowa mieszaniny; μ jest średnią (pozorną) masą molową mieszaniny(wartość warunkowa odnosząca się do jednorodnego reprezentatywnego gazu, w którym liczba cząsteczek i masa całkowita są równe liczbie cząsteczek i masie mieszaniny).
Masa mieszaniny jest równa masie wszystkich składników
Głównym prawem określającym zachowanie mieszaniny gazów jest prawo Daltona:
każdy pojedynczy gaz zachowuje się w mieszaninie gazów tak, jakby sam w temperaturze mieszaniny zajmował całą objętość mieszaniny,
każdy pojedynczy gaz wchodzący do mieszaniny gazów ma takie samo ciśnienie, jakie miałby, gdyby sam zajmował całą objętość mieszaniny gazów.
Stąd wartość R(bezwzględne ciśnienie mieszanki) definiuje się jako
Gdzie R I – Ciśnienie cząstkowe I składnik, tj. ciśnienie, które by to zrobiło I składnik, jeśli sam zajmował całą objętość mieszaniny w tej samej temperaturze ().
Skład mieszaniny podaje się ułamkami masowymi lub molowymi składników składowych mieszaniny, a także ułamkami objętościowymi (stężeniami).
Ułamek masowy jest stosunkiem masy każdego gazu do całkowitej masy mieszaniny: .
Z równania (1.3) wynika, że .
Ułamek objętościowy nazywa się współczynnikiem częściowa objętość(objętość, jaką zajmowałby gaz, gdyby jego ciśnienie i temperatura były równe ciśnieniu i temperaturze mieszaniny gazów, tj.) do całkowitej objętości mieszaniny gazów: . Z definicji ciśnienia cząstkowego i objętości oraz stałości temperatury wynika:
![]() (1.5)
(1.5)
Sumując ostatnią równość po wszystkich składnikach mieszaniny, otrzymujemy , tj. suma objętości cząstkowych gazów tworzących mieszaninę jest równa objętości mieszaniny gazów.
Suma ułamków objętościowych jest równa jeden: .
ułamek molowy składnik nazywany jest stosunkiem ilości substancji każdego gazu N I do ilości substancji w mieszaninie gazów N. Z relacji i i Prawo Avogadra(w równych objętościach różnych gazów doskonałych w tych samych temperaturach i pod tym samym ciśnieniem zawarta jest taka sama liczba cząsteczek, tj.) następująco:
te. określenie mieszaniny za pomocą ułamków molowych jest równoznaczne z określeniem jej ułamków objętościowych.
Ułamki masowe i objętościowe są powiązane stosunkiem:
![]() .
.
Jeśli mieszaninę podaje się w ułamkach masowych G I, to stałą gazową mieszaniny i masę molową mieszaniny oblicza się w następujący sposób:
![]()
![]()
Jeśli mieszaninę podano w ułamkach objętościowych R I, to wzory do obliczania masy molowej mieszaniny i stałej gazowej mieszaniny są następujące:
![]() (1.6)
(1.6)
Ciśnienia cząstkowe i objętości gazów są określone przez prawo Boyle'a–marionetka(przy stałej temperaturze gazu iloczyn ciśnienia gazu i jego objętości jest wartością stałą, tj.):
![]() .
.
Pytania kontrolne
Międzynarodowy Układ Jednostek Miar (SI) i jego jednostki podstawowe.
Podstawowe parametry termodynamiczne i ich wymiary.
Co oznacza stan równowagi układu termodynamicznego?
Pojęcie stanów równowagi i stanów nierównowagi.
Co to jest równanie stanu układu?
Geometryczna interpretacja stanu układu, proces termodynamiczny.
Co to jest gaz doskonały? Jaka jest różnica między gazem idealnym a rzeczywistym?
Jaka jest stała gazowa? Jego znaczenie fizyczne, wymiar i sposoby definiowania.
2. Pojemność cieplna
Przekaz ciepła do ciała roboczego w każdym procesie powoduje zmianę jego stanu iw ogólnym przypadku towarzyszy mu zmiana temperatury. Zmiana temperatury, jak również każdy inny parametr stanu płynu roboczego, nie zależy od rodzaju procesu, ale zależy od jego początkowego ( 1 ) i końcowe ( 2 ) stanowi, tj. (dla procesu elementarnego zmiana parametru jest zastępowana jego różniczką).
Stosunek ilości ciepła δ Q przekazywana organizmowi na zmianę temperatury ciała dT w elementarnym procesie termodynamicznym nazywamy rzeczywista pojemność cieplna ciała w tym procesie:
Indeks dolny tutaj wskazuje na fakt, że pojemność cieplna, podobnie jak ciepło, zależy od charakteru procesu. Ponadto pojemność cieplna zależy od wielkości ciała i jego stanu termodynamicznego. Należy również zauważyć, że w procesie tym nie zmienia się skład chemiczny organizmu, nie następuje przejście substancji z jednego stanu skupienia w drugi, nie dochodzi do rozpuszczania składników itp.
W zależności od wybranej jednostki ilości substancji wyróżnia się masę, objętość i molowe ciepło właściwe:
W praktyce najczęściej stosuje się pojęcie masowej pojemności cieplnej.
2.1. Rzeczywista i średnia pojemność cieplna
Pojemność cieplna rzeczywistej substancji nie jest wartością stałą. Zmienia się wraz z temperaturą, a zależność ta może być bardzo znacząca (ryc. 2.1).
Konkretną ilość ciepła procesowego oblicza się według wzoru
Do określenia tej wartości stosuje się następujące metody:
zgodnie z wynikami eksperymentu zależność pojemności cieplnej od temperatury jest reprezentowana jako wielomian aproksymacyjny
gdzie są współczynniki aproksymacji. Współczynniki te podano w literaturze przedmiotu. Następnie
w praktycznych obliczeniach w zakresie temperatur T 1 , T 2 pojemność cieplna jest uważana za stałą wartość równą
zwany średnia pojemność cieplna w tym przedziale, w przeciwieństwie do rzeczywistej pojemności cieplnej wprowadzonej w (2.1). Dane referencyjne podają średnie pojemności cieplne od 0 do ustalonej temperatury T uzyskane empirycznie, tj.
Średnia pojemność cieplna w zakresie temperatur T 1 , T 2 zgodnie z tymi danymi referencyjnymi można obliczyć za pomocą wzoru
Następnie konkretna ilość ciepło procesowe definiuje się jako
2.2. Izochoryczne i izobaryczne pojemności cieplne
mają duże znaczenie w termodynamice.
izochorycznypojemność cieplna
równy stosunkowi ilości ciepła w procesie przy stałej objętości do zmiany temperatury ciała,
izobarycznypojemność cieplna
równy stosunkowi ilości ciepła w procesie przy stałym ciśnieniu do zmiany temperatury ciała.
W obliczeniach termotechnicznych stosuje się tabele, które pokazują wartości liczbowe uzyskane eksperymentalnie dla określonych izobarycznych i izochorycznych pojemności cieplnych dla różnych substancji w zależności od temperatury.
2.3. Pojemność cieplna mieszanin gazowych
W obliczeniach często trzeba zajmować się mieszaninami gazów, a pojemności cieplne podane są w tabelach tylko dla poszczególnych gazów.
Jeżeli mieszaninę gazów podaje się w ułamkach masowych G I, to właściwe pojemności cieplne masowe mieszaniny określa się za pomocą wzorów
![]()
Jeżeli mieszaninę gazów podaje się w ułamkach objętościowych R I, to właściwe objętościowe pojemności cieplne mieszaniny określa się za pomocą wzorów
![]()
Pytania kontrolne
Zapisz jednostki ciepła właściwego.
W jaki sposób wprowadza się pojęcie średniej pojemności cieplnej?
3. Prawo zachowania i przemiany energii
Pojęcie energii jest związane z ruchem materii.
Energia może przybierać różne formy - praca mechaniczna, ciepło, energia chemiczna, energia pól elektrycznych i magnetycznych.
W procesie termodynamicznym oddziaływanie otoczenia i zamkniętego układu termodynamicznego odbywa się poprzez wymianę energii w postaci ciepła i pracy mechanicznej.
3.1. Energia wewnętrzna
Każde środowisko ma pewien margines energia wewnętrznau(J), który w termodynamice technicznej jest reprezentowany jako suma energii kinetycznej i potencjalnej cząsteczek i atomów ośrodka. Energia kinetyczna tych cząstek jest określona przez ich prędkość i masę, natomiast energia potencjalna przez siły oddziaływania między nimi, które zależą od ich względnego położenia. Energia wewnętrzna układu to energia zawarta w samym układzie. Oznacza to, że energia wewnętrzna może charakteryzować stan ciała wraz z wielkościami R, V, T.
Energia wewnętrzna ma właściwość addytywności, tj. energia wewnętrzna złożonego układu jest równa sumie energii wewnętrznych jego części składowych:
Energia wewnętrzna 1 kg substancji nazywa się określoną energię wewnętrzną u= u/ M (J/kg).
W przypadku większości technicznych zastosowań termodynamiki wartość bezwzględna nie ma znaczenia u, oraz zmianę tej wartości. Dlatego ilościowa definicja energii wewnętrznej układu jednorodnego jest często określana w odniesieniu do jakiegoś konwencjonalnie wybranego stanu standardowego.
3.2. Zasada zachowania energii w termodynamice
Przeprowadzając proces termodynamiczny układ zamknięty oddziałuje ze środowiskiem zewnętrznym (ciałami i polami zewnętrznymi), tj. wymienia energię. W termodynamice technicznej rozważa się dwa rodzaje przekazywania energii - przez przenoszenie ciepła i przez wykonywanie pracy mechanicznej.
Wymiana ciepła zachodzi między ciałami o różnych temperaturach i stykającymi się lub między ciałami o różnych temperaturach, znajdującymi się w pewnej odległości, za pomocą fal elektromagnetycznych ( promieniowanie cieplne). Audycja ciepło zachodzi na poziomie molekularnym (mikrofizycznym) bez widocznego ruchu ciał.
Przeniesienie energii w postaci pracy następuje wraz z ruchem całego ciała lub jego części w przestrzeni. Dzięki tej metodzie ciało albo porusza się w polu siłowym, albo zmienia swoją objętość pod wpływem ciśnienia zewnętrznego. Stanowisko jest makrofizyczną formą przekazywania energii.
Należy zauważyć, że ciepło i praca, w przeciwieństwie do energii ciała, nie są funkcjami jego stanu, ale zależą od rodzaju procesu, określają ten proces, tj. są funkcjami samego procesu.
Liczne eksperymenty i obserwacje doprowadziły do odkrycia podstawowego prawa natury - prawa zachowania energii: energia w przyrodzie nie powstaje z niczego i nie znika, Lub ilość energii pozostaje niezmieniona, zmienia się tylko z jednej postaci w drugą, Lub
Gdzie Q to ciepło zaangażowane w proces; Ł- wykonywana praca; Δ mi jest zmianą energii układu. Tutaj i poniżej zgadzamy się rozważyć:
praca pozytywny jeśli praca ta jest wykonywana przez ciało robocze, oraz negatywny, jeśli praca jest wykonywana na roboczym ciele systemu;
ciepło dostarczane do organizmu pozytywny, a przydzielone - negatywny
dodatkowo zmiana dowolnego parametru stanu w procesie końcowym będzie oznaczona symbolem Δ (delta), aw procesie elementarnym - D(różniczka odpowiedniego parametru). Dla dowolnego skończonego procesu termodynamicznego zmiana parametru stanu (ciśnienie, temperatura, energia wewnętrzna, entalpia, entropia itp.) nie zależy od rodzaju procesu, ale jest określona przez stan początkowy i końcowy.
Ogólnie rzecz biorąc, układ termodynamiczny ma energię wewnętrzną u, energia kinetyczna (w termodynamice układ jest traktowany jako całość poruszająca się z prędkością w) – mw 2 /2, potencjał - mgz (z to wysokość, na której znajduje się system). Zmiana całkowitej energii w procesie 1 –2 można sobie wyobrazić jako:
Praca wykonana w tym procesie jest sumą pracy Ł około, związane ze zmianą objętości płynu roboczego układu (praca odkształcenia), praca Ł dv o ruchu układu w przestrzeni, prace techniczne L te (podczas przenoszenia układu w różnych urządzeniach technicznych, np. w silniku, kotle parowym, sprężarce itp.) działają przeciw siłom tarcia Ł tr:
L \u003d L około + L dv + L te + L tr.
Ciepło zaangażowane w proces jest sumą ciepła Q zewnętrzne, uczestniczące w wymianie ze środowiskiem zewnętrznym oraz ciepło tarcia Q tr:
Q = Q zewnętrzny + Q tr.
Jeśli się uwzględni Q tr = Ł tr (liczne eksperymenty wykazały, że praca przepływu wydatkowana na pokonanie tarcia jest całkowicie zamieniana na ciepło odbierane przez przepływ), zasada zachowania energii w termodynamice dla 1 kg pracującej jednorodnej substancji (tj. w określonych wartościach masowych ) w procesie elementarnym można zapisać:
![]() , (3.1)
, (3.1)
(indeks zewnętrzny pominięty jako zbędny).
Należy podkreślić, że po prawej stronie (3.1) pod znakiem różniczki znajdują się funkcje stanu, a pozostałe to wielkości zależne od charakteru procesu termodynamicznego. Ponieważ praca i ciepło są funkcjami procesu, a nie funkcjami stanu, znak δ oznacza jedynie fakt, że w procesie elementarnym następujące po nim wielkości są dowolnymi nieskończenie małymi, a nie przyrostami określonych funkcji. Zatem δ Q i δ l-elementarne (tj. odpowiadające nieskończenie małym zmianom stanu układu) ilości ciepła i pracy.
Jeżeli układ termodynamiczny nie zmienia swojego położenia w przestrzeni, a jedynym rodzajem pracy jest praca związana ze zmianą objętości układu, to równanie (3.1) przyjmuje prostszą postać:
Praca δ l o odbywa się albo wbrew siłom ciśnienia zewnętrznego, a następnie objętość płynu roboczego rozszerza się, albo odwrotnie, środowisko zewnętrzne wykonuje pracę na ciele, ściskając je. Dla procesów równowagowych, gdy ciśnienie ośrodka jest równe ciśnieniu płynu roboczego, pracę tę oblicza się jako Rdv, Gdzie w jest objętością właściwą substancji roboczej.
Równanie
zwany pierwsza zasada termodynamiki: ciepło dostarczane do zamkniętego układu termodynamicznego w stanie spoczynku jest zużywane na zmianę energii wewnętrznej układu i na pracę mającą na celu zmianę objętości układu. Relacja równowagi (3.2) jest również nazywana wykładami Przez literatura teoretyczna. 1. Barok: ...
L. A. Eliseeva © Federalna Państwowa Budżetowa Instytucja Nauki Państwowa Publiczna Biblioteka Naukowa i Techniczna Oddziału Syberyjskiego Rosyjskiej Akademii Nauk, 2013
WskaźnikPrzypadkowe spacery / A.N. Borodin, IA Ibragimow; pod... 241. Dorogokupets P.I. Termodynamika minerały i równowaga mineralna ... katalogi: kompendium Wykłady Przez kurs „Referencja… stan techniczny Uniwersytet. Seria, Techniczny Nauki. - ...
NV Basova [i inni]; wyd. NV Basova. Rostów bd: Phoenix, 2008
PodręcznikKurs) Pisemne streszczenie DT Wykłady Przez wyższa matematyka [Tekst]: ... Techniczny termodynamika Rudobashta, SP Ciepłownictwo [Tekst]: podręcznik dla studentów. studia na uniwersytetach Przez... 2008. - 204 s. 10 Borodin, I. F. Automatyzacja procesów technologicznych...
Wykaz prac naukowych Skarbu Państwa za okres 2008 – 1 czerwca 2013 (1)
Dokument... „Rentgenowskie metody badań” Wykłady Przez onkologia kliniczna. Almaty... drugiego prawa termodynamika» 2-Międzynarodowe... i opinia eksperta techniczny wyposażenie organizacji opieki zdrowotnej ... Akademik Rosyjskiej Akademii Nauk Medycznych Yu.I. Borodin, Biszkek, 2009, s. ...
W praktyce inżynierskiej często mamy do czynienia nie z gazami jednorodnymi, ale z mieszaninami chemicznie niezwiązanych gazów. Przykładami mieszanin gazowych są: powietrze atmosferyczne, gaz ziemny, gazowe produkty spalania paliw itp.
W przypadku mieszanek gazowych obowiązują następujące przepisy.
1. Każdy gaz wprowadzany do mieszaniny ma temperaturę, równa temperaturze mieszanki.
2. Każdy z gazów zawartych w mieszaninie jest rozłożony w całej objętości mieszaniny, a zatem objętość każdego gazu jest równa objętości całej mieszaniny.
3. Każdy z gazów wchodzących w skład mieszaniny podlega własnemu równaniu stanu.
4. Mieszanina jako całość jest jak nowy gaz i podlega własnemu równaniu stanu.
Badanie mieszanin gazowych opiera się na prawie Daltona, zgodnie z którym w stałej temperaturze ciśnienie mieszaniny jest równe sumie ciśnień cząstkowych gazów wchodzących w skład mieszaniny:
gdzie p cm to ciśnienie mieszaniny;
p i - ciśnienie cząstkowe i-tego gazu zawartego w mieszaninie;
n to liczba gazów zawartych w mieszaninie.
Ciśnienie cząstkowe to ciśnienie, jakie wywiera gaz wchodzący do mieszaniny, jeśli sam zajmuje całą objętość mieszaniny w tej samej temperaturze.
Metody wiązania mieszanek gazowych
Skład mieszaniny gazów można określić za pomocą ułamków masowych, objętościowych i molowych.
Ułamki masowe. Ułamek masowy dowolnego gazu zawartego w mieszaninie to stosunek masy tego gazu do masy mieszaniny.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; .........; m n \u003d M n / M cm,
gdzie m 1 , m 2 , ..., m n - ułamki masowe gazów;
M 1 , M 2 , ..., M n - masy poszczególnych gazów;
M cm to masa mieszaniny.
Łatwo to zauważyć  I
I  (100%).
(100%).
Udziały wolumenowe. Ułamek objętościowy dowolnego gazu zawartego w mieszaninie to stosunek zmniejszonej (częściowej) objętości tego gazu do objętości mieszaniny.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
gdzie V 1 , V 2 , ..., V n - zmniejszone objętości gazów;
V cm to objętość mieszaniny;
r 1 , r 2 , ..., r n - ułamki objętościowe gazów.
Objętość zredukowana to objętość gazu w warunkach mieszaniny (w temperaturze i ciśnieniu mieszaniny).
Zmniejszoną objętość można przedstawić w następujący sposób: jeśli wszystkie gazy oprócz jednego zostaną usunięte z naczynia zawierającego mieszaninę, a pozostały gaz zostanie sprężony do ciśnienia mieszaniny przy zachowaniu temperatury, wówczas jego objętość zostanie zmniejszona lub częściowa.
Można udowodnić, że objętość mieszaniny będzie równa sumie objętości zredukowanych gazów.
 (100%).
(100%).
Ułamki molowe. Ułamek molowy dowolnego gazu zawartego w mieszaninie to stosunek liczby kilomoli tego gazu do liczby kilomoli mieszaniny.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
gdzie r 1 , r 2 , ..., r n - ułamki molowe gazów;
n cm to liczba kilomoli mieszaniny;
n 1 , n 2 , ..., n n to liczba kilomoli gazów.
Określanie mieszaniny za pomocą ułamków molowych jest identyczne z określaniem mieszaniny za pomocą ułamków objętościowych, tj. ułamki molowe i objętościowe mają takie same wartości liczbowe dla każdego gazu zawartego w mieszaninie.
Stała gazowa i pozorna (średnia) masa cząsteczkowa mieszaniny. Aby obliczyć stałą mieszaniny gazów wyrażoną w ułamkach masowych, piszemy równania stanu:
dla mieszanki
p cm × V cm = M cm R cm T; (1,9)
dla gazów
 .
(1.10)
.
(1.10)
Sumujemy lewą i prawą część równań (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Ponieważ  ,
,
wtedy p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1,11)
Wynikają z tego równania (1.9) i (1.11).
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
Lub  ,
(1.12)
,
(1.12)
gdzie R cm jest stałą gazową mieszaniny.
Ponieważ stała gazowa i-tego gazu
R ja = 8314 / m ja ,
następnie równanie (1.12) przepisuje się w następujący sposób:
 .
(1.13)
.
(1.13)
Przy określaniu parametrów mieszaniny gazów wygodnie jest zastosować pewną wartość warunkową zwaną pozorną (średnią) masą cząsteczkową mieszaniny gazów. Koncepcja pozornej masy cząsteczkowej mieszaniny pozwala nam konwencjonalnie traktować mieszaninę jako jednorodny gaz, co znacznie upraszcza obliczenia.
Dla oddzielnego gazu wyrażenie
Analogicznie dla mieszaniny możemy napisać
m cm R cm = 8314, (1,14)
gdzie m cm jest pozorną masą cząsteczkową mieszaniny.
Z równania (1.14), korzystając z wyrażeń (1.12) i (1.13), otrzymujemy
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Argumentując w ten sposób, można otrzymać wzory do obliczania R cm i m cm przez ułamki objętościowe, wzory do przeliczania ułamków masowych na ułamki objętościowe i odwrotnie ułamki objętościowe na ułamki masowe, wzory do obliczania objętości właściwej mieszaniny u cm i gęstość mieszaniny r cm poprzez ułamki masowe i objętościowe oraz wreszcie wzory do obliczania ciśnień cząstkowych gazów wchodzących w skład mieszaniny poprzez ułamki objętościowe i masowe. Przedstawiamy te wzory bez wyprowadzenia w tabeli.
Wzory do obliczania mieszanin gazowych
|
Ustalenie składu mieszanki |
Przejście z jednej kompozycji do drugiej |
Gęstość i objętość właściwa mieszaniny |
Pozorna masa cząsteczkowa mieszaniny |
Stała mieszaniny gazów |
Ciśnienie cząstkowe |
|
Ułamki masowe |
|
|
|
|
|
|
Ułamki objętościowe |
|
|
|
|
|
Pojemność cieplna gazów
Pojemność cieplna ciała to ilość ciepła potrzebna do ogrzania lub ochłodzenia ciała o 1 K. Pojemność cieplna jednostkowej ilości substancji nazywana jest pojemnością cieplną właściwą.
Tak więc ciepło właściwe substancji to ilość ciepła, którą należy przekazać lub odjąć od jednostki substancji, aby zmienić jej temperaturę o 1 K w tym procesie.
Ponieważ w dalszej części rozważane będą tylko właściwe pojemności cieplne, będziemy odnosić się do właściwej pojemności cieplnej po prostu jako pojemności cieplnej.
Ilość gazu można podać za pomocą masy, objętości i liczby kilomoli. Należy zauważyć, że podczas ustawiania objętości gazu objętość ta jest doprowadzana do normalnych warunków i mierzona w normalnych metrach sześciennych (nm 3).
W zależności od sposobu ustawienia ilości gazu wyróżnia się następujące pojemności cieplne:
c - masowa pojemność cieplna, J / (kg × K);
c¢ - objętościowa pojemność cieplna, J / (nm 3 × K);
c m - molowa pojemność cieplna, J / (kmol × K).
Pomiędzy tymi pojemnościami cieplnymi zachodzą następujące zależności:
do = do m / m; gdzie m = gdzie × m;
s¢ = сm / 22,4; gdzie m = s¢ × 22,4,
stąd  ; s¢ = s × r n,
; s¢ = s × r n,
gdzie u n i r n - objętość właściwa i gęstość w normalnych warunkach.
Izochoryczne i izobaryczne pojemności cieplne
Ilość ciepła przekazywanego do płynu roboczego zależy od cech procesu termodynamicznego. Praktyczne znaczenie w zależności od procesu termodynamicznego mają dwa rodzaje pojemności cieplnej: izochoryczna i izobaryczna.
Pojemność cieplna przy u = const jest izochoryczna.
c u - masowa izochoryczna pojemność cieplna,
c¢ u jest objętościową izochoryczną pojemnością cieplną,
cm u jest molową izochoryczną pojemnością cieplną.
Pojemność cieplna przy p = const jest izobaryczna.
c p - masowa izobaryczna pojemność cieplna,
c¢ р - objętościowa izobaryczna pojemność cieplna,
c m p - molowa izobaryczna pojemność cieplna.
Przy tej samej zmianie temperatury w procesie prowadzonym przy p = const zużywane jest więcej ciepła niż w procesie przy u = const. Wyjaśnia to fakt, że przy u = const ciepło oddane ciału zużywane jest tylko na zmianę jego energii wewnętrznej, podczas gdy przy p = const ciepło jest wydawane zarówno na zwiększenie energii wewnętrznej, jak i na wykonanie pracy rozszerzania. Różnica między masowymi izobarycznymi i masowymi izochorycznymi pojemnościami cieplnymi zgodnie z równaniem Mayera
c p - c u=R. (1.17)
Jeśli lewą i prawą stronę równania (1.17) pomnożymy przez kilomolową masę m, to otrzymamy
c m p - c m u= 8314 J/(kmol×K) (1,18)
W termodynamice i jej zastosowaniach duże znaczenie ma stosunek izobarycznych i izochorycznych pojemności cieplnych:
 ,
(1.19)
,
(1.19)
gdzie k jest wykładnikiem adiabatycznym.
Z obliczeń wynika, że dla gazów jednoatomowych k » 1,67, gazów dwuatomowych k » 1,4, a gazów trójatomowych k » 1,29.
Łatwo zauważyć, że wartość Do zależne od temperatury. Rzeczywiście, z równań (1.17) i (1.19) wynika, że
 ,
(1.20)
,
(1.20)
oraz z równań (1.18) i (1.19)
 .
(1.21)
.
(1.21)
Ponieważ pojemności cieplne rosną wraz ze wzrostem temperatury gazu, wartość k maleje, zbliżając się do jedności, ale zawsze pozostaje od niej większa.
Znając wartość k, można wyznaczyć wartość odpowiadającej jej pojemności cieplnej. Na przykład z równania (1.20) mamy
 ,
(1.22)
,
(1.22)
i od tego czasu gdzie p = k × s u, wtedy dostajemy
 .
(1.23)
.
(1.23)
Podobnie dla molowych pojemności cieplnych, z równania (1.21) otrzymujemy
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Średnia i rzeczywista pojemność cieplna
Pojemność cieplna gazów zależy od temperatury i do pewnego stopnia od ciśnienia. Zależność pojemności cieplnej od ciśnienia jest niewielka i jest pomijana w większości obliczeń. Zależność pojemności cieplnej od temperatury jest znacząca i należy ją wziąć pod uwagę. Zależność tę dość dokładnie wyraża równanie
do = za + V t + et 2 , (1,26)
gdzie, V a e to wartości stałe dla danego gazu.
Często w obliczeniach termotechnicznych zależność nieliniowa (1.26) jest zastępowana liniową:
do = za + V T. (1,27)
|
Jeżeli skonstruujemy graficznie zależność pojemności cieplnej od temperatury zgodnie z równaniem (1.26), to będzie to zależność krzywoliniowa (ryc. 1.4). Jak pokazano na rysunku, każda wartość temperatury ma swoją własną wartość pojemności cieplnej, która jest powszechnie nazywana rzeczywistą pojemnością cieplną. Matematycznie wyrażenie na rzeczywistą pojemność cieplną jest zapisane w następujący sposób:
|
|
|
|
Dlatego rzeczywista pojemność cieplna jest stosunkiem nieskończenie małej ilości ciepła dq do nieskończenie małej zmiany temperatury dt. Innymi słowy, rzeczywista pojemność cieplna to pojemność cieplna gazu w danej temperaturze. na ryc. 1.4 rzeczywista pojemność cieplna w temperaturze t1 jest oznaczona jako t1 i jest przedstawiona jako odcinek 1-4, w temperaturze t2 - przez t2 i jest przedstawiona jako odcinek 2-3. Z równania (1.28) otrzymujemy dq=cdt. (1,29) W praktycznych obliczeniach zawsze określamy ilość ciepła przy końcowej zmianie |
temperatura. Oczywiste jest, że ilość ciepła q, która jest podawana jednostkowej ilości substancji, gdy jest ona podgrzewana od t 1 do t 2, można znaleźć przez całkowanie (1,29) od t 1 do t 2.
 .
(1.30)
.
(1.30)
Graficznie całkę (1,30) wyraża pole 4-1-2-3. Jeżeli w wyrażeniu (1,30) podstawimy wartość rzeczywistej pojemności cieplnej zgodnie z zależnością liniową (1,27), to otrzymamy
 (1.31)
(1.31)
Gdzie  - średnia pojemność cieplna w zakresie temperatur od t 1 do t 2.
- średnia pojemność cieplna w zakresie temperatur od t 1 do t 2.
 ,
(1.32)
,
(1.32)
Dlatego średnia pojemność cieplna jest stosunkiem końcowej ilości ciepła q do końcowej zmiany temperatury t 2 - t 1:
 .
(1.33)
.
(1.33)
Jeżeli na podstawie figury 4-3 (ryc. 1.4) skonstruowany zostanie prostokąt 4-1¢-2¢-3 równy wielkości figurze 4-1-2-3, to wysokość tego prostokąta wyniesie być równa średniej pojemności cieplnej, gdzie  mieści się w zakresie temperatur t 1 - t 2 .
mieści się w zakresie temperatur t 1 - t 2 .
Zwykle wartości średnich pojemności cieplnych podaje się w tabelach właściwości termodynamicznych substancji. Aby jednak zmniejszyć objętość tych tabel, podano w nich wartości średnich pojemności cieplnych wyznaczonych w zakresie temperatur od 0°C do t°C.
Jeśli konieczne jest obliczenie wartości średniej pojemności cieplnej w danym zakresie temperatur t 1 - t 2, można to zrobić w następujący sposób.
Obszar 0a14 pod krzywą c \u003d f (t) (ryc. 1.4) odpowiada ilości ciepła q 1 potrzebnej do podniesienia temperatury gazu z 0 ° C do t 1 ° C.

Podobnie obszar 0a23 odpowiada q 2, gdy temperatura wzrasta od 0 o C do t 2 o C:

Zatem q \u003d q 2 - q 1 (obszar 4123) można przedstawić jako
![]() (1.34)
(1.34)
Podstawiając wartość q zgodnie z (1,34) do wyrażenia (1,33), otrzymujemy wzór na średnią pojemność cieplną w dowolnym zakresie temperatur:
 .
(1.35)
.
(1.35)
Zatem średnią pojemność cieplną można obliczyć z tabelarycznych średnich pojemności cieplnych za pomocą równania (1.35). Ponadto otrzymujemy nieliniową zależność c = f(t). Średnią pojemność cieplną można również znaleźć za pomocą równania (1.32) za pomocą zależności liniowej. Wartości a i V w równaniu (1.32) dla różnych gazów podano w literaturze.
Ilość ciepła dostarczonego lub usuniętego z płynu roboczego można obliczyć za pomocą dowolnego z równań:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
Gdzie 

 - odpowiednio średnią masę, objętość i molową pojemność cieplną; M to masa gazu; n to liczba kilomoli gazu; V n - objętość gazu w normalnych warunkach.
- odpowiednio średnią masę, objętość i molową pojemność cieplną; M to masa gazu; n to liczba kilomoli gazu; V n - objętość gazu w normalnych warunkach.
Objętość gazu V n można znaleźć w następujący sposób. Mając zapisane równanie stanu dla danych warunków: pV = MRT i dla warunków normalnych: p n V n = MRT n, pierwszemu przypisujemy drugie równanie:
 ,
,
stąd  .
(1.39)
.
(1.39)
Pojemność cieplna mieszanin gazowych
Pojemność cieplną mieszaniny gazów można obliczyć, jeśli podany jest jej skład i znane są pojemności cieplne składników wchodzących w skład mieszaniny.
Aby ogrzać mieszaninę o masie M cm o 1 K, temperaturę każdego ze składników należy również zwiększyć o 1 K. Jednocześnie ilość ciepła równa c i M i jest zużywana na ogrzewanie i-tego składnika mieszaniny o masie М i . Dla całej mieszanki ilość ciepła  ,
,
gdzie c i oraz c cm to masowe pojemności cieplne i-tego składnika i mieszaniny.
Dzieląc ostatnie wyrażenie przez M cm, otrzymujemy wzór na masową pojemność cieplną mieszaniny:
 ,
(1.40)
,
(1.40)
gdzie m i jest ułamkiem masowym i-tego składnika.
Argumentując podobnie, znajdujemy objętościową pojemność cieplną c¢ cm i molową pojemność cieplną c m cm mieszaniny:
 (1.41)
(1.41)
gdzie c¢ i - objętościowa pojemność cieplna i-tego składnika, r i - ułamek objętościowy i-tego składnika,
 ,
(1.42)
,
(1.42)
gdzie c m i jest molową pojemnością cieplną i-tego składnika,
r i - ułamek molowy (objętościowy) i-tego składnika.
W silnikach cieplnych (maszynach) płynem roboczym jest mieszanina różnych gazów. Jeżeli składniki mieszaniny nie wchodzą ze sobą w reakcje chemiczne, a każdy składnik spełnia równanie stanu Claiperona, to taka mieszanina jest uważana za gaz doskonały.
Aby obliczyć mieszaninę, konieczne jest określenie μ cm - średniej masy molowej i R c m - właściwej stałej gazowej mieszaniny. Aby je określić, konieczna jest znajomość składu mieszanki, czyli jakie składniki iw jakich ilościach tworzą tę mieszaninę, jakie parametry ma każdy składnik wchodzący w skład mieszaniny.
Każdy składnik mieszaniny zachowuje się tak, jakby w mieszaninie nie było innych gazów, zajmuje całą dostępną objętość, w której znajduje się mieszanina, kieruje się własnym równaniem stanu i wywiera na ścianki tzw. wszystkich składników mieszaniny jest taka sama i równa temperaturze mieszaniny.
Zgodnie z prawem Daltona ciśnienie mieszaniny P jest równe sumie ciśnień cząstkowych poszczególnych składników wchodzących w skład mieszaniny:
gdzie n to liczba składników mieszaniny.
Zgodnie z prawem Amaga objętość mieszaniny V jest równa sumie objętości cząstkowych poszczególnych składników wchodzących w skład mieszaniny w temperaturze i ciśnieniu mieszaniny:
 , (1.21)
, (1.21)
gdzie - częściowa objętość, m 3; V- objętość mieszaniny, m 3
Skład mieszaniny podaje się w ułamkach objętościowych (molowych) lub masowych.
Ułamek objętościowy i-tego składnika jest stosunkiem częściowej objętości składnika do objętości mieszaniny, tj. wtedy suma ułamków objętościowych składników mieszaniny wynosi 1, tj. . Jeżeli wartość jest podana w %, to ich suma = 100%.
Ułamek molowy i-tego składnika n i jest stosunkiem liczby kilomoli składnika N i do liczby kilomoli mieszaniny N, tj. gdzie ![]() , , tj. liczba kilomoli każdego składnika i mieszaniny jako całości jest równa stosunkowi odpowiedniego składnika i mieszaniny jako całości do objętości zajmowanej przez jeden kilomol.
, , tj. liczba kilomoli każdego składnika i mieszaniny jako całości jest równa stosunkowi odpowiedniego składnika i mieszaniny jako całości do objętości zajmowanej przez jeden kilomol.
Biorąc pod uwagę, że gaz doskonały w tych samych warunkach ma taką samą objętość kilomolową, to po podstawieniu otrzymujemy: tj. dla gazów doskonałych ułamki molowe i objętościowe są liczbowo równe.
Ułamek masowy i-tego składnika jest stosunkiem masy składnika do masy mieszaniny: , wynika z tego, że masa mieszaniny jest równa sumie mas składników, a także suma ułamków masowych składników jest równa do 1 (lub 100%).
Przeliczanie ułamków objętościowych na ułamki masowe i odwrotnie opiera się na następujących stosunkach:
![]() ,
,
gdzie ρ = μ / 22,4, kg / m 3.
Stąd wynika, że ułamek masowy i-tego składnika będzie wyznaczony z zależności:
 ,
,
gdzie jest gęstość mieszaniny, kg / m3, jest ułamkiem objętościowym i-tego składnika.
W przyszłości można to określić za pomocą ułamków objętościowych.
 .
.
Gęstość mieszaniny dla ułamków objętościowych określa się ze stosunku
 , Gdzie
, Gdzie  , (1.22)
, (1.22)
 .
.
Ciśnienie cząstkowe określa się za pomocą wzorów:
![]() Lub
Lub  (1.23)
(1.23)
Równania stanu składników i mieszaniny jako całości mają postać:
![]() ;
;
![]() ,
,
skąd po przekształceniach otrzymujemy for masywny Akcje
 ,
,  . (1.24)
. (1.24)
Gęstość i objętość właściwa mieszaniny dla masywny udział:
;  . (1.25)
. (1.25)
Do obliczenia ciśnień cząstkowych stosuje się wzór:
 . (1.26)
. (1.26)
Zamiana ułamków masowych na ułamki objętościowe odbywa się według wzoru:
 .
.
Przy określaniu pojemności cieplnej mieszaniny gazów przyjmuje się, że aby ogrzać (schłodzić) mieszaninę gazów, należy ogrzać (schłodzić) każdy ze składników mieszaniny
gdzie Q i = M i c i ∆t to ciepło zużyte na zmianę temperatury i-tego składnika mieszaniny, c i to masowa pojemność cieplna i-tego składnika mieszaniny.
Pojemność cieplna mieszaniny jest określana ze stosunku (jeśli mieszanina jest podana w ułamkach masowych)
 , podobnie
, podobnie  . (1.28)
. (1.28)
Molarne i objętościowe pojemności cieplne dla mieszaniny podane przez ułamki objętościowe są określone przez
 ;
;  ;
;
 ;
; 
Przykład 1.5 Masowe suche powietrze składa się z g O2 \u003d 23,3% tlenu i g N 2 \u003d 76,6% azotu. Określ skład objętościowy powietrza (r O2 i r N 2) oraz stałą gazową mieszaniny.
Rozwiązanie.
1. Z Tabeli 1 znajdujemy kg/kmol i kg/kmol
2. Określ ułamki objętościowe tlenu i azotu:
1. Stałą gazową powietrza (mieszaniny) określa się wzorem:
 , J/kg K
, J/kg K
Przykład 1.6. Określ ilość ciepła potrzebną do ogrzania mieszaniny gazów o masie M = 2 kg w P = const, składającej się z % wagowych: , , , , gdy temperatura zmienia się od t 1 = 900 ° C do t 2 = 1200 °C
Rozwiązanie:
1. Wyznacz średnią masową pojemność cieplną składników tworzących mieszaninę gazów przy P=const i t 1 =900 o C (z P2):
1,0258 kJ/kg K; =1,1045 kJ/kgK;
1,1078 kJ/kg K; =2,1097 kJ/kgK;
2. Wyznaczamy średnią masową pojemność cieplną składników tworzących mieszaninę gazów przy P=const i t 1 =1200 o C (z P2):
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kg K; =2,2106 kJ/kg K;
3. Określamy średnią masową pojemność cieplną mieszaniny dla zakresu temperatur: t 2 \u003d 1200 ° C i t 1 \u003d 900 ° C:
4. Ilość ciepła do ogrzania 2 kg mieszanki przy P=const:
Pierwsza zasada termodynamiki ustala ilościową zależność między zmianą energii wewnętrznej układu a pracą mechaniczną wykonaną wbrew siłom ciśnienia zewnętrznego otoczenia w wyniku doprowadzenia ciepła do płynu roboczego.
Dla zamkniętego układu termodynamicznego równanie pierwszej zasady ma postać
Ciepło przekazywane do płynu roboczego (lub układu) jest wykorzystywane do zwiększenia jego energii wewnętrznej (dU) w wyniku wzrostu temperatury ciała oraz do wykonania pracy zewnętrznej (dL) w wyniku rozszerzania się płynu roboczego i wzrostu jego tom.
Pierwszą zasadę można zapisać jako dH=dq+VdP=dq-dL 0 ,
gdzie dL 0 \u003d VdP - elementarna praca zmiany ciśnienia nazywana jest użyteczną pracą zewnętrzną (techniczną).
dU to zmiana energii wewnętrznej płynu roboczego (układu), na którą składa się energia ruchu termicznego cząsteczek (translacyjnego, obrotowego i wibracyjnego) oraz energia potencjalna oddziaływania cząsteczek.
Ponieważ przejście układu z jednego stanu do drugiego następuje w wyniku doprowadzenia ciepła, więc płyn roboczy nagrzewa się i jego temperatura wzrasta o dT, a objętość zwiększa się o dV.
Wzrost temperatury ciała powoduje wzrost energii kinetycznej jego cząstek, a wzrost objętości ciała prowadzi do zmiany energii potencjalnej cząstek. W rezultacie energia wewnętrzna ciała wzrasta o dU, więc energia wewnętrzna U jest funkcją stanu ciała i może być przedstawiona jako funkcja dwóch niezależnych parametrów U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T). O zmianie energii wewnętrznej w procesie termodynamicznym decydują tylko stany początkowy (U 1) i końcowy (U 2), tj.
W postaci różniczkowej zapisywana jest zmiana energii wewnętrznej
a) jako funkcja określonej objętości i temperatury

b) w funkcji temperatury, ponieważ , To
Do praktycznych obliczeń, w których konieczne jest uwzględnienie zmiany C v wraz z temperaturą, istnieją wzory empiryczne i tabele określonej energii wewnętrznej (często molowej). W przypadku gazów doskonałych molowa energia wewnętrzna mieszaniny Um jest określona wzorem
 , J/kmol
, J/kmol
Dla mieszaniny podanej przez ułamki masowe . Zatem energia wewnętrzna Jest właściwość systemu i charakteryzuje stan systemu.
Entalpia jest funkcją stanu termicznego wprowadzoną przez Kamerlinga-Onnesa (zwycięzca nagroda Nobla, 1913), która jest sumą energii wewnętrznej układu U oraz iloczynu ciśnienia układu P i jego objętości V.
Ponieważ zawarte w nim wielkości są funkcjami stanu, dlatego H jest również funkcją stanu, tj. H \u003d f 1 (P, V); H=f2 (V, T); H=f 3 (P, T).
Zmiana entalpii dH w dowolnym procesie termodynamicznym jest określona przez początkowy stan H 1 i końcowy H 2 i nie zależy od charakteru procesu. Jeżeli układ zawiera 1 kg substancji, wówczas stosowana jest entalpia właściwa J/kg.
Dla gazu doskonałego równanie różniczkowe ma postać
odpowiednio, specyficzna entalpia jest określona przez wzór
Równanie pierwszej zasady termodynamiki to dq=dU+Pdυ, gdy jedynym rodzajem pracy jest praca rozprężania Pdυ=d(Pυ)-υdP, to dq=d(U+Pυ)-υdP, skąd
Praktyczna praca№ 2
Temat: Pojemność cieplna, entalpia, mieszaniny gazów doskonałych, energia wewnętrzna, praca, procesy termodynamiczne.
Cel pracy: Utrwalenie wiedzy zdobytej podczas szkolenia teoretycznego, nabycie umiejętności wykonywania obliczeń ciepłowniczych.
I. Podstawowe definicje, wzory i równania
1. Mieszaniny gazów doskonałych
Mieszanina gazów to mechaniczna mieszanina kilku gazów, które nie oddziałują ze sobą chemicznie. Każdy z gazów w mieszaninie nazywany jest składnikiem gazowym; zachowuje się tak, jakby w mieszaninie nie było innych gazów, tj. równomiernie rozłożone w całej mieszance. Ciśnienie wywierane przez każdy gaz z mieszaniny na ścianki naczynia nazywa się ciśnieniem cząstkowym. Podstawowym prawem dla mieszanin gazów doskonałych jest prawo Daltona, zgodnie z którym ciśnienie mieszaniny jest równe sumie ciśnień cząstkowych gazów tworzących mieszaninę:
2. Energia wewnętrzna
Energia wewnętrzna ciała jest połączeniem energii kinetycznej ruchu mikrocząstek tworzących ciało i ich energii potencjalnej. zdefiniowana interakcja. siły wzajemnego przyciągania się lub odpychania. Nie da się wyznaczyć wartości bezwzględnej energii wewnętrznej, dlatego w obliczeniach termodynamicznych oblicza się nie wartość bezwzględną energii wewnętrznej, ale jej zmianę, tj.
![]() Lub
Lub ![]()
gdzie U 1 i U 2 - energia wewnętrzna stanu początkowego i końcowego płynu roboczego (gazu);
u 1 i 2 - uderzenia. energia wewnętrzna stanu początkowego i końcowego płynu roboczego.
Wynika z tego, że zmiana energii wewnętrznej nie zależy od charakteru i przebiegu procesu, ale jest zdeterminowana stanem płynu roboczego na początku i na końcu procesu zmiany.
Cechą gazu doskonałego jest brak w nim sił oddziaływań molekularnych, a co za tym idzie brak wewnętrznej energii potencjalnej, tj. U n \u003d 0 i U „ \u003d 0. Zatem energia wewnętrzna gazu doskonałego:
U=U k =f(T) unu u=uk =f(T).
H. Gazownictwo.
W termodynamice każda zmiana stanu płynu roboczego w wyniku wymiany energii z środowisko zwany procesem. W takim przypadku zmieniają się główne parametry korpusu roboczego:
Przemiana ciepła w pracę mechaniczną jest związana z procesem zmiany stanu skupienia płynu roboczego. Procesy zmiany stanu skupienia gazu mogą być procesami rozszerzania i kurczenia. Dla dowolnej masy gazu M (kg) praca jest równa:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J.
gdzie l \u003d p (v 2 -v 1) J / kg to praca 1 kg gazu lub praca właściwa.
4. Entalpia gazu,
Entalpia to parametr charakteryzujący energię potencjalną połączenia czynnika roboczego (gazu) z otoczeniem. Entalpia i entalpia właściwa:
ja \u003d U + pV, J i ja i \u003d i + pv, J / kg.
5. Pojemność cieplna.
Ciepło właściwe to ilość ciepła, jaką należy dostarczyć 1 kg gazu, aby ogrzać go o 1°C w danym zakresie temperatur.
Ciepło właściwe to masa, objętość i kilomol. Istnieje związek między masą C, objętością C i kilomolami C pojemności cieplnej:
 ;
; 
gdzie Vo 22,4 m 3 / kmol - bije. objętość gazu w normalnych warunkach.
Masa ud. pojemność cieplna mieszaniny gazów:

Wolumetryczny ciepło właściwe mieszanka gazowa:

Kilomolowe ciepło właściwe mieszaniny gazów:

6. Równanie do określania ilości ciepła
Ilość ciepła oddawanego lub odbieranego przez czynnik roboczy (gaz) można określić za pomocą równania:
Q \u003d M C m (t 2 -t 1), J lub Q \u003d VC (t-t), J, gdzie M i V to masa lub objętość gazu, kg lub m 3;
t u t - temperatura gazu na końcu i na początku procesu ° С;
C i C - średnie masowe i objętościowe uderzenia. pojemność cieplna gazu
W t cp \u003d J / kgK lub J / m 3 K
7. Pierwsza zasada termodynamiki
Prawo to uwzględnia wzajemne przemiany ciepła i pracy mechanicznej. Zgodnie z tym prawem ciepło jest zamieniane na pracę mechaniczną i odwrotnie, praca mechaniczna na ciepło w ściśle równoważnych ilościach. Równanie równoważności ciepła i pracy ma postać:
Uwzględniając zasadę równoważności ciepła i pracy, równanie bilansu cieplnego dla dowolnej masy gazu:
Q \u003d U + L i q \u003d u + l \u003d u -u + l
Rozwiązywanie problemówII
Zadanie nr 1 (nr 1)
Suche powietrze atmosferyczne ma następujący przybliżony skład masowy: g 02 = 23,2%, g N 2 = 76,8%.
Za pomocą barometru wyznacz skład objętościowy powietrza, jego stałą gazową, pozorną masę cząsteczkową, ciśnienie cząstkowe tlenu i azotu, jeśli powietrze wynosi P = 101325 Pa.
Określam skład objętościowy powietrza:
 ;
; ;
;
gdzie r jest ułamkiem masowym;
m jest względną masą cząsteczkową;
g to ułamek objętościowy.
m powietrze. = m O2 r O2 + m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
gdzie R 0 jest stałą gazową.
Wyznaczam ciśnienia cząstkowe różnych gazów:
P O 2 \u003d P cm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
gdzie P O 2 , P N 2 - ciśnienie cząstkowe;
P cm to ciśnienie mieszaniny.
Zadanie nr 2 (nr 2)
Naczynie jest podzielone przegrodą na 2 części, których objętości wynoszą V 1 = 1,5 m 3 i V 2 = 1,0 m 3 . Pierwsza część objętości V1 zawiera CO2 przy P1 = 0,5 MPa i t1 = 30°C; druga część objętości V2 zawiera O2 przy P2 = 0,2 MPa i t2 = 57°C. Wyznacz ułamki masowe i objętościowe CO 2 i O 2 , pozorną masę cząsteczkową mieszaniny oraz jej stałą gazową po usunięciu przegrody i zakończeniu procesu mieszania.
Wyznaczam poszczególne stałe gazowe:
Aby to zrobić, określam względną masę cząsteczkową: m (CO 2) \u003d 32 + 12 \u003d 44; m(02)=32;

 ;
;
![]()
 ;
;
Zgodnie z charakterystycznym równaniem Klaiperona określam masy gazów:
 (kg);
(kg);
 (kg);
(kg);
Wyznaczam ułamki masowe:


Wyznaczam ułamki objętościowe:


Wyznacz pozorną masę cząsteczkową powietrza:
m powietrze. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 \u003d 41,48;
Wyznaczam indywidualną stałą gazową dla powietrza (R):

 ;
;
Zadanie nr 3 (nr 6)
W naczyniu o pojemności 300 l znajduje się tlen pod ciśnieniem P 1 \u003d 0,2 MPa i t 1 \u003d 20 0 C. Ile ciepła należy dostarczyć, aby temperatura tlenu wzrosła do t 2 \u003d 300 0 C ? Jakie ciśnienie powstanie w naczyniu? Do obliczeń weź średnie objętościowe ciepło właściwe tlenu w n.o. C02 \u003d 0,935 
Zgodnie z prawem Karola określam końcowe ciśnienie procesu:
;  (Rocznie);
(Rocznie);
gdzie P, T to parametry gazu.
Wyznaczam indywidualną stałą gazową dla tlenu (R):

 ;
;
Ponieważ proces jest izochoryczny, określam ilość ciepła, które należy dostarczyć zgodnie z odpowiednim wzorem: Q v \u003d M C cv (T 2 -T 1) w tym celu, zgodnie z charakterystycznym równaniem Claiperona, określam masę gazu
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
Zadanie nr 4 (nr 7)
Ile ciepła należy wydać, aby ogrzać 2m3 powietrza przy stałym nadciśnieniu P ex. \u003d 0,2 MPa od temperatury 100 0 C do temperatury 500 0 C. Jaką pracę wykona w tym przypadku powietrze? Do obliczeń weź: ciśnienie atmosferyczne P o godz. \u003d 0,1 MPa, średnia masa izobaryczna pojemność cieplna powietrza C pm \u003d 1,022  ; obliczyć stałą gazową pamiętając, że pozorna masa cząsteczkowa powietrza M powietrze. =29.
; obliczyć stałą gazową pamiętając, że pozorna masa cząsteczkowa powietrza M powietrze. =29.
Wyznaczam indywidualną stałą gazową dla powietrza:

 ;
;
Ciśnienie bezwzględne jest równe sumie nadmiaru i atmosferycznego P=P est. + P o godz. =0,1+0,2=0,3 MPa
 (kg);
(kg);
Ponieważ proces jest izobaryczny, wyznaczam Q i L zgodnie z odpowiednimi wzorami:
zgodnie z prawem Gay-Lussaca określam objętość końcową:
 m3;
m3;
Q \u003d M C pm (T 2 -T 1) \u003d 5,56 1022 400 \u003d 2272928 (J);
L \u003d P. (V 2 -V 1) \u003d 300000 2,15 \u003d 645000 (J).
Zadanie nr 5 (nr 8)
W cylindrze znajduje się powietrze o ciśnieniu P=0,5 MPa i temperaturze t 1 = 400 0 C. Ciepło jest odbierane z powietrza przy P=const tak, że na końcu procesu temperatura t 2 = 0 0 C wynosi zestaw Objętość cylindra, w którym powietrze V 1 \u003d 400l.
Wyznacz ilość oddanego ciepła, objętość końcową, zmianę energii wewnętrznej i pracę doskonałą sprężania C pm = 1,028  .
.
Ponieważ proces jest izobaryczny, zgodnie z prawem Gay-Lussaca określam końcową objętość:
 m3;
m3;
Zgodnie z charakterystycznym równaniem Klaiperona określam masę gazu:
Z poprzedniego problemu R=286,7 
 (kg);
(kg);
Określam ilość wydzielanego ciepła:
Q=M Cpm (T2-T1)=1,03 1028 (273-673)=-423536 (J);
Określam ilość włożonej pracy:
L=P (V2-V1)=500000 (0,16-0,4)=-120000 (J);
Z równania, za pomocą którego określa się całkowitą ilość, określam zmianę ilości energii wewnętrznej:
![]() ; (J)
; (J)
Zadanie nr 6 (nr 9)
Powietrze o objętości V 1 = 0,02 m3 pod ciśnieniem P 1 = 1,1 MPa i t 1 = 25 s rozpręża się w cylindrze z ruchomym tłokiem do ciśnienia P 2 = 0,11 MPa. Znajdź końcową objętość V 2 , końcową temperaturę t 2 , pracę wykonaną przez powietrze i dostarczone ciepło, jeśli nastąpi rozprężenie w cylindrze:
a) izotermicznie
b) adiabatycznie z wykładnikiem adiabatycznym k=1,4
c) politropowe o indeksie politropowym n=1,3
Proces izotermiczny:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0,02 1,1 / 0,11 \u003d 0,2 M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000 J
proces adiabatyczny:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 · 298 \u003d 20,32 k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1,4-1) (1,1 10 6 0,02 -0,11 10 6 0, 1)=2,0275 10 6 J
Proces politropowy:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1,3-1)) (1,1 10 6 0,02 -0,11 10 6 0,118)=30000J
Q=(k-n/k-1) l M=((1,4-1,3)/(1,4-1)) 30000=7500J
Literatura:
1. Energia, Moskwa, 1975.
2. Litwin AM „Teoretyczne podstawy ciepłownictwa”, wydawnictwo „Energia”, Moskwa, 1969.
3. Tugunov P.I., Samsonov A.A., „Podstawy ciepłownictwa, silników cieplnych i urządzeń parowych”, wydawnictwo Nedra, Moskwa, 1970.
4. Krutov V.I., „Ciepłownictwo”, wydawnictwo „Inżynieria”, Moskwa, 1986.
Mieszanki gazowe. Pojemność cieplna gazów
Mieszaniny gazów są rozumiane jako mechaniczna mieszanina kilku gazów, które nie oddziałują ze sobą chemicznie. Mieszanina gazów doskonałych spełnia wszystkie prawa dotyczące gazy doskonałe. Skład mieszaniny gazów jest określony przez ilość każdego z gazów zawartych w mieszaninie i może być określony przez ułamki masowe lub objętościowe:
gdzie to masa -tego składnika, to objętość -tego składnika, a i to odpowiednio masa i objętość całej mieszaniny.
To oczywiste
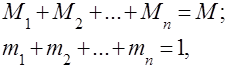
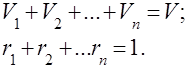
Dla wygody rozwiązywania praktycznych problemów z mieszaninami gazów wprowadzono pojęcie pozornej masy cząsteczkowej mieszaniny gazów, która jest średnią masą rzeczywistych mas cząsteczkowych poszczególnych składników mieszaniny.
Równanie stanu mieszaniny gazów ma postać:
Mieszaniny gazów podlegają koncepcji uniwersalnej stałej gazowej
Zależność między ciśnieniem mieszaniny gazów a ciśnieniem cząstkowym poszczególnych składników wchodzących w skład mieszaniny określa prawo Daltona:
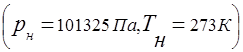
1 gaz ma różną masę w zależności od ciśnienia i temperatury. W związku z tym objętościowa pojemność cieplna jest zawsze odnoszona do masy gazu zamkniętego w 1 w normalnych warunkach. W tym przypadku objętość 1 kmola różnych gazów wynosi 22,4 / kmol, a uniwersalna stała gazowa wynosi . W zależności od sposobu dostarczania ciepła do gazu wyróżnia się izobaryczne i izochoryczne pojemności cieplne. Stosunek tych wielkości nazywany jest wykładnikiem adiabatycznym
Pojemności cieplne i są również powiązane relacją Mayera
Ilość ciepła, którą należy wydać w procesie ogrzewania 1 kg gazu w zakresie temperatur od do, określa wzór:
gdzie i są odpowiednio średnimi pojemnościami cieplnymi w zakresie 0°- i 0°-.
Jeśli (kg) lub () gaz jest zaangażowany w proces, to
Pojemność cieplną mieszaniny gazów należy określić za pomocą wzorów:
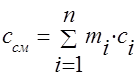
masa - ;
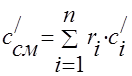
wolumetryczny -;
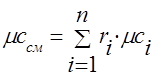
molowy - .
Aby wykorzystać ciepło gazów będących produktami spalania paliwa w zespole kotłowym, w kanałach gazowych tego ostatniego instaluje się nagrzewnice powietrza niezbędnego do spalania paliwa (rys. 1). Gazy opuszczające kocioł wchodzą do nagrzewnicy powietrza o temp. i ulegają schłodzeniu oddając ciepło do powietrza do ok. W kanale gazowym zespołu kotłowego pod wpływem pracy oddymiacza ustawia się ciśnienie nieco poniżej atmosferycznego. Powietrze w nagrzewnicy powietrza jest podgrzewane od temperatury do temperatury.
spaliny
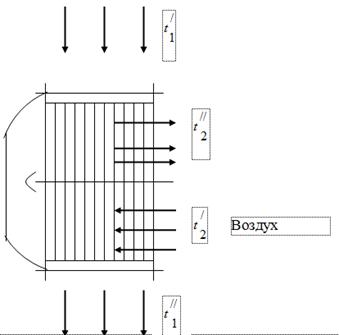
Podczas testowania jednostki kotłowej uzyskano następujące dane:
Temperatura gazów na wlocie do nagrzewnicy powietrza = 450 °C.
Temperatura gazów na wylocie nagrzewnicy powietrza = 150°C.
Temperatura powietrza na wlocie do nagrzewnicy = 26°C.
Temperatura powietrza na wylocie nagrzewnicy powietrza = 260°C.
Skład objętościowy spalin - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Godzinne zużycie gazów wynosi 50 ·/h.
Próżnia w kanale gazowym - 15 mm wody. Sztuka.
Ciśnienie barometryczne 760 mm Hg. Sztuka.
Definiować:
pozorna masa cząsteczkowa gazów spalinowych;
stała gazowa spalin;
udziały wagowe (masowe) poszczególnych składników wchodzących w skład spalin;
ciśnienia cząstkowe składników:
godzinny przepływ powietrza.
Załóżmy, że całe ciepło oddawane przez gaz jest pobierane przez powietrze.
Zależność pojemności cieplnej od temperatury uważa się za krzywoliniową.
1. Pozorna masa cząsteczkowa gazów spalinowych
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Stała gazowa spalin
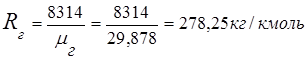
3. Ułamki masowe komponenty gazowe
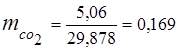
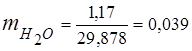
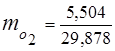
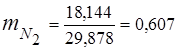
4. Ciśnienia cząstkowe składników
Wyniki obliczeń zostaną wprowadzone do tabeli
|
Opcje |
mieszanka gazowa |
|||
|
|
||||
|
|
||||
|
|
5. Godzinowe zużycie powietrza
Zużycie powietrza określa się z równania bilansu cieplnego nagrzewnicy
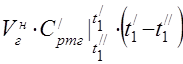
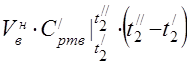
średnia molowa pojemność cieplna w 450 ° C
Średnie ciepło właściwe składników w zakresie temperatur 0 ... 450 ° C.













 .
(1.28)
.
(1.28)