Isı kapasitesi hangi birimlerde ölçülür? Gazların ısı kapasitesi. Isı kapasitesi türleri
Bir cismin ısı kapasitesi, sıcaklığını bir derece yükseltmek için belirli bir cisme verilmesi gereken ısı miktarıdır. Vücut bir derece soğuduğunda aynı miktarda ısı verir. Isı kapasitesi vücudun kütlesi ile orantılıdır. Bir cismin birim kütlesinin ısı kapasitesi özgül olarak adlandırılır ve özgül ısının atomik veya moleküler kütle ile çarpımı sırasıyla atomik veya molar olarak adlandırılır.
Isı kapasiteleri çeşitli maddeler birbirinden çok farklıdır. Yani, özısı 20 ° C'de su 4200 J / kg K, çam ağacı - 1700, hava - 1010. Metaller için daha azdır: alüminyum - 880 J / kg K, demir - 460, bakır - 385, kurşun - 130. Özgül ısı sıcaklıkla hafifçe artar (90°C'de suyun ısı kapasitesi 4220 J/kg K'dir) ve faz dönüşümleri sırasında büyük ölçüde değişir: 0°C'de buzun ısı kapasitesi suyunkinden 2 kat daha azdır; 100°C'de su buharının ısı kapasitesi yaklaşık 1500 J/kg K'dir.
Isı kapasitesi, vücudun sıcaklığının değiştiği koşullara bağlıdır. Vücudun boyutları değişmezse, tüm ısı iç enerjiyi değiştirmeye gider. Burada sabit hacimdeki ısı kapasitesinden bahsediyoruz. Sabit dış basınçta, termal genleşme nedeniyle, dış kuvvetlere karşı mekanik iş yapılır ve belirli bir sıcaklığa kadar ısıtma daha fazla ısı gerektirir. Bu nedenle, sabit basınçtaki ısı kapasitesi her zaman 'den büyüktür. İçin ideal gazlar(şekle bakın), burada R, 8,32 J / mol K'ye eşit gaz sabitidir.
Genellikle ölçülür. Klasik yolısı kapasitesi ölçümleri şu şekildedir: ısı kapasitesi ölçülecek olan bir cisim, belirli bir sıcaklığa kadar ısıtılır ve başlangıç sıcaklığı olan bir kalorimetreye yerleştirilir, su veya bilinen bir ısı kapasitesine sahip başka bir sıvı ile doldurulur ve - ısı kapasitesi kalorimetre ve sıvı).
Termal denge kurulduktan sonra kalorimetredeki sıcaklığı ölçerek, vücudun ısı kapasitesi aşağıdaki formül kullanılarak hesaplanabilir:
![]()
nerede ve vücut, sıvı ve kalorimetrenin kütleleridir.
En gelişmiş teori, gazların ısı kapasitesidir. Normal sıcaklıklarda, ısıtma esas olarak gaz moleküllerinin öteleme ve dönme hareketinin enerjisinde bir değişikliğe yol açar. Tek atomlu gazların molar ısı kapasitesi için teori, iki atomlu ve çok atomlu - ve verir. Çok düşük sıcaklıklarda, kuantum etkilerinden dolayı ısı kapasitesi biraz daha azdır (bkz. Kuantum mekaniği). -de yüksek sıcaklıklar titreşim enerjisi eklenir ve çok atomlu gazların ısı kapasitesi artan sıcaklıkla artar.
Klasik teoriye göre kristallerin atomik ısı kapasitesi eşittir Dulong ve Petit'in (1819'da Fransız bilim adamları P. Dulong ve A. Petit tarafından kurulan) ampirik yasasıyla tutarlıdır. Kuantum teorisiısı kapasitesi, yüksek sıcaklıklarda aynı sonuca götürür, ancak sıcaklık azaldıkça ısı kapasitesinde bir azalma öngörür. Mutlak sıfıra yakın, tüm cisimlerin ısı kapasitesi sıfıra eğilimlidir (termodinamiğin üçüncü yasası).
Vücudun ısı kapasitesi- BT fiziksel miktar, ısıtıldığında vücut tarafından emilen ısı miktarının sıcaklığındaki değişime oranı ile belirlenir:
Bir cismin ısı kapasitesinin fiziksel anlamı: Bir cismin ısı kapasitesi, vücut tarafından ısıtıldığında emilen veya 1K soğutulduğunda salınan ısı miktarına eşittir.
Isı kapasiteleri değişken olduğundan, ortalama ve gerçek ısı kapasiteleri arasında ayrım yaparlar. Ortalama ısı kapasitesi altında, ısı miktarının oranını anlayın q , bir maddenin (gaz) miktarının bir birimine, sıcaklığındaki bir değişikliğe kadar toplanır t 1 önceki t 2 sıcaklık farkı olması şartıyla t 2 - t 1 sonlu bir değerdir. Sırasıyla ortalama kütle, hacim ve molar ısı kapasiteleri şu şekilde gösterilir: c m , c m ' ve m . Ortalama ısı kapasitesinin tanımından, eğer gaz sıcaklığı yükselirse, t 1 önceki t 2 daha sonra ortalama ısı kapasitesi [kJ / (kg * K)]
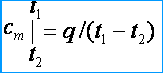
Gerçek ısı kapasitesi altında, gaz sıcaklığındaki sonsuz küçük bir değişikliğe karşılık gelen ve sıcaklıktaki sonsuz küçük bir değişikliğe karşılık gelen gazın ısı kapasitesini anlayın. dt , yani
c = dq/dt,
nerede dq=cdt.
Özısı farklı maddelerin ısıtıldıklarında ısıyı emme yeteneğidir. Bir maddenin özgül ısı kapasitesi, aşağıdaki durumlarda, ısıtıldığında aldığı ısı miktarının maddenin kütlesine oranı ve sıcaklığındaki değişim ile belirlenir: ![]()
molar ısı kapasiteleri Cp ve CV arasındaki ilişkiyi ifade eden ilişki şu şekildedir (Mayer formülü): Cp = CV + R. VEYA DAHA FAZLA GENİŞLETİLMİŞ Isı kapasitesi Ideal gaz Isı transferi sonucunda vücuda belirli bir miktar ısı aktarılırsa, vücudun iç enerjisi ve sıcaklığı değişir. 1 kg maddeyi 1 K ısıtmak için gereken Q ısı miktarına c maddesinin özgül ısısı denir. c = Q / (mΔT). Çoğu durumda, molar ısı kapasitesi C: C = M c'nin kullanılması uygundur, burada M, maddenin molar kütlesidir. Bu şekilde belirlenen ısı kapasitesi, bir maddenin kesin bir özelliği değildir. Termodinamiğin birinci yasasına göre, bir cismin iç enerjisindeki değişim sadece aldığı ısı miktarına değil, cismin yaptığı işe de bağlıdır. Isı transfer işleminin gerçekleştirildiği koşullara bağlı olarak, vücut çeşitli işler yapabilir. Bu nedenle, vücuda aktarılan aynı miktarda ısı, vücudun iç enerjisinde ve dolayısıyla sıcaklığında farklı değişikliklere neden olabilir. Isı kapasitesinin belirlenmesindeki bu tür belirsizlik, yalnızca gaz halindeki bir madde için tipiktir. Sıvı ve katı cisimler ısıtıldığında hacimleri pratik olarak değişmez ve genleşme işi sıfıra eşit olur. Bu nedenle vücut tarafından alınan ısı miktarının tamamı iç enerjisini değiştirmeye gider. Sıvıların aksine ve katılar, ısı transferi sürecindeki gaz hacmini büyük ölçüde değiştirebilir ve iş yapabilir. Bu nedenle, gaz halindeki bir maddenin ısı kapasitesi termodinamik sürecin doğasına bağlıdır. Genellikle, gazların ısı kapasitesinin iki değeri dikkate alınır: CV, izokorik bir işlemdeki molar ısı kapasitesidir (V = sabit) ve Cp, izobarik bir işlemdeki molar ısı kapasitesidir (p = sabit). Sabit hacimdeki süreçte gaz iş yapmaz: A = 0. Termodinamiğin birinci kanunundan 1 mol gaz için QV = CVΔT = ΔU gelir. Bir gazın iç enerjisinin değişimi ΔU, sıcaklığındaki değişim ΔT ile doğru orantılıdır. Sabit basınçtaki bir süreç için, termodinamiğin birinci yasası şunu verir: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV, burada ΔV, ideal bir gazın 1 molünün sıcaklığı ΔT kadar değiştiğinde hacmindeki değişimdir. Bundan şu sonuç çıkar: ΔV / ΔT oranı, 1 mol için yazılmış ideal bir gazın durum denkleminden bulunabilir: pV = RT, burada R, evrensel gaz sabitidir. p = const'de Böylece, molar ısı kapasiteleri Cp ve CV arasındaki ilişkiyi ifade eden ilişki şu şekildedir (Mayer'in formülü): Cp = CV + R.
Gaz sabiti sayısal olarak 1 mol ideal gazın 1 K ile ısıtıldığında sabit basınç altında genleşme işine eşittir. R = pV/T = 1,01 10 5 22,4 10-3/273[Pa m 3 /mol]/ K =8,31(44) Dzh/ (mol K)
Evrensel gaz sabiti, Boltzmann sabiti k ve Avogadro sabitinin ürününe eşit olan evrensel, temel bir fiziksel sabit R'dir.
Fiziksel anlamı: Gaz sabiti i, sıcaklıkta 1 K artışla izobarik bir işlemde bir mol ideal gazın genleşme işine sayısal olarak eşittir
CGS sisteminde gaz sabiti:
Spesifik gaz sabiti:
adyabatik üs(bazen denir katsayıPoisson) - sabit basınçtaki () ısı kapasitesinin sabit hacimdeki () ısı kapasitesine oranı. Bazen de denir faktör izantropik uzantılar. Yunanca harf (gama) veya (kappa) ile gösterilir. Harf sembolü çoğunlukla kimya mühendisliği disiplinlerinde kullanılır. Isı mühendisliğinde Latin harfi kullanılır.
Bir gaz karışımı göz önünde bulundurulan koşullar altında birbiriyle kimyasal reaksiyona girmeyen birkaç farklı gazın bir koleksiyonudur.
Bir gaz karışımı homojen bir termodinamik sistemdir (sistemin makroskobik kısımlarını birbirinden ayıran, özellikleri ve bileşimleri bakımından farklılık gösteren arayüzlerin bulunmadığı).
Kısmi basıncı Karışımdaki i'inci gazın Pi'si, diğer tüm gazlar karışımdan çıkarıldığında bu gazın altında olacağı basınçtır ve V ve T aynı kalır.
Dalton yasası - Birbiriyle kimyasal olarak etkileşime girmeyen gaz karışımlarının basıncı, bu gazların kısmi basınçlarının toplamına eşittir.
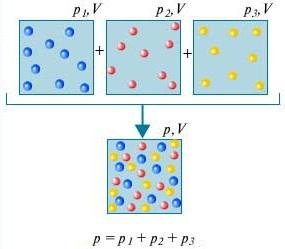
ne olduğunu anlamak için dalton yasası, bunun için odadaki havayı düşünün. Birkaç gazın karışımıdır: nitrojen (%80), oksijen (%20). Bu gazların her birinin kısmi basıncı, gazın tek başına tüm hacmi kaplaması durumunda sahip olacağı basınçtır. Örneğin, nitrojen dışındaki tüm gazlar odadan çıkarılırsa, geriye kalanın basıncı nitrojenin kısmi basıncı olacaktır. Dalton yasası birlikte alınan tüm gazların toplam basıncının, ayrı ayrı alınan her gazın kısmi basınçlarının toplamına eşit olduğunu belirtir. (Aslında, yasa yalnızca ideal gazlar için geçerlidir, ancak yeterince iyi bir yaklaşımla gerçek gazları da tanımlar.)
termodinamiğin birinci yasası termodinamik bir sistem için enerjinin korunumu ve dönüşümü yasasının genelleştirilmesidir. Aşağıdaki gibi formüle edilmiştir:
Δ değiştirsen Yalıtılmamış bir termodinamik sistemin iç enerjisi, ısı miktarı arasındaki farka eşittir.Q sisteme aktarılır ve çalışırA , dış cisimler üzerinde mükemmel bir sistem.
|
Termodinamiğin birinci yasasını ifade eden bağıntı genellikle farklı bir biçimde yazılır:
|
Sistem tarafından alınan ısı miktarı, iç enerjisini değiştirmek ve dış cisimler üzerinde iş yapmak için kullanılır.
Termodinamiğin birinci yasası, deneysel gerçeklerin genelleştirilmesidir. Bu yasaya göre enerji var edilemez veya yok edilemez; bir sistemden diğerine aktarılır ve bir biçimden diğerine dönüştürülür. Termodinamiğin birinci yasasının önemli bir sonucu, dışarıdan enerji tüketmeden ve makinenin kendisinde herhangi bir değişiklik olmaksızın yararlı işler yapabilen bir makine yaratmanın imkansız olduğu iddiasıdır. Böyle bir varsayımsal makine denir birinci türden sürekli hareket makinesi (perpetuum mobile) . Böyle bir makine yaratmaya yönelik çok sayıda girişim, her zaman başarısızlıkla sonuçlandı. Herhangi bir makine pozitif iş yapabilir A sadece belirli bir miktarda ısı elde ederek dış cisimler üzerinde Qçevreleyen cisimlerden veya Δ'da bir azalmadan sen onun iç enerjisi.
Termodinamiğin birinci yasasını gazlardaki izoproseslere uygulayalım.
izobarik genişleme ile Q> 0 - gaz tarafından ısı emilir ve gaz pozitif iş yapar. izobarik sıkıştırma ile Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T bir tane ; iç enerji azalır, Δ sen < 0.
AT izotermal süreç gaz sıcaklığı değişmez, bu nedenle gazın iç enerjisi, Δ sen = 0.
AT izokorik süreç (V= sabit) gaz iş yapmaz, A= 0. Bu nedenle,
İzobarik bir süreç için termodinamiğin birinci yasası şunu verir:
|
İzotermal bir süreç için termodinamiğin birinci yasası şu bağıntıyla ifade edilir:
|
ısı miktarı Q izotermal genleşme sürecinde elde edilen gaz, dış cisimler üzerinde işe dönüşür. İzotermal sıkıştırma altında, gaz üzerinde üretilen dış kuvvetlerin işi, çevredeki cisimlere aktarılan ısıya dönüştürülür.
Termodinamik, izokorik, izobarik ve izotermal süreçlerin yanı sıra, genellikle çevreleyen cisimlerle ısı alışverişinin olmadığı durumlarda meydana gelen süreçleri dikkate alır. Yalıtkan duvarlara sahip gemiler denir adyabatik kabuklar ve bu tür kaplarda gaz genleşme veya sıkıştırma işlemleri denir adyabatik.
AT Adyabatik süreçQ= 0; bu nedenle termodinamiğin birinci yasası şu şekli alır:
|
|
|
Fiziksel anlamıyla termodinamiğin birinci yasası, termodinamiğin enerjinin korunumu (değişimi) yasasıdır. Mekanikte enerji değişimi yasasına göre, korunumsuz kuvvetlerin işi sistemin mekanik enerjisinin artışına eşitse (özellikle, negatif işaretli sürtünme kuvvetlerinin işi azalmaya eşittir) sistemin mekanik enerjisi), o zaman termodinamiğin birinci yasasına göre, termodinamiğin iç enerjisinin artışı, sistem üzerindeki mükemmel dış kuvvetlerin işi ile sisteme aktarılan enerjinin toplamına eşittir. ısı transferi ile sistem. entalpi(Yunancadan. entalpo- ısınmak) maddenin özelliği, ısıya dönüştürülebilen enerji miktarını gösterir. entalpi bir maddenin moleküler yapısında depolanan enerji seviyesini gösteren termodinamik bir özelliğidir. Bu, maddenin sıcaklık ve basınca bağlı olarak enerjiye sahip olabileceği, ancak tamamının ısıya dönüştürülemeyeceği anlamına gelir. İç enerjinin bir kısmı her zaman maddede kalır ve moleküler yapısını korur. Bir maddenin kinetik enerjisinin bir kısmı, sıcaklığı ortam sıcaklığına yaklaştığında mevcut değildir. Sonuç olarak, entalpi belirli bir sıcaklık ve basınçta ısıya dönüştürülebilen enerji miktarıdır. Entalpi birimleri, enerji için BTU veya Joule ve özgül enerji için Btu/lbm veya J/kg'dır. 11 soru |

işin amacı: Malzemelerin ısı kapasitesinin deneysel olarak belirlenmesi.
Teçhizat: Terazi, ağırlık, kalorimetre, ısı kapasitesi bilinen metal silindir, beher, ısıtıcı, kanca.
Kısa teori:
Tüm makroskobik cisimler ve cisim sistemleri, hareketlerinden ve etkileşimlerinden kaynaklanan mekanik enerjiye ek olarak, içsel durumlarına bağlı olan enerjiye sahiptir. Vücudu oluşturan tüm parçacıkların arasındaki hareket ve etkileşim enerjisi olan bu enerjiye içsel denir.
İç enerji, belirli bir cismi oluşturan moleküllerin ve atomların ısıl hareketinin kinetik enerjisini, çekirdeklerin etrafındaki atomlarda hareket eden elektronların kinetik enerjisini, moleküller, atomlar, elektronlar ve çekirdekler arasındaki etkileşimlerin potansiyel enerjisini, çekirdekteki nükleonları içerir. , vb. İç enerji kavramı, belirli bir cismin bir bütün olarak kinetik ve potansiyel enerjisini içermez.
İç enerji, belirli bir sistemin durumunu karakterize eden bir dizi parametre tarafından benzersiz bir şekilde belirlenir, yani. bu sistemin durumunun tek değerli bir fonksiyonudur.
İç enerji genellikle U harfi ile gösterilir.
Faz geçiş sıcaklıklarından uzak sıcaklıklarda meydana gelen termal olaylarda, iç enerji DU'daki bir değişiklik, moleküllerin kinetik ve potansiyel enerjisindeki bir değişiklikle ilişkilendirilirken, iç enerjinin geri kalan bileşenleri değişmez. Bu nedenle, bu tür işlemlerde, bir cismin iç enerjisinin, bu cismin kütle merkezine göre tüm moleküllerin kaotik termal hareketinin kinetik enerjilerinin ve tümünün potansiyel etkileşim enerjilerinin toplamına eşit olduğunu varsayabiliriz. moleküller birbirleriyle
Vücudun durumu değiştiğinde, iç enerjisi de değişir. Örneğin, bir cismin sıcaklığı arttığında, bu cismin moleküllerinin hareketinin ortalama kinetik enerjisi arttığından, cismin iç enerjisi artar. Sıcaklık düştükçe vücudun iç enerjisi azalır.
Vücutların iç enerjisi değişebilir Farklı yollar. Örneğin, iç enerji, belirli bir cismin deformasyonu sırasında dış kuvvetler tarafından mekanik iş yapıldığında ve ayrıca iş yapılmadan vücut, sıcaklıktan daha yüksek veya daha düşük sıcaklığa sahip başka bir cisim (veya ortam) ile temas halinde olduğunda değişir. verilen beden.
Bir cismin iç enerjisini mekanik iş yapmadan değiştirme işlemine ısı transferi veya ısı transferi denir. Üç tür ısı transferi vardır: konveksiyon, iletim ve radyasyon.
Isı alışverişi sırasında, bir türden diğerine enerji dönüşümü olmaz. Isı transferi işlemi, iç enerjinin daha sıcak bir gövdeden bir kısmının daha az sıcak bir gövdeye (veya ortama) aktarılması gerçeğinden oluşur.
Isı transferi süreçlerini karakterize etmek için, ısı transferi sürecinde vücudun iç enerjisindeki değişimin nicel bir ölçüsü olan bir miktar olarak adlandırılan ısı miktarı kavramı tanıtılır.
Bir cismin sadece enerji verebileceği veya alabileceği ve Q ısı miktarının, ısı transferi sürecinde vücut tarafından verilen veya alınan enerjinin yalnızca sayısal bir eşdeğeri olduğu unutulmamalıdır.
Isı miktarı işlemin türüne bağlıdır ve sistemin durumunun bir fonksiyonu değildir.
Faz dönüşümleri olmadan meydana gelen vücudu ısıtmak için gereken ısı miktarı (maddenin toplanma durumunu değiştirmeden):
burada c cismin özgül ısı kapasitesi, aktarılan ısı miktarının cismin m kütlesine oranı ile belirlenir ve bunun sonucunda oluşan sıcaklık değişimi DT, m vücut kütlesi, DT nihai arasındaki farktır ve verilen cismin başlangıç sıcaklıkları.
Cismin sıcaklığını bir Kelvin yükseltmek için verilmesi gereken ısı miktarına bu maddenin ısı kapasitesi denir. Bir Kelvin soğutulduğunda, vücut aynı miktarda ısı verir. Bir cismin ısı kapasitesi, cismin kütlesi ile orantılıdır ve onu oluşturan maddeye bağlıdır. SI birim sisteminde, ısı kapasitesi J/K cinsinden ölçülür.
Bir maddenin termal özelliklerini karakterize etmek için, bu maddenin birim kütlesinin ısı kapasitesi alınır. Bu özelliğe özgül ısı kapasitesi denir. Belirli bir cismin ısı kapasitesinin kütlesine oranına eşittir. SI sistemi ile özgül ısı kapasitesi J / (kg × K) cinsinden ölçülür.
Deneysel olarak, bir metal gövdenin özgül ısısı, bir kalorimetre ve bir termometre kullanılarak belirlenir. En basit kalorimetre, başka bir camın içine tıpalar üzerine yerleştirilmiş (ısı yalıtımı amacıyla) cilalı metal bir camdan oluşur. İç cam, su veya bilinen bir özgül ısı kapasitesi olan başka bir sıvı ile doldurulur. Belirli bir t sıcaklığına kadar ısıtılan bir cisim bir kalorimetreye indirilir. Vücut alçaltılmadan önce kalorimetredeki sıvının sıcaklığı t 1 olsun ve sıvının ve içine indirilen gövdenin termal dengesi kurulduktan sonra toplam sıcaklıkları q'ya eşit olacaktır.
Enerjinin korunumu yasasından şu sonuç çıkar:
Q \u003d Q 1 + Q 2,(2)
ısı miktarı nerede Q, ısıtılmış bir cisim tarafından verilen ısı miktarının toplamına eşittir Q1, su ile elde edilen ve S2, kalorimetre tarafından alınır.
(1)'i dikkate alarak, (2)'yi şu şekilde yeniden yazarız:
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1),(3)
nerede c 1 ve m 1- kalorimetredeki suyun özgül ısı kapasitesi ve kütlesi, c 2 ve m2- kalorimetrenin özgül ısı kapasitesi ve kütlesi. Bu denkleme ısı dengesi denklemi denir. Ondan vücudun özgül ısı kapasitesini buluyoruz:
Bu sorunun çözümüne farklı bir şekilde yaklaşmak mümkündür, bir deney çerçevesindeki enerji kayıplarının aynı olacağını varsayalım. Gövde ile birlikte belirli bir sıcaklığa kadar ısıtılan bilinen özgül ısı kapasitesi t, sıcaklığı değişen bir kalorimetreye indirilir. O zaman ısı dengesi denklemi şu şekli alacaktır:
cm(t-q) = c 1 m 1 (q-t 1) + Q kaybı,(5)
nerede Q kaybı kalorimetre tarafından alınan ısı miktarıdır ve çevre, Sonuç olarak:
Q kaybı, = cm(t-q) - c 1 m 1 (q-t 1). (6)
Aynı sıcaklığa ısıtılan, özgül ısı kapasitesi bilinmeyen bir cisim bir kalorimetreye indirilirse, ısı dengesi denklemi şu şekli alacaktır:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q kayıpları,(7)
nerede m¢ 1 kalorimetredeki su kütlesidir ve t¢ 1- bu deneydeki su sıcaklığı. O zamanlar:
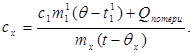 (8)
(8)
(6) değerini (8) ile değiştirerek şunu elde ederiz:
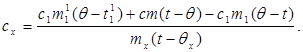 (9)
(9)
temel ısı miktarı nerede; - sıcaklıkta temel bir değişiklik.
Isı kapasitesi, belirli koşullar altında sıcaklığını 1 derece artırmak için sisteme verilmesi gereken ısı miktarına sayısal olarak eşittir. SI'daki ısı birimi joule ve sıcaklık K derecesi olduğundan, ısı kapasitesinin birimi J/K'dir.
Termodinamikte ısının verildiği cismin kantitatif birimine bağlı olarak kütle, hacim ve molar ısı kapasiteleri ayırt edilir.
Kütle ısı kapasitesiçalışma sıvısının birim kütlesi başına ısı kapasitesi,
nerede ve normal fiziksel koşullar altında vücudun hacmi ve yoğunluğudur.
Hacimsel ısı kapasitesi J/(m3K) cinsinden ölçülür.
Molar ısı kapasitesi- ısı kapasitesi, çalışma sıvısının (gaz) mol cinsinden miktarı olarak ifade edilir,
| , |
m3/mol, normal koşullar altında gazın molar hacmidir.
Isı kapasitesinin sabit olmayıp sıcaklığa ve diğer termal parametrelere bağlı olduğu düşünüldüğünde, gerçek ve ortalama ısı kapasitesi arasında bir ayrım yapılır. Genellikle, gerçek ısı kapasitesi, herhangi bir işlemde bir termodinamik sisteme bildirilen temel ısı miktarının, verilen ısının neden olduğu bu sistemin sıcaklığındaki sonsuz küçük bir artışa oranı olarak anlaşılır. Termodinamik sistemin gerçek ısı kapasitesini şuna eşit bir sistem sıcaklığında ve - eşit sıcaklıkta çalışma sıvısının gerçek özgül ısısını dikkate alacağız. Daha sonra çalışma akışkanının sıcaklığı değiştiğinde ortalama özgül ısı kapasitesi olarak belirlenebilir.
Vücudun iç enerjisinin belirlenmesi.
İçsel enerji gövde (olarak anılır) E veya sen) moleküler etkileşimlerin enerjilerinin ve bir molekülün termal hareketlerinin toplamıdır. Özellikle ideal bir gazın iç enerjisi, sürekli ve rasgele termal hareket halindeki tüm gaz parçacıklarının kinetik enerjilerinin toplamına eşittir. Bundan, sayısız deneyle doğrulanan Joule yasası gelir.
Moleküler kinetik teori, molekülleri yalnızca öteleme hareketi gerçekleştiren ideal bir tek atomlu gazın (helyum, neon, vb.) Bir molünün iç enerjisi için aşağıdaki ifadeye yol açar:
Böylece, içsel enerji sen vücut, vücudun durumunu karakterize eden makroskobik parametreler tarafından benzersiz bir şekilde belirlenir. Verilen durumun nasıl gerçekleştiğine bağlı değildir. İç enerjinin bir durum fonksiyonu olduğunu söylemek adettendir.
TD'de mutlak değeri değil, iç enerjideki değişim kullanılır.
Genişletme işi nedir? TD'nin birinci yasası.
Genişleme işi - aracın genişleme sürecinde dış basınç kuvvetlerine karşı gerçekleştirdiği mekanik çalışma. Hacim değiştiğinde gaz iş yapar, V'deki değişimin işareti işin işaretiyle çakışır.
TD'nin birinci yasası: sisteme verilen ısı, iç enerjiyi dönüştürmek ve iş yapmak için kullanılır.
Isı şeklinde enerji alma (veya verme) yeteneği açısından, bir termodinamik sistemi ısı kapasitesi ile karakterize etmek alışılmış bir durumdur.
Bir vücudun (sistemin) ısı kapasitesi, sıcaklığını bir Kelvin değiştirmek için vücuda (sisteme) verilmesi gereken ısı miktarına sayısal olarak eşit olan fiziksel bir niceliktir.
Vücuda sonsuz miktarda ısı verilirse Q sıcaklıkta sonsuz küçük bir artışa neden olan dT, daha sonra ısı kapasitesi İle birlikte tanım gereği eşittir
Isı kapasitesinin SI birimi joule bölü kelvindir ( J/İle).
Deneyler ve teorik hesaplamalar gösteriyor ki Bir cismin ısı kapasitesi onun kimyasal bileşimine, kütlesine ve termodinamik durumuna bağlıdır.(örneğin, sıcaklıkta) ve ayrıca ona ısı verildiğinde vücudun durumunu değiştirme sürecinin türü.
Özgül ısı kapasitesi, bir maddenin birim kütlesi başına ısı kapasitesidir, yani homojen bir madde için
![]() , (25.2)
, (25.2)
nerede ile birlikte- özgül ısı kapasitesi, M maddenin kütlesidir.
SI özgül ısı birimi joule bölü kelvin-kilogramdır [( J/(İle . kilogram)].
Molar ısı kapasitesi, bir maddenin bir molünün ısı kapasitesidir, yani
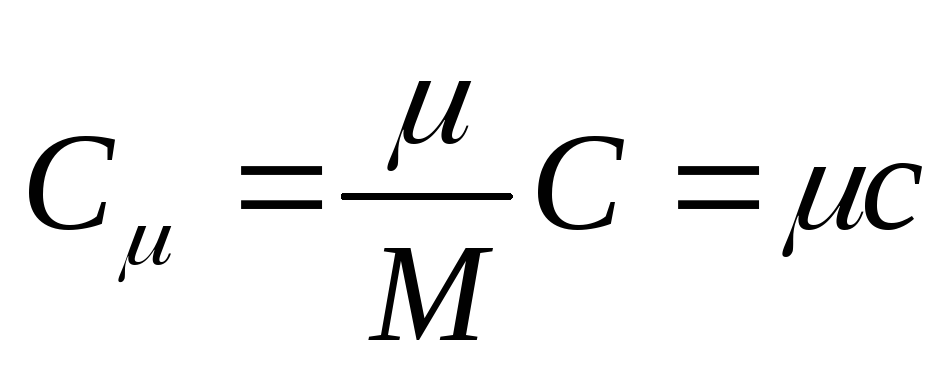 , (25.3)
, (25.3)
nerede İle birlikte - molar ısı kapasitesi; maddenin molar kütlesidir.
SI'daki molar ısı kapasitesinin birimi, joule bölü kelvin-mole [ J/(İle . köstebek)].
Temel ısı miktarı Q, vücut ısısını değiştirmek için gerekli dT, olarak tanımlanır
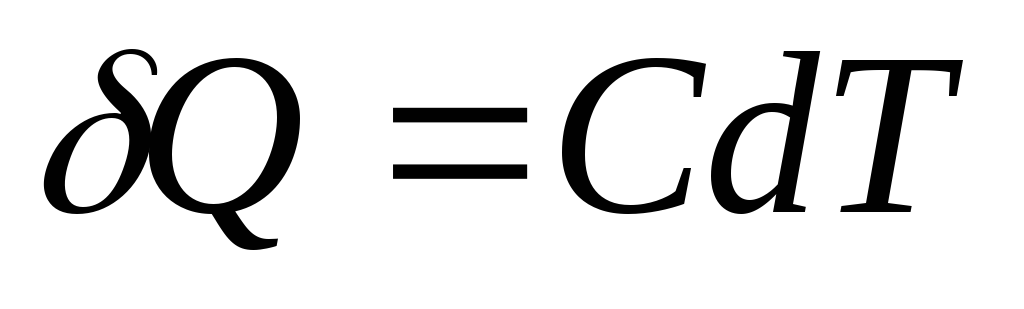 ,
,
ve homojen bir vücut için
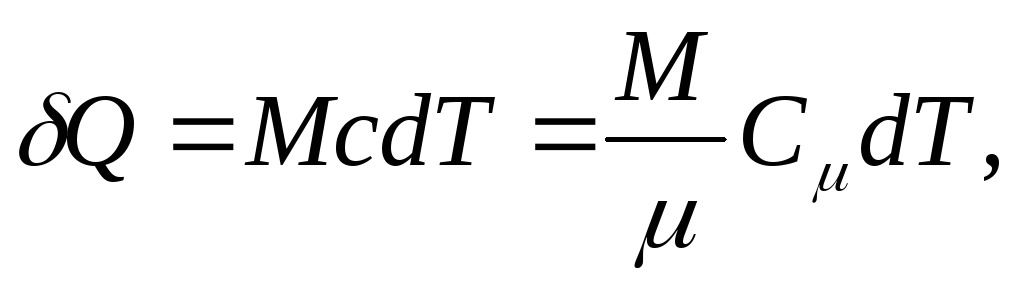 (25.4)
(25.4)
nerede M/ - madde miktarı (mol sayısı).
§26. termodinamiğin birinci yasası
Termodinamiğin birinci yasası (birinci yasa), termodinamik sistemlere uygulandığı şekliyle enerjinin korunumu ve dönüşümü yasasının matematiksel bir ifadesidir. Fizik ve kimya alanındaki deneysel ve teorik araştırmalar sonucunda kurulmuş olup, son aşaması ısı ve iş eşdeğerliğinin keşfi, yani ısının işe ve işin enerjiye dönüştürülmesinin keşfi olmuştur. ısı her zaman aynı kesinlikle sabit niceliksel oranda gerçekleştirilir.
§24'te, bir sistemin iç enerjisinin iki şekilde değiştirilebileceği belirtildi: iş yaparak ve ısıyı aktararak. Bu nedenle şunları yazabiliriz:
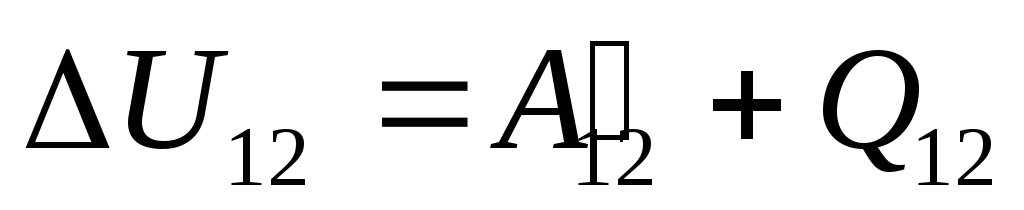 ,
(26.1)
,
(26.1)
nerede
sen 12
-
durumdan geçiş sırasında sistemin iç enerjisindeki değişim 1
bir duruma 2
üzerinde çalışmanın bir sonucu olarak 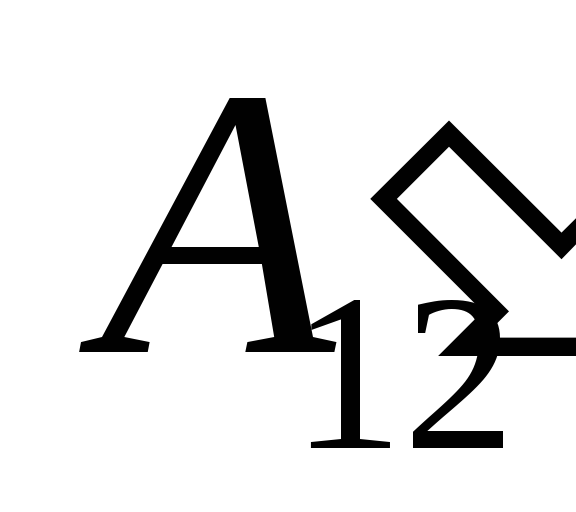 dış cisimlerden ve ona dışarıdan belirli bir miktarda ısı aktarımı
dış cisimlerden ve ona dışarıdan belirli bir miktarda ısı aktarımı  .
.
o işi biliyoruz 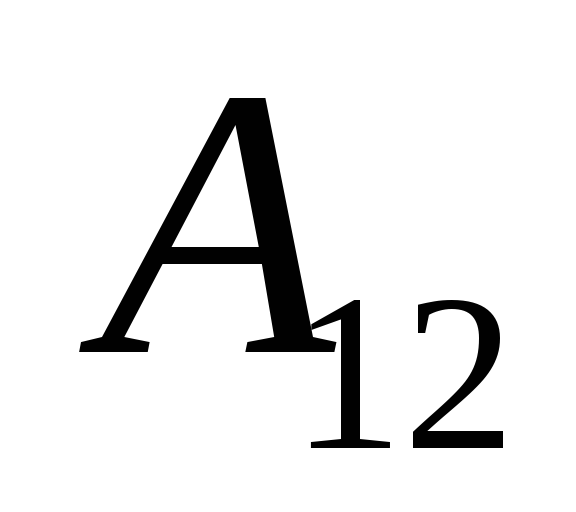 sistemin kendisinin dış cisimler üzerinde yaptığı işe sayısal olarak eşit ve işaret olarak zıttır.
sistemin kendisinin dış cisimler üzerinde yaptığı işe sayısal olarak eşit ve işaret olarak zıttır.  sistemin üzerindeki dış cisimler, yani
sistemin üzerindeki dış cisimler, yani
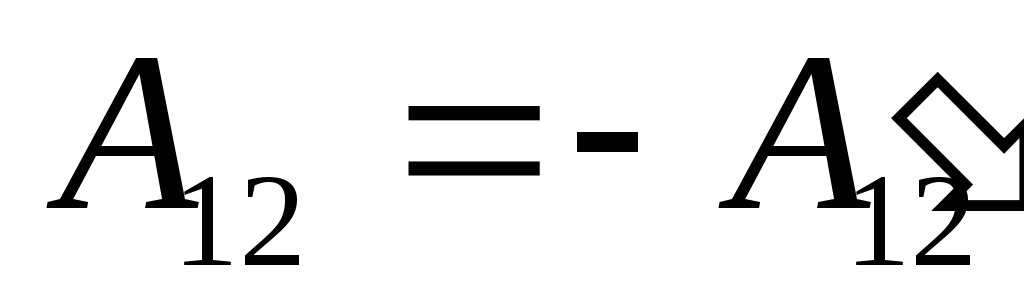 ,
(26.2)
,
(26.2)
bu nedenle ifade (26.1) şu şekilde yeniden yazılabilir:
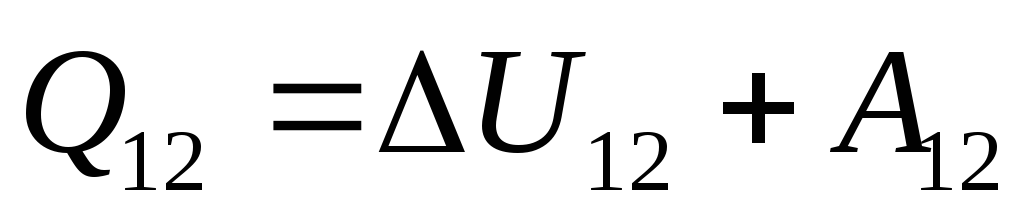 . (26.3)
. (26.3)
Bu denklem, termodinamiğin birinci yasasının matematiksel bir kaydıdır: sisteme iletilen ısı miktarı, sistemin iç enerjisini değiştirmeye ve sistem tarafından dış cisimler üzerinde iş yapmaya harcanır.
Sistemin durumundaki çok küçük bir değişiklikle, denklem (26.3) şu şekli alır:
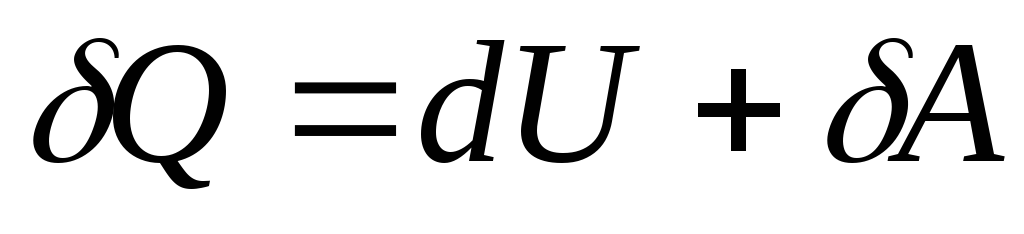 , (26.4)
, (26.4)
nerede 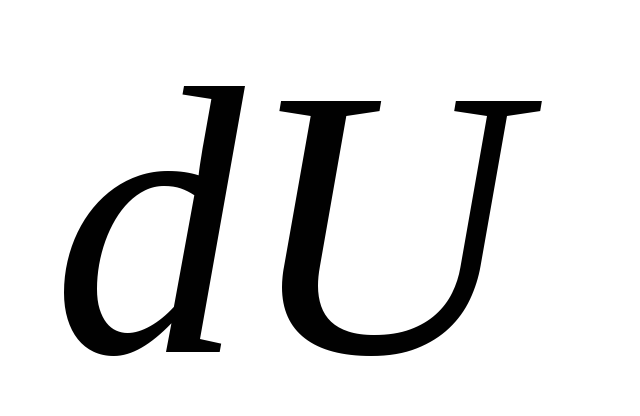 - Sisteme temel miktarda ısı verildiğinde sistemin iç enerjisinde çok küçük bir değişiklik
Q ve sistem tarafından temel işlerin yapılması
VE dış cisimler üzerinde.
- Sisteme temel miktarda ısı verildiğinde sistemin iç enerjisinde çok küçük bir değişiklik
Q ve sistem tarafından temel işlerin yapılması
VE dış cisimler üzerinde.
