ความจุความร้อนวัดในหน่วยใด ความจุความร้อนของก๊าซ ประเภทของความจุความร้อน
ความจุความร้อนของร่างกายคือปริมาณความร้อนที่ต้องส่งให้กับร่างกายที่กำหนดเพื่อเพิ่มอุณหภูมิของร่างกายขึ้นหนึ่งองศา เมื่อเย็นลงหนึ่งองศา ร่างกายจะปล่อยความร้อนในปริมาณเท่ากัน ความจุความร้อนเป็นสัดส่วนกับมวลของร่างกาย ความจุความร้อนของมวลหน่วยของร่างกายเรียกว่าจำเพาะ และผลิตภัณฑ์ของความร้อนจำเพาะโดยมวลอะตอมหรือโมเลกุลเรียกว่าอะตอมหรือโมลาร์ตามลำดับ
ความจุความร้อน สารต่างๆต่างกันมาก ดังนั้น, ความร้อนจำเพาะน้ำที่ 20 ° C คือ 4200 J / kg K, ไม้สน - 1700, อากาศ - 1010 สำหรับโลหะจะน้อยกว่า: อลูมิเนียม - 880 J / kg K, เหล็ก - 460, ทองแดง - 385, ตะกั่ว - 130 ความร้อนจำเพาะ เพิ่มขึ้นเล็กน้อยตามอุณหภูมิ (ที่ 90°C ความจุความร้อนของน้ำคือ 4220 J/kg K) และแปรผันอย่างมากในระหว่างการเปลี่ยนเฟส: ความจุความร้อนของน้ำแข็งที่ 0 °C น้อยกว่าน้ำ 2 เท่า ความจุความร้อนของไอน้ำที่อุณหภูมิ 100°C อยู่ที่ประมาณ 1500 J/kg K
ความจุความร้อนขึ้นอยู่กับสภาวะที่อุณหภูมิของร่างกายเปลี่ยนแปลง หากขนาดของร่างกายไม่เปลี่ยนแปลง ความร้อนทั้งหมดก็จะเปลี่ยนพลังงานภายใน ที่นี่เรากำลังพูดถึงความจุความร้อนที่ปริมาตรคงที่ ที่แรงดันภายนอกคงที่ เนื่องจากการขยายตัวทางความร้อน การทำงานเชิงกลจะดำเนินการกับแรงภายนอก และการทำความร้อนที่อุณหภูมิหนึ่งๆ ต้องใช้ความร้อนมากกว่า ดังนั้นความจุความร้อนที่ความดันคงที่จึงมากกว่า สำหรับ ก๊าซในอุดมคติ(ดูรูป) โดยที่ R คือค่าคงที่ของแก๊ส เท่ากับ 8.32 J / mol K
ปกติวัด. วิถีคลาสสิคการวัดความจุความร้อนมีดังนี้: ร่างกายที่จะวัดความจุความร้อนจะได้รับความร้อนจนถึงอุณหภูมิที่กำหนดและวางไว้ในเครื่องวัดความร้อนด้วยอุณหภูมิเริ่มต้นของ , เติมน้ำหรือของเหลวอื่นที่มีความจุความร้อนที่ทราบและ - ความจุความร้อนของ แคลอรีมิเตอร์และของเหลว)
โดยการวัดอุณหภูมิในแคลอริมิเตอร์หลังจากสร้างสมดุลทางความร้อนแล้ว ความจุความร้อนของร่างกายสามารถคำนวณได้โดยใช้สูตร:
![]()
โดยที่และคือมวลของร่างกาย ของเหลว และแคลอรีมิเตอร์
ทฤษฎีที่พัฒนามากที่สุดคือความจุความร้อนของก๊าซ ที่อุณหภูมิปกติ ความร้อนจะนำไปสู่การเปลี่ยนแปลงพลังงานของการเคลื่อนที่เชิงการแปลและการเคลื่อนที่แบบหมุนของโมเลกุลแก๊ส สำหรับความจุความร้อนโมลาร์ของก๊าซโมโนโทมิก ทฤษฎีนี้ให้ ไดอะตอมมิกและโพลิอะตอมิกและ ที่อุณหภูมิต่ำมาก ความจุความร้อนจะลดลงบ้างเนื่องจากผลกระทบของควอนตัม (ดูรูปที่ กลศาสตร์ควอนตัม). ที่ อุณหภูมิสูงพลังงานสั่นสะเทือนถูกเพิ่มเข้าไป และความจุความร้อนของก๊าซ polyatomic จะเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น
ความจุความร้อนปรมาณูของคริสตัลตามทฤษฎีคลาสสิก เท่ากับ ซึ่งสอดคล้องกับกฎเชิงประจักษ์ของ Dulong และ Petit (ก่อตั้งในปี 1819 โดยนักวิทยาศาสตร์ชาวฝรั่งเศส P. Dulong และ A. Petit) ทฤษฎีควอนตัมความจุความร้อนนำไปสู่ข้อสรุปเดียวกันที่อุณหภูมิสูง แต่คาดการณ์ความจุความร้อนที่ลดลงเมื่ออุณหภูมิลดลง ใกล้ศูนย์สัมบูรณ์ ความจุความร้อนของวัตถุทั้งหมดมีแนวโน้มเป็นศูนย์ (กฎข้อที่สามของอุณหพลศาสตร์)
ความจุความร้อนของร่างกาย- นี่คือ ปริมาณทางกายภาพกำหนดโดยอัตราส่วนของปริมาณความร้อนที่ร่างกายดูดซับเมื่อถูกความร้อนต่อการเปลี่ยนแปลงของอุณหภูมิ:
ความหมายทางกายภาพของความจุความร้อนของร่างกาย: ความจุความร้อนของร่างกายเท่ากับปริมาณความร้อนที่ร่างกายดูดซับเมื่อถูกความร้อนหรือปล่อยออกมาเมื่อเย็นลง 1K
เนื่องจากความจุความร้อนเป็นตัวแปร จึงแยกความแตกต่างระหว่างความจุความร้อนเฉลี่ยและความจุความร้อนจริง ภายใต้ความจุความร้อนเฉลี่ย เข้าใจอัตราส่วนของปริมาณความร้อน q สรุปเป็นหน่วยของปริมาณของสาร (ก๊าซ) จนถึงการเปลี่ยนแปลงของอุณหภูมิจาก t 1 ก่อน t 2 โดยมีเงื่อนไขว่าความแตกต่างของอุณหภูมิ t 2 – t 1 เป็นค่าจำกัด มวล ปริมาตร และความจุความร้อนกรามเฉลี่ย ตามลำดับ แทนด้วย ค ม , ค ม ' และ ม . จากคำจำกัดความของความจุความร้อนเฉลี่ย จะเห็นว่า ถ้าอุณหภูมิของแก๊สสูงขึ้นจาก t 1 ก่อน t 2 จากนั้นความจุความร้อนเฉลี่ย [kJ / (kg * K)]
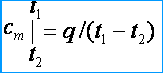
ภายใต้ความจุความร้อนที่แท้จริง ให้เข้าใจความจุความร้อนของก๊าซ ซึ่งสอดคล้องกับการเปลี่ยนแปลงอุณหภูมิก๊าซเพียงเล็กน้อย ซึ่งสอดคล้องกับการเปลี่ยนแปลงอุณหภูมิเพียงเล็กน้อย dt , เช่น.
ค = dq/dt,
ที่ไหน dq=cdt.
ความร้อนจำเพาะคือความสามารถของสารต่าง ๆ ในการดูดซับความร้อนเมื่อถูกความร้อน ความจุความร้อนจำเพาะของสารถูกกำหนดโดยอัตราส่วนของปริมาณความร้อนที่ได้รับเมื่อให้ความร้อนต่อมวลของสารและการเปลี่ยนแปลงของอุณหภูมิหาก: ![]()
ความสัมพันธ์ที่แสดงความสัมพันธ์ระหว่างความจุความร้อนกราม Cp และ CV มีรูปแบบ (สูตรของเมเยอร์): Cp = CV + R. OR MORE EXPANDED ความจุความร้อน ก๊าซในอุดมคติหากเป็นผลมาจากการถ่ายเทความร้อน ความร้อนจำนวนหนึ่งถูกส่งไปยังร่างกาย พลังงานภายในของร่างกายและอุณหภูมิจะเปลี่ยนไป ปริมาณความร้อน Q ที่ต้องการเพื่อให้ความร้อนแก่สาร 1 กิโลกรัมคูณ 1 K เรียกว่าความร้อนจำเพาะของสาร c c = Q / (mΔT). ในหลายกรณี จะสะดวกที่จะใช้ความจุความร้อนโมลาร์ C: C = M c โดยที่ M คือมวลโมลาร์ของสาร ความจุความร้อนที่กำหนดด้วยวิธีนี้ไม่ใช่คุณลักษณะที่ชัดเจนของสาร ตามกฎข้อที่หนึ่งของอุณหพลศาสตร์ การเปลี่ยนแปลงของพลังงานภายในของร่างกายไม่ได้ขึ้นอยู่กับปริมาณความร้อนที่ได้รับเท่านั้น แต่ยังขึ้นกับงานที่ทำโดยร่างกายด้วย ร่างกายสามารถทำงานต่างๆ ได้ ทั้งนี้ขึ้นอยู่กับเงื่อนไขของกระบวนการถ่ายเทความร้อน ดังนั้นปริมาณความร้อนที่ถ่ายเทไปยังร่างกายในปริมาณเท่ากันอาจทำให้เกิดการเปลี่ยนแปลงพลังงานภายในและอุณหภูมิที่แตกต่างกัน ความกำกวมดังกล่าวในการกำหนดความจุความร้อนเป็นเรื่องปกติสำหรับสารที่เป็นก๊าซเท่านั้น เมื่อของเหลวและของแข็งถูกทำให้ร้อน ปริมาตรของพวกมันจะไม่เปลี่ยนแปลง และการทำงานของการขยายตัวจะเท่ากับศูนย์ ดังนั้นปริมาณความร้อนทั้งหมดที่ร่างกายได้รับจะไปเปลี่ยนพลังงานภายใน ต่างจากของเหลวและ ของแข็งก๊าซในกระบวนการถ่ายเทความร้อนสามารถเปลี่ยนปริมาตรและทำงานได้อย่างมาก ดังนั้นความจุความร้อนของสารที่เป็นก๊าซจึงขึ้นอยู่กับธรรมชาติของกระบวนการทางอุณหพลศาสตร์ โดยปกติ จะพิจารณาค่าความจุความร้อนของก๊าซสองค่า: CV คือความจุความร้อนโมลาร์ในกระบวนการไอโซโคริก (V = const) และ Cp คือความจุความร้อนกรามในกระบวนการไอโซบาริก (p = const) ในกระบวนการที่ปริมาตรคงที่ ก๊าซจะไม่ทำงาน: A = 0 จากกฎข้อที่หนึ่งของอุณหพลศาสตร์สำหรับก๊าซ 1 โมลตาม QV = CVΔT = ΔU การเปลี่ยนแปลง ΔU ของพลังงานภายในของก๊าซเป็นสัดส่วนโดยตรงกับการเปลี่ยนแปลง ΔT ของอุณหภูมิ สำหรับกระบวนการที่ความดันคงที่ กฎข้อที่หนึ่งของอุณหพลศาสตร์กำหนด: Qp = ΔU + p(V2 - V1) = CVΔT + pΔV โดยที่ ΔV คือการเปลี่ยนแปลงของปริมาตร 1 โมลของก๊าซในอุดมคติเมื่ออุณหภูมิเปลี่ยนแปลงโดย ΔT จากนี้ไป อัตราส่วน ΔV / ΔT สามารถหาได้จากสมการสถานะของก๊าซในอุดมคติที่เขียนขึ้นสำหรับ 1 โมล: pV = RT โดยที่ R คือค่าคงที่ของแก๊สสากล ที่ p = const ดังนั้น ความสัมพันธ์ที่แสดงความสัมพันธ์ระหว่างความจุความร้อนกราม Cp และ CV มีรูปแบบ (สูตรของ Mayer): Cp = CV + R
ค่าคงที่ของแก๊สมีค่าเท่ากับตัวเลขการขยายตัวของแก๊สอุดมคติ 1 โมลภายใต้แรงดันคงที่เมื่อถูกความร้อน 1 K R = pV/T = 1.01 10 5 22.4 10-3/273[Pa m 3 /mol]/ K =8.31(44) Dzh/ (โมล K)
ค่าคงที่ก๊าซสากลคือค่าคงที่ทางกายภาพพื้นฐานสากล R เท่ากับผลคูณของค่าคงที่โบลต์ซมันน์ k และค่าคงที่อะโวกาโดร
ความหมายทางกายภาพ: ค่าคงที่ของแก๊ส i เป็นตัวเลขเท่ากับการขยายตัวของก๊าซในอุดมคติหนึ่งโมลในกระบวนการไอโซบาริกที่มีอุณหภูมิเพิ่มขึ้น 1 K
ในระบบ CGS ค่าคงที่ของแก๊สคือ:
ค่าคงที่ก๊าซจำเพาะคือ:
เลขชี้กำลังอะเดียแบติก(บางครั้งเรียกว่า ค่าสัมประสิทธิ์ปัวซอง) - อัตราส่วนของความจุความร้อนที่ความดันคงที่ () ต่อความจุความร้อนที่ปริมาตรคงที่ () บางครั้งก็เรียกว่า ปัจจัย ไอเซนโทรปิก นามสกุล. เขียนแทนด้วยอักษรกรีก (แกมมา) หรือ (คัปปา) สัญลักษณ์ตัวอักษรใช้เป็นหลักในสาขาวิชาวิศวกรรมเคมี ในวิศวกรรมความร้อนจะใช้อักษรละติน
ส่วนผสมของก๊าซ เป็นการรวมตัวของก๊าซที่ไม่เหมือนกันหลายตัวซึ่งภายใต้สภาวะที่พิจารณาแล้ว จะไม่เกิดปฏิกิริยาเคมีระหว่างกัน
ส่วนผสมของก๊าซเป็นระบบเทอร์โมไดนามิกที่เป็นเนื้อเดียวกัน (ภายในซึ่งไม่มีส่วนต่อประสานที่แยกส่วนมหภาคของระบบออกจากกัน ซึ่งแตกต่างกันในคุณสมบัติและองค์ประกอบ)
ความดันบางส่วน Pi ของก๊าซที่ i-th ในของผสมคือความดันที่ก๊าซนี้จะเป็นถ้าก๊าซอื่นทั้งหมดถูกกำจัดออกจากส่วนผสม และ V และ T ยังคงเหมือนเดิม
กฎของดาลตัน - ความดันของส่วนผสมของก๊าซที่ไม่มีปฏิกิริยาทางเคมีเท่ากับผลรวมของแรงดันบางส่วนของก๊าซเหล่านี้
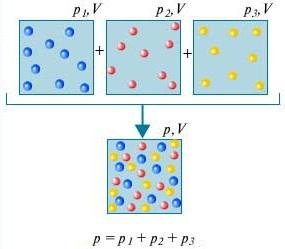
เพื่อให้เข้าใจว่าคืออะไร กฎของดัลตัน, พิจารณาสิ่งนี้อากาศในห้อง. เป็นส่วนผสมของก๊าซหลายชนิด ได้แก่ ไนโตรเจน (80%) ออกซิเจน (20%) ความดันบางส่วนของก๊าซแต่ละชนิดคือความดันที่ก๊าซจะมีหากก๊าซนั้นครอบครองปริมาตรทั้งหมดเพียงลำพัง ตัวอย่างเช่น ถ้าก๊าซทั้งหมดยกเว้นไนโตรเจนถูกกำจัดออกจากห้อง ความดันของสิ่งที่เหลืออยู่ก็คือความดันบางส่วนของไนโตรเจน กฎของดาลตันระบุว่าความดันรวมของก๊าซทั้งหมดที่นำมารวมกันนั้นเท่ากับผลรวมของแรงดันบางส่วนของก๊าซแต่ละชนิดแยกกัน (พูดอย่างเคร่งครัด กฎหมายใช้เฉพาะกับก๊าซในอุดมคติเท่านั้น แต่สำหรับการประมาณที่ดีพอ กฎหมายนี้ใช้อธิบายก๊าซจริงด้วย)
กฎข้อที่หนึ่งของอุณหพลศาสตร์ เป็นลักษณะทั่วไปของกฎการอนุรักษ์และการเปลี่ยนแปลงพลังงานสำหรับระบบอุณหพลศาสตร์ เป็นสูตรดังนี้
เปลี่ยน Δยู พลังงานภายในของระบบอุณหพลศาสตร์ที่ไม่แยกตัวเท่ากับความแตกต่างระหว่างปริมาณความร้อนQ โอนเข้าระบบและทำงานอา เป็นระบบที่สมบูรณ์แบบเหนือร่างกายภายนอก
|
ความสัมพันธ์ที่แสดงกฎข้อที่หนึ่งของอุณหพลศาสตร์มักเขียนในรูปแบบที่แตกต่างกัน:
|
ปริมาณความร้อนที่ระบบได้รับใช้เพื่อเปลี่ยนพลังงานภายในและทำงานบนร่างกายภายนอก
กฎข้อที่หนึ่งของอุณหพลศาสตร์เป็นการสรุปข้อเท็จจริงจากการทดลอง ตามกฎหมายนี้ พลังงานไม่สามารถสร้างหรือทำลายได้ มันถูกถ่ายโอนจากระบบหนึ่งไปยังอีกระบบหนึ่งและเปลี่ยนจากรูปแบบหนึ่งไปเป็นอีกระบบหนึ่ง ผลที่ตามมาที่สำคัญของกฎข้อที่หนึ่งของอุณหพลศาสตร์คือการยืนยันว่าเป็นไปไม่ได้ที่จะสร้างเครื่องจักรที่สามารถทำงานที่มีประโยชน์ได้โดยไม่ต้องใช้พลังงานจากภายนอกและไม่มีการเปลี่ยนแปลงภายในตัวเครื่อง เครื่องสมมุติดังกล่าวเรียกว่า เครื่องเคลื่อนที่ถาวร (perpetuum mobile) ชนิดแรก . ความพยายามหลายครั้งในการสร้างเครื่องดังกล่าวสิ้นสุดลงด้วยความล้มเหลวอย่างสม่ำเสมอ เครื่องไหนก็ทำงานบวกได้ อาเหนือร่างกายภายนอกโดยได้รับความร้อนจำนวนหนึ่งเท่านั้น Qจากวัตถุรอบข้างหรือลดลงใน Δ ยูพลังงานภายในของมัน
ให้เราใช้กฎข้อที่หนึ่งของอุณหพลศาสตร์กับกระบวนการไอโซโพรเซสในก๊าซ
ด้วยการขยายตัวไอโซบาริก Q> 0 - ความร้อนถูกดูดซับโดยแก๊ส และแก๊สก็ทำงานเป็นบวก ด้วยการบีบอัดไอโซบาริก Q < 0 – тепло отдается внешним телам. В этом случае อา < 0. Температура газа при изобарном сжатии уменьшается, ตู่ 2 < ตู่หนึ่ง ; พลังงานภายในลดลง Δ ยู < 0.
ที่ กระบวนการไอโซเทอร์มอลอุณหภูมิของแก๊สไม่เปลี่ยนแปลง ดังนั้น พลังงานภายในของแก๊ส Δ ยู = 0.
ที่ กระบวนการ isochoric (วี= const) แก๊สไม่ทำงาน อา= 0. ดังนั้น
กฎข้อที่หนึ่งของอุณหพลศาสตร์สำหรับกระบวนการไอโซบาริกให้:
|
กฎข้อที่หนึ่งของอุณหพลศาสตร์สำหรับกระบวนการไอโซเทอร์มอลแสดงโดยความสัมพันธ์
|
ปริมาณความร้อน Qที่ได้จากก๊าซในกระบวนการขยายตัวด้วยอุณหภูมิความร้อน กลายเป็นงานกับวัตถุภายนอก ภายใต้การบีบอัดด้วยอุณหภูมิความร้อน การทำงานของแรงภายนอกที่เกิดจากแก๊สจะถูกแปลงเป็นความร้อน ซึ่งจะถูกถ่ายเทไปยังวัตถุโดยรอบ
นอกเหนือจากกระบวนการไอโซโคริก ไอโซบาริก และไอโซเทอร์มอล เทอร์โมไดนามิกส์มักพิจารณากระบวนการที่เกิดขึ้นในกรณีที่ไม่มีการแลกเปลี่ยนความร้อนกับวัตถุโดยรอบ เรือที่มีผนังฉนวนเรียกว่า เปลือกหอยอะเดียแบติกและกระบวนการขยายหรืออัดก๊าซในภาชนะดังกล่าวเรียกว่า อะเดียแบติก.
ที่ กระบวนการอะเดียแบติกQ= 0; ดังนั้นกฎข้อที่หนึ่งของอุณหพลศาสตร์จึงอยู่ในรูป
|
|
|
ในความหมายทางกายภาพ กฎข้อที่หนึ่งของอุณหพลศาสตร์คือกฎการอนุรักษ์ (การเปลี่ยนแปลง) ของพลังงานในอุณหพลศาสตร์ ถ้าตามกฎของการเปลี่ยนแปลงพลังงานในกลศาสตร์ การทำงานของแรงที่ไม่อนุรักษ์นิยมเท่ากับการเพิ่มขึ้นของพลังงานกลของระบบ (โดยเฉพาะ แรงเสียดสีที่มีเครื่องหมายลบเท่ากับการลดลงใน พลังงานกลของระบบ) ตามกฎข้อที่หนึ่งของอุณหพลศาสตร์ การเพิ่มขึ้นของพลังงานภายในของระบบเทอร์โมไดนามิกเท่ากับผลรวมของงานของแรงภายนอก สมบูรณ์เหนือระบบ และพลังงานที่ถ่ายโอนไปยัง ระบบโดยการถ่ายเทความร้อน เอนทัลปี(จากภาษากรีก. เอนทัลโป- ร้อนขึ้น) คือ คุณสมบัติของสสารแสดงถึงปริมาณพลังงานที่สามารถเปลี่ยนเป็นความร้อนได้ เอนทัลปีเป็นคุณสมบัติทางอุณหพลศาสตร์ของสารที่ระบุระดับพลังงานที่เก็บไว้ในโครงสร้างโมเลกุล ซึ่งหมายความว่าแม้ว่าสสารจะมีพลังงานตามอุณหภูมิและความดัน แต่ก็ไม่สามารถเปลี่ยนเป็นความร้อนได้ทั้งหมด ส่วนหนึ่งของพลังงานภายในยังคงอยู่ในสสารและคงโครงสร้างโมเลกุลไว้ พลังงานจลน์ของสารบางส่วนไม่สามารถใช้ได้เมื่ออุณหภูมิเข้าใกล้อุณหภูมิแวดล้อม เพราะเหตุนี้, เอนทัลปีคือปริมาณพลังงานที่สามารถเปลี่ยนเป็นความร้อนที่อุณหภูมิและความดันที่กำหนด หน่วยของเอนทาลปีคือ BTU หรือ Joule สำหรับพลังงานและ Btu/lbm หรือ J/kg สำหรับพลังงานจำเพาะ 11 คำถาม |

วัตถุประสงค์:การหาค่าความจุความร้อนของวัสดุแบบทดลอง
อุปกรณ์:ตาชั่ง, น้ำหนัก, แคลอรีมิเตอร์, กระบอกโลหะที่มีความจุความร้อนที่ทราบ, บีกเกอร์, เครื่องทำความร้อน, ตะขอ
ทฤษฎีโดยย่อ:
วัตถุและระบบขนาดมหภาคทั้งหมดของร่างกาย นอกเหนือจากพลังงานกลอันเนื่องมาจากการเคลื่อนไหวและปฏิสัมพันธ์แล้ว ยังมีพลังงานที่ขึ้นอยู่กับสถานะภายในของพวกมัน พลังงานนี้ซึ่งเป็นพลังงานของการเคลื่อนไหวและปฏิสัมพันธ์ระหว่างอนุภาคทั้งหมดที่ประกอบขึ้นเป็นร่างกายเรียกว่าภายใน
พลังงานภายในประกอบด้วยพลังงานจลน์ของการเคลื่อนที่เชิงความร้อนของโมเลกุลและอะตอมที่ประกอบเป็นร่างกายที่กำหนด พลังงานจลน์ของอิเล็กตรอนที่เคลื่อนที่ในอะตอมรอบนิวเคลียส พลังงานศักย์ของปฏิกิริยาระหว่างโมเลกุล อะตอม อิเล็กตรอนและนิวเคลียส นิวเคลียสในนิวเคลียส ฯลฯ แนวคิดเรื่องพลังงานภายในไม่รวมถึงพลังงานจลน์และพลังงานศักย์ของร่างกายที่กำหนดโดยรวม
พลังงานภายในถูกกำหนดโดยชุดของพารามิเตอร์ที่แสดงถึงสถานะของระบบที่กำหนดอย่างเฉพาะเจาะจง กล่าวคือ เป็นฟังก์ชันค่าเดียวของสถานะของระบบนี้
พลังงานภายในมักเขียนแทนด้วยตัวอักษร U
ในปรากฏการณ์ทางความร้อนที่เกิดขึ้นที่อุณหภูมิห่างไกลจากอุณหภูมิของการเปลี่ยนเฟส การเปลี่ยนแปลงใน DU ของพลังงานภายในจะสัมพันธ์กับการเปลี่ยนแปลงในพลังงานจลน์และพลังงานศักย์ของโมเลกุล ในขณะที่ส่วนประกอบที่เหลือของพลังงานภายในจะไม่เปลี่ยนแปลง ดังนั้น ในกระบวนการดังกล่าว เราสามารถสรุปได้ว่าพลังงานภายในร่างกายเท่ากับผลรวมของพลังงานจลน์ของการเคลื่อนที่เชิงความร้อนที่วุ่นวายของโมเลกุลทั้งหมดที่สัมพันธ์กับจุดศูนย์กลางมวลของวัตถุนี้และพลังงานศักย์ของการปฏิสัมพันธ์ของทั้งหมด โมเลกุลซึ่งกันและกัน
เมื่อสภาวะของร่างกายเปลี่ยนไป พลังงานภายในก็เปลี่ยนไป ตัวอย่างเช่น เมื่ออุณหภูมิของร่างกายสูงขึ้น พลังงานภายในจะเพิ่มขึ้น เนื่องจากพลังงานจลน์เฉลี่ยของการเคลื่อนที่ของโมเลกุลของร่างกายนี้เพิ่มขึ้น เมื่ออุณหภูมิลดลง พลังงานภายในร่างกายจะลดลง
พลังงานภายในร่างกายสามารถเปลี่ยนแปลงได้ วิธีทางที่แตกต่าง. ตัวอย่างเช่น พลังงานภายในเปลี่ยนแปลงเมื่องานทางกลกระทำโดยแรงภายนอกบนร่างกายที่กำหนดในระหว่างการเสียรูป และเมื่อร่างกายสัมผัสกับอีกวัตถุหนึ่ง (หรือตัวกลาง) ที่มีอุณหภูมิสูงหรือต่ำกว่า ร่างกายที่กำหนด
กระบวนการเปลี่ยนพลังงานภายในของร่างกายโดยไม่ทำงานทางกลเรียกว่าการถ่ายเทความร้อนหรือการถ่ายเทความร้อน การถ่ายเทความร้อนมีสามประเภท: การพาความร้อนการนำและการแผ่รังสี
ในระหว่างการแลกเปลี่ยนความร้อนจะไม่มีการแปลงพลังงานจากประเภทหนึ่งไปเป็นอีกประเภทหนึ่ง กระบวนการถ่ายเทความร้อนประกอบด้วยความจริงที่ว่าส่วนหนึ่งของพลังงานภายในจากร่างกายที่ร้อนกว่าถูกถ่ายโอนไปยังร่างกายที่ร้อนน้อยกว่า (หรือปานกลาง)
เพื่ออธิบายลักษณะกระบวนการถ่ายเทความร้อน แนวคิดของปริมาณความร้อนถูกนำมาใช้ซึ่งเรียกว่าปริมาณที่เป็นการวัดเชิงปริมาณของการเปลี่ยนแปลงพลังงานภายในของร่างกายในกระบวนการถ่ายเทความร้อน
ต้องจำไว้ว่าร่างกายสามารถให้หรือรับพลังงานเท่านั้น และปริมาณความร้อน Q เป็นเพียงตัวเลขที่เทียบเท่าพลังงานที่ร่างกายให้หรือรับในกระบวนการถ่ายเทความร้อน
ปริมาณความร้อนขึ้นอยู่กับประเภทของกระบวนการและไม่ใช่หน้าที่ของสถานะของระบบ
ปริมาณความร้อนที่ต้องการเพื่อให้ความร้อนแก่ร่างกายที่เกิดขึ้นโดยไม่มีการเปลี่ยนแปลงเฟส (โดยไม่เปลี่ยนสถานะของการรวมตัวของสาร):
โดยที่ c คือความจุความร้อนจำเพาะของร่างกาย กำหนดโดยอัตราส่วนของปริมาณความร้อนที่ถ่ายเทไปยังมวล m ของร่างกาย และการเปลี่ยนแปลงอุณหภูมิที่เกิดขึ้น DT, m คือมวลกาย DT คือความแตกต่างระหว่างอุณหภูมิสุดท้าย และอุณหภูมิเริ่มต้นของร่างกายที่กำหนด
ปริมาณความร้อนที่ต้องให้ร่างกายเพื่อเพิ่มอุณหภูมิหนึ่งเคลวินเรียกว่าความจุความร้อนของสารนี้ เมื่อเย็นลงหนึ่งเคลวิน ร่างกายจะปล่อยความร้อนออกมาในปริมาณเท่ากัน ความจุความร้อนของร่างกายเป็นสัดส่วนกับมวลของร่างกายและขึ้นอยู่กับสารที่ประกอบเป็นองค์ประกอบ ในระบบ SI ของหน่วย ความจุความร้อนมีหน่วยวัดเป็น J/K
ในการจำแนกคุณสมบัติทางความร้อนของสาร จะใช้ความจุความร้อนของมวลต่อหน่วยของสารนี้ ลักษณะนี้เรียกว่าความจุความร้อนจำเพาะ เท่ากับอัตราส่วนของความจุความร้อนของวัตถุที่กำหนดต่อมวลของมัน ความจุความร้อนจำเพาะของระบบ SI วัดเป็น J / (กก. × K)
ในการทดลอง ความร้อนจำเพาะของตัวโลหะจะถูกกำหนดโดยใช้เครื่องวัดความร้อนและเทอร์โมมิเตอร์ แคลอรีมิเตอร์ที่ง่ายที่สุดประกอบด้วยแก้วโลหะขัดเงาที่วางอยู่ภายในแก้วอีกอันบนสต็อปเปอร์ (เพื่อใช้เป็นฉนวนกันความร้อน) กระจกด้านในเต็มไปด้วยน้ำหรือของเหลวอื่นที่มีความจุความร้อนจำเพาะที่ทราบ ร่างกายที่ถูกทำให้ร้อนจนถึงอุณหภูมิที่กำหนด t จะถูกลดระดับลงในแคลอรีมิเตอร์ ปล่อยให้อุณหภูมิของของเหลวในแคลอรีมิเตอร์เป็น t 1 ก่อนที่ร่างกายจะลดระดับลง และหลังจากสมดุลทางความร้อนของของเหลวและร่างกายลดระดับลงในอุณหภูมิแล้ว อุณหภูมิรวมจะเท่ากับ q
จากกฎการอนุรักษ์พลังงาน ดังนี้
Q \u003d Q 1 + Q 2,(2)
ปริมาณความร้อนอยู่ที่ไหน Qให้โดยร่างกายร้อน เท่ากับผลรวมของปริมาณความร้อน ไตรมาสที่ 1ที่ได้จากน้ำและ ไตรมาสที่ 2ได้รับโดยเครื่องวัดความร้อน
เมื่อพิจารณา (1) เราเขียน (2) ใหม่เป็น:
cm (t-q) \u003d c 1 m 1 (q-t 1) + c 2 m 2 (q-t 1)(3)
ที่ไหน ค 1และ ม.1- ความจุความร้อนจำเพาะและมวลของน้ำในเครื่องวัดความร้อน ค2และ m2- ความจุความร้อนจำเพาะและมวลของแคลอรีมิเตอร์ สมการนี้เรียกว่าสมการสมดุลความร้อน จากนั้นเราจะพบความจุความร้อนจำเพาะของร่างกาย:
เป็นไปได้ที่จะแก้ปัญหานี้ด้วยวิธีอื่น สมมติว่าการสูญเสียพลังงานในกรอบของการทดลองหนึ่งจะเหมือนกัน ร่างกาย กับความจุความร้อนจำเพาะที่รู้จัก ถูกทำให้ร้อนจนถึงอุณหภูมิที่กำหนด t, ลดลงเป็นแคลอรีมิเตอร์, อุณหภูมิที่เปลี่ยนแปลง. จากนั้นสมการสมดุลความร้อนจะอยู่ในรูปแบบ:
cm(t-q) = c 1 m 1 (q-t 1) + Q สูญเสีย(5)
ที่ไหน การสูญเสียคิวคือ ปริมาณความร้อนที่แคลอรีมิเตอร์ได้รับ และ สิ่งแวดล้อม, เพราะเหตุนี้:
การสูญเสีย Q = cm(t-q) - c 1 m 1 (q-t 1) (6)
หากร่างกายที่มีความจุความร้อนจำเพาะที่ไม่รู้จักซึ่งถูกทำให้ร้อนที่อุณหภูมิเท่ากัน ถูกลดระดับลงในแคลอริมิเตอร์ สมการสมดุลความร้อนจะอยู่ในรูปแบบ:
c x m x (t-q x) = c 1 m¢ 1 (q - t¢ 1) + Q การสูญเสีย(7)
ที่ไหน m¢ 1คือ มวลของน้ำในแคลอรีมิเตอร์ และ t¢ 1- อุณหภูมิของน้ำในการทดลองนี้ แล้ว:
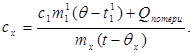 (8)
(8)
แทนค่า (6) เป็น (8) เราได้รับ:
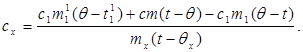 (9)
(9)
ปริมาณความร้อนเบื้องต้นอยู่ที่ไหน - การเปลี่ยนแปลงอุณหภูมิเบื้องต้น
ความจุความร้อนเป็นตัวเลขเท่ากับปริมาณความร้อนที่ต้องจ่ายให้กับระบบเพื่อเพิ่มอุณหภูมิขึ้น 1 องศาภายใต้สภาวะที่กำหนด เนื่องจากหน่วยความร้อนใน SI คือจูล และอุณหภูมิคือองศา K หน่วยของความจุความร้อนคือ J/K
ขึ้นอยู่กับหน่วยเชิงปริมาณของร่างกายที่มีการจ่ายความร้อนในอุณหพลศาสตร์ ความจุของมวล ปริมาตร และความร้อนกรามจะแตกต่างกัน
ความจุความร้อนมวลคือความจุความร้อนต่อหน่วยมวลของของไหลทำงาน
โดยที่และคือปริมาตรและความหนาแน่นของร่างกายภายใต้สภาพร่างกายปกติ
ความจุความร้อนเชิงปริมาตรมีหน่วยวัดเป็น J/(m3 K)
ความจุความร้อนกราม- ความจุความร้อนหมายถึงปริมาณของของไหลทำงาน (แก๊ส) ในโมล
| , |
โดยที่ m3/mol คือปริมาตรของก๊าซในสภาวะปกติ
เมื่อพิจารณาว่าความจุความร้อนไม่คงที่ แต่ขึ้นอยู่กับอุณหภูมิและพารามิเตอร์ทางความร้อนอื่นๆ ความแตกต่างระหว่างความจุความร้อนจริงกับความจุความร้อนเฉลี่ย โดยปกติ ความจุความร้อนที่แท้จริงจะเข้าใจว่าเป็นอัตราส่วนของปริมาณความร้อนเบื้องต้นที่รายงานไปยังระบบอุณหพลศาสตร์ในกระบวนการใดๆ ต่อการเพิ่มขึ้นของอุณหภูมิของระบบนี้เพียงเล็กน้อยอย่างไม่สิ้นสุด ซึ่งเกิดจากความร้อนที่ส่งต่อ เราจะพิจารณาความจุความร้อนที่แท้จริงของระบบเทอร์โมไดนามิกที่อุณหภูมิระบบเท่ากับ และ - จริง ความจุความร้อนจำเพาะของเหลวทำงานที่อุณหภูมิเท่ากับ . จากนั้น ความจุความร้อนจำเพาะเฉลี่ยของของไหลทำงานเมื่ออุณหภูมิเปลี่ยนจากเป็นเป็นสามารถหาได้เป็น
การกำหนดพลังงานภายในร่างกาย
กำลังภายในร่างกาย (เรียกว่า อีหรือ ยู) คือผลรวมของพลังงานของปฏิกิริยาระหว่างโมเลกุลและการเคลื่อนที่เชิงความร้อนของโมเลกุล โดยเฉพาะอย่างยิ่ง พลังงานภายในของก๊าซในอุดมคติจะเท่ากับผลรวมของพลังงานจลน์ของอนุภาคก๊าซทั้งหมดในการเคลื่อนที่ด้วยความร้อนแบบสุ่มและต่อเนื่อง จากนี้ไปเป็นไปตามกฎของจูล ซึ่งได้รับการยืนยันจากการทดลองหลายครั้ง
ทฤษฎีจลนพลศาสตร์ของโมเลกุลนำไปสู่การแสดงออกต่อไปนี้สำหรับพลังงานภายในของหนึ่งโมลของก๊าซโมโนโทมิกในอุดมคติ (ฮีเลียม นีออน ฯลฯ) ซึ่งโมเลกุลทำการเคลื่อนที่เชิงแปลเท่านั้น:
ทางนี้, กำลังภายใน ยูร่างกายถูกกำหนดโดยพารามิเตอร์มหภาคที่แสดงถึงสถานะของร่างกายโดยเฉพาะ. มันไม่ได้ขึ้นอยู่กับว่าสถานะที่กำหนดนั้นรับรู้ได้อย่างไร เป็นเรื่องปกติที่จะบอกว่าพลังงานภายในเป็นหน้าที่ของรัฐ
ใน TD การเปลี่ยนแปลงของพลังงานภายในถูกใช้ ไม่ใช่ค่าสัมบูรณ์
งานขยายคืออะไร. กฎข้อที่หนึ่งของ TD
งานขยาย - งานทางกลที่ดำเนินการโดยยานพาหนะกับแรงกดภายนอกในกระบวนการขยายตัว เมื่อปริมาตรเปลี่ยนแปลง แก๊สจะทำงาน สัญญาณของการเปลี่ยนแปลงใน V ตรงกับสัญลักษณ์ของงาน
กฎข้อที่หนึ่งของ TD: ความร้อนที่ส่งไปยังระบบใช้เพื่อแปลงพลังงานภายในและทำงาน
จากมุมมองของความสามารถในการรับ (หรือให้) พลังงานในรูปของความร้อน เป็นเรื่องปกติที่จะกำหนดคุณลักษณะของระบบทางอุณหพลศาสตร์ด้วยความจุความร้อน
ความจุความร้อนของร่างกาย (ระบบ) คือปริมาณทางกายภาพที่เป็นตัวเลขเท่ากับปริมาณความร้อนที่ต้องส่งให้กับร่างกาย (ระบบ) เพื่อเปลี่ยนอุณหภูมิหนึ่งเคลวิน
หากร่างกายได้รับความร้อนเพียงเล็กน้อย Qซึ่งทำให้อุณหภูมิเพิ่มขึ้นเล็กน้อย dทีแล้วความจุความร้อน จากโดยนิยามเท่ากับ
หน่วย SI ของความจุความร้อนคือจูลหารด้วยเคลวิน ( เจ/ถึง).
การทดลองและการคำนวณทางทฤษฎีแสดงให้เห็นว่า ความจุความร้อนของร่างกายขึ้นอยู่กับองค์ประกอบทางเคมี มวล และสถานะทางอุณหพลศาสตร์(ตัวอย่างเช่น เกี่ยวกับอุณหภูมิ) เช่นเดียวกับประเภทของกระบวนการเปลี่ยนสถานะของร่างกายเมื่อมีการให้ความร้อน
ความจุความร้อนจำเพาะคือความจุความร้อนต่อหน่วยมวลของสารนั่นคือสำหรับสารที่เป็นเนื้อเดียวกัน
![]() , (25.2)
, (25.2)
ที่ไหน กับ- ความจุความร้อนจำเพาะ เอ็มคือมวลของสาร
หน่วย SI ของความร้อนจำเพาะคือจูลหารด้วยเคลวิน-กิโลกรัม [( เจ/(ถึง . กิโลกรัม)].
ความจุความร้อนโมลาร์ คือ ความจุความร้อนของสารหนึ่งโมลนั่นคือ
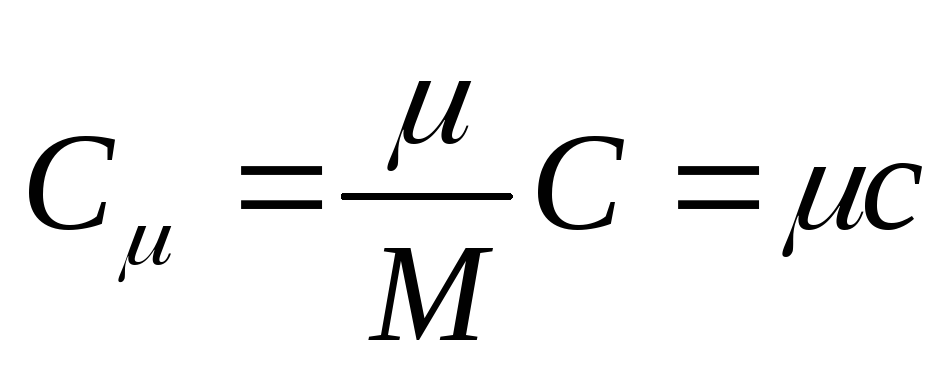 , (25.3)
, (25.3)
ที่ไหน จาก - ความจุความร้อนกราม; คือมวลโมลาร์ของสาร
หน่วยความจุความร้อนโมลาร์ใน SI คือจูลหารด้วยเคลวินโมล [ เจ/(ถึง . ตุ่น)].
ปริมาณความร้อนเบื้องต้น Q, จำเป็นต้องเปลี่ยนอุณหภูมิร่างกาย dตู่, ถูกกำหนดเป็น
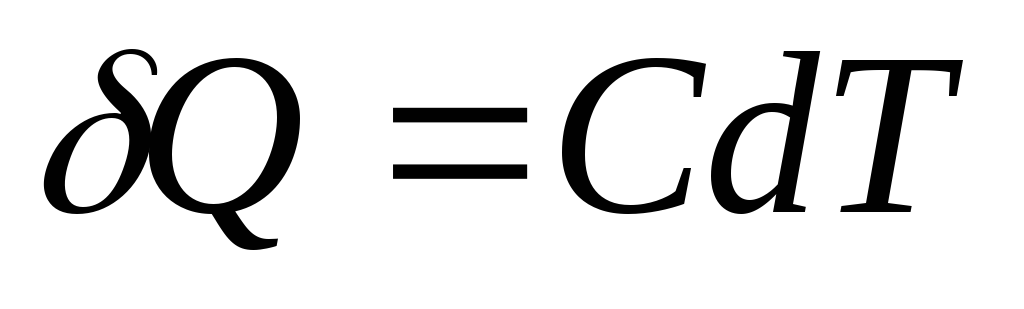 ,
,
และเพื่อความเป็นเนื้อเดียวกัน
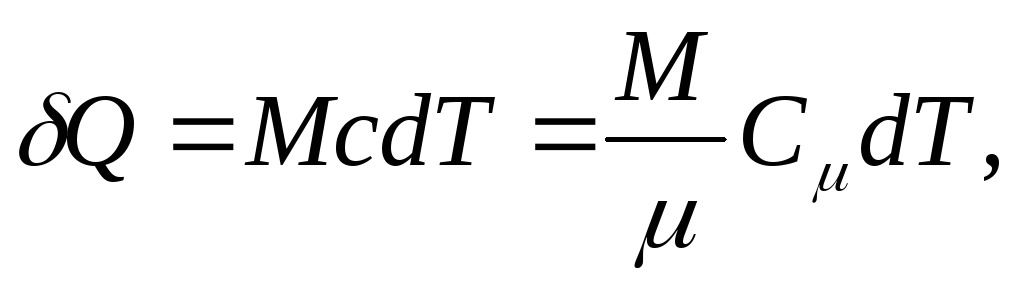 (25.4)
(25.4)
ที่ไหน เอ็ม/ - ปริมาณสาร (จำนวนโมล)
§26. กฎข้อที่หนึ่งของอุณหพลศาสตร์
กฎข้อที่หนึ่ง (กฎข้อที่หนึ่ง) ของอุณหพลศาสตร์คือการแสดงออกทางคณิตศาสตร์ของกฎการอนุรักษ์และการเปลี่ยนแปลงพลังงานที่นำไปใช้กับระบบอุณหพลศาสตร์ ก่อตั้งขึ้นจากผลการวิจัยเชิงทดลองและทฤษฎีในสาขาฟิสิกส์และเคมี ขั้นตอนสุดท้ายคือการค้นพบความเท่าเทียมกันของความร้อนและงาน นั่นคือ การค้นพบว่าการเปลี่ยนความร้อนเป็นงานและทำงานเป็น ความร้อนจะถูกดำเนินการในอัตราส่วนเชิงปริมาณคงที่อย่างเคร่งครัดเสมอ
ใน §24 สังเกตว่าพลังงานภายในของระบบสามารถเปลี่ยนแปลงได้สองวิธี: โดยการทำงานและการถ่ายเทความร้อน ดังนั้น เราสามารถเขียนได้ว่า
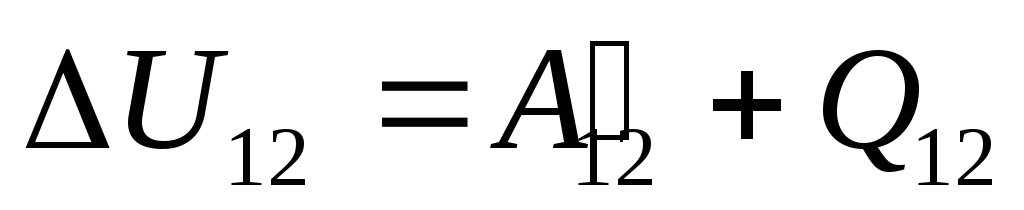 ,
(26.1)
,
(26.1)
ที่ไหน
ยู 12
-
การเปลี่ยนแปลงพลังงานภายในของระบบระหว่างการเปลี่ยนจากสถานะ 1
เข้าสู่สถานะ 2
อันเป็นผลมาจากการทำงานกับมัน 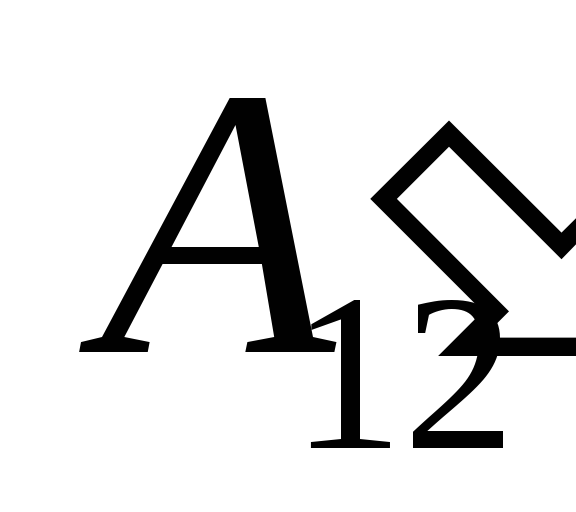 จากร่างกายภายนอกและถ่ายเทความร้อนจากภายนอกไปยังภายนอก
จากร่างกายภายนอกและถ่ายเทความร้อนจากภายนอกไปยังภายนอก  .
.
เรารู้ว่าการทำงาน 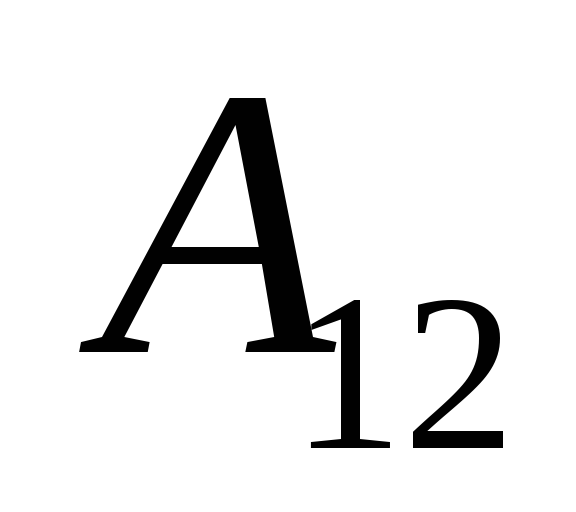 ที่ดำเนินการโดยระบบเองบนวัตถุภายนอกนั้นมีค่าเท่ากับตัวเลขและตรงข้ามกับเครื่องหมายของงาน
ที่ดำเนินการโดยระบบเองบนวัตถุภายนอกนั้นมีค่าเท่ากับตัวเลขและตรงข้ามกับเครื่องหมายของงาน  วัตถุภายนอกเหนือระบบ นั่นคือ
วัตถุภายนอกเหนือระบบ นั่นคือ
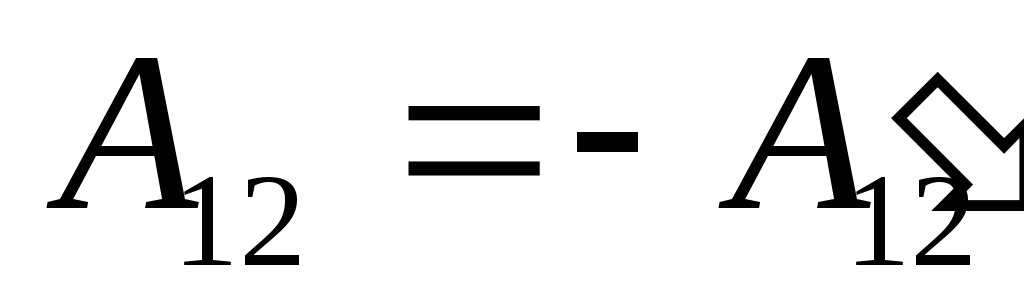 ,
(26.2)
,
(26.2)
ดังนั้นนิพจน์ (26.1) สามารถเขียนใหม่เป็น
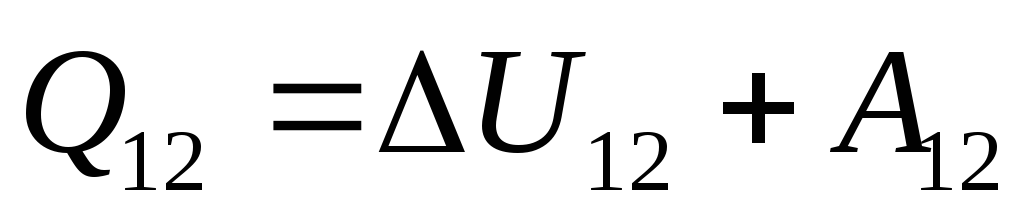 . (26.3)
. (26.3)
สมการนี้เป็นบันทึกทางคณิตศาสตร์ของกฎข้อที่หนึ่งของอุณหพลศาสตร์: ปริมาณความร้อนที่ส่งไปยังระบบถูกใช้ไปในการเปลี่ยนพลังงานภายในและการทำงานกับวัตถุภายนอกโดยระบบ
ด้วยการเปลี่ยนแปลงเล็กน้อยในสถานะของระบบ สมการ (26.3) จะใช้รูปแบบ
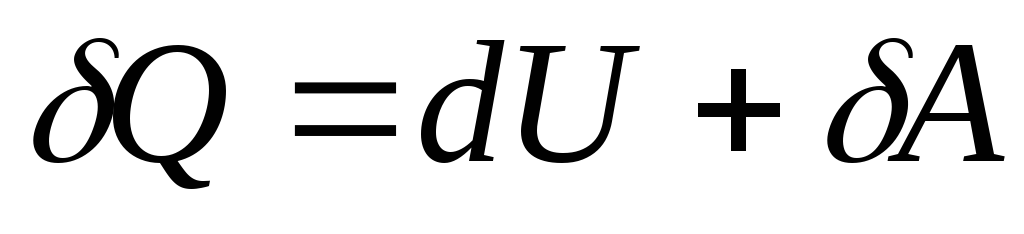 , (26.4)
, (26.4)
ที่ไหน  - การเปลี่ยนแปลงเล็กน้อยในพลังงานภายในของระบบเมื่อมีการให้ความร้อนในปริมาณพื้นฐาน
Qและปฏิบัติงานเบื้องต้นโดยระบบ
แต่เหนือร่างกายภายนอก
- การเปลี่ยนแปลงเล็กน้อยในพลังงานภายในของระบบเมื่อมีการให้ความร้อนในปริมาณพื้นฐาน
Qและปฏิบัติงานเบื้องต้นโดยระบบ
แต่เหนือร่างกายภายนอก
