Teoria cinetică moleculară a gazelor ideale
Știați,
Ce este un experiment de gândire, experiment gedanken?
Aceasta este o practică inexistentă, o experiență de altă lume, o imaginație a ceva care nu există de fapt. Experimentele gândirii sunt ca niște vise trezite. Ele dau naștere monștrilor. Spre deosebire de un experiment fizic, care este un test experimental de ipoteze, un „experiment de gândire” înlocuiește în mod magic testarea experimentală cu concluziile dorite care nu au fost testate în practică, manipulând construcții logice care încalcă de fapt logica însăși prin utilizarea premiselor nedovedite ca fiind dovedite, că este, prin substituire. Astfel, sarcina principală a solicitanților „experimentelor de gândire” este de a înșela ascultătorul sau cititorul prin înlocuirea unui experiment fizic real cu „păpușa” sa - raționament fictiv în eliberare condiționată fără verificarea fizică în sine.
Umplerea fizicii cu „experimente de gândire” imaginare a dus la apariția unei imagini absurde, suprareale și confuze a lumii. Un adevărat cercetător trebuie să distingă astfel de „împachetări de bomboane” de valorile reale.
Relativiștii și pozitiviștii susțin că „experimentele gândirii” sunt un instrument foarte util pentru testarea teoriilor (care apar și în mintea noastră) pentru coerență. În aceasta, ei înșală oamenii, deoarece orice verificare poate fi efectuată doar de o sursă independentă de obiectul verificării. Reclamantul însuși al ipotezei nu poate fi un test al propriei afirmații, întrucât motivul în sine a acestei afirmații este absența contradicțiilor în afirmație vizibilă reclamantului.
Vedem acest lucru în exemplul SRT și GTR, care s-au transformat într-un tip unic de religie care guvernează știința și opinie publica. Nicio cantitate de fapte care le contrazic nu poate depăși formula lui Einstein: „Dacă un fapt nu corespunde teoriei, schimbați faptul” (Într-o altă versiune, „Faptul nu corespunde teoriei? - Cu atât mai rău pentru faptul că ”).
Maximul pe care un „experiment de gândire” îl poate pretinde este doar consistența internă a ipotezei în cadrul propriei logici a solicitantului, adesea deloc adevărată. Acest lucru nu verifică conformitatea cu practica. Verificarea reală poate avea loc doar într-un experiment fizic real.
Un experiment este un experiment pentru că nu este o rafinare a gândirii, ci un test al gândirii. Un gând care este auto-consecvent nu se poate verifica singur. Acest lucru a fost dovedit de Kurt Gödel.
Într-un gaz rarefiat, distanța dintre molecule este de multe ori mai mare decât dimensiunea lor. În acest caz, interacțiunea dintre molecule este neglijabilă, iar energia cinetică a moleculelor este mult mai mare decât energia potențială a interacțiunii lor.
Pentru a explica proprietățile unei substanțe în stare gazoasă, în loc de un gaz real, se folosește modelul său fizic - un gaz ideal. Modelul presupune:
distanța dintre molecule este puțin mai mare decât diametrul lor;
moleculele sunt bile elastice;
nu există forțe atractive între molecule;
atunci când moleculele se ciocnesc între ele și cu pereții vasului, acționează forțele de respingere;
Mișcarea moleculelor respectă legile mecanicii.
Ecuația de bază pentru un gaz ideal este:
Ecuația de bază MKT permite să se calculeze presiunea gazului dacă se cunosc masa moleculei, valoarea medie a pătratului vitezei și concentrația moleculelor.
Presiunea ideală a gazului constă în faptul că moleculele, atunci când se ciocnesc de pereții unui vas, interacționează cu acestea conform legilor mecanicii ca corpuri elastice. Când o moleculă se ciocnește de peretele unui vas, proiecția vectorului viteză v x viteză pe axa OX, perpendiculară pe perete, își schimbă semnul în sens opus, dar rămâne constantă ca mărime. Prin urmare, ca urmare a ciocnirii unei molecule cu un perete, proiecția impulsului său pe axa OX se modifică de la mv 1x = -mv x la mv 2x = mv x. O modificare a impulsului unei molecule la ciocnirea cu un perete este cauzată de o forță F 1 care acționează asupra acesteia din partea laterală a peretelui. Modificarea impulsului moleculei este egală cu impulsul acestei forțe:
În timpul unei coliziuni, conform celei de-a treia legi a lui Newton, molecula acționează asupra peretelui cu o forță F 2, egală ca mărime cu forța F 1 și direcționată opus.
Există multe molecule și fiecare transferă același impuls către perete la ciocnire. Într-o secundă transmit impuls 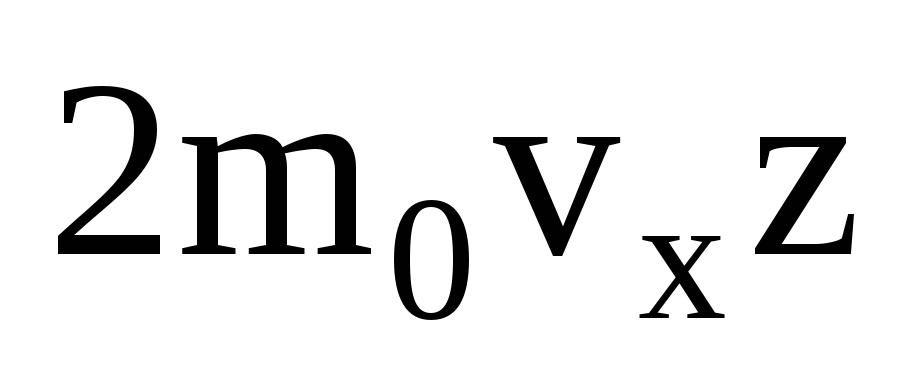 , unde z este numărul de ciocniri ale tuturor moleculelor cu peretele, care este proporțional cu concentrația de molecule din gaz, viteza moleculelor și aria suprafeței peretelui:
, unde z este numărul de ciocniri ale tuturor moleculelor cu peretele, care este proporțional cu concentrația de molecule din gaz, viteza moleculelor și aria suprafeței peretelui: 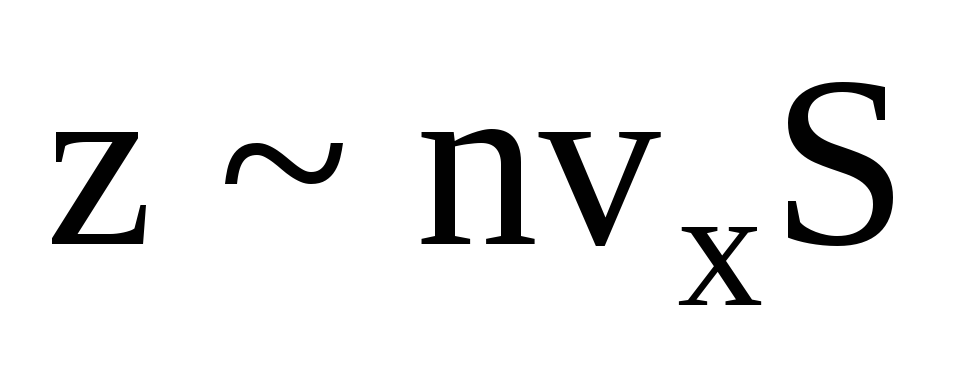 . Doar jumătate dintre molecule se deplasează spre perete, restul se deplasează în direcția opusă:
. Doar jumătate dintre molecule se deplasează spre perete, restul se deplasează în direcția opusă: 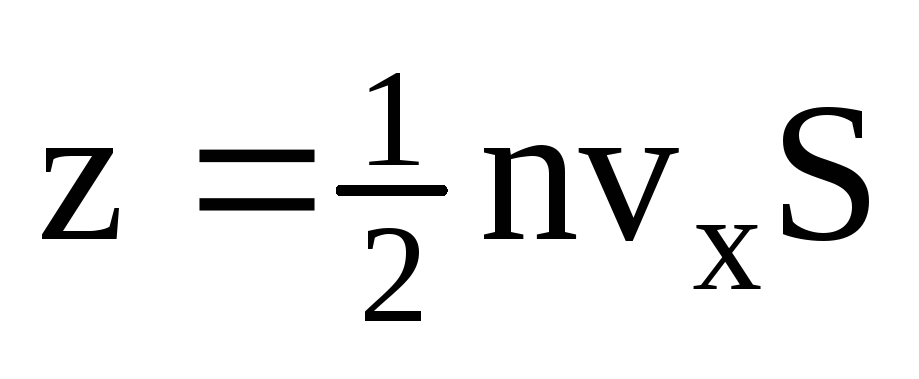 . Apoi impulsul total a fost transferat pe perete în 1 secundă:
. Apoi impulsul total a fost transferat pe perete în 1 secundă: 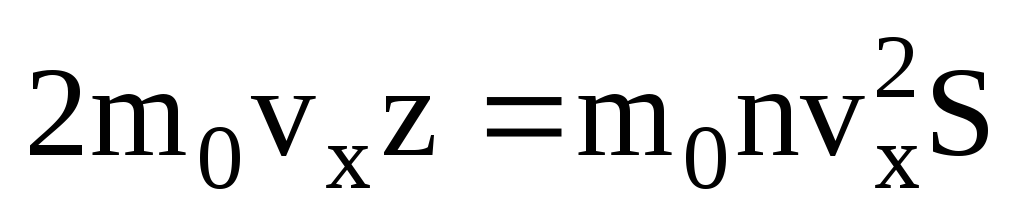 . Conform celei de-a doua legi a lui Newton, modificarea impulsului unui corp pe unitatea de timp este egală cu forța care acționează asupra acestuia:
. Conform celei de-a doua legi a lui Newton, modificarea impulsului unui corp pe unitatea de timp este egală cu forța care acționează asupra acestuia:
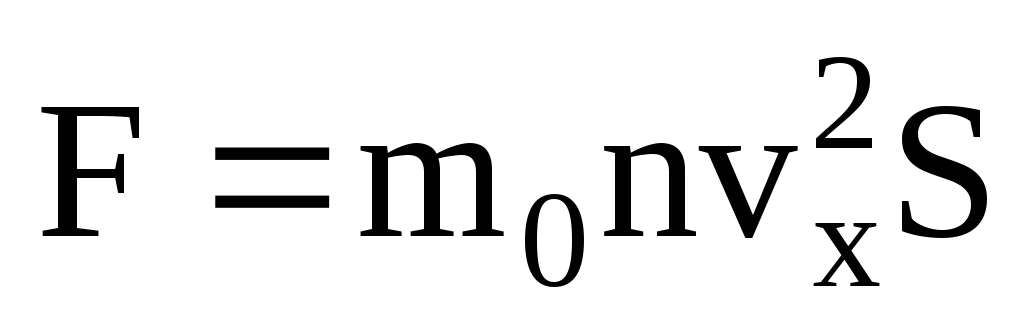
Având în vedere că nu toate moleculele au aceeași viteză, forța care acționează asupra peretelui va fi proporțională cu pătratul mediu al vitezei. Deoarece moleculele se mișcă în toate direcțiile, valorile medii ale pătratelor vitezelor proiectate sunt egale. Prin urmare, pătratul mediu al proiecției vitezei este: 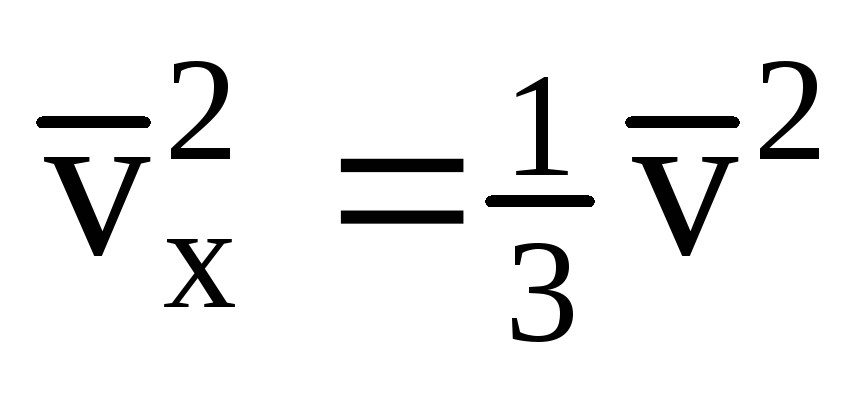 ;
;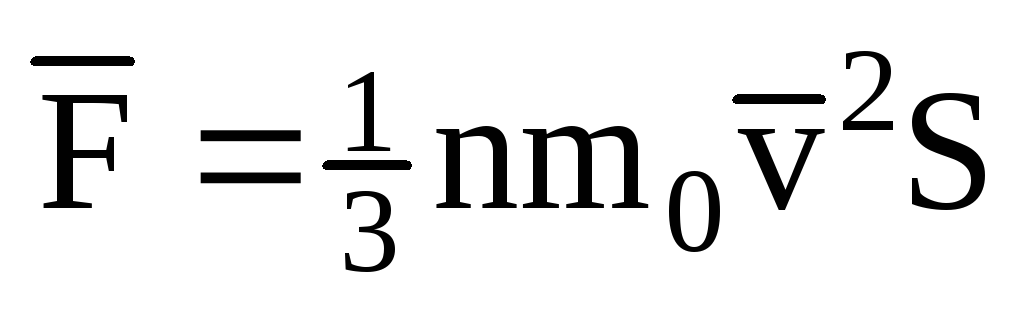 . Apoi presiunea gazului pe peretele vasului este egală cu:
. Apoi presiunea gazului pe peretele vasului este egală cu:
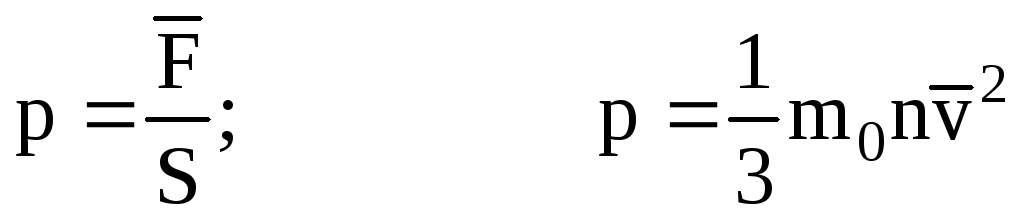 - ecuația de bază a MKT.
- ecuația de bază a MKT.
Desemnând valoarea medie a energiei cinetice a mișcării de translație a moleculelor gaz ideal:
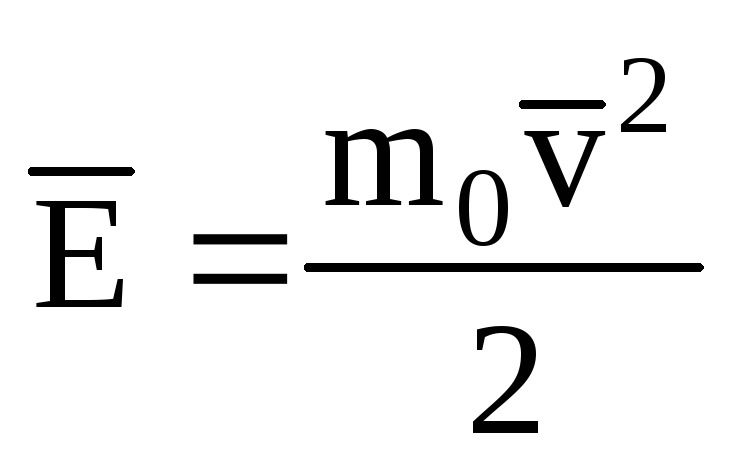 , primim
, primim
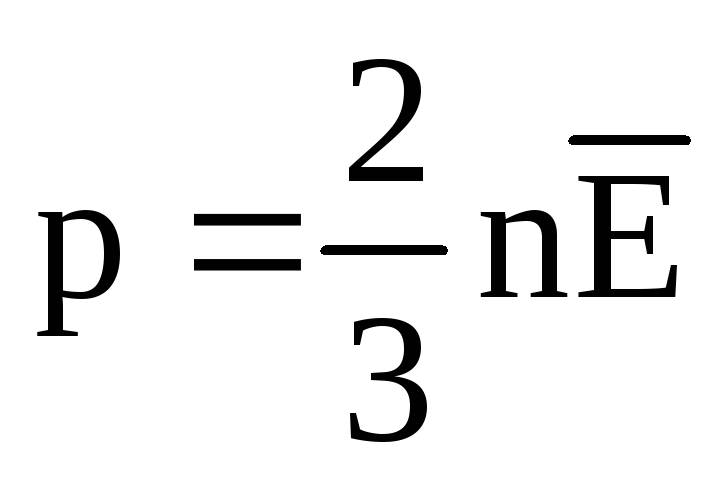
Temperatura și măsurarea acesteia:
Ecuația de bază MKT pentru un gaz ideal stabilește o legătură între un parametru macroscopic ușor de măsurat - presiunea - și parametri microscopici ai gazului, cum ar fi energia cinetică medie și concentrația moleculară. Dar măsurând doar presiunea, nu putem afla nici energia cinetică medie a moleculelor individuale, nici concentrația lor. În consecință, pentru a găsi parametrii microscopici ai unui gaz, sunt necesare măsurători ale unei alte mărimi fizice legate de energia cinetică medie a moleculelor. Această cantitate este temperatura.
Orice corp macroscopic sau grup de corpuri macroscopice, în condiții externe constante, trece spontan într-o stare de echilibru termic. Echilibru termic - Aceasta este o stare în care toți parametrii macroscopici rămân neschimbați atât timp cât se dorește.
Temperatura caracterizează starea de echilibru termic a unui sistem de corpuri: toate corpurile sistemului care sunt în echilibru termic între ele au aceeași temperatură.
Pentru a măsura temperatura, puteți utiliza modificarea în orice mărime macroscopică în funcție de temperatură: volum, presiune, rezistență electrică etc.
Cel mai adesea, în practică, se utilizează dependența volumului de lichid (mercur sau alcool) de temperatură. La calibrarea unui termometru, temperatura gheții de topire este de obicei luată ca punct de referință (0); al doilea punct constant (100) este considerat punctul de fierbere al apei la presiunea atmosferică normală (scara Celsius). Deoarece diferitele lichide se extind diferit atunci când sunt încălzite, scara astfel stabilită va depinde într-o oarecare măsură de proprietățile lichidului în cauză. Desigur, 0 și 100°C vor coincide pentru toate termometrele, dar 50°C nu vor coincide.
Spre deosebire de lichide, toate gazele rarefiate se extind în mod egal atunci când sunt încălzite și își schimbă presiunea în mod egal atunci când temperatura se schimbă. Prin urmare, în fizică, pentru a stabili o scară rațională de temperatură, ei folosesc o modificare a presiunii unei anumite cantități de gaz rarefiat la un volum constant sau o modificare a volumului unui gaz la o presiune constantă. Această scară este uneori numită scala de temperatură a gazului ideal.
La echilibru termic, energia cinetică medie a mișcării de translație a moleculelor tuturor gazelor este aceeași. Presiunea este direct proporțională cu energia cinetică medie a mișcării de translație a moleculelor: 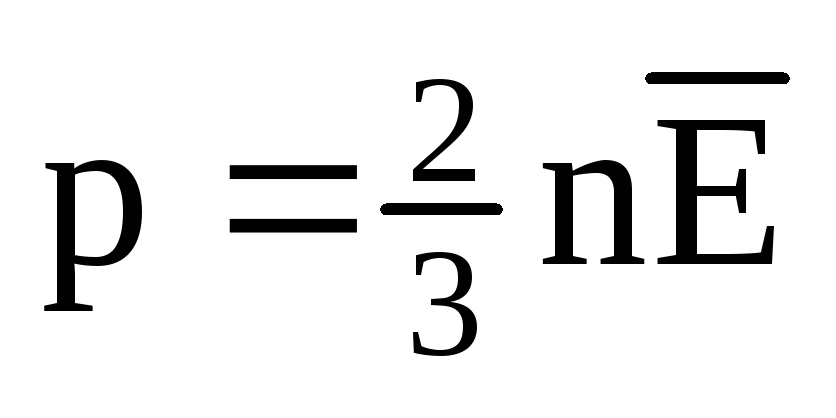 . În echilibru termic, dacă presiunea unui gaz de o masă dată și volumul acestuia sunt fixe, energia cinetică medie a moleculelor de gaz trebuie să aibă o valoare strict definită, la fel ca și temperatura. Deoarece
. În echilibru termic, dacă presiunea unui gaz de o masă dată și volumul acestuia sunt fixe, energia cinetică medie a moleculelor de gaz trebuie să aibă o valoare strict definită, la fel ca și temperatura. Deoarece 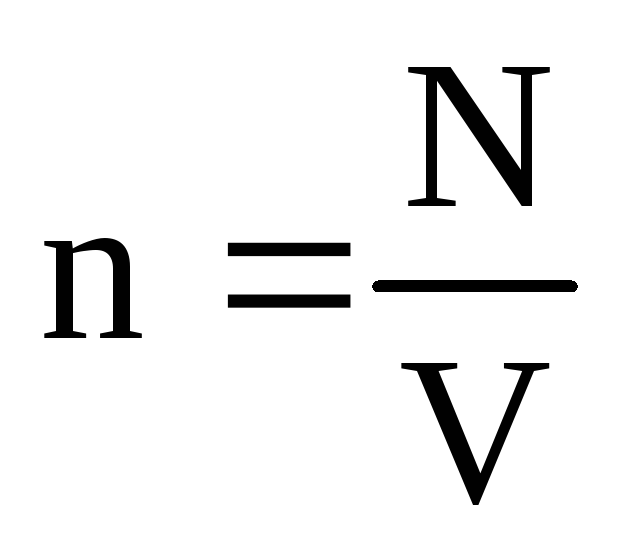 , Acea
, Acea 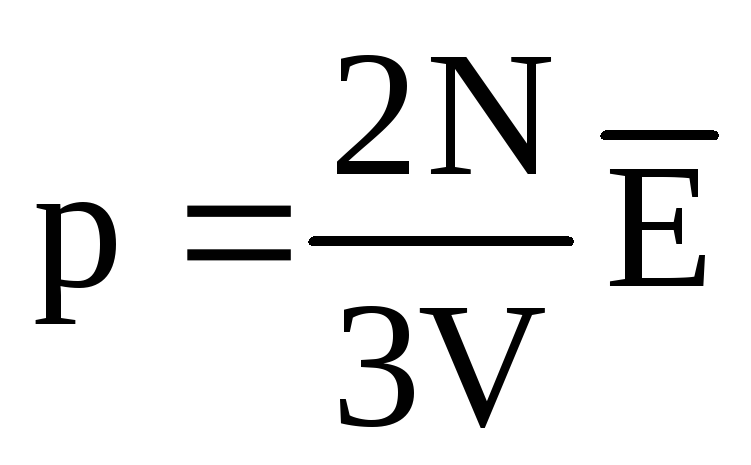 , sau
, sau 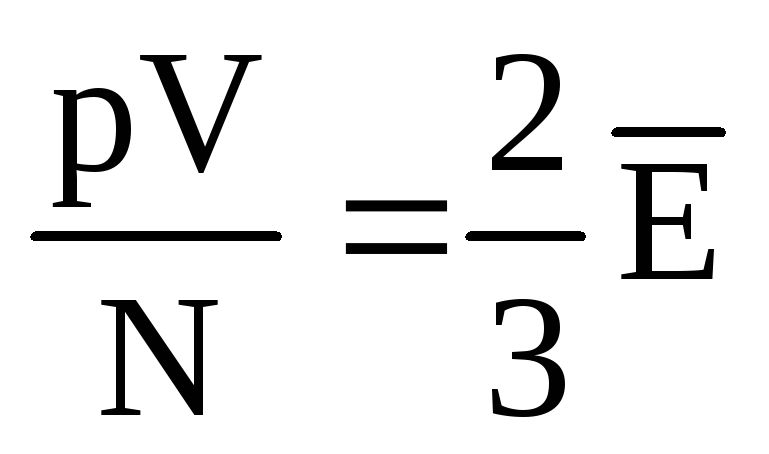 .
.
Să notăm 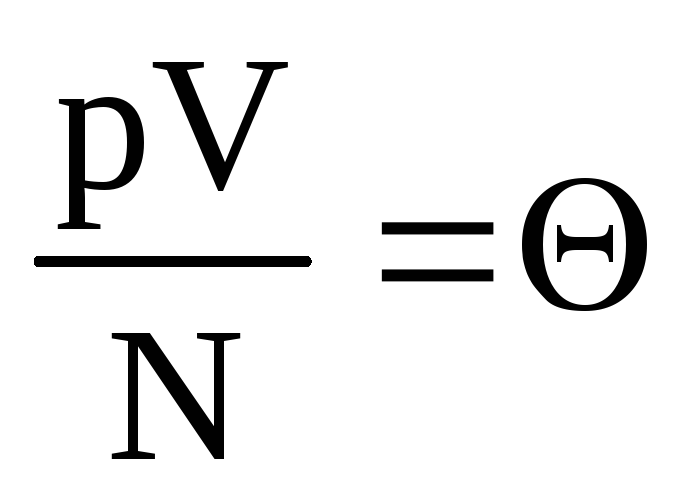 . Magnitudinea
. Magnitudinea  crește odată cu creșterea temperaturii și nu depinde de altceva decât de temperatură. Prin urmare, poate fi considerată o măsură naturală a temperaturii.
crește odată cu creșterea temperaturii și nu depinde de altceva decât de temperatură. Prin urmare, poate fi considerată o măsură naturală a temperaturii.
Teoria cinetică moleculară descrie comportamentul și proprietățile unui obiect ideal special numit gaz ideal. Acest model fizic se bazează pe structura moleculară a materiei. Crearea teoriei moleculare este asociată cu lucrările lui R. Clausius, J. Maxwell, D. Joule și L. Boltzmann.
Gaz ideal. Teoria cinetică moleculară a gazului ideal se bazează pe următoarele premise:
atomii şi moleculele pot fi considerate ca puncte materiale, în mișcare continuă;
volumul intrinsec al moleculelor de gaz este neglijabil în comparație cu volumul recipientului;
toți atomii și moleculele se pot distinge, adică în mod fundamental este posibil să se urmărească mișcarea fiecărei particule;
înainte ca moleculele de gaz să se ciocnească, nu există forțe de interacțiune între ele, iar ciocnirile moleculelor între ele și cu pereții vasului sunt presupuse a fi absolut elastice;
mișcarea fiecărui atom sau moleculă a unui gaz este descrisă de legile mecanicii clasice.
Legile obţinute pentru un gaz ideal pot fi folosite în studiul gazelor reale. Pentru a face acest lucru, sunt create modele experimentale ale unui gaz ideal în care proprietățile unui gaz real sunt apropiate de caracteristicile unui gaz ideal (de exemplu, la presiuni scăzute și temperaturi ridicate).
Legile gazelor ideale
Legea Boyle-Mariotte:
pentru o masă dată de gaz la o temperatură constantă, produsul dintre presiunea gazului și volumul acestuia este o valoare constantă: рV = const , (1.1)
la T = const , m = const .
Curbă care ilustrează relația dintre cantități RȘi V, caracterizează proprietățile unei substanțe la o temperatură constantă și se numește izotermă aceasta este o hiperbolă (Fig. 1.1.), iar un proces care are loc la o temperatură constantă se numește izoterm.
legile lui Gay-Lussac:
Volumul unei mase date de gaz la presiune constantă variază liniar cu temperatura
V=V 0 (1 + t ) la P = const , m = const . (1.2)

p = p 0 (1 + t ) la V = const , m = const . (1.3)
În ecuațiile (1.2) și (1.3), temperatura este exprimată pe scara Celsius, presiune și volum - la
0 С, în timp ce
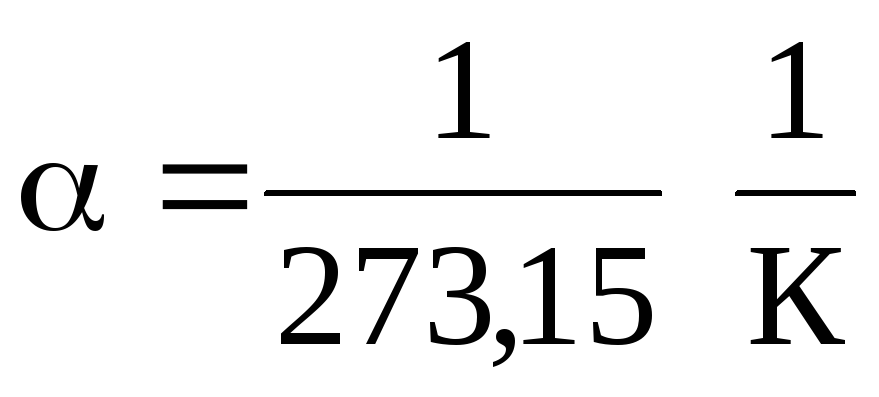 .
.
Un proces care are loc la presiune constantă se numește izobaric, poate fi reprezentată ca o funcție liniară (Fig. 1.2.).
Un proces care are loc la volum constant se numește izocoric(Fig. 1.3.).
Din ecuațiile (1.2) și (1.3) rezultă că izobarele și izocorile intersectează axa temperaturii în punctul t =1/ = 273,15 С . Dacă mutam punctul de referință în acest punct, trecem la scara Kelvin.
Introducerea în formulele (1.2) și (1.3) temperatura termodinamică, legile lui Gay-Lussac pot primi o formă mai convenabilă:
V = V 0 (1+t) = = V 0 = =V 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
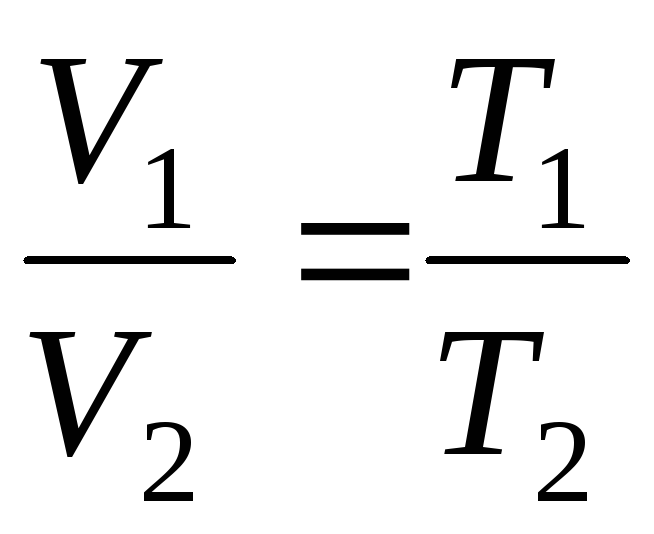 la
p = const, m = const
;
(1.4)
la
p = const, m = const
;
(1.4)
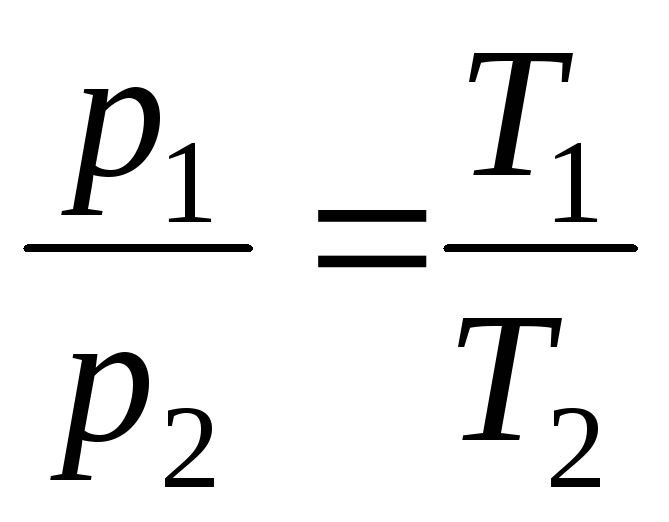 la V = const, m = const
,
(1.5)
la V = const, m = const
,
(1.5)
unde indicii 1 și 2 se referă la stări arbitrare situate pe aceeași izobară sau izocor .
legea lui Avogadro:
moli de orice gaz la aceleași temperaturi și presiuni ocupă aceleași volume.
În condiții normale, acest volum este egal cu V,0 = 22,4110 -3 m 3 /mol . Prin definiție, într-un singur mall diverse substanțe conţine acelaşi număr de molecule, egal cu constanta lui Avogadro:N A = 6,02210 23 mol -1 .
legea lui Dalton:
presiunea unui amestec de diferite gaze ideale este egală cu suma presiunilor parțiale R 1 , R 2 , R 3 … R n , gazele incluse în acesta:
p = p 1 + p 2 + R 3 + …+ p n .
Presiune parțială – Acest presiunea pe care gazul conținut în compoziție ar produce-o amestec de gaze, dacă singur a ocupat un volum egal cu volumul amestecului la aceeași temperatură.
Ecuația de stare a gazelor ideale
(Ecuația Clapeyron-Mendeleev)
Există o anumită relație între temperatură, volum și presiune. Această relație poate fi reprezentată printr-o dependență funcțională:
f(p, V, T)= 0.
La rândul său, fiecare dintre variabilele ( p, V, T) este o funcție a altor două variabile. Tipul de dependență funcțională pentru fiecare stare de fază a unei substanțe (solid, lichid, gazos) se găsește experimental. Acesta este un proces foarte intensiv în muncă și ecuația de stare a fost stabilită numai pentru gazele care sunt în stare rarefiată și într-o formă aproximativă pentru unele gaze comprimate. Pentru substanțele care nu sunt în stare gazoasă, această problemă nu a fost încă rezolvată.
Fizicianul francez B. Clapeyron a dedus ecuația de stare a gazelor ideale, combinând legile lui Boyle-Mariotte, Gay-Lussac, Charles:
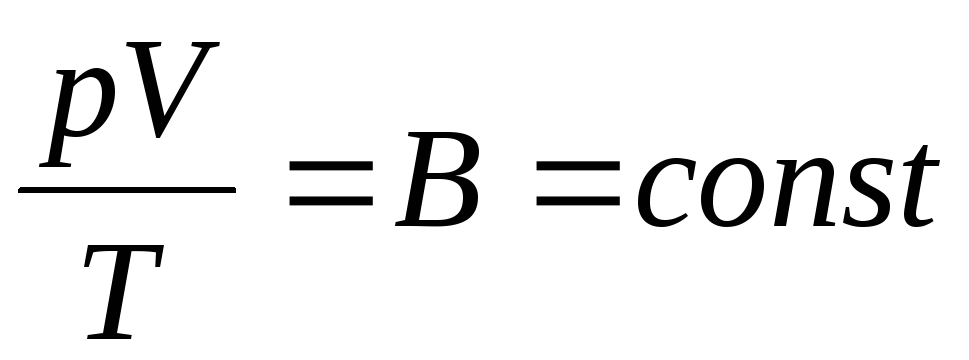 . (1.6)
. (1.6)
Expresia (1.6) este ecuația Clapeyron, unde ÎN– constanta de gaz. Este diferit pentru diferite gaze.
DI. Mendeleev a combinat ecuația lui Clapeyron cu legea lui Avogadro, relaționând ecuația (1.6) la un mol și folosind volumul molar V . Conform legii lui Avogadro, pentru egal RȘi T molii tuturor gazelor ocupă același volum molar V .
.
Prin urmare constanta ÎN va fi la fel pentru toate gazele ideale. Această constantă este de obicei indicată R si este egal cu R=
8,31
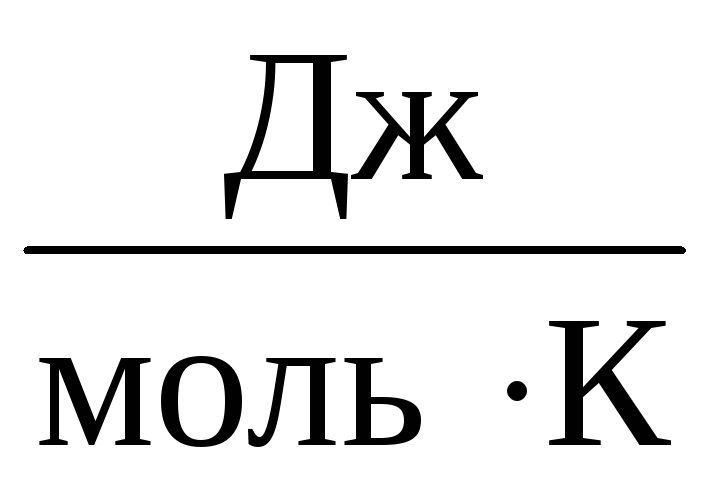 .
.
Ecuația Clapeyron-Mendeleev are următoarea formă:
p V . = R T.
Din ecuația (1.7) pentru un mol de gaz putem merge la Ecuația Clapeyron-Mendeleev pentru o masă arbitrară de gaz:
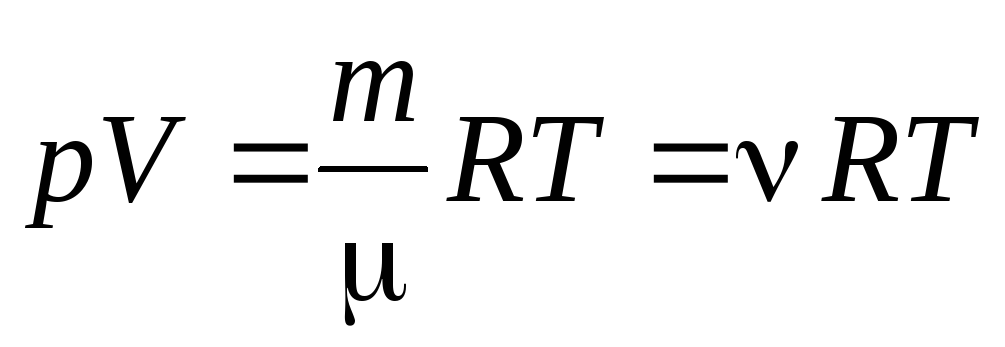 , (1.7)
, (1.7)
Unde
–
Masă molară
(masa unui mol de substanță, kg/mol); m
masa de gaz;
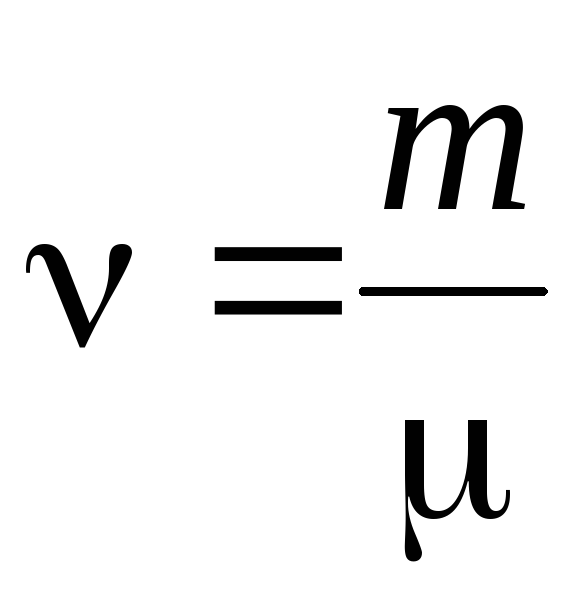 - cantitate de substanță .
- cantitate de substanță .
Mai des folosesc o altă formă a ecuației de stare a gazelor ideale, introducând constanta Boltzmann: 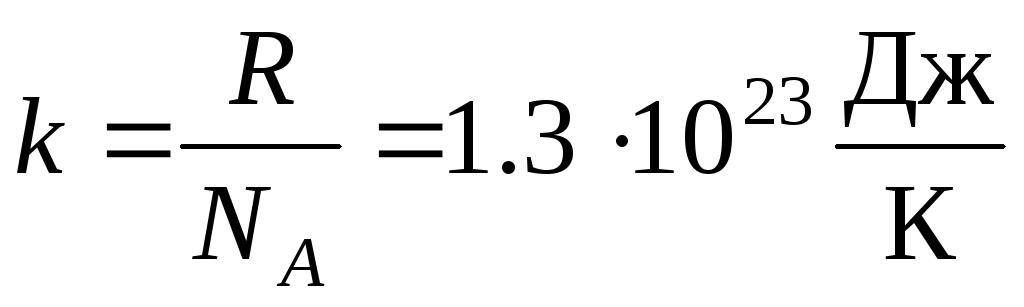 .
.
Atunci ecuația (1.7) arată astfel:
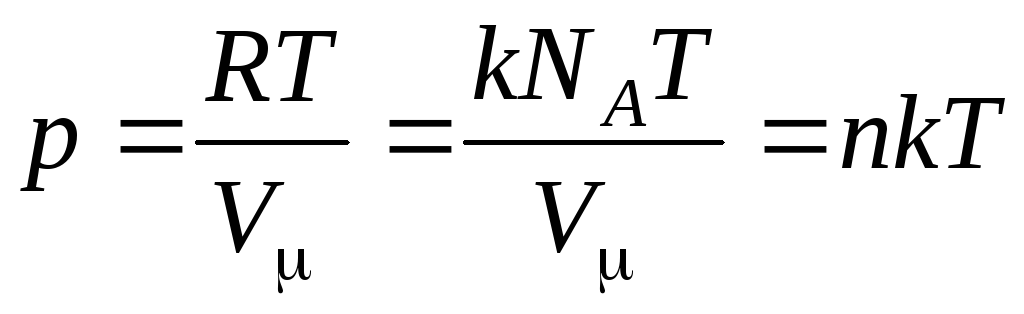 ,
(1.8)
,
(1.8)
Unde
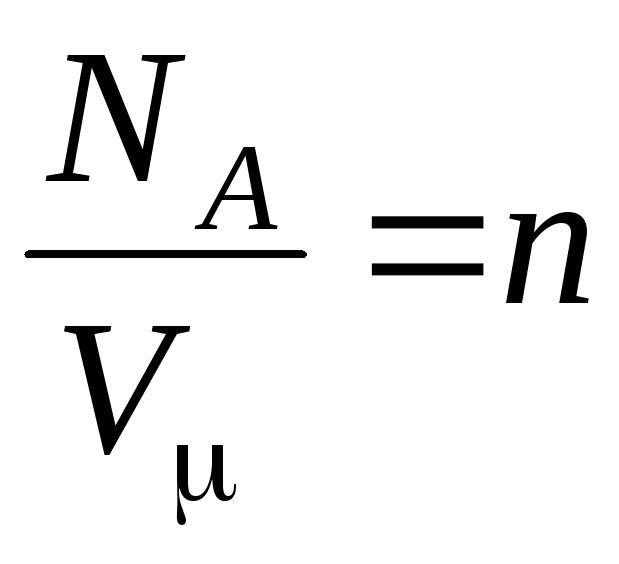 –
concentrația moleculelor (numărul de molecule pe unitatea de volum). Din această expresie rezultă că presiunea unui gaz ideal este direct proporțională cu concentrația moleculelor sale sau cu densitatea gazului. La aceleași temperaturi și presiuni, toate gazele conțin același număr de molecule pe unitatea de volum. Se numește numărul de molecule conținute în 1 m3 în condiții normale
Numărul Loschmidt:
–
concentrația moleculelor (numărul de molecule pe unitatea de volum). Din această expresie rezultă că presiunea unui gaz ideal este direct proporțională cu concentrația moleculelor sale sau cu densitatea gazului. La aceleași temperaturi și presiuni, toate gazele conțin același număr de molecule pe unitatea de volum. Se numește numărul de molecule conținute în 1 m3 în condiții normale
Numărul Loschmidt:
N L = 2,68 10 25 m -3 .
Ecuația de bază a cineticii moleculare
teoria gazelor ideale
Cea mai importantă sarcină teoria cinetică a gazelor este calculul teoretic al presiunii unui gaz ideal bazate pe concepte cinetice moleculare. Ecuația de bază a teoriei cinetice moleculare a gazelor ideale este derivată folosind metode statistice.
Se presupune că moleculele de gaz se mișcă haotic, numărul de ciocniri reciproce dintre moleculele de gaz este neglijabil în comparație cu numărul de impacturi asupra pereților recipientului, iar aceste ciocniri sunt absolut elastice. Pe peretele vasului se identifică o anumită zonă elementară Sși calculați presiunea pe care moleculele de gaz o vor exercita asupra acestei zone.
Este necesar să se țină cont de faptul că, în realitate, moleculele se pot deplasa spre site în unghiuri diferite și pot avea viteze diferite, care, de altfel, se poate schimba cu fiecare coliziune. În calculele teoretice, mișcările haotice ale moleculelor sunt idealizate și înlocuite cu mișcarea de-a lungul a trei direcții reciproc perpendiculare.
Dacă luăm în considerare un vas sub formă de cub, în care N molecule de gaz în șase direcții, atunci este ușor de observat că, în orice moment, 1/3 din numărul tuturor moleculelor se mișcă de-a lungul fiecăreia dintre ele și jumătate dintre ele (adică 1/6 din numărul tuturor moleculelor). ) se mișcă într-o direcție, iar a doua jumătate (tot 1/6) - în direcția opusă. La fiecare ciocnire, o moleculă separată care se mișcă perpendicular pe platformă, fiind reflectată, îi transferă impulsul, în timp ce impulsul său (momentul) se modifică cu cantitatea
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Numărul de impacturi ale moleculelor care se deplasează într-o direcție dată pe platformă va fi egal cu: N = 1/6 n Svt. Când se ciocnesc de platformă, aceste molecule își vor transfera impuls
P= N P 1 =2 m 0 vnSvt= m 0 v 2 nSt,
Unde n– concentrația de molecule. Apoi presiunea pe care o exercită gazul pe peretele vasului va fi egală cu:
p = 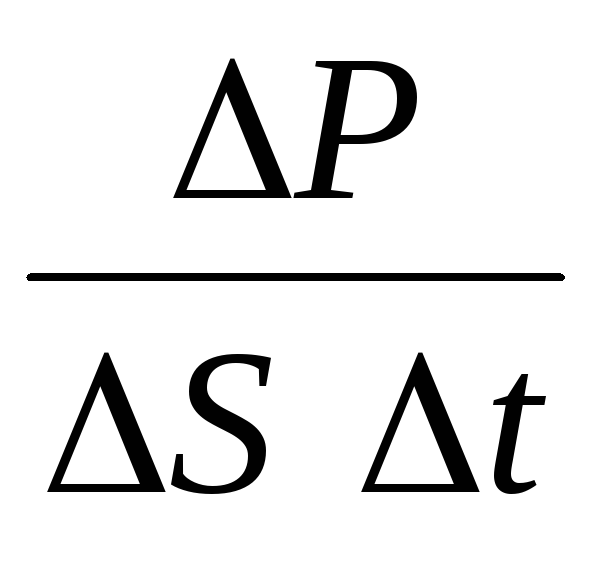 =
n m 0
v 2
.
(1.9)
=
n m 0
v 2
.
(1.9)
Cu toate acestea, moleculele de gaz se mișcă cu viteze diferite: v 1 , v 2 , …,v n, deci vitezele trebuie să fie mediate. Suma pătratelor vitezei de mișcare a moleculelor de gaz, împărțită la numărul lor, determină viteza rădăcină-pătrată medie:
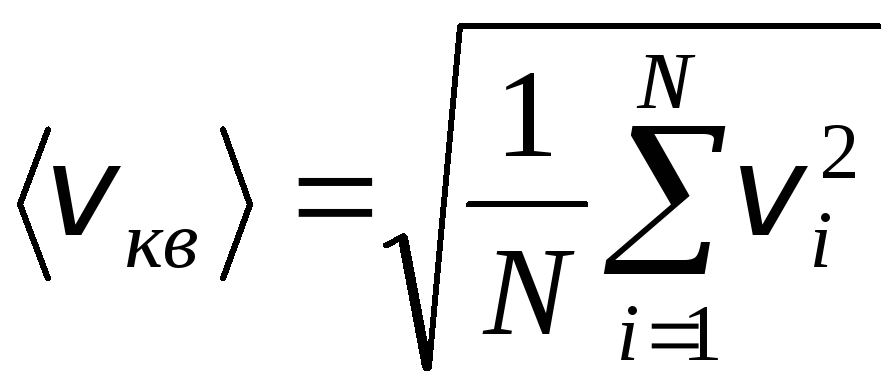 .
.
Ecuația (1.9) va lua forma:
![]() (1.10)
(1.10)
expresia (1.10) se numește ecuația de bază a teoriei cinetice moleculare gaze ideale.
Având în vedere că 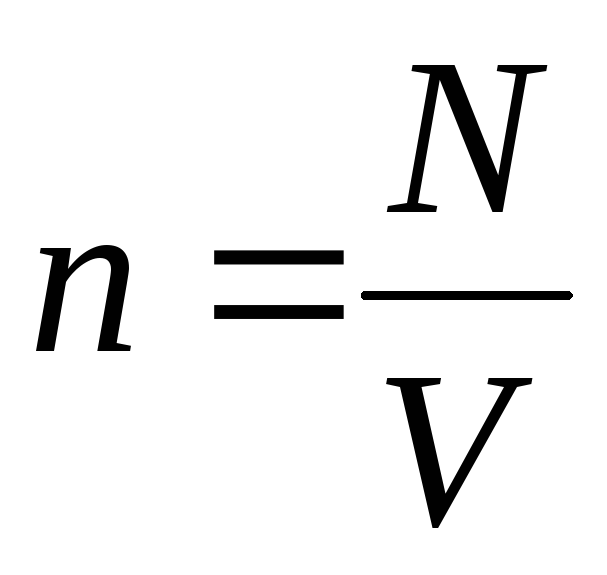 , primim:
, primim:
p V = N 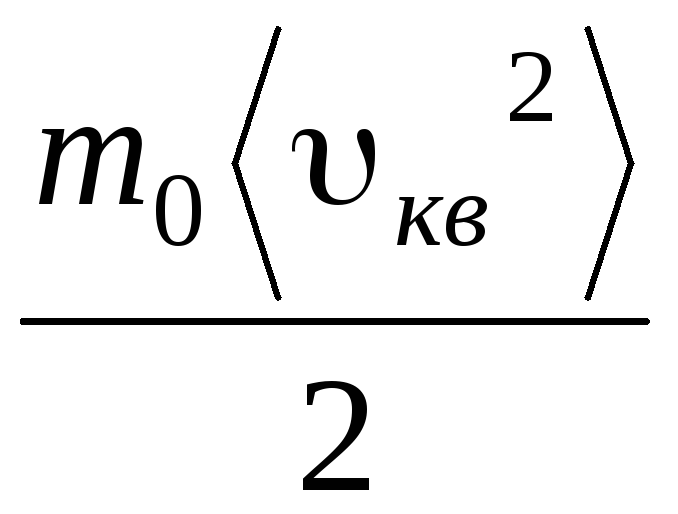 =E,
(1.11)
=E,
(1.11)
Unde E– energia cinetică totală a mișcării de translație a tuturor moleculelor de gaz. În consecință, presiunea gazului este direct proporțională cu energia cinetică a mișcării de translație a moleculelor de gaz.
Pentru un mol de gaz m =, iar ecuația Clapeyron-Mendeleev are următoarea formă:
pV . = R T,
iar din (1.11) rezultă că pV . = v kv 2, obținem:
RT = v kv 2 .
Prin urmare, viteza medie pătrată a moleculelor de gaz este egală cu
v
kv
=
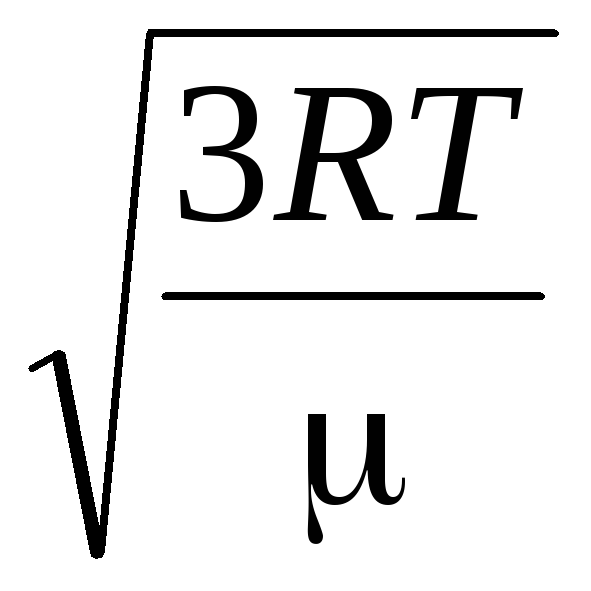 =
=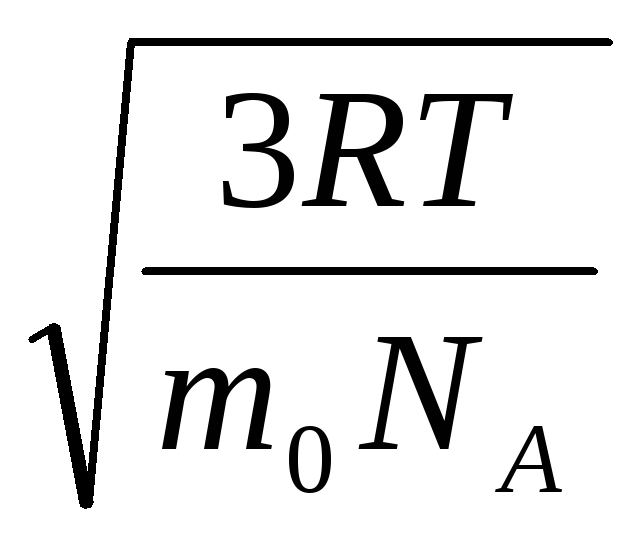 =
= ,
,
Unde k = R/N A = 1,3810 -23 J/K – constanta lui Boltzmann. De aici puteți găsi viteza pătrată medie a moleculelor de oxigen la temperatura camerei - 480 m/s, hidrogen - 1900 m/s.
Sensul molecular-cinetic al temperaturii
Temperatura este o măsură cantitativă a „căldurii” unui corp. Pentru a clarifica semnificația fizică a temperaturii termodinamice absolute T Să comparăm ecuația de bază a teoriei cinetice moleculare a gazelor (1.14) cu ecuația Clapeyron-Mendeleev p V = R T.
Echivalând părțile din dreapta acestor ecuații, găsim valoarea medie a energiei cinetice 0 a unei molecule ( = N/N A , k=R/N A):
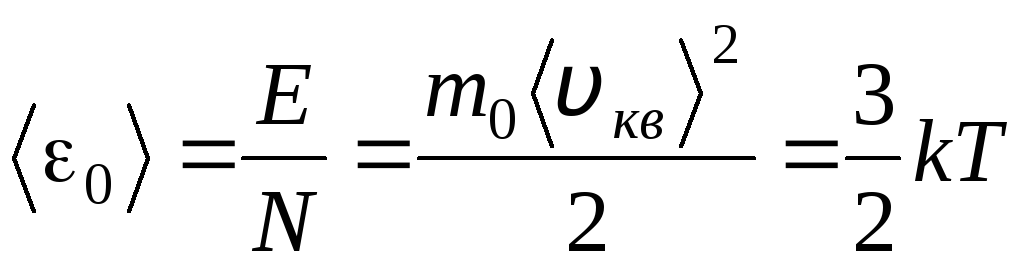 .
.
Din această ecuație rezultă cea mai importantă concluzie a teoriei cinetice moleculare: energia cinetică medie a mișcării de translație a unei molecule a unui gaz ideal depinde doar de temperatură, în timp ce este direct proporțională cu temperatura termodinamică. Astfel, scala de temperatură termodinamică capătă un sens fizic direct: at T= 0 energia cinetică a moleculelor de gaz ideal este zero. În consecință, pe baza acestei teorii, mișcarea de translație a moleculelor de gaz se va opri și presiunea acesteia va deveni zero.
Teoria proprietăților de echilibru ale unui gaz ideal
Numărul de grade de libertate ale moleculelor. Teoria molecular-cinetică a gazelor ideale duce la o consecință foarte importantă: moleculele de gaz suferă mișcări aleatorii, iar energia cinetică medie a mișcării de translație a unei molecule este determinată numai de temperatură.
Energia cinetică a mișcării moleculelor nu este epuizată de cinetică energie de mișcare înainte: constă și din cinetică energii rotațieȘi fluctuatii molecule. Pentru a calcula energia cheltuită pentru toate tipurile de mișcare moleculară, este necesar să se definească numărul de grade de libertate.
Sub numărul de grade de libertate (i) corp este subînțeles numărul de coordonate independente care trebuie introduse pentru a determina poziția corpului în spațiu.
N  De exemplu, un punct material are trei grade de libertate, deoarece poziția sa în spațiu este determinată de trei coordonate: X yȘi z. În consecință, o moleculă monoatomică are trei grade de libertate de mișcare de translație.
De exemplu, un punct material are trei grade de libertate, deoarece poziția sa în spațiu este determinată de trei coordonate: X yȘi z. În consecință, o moleculă monoatomică are trei grade de libertate de mișcare de translație.
D 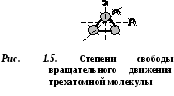 o moleculă vukhatomny are 5 grade de libertate (Fig. 1.4): 3 grade de libertate de mișcare de translație și 2 grade de libertate de mișcare de rotație.
o moleculă vukhatomny are 5 grade de libertate (Fig. 1.4): 3 grade de libertate de mișcare de translație și 2 grade de libertate de mișcare de rotație.
Moleculele de trei sau mai mulți atomi au 6 grade de libertate: 3 grade de libertate a mișcării de translație și 3 grade de libertate a mișcării de rotație (Fig. 1.5).
Fiecare moleculă de gaz are un anumit număr de grade de libertate, dintre care trei corespund mișcării sale de translație.
Clauza de Echitate Energetică
prin grade de libertate
Premisa principală a teoriei cinetice moleculare a gazelor este presupunerea unei dezordine complete în mișcarea moleculelor. Acest lucru se aplică atât mișcărilor oscilatorii, cât și mișcărilor de rotație, și nu doar celor de translație. Se crede că toate direcțiile de mișcare ale moleculelor dintr-un gaz sunt la fel de probabile. Prin urmare, putem presupune că pentru fiecare grad de libertate al unei molecule, în medie, există aceeași cantitate de energie - acesta este principiul echidistribuției energiei între gradele de libertate. Energia pe gradul de libertate a unei molecule este egală cu:
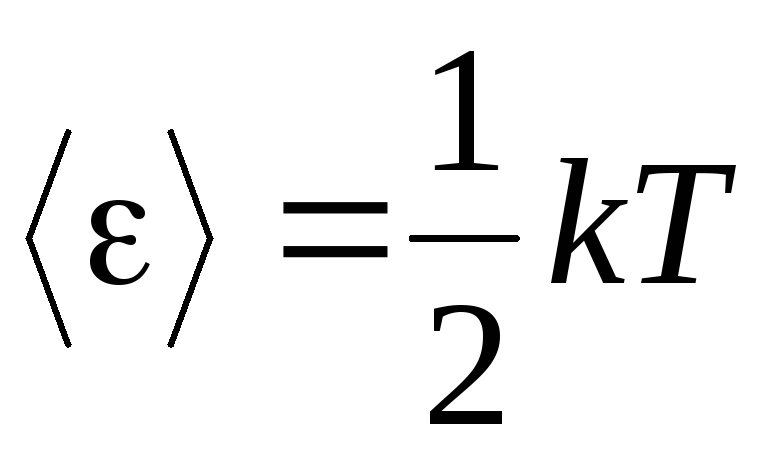 . (1.12)
. (1.12)
Dacă o moleculă are i grade de libertate, atunci pentru fiecare grad de libertate există în medie:
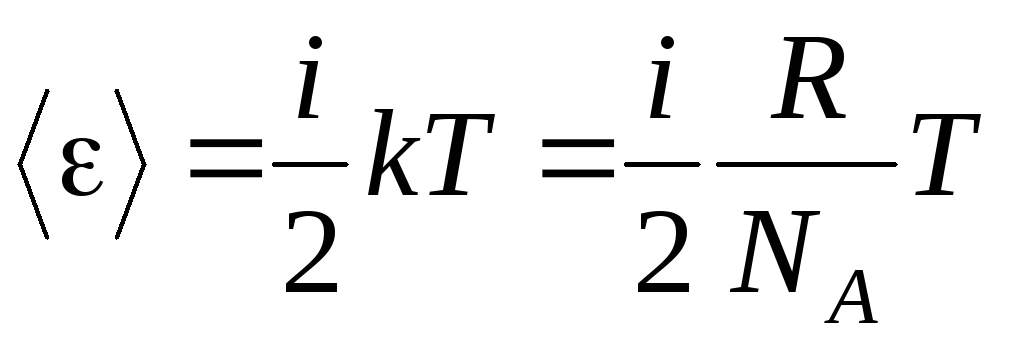 .
(1.13)
.
(1.13)
Energia internă a unui gaz ideal
Dacă raportăm energia internă totală a unui gaz la un mol, obținem valoarea acestuia înmulțind cu numărul lui Avogadro:
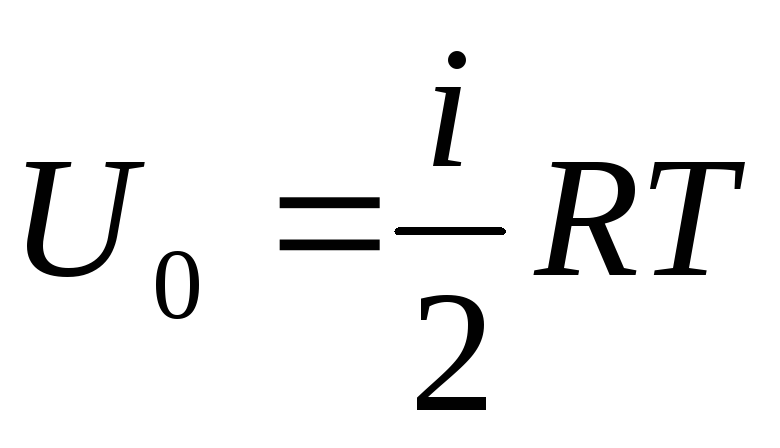 .
(1.14)
.
(1.14)
Rezultă că energia internă a unui mol dintr-un gaz ideal depinde numai de temperatură și de numărul de grade de libertate al moleculelor de gaz.
Distribuțiile Maxwell și Boltzmann
Distribuția moleculelor de gaz ideal după viteze și energii ale mișcării termice (distribuția Maxwell). La o temperatură constantă a gazului, se presupune că toate direcțiile mișcării moleculare sunt la fel de probabile. În acest caz, viteza pătratică medie a fiecărei molecule rămâne constantă și este egală cu
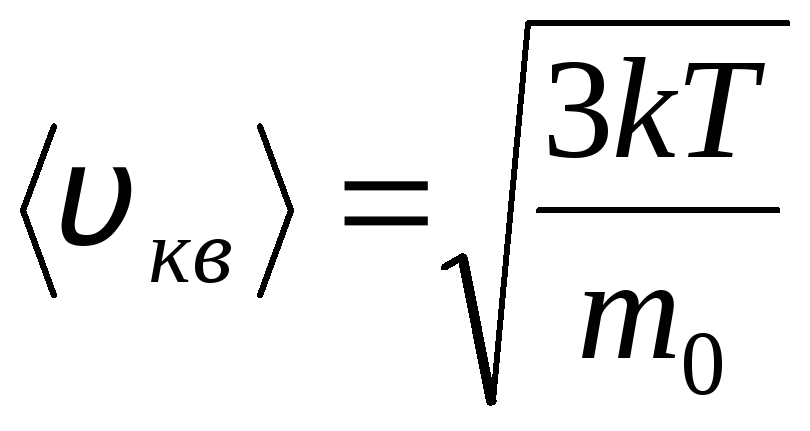 .
.
Acest lucru se explică prin faptul că într-un gaz ideal în stare de echilibru se stabilește o anumită distribuție staționară a vitezei moleculelor care nu se modifică în timp. această distribuție se supune unei anumite legi statistice, care a fost teoretic derivată de J. Maxwell. Legea lui Maxwell este descrisă de funcție
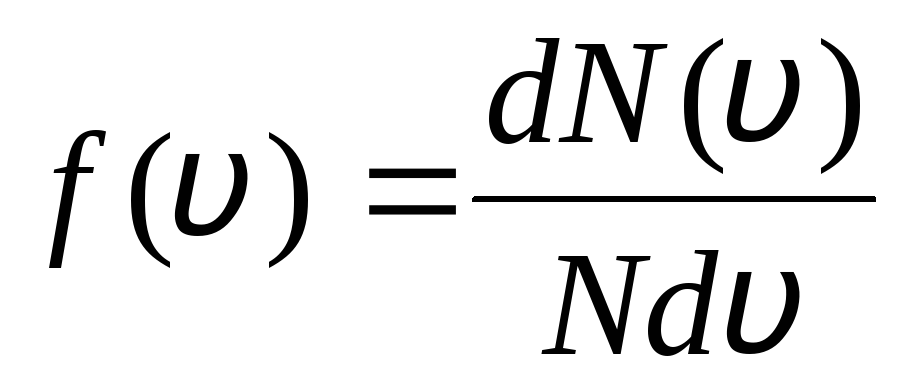 ,
,
adică funcția f(v) determină numărul relativ de molecule  , ale căror viteze se află în intervalul de la v
inainte de v+dv. Folosind metode ale teoriei probabilităților, a găsit Maxwell Legea distribuției moleculelor de gaz ideal în funcție de viteză:
, ale căror viteze se află în intervalul de la v
inainte de v+dv. Folosind metode ale teoriei probabilităților, a găsit Maxwell Legea distribuției moleculelor de gaz ideal în funcție de viteză:
 . (1.15)
. (1.15)
Funcția de distribuție este prezentată grafic în Fig. 1.6. Aria delimitată de curba de distribuție și de axa x este egală cu unu. Aceasta înseamnă că funcția f(v) satisface condiția de normalizare:
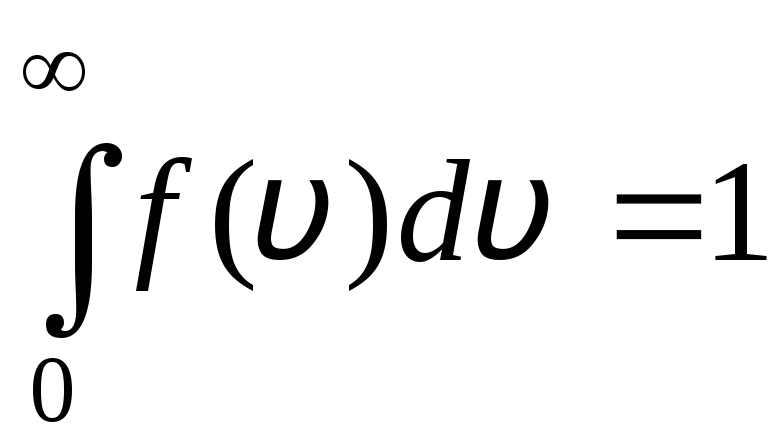 .
.
CU  viteza cu care funcția de distribuție a vitezei moleculelor de gaz ideal f(v) este maxim, numit cel mai probabil
viteză
v B .
viteza cu care funcția de distribuție a vitezei moleculelor de gaz ideal f(v) este maxim, numit cel mai probabil
viteză
v B .
Valori v = 0 Și v = corespund minimelor de expresie (1.15). Cea mai probabilă viteză poate fi găsită prin diferențierea expresiei (1.23) și echivalând-o cu zero:
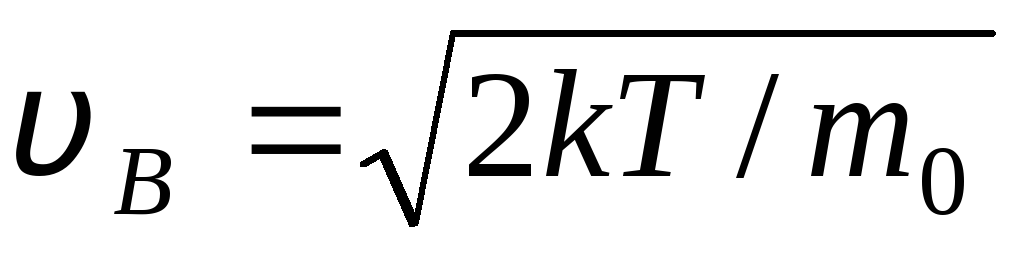 =
=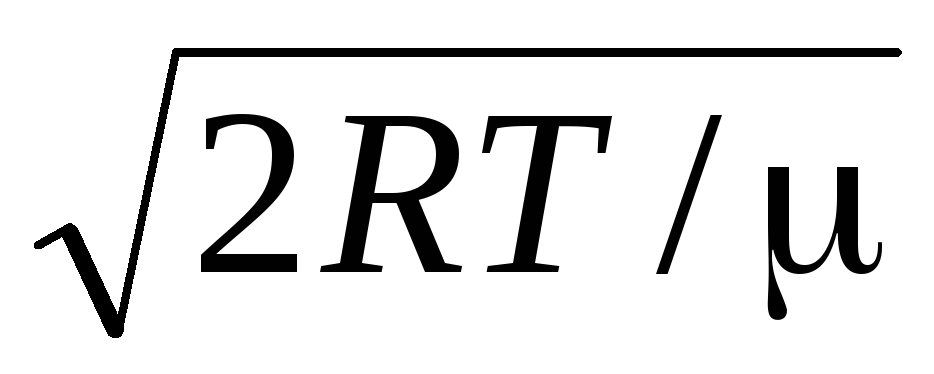 =
1,41
=
1,41
Pe măsură ce temperatura crește, maximul funcției se va deplasa spre dreapta (Fig. 1.6), adică pe măsură ce temperatura crește, viteza cea mai probabilă crește, cu toate acestea, aria limitată de curbă rămâne neschimbată. De remarcat că în gaze și la temperaturi scăzute există întotdeauna un număr mic de molecule care se mișcă la viteze mari. Prezența unor astfel de molecule „fierbinte” are mare importanță pe parcursul multor procese.
Viteza medie aritmetică moleculele sunt determinate de formula
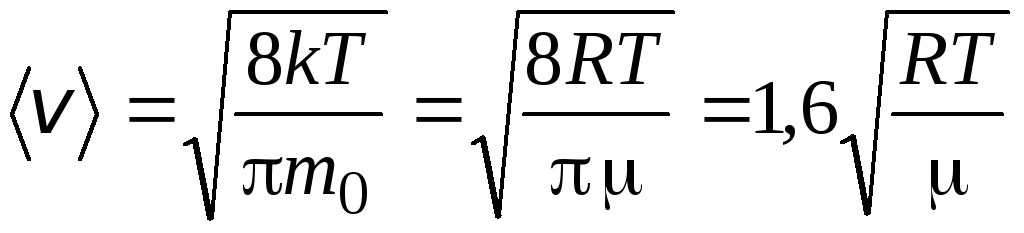 .
.
Viteza RMS
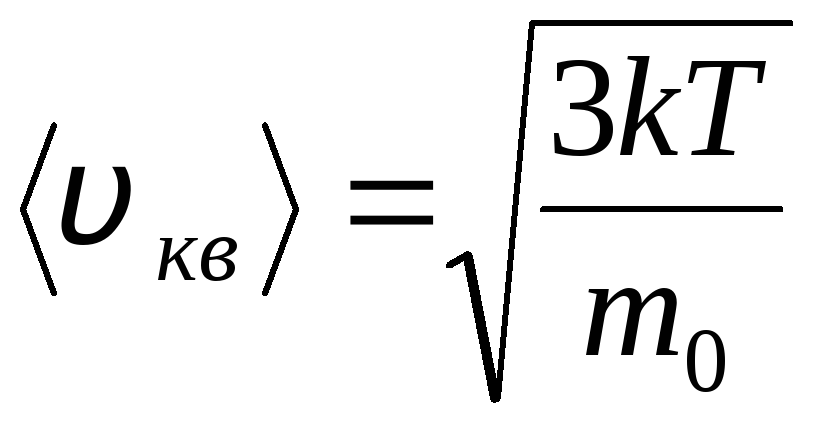 =
1,73
=
1,73 .
.
Raportul acestor viteze nu depinde nici de temperatură, nici de tipul de gaz.
Funcția de distribuție a moleculelor prin energia mișcării termice. Această funcție poate fi obținută prin înlocuirea valorii energiei cinetice în ecuația de distribuție moleculară (1.15) în loc de viteză:
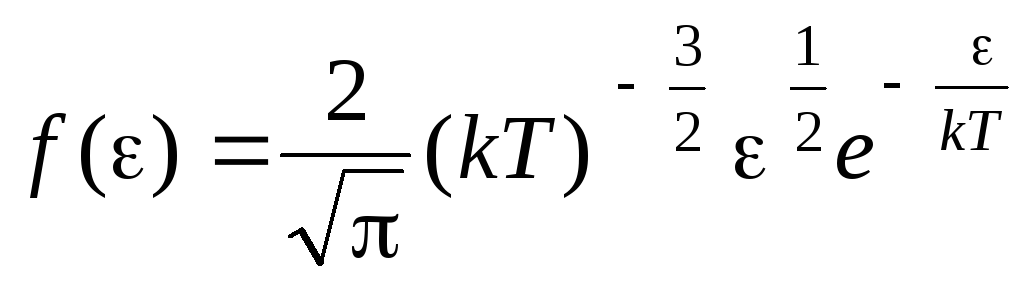 .
.
Avand integrat expresia peste valorile energetice de la  inainte de
inainte de 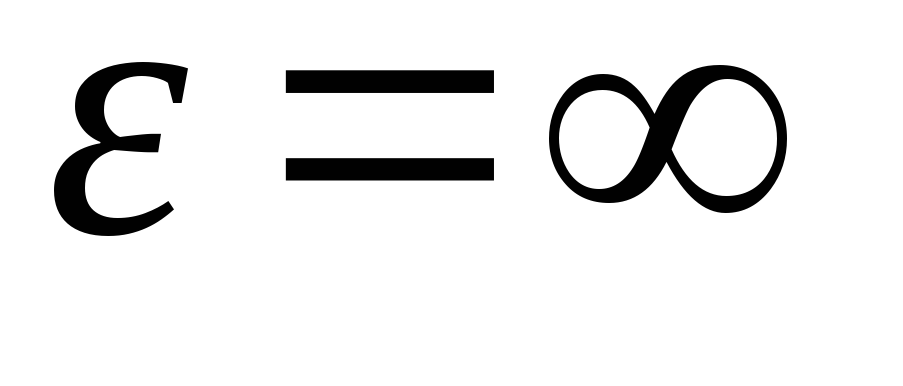
 , primim energie cinetică medie molecule de gaz ideal:
, primim energie cinetică medie molecule de gaz ideal:
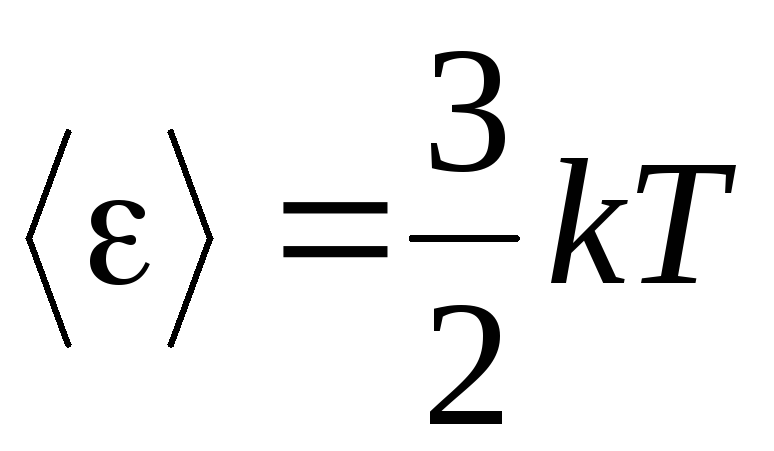 .
.
Formula barometrică. Distribuția Boltzmann. La derivarea ecuației de bază a teoriei cinetice moleculare a gazelor și a distribuției vitezei Maxwell a moleculelor, sa presupus că moleculele unui gaz ideal nu sunt acționate de forțe externe, prin urmare moleculele sunt distribuite uniform pe întregul volum. Cu toate acestea, moleculele oricărui gaz se află în câmpul gravitațional al Pământului. Când se derivă legea presiunii în funcție de înălțime, se presupune că câmpul gravitațional este uniform, temperatura este constantă și masa tuturor moleculelor este aceeași:
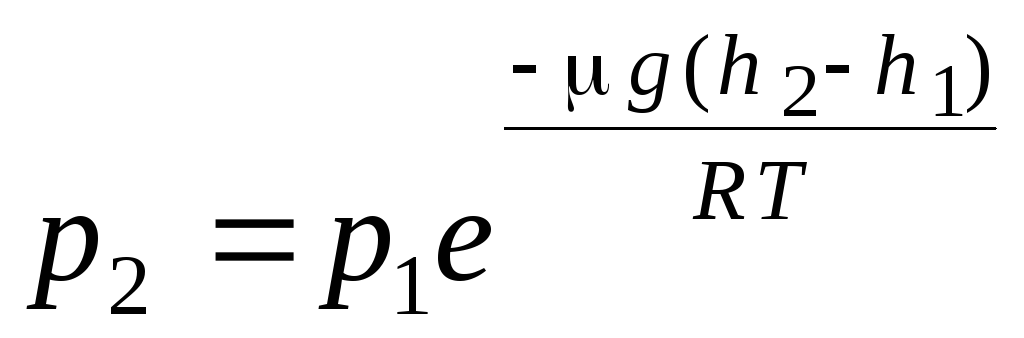 . (1.16)
. (1.16)
Se numește expresia (1.16). formula barometrică. Vă permite să găsiți presiunea atmosferică în funcție de altitudine, sau măsurând presiunea puteți găsi altitudinea. Deoarece h 1 este altitudinea deasupra nivelului mării la care presiunea este considerată normală, atunci expresia poate fi modificată:
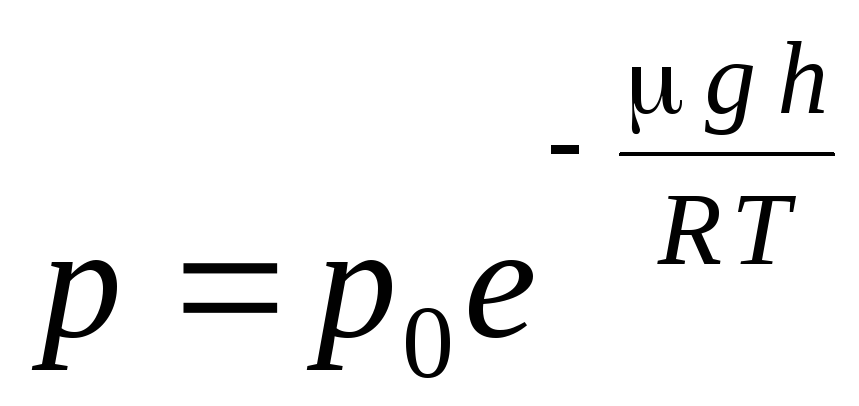 .
.
Formula barometrică poate fi convertită folosind expresia p = nkT:
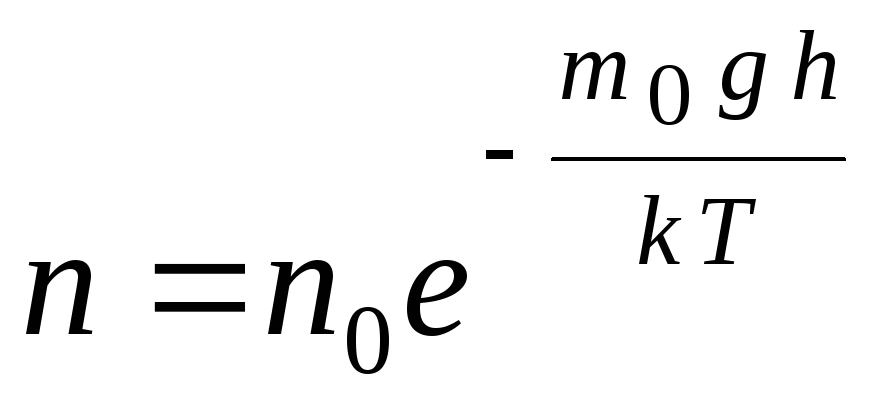 ,
,
G  de n
–
concentrația de molecule la înălțime h,
m 0
gh=P–
energia potențială a unei molecule într-un câmp gravitațional. La temperatură constantă, densitatea gazului este mai mare acolo unde energia potențială a moleculei este mai mică. Grafic, legea scăderii numărului de particule pe unitate de volum cu înălțime arată așa cum se arată în Fig. 1.7.
de n
–
concentrația de molecule la înălțime h,
m 0
gh=P–
energia potențială a unei molecule într-un câmp gravitațional. La temperatură constantă, densitatea gazului este mai mare acolo unde energia potențială a moleculei este mai mică. Grafic, legea scăderii numărului de particule pe unitate de volum cu înălțime arată așa cum se arată în Fig. 1.7.
Pentru un câmp de potențial extern arbitrar scriem următoarea expresie generală
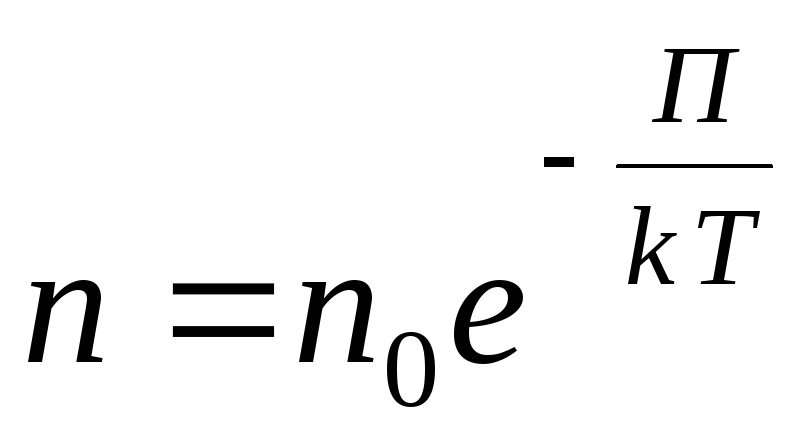 ,
,
