amestecuri de gaze. Capacitatea termică a gazelor. Combustibil, amestecuri de gaze și capacitatea de căldură
1.3. Ecuația de stare a gazelor ideale
Forma ecuațiilor de stare (1.1) pentru substanțele reale este destul de complicată.
În acest sens, modelele fizice simplificate ale corpurilor de lucru sunt utilizate în termodinamică.
Pentru fluidele de lucru în stare gazoasă, cel mai simplu și din punct de vedere istoric este primul model gaz ideal. Un gaz ideal este un gaz în care forțele interacțiunii intermoleculare (atracție și repulsie) sunt absente, iar moleculele în sine sunt considerate ca puncte materiale. Un gaz ideal se supune ecuația Claiperon– Mendeleev
Unde m este masa gazului din sistem; μ este masa molară a gazului; Rμ = 8314 J/(kmol K) este constanta universală a gazului, care nu depinde de tipul gazului sau de condițiile de existență a acestuia. Ecuația de stare (1.2) se obține prin combinare Legile Boyle-Mariotteși Gay Lussac luând în considerare legea lui Avogadro.
Masă molară μ = m/n, kg/mol, este masa unei substanțe luate în cantitate de un mol. 1 mol este o unitate a cantității de substanță care conține tot atâtea particule cât 12 grame de carbon. Cantitate de substanță– n = N/N A, cârtiță, unde N este numărul de particule (atomi, molecule), N A ≈ 6,02 10 23 - numărul de atomi în 12 grame de carbon ( numărul lui Avogadro). Numeric μ = Мr 10 -3 , unde Mr este greutatea moleculară relativă a substanței ( fila. Mendeleev) (de exemplu: =2 kg/kmol).
În termeni specifici (adică pentru 1 kg de gaz), ecuația (1.2) va avea forma
Unde R– constanta specifică a gazului, J/(kg K).
Să explicăm semnificația fizică a constantei specifice de gaz R. Pentru prima stare ecuația (1.2) se va scrie ca , pentru a doua stare la aceeași presiune - . Scădeți prima ecuație din a doua ecuație și găsiți că , i.e. Constanta specifică a gazului este munca efectuată de 1 kg de gaz atunci când este încălzit cu 1 grad la presiune constantă.
Datele experimentale arată că un gaz real este mai aproape de unul ideal, cu atât densitatea lui este mai mică. Cu alte cuvinte, cu o scădere a volumului unei cantități date de gaz, cauzată de o creștere a presiunii sau o scădere a temperaturii, orice gaz va da din ce în ce mai multe abateri de la proprietățile unui gaz ideal. Astfel, sub conceptul de „gaz ideal” se potrivesc toate gazele reale la temperaturi ridicate și presiuni scăzute.
1.4. Amestecuri gaze ideale
În practică, fluidul de lucru este adesea un amestec de gaze omogene (de exemplu, aer), fiecare dintre acestea putând fi considerat ideal și care nu intră în reacții chimice.
Un astfel de amestec este, de asemenea, un gaz ideal și respectă ecuația de stare (1.2) pentru amestec.
Unde R=R μ / μ este constanta de gaz a amestecului; μ este masa molară medie (aparentă) a amestecului(o valoare condiționată referitoare la un gaz reprezentativ omogen, în care numărul de molecule și masa totală sunt egale cu numărul de molecule și masa amestecului).
Masa amestecului este egală cu masa tuturor componentelor constitutive
Legea principală care determină comportamentul unui amestec de gaze este legea lui Dalton:
fiecare gaz individual se comportă într-un amestec de gaze ca și cum singur, la temperatura amestecului, ocupă întregul volum al amestecului,
fiecare gaz individual care intră în amestecul de gaze are aceeași presiune pe care ar avea-o dacă singur ar ocupa întregul volum al amestecului de gaze.
De aici și valoarea R(presiunea absolută a amestecului) este definită ca
Unde R i – presiune parțială i a-a componentă, adică presiune care ar i componenta, dacă singura a ocupat întregul volum al amestecului la aceeași temperatură ().
Compoziția amestecului este dată de fracțiunile masice sau molare ale componentelor constitutive ale amestecului, precum și de fracțiuni de volum (concentrații).
Fractiune in masa este raportul dintre masa fiecărui gaz și masa totală a amestecului: .
Ecuația (1.3) implică faptul că .
Fracție de volum se numeste raport volum parțial(volumul pe care l-ar ocupa gazul dacă presiunea și temperatura acestuia ar fi egale cu presiunea și temperatura amestecului de gaze, adică) cu volumul total al amestecului de gaze: . Din definițiile presiunii parțiale și ale volumului și ale constantei temperaturii, rezultă:
![]() (1.5)
(1.5)
Însumând ultima egalitate peste toate componentele amestecului, obținem , i.e. suma volumelor parțiale ale gazelor care alcătuiesc amestecul este egală cu volumul amestecului de gaze.
Suma fracțiilor de volum este egală cu unu: .
fracție molară componentă se numește raportul dintre cantitatea de substanță a fiecărui gaz n i la cantitatea de substanţă a amestecului de gaze n. Din relaţiile şi şi legea lui Avogadro(în volume egale de gaze ideale diferite, la aceleași temperaturi și aceleași presiuni, sunt incluse un număr egal de molecule, adică) urmează:
acestea. specificarea unui amestec prin fracții molare este echivalentă cu specificarea fracțiilor sale de volum.
Fracțiile de masă și volum sunt legate prin raportul:
![]() .
.
Dacă amestecul este dat de fracții de masă g i, apoi constanta de gaz a amestecului și masa molară a amestecului se calculează după cum urmează:
![]()
![]()
Dacă amestecul este dat de fracţiuni de volum r i, atunci formulele de calcul a masei molare a amestecului și a constantei de gaz a amestecului sunt următoarele:
![]() (1.6)
(1.6)
Presiunile parțiale și volumele de gaze sunt determinate de legea lui Boyle–marriotte(la o temperatură constantă a gazului, produsul dintre presiunea gazului și volumul acestuia este o valoare constantă, adică):
![]() .
.
întrebări de test
Sistemul Internațional de Unități (SI) și unitățile sale de bază.
Parametrii termodinamici de bază și dimensiunile acestora.
Ce se înțelege prin starea de echilibru a unui sistem termodinamic?
Conceptul de stări de echilibru și de neechilibru.
Care este ecuația de stare a unui sistem?
Interpretarea geometrică a stării sistemului, proces termodinamic.
Ce este un gaz ideal? Care este diferența dintre un gaz ideal și unul real?
Care este constanta gazului? Semnificația sa fizică, dimensiunea și metodele de definire.
2. Capacitate termică
Mesajul de căldură către corpul de lucru în orice proces provoacă o schimbare a stării sale și, în cazul general, este însoțit de o schimbare a temperaturii. Modificarea temperaturii, precum și orice alt parametru al stării fluidului de lucru, nu depinde de tipul procesului, ci depinde de inițial ( 1 ) și final ( 2 ) afirmă, i.e. (pentru un proces elementar, modificarea unui parametru este înlocuită cu diferenţialul acestuia).
Raportul dintre cantitatea de căldură δ Q comunicate organismului la o modificare a temperaturii corpului dTîntr-un proces termodinamic elementar se numeşte capacitate termică adevărată corpuri în acest proces:
Indicele indică aici faptul că capacitatea de căldură, ca și căldura, depinde de natura procesului. În plus, capacitatea termică depinde de cantitatea corpului și de starea termodinamică a acestuia. De asemenea, trebuie remarcat faptul că în acest proces compoziția chimică a corpului nu se modifică, nu există nicio tranziție a unei substanțe de la o stare de agregare la alta, nu există dizolvarea componentelor etc.
În funcție de unitatea de măsură aleasă a unei substanțe, se disting capacitățile termice specifice de masă, volum și molare:
Conceptul de capacitate termică în masă este cel mai des folosit în practică.
2.1. Capacitate termică adevărată și medie
Capacitatea termică a unei substanțe reale nu este o valoare constantă. Se modifică cu temperatura, iar această dependență poate fi foarte semnificativă (Fig. 2.1).
Cantitatea specifică de căldură de proces este calculată prin formula
Pentru a determina această valoare sunt utilizate următoarele metode:
conform rezultatelor experimentului, dependența capacității termice de temperatură este reprezentată ca polinom de aproximare
unde sunt coeficienții de aproximare. Acești coeficienți sunt indicați în literatura de referință. Apoi
în calcule practice în domeniul de temperatură t 1 , t 2 capacitatea termică este considerată o valoare constantă egală cu
numit capacitate termică medieîn acest interval, spre deosebire de capacitatea termică adevărată introdusă în (2.1). Datele de referință oferă capacități termice medii de la 0 la temperatura fixă t obţinută empiric, adică
Capacitate termică medie în domeniul de temperatură t 1 , t 2 conform acestor date de referință pot fi calculate prin formula
Apoi cantitate specifică căldura de proces este definită ca
2.2. Capacități termice izocorice și izobare
sunt de mare importanță în termodinamică.
izocoriccapacitate termică
egal cu raportul dintre cantitatea de căldură din proces la un volum constant și modificarea temperaturii corpului,
izobariccapacitate termică
egal cu raportul dintre cantitatea de căldură din proces la presiune constantă și modificarea temperaturii corpului.
În calculele de inginerie termică se folosesc tabele care listează valorile numerice obținute experimental ale capacităților termice izobare și izocorice specifice pentru diferite substanțe în funcție de temperatură.
2.3. Capacitatea termică a amestecurilor de gaze
În calcule, este adesea necesar să se ocupe de amestecuri de gaze, iar capacitățile termice sunt date în tabele numai pentru gaze individuale.
Dacă amestecul de gaze este dat de fracții de masă g i, atunci capacitățile termice specifice masei ale amestecului sunt determinate de formule
![]()
Dacă amestecul de gaze este dat de fracţiuni de volum r i, atunci capacitățile termice volumetrice specifice ale amestecului sunt determinate de formule
![]()
întrebări de test
Notați unitățile de capacitate termică specifică.
Cum este introdus conceptul de capacitate termică medie?
3. Legea conservării și transformării energiei
Conceptul de energie este asociat cu mișcarea materiei.
Energia poate lua multe forme - lucru mecanic, căldură, energie chimică, energia câmpurilor electrice și magnetice.
Într-un proces termodinamic, interacțiunea dintre mediu și un sistem termodinamic închis se realizează prin schimbul de energie sub formă de căldură și lucru mecanic.
3.1. Energie interna
Orice mediu are o anumită marjă energie internaU(J), care în termodinamica tehnică este reprezentată ca suma energiilor cinetice și potențiale ale moleculelor și atomilor mediului. Energia cinetică a acestor particule este determinată de viteza și masa lor, în timp ce energia potențială este determinată de forțele de interacțiune dintre ele, care depind de poziția lor relativă. Energia internă a unui sistem este energia conținută în sistemul însuși. Aceasta înseamnă că energia internă poate caracteriza starea corpului împreună cu cantitățile R, V, T.
Energia internă are proprietatea de aditivitate, adică. energia internă a unui sistem complex este egală cu suma energiilor interne ale părților sale constitutive:
Energia internă a 1 kg dintr-o substanță se numește energie internă specifică u= U/ m (J/kg).
Pentru majoritatea aplicațiilor tehnice ale termodinamicii, nu valoarea absolută contează U, dar modificarea acestei valori. Prin urmare, definiția cantitativă a energiei interne a unui sistem omogen este adesea determinată în raport cu o stare standard aleasă în mod convențional.
3.2. Legea conservării energiei în termodinamică
Efectuând un proces termodinamic, un sistem închis interacționează cu mediul extern (corpuri și câmpuri externe), adică. schimbă energie. În termodinamica tehnică sunt luate în considerare două tipuri de transfer de energie - prin transferul de căldură și prin efectuarea lucrărilor mecanice.
Transferul de căldură are loc între corpuri de temperaturi diferite și aduse în contact, sau între corpuri cu temperaturi diferite, situate la distanță, prin intermediul undelor electromagnetice ( Radiație termala). Difuzare căldură apare la nivel molecular (microfizic) fără mișcarea vizibilă a corpurilor.
Transferul de energie sub formă de muncă are loc odată cu mișcarea întregului corp sau a unei părți a acestuia în spațiu. Cu această metodă, corpul fie se mișcă într-un câmp de forță, fie își schimbă volumul sub influența presiunii externe. Muncă este o formă macrofizică de transfer de energie.
Trebuie remarcat faptul că căldura și munca, spre deosebire de energia unui corp, nu sunt funcții ale stării sale, ci depind de tipul procesului, determină acest proces, adică. sunt funcții ale procesului în sine.
Numeroase experimente și observații au condus la descoperirea unei legi fundamentale a naturii - legea conservării energiei: energia din natură nu ia naștere din nimic și nu dispare, sau cantitatea de energie este neschimbată, se schimbă doar de la o formă la alta, sau
Unde Q este căldura implicată în proces; L- munca in curs de desfasurare; Δ E este schimbarea energiei sistemului. Aici și mai jos, suntem de acord să luăm în considerare:
muncă pozitiv dacă această muncă este efectuată de corpul de lucru, și negativ, dacă se lucrează la corpul de lucru al sistemului;
căldură furnizată corpului pozitiv, iar cel alocat - negativ
în plus, o modificare a oricărui parametru de stare în procesul final va fi notat cu simbolul Δ (delta), iar în procesul elementar - d(diferențial parametrului corespunzător). În orice proces termodinamic final, modificarea parametrului de stare (presiune, temperatură, energie internă, entalpie, entropie etc.) nu depinde de tipul procesului, ci este determinată de stările inițiale și finale.
În general, un sistem termodinamic are o energie internă U, energie cinetică (în termodinamică, sistemul este considerat ca un întreg care se mișcă cu o viteză w) – mw 2/2, potential - mgz (z este înălțimea la care se află sistemul). Modificarea energiei totale în proces 1 –2 poate fi imaginat ca:
Munca depusă în acest proces este suma muncii L despre, asociat cu o modificare a volumului fluidului de lucru al sistemului (lucru de deformare), lucru L dv despre mișcarea sistemului în spațiu, munca tehnica L cei (la deplasarea sistemului în diverse dispozitive tehnice, de exemplu, într-un motor, cazan de abur, compresor etc.), lucrează împotriva forțelor de frecare L tr:
L \u003d L despre + L dv + L acelea + L tr.
Căldura implicată în proces este suma căldurii Q extern, implicat în schimbul cu mediul extern, și căldura de frecare Q tr:
Q = Q extern + Q tr.
Dat fiind Q tr = L tr (numerele experimente au arătat că munca debitului cheltuită pentru depășirea frecării este complet convertită în căldură percepută de curgere), legea conservării energiei în termodinamică pentru 1 kg dintr-o substanță omogenă de lucru (adică, în valori specifice masei ) într-un proces elementar se poate scrie:
![]() , (3.1)
, (3.1)
(indexul extern a fost omis ca fiind inutil).
Trebuie subliniat că în partea dreaptă a (3.1) sub semnul diferenţialului se află funcţii de stare, iar restul sunt mărimi care depind de natura procesului termodinamic. Deoarece munca și căldura sunt funcții ale procesului, și nu funcții ale stării, semnul δ denotă doar faptul că într-un proces elementar mărimile care îl urmează sunt infinitezimale arbitrare și nu incremente ale oricărei funcții specifice. Astfel, δ qşi δ l-cantități elementare de căldură și muncă (adică corespunzătoare modificărilor infinitezimale ale stării sistemului).
Dacă sistemul termodinamic nu își schimbă poziția în spațiu și singurul tip de lucru este munca asociată cu o modificare a volumului sistemului, atunci ecuația (3.1) ia o formă mai simplă:
Iov δ l despre se efectuează fie împotriva forțelor presiunii externe și, apoi, volumul fluidului de lucru se extinde, fie, dimpotrivă, mediul extern efectuează lucru asupra corpului, comprimându-l. Pentru procesele de echilibru, când presiunea mediului este egală cu presiunea din fluidul de lucru, acest lucru se calculează ca Rdv, Unde v este volumul specific al substanței de lucru.
Ecuația
numit prima lege a termodinamicii: căldura furnizată unui sistem termodinamic închis în repaus este cheltuită pentru modificarea energiei interne a sistemului și pentru a lucra pentru a modifica volumul sistemului. Relația de echilibru (3.2) se mai numește și prelegeri pe literatura teoretică. 1. Baroc: ...
L. A. Eliseeva © Instituția de știință bugetară de stat federală Biblioteca publică științifică și tehnică de stat a filialei din Siberia a Academiei Ruse de Științe, 2013
IndicatorPlimbări aleatorii / A.N. Borodin, I. A. Ibragimov; sub... 241. Dorogokupets P.I. Termodinamica minerale și echilibre minerale ... cataloage: compendiu prelegeri pe curs „Referință... stat tehnic universitate. Serie, Tehnicştiinţă. -...
N. V. Basova [și alții];ed. N. V. Basova. Rostov n/a: Phoenix, 2008
ManualCurs) Scris D. T. Sinopsis prelegeri pe matematică superioară [Text]: ... Tehnic termodinamica Rudobashta, S.P. Inginerie termică [Text]: manual pentru studenți. universități care studiază pe... 2008. - 204 p. zece Borodin, I. F. Automatizarea proceselor tehnologice...
Lista lucrărilor științifice ale Trezoreriei pentru perioada 2008 - 1 iunie 2013 (1)
Document... „Metode de cercetare cu raze X” Prelegeri pe oncologie clinică. Almaty... a celei de-a doua legi termodinamica» 2-International... si revizuire de specialitate tehnic echiparea organizațiilor medicale ... Academician al Academiei Ruse de Științe Medicale Yu.I. Borodin, Bishkek, 2009, p. ...
În practica inginerească, de multe ori trebuie să ne confrunți nu cu gaze omogene, ci cu amestecuri de gaze neînrudite chimic. Exemple de amestecuri de gaze sunt: aerul atmosferic, gazele naturale, produsele gazoase de ardere a combustibililor etc.
Pentru amestecurile de gaze sunt valabile următoarele prevederi.
1. Fiecare gaz care intră în amestec are o temperatură, egal cu temperatura amestecuri.
2. Oricare dintre gazele incluse în amestec este distribuită în întregul volum al amestecului și, prin urmare, volumul fiecărui gaz este egal cu volumul întregului amestec.
3. Fiecare dintre gazele incluse în amestec respectă propria ecuație de stare.
4. Amestecul în ansamblu este ca un gaz nou și se supune propriei sale ecuații de stare.
Studiul amestecurilor de gaze se bazează pe legea lui Dalton, conform căreia, la o temperatură constantă, presiunea amestecului este egală cu suma presiunilor parțiale ale gazelor incluse în amestec:
unde p cm este presiunea amestecului;
p i - presiunea parțială a gazului i-lea inclus în amestec;
n este numărul de gaze incluse în amestec.
Presiunea parțială este presiunea pe care gazul care intră în amestec o va exercita dacă singur ocupă întregul volum al amestecului la aceeași temperatură.
Metode de fixare a amestecurilor de gaze
Compoziția amestecului de gaze poate fi specificată prin masă, volum și fracțiuni molare.
Fracții de masă. Fracția de masă a oricărui gaz inclus în amestec este raportul dintre masa acestui gaz și masa amestecului.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ..........; m n \u003d M n / M cm,
unde m 1 , m 2 , ..., m n - fracțiuni de masă ale gazelor;
M 1 , M 2 , ..., M n - mase de gaze individuale;
M cm este masa amestecului.
Este ușor să vezi asta  și
și  (100%).
(100%).
Cotări de volum. Fracția de volum a oricărui gaz inclus în amestec este raportul dintre volumul redus (parțial) al acestui gaz și volumul amestecului.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
unde V 1 , V 2 , ..., V n - volume reduse de gaze;
V cm este volumul amestecului;
r 1 , r 2 , ..., r n - fracțiunile de volum ale gazelor.
Volumul redus este volumul de gaz în condițiile amestecului (la temperatura și presiunea amestecului).
Volumul redus poate fi reprezentat astfel: dacă toate gazele, cu excepția unuia, sunt îndepărtate din vasul care conține amestecul, iar gazul rămas este comprimat la presiunea amestecului menținând temperatura, atunci volumul acestuia va fi redus sau parțial.
Se poate dovedi că volumul amestecului va fi egal cu suma volumelor reduse de gaze.
 (100%).
(100%).
Fracții molare. Fracția molară a oricărui gaz dintr-un amestec este raportul dintre numărul de kilomoli ai acestui gaz și numărul de kilomoli din amestec.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
unde r 1 , r 2 , ..., r n - fracții molare ale gazelor;
n cm este numărul de kilomoli ai amestecului;
n 1 , n 2 , ..., n n este numărul de kilomoli de gaze.
Specificarea unui amestec după fracții molare este identică cu specificarea unui amestec după fracții de volum, adică fracțiile molare și de volum au aceleași valori numerice pentru fiecare gaz inclus în amestec.
Constantele gazului și greutatea moleculară aparentă (medie) a amestecului. Pentru a calcula constanta amestecului de gaze dată de fracțiile de masă, scriem ecuațiile de stare:
pentru amestec
p cm × V cm = M cm R cm T; (1,9)
pentru gaze
 .
(1.10)
.
(1.10)
Însumăm părțile din stânga și din dreapta ecuațiilor (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
pentru că  ,
,
atunci p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
Ecuațiile (1.9) și (1.11) implică faptul că
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M1R1 + m2R2 + ...... + mn R n
sau  ,
(1.12)
,
(1.12)
unde R cm este constanta de gaz a amestecului.
Deoarece constanta de gaz a gazului i-lea
R i = 8314 / m i ,
atunci ecuația (1.12) este rescrisă după cum urmează:
 .
(1.13)
.
(1.13)
Atunci când se determină parametrii unui amestec de gaze, este convenabil să se utilizeze o anumită valoare condiționată numită greutate moleculară aparentă (medie) a amestecului de gaze. Conceptul de greutate moleculară aparentă a unui amestec ne permite să considerăm în mod convențional amestecul ca un gaz omogen, ceea ce simplifică foarte mult calculele.
Pentru un gaz separat, expresia
Prin analogie, pentru un amestec, putem scrie
m cm R cm = 8314, (1,14)
unde m cm este greutatea moleculară aparentă a amestecului.
Din ecuația (1.14), folosind expresiile (1.12) și (1.13), obținem
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Argumentând astfel, se pot obține formule de calcul a R cm și m cm prin fracții de volum, formule de conversie a fracțiilor de masă în fracții de volum și, invers, fracții de volum în fracții de masă, formule de calcul al volumului specific al unui amestec u cm și densitatea amestecului r cm prin fracții de masă și volum și, în final, formule de calcul a presiunilor parțiale ale gazelor incluse în amestec, prin fracții de volum și de masă. Prezentăm aceste formule fără derivare în tabel.
Formule pentru calcularea amestecurilor de gaze
|
Stabilirea compoziției amestecului |
Transfer de la o compoziție la alta |
Densitatea și volumul specific al amestecului |
Greutatea moleculară aparentă a amestecului |
Amestecul gazos constant |
Presiune parțială |
|
Fracții de masă |
|
|
|
|
|
|
Fracții de volum |
|
|
|
|
|
Capacitatea termică a gazelor
Capacitatea termică a unui corp este cantitatea de căldură necesară pentru încălzirea sau răcirea corpului cu 1 K. Capacitatea termică a unei cantități unitare de substanță se numește capacitatea termică specifică.
Deci, capacitatea termică specifică a unei substanțe este cantitatea de căldură care trebuie transmisă sau scăzută dintr-o unitate a unei substanțe pentru a-și schimba temperatura cu 1 K în acest proces.
Deoarece în cele ce urmează vor fi luate în considerare numai capacități termice specifice, ne vom referi la capacitatea termică specifică pur și simplu ca capacitate termică.
Cantitatea de gaz poate fi dată de masă, volum și număr de kilomoli. Trebuie remarcat faptul că la setarea unui volum de gaz, acest volum este adus la condiții normale și măsurat în metri cubi normali (nm 3).
În funcție de metoda de setare a cantității de gaz, se disting următoarele capacități termice:
c - capacitatea termică de masă, J / (kg × K);
c¢ - capacitatea termică volumetrică, J / (nm 3 × K);
c m - capacitatea de căldură molară, J / (kmol × K).
Între aceste capacități termice există următoarele relații:
c = c m / m; cu m = cu × m;
с¢ = с m / 22,4; cu m = s¢ × 22,4,
de aici  ; s¢ = s × r n,
; s¢ = s × r n,
unde u n și r n - volum specific și densitate în condiții normale.
Capacități termice izocorice și izobare
Cantitatea de căldură transmisă fluidului de lucru depinde de caracteristicile procesului termodinamic. Două tipuri de capacitate termică au importanță practică în funcție de procesul termodinamic: izocor și izobar.
Capacitatea termică la u = const este izocoră.
c u - capacitate termică izocorică de masă,
c¢ u este capacitatea termică izocoră volumetrică,
cm u este capacitatea termică izocorică molară.
Capacitatea termică la p = const este izobară.
c p - capacitatea termică izobară de masă,
c¢ р - capacitatea termică izobară volumetrică,
c m p - capacitatea termică izobară molară.
Cu aceeași modificare de temperatură în procesul efectuat la p = const, se consumă mai multă căldură decât în procesul la u = const. Acest lucru se explică prin faptul că la u = const căldura transmisă corpului este cheltuită doar pentru modificarea energiei sale interne, în timp ce la p = const căldura este cheltuită atât pentru creșterea energiei interne, cât și pentru efectuarea lucrării de dilatare. Diferența dintre capacitățile de căldură izobară de masă și izocoră de masă conform ecuației Mayer
c p - c u=R. (1,17)
Dacă părțile stânga și dreaptă ale ecuației (1.17) sunt înmulțite cu masa kilomol m, atunci obținem
c m p - c m u= 8314 J/(kmol×K) (1,18)
În termodinamică și aplicațiile sale, raportul dintre capacități termice izobare și izocorice este de mare importanță:
 ,
(1.19)
,
(1.19)
unde k este exponentul adiabatic.
Calculele arată că pentru gazele monoatomice k » 1,67, gazele diatomice k » 1,4 și gazele triatomice k » 1,29.
Este ușor de observat că valoarea la dependent de temperatură. Într-adevăr, din ecuațiile (1.17) și (1.19) rezultă că
 ,
(1.20)
,
(1.20)
și din ecuațiile (1.18) și (1.19)
 .
(1.21)
.
(1.21)
Deoarece capacitățile termice cresc odată cu creșterea temperaturii gazului, valoarea lui k scade, apropiindu-se de unitate, dar rămâne întotdeauna mai mare decât aceasta.
Cunoscând valoarea lui k, se poate determina valoarea capacității termice corespunzătoare. Deci, de exemplu, din ecuația (1.20) avem
 ,
(1.22)
,
(1.22)
iar din moment ce cu p = k × s u, apoi primim
 .
(1.23)
.
(1.23)
În mod similar, pentru capacitățile de căldură molare, din ecuația (1.21) obținem
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Capacitate termică medie și reală
Capacitatea termică a gazelor depinde de temperatură și, într-o oarecare măsură, de presiune. Dependența capacității termice de presiune este mică și este neglijată în majoritatea calculelor. Dependența capacității termice de temperatură este semnificativă și trebuie luată în considerare. Această dependență este exprimată destul de exact prin ecuație
c = a + în t + et 2 , (1,26)
unde un, înși e sunt valori care sunt constante pentru un anumit gaz.
Adesea, în calculele de inginerie termică, dependența neliniară (1.26) este înlocuită cu una liniară:
c = a + în t. (1,27)
|
Dacă construim grafic dependența capacității termice de temperatură conform ecuației (1.26), atunci aceasta va fi o dependență curbilinie (Fig. 1.4). După cum se arată în figură, fiecare valoare a temperaturii are propria sa valoare a capacității termice, care este denumită în mod obișnuit capacitatea de căldură reală. Din punct de vedere matematic, expresia pentru capacitatea termică reală se scrie după cum urmează:
|
|
|
|
Prin urmare, capacitatea de căldură adevărată este raportul dintre o cantitate infinitezimală de căldură dq și o modificare infinitezimală a temperaturii dt. Cu alte cuvinte, adevărata capacitate termică este capacitatea termică a gazului la o anumită temperatură. Pe fig. 1.4, capacitatea termică reală la o temperatură t 1 este indicată cu t1 și este reprezentată ca un segment 1-4, la o temperatură t 2 - cu t2 și este reprezentată ca un segment 2-3. Din ecuația (1.28) obținem dq=cdt. (1,29) În calculele practice, determinăm întotdeauna cantitatea de căldură la schimbarea finală |
temperatura. Este evident că cantitatea de căldură q, care este raportată la o cantitate unitară a unei substanțe atunci când este încălzită de la t 1 la t 2, poate fi găsită prin integrarea (1.29) de la t 1 la t 2.
 .
(1.30)
.
(1.30)
Grafic, integrala (1.30) este exprimată prin aria 4-1-2-3. Dacă în expresia (1.30) înlocuim valoarea capacității termice adevărate în funcție de dependența liniară (1.27), atunci obținem
 (1.31)
(1.31)
Unde  - capacitate termică medie în domeniul de temperatură de la t 1 la t 2.
- capacitate termică medie în domeniul de temperatură de la t 1 la t 2.
 ,
(1.32)
,
(1.32)
Prin urmare, capacitatea medie de căldură este raportul dintre cantitatea finală de căldură q și modificarea finală a temperaturii t 2 - t 1:
 .
(1.33)
.
(1.33)
Dacă, pe baza lui 4-3 (Fig. 1.4), se construiește un dreptunghi 4-1¢-2¢-3, egal ca dimensiune cu figura 4-1-2-3, atunci înălțimea acestui dreptunghi va să fie egală cu capacitatea termică medie, unde  este în intervalul de temperatură t 1 - t 2 .
este în intervalul de temperatură t 1 - t 2 .
De obicei, valorile capacităților termice medii sunt date în tabelele cu proprietățile termodinamice ale substanțelor. Cu toate acestea, pentru a reduce volumul acestor tabele, ele furnizează valorile capacităților termice medii determinate în intervalul de temperatură de la 0 ° C la t ° C.
Dacă este necesar să se calculeze valoarea capacității termice medii într-un interval de temperatură dat t 1 - t 2, atunci acest lucru se poate face după cum urmează.
Aria 0a14 sub curba c \u003d f (t) (Fig. 1.4) corespunde cantității de căldură q 1 necesară pentru a crește temperatura gazului de la 0 ° C la t 1 ° C.

În mod similar, aria 0a23 corespunde lui q 2 când temperatura crește de la 0 o C la t 2 o C:

Astfel, q \u003d q 2 - q 1 (zona 4123) poate fi reprezentat ca
![]() (1.34)
(1.34)
Înlocuind valoarea lui q conform (1.34) în expresia (1.33), obținem formula pentru capacitatea termică medie în orice interval de temperatură:
 .
(1.35)
.
(1.35)
Astfel, capacitatea termică medie poate fi calculată din capacitățile termice medii tabelare folosind ecuația (1.35). Mai mult, obținem o dependență neliniară c = f(t). De asemenea, puteți găsi capacitatea termică medie folosind ecuația (1.32) folosind o relație liniară. Valorile a și înîn ecuaţia (1.32) pentru diferite gaze sunt date în literatură.
Cantitatea de căldură furnizată sau îndepărtată din fluidul de lucru poate fi calculată folosind oricare dintre ecuațiile:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
Unde 

 - respectiv, masa medie, volumul și capacitatea de căldură molară; M este masa gazului; n este numărul de kilomoli de gaz; V n - volumul de gaz în condiții normale.
- respectiv, masa medie, volumul și capacitatea de căldură molară; M este masa gazului; n este numărul de kilomoli de gaz; V n - volumul de gaz în condiții normale.
Volumul gazului V n poate fi găsit după cum urmează. După ce am scris ecuația de stare pentru condițiile date: pV = MRT și pentru condiții normale: p n V n = MRT n, atribuim a doua ecuație primei:
 ,
,
de aici  .
(1.39)
.
(1.39)
Capacitatea termică a amestecurilor de gaze
Capacitatea termică a unui amestec de gaze poate fi calculată dacă este dată compoziția amestecului și sunt cunoscute capacitățile termice ale componentelor incluse în amestec.
Pentru a încălzi un amestec de masă M cm cu 1 K, temperatura fiecăruia dintre componente trebuie, de asemenea, crescută cu 1 K. În același timp, cantitatea de căldură egală cu c i M i este cheltuită pentru încălzirea i-a componentă a amestecului cu masa М i . Pentru întregul amestec, cantitatea de căldură  ,
,
unde c i și c cm sunt capacitățile termice masice ale i-a componentă și amestec.
Împărțind ultima expresie la M cm, obținem formula de calcul pentru capacitatea termică în masă a amestecului:
 ,
(1.40)
,
(1.40)
unde m i este fracția de masă a componentei i.
Argumentând în mod similar, găsim capacitatea termică volumetrică c¢ cm și capacitatea termică molară c m cm a amestecului:
 (1.41)
(1.41)
unde c¢ i - capacitatea termică volumetrică a componentei i, r i - fracția de volum a componentei i;
 ,
(1.42)
,
(1.42)
unde c m i este capacitatea de căldură molară a componentei i,
r i - fracțiunea molară (volum) a componentei i-a.
În motoarele termice (mașini), fluidul de lucru este un amestec de diferite gaze. Dacă componentele amestecului nu intră în reacții chimice între ele și fiecare componentă respectă ecuația de stare Claiperon, atunci un astfel de amestec este considerat un gaz ideal.
Pentru a calcula amestecul, este necesar să se determine μ cm - masa molară medie și R c m - constanta specifică de gaz a amestecului. Pentru determinarea acestora este necesar să se cunoască compoziția amestecului, adică ce componente și în ce cantități formează acest amestec, ce parametri are fiecare component inclus în amestec.
Fiecare componentă a amestecului se comportă ca și cum nu ar exista alte gaze în amestec, ocupă întregul volum disponibil în care se află amestecul, urmează propria ecuație de stare și își exercită așa-numita presiune parțială asupra pereților, în timp ce temperatura dintre toate componentele amestecului este aceeași și egală cu temperatura amestecului.
Conform legii lui Dalton, presiunea amestecului P este egală cu suma presiunilor parțiale ale componentelor individuale incluse în amestec:
unde n este numărul de componente ale amestecului.
Conform legii lui Amag, volumul amestecului V este egal cu suma volumelor parțiale ale componentelor individuale incluse în amestec la temperatura și presiunea amestecului:
 , (1.21)
, (1.21)
unde - volum parțial, m 3; V- volumul amestecului, m 3
Compoziția amestecului este dată de fracții de volum (molare) sau de masă.
Fracția de volum a componentei i-a este raportul dintre volumul parțial al componentei și volumul amestecului, adică atunci suma fracțiilor volumice ale componentelor amestecului este 1, adică . Dacă valoarea este dată în %, atunci suma lor = 100%.
Fracția molară a i-a componentă n i este raportul dintre numărul de kilomoli ai componentului Ni și numărul de kilomoli din amestecul N, adică unde ![]() , , adică numărul de kilomoli ai fiecărui component și a amestecului în ansamblu este egal cu raportul dintre componenta corespunzătoare și amestecul ca întreg la volumul ocupat de un kilomol.
, , adică numărul de kilomoli ai fiecărui component și a amestecului în ansamblu este egal cu raportul dintre componenta corespunzătoare și amestecul ca întreg la volumul ocupat de un kilomol.
Având în vedere că un gaz ideal în aceleași condiții are același volum de kilomol, atunci după substituție obținem:, adică pentru gazele ideale, fracțiile molare și de volum sunt egale numeric.
Fracția de masă a componentei i-a este raportul dintre masa componentei și masa amestecului: , rezultă că masa amestecului este egală cu suma maselor componentelor și, de asemenea, suma fracțiilor de masă ale componentelor este egală la 1 (sau 100%).
Conversia fracțiilor de volum în fracții de masă și invers se bazează pe următoarele rapoarte:
![]() ,
,
unde ρ = μ / 22,4, kg / m 3.
De unde rezultă că fracția de masă a componentei i-a va fi determinată din relația:
 ,
,
unde este densitatea amestecului, kg / m 3, este fracția de volum a i-a componentă.
În viitor, poate fi determinat prin fracțiuni de volum.
 .
.
Densitate amestecuri pentru fracțiuni de volum se determină din raport
 , Unde
, Unde  , (1.22)
, (1.22)
 .
.
Presiunea parțială este determinată de formulele:
![]() sau
sau  (1.23)
(1.23)
Ecuațiile de stare ale componentelor și ale amestecului în ansamblu au forma:
![]() ;
;
![]() ,
,
de unde, după transformări, obținem pentru masiv acțiuni
 ,
,  . (1.24)
. (1.24)
Densitatea si volumul specific al amestecului pt masiv acțiune:
;  . (1.25)
. (1.25)
Pentru a calcula presiunile parțiale, se utilizează formula:
 . (1.26)
. (1.26)
Conversia fracțiilor de masă în fracții de volum se realizează după formula:
 .
.
Atunci când se determină capacitatea termică a unui amestec de gaze, se presupune că pentru a încălzi (răci) un amestec de gaze, este necesar să se încălzească (răci) fiecare dintre componentele amestecului.
unde Q i =M i c i ∆t este căldura consumată pentru modificarea temperaturii componentei i-a a amestecului, c i este capacitatea termică în masă a componentei i-a a amestecului.
Capacitatea termică a amestecului este determinată din raport (dacă amestecul este dat de fracțiuni de masă)
 , la fel
, la fel  . (1.28)
. (1.28)
Capacitățile termice molare și volumetrice pentru un amestec dat de fracțiuni de volum sunt determinate de
 ;
;  ;
;
 ;
; 
Exemplul 1.5 Aerul uscat în masă este format din g O2 \u003d 23,3% oxigen și g N 2 \u003d 76,6% azot. Determinați compoziția aerului în volum (r O2 și r N 2) și constanta de gaz a amestecului.
Soluţie.
1. Din tabelul 1 găsim kg/kmol și kg/kmol
2. Determinați fracțiile volumice ale oxigenului și azotului:
1. Constanta de gaz a aerului (amestecului) este determinată de formula:
 , J/kg K
, J/kg K
Exemplul 1.6. Determinați cantitatea de căldură necesară pentru încălzirea unui amestec de gaze cu masa de M = 2 kg la P = const, constând în % din greutate: , , , , când temperatura se schimbă de la t 1 =900 ° C la t 2 = 1200 °C.
Soluţie:
1. Determinați capacitatea termică medie în masă a componentelor care alcătuiesc amestecul de gaze la P=const și t 1 =900 o C (din P2):
1,0258 kJ/kg K; = 1,1045 kJ/kg K;
1,1078 kJ/kg K; =2,1097 kJ/kg K;
2. Determinăm capacitatea termică medie în masă a componentelor care alcătuiesc amestecul de gaze la P=const și t 1 =1200 o C (din P2):
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kg K; =2,2106 kJ/kg K;
3. Determinăm capacitatea medie de căldură în masă a amestecului pentru intervalul de temperatură: t 2 \u003d 1200 ° C și t 1 \u003d 900 ° C:
4. Cantitatea de căldură pentru încălzirea a 2 kg de amestec la P=const:
Prima lege a termodinamicii stabilește o relație cantitativă între modificarea energiei interne a sistemului și munca mecanică efectuată împotriva forțelor presiunii externe ale mediului ca urmare a alimentării cu căldură fluidului de lucru.
Pentru un sistem termodinamic închis, ecuația primei legi are forma
Căldura transmisă fluidului de lucru (sau sistemului) este utilizată pentru a-și crește energia internă (dU) datorită creșterii temperaturii corpului și pentru a efectua un lucru extern (dL) datorită expansiunii fluidului de lucru și a creșterii acestuia. volum.
Prima lege poate fi scrisă ca dH=dq+VdP=dq-dL 0 ,
unde dL 0 \u003d VdP - munca elementară de schimbare a presiunii se numește muncă externă (tehnică) utilă.
dU este modificarea energiei interne a fluidului de lucru (sistem), care include energia mișcării termice a moleculelor (de translație, rotație și vibrație) și energia potențială a interacțiunii moleculelor.
Deoarece trecerea sistemului de la o stare la alta are loc ca urmare a alimentării cu căldură, prin urmare, fluidul de lucru se încălzește și temperatura acestuia crește cu dT, iar volumul crește cu dV.
O creștere a temperaturii corpului determină o creștere a energiei cinetice a particulelor sale, iar o creștere a volumului corpului duce la o modificare a energiei potențiale a particulelor. Ca urmare, energia internă a corpului crește cu dU, deci energia internă U este o funcție a stării corpului și poate fi reprezentată în funcție de doi parametri independenți U=f 1 (P,V); U=f2 (P,T), U=f3 (υ,T). Modificarea energiei interne într-un proces termodinamic este determinată numai de starea inițială (U 1) și finală (U 2), adică.
În formă diferențială, se scrie modificarea energiei interne
a) în funcție de volumul și temperatura specifice

b) în funcţie de temperatură, deoarece , apoi
Pentru calculele practice, în care este necesar să se țină cont de modificarea C v cu temperatura, există formule empirice și tabele de energie internă specifică (adesea molară). Pentru gazele ideale, energia molară internă a amestecului U m este determinată de formula
 , J/kmol
, J/kmol
Pentru un amestec dat de fracții de masă . În acest fel energie interna există proprietatea sistemului și caracterizează starea sistemului.
Entalpie este funcția de stare termică introdusă de Kamerling-Onnes, (câștigător Premiul Nobel, 1913), care este suma energiei interne a sistemului U și produsul presiunii sistemului P și volumul acestuia V.
Deoarece cantitățile incluse în el sunt funcții de stare, prin urmare H este și o funcție de stare, adică H \u003d f 1 (P, V); H=f2 (V,T); H=f3 (P, T).
Modificarea entalpiei dH în orice proces termodinamic este determinată de stările inițiale H 1 și H 2 finale și nu depinde de natura procesului. Dacă sistemul conține 1 kg dintr-o substanță, atunci se aplică entalpia specifică, J/kg.
Pentru un gaz ideal, ecuația diferențială are forma
în consecință, entalpia specifică este determinată de formulă
Ecuația primei legi a termodinamicii este dq=dU+Pdυ, când singurul tip de lucru este lucrul de expansiune Pdυ=d(Pυ)-υdP, atunci dq=d(U+Pυ)-υdP, de unde
Munca practica№ 2
Tema: Capacitate termică, entalpie, amestecuri de gaze ideale, energie internă, lucru, procese termodinamice.
Scopul lucrării: Consolidarea cunoștințelor acumulate în timpul pregătirii teoretice, dobândirea de competențe în implementarea calculelor de inginerie termică.
eu. Definiții de bază, formule și ecuații
1. Amestecuri de gaze ideale
Un amestec de gaze este un amestec mecanic de mai multe gaze care nu interacționează chimic între ele. Fiecare dintre gazele din amestec se numește componentă gazoasă; se comportă de parcă nu ar exista alte gaze în amestec, adică distribuite uniform pe tot amestecul. Presiunea exercitată de fiecare gaz al amestecului pe pereții vasului se numește presiune parțială. Legea de bază pentru amestecurile de gaze ideale este legea lui Dalton, conform căreia presiunea amestecului este egală cu suma presiunilor parțiale ale gazelor care formează amestecul:
2. Energie internă
Energia internă a corpului este o combinație între energia cinetică a mișcării microparticulelor care alcătuiesc corpul și energia potențială a acestora. interacțiune definită. forţe de atracţie sau repulsie reciprocă. Este imposibil să se determine valoarea absolută a energiei interne, prin urmare, în calculele termodinamice, nu valoarea absolută a energiei interne se calculează, ci modificarea acesteia, i.e.
![]() sau
sau ![]()
unde U 1 și U 2 - energia internă a stării inițiale și finale a fluidului de lucru (gaz);
u 1 și și 2 - bătăi. energia internă a stării inițiale și finale a fluidului de lucru.
De aici rezultă că schimbarea energiei interne nu depinde de natura și calea procesului, ci este determinată de starea fluidului de lucru la începutul și sfârșitul procesului de schimbare.
O caracteristică a unui gaz ideal este absența forțelor interacțiunilor moleculare în el și, prin urmare, absența energiei potențiale interne, de exemplu. U n \u003d 0 și U „ \u003d 0. Prin urmare, energia internă a unui gaz ideal:
U=U k =f(T) unu u=uk =f(T).
H. Lucrări cu gaze.
În termodinamică, orice modificare a stării fluidului de lucru ca urmare a schimbului de energie cu mediu inconjurator numit proces. În acest caz, parametrii principali ai corpului de lucru sunt modificați:
Transformarea căldurii în lucru mecanic este asociată cu procesul de schimbare a stării fluidului de lucru. Procesele de schimbare a stării unui gaz pot fi procese de dilatare și contracție. Pentru o masă arbitrară de gaz M (kg), lucrul este egal cu:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
unde l \u003d p (v 2 -v 1) J / kg este munca a 1 kg de gaz sau lucru specific.
4. Entalpia gazului,
Entalpia este un parametru care caracterizează energia potențială a conexiunii fluidului de lucru (gaz) cu mediul. Entalpia și entalpia specifică:
I \u003d U + pV, J și i i \u003d și + pv, J / kg.
5. Capacitate termică.
Capacitatea termică specifică este cantitatea de căldură care trebuie furnizată la 1 kg de gaz pentru a-l încălzi cu 1 ° C într-un interval de temperatură dat.
Capacitatea termică specifică este de masă, volumetrică și kilomol. Există o legătură între masa C, volumul C și capacitățile termice în kilomol C:
 ;
; 
unde Vo 22,4 m 3 / kmol - batai. volumul de gaz în condiții normale.
Masa ud. capacitatea termică a amestecului de gaze:

Volumetric căldura specifică amestec de gaze:

Căldura specifică kilomolară a amestecului de gaze:

6. Ecuația pentru determinarea cantității de căldură
Cantitatea de căldură degajată sau absorbită de fluidul de lucru (gaz) poate fi determinată prin ecuația:
Q \u003d M C m (t 2 -t 1), J sau Q \u003d VC (t-t), J, unde M și V sunt greutatea sau volumul cantității de gaz, kg sau m 3;
t u t - temperatura gazului la sfârșitul și la începutul procesului ° С;
C și C - bătăi medii de masă și volum. capacitatea termică a gazului
La t cp \u003d J / kgK sau J / m 3 K
7. Prima lege a termodinamicii
Această lege ia în considerare interconversiile căldurii și a muncii mecanice. Conform acestei legi, căldura este transformată în lucru mecanic și invers, lucrul mecanic în căldură în cantități strict echivalente. Ecuația de echivalență pentru căldură și lucru are forma:
Luând în considerare principiul echivalenței căldurii și muncii, ecuația de echilibru termic pentru o masă arbitrară de gaz:
Q \u003d U + L și q \u003d u + l \u003d u -u + l
Rezolvarea problemelorII
Sarcina #1 (#1)
Aerul uscat atmosferic are următoarea compoziție de masă aproximativă: g 02 = 23,2%, g N 2 = 76,8%.
Determinați compoziția volumetrică a aerului, constanta sa de gaz, greutatea moleculară aparentă, presiunea parțială a oxigenului și azotului, dacă aerul este P = 101325 Pa folosind un barometru.
Determin compoziția volumetrică a aerului:
 ;
; ;
;
unde r este fracția de masă;
m este greutatea moleculară relativă;
g este fracția de volum.
m aer. =m O2 r O2 +m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
unde R 0 este constanta gazului.
Determin presiunile parțiale ale diferitelor gaze:
P O 2 \u003d P cm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
unde PO 2 , P N 2 - presiune parţială;
P cm este presiunea amestecului.
Sarcina #2 (#2)
Vasul este împărțit printr-o partiție în 2 părți, ale căror volume sunt V 1 =1,5 m 3 și V 2 = 1,0 m 3 . Prima parte a volumului V1 conține CO2 la P1 =0,5 MPa și t1 =30°C; a doua parte a volumului V2 conţine O2 la P2 =0,2 MPa şi t2 =57°C. Se determină fracțiunile de masă și volum ale CO 2 și O 2 , greutatea moleculară aparentă a amestecului și constanta sa de gaz după ce partiția este îndepărtată și procesul de amestecare este finalizat.
Determin constantele individuale ale gazelor:
Pentru a face acest lucru, determin greutatea moleculară relativă: m (CO 2) \u003d 32 + 12 \u003d 44; m(02)=32;

 ;
;
![]()
 ;
;
Conform ecuației caracteristice a lui Klaiperon, determin masele de gaze:
 (kg);
(kg);
 (kg);
(kg);
Determin fracțiile de masă:


Determin fracțiile de volum:


Determinați greutatea moleculară aparentă a aerului:
m aer. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 \u003d 41,48;
Determin constanta individuală de gaz pentru aer (R):

 ;
;
Sarcina #3 (#6)
Într-un vas cu un volum de 300 l există oxigen la o presiune P 1 \u003d 0,2 MPa și t 1 \u003d 20 0 C. Câtă căldură trebuie furnizată pentru ca temperatura oxigenului să crească la t 2 \u003d 300 0 C. ? Ce presiune se va stabili în vas? Pentru calcul, luați căldura specifică volumetrică medie a oxigenului la n.o. C 02 \u003d 0,935 
Conform legii lui Charles, determin presiunea finală a procesului:
;  (Pa);
(Pa);
unde P, T sunt parametrii gazului.
Determin constanta individuală de gaz pentru oxigen (R):

 ;
;
Deoarece procesul este izocor, determin cantitatea de căldură care trebuie furnizată conform formulei adecvate: Q v \u003d M C cv (T 2 -T 1) pentru aceasta, conform ecuației caracteristice Claiperon, determin masa de gaz
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
Sarcina #4 (#7)
Câtă căldură trebuie consumată pentru a încălzi 2m 3 de aer la o suprapresiune constantă P ex. \u003d 0,2 MPa de la o temperatură de 100 0 C la o temperatură de 500 0 C. Ce lucru va face aerul în acest caz? Pentru calcul, luați: presiunea atmosferică P at. \u003d 0,1 MPa, masa medie a capacității de căldură izobară a aerului C pm \u003d 1,022  ; calculați constanta gazului ținând cont de faptul că greutatea moleculară aparentă a aerului M aer. =29.
; calculați constanta gazului ținând cont de faptul că greutatea moleculară aparentă a aerului M aer. =29.
Determin constanta individuală de gaz pentru aer:

 ;
;
Presiunea absolută este egală cu suma excesului și a atmosferei P=P est. + P la. =0,1+0,2=0,3 MPa
 (kg);
(kg);
Deoarece procesul este izobar, determin Q și L conform formulelor corespunzătoare:
conform legii Gay-Lussac, determin volumul final:
 m3;
m3;
Q \u003d M C pm (T 2 -T 1) \u003d 5,56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2,15 \u003d 645000 (J).
Sarcina #5 (#8)
În cilindru există aer la o presiune P=0,5 MPa și o temperatură t 1 =400 0 C. Căldura este îndepărtată din aer la P=const astfel încât la sfârșitul procesului temperatura t 2 =0 0 C să fie set. Volumul cilindrului în care aerul V 1 \u003d 400l.
Determinați cantitatea de căldură îndepărtată, volumul final, modificarea energiei interne și lucrul perfect de compresie C pm =1,028  .
.
Deoarece procesul este izobar, atunci conform legii Gay-Lussac determin volumul final:
 m3;
m3;
Conform ecuației caracteristice a lui Klaiperon, determin masa gazului:
Din problema anterioară R=286,7 
 (kg);
(kg);
Determin cantitatea de căldură care se eliberează:
Q=M C pm (T2-T1)=1,03 1028 (273-673)=-423536 (J);
Determin cantitatea de muncă cheltuită:
L=P (V2-V1)= 500.000 (0,16-0,4)=-120.000 (J);
Din ecuația prin care se determină cantitatea totală, determin modificarea cantității de energie internă:
![]() ; (J)
; (J)
Problema #6 (#9)
Aerul având un volum V 1 = 0,02 m3 la o presiune P 1 = 1,1 MPa și t 1 = 25 s se extinde într-un cilindru cu piston mobil la o presiune P 2 = 0,11 MPa. Aflați volumul final V 2 , temperatura finală t 2 , munca efectuată de aer și căldura furnizată, dacă are loc dilatarea în cilindru:
a) izotermic
b) adiabatic cu exponent adiabatic k=1,4
c) politropic cu indice politropic n=1,3
Proces izotermic:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0,02 1,1 / 0,11 \u003d 0,2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000J
proces adiabatic:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 298 \u003d 20,32k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1,4-1) (1,1 10 6 0,02 -0,11 10 6 0, 1)=2,0275 10 6 J
Proces politropic:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1,3-1)) (1,1 10 6 0,02 -0,11 10 6 0,118)=30000J
Q=(k-n/k-1) l M=((1,4-1,3)/(1,4-1)) 30000=7500J
Literatură:
1. Energie, Moscova, 1975.
2. Litvin A.M. „Bazele teoretice ale ingineriei termice”, editura „Energie”, Moscova, 1969.
3. Tugunov P.I., Samsonov A.A., „Fundamentals of heat engineering, heat engines and steam power units”, Editura Nedra, Moscova, 1970.
4. Krutov V.I., „Inginerie termică”, editura „Inginerie”, Moscova, 1986.
Amestecuri de gaze. Capacitatea termică a gazelor
Amestecuri de gaze sunt înțelese ca un amestec mecanic de mai multe gaze care nu interacționează chimic între ele. Un amestec de gaze ideale respectă toate legile referitoare la gaze ideale. Compoziția amestecului de gaze este determinată de cantitatea fiecăruia dintre gazele incluse în amestec și poate fi specificată prin fracțiuni de masă sau volum:
unde este masa componentei --a, este volumul componentei --a și, respectiv, sunt masa și volumul întregului amestec.
Este evident că
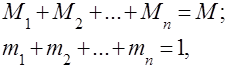
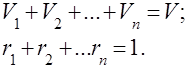
Pentru comoditatea rezolvării problemelor practice cu amestecuri de gaze, este introdus conceptul de greutate moleculară aparentă a unui amestec de gaze, care este masa medie a greutăților moleculare reale ale componentelor individuale ale amestecului.
Ecuația de stare pentru un amestec de gaze are forma:
Amestecurile de gaze sunt supuse conceptului de constantă universală a gazelor
Relația dintre presiunea unui amestec de gaze și presiunea parțială a componentelor individuale incluse în amestec este stabilită de legea lui Dalton:
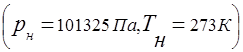
1 gaz are o masă diferită în funcție de presiune și temperatură. În acest sens, capacitatea termică volumetrică se referă întotdeauna la masa de gaz închisă în 1 în condiții normale. În acest caz, volumul de 1 kmol de diferite gaze este de 22,4 / kmol, iar constanta universală a gazului este . În funcție de metoda de alimentare cu căldură a gazului, există capacități de căldură izobară și izocoră. Raportul acestor mărimi se numește exponent adiabatic
Capacitatile termice si sunt corelate si prin relatia Mayer
Cantitatea de căldură care trebuie consumată în procesul de încălzire a 1 kg de gaz în intervalul de temperatură de la până la este determinată de formula:
unde și sunt, respectiv, capacitățile termice medii între 0°- și 0°-.
Dacă (kg) sau () gaz este implicat în proces, atunci
Capacitatea termică a amestecului de gaze trebuie determinată prin formulele:
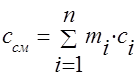
masa -;
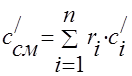
volumetric -;
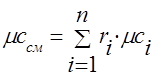
molar - .
Pentru a utiliza căldura gazelor care sunt produse ale arderii combustibilului în unitatea cazanului, în conductele de gaz ale acestuia din urmă sunt instalate încălzitoare de aer necesare pentru arderea combustibilului (Fig. 1). Gazele care ies din cazan intră în aeroterma cu o temperatură și sunt răcite, degajând căldură aerului, până la. În conducta de gaz a unității cazanului, sub influența funcționării evacuatorului de fum, o presiune este setată ușor sub nivelul atmosferic. Aerul din încălzitorul de aer este încălzit de la temperatură la temperatură.
gaze de ardere
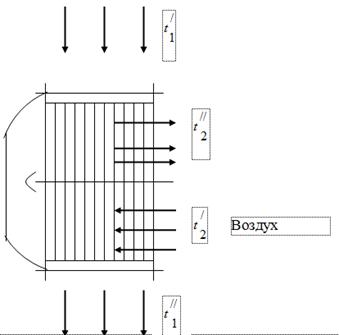
La testarea unității cazanului s-au obținut următoarele date:
Temperatura gazelor la intrarea în încălzitorul de aer, = 450 °C.
Temperatura gazelor la ieșirea încălzitorului de aer, = 150 ° C.
Temperatura aerului la intrarea în încălzitorul de aer, = 26 ° C.
Temperatura aerului la ieșirea încălzitorului de aer, = 260 ° C.
Compoziția volumetrică a gazelor de ardere - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Consumul orar de gaze la este de 50 ·/h.
Aspirați în conducta de gaz - 15 mm apă. Artă.
Presiune barometrică 760 mm Hg. Artă.
Defini:
greutatea moleculară aparentă a gazelor de ardere;
constanta gazelor de ardere;
fracțiuni de greutate (masă) ale componentelor individuale care alcătuiesc gazele de ardere;
presiuni parțiale ale componentelor:
flux orar de aer.
Să presupunem că toată căldura degajată de gaz este preluată de aer.
Dependența capacității termice de temperatură este considerată curbiliniară.
1. Greutatea moleculară aparentă a gazelor de ardere
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Constanta gazelor de ardere
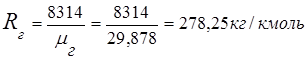
3. Fracții de masă componente de gaz
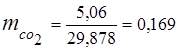
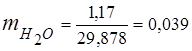
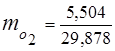
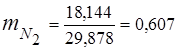
4. Presiuni parțiale ale componentelor
Rezultatele calculului vor fi trecute în tabel
|
Opțiuni |
amestec de gaze |
|||
|
|
||||
|
|
||||
|
|
5. Consumul orar de aer
Consumul de aer este determinat din ecuația de echilibru termic a încălzitorului de aer
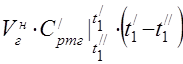
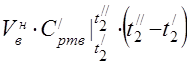
capacitate termică medie molară la 450 °C
Capacitatea termică specifică medie a componentelor în intervalul de temperatură 0 ... 450 ° C.













 .
(1.28)
.
(1.28)