A quantidade de calor no sistema SI é medida. Métodos e meios de medir a quantidade de calor
Aquecer- a energia transferida de um corpo mais quente para um menos aquecido por contato direto ou por radiação.
A temperatura é uma medida da intensidade do movimento molecular.
A quantidade de calor que um corpo possui a uma dada temperatura depende de sua massa; Por exemplo, na mesma temperatura, mais calor está contido em um copo grande de água do que em um pequeno, e em um balde de água fria pode haver mais do que em um copo de água. água quente(embora a temperatura da água no balde seja menor).
O calor desempenha um papel importante na vida humana, inclusive no funcionamento de seu corpo. Parte da energia química contida nos alimentos é convertida em calor, devido ao qual a temperatura corporal é mantida perto de 37 ° C. O equilíbrio térmico do corpo humano também depende da temperatura. meio Ambiente, e as pessoas são obrigadas a gastar muita energia para aquecer instalações residenciais e industriais no inverno e resfriá-las no verão. A maior parte dessa energia é fornecida por motores térmicos, como caldeiras e turbinas a vapor de usinas que funcionam com combustíveis fósseis (carvão, petróleo) e geram eletricidade.
Até o final do século XVIII. o calor era considerado uma substância material, acreditando que a temperatura de um corpo é determinada pela quantidade de<калорической жидкости>, ou<теплорода>. Mais tarde, B. Rumford, J. Joule e outros físicos da época, por meio de experimentos e raciocínios espirituosos, refutaram<калорическую>teoria, provando que o calor não tem peso e pode ser obtido em qualquer quantidade simplesmente devido ao movimento mecânico. O calor em si não é uma substância - é apenas a energia do movimento de seus átomos ou moléculas. É a essa compreensão do calor que a física moderna adere.
Neste artigo, veremos como o calor e a temperatura estão relacionados e como essas quantidades são medidas. O assunto de nossa discussão também serão as seguintes questões: a transferência de calor de uma parte do corpo para outra; transferência de calor no vácuo (espaço que não contém matéria); o papel do calor no mundo moderno.
Calor e temperatura
A quantidade de energia térmica em uma substância não pode ser determinada observando o movimento de cada uma de suas moléculas separadamente. Pelo contrário, somente estudando as propriedades macroscópicas de uma substância, pode-se encontrar as características do movimento microscópico de muitas moléculas em um determinado período de tempo. A temperatura de uma substância é o indicador médio da intensidade do movimento das moléculas, cuja energia é energia térmica substâncias.
Uma das maneiras mais familiares, mas também menos precisas, de estimar a temperatura é pelo toque. Ao tocar um objeto, julgamos se está quente ou frio, focando em nossos sentimentos. Claro que essas sensações dependem da temperatura do nosso corpo, o que nos leva ao conceito de equilíbrio térmico – um dos mais importantes na medição da temperatura.
Equilíbrio térmico
Equilíbrio térmico entre os corpos A e B
Obviamente, se dois corpos A e B são pressionados firmemente um contra o outro, depois de tocá-los após um tempo suficientemente longo, notamos que sua temperatura é a mesma. Nesse caso, diz-se que os corpos A e B estão em equilíbrio térmico entre si. No entanto, os corpos, em geral, não precisam estar em contato para que haja equilíbrio térmico entre eles - basta que suas temperaturas sejam as mesmas. Isso pode ser verificado usando o terceiro corpo C, primeiro colocando-o em equilíbrio térmico com o corpo A, e depois comparando as temperaturas dos corpos C e B. O corpo C aqui desempenha o papel de um termômetro. Em uma formulação estrita, esse princípio é chamado de lei zero da termodinâmica: se os corpos A e B estão em equilíbrio térmico com um terceiro corpo C, então esses corpos também estão em equilíbrio térmico entre si. Esta lei é a base de todos os métodos de medição de temperatura.
Medição de temperatura

Escalas de temperatura

termômetros
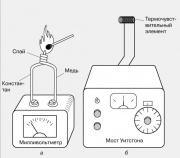
Termômetros baseados em efeitos elétricos
Se quisermos realizar experimentos e cálculos precisos, as classificações de temperatura como quente, quente, frio e frio não são suficientes - precisamos de uma escala de temperatura graduada. Existem várias dessas escalas, e os pontos de congelamento e ebulição da água são geralmente tomados como pontos de referência. As quatro escalas mais comuns são mostradas na figura. A escala centígrada, segundo a qual o ponto de congelamento da água corresponde a 0 °, e o ponto de ebulição a 100 °, é chamada de escala Celsius em homenagem a A. Celsius, um astrônomo sueco que a descreveu em 1742. Acredita-se que a escala Celsius O naturalista sueco K. Linnaeus aplicou pela primeira vez esta escala. Agora, a escala Celsius é a mais comum no mundo. A escala de temperatura Fahrenheit, na qual os pontos de congelamento e ebulição da água correspondem a números extremamente desconfortáveis de 32 e 212°, foi proposta em 1724 por G. Fahrenheit. A escala Fahrenheit é amplamente utilizada em países de língua inglesa, mas é pouco utilizada na literatura científica. Para converter a temperatura Celsius (°C) em temperatura Fahrenheit (°F), existe uma fórmula °F = (9/5)°C + 32, e para a tradução reversa - a fórmula °C = (5/9) ( °F-32).
Ambas as escalas - tanto Fahrenheit quanto Celsius - são muito inconvenientes ao realizar experimentos em condições em que a temperatura cai abaixo do ponto de congelamento da água e é expressa como um número negativo. Para esses casos, foram introduzidas escalas de temperatura absoluta, que se baseiam na extrapolação para o chamado zero absoluto - o ponto em que o movimento molecular deve parar. Uma delas é chamada de escala Rankin e a outra é chamada de escala termodinâmica absoluta; as temperaturas são medidas em graus Rankine (°R) e kelvins (K). Ambas as escalas começam no zero absoluto e o ponto de congelamento da água corresponde a 491,7 ° R e 273,16 K. O número de graus e kelvins entre os pontos de congelamento e ebulição da água na escala Celsius e a escala termodinâmica absoluta é o mesmo e igual a 100; para as escalas Fahrenheit e Rankine, também é o mesmo, mas igual a 180. Os graus Celsius são convertidos em kelvins usando a fórmula K \u003d ° C + 273,16, e os graus Fahrenheit são convertidos em graus Rankine usando a fórmula ° R \u003d °F + 459,7.
A operação de dispositivos projetados para medir a temperatura é baseada em vários fenômenos físicos associados a uma mudança na energia térmica de uma substância - mudanças na resistência elétrica, volume, pressão, características radiativas, propriedades termoelétricas. Um dos instrumentos de medição de temperatura mais simples e familiares é o termômetro de vidro mostrado na figura. A bola c na parte inferior do termômetro é colocada no meio ou pressionada contra o objeto cuja temperatura deve ser medida, e dependendo se a bola recebe calor ou emite, expande ou contrai e sua coluna sobe ou desce no capilar. Se o termômetro estiver pré-calibrado e equipado com uma escala, você poderá descobrir diretamente a temperatura do corpo.
Outro dispositivo cuja ação é baseada na expansão térmica é o termômetro bimetálico mostrado na figura. Seu elemento principal é uma placa espiral de dois metais soldados com diferentes coeficientes de expansão térmica. Quando aquecido, um dos metais se expande mais que o outro, a espiral torce e gira a seta em relação à escala. Esses dispositivos são frequentemente usados para medir a temperatura do ar interno e externo, mas não são adequados para determinar a temperatura local.
A temperatura local é geralmente medida usando um termopar, que é dois fios de metais diferentes soldados em uma extremidade. Quando essa junção é aquecida, surge um EMF nas extremidades livres dos fios, geralmente alguns milivolts. Os termopares são feitos de diferentes pares de metais: ferro e constantan, cobre e constantan, chromel e alumel. Seu termo-EMF muda quase linearmente com a temperatura em uma ampla faixa de temperatura.
Outro efeito termoelétrico também é conhecido - a dependência da resistência de um material condutor da temperatura. Ele é a base da operação de termômetros de resistência elétrica, um dos quais é mostrado na figura. A resistência de um pequeno elemento sensor de temperatura (termopar) - geralmente bobinas de fio fino - é comparada com a resistência de um resistor variável calibrado usando uma ponte de Wheatstone. O instrumento de saída pode ser graduado diretamente em graus.
Os pirômetros ópticos são usados para medir a temperatura de corpos quentes que emitem luz visível. Em uma versão deste dispositivo, a luz emitida pelo corpo é comparada com a radiação de um filamento de lâmpada incandescente colocado no plano focal dos binóculos através do qual o corpo emissor é visto. A corrente elétrica, aquecendo o filamento da lâmpada, é alterada até que, ao comparar visualmente o brilho do filamento e do corpo, verifica-se que o equilíbrio térmico foi estabelecido entre eles. A escala do dispositivo pode ser graduada diretamente em unidades de temperatura.
Avanços técnicos anos recentes permissão para criar novos sensores de temperatura. Por exemplo, nos casos em que é necessária uma sensibilidade particularmente alta, em vez de um termopar ou um termômetro de resistência convencional, é usado um dispositivo semicondutor - termistor. Corantes e cristais líquidos que mudam seu estado de fase também são usados como conversores térmicos, especialmente nos casos em que a temperatura da superfície do corpo varia em uma ampla faixa. Por fim, utiliza-se a termografia infravermelha, na qual é obtida uma imagem infravermelha de um objeto em cores condicionais, onde cada cor corresponde a uma determinada temperatura. Este método de medição de temperatura encontra a aplicação mais ampla - desde diagnóstico médico antes de verificar o isolamento térmico das instalações.
Medindo a quantidade de calor
calorímetro de água
A energia térmica (quantidade de calor) de um corpo pode ser medida diretamente com o chamado calorímetro; Uma versão simples de tal dispositivo é mostrada na figura. É um recipiente fechado cuidadosamente isolado, equipado com dispositivos para medir a temperatura em seu interior, e às vezes preenchido com um fluido de trabalho de propriedades conhecidas, como a água. Para medir a quantidade de calor em um pequeno corpo aquecido, ele é colocado em um calorímetro e aguarda o sistema entrar em equilíbrio térmico. A quantidade de calor transferida para o calorímetro (mais precisamente, para a água que o enche) é determinada pelo aumento da temperatura da água.
A quantidade de calor liberada durante uma reação química, como a combustão, pode ser medida colocando um pequeno<бомбу>. NO<бомбе>uma amostra está localizada, à qual os fios elétricos para ignição estão conectados e a quantidade correspondente de oxigênio. Depois que a amostra queima completamente e o equilíbrio térmico é estabelecido, determina-se o quanto a temperatura da água no calorímetro aumentou e, portanto, a quantidade de calor liberada.
Unidades de calor
O calor é uma forma de energia e, portanto, deve ser medido em unidades de energia. No sistema internacional SI, a unidade de energia é o joule (J). Também é permitido usar unidades fora do sistema da quantidade de calor - calorias: uma caloria internacional é 4,1868 J, uma caloria termoquímica é 4,1840 J. Em laboratórios estrangeiros, os resultados da pesquisa são frequentemente expressos usando o chamado. Uma caloria de 15 graus igual a 4,1855 J. A unidade térmica britânica (BTU) fora do sistema está caindo em desuso: BTU médio = 1,055 J.
Fontes de calor
As principais fontes de calor são reações químicas e nucleares, bem como vários processos de conversão de energia. Exemplos de reações químicas com liberação de calor são a combustão e a quebra de componentes dos alimentos. Quase todo o calor recebido pela Terra é fornecido por reações nucleares que ocorrem nas profundezas do Sol. A humanidade aprendeu a obter calor com a ajuda de processos controlados de fissão nuclear e agora está tentando usar reações de fusão termonuclear para o mesmo propósito. Outros tipos de energia também podem ser convertidos em calor, como trabalho mecânico e energia elétrica. É importante lembrar que a energia térmica (como qualquer outra) só pode ser convertida em outra forma, mas não pode ser obtida.<из ничего>, nem destruir. Este é um dos princípios básicos da ciência chamada termodinâmica.
Termodinâmica
Termodinâmicaé a ciência da relação entre calor, trabalho e matéria. As idéias modernas sobre essas relações foram formadas com base nos trabalhos de grandes cientistas do passado como Carnot, Clausius, Gibbs, Joule, Kelvin e outros. expansão térmica dos corpos e o calor das transições de fase. Esta ciência é baseada em várias leis - princípios estabelecidos experimentalmente.
Calor e propriedades das substâncias
Várias substâncias têm capacidade diferente de acumular energia térmica; depende de sua estrutura molecular e densidade. A quantidade de calor necessária para aumentar a temperatura de uma unidade de massa de uma substância em um grau é chamada de calor específico. A capacidade calorífica depende das condições em que a substância está localizada. Por exemplo, para aquecer um grama de ar em um balão em 1 K, é necessário mais calor do que aquecê-lo da mesma forma em um recipiente selado com paredes rígidas, pois parte da energia transmitida ao balão é gasta na expansão do balão. ar, e não ao aquecê-lo. Portanto, em particular, a capacidade calorífica dos gases é medida separadamente a pressão constante e a volume constante.
Com o aumento da temperatura, a intensidade do movimento caótico das moléculas aumenta - a maioria das substâncias se expande quando aquecida. O grau de expansão de uma substância com um aumento de temperatura de 1 K é chamado coeficiente de expansão térmica.
Para que uma substância passe de um estado de fase para outro, por exemplo, de sólido para líquido (e às vezes imediatamente para gasoso), ela deve receber uma certa quantidade de calor. Se aquecido sólido, então sua temperatura aumentará até começar a derreter; até que a fusão esteja completa, a temperatura do corpo permanecerá constante apesar da entrada de calor. A quantidade de calor necessária para derreter uma unidade de massa de uma substância é chamada de calor de fusão. Se você continuar fornecendo calor, a substância derretida aquecerá até ferver. A quantidade de calor necessária para vaporizar uma unidade de massa de um líquido a uma dada temperatura é chamada de calor de vaporização.
O papel do calor e seu uso
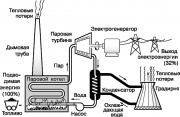
Esquema de operação de uma usina de turbina a vapor
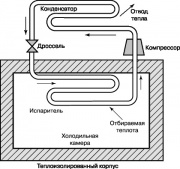
Diagrama do ciclo de refrigeração
Os processos globais de transferência de calor não se reduzem ao aquecimento da Terra pela radiação solar. Massivas correntes de convecção na atmosfera determinam mudanças diárias nas condições climáticas em todo o globo. As diferenças de temperatura na atmosfera entre as regiões equatorial e polar, juntamente com as forças de Coriolis devido à rotação da Terra, levam ao aparecimento de correntes de convecção em constante mudança, como ventos alísios, correntes de jato e frentes quentes e frias.
A transferência de calor (devido à condutividade térmica) do núcleo fundido da Terra para sua superfície leva a erupções vulcânicas e ao aparecimento de gêiseres. Em algumas regiões, a energia geotérmica é usada para aquecimento de ambientes e geração de energia.
O calor é um participante indispensável em quase todas as processos de produção. Mencionaremos os mais importantes deles, como a fundição e processamento de metais, a operação de motores, produção de alimentos, síntese química, refino de petróleo, fabricação de diversos itens – de tijolos e louças a carros e aparelhos eletrônicos.
Muitas produções industriais e de transporte, assim como usinas termelétricas, não poderiam funcionar sem motores térmicos - dispositivos que convertem calor em trabalho útil. Exemplos de tais máquinas são compressores, turbinas, vapor, gasolina e motores a jato.
Uma das máquinas térmicas mais conhecidas é a turbina a vapor, que implementa parte do ciclo Rankine utilizado nas usinas modernas. Um diagrama simplificado deste ciclo é mostrado na figura. O fluido de trabalho - água - é convertido em vapor superaquecido em uma caldeira a vapor aquecida pela queima de combustíveis fósseis (carvão, petróleo ou gás natural). Vapor alto
Gasovik - equipamentos de gás industrial Diretório de GOST, SNiP, PB Unidades de grandezas físicas, conceitos físico-químicos, proporções, composição e características de gases
Unidades de medida para temperatura e quantidade de calor
A unidade básica de medida de temperatura foi o grau da Escala Internacional de Temperatura, que praticamente corresponde ao grau Celsius. Esse valor é igual a 1/100 do intervalo de temperatura entre 0 e 100°C, ou seja, entre os pontos de fusão do gelo e a água fervente a uma pressão de 760 mm Hg. Arte.
A temperatura absoluta é a temperatura medida a partir do zero absoluto, ou seja, de -273,16 ° C, e medida em graus Kelvin (° K). O grau Kelvin é o mesmo que o grau Celsius. Portanto, a temperatura absoluta é expressa em graus centígrados da seguinte forma:
T, °K = t, °C + 273,16
No sistema SI, a unidade de temperatura é o Kelvin. É permitido expressar os resultados práticos das medições de temperatura usando o grau Celsius junto com o grau Kelvin, dependendo da origem (posição zero) na escala.
Exemplo: 250 ±5 °С = 523,16 ±5 °K.
No sistema SI, trabalho, energia e calor são medidos em joules (J). Às vezes, uma unidade maior e mais conveniente para fins práticos é usada - quilojoule (kJ), igual a 1000 J. A unidade de trabalho no SI é o trabalho realizado por uma força de 1 N em um deslocamento de 1 m. Energia - quantidade física mostrando quanto trabalho o corpo pode fazer.
Calorias e quilocalorias podem ser usadas como unidades de calor fora do sistema. Uma caloria é a quantidade de calor necessária para elevar a temperatura de 1 grama de água em 1°C (19,5 a 20,5°C).
1 cal (caloria) = 4,1868 J;
1 kcal (quilocaloria) \u003d 1000 cal \u003d 4186,8 J \u003d 4,187 kJ;
1 Mcal (megacaloria) \u003d 10 6 cal \u003d 4,1868 MJ;
1 Gcal (gigacaloria) \u003d 10 9 cal \u003d 4186,8 MJ.
Para efeito de comparação, na avaliação do combustível, é utilizado o chamado calor condicional, cujo poder calorífico para cálculo é considerado condicionalmente igual a 7 Mcal/kg ou 7 Gcal/t. Nesses casos, fala-se, respectivamente, de 1 kg ou 1 tonelada de combustível padrão (t.c.f.).
O calor desempenha um papel importante na vida humana, inclusive no funcionamento de seu corpo. Parte da energia química contida nos alimentos é convertida em calor, devido ao qual a temperatura corporal é mantida próxima a 37
° C. O equilíbrio térmico do corpo humano também depende da temperatura ambiente, e as pessoas são obrigadas a gastar muita energia para aquecer instalações residenciais e industriais no inverno e resfriá-las no verão. A maior parte dessa energia é fornecida por motores térmicos, como caldeiras e turbinas a vapor de usinas de energia que funcionam com combustíveis fósseis (carvão, petróleo) e geram eletricidade.Até o final do século XVIII. o calor era considerado uma substância material, acreditando-se que a temperatura de um corpo é determinada pela quantidade de "líquido calórico" ou "calórico" contido nele. Mais tarde, B. Rumford, J. Joule e outros físicos da época, através de engenhosos experimentos e raciocínios, refutaram a teoria "calórica", provando que o calor não tem peso e pode ser obtido em qualquer quantidade simplesmente devido ao movimento mecânico. O calor em si não é uma substância - é apenas a energia do movimento de seus átomos ou moléculas. É a essa compreensão do calor que a física moderna adere. Veja também FÍSICA.
Neste artigo, veremos como o calor e a temperatura estão relacionados e como essas quantidades são medidas. O assunto de nossa discussão também serão as seguintes questões: a transferência de calor de uma parte do corpo para outra; transferência de calor no vácuo (espaço que não contém matéria); o papel do calor no mundo moderno.
CALOR E TEMPERATURA A quantidade de energia térmica em uma substância não pode ser determinada observando o movimento de cada uma de suas moléculas separadamente. Pelo contrário, apenas estudando as propriedades macroscópicas da matéria, pode-se encontrar as características do movimento microscópico de muitas moléculas em média durante um certo período de tempo. A temperatura de uma substância é um indicador médio da intensidade do movimento das moléculas, cuja energia é a energia térmica de uma substância.Uma das formas mais comuns, mas também menos precisas, de estimar a temperatura é pelo toque. Ao tocar um objeto, julgamos se está quente ou frio, focando em nossos sentimentos. Claro que essas sensações dependem da temperatura do nosso corpo, o que nos leva ao conceito de equilíbrio térmico – um dos mais importantes na medição da temperatura.
Equilíbrio térmico. Obviamente, se dois corpos A e B (Fig. 1) firmemente pressionados um contra o outro, depois de tocá-los após um tempo suficientemente longo, notamos que sua temperatura é a mesma. Neste caso, dizemos que os corpos são A e B estão em equilíbrio térmico entre si. No entanto, os corpos, em geral, não precisam estar em contato para que haja equilíbrio térmico entre eles - basta que suas temperaturas sejam as mesmas. Isso pode ser verificado usando o terceiro corpo C , colocando-o primeiro em equilíbrio térmico com o corpo UMA , e então comparando as temperaturas dos corpos C e b. Corpo C aqui desempenha o papel de um termômetro. Em uma formulação estrita, esse princípio é chamado de lei zero da termodinâmica: se os corpos A e B estão em equilíbrio térmico com um terceiro corpo C, então esses corpos também estão em equilíbrio térmico entre si. Esta lei é a base de todos os métodos de medição de temperatura.Medição de temperatura. Se quisermos realizar experimentos e cálculos precisos, as classificações de temperatura como quente, quente, frio e frio não são suficientes - precisamos de uma escala de temperatura graduada. Existem várias dessas escalas, e os pontos de congelamento e ebulição da água são geralmente tomados como pontos de referência. As quatro escalas mais comuns são mostradas na fig. 2. Escala centígrada, segundo a qual o ponto de congelamento da água corresponde a 0° , e o ponto de ebulição é 100° , é chamada de escala Celsius em homenagem a A. Celsius, um astrônomo sueco que a descreveu em 1742. Acredita-se que o naturalista sueco K. Linney foi o primeiro a usar essa escala. Agora, a escala Celsius é a mais comum no mundo. A escala de temperatura Fahrenheit, na qual os pontos de congelamento e ebulição da água correspondem aos números extremamente desconfortáveis 32 e 212° , foi proposto em 1724 por G. Fahrenheit. A escala Fahrenheit é amplamente utilizada em países de língua inglesa, mas é pouco utilizada na literatura científica. Para converter a temperatura para Celsius (° C) a temperatura Fahrenheit (° F) existe uma fórmula°F = (9/5) ° C + 32, e para a tradução reversa - a fórmula°C = (5/9)(°F - 32). Ambas as escalas - tanto Fahrenheit quanto Celsius - são muito inconvenientes ao realizar experimentos em condições em que a temperatura cai abaixo do ponto de congelamento da água e é expressa como um número negativo. Para esses casos, foram introduzidas escalas de temperatura absoluta, que se baseiam na extrapolação para o chamado zero absoluto - o ponto em que o movimento molecular deve parar. Uma delas é chamada de escala Rankin e a outra é chamada de escala termodinâmica absoluta; as temperaturas são medidas em graus Rankine (° R) e kelvins (K). Ambas as escalas começam no zero absoluto e o ponto de congelamento da água é 491,7° R e 273,16 K. O número de graus e kelvins entre os pontos de congelamento e ebulição da água na escala Celsius e na escala termodinâmica absoluta é o mesmo e igual a 100; para as escalas Fahrenheit e Rankine, também é o mesmo, mas igual a 180. Os graus Celsius são convertidos em kelvins usando a fórmula K \u003d° C + 273,16 e Fahrenheit para Rankine usando a fórmula°R = °F + 459,7. A operação de dispositivos projetados para medir temperatura é baseada em vários fenômenos físicos associados a uma mudança na energia térmica de uma substância, como mudanças na resistência elétrica, volume, pressão, características radiativas e propriedades termoelétricas. Um dos instrumentos mais simples e familiares para medir a temperatura é o termômetro de mercúrio em vidro mostrado na Fig. 3, uma. A bola com mercúrio na parte inferior do termômetro é colocada no meio ou pressionada contra o objeto cuja temperatura se quer medir, e dependendo se a bola recebe calor ou emite, o mercúrio se expande ou se contrai e sua coluna sobe ou cai no capilar. Se o termômetro estiver pré-calibrado e equipado com uma escala, você poderá descobrir diretamente a temperatura do corpo.Outro dispositivo cujo funcionamento é baseado na expansão térmica é o termômetro bimetálico mostrado na Fig.
3, b. Seu elemento principal placa espiral de dois metais soldados com diferentes coeficientes de expansão térmica. Quando aquecido, um dos metais se expande mais que o outro, a espiral torce e gira a seta em relação à escala. Esses dispositivos são frequentemente usados para medir a temperatura do ar interno e externo, mas não são adequados para determinar a temperatura local.A temperatura local é geralmente medida usando um termopar, que são dois fios de metais diferentes soldados em uma extremidade (Fig.
4, uma). Quando essa junção é aquecida, surge uma fem nas extremidades livres dos fios, geralmente alguns milivolts. Os termopares são feitos de diferentes pares de metais: ferro e constantan, cobre e constantan, chromel e alumel. Seu termo-EMF muda quase linearmente com a temperatura em uma ampla faixa de temperatura.Outro efeito termoelétrico também é conhecido - a dependência da resistência de um material condutor da temperatura. Ele é a base da operação de termômetros de resistência elétrica, um dos quais é mostrado na Fig.
4, b. A resistência de um pequeno elemento sensor de temperatura (termopar) - geralmente bobinas de fio fino - é comparada com a resistência de um resistor variável calibrado usando uma ponte de Wheatstone. O instrumento de saída pode ser graduado diretamente em graus.Pirômetros ópticos são usados para medir a temperatura de corpos incandescentes que emitem luz visível. Em uma versão deste dispositivo, a luz emitida pelo corpo é comparada com a radiação de um filamento de lâmpada incandescente colocado no plano focal dos binóculos através do qual o corpo emissor é visto. A corrente elétrica que aquece o filamento da lâmpada é alterada até que uma comparação visual da luminescência do filamento e do corpo revele que o equilíbrio térmico foi estabelecido entre eles. A escala do dispositivo pode ser graduada diretamente em unidades de temperatura.
Os avanços técnicos nos últimos anos tornaram possível a criação de novos sensores de temperatura. Por exemplo, nos casos em que é necessária uma sensibilidade particularmente alta, um dispositivo semicondutor, o termistor, é usado em vez de um termopar ou termômetro de resistência convencional. Corantes e cristais líquidos que mudam seu estado de fase também são usados como conversores térmicos, especialmente nos casos em que a temperatura da superfície do corpo varia em uma ampla faixa. Por fim, utiliza-se a termografia infravermelha, na qual é obtida uma imagem infravermelha de um objeto em cores condicionais, onde cada cor corresponde a uma determinada temperatura. Este método de medição de temperatura encontra a aplicação mais ampla - desde diagnósticos médicos até a verificação do isolamento térmico das salas. Veja também FÍSICA DO ESTADO SÓLIDO; CRISTAL LÍQUIDO.
Medição da quantidade de calor. A energia térmica (quantidade de calor) de um corpo pode ser medida diretamente com o chamado calorímetro; Uma versão simples de tal dispositivo é mostrada na Fig. 5. Trata-se de um recipiente fechado cuidadosamente isolado, equipado com dispositivos para medir a temperatura no seu interior e, por vezes, preenchido com um fluido de trabalho com propriedades conhecidas, como a água. Para medir a quantidade de calor em um pequeno corpo aquecido, ele é colocado em um calorímetro e aguarda o sistema entrar em equilíbrio térmico. A quantidade de calor transferida para o calorímetro (mais precisamente, para a água que o enche) é determinada pelo aumento da temperatura da água.A quantidade de calor liberada durante uma reação química, como a combustão, pode ser medida colocando uma pequena "bomba" no calorímetro. A "bomba" contém uma amostra, à qual são conectados os fios elétricos para ignição e a quantidade correspondente de oxigênio. Depois que a amostra queima completamente e o equilíbrio térmico é estabelecido, determina-se o quanto a temperatura da água no calorímetro aumentou e, portanto, a quantidade de calor liberada. Veja também CALORIMETRIA.
Unidades de calor. O calor é uma forma de energia e, portanto, deve ser medido em unidades de energia. No sistema internacional SI, a unidade de energia é o joule (J). Também é permitido usar unidades não sistêmicas da quantidade de calor - calorias: uma caloria internacional é 4,1868 J, uma caloria termoquímica é 4,1840 J. Em laboratórios estrangeiros, os resultados da pesquisa são frequentemente expressos usando o chamado. Uma caloria de 15 graus igual a 4,1855 J. A unidade térmica britânica (BTU) fora do sistema está caindo em desuso: BTU médio = 1,055 J. As principais fontes de calor são reações químicas e nucleares, bem como vários processos de conversão de energia. Exemplos de reações químicas com liberação de calor são a combustão e a quebra de componentes dos alimentos. Quase todo o calor recebido pela Terra é fornecido por reações nucleares que ocorrem nas profundezas do Sol. A humanidade aprendeu a obter calor com a ajuda de processos controlados de fissão nuclear e agora está tentando usar reações de fusão termonuclear para o mesmo propósito. Outros tipos de energia também podem ser convertidos em calor, como trabalho mecânico e energia elétrica. É importante lembrar que a energia térmica (como qualquer outra) só pode ser transformada em outra forma, mas não pode ser obtida "do nada" nem destruída. Este é um dos princípios básicos da ciência chamada termodinâmica. TERMODINÂMICA A termodinâmica é a ciência da relação entre calor, trabalho e matéria. As idéias modernas sobre essas relações foram formadas com base nos trabalhos de grandes cientistas do passado como Carnot, Clausius, Gibbs, Joule, Kelvin e outros. expansão térmica dos corpos e o calor das transições de fase. Esta ciência é baseada em várias leis - princípios estabelecidos experimentalmente.Primórdios da termodinâmica. A lei zero da termodinâmica formulada acima introduz os conceitos de equilíbrio térmico, temperatura e termometria. A primeira lei da termodinâmica é uma afirmação de importância fundamental para toda a ciência como um todo: a energia não pode ser destruída nem obtida "do nada", então a energia total do Universo é um valor constante. Em sua forma mais simples, a primeira lei da termodinâmica pode ser enunciada da seguinte forma: a energia que o sistema recebe, menos a energia que ele cede, é igual à energia que permanece no sistema. À primeira vista, esta afirmação parece óbvia, mas não em tal, por exemplo, situações como a combustão de gasolina nos cilindros de um motor de automóvel: aqui a energia recebida é química, a energia liberada é mecânica (trabalho), e a energia restante no sistema é térmica.Assim, fica claro que a energia pode mudar de uma forma para outra e que tais transformações ocorrem constantemente na natureza e na tecnologia. Há mais de cem anos, J. Joule provou isso para o caso da conversão de energia mecânica em energia térmica usando o dispositivo mostrado na fig. 6, uma. Neste dispositivo, pesos descendentes e ascendentes giravam um eixo com lâminas em um calorímetro cheio de água, como resultado do aquecimento da água. Medições precisas permitiram a Joule determinar que uma caloria de calor é equivalente a 4,186 J de trabalho mecânico. O dispositivo mostrado na fig.
6, b, foi utilizado para determinar o equivalente térmico da energia elétrica.A primeira lei da termodinâmica explica muitos fenômenos comuns. Por exemplo, fica claro por que é impossível resfriar a cozinha com uma geladeira aberta. Vamos supor que temos isolado termicamente a cozinha do ambiente. A energia é fornecida continuamente ao sistema através do fio de alimentação do refrigerador, mas o sistema não emite energia. Assim, sua energia total aumenta e a cozinha fica mais quente: basta tocar nos tubos do trocador de calor (condensador) na parte de trás da geladeira e você entenderá sua inutilidade como dispositivo de "resfriamento". Mas se esses tubos fossem retirados do sistema (por exemplo, pela janela), a cozinha forneceria mais energia do que recebeu, ou seja, seria resfriado, e a geladeira funcionava como ar condicionado de janela.
A primeira lei da termodinâmica é uma lei da natureza que impede a criação ou destruição de energia. No entanto, não diz nada sobre como os processos de transferência de energia ocorrem na natureza. Assim, sabemos que um corpo quente aquecerá um corpo frio se esses corpos forem postos em contato. Mas pode um corpo frio por si só transferir sua reserva de calor para um corpo quente? Última oportunidade categoricamente rejeitado pela segunda lei da termodinâmica.
A primeira lei também exclui a possibilidade de criar um motor com coeficiente ação útil(eficiência) mais de 100% (semelhante
"eterno" o motor pode liberar mais energia por um tempo arbitrariamente longo do que consome). É impossível construir um motor mesmo com uma eficiência igual a 100%, pois alguma parte da energia fornecida a ele deve necessariamente ser perdida por ele na forma de energia térmica menos útil. Assim, a roda não girará indefinidamente sem fornecimento de energia, pois devido ao atrito nos rolamentos, a energia do movimento mecânico se transformará gradualmente em calor até que a roda pare.A tendência de converter trabalho "útil" em energia menos útil - calor - pode ser comparada com outro processo que ocorre quando dois recipientes contendo gases diferentes são conectados. Depois de esperar bastante, encontramos em ambos os vasos uma mistura homogênea de gases - a natureza funciona para que a ordem do sistema diminua. A medida termodinâmica dessa desordem é chamada entropia, e a segunda lei da termodinâmica pode ser formulada de maneira diferente: os processos na natureza sempre ocorrem de tal maneira que a entropia do sistema e de seu ambiente aumenta. Assim, a energia do Universo permanece constante, enquanto sua entropia cresce continuamente.
Calor e propriedades das substâncias. Diferentes substâncias têm diferentes capacidades de armazenar energia térmica; depende de sua estrutura molecular e densidade. A quantidade de calor necessária para aumentar a temperatura de uma unidade de massa de uma substância em um grau é chamada de calor específico. A capacidade calorífica depende das condições em que a substância está localizada. Por exemplo, para aquecer um grama de ar em um balão em 1 K, é necessário mais calor do que aquecê-lo da mesma forma em um recipiente selado com paredes rígidas, pois parte da energia transmitida ao balão é gasta na expansão do balão. ar, e não ao aquecê-lo. Portanto, em particular, a capacidade calorífica dos gases é medida separadamente a pressão constante e a volume constante.Com o aumento da temperatura, a intensidade do movimento caótico das moléculas aumenta - a maioria das substâncias se expande quando aquecida. O grau de expansão de uma substância com um aumento de temperatura de 1 K é chamado de coeficiente de expansão térmica.
Para que uma substância passe de um estado de fase para outro, por exemplo, de sólido para líquido (e às vezes imediatamente para gasoso), ela deve receber uma certa quantidade de calor. Se um corpo sólido for aquecido, sua temperatura aumentará até que comece a derreter; até que a fusão seja concluída, a temperatura do corpo permanecerá constante, apesar do fornecimento de calor. A quantidade de calor necessária para derreter uma unidade de massa de uma substância é chamada de calor de fusão. Se você continuar fornecendo calor, a substância derretida aquecerá até ferver. A quantidade de calor necessária para vaporizar uma unidade de massa de um líquido a uma dada temperatura é chamada de calor de vaporização.
Teoria molecular-cinética. A teoria da cinética molecular explica as propriedades macroscópicas de uma substância considerando no nível microscópico o comportamento dos átomos e moléculas que compõem essa substância. Neste caso, uma abordagem estatística é usada e algumas suposições são feitas sobre as próprias partículas e a natureza de seu movimento. Assim, as moléculas são consideradas bolas sólidas, que em meios gasosos estão em movimento caótico contínuo e percorrem distâncias consideráveis de uma colisão a outra. As colisões são consideradas elásticas e ocorrem entre partículas cujo tamanho é pequeno e o número é muito grande. Nenhum dos gases reais corresponde exatamente a esse modelo, mas a maioria dos gases está bem próxima dele, o que explica o valor prático da teoria cinética molecular.Com base nessas ideias e usando uma abordagem estatística, Maxwell deduziu a distribuição das velocidades das moléculas de gás em um volume limitado, que mais tarde recebeu seu nome. Esta distribuição é apresentada graficamente na fig. 7 para uma dada massa de hidrogênio a temperaturas de 100 e 1000
° C. A ordenada representa o número de moléculas que se movem na velocidade indicada na abcissa. O número total de partículas é igual à área sob cada curva e é o mesmo em ambos os casos. Pode-se ver pelo gráfico que a maioria das partículas tem velocidades próximas a algum valor médio, e apenas um pequeno número delas tem velocidades muito altas ou baixas. As velocidades médias nestas temperaturas estão na faixa de 2.000 a 3.000 m/s, ou seja, muito grande.Um grande número dessas moléculas de gás em movimento rápido atua com uma força completamente mensurável nos corpos circundantes. As forças microscópicas com as quais numerosas moléculas de gás atingem as paredes do vaso somam uma quantidade macroscópica chamada pressão. Quando a energia é fornecida a um gás (a temperatura aumenta), a energia cinética média de suas moléculas aumenta, as partículas de gás atingem as paredes com mais frequência e com mais força, a pressão aumenta e, se as paredes não forem completamente rígidas, elas se esticam e o gás volume aumenta. Assim, a abordagem estatística microscópica subjacente à teoria cinética molecular torna possível explicar o fenômeno de expansão térmica que discutimos.
Outro resultado da teoria da cinética molecular é uma lei que descreve as propriedades de um gás que satisfaz os requisitos listados acima. Esta é a chamada equação de estado gás ideal conecta a pressão, volume e temperatura de um mol de gás e tem a forma de igualdade
PV = RT onde P - pressão, V - volume, T é a temperatura e R é a constante universal do gás igual a (8,31441± 0,00026) J/(mol H PARA). Veja também TEORIA MOLECULAR-CINÉTICA; TERMODINÂMICA. TRANSFERÊNCIA DE CALOR A transferência de calor é o processo de transferência de calor dentro de um corpo ou de um corpo para outro, devido a diferenças de temperatura. A intensidade da transferência de calor depende das propriedades da substância, da diferença de temperatura e obedece às leis da natureza estabelecidas experimentalmente. Para criar sistemas eficientes de aquecimento ou resfriamento, vários motores, usinas de energia, sistemas de isolamento térmico, você precisa conhecer os princípios da transferência de calor. Em alguns casos, a troca de calor é indesejável (isolamento térmico de fornos de fusão, naves espaciais, etc.), enquanto em outros deve ser o maior possível (caldeiras a vapor, trocadores de calor, utensílios de cozinha).Existem três tipos principais de transferência de calor: condução, convecção e transferência de calor radiante.
Condutividade térmica. Se houver uma diferença de temperatura dentro do corpo, a energia térmica passa da parte mais quente para a mais fria. Esse tipo de transferência de calor, devido a movimentos térmicos e colisões de moléculas, é chamado de condutividade térmica; o suficiente temperaturas altas em sólidos pode ser observado visualmente. Assim, quando uma haste de aço é aquecida de uma extremidade na chama de um queimador de gás, a energia térmica é transferida através da haste e um brilho se espalha a uma certa distância da extremidade aquecida (menos e menos intensa com a distância do local de aquecimento).A intensidade da transferência de calor devido à condutividade térmica depende do gradiente de temperatura, ou seja, relações
D T/D x diferença de temperatura nas extremidades da haste para a distância entre elas. Também depende da área da seção transversal da haste (em m 2 ) e a condutividade térmica do material[ em unidades correspondentes W/(m Ch K) ] . A relação entre essas quantidades foi derivada pelo matemático francês J. Fourier e tem a seguinte forma: Onde q - fluxo de calor, k é o coeficiente de condutividade térmica, e UMA - área da seção transversal. Essa relação é chamada de lei de condução de calor de Fourier; o sinal de menos indica que o calor é transferido na direção oposta ao gradiente de temperatura.Decorre da lei de Fourier que o fluxo de calor pode ser reduzido reduzindo uma das quantidades - o coeficiente de condutividade térmica, área ou gradiente de temperatura. Para um edifício em condições de inverno, os últimos valores são praticamente constantes e, portanto, para manter a temperatura desejada na sala, resta reduzir a condutividade térmica das paredes, ou seja, melhorar o seu isolamento térmico.
A tabela mostra os coeficientes de condutividade térmica de algumas substâncias e materiais. A tabela mostra que alguns metais conduzem o calor muito melhor do que outros, mas todos eles são condutores de calor muito melhores do que o ar e os materiais porosos.
|
CONDUTIVIDADE TÉRMICA DE ALGUMAS SUBSTÂNCIAS E MATERIAIS |
|
|
Substâncias e materiais |
Condutividade térmica, W / (m × K) |
| Alumínio | |
| Bronze | |
| Bismuto | |
| Tungstênio | |
| Ferro | |
| Ouro | |
| Cádmio | |
| Magnésio | |
| Cobre | |
| Arsênico | |
| Níquel | |
| Platina | |
| Mercúrio | |
| Conduzir | |
| Zinco | |
|
Outros materiais |
|
| Amianto | |
| Concreto | |
| Ar | |
| Eider para baixo (solto) | |
| noz de árvore) | |
| Magnésia (MgO) | |
| Serragem | |
| Borracha (esponja) | |
| Mica | |
| Vidro | |
| Carbono (grafite) | |
A resistência térmica e elétrica de muitas substâncias diminui drasticamente à medida que a temperatura cai abaixo da temperatura do hélio líquido (1,8 K). Esse fenômeno, chamado supercondutividade, é usado para melhorar a eficiência de muitos dispositivos, desde microeletrônicos a linhas de energia e grandes eletroímãs. Veja também SUPERCONDUTIVIDADE.
Convecção. Como já dissemos, quando o calor é aplicado a um líquido ou gás, a intensidade do movimento das moléculas aumenta e, como resultado, a pressão aumenta. Se um líquido ou gás não é limitado em volume, eles se expandem; a densidade local do líquido (gás) torna-se menor e, devido às forças de flutuação (arquimedianas), a parte aquecida do meio se move para cima (é por isso que o ar quente na sala sobe das baterias para o teto). Esse fenômeno é chamado de convecção. Para não desperdiçar o calor do sistema de aquecimento à toa, você precisa usar aquecedores modernos que fornecem circulação forçada de ar.O fluxo de calor convectivo do aquecedor para o meio aquecido depende da velocidade inicial das moléculas, densidade, viscosidade, condutividade térmica e capacidade de calor e do meio; o tamanho e a forma do aquecedor também são muito importantes. A razão entre as quantidades correspondentes obedece à lei de Newton
q = hA ( T W- TҐ ), onde q - fluxo de calor (medido em watts), UMA é a área da superfície da fonte de calor (em m 2), T W e T são as temperaturas da fonte e seu ambiente (em kelvins). Coeficiente de transferência de calor por convecção h depende das propriedades do meio, da velocidade inicial de suas moléculas e também da forma da fonte de calor, e é medida em unidades de W/(m 2 horas PARA).Valor
h não é o mesmo para os casos em que o ar ao redor do aquecedor está estacionário (convecção livre) e quando o mesmo aquecedor está no fluxo de ar (convecção forçada). Em casos simples de fluxo de fluido através de um tubo ou fluxo em torno de uma superfície plana, o coeficiente h pode ser calculado teoricamente. No entanto, ainda não foi possível encontrar uma solução analítica para o problema da convecção para um escoamento turbulento de um meio. A turbulência é um movimento complexo de um líquido (gás), caótico em uma escala que excede significativamente a escala molecular.Se um corpo aquecido (ou, inversamente, frio) é colocado em um meio estacionário ou em um fluxo, correntes convectivas e uma camada limite são formadas ao seu redor. A temperatura, pressão e velocidade das moléculas nesta camada desempenham um papel importante na determinação do coeficiente de transferência de calor por convecção.
A convecção deve ser considerada no projeto de trocadores de calor, sistemas de ar condicionado, aeronaves de alta velocidade e muitas outras aplicações. Em todos esses sistemas, a condução de calor ocorre simultaneamente com a convecção, tanto entre sólidos quanto em seu ambiente. No temperaturas elevadas A transferência de calor radiante também pode desempenhar um papel significativo.
Transferência de calor radiante. O terceiro tipo de transferência de calor - transferência de calor radiante - difere da condução de calor e convecção, pois o calor, neste caso, pode ser transferido através do vácuo. Sua semelhança com outros métodos de transferência de calor é que também se deve à diferença de temperatura. A radiação térmica é um dos tipos radiação eletromagnética. Seus outros tipos - ondas de rádio, radiação ultravioleta e gama - ocorrem na ausência de diferença de temperatura.Na fig. 8 mostra a dependência da energia da radiação térmica (infravermelha) no comprimento de onda. A radiação térmica pode ser acompanhada pela emissão de luz visível, mas sua energia é pequena em comparação com a energia de radiação da parte invisível do espectro.
A intensidade da transferência de calor por condução e convecção de calor é proporcional à temperatura, e o fluxo de calor radiante é proporcional à quarta potência da temperatura e obedece à lei de Stefan-Boltzmann
Os espaços residenciais e de escritórios são frequentemente aquecidos com pequenos emissores elétricos de calor; o brilho avermelhado de suas espirais é a radiação térmica visível, próxima à borda da parte infravermelha do espectro. A sala é aquecida pelo calor, que é transportado principalmente pela parte invisível e infravermelha da radiação. Em dispositivos de visão noturna
^ A câmera usa uma fonte de radiação térmica e um receptor sensível a IR que permite que você veja no escuro.O Sol é um poderoso emissor de energia térmica; aquece a Terra mesmo a uma distância de 150 milhões de km. A intensidade da radiação solar, registrada ano após ano por estações localizadas em várias partes do globo, é de aproximadamente 1,37 W
/m2 . A energia solar é a fonte da vida na Terra. Pesquisas estão sendo feitas para maneiras de usá-lo de forma mais eficaz. Painéis solares foram criados para aquecer casas e gerar eletricidade para as necessidades domésticas. O PAPEL DO CALOR E SEU USO Os processos globais de transferência de calor não se reduzem ao aquecimento da Terra pela radiação solar. Massivas correntes de convecção na atmosfera determinam mudanças diárias nas condições climáticas em todo o globo. As diferenças de temperatura na atmosfera entre as regiões equatorial e polar, juntamente com as forças de Coriolis devido à rotação da Terra, levam ao aparecimento de correntes de convecção em constante mudança, como ventos alísios, correntes de jato e frentes quentes e frias. Veja também CLIMA; METEOROLOGIA E CLIMATOLOGIA.A transferência de calor (devido à condutividade térmica) do núcleo fundido da Terra para sua superfície leva a erupções vulcânicas e ao aparecimento de gêiseres. Em algumas regiões, a energia geotérmica é usada para aquecimento de ambientes e geração de energia.
O calor é um participante indispensável em quase todos os processos de produção. Mencionaremos os mais importantes, como a fundição e processamento de metais, o funcionamento de motores, a produção de alimentos, a síntese química, o refino de petróleo, a fabricação de uma grande variedade de itens - de tijolos e louças a carros e aparelhos eletrônicos .
Muitas produções industriais e de transporte, assim como usinas termelétricas, não poderiam funcionar sem motores térmicos - dispositivos que convertem calor em trabalho útil. Exemplos de tais máquinas são compressores, turbinas, vapor, gasolina e motores a jato.
Uma das máquinas térmicas mais famosas é a turbina a vapor, que implementa parte do ciclo Rankine usado em usinas modernas. Um diagrama simplificado deste ciclo é mostrado na fig. 9. O fluido de trabalho - água - é convertido em vapor superaquecido em uma caldeira a vapor aquecida pela queima de combustíveis fósseis (carvão, petróleo ou gás natural). Vapor alta pressão gira o eixo de uma turbina a vapor, que aciona um gerador que gera eletricidade. O vapor de exaustão condensa quando resfriado por água corrente, que absorve parte do calor não utilizado no ciclo Rankine. Em seguida, a água é alimentada na torre de resfriamento (torre de resfriamento), de onde parte do calor é liberado para a atmosfera. O condensado é bombeado de volta para a caldeira de vapor e todo o ciclo é repetido.
Todos os processos do ciclo Rankine ilustram os princípios da termodinâmica descritos acima. Em particular, de acordo com a segunda lei, parte da energia consumida pela usina deve ser dissipada no ambiente na forma de calor. Acontece que cerca de 68% da energia originalmente contida nos combustíveis fósseis é perdida dessa maneira. Um aumento notável na eficiência da usina poderia ser alcançado apenas aumentando a temperatura da caldeira a vapor (que é limitada pela resistência ao calor dos materiais) ou diminuindo a temperatura do meio onde o calor vai, ou seja, atmosfera.
Outro ciclo termodinâmico com grande importância na nossa Vida cotidiana, é o ciclo de refrigeração de compressor de vapor Rankin, cujo esquema é mostrado na fig. 10. Em refrigeradores e aparelhos de ar condicionado domésticos, a energia é fornecida de fora para fornecê-la. O compressor aumenta a temperatura e a pressão da substância de trabalho do refrigerador - freon, amônia ou dióxido de carbono. O gás superaquecido é alimentado no condensador, onde é resfriado e condensado, liberando calor para o ambiente. O líquido que sai dos bicos do condensador passa pela válvula de estrangulamento para o evaporador e parte dele evapora, o que é acompanhado por uma queda acentuada da temperatura. O evaporador retira calor da câmara frigorífica, que aquece o fluido de trabalho nos bicos; este líquido é fornecido pelo compressor ao condensador, e o ciclo se repete novamente.
O ciclo de refrigeração mostrado na fig. 10 também pode ser usado em uma bomba de calor. Essas bombas de calor no verão emitem calor para o ar atmosférico quente e condicionam a sala, e no inverno, pelo contrário, retiram calor do ar frio e aquecem a sala.
As reações nucleares são uma importante fonte de calor para fins como geração de energia e transporte. Em 1905, A. Einstein mostrou que massa e energia estão relacionadas pela relação
E=mc2 , ou seja podem passar um no outro. velocidade da luz c muito grande: 300 mil km/ Com. Isso significa que mesmo uma pequena quantidade de matéria pode fornecer uma enorme quantidade de energia. Assim, a partir de 1 kg de material cindível (por exemplo, urânio), é teoricamente possível obter energia, que para 1000 dias de operação contínua é fornecida por uma usina com capacidade de 1 MW. Veja também ESTRUTURA DO ÁTOMO; FORNOS E TECNOLOGIA DE FORNOS; RADIAÇÃO ELETROMAGNÉTICA; TROCADOR DE CALOR; TURBINA; UNIDADES DE MEDIDA DE QUANTIDADES FÍSICAS.LITERATURA Zemansky M. Temperaturas muito altas e muito baixas. M., 1968Paulo R. Mecânica, acústica e a doutrina do calor. M., 1971
Smorodinsky Ya.A. Temperatura. M., 1981
Fã J. Máquinas, energia e entropia. M., 1986
Atkins P.V. Ordem e desordem na natureza. M., 1987
Calorímetros líquidos
Este tipo de calorímetro, o mais utilizado em tecnologia, tem um design simples e fácil manutenção. A quantidade de calor produzida por uma reação induzida externamente é primeiro transferida para o recipiente de reação (no qual a reação ocorreu) e depois para o banho líquido. O líquido no banho é agitado continuamente por meio de um impulsor, um parafuso de elevação ou bombas, que aceleram a equalização das temperaturas. O banho é isolado termicamente (blindado) do ambiente tanto quanto possível. A mudança de temperatura do banho líquido é uma medida da quantidade de calor detectada. A capacidade calorífica das massas a serem aquecidas não deve ser muito alta para garantir uma mudança de temperatura suficiente e para que o processo de medição não dure muito (devido ao aumento das perdas de calor).
Figura Dispositivo de um calorímetro líquido.
Com altas demandas na constância das condições ambientais, é possível colocar todo o calorímetro em outro banho e estabilizar a temperatura nele com alta precisão usando uma malha de controle. Isso é necessário em primeiro lugar nos casos em que é necessário realizar um experimento em temperaturas que diferem significativamente da temperatura ambiente.
Para análise em baixas temperaturas (até cerca de -150°C), o nitrogênio líquido é usado como meio de resfriamento. Nesse caso, é necessário atentar para o fato de que, ao trocá-los, a geada do ar úmido ao redor não precipita nas amostras ou nos recipientes de amostra, pois sua camada pode afetar o processo de medição. Para evitar isso, quando o calorímetro está aberto, a amostra e o recipiente de amostra são purgados com gás nitrogênio frio.
Calorímetros de corpo metálico
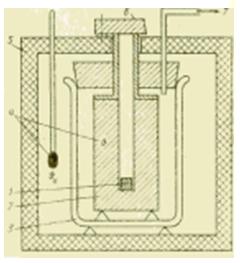
Figura Esquema do dispositivo de um calorímetro de metal.
Se for necessário realizar estudos calorimétricos em uma faixa de temperatura mais ampla, os calorímetros líquidos não são mais adequados. Nos calorímetros de corpo metálico adequados para este fim, a quantidade de calor transferida é absorvida por um bloco de metal (prata, cobre, alumínio) que geralmente está à temperatura ambiente. Tal calorímetro destina-se principalmente a determinar a capacidade de calor específico c, J / (kg * K), substâncias líquidas e sólidas.
A amostra é primeiro resfriada fora do calorímetro em planta de refrigeração ou aquecido em uma fornalha e, depois de atingir um estado estável, abaixado (caído) em um buraco em um bloco de metal. De acordo com o método de operação, esse dispositivo é chamado de calorímetro de queda livre e, de acordo com a natureza dos processos termodinâmicos, às vezes é chamado de calorímetro de deslocamento.
A quantidade de calor transferida durante esta mistura da amostra (com parâmetros m1, c1, ) para o bloco de metal (m2, c2, ) causa uma mudança mensurável na temperatura do bloco. Isso torna possível determinar o valor geralmente desconhecido da capacidade calorífica específica da amostra para condições ideais(na ausência de troca de calor com o ambiente) da expressão:
O próprio bloco de metal está localizado em um recipiente Dewar evacuado e, às vezes, em um banho líquido. Neste último caso, para obter a capacidade calorífica do calorímetro Ck, a capacidade calorífica do banho Cw deve ser somada à capacidade calorífica do bloco metálico C2:
CK=C2+CW=c2m2+cWmW.
MÉTODOS CALORIMÉTRICOS DE MEDIÇÃO
Na maioria das vezes, os calorímetros são usados no modo de condições ambientais constantes. Isso se aplica principalmente à maioria dos calorímetros de combustão, nos quais o tempo de reação é muito curto. Enquanto a temperatura das partes internas do calorímetro muda devido à reação, a temperatura do ar ambiente permanece constante. Em muitos casos, um banho com temperatura controlada é usado como ambiente para evitar influência no valor medido de interferência externa - flutuações de temperatura na sala, radiação, correntes de ar, etc.
A vantagem deste esquema de medição é o custo relativamente baixo do equipamento, que pode ser usado para realizar a parte predominante das medições calorimétricas. A principal desvantagem deve ser considerada a troca de calor do calorímetro com o ambiente, o que dificulta a interpretação dos resultados. Este método de medição é sempre chamado de isoperibol (diatérmico). Em qualquer caso, não pode ser chamado de isotérmico, cuja essência reside no fato de que a temperatura do calorímetro permanece constante durante o curso da reação, como, por exemplo, calorímetros projetados para medir transformações de fase.
método adiabático
Se for possível excluir a troca de calor com o ambiente, ou seja, para garantir o fluxo adiabático do processo, o experimento e a interpretação dos resultados são simplificados e o resultado da medição é mais preciso, pois não há necessidade de registro contínuo a mudança de temperatura e calcular as correções. Além disso, neste caso, um aumento de temperatura um pouco maior no recipiente do calorímetro pode ser tolerado; para dispositivos não adiabáticos, isso é inaceitável devido a um aumento nas perdas de calor.
Para evitar a troca de calor entre o recipiente do calorímetro e seu entorno imediato (geralmente o banho líquido), a temperatura do banho deve ser constantemente corrigida de acordo com as mudanças de temperatura dentro do recipiente. Com a ajuda de um controlador eletrônico (circuito de rastreamento) é possível manter constantemente a diferença dessas temperaturas praticamente igual a zero. Isso aumenta o custo do equipamento de medição, dependendo da precisão de medição necessária.
Os elementos de hardware devem ser rápidos e estáveis por um longo tempo (ter desvio mínimo). A zona morta do circuito de controle de rastreamento deve estar na faixa de ±10-3 a ±10-5 K. Como dispositivos de medição, podem ser usados quaisquer termômetros de contato elétrico de resposta rápida, que, quando incluídos no circuito de ponte, fornecem um impulso ao controlador para alterar a potência de aquecimento. O aquecimento é realizado por meio de uma bobina de resistência elétrica ou diretamente em um banho líquido, que atua como um resistor de aquecimento devido à dissociação fraca (o chamado aquecimento eletrolítico). Este segundo método é praticamente inercial. O resultado pode ser obtido usando meios já existentes para medição de temperatura elétrica ou usando um termômetro de líquido instalado adicionalmente (Beckmann).
O método de medição adiabático é adequado para estudar principalmente processos lentos e efeitos térmicos. Com mudanças rápidas na quantidade de calor (nos calorímetros de combustão), a inércia da equalização da temperatura tem um efeito tão desfavorável que nem mesmo a precisão dos métodos convencionais não adiabáticos é alcançada. No entanto, ao fornecer uma baixa capacidade calorífica dos elementos de aquecimento e sensores de temperatura e pela mistura intensiva do líquido do banho, é possível obter pequenos valores de várias constantes de tempo (reduzir a inércia).
Método de compensação
Usando calorímetros diferenciais ou duplos baseados no princípio de compensação, é possível eliminar amplamente as influências externas no processo de medição. Dois recipientes calorimétricos idênticos com acessórios idênticos são colocados em um ambiente sob as mesmas condições. Em um vaso ocorre o processo em estudo com efeito térmico, e o outro vaso é aquecido com auxílio de um sistema de servocontrole de forma que a perda de calor para o ambiente para ambos os vasos seja a mesma. Portanto, a potência de aquecimento de entrada pode ser colocada em proporção direta com a quantidade de calor liberada durante o processo em estudo. Neste caso, a tarefa experimental de medição vai para outra área e se reduz a uma determinação muito precisa da potência de aquecimento elétrica fornecida (W * s, J):
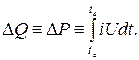
O calorímetro diferencial é usado, em particular, sob condições ambientais adiabáticas, especialmente quando mudanças muito pequenas ou muito lentas na quantidade de calor são esperadas. Nos processos endotérmicos, basta ter um vaso calorimétrico. A entrada de calor é controlada de tal forma que a temperatura no recipiente permanece a mesma o tempo todo (método isotérmico). A desvantagem dos calorímetros diferenciais é o alto custo dos equipamentos e instrumentos de medição.
CALORÍMETROS DE COMBUSTÃO
O combustível utilizado nas instalações de aquecimento e energia é examinado para determinar o seu poder calorífico H (J/kg). Este indicador é necessário para determinar os fatores de eficiência, estudar a eficiência e calcular a energia consumida em várias instalações, bem como para o controle ideal do processo de combustão. Flutuações significativas na composição de componentes combustíveis muitas vezes exigem a determinação contínua do poder calorífico.
Quando uma substância é completamente queimada, uma certa quantidade de calor Q (calor de combustão) é liberada. Se dividirmos pela massa m (ou pelo volume em condições normais Vn), obtemos o calor (específico) de combustão:
Dependendo do estado dos produtos de combustão, distinguem-se dois tipos de poder calorífico: H0 mais alto e H mais baixo, que também são chamados de calor de combustão e poder calorífico. Ao determinar o poder calorífico líquido do Ni, a água formada durante reações químicas deve estar em estado de vapor. A diferença entre os dois calores H0 - Ni corresponde ao calor de vaporização da água condensada (índice KO - condensado) r, que é igual a 2,441 MJ/kg.
Para combustíveis sólidos e líquidos, a quantidade de água resultante pode ser determinada com base na análise elementar e, ao queimar combustíveis gasosos, medindo a quantidade de condensado.
Em fornos industriais, a temperatura dos produtos de combustão sempre excede o ponto de ebulição da água. Portanto, apenas o poder calorífico líquido Ni costuma ser de interesse, uma vez que o calor de condensação da água não pode ser utilizado.
Calorímetros de Combustão para Sólidos e Líquidos
Para processos de combustão rápida, foi desenvolvida uma forma especial de calorímetro líquido - a chamada bomba calorimétrica de Berthelot (Fig. 3).
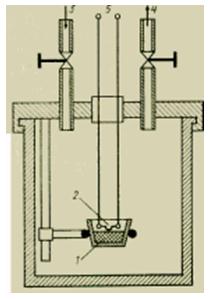
Figura O dispositivo de uma bomba calorimétrica.
A combustão de uma quantidade pequena e precisamente medida de uma substância ocorre a um volume constante em uma bomba selada em uma atmosfera do oxigênio mais puro possível a uma pressão de ~30 atm (3 MPa). A bomba cheia é colocada no banho líquido do calorímetro, que absorve o calor liberado da combustão.
Sólidos geralmente prensados em pequenos briquetes (comprimidos) e pesados com muita precisão. Aconselha-se misturar substâncias pouco ardidas com líquidos de boa combustão com um calor de combustão conhecido (por exemplo, ácido benzóico). As substâncias líquidas são colocadas em copos (barcos) de platina ou quartzo ou em pequenas cápsulas plásticas. Na tampa, aparafusada ao corpo da bomba, estão todos os dispositivos necessários à pesquisa: válvulas para fornecimento de oxigênio e remoção de produtos da combustão, porta-amostras e um acendedor elétrico. A ignição é realizada fornecendo eletricidade a um fio de platina fino. O calor fornecido para a ignição deve ser medido com precisão para que possa ser levado em consideração ao decifrar os resultados do experimento. Em uma bomba calorimétrica, o maior poder calorífico H0 é determinado. Durante a verificação, o equivalente térmico do calorímetro Ck é determinado queimando uma substância de referência (por exemplo, ácido benzóico) ou usando um dispositivo de aquecimento elétrico.
Calorímetro de combustão para substâncias gasosas
Para determinar o calor de combustão de meios gasosos, existem vários métodos. Todos eles, ao contrário da bomba calorimétrica para substâncias sólidas e líquidas, são baseados em medição contínua. O princípio de medição utilizado é bastante simples. O gás de teste é continuamente queimado em um queimador a uma pressão constante. Todo o calor liberado durante a combustão é absorvido pelo fluxo do meio de resfriamento no trocador de calor (calorímetro úmido ou de troca de calor) ou pela mistura dos produtos da combustão com o fluxo de ar a uma taxa de fluxo conhecida (calorímetro seco ou de mistura). Normalmente determinar o valor calorífico líquido Hu. Para determinar o poder calorífico bruto H0, é necessário condensar o vapor de água (índice KO) contido nos gases de combustão. Conhecendo as vazões mássicas e a diferença de temperatura na entrada (índice e) e na saída (índice a) do calorímetro, é possível calcular o poder calorífico correspondente usando a equação do balanço térmico.
A preparação de gás necessária é basicamente a mesma em todos os calorímetros de gás. Antes da combustão, o gás (índice G) é primeiro limpo de impurezas mecânicas sólidas (no filtro) e umedecido (até saturação com umidade, 100%), e depois levado aos valores especificados de pressão preliminar (usando um redutor de pressão válvula) e temperatura do meio de refrigeração (índice K) . O ar necessário para a combustão (índice L) também é umidificado e levado à temperatura do meio de resfriamento.
Dependendo da precisão necessária e dos custos de instrumentação permitidos, algumas dessas condições podem não ser atendidas. Os calorímetros devem ser verificados com um gás de referência (por exemplo, hidrogênio) para determinar o desvio da equação para o estado ideal do calorímetro. Para um calorímetro de troca de calor (úmido), a equação acima tem a forma
onde e são as vazões mássicas do meio de resfriamento e combustível, kg/s; sk - capacidade de calor específico do meio de resfriamento, J / (kg * K); - aumento da temperatura do meio de resfriamento, K.
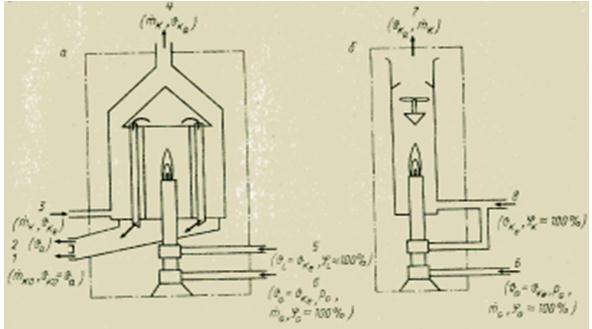
Figura Dispositivo de calorímetros úmido (a) e seco (b) para combustível gasoso.
O aumento de temperatura é tipicamente de 5 a 15 K. Devido à grande massa térmica, os calorímetros de transferência de calor têm uma constante de tempo muito longa, que pode chegar a vários minutos. Portanto, eles são menos adequados para uso em um circuito fechado de controle como sensor do que calorímetros secos (de mistura), cuja constante de tempo é de apenas alguns segundos. Por outro lado, a precisão alcançável dos calorímetros de troca de calor é comparativamente alta. Seu erro não excede ±0,25-1%, então eles também podem ser usados para trabalho de laboratório e para verificação. Os calorímetros secos (mistura) têm um erro de ±1 a ±2% do limite superior da faixa de medição.
Versões de projeto de calorímetros de vários fabricantes diferem principalmente em dispositivos auxiliares e de segurança, elementos sensores e circuitos computacionais que fornecem compensação de erros. Assim, nos calorímetros de troca de calor, a relação entre as vazões do gás e do meio de resfriamento é mantida de várias maneiras (veja a equação do calorímetro acima), devido à qual o maior poder calorífico H0 depende diretamente apenas do aumento da temperatura.
Nos calorímetros secos, o aumento da temperatura é medido diretamente usando termômetros de contato elétrico ou indiretamente usando um sensor dilatométrico - um tubo em expansão localizado no fluxo de gás de exaustão. No calorímetro ADOS, o alongamento térmico do tubo do dilatômetro corresponde diretamente ao calor de combustão e pode ser convertido em qualquer sinal usando uma ligação e um medidor de comprimento. No calorímetro Reinecke, a extensão da haste é utilizada como sinal de medição em um circuito de controle que controla o fluxo de ar de resfriamento de tal forma que o aumento de sua temperatura permanece quase constante. Nesse caso, a malha de controle acaba sendo puramente proporcional, mas algum desvio residual é inevitável nela. Neste caso, o consumo de ar de refrigeração ou o alongamento do tubo dilatométrico (haste) são uma medida do poder calorífico determinado. Um pré-requisito para obter precisão suficiente em todos os calorímetros secos é uma boa mistura de ar de resfriamento e produtos de combustão.
MEDIÇÕES DE FLUXO DE CALOR
O calor como tipo de energia é transferido de três maneiras: através de um corpo sólido (condução térmica), meio líquido ou gasoso (convecção) e sem a participação da matéria (radiação). Na tecnologia, todos os três componentes estão quase sempre envolvidos na transferência de calor; no entanto, em muitos casos é possível obter resultados de precisão aceitável medindo apenas um componente.
Medição fluxo de calor com condutividade térmica
A transferência de calor através de paredes condutoras de calor é de grande importância em muitas áreas da tecnologia (trocadores de calor de todos os tipos, isolamento térmico, etc.). Ao mesmo tempo, não é tanto o controle atual das quantidades de produção que interessa, mas os resultados de medições únicas utilizadas para avaliar a carga, verificar o cumprimento de indicadores garantidos e eficiência.
De acordo com as leis da condução de calor estacionária, o fluxo de calor é determinado pelas seguintes fórmulas (J/s):
Como a condutividade térmica da parede [J/(m*s*K)] e suas dimensões geométricas são conhecidas, a medição do fluxo de calor é reduzida à medição da diferença de temperatura. No entanto, esta técnica requer uma determinação muito precisa das temperaturas da superfície. Os erros associados a mudanças nas condições de transferência de calor ao instalar elementos sensíveis à temperatura em superfícies podem ser bastante grandes. Portanto, para medições mais precisas, os métodos abaixo são recomendados, nos quais tanto a condutividade térmica quanto a transferência de calor são usadas simultaneamente.
Medição de fluxos de calor na transferência de calor (transferência de calor combinada com condução de calor)
Para a parede plana mencionada na seção anterior, a seguinte lei de transferência de calor (J/s) é válida:
![]() ,
,
onde o coeficiente de transferência de calor k 1J/(m2*s*K)] juntamente com a condutividade térmica [J/Dm*s*K)] também leva em consideração os coeficientes de transferência de calor e [J/(m2*s*K) ] de ambos os lados da parede.
Em uma parede plana através da qual o fluxo de calor medido passa, uma pequena placa fina é colocada, cuja temperatura da superfície é determinada por termopares de filme fino embutidos. A vantagem de medir desta forma é que não requer conhecimento das propriedades térmicas da parede, e as propriedades correspondentes da placa podem ser reduzidas a um único valor constante durante a calibração. Tais elementos sensíveis têm um tamanho de aproximadamente 30x30x0,5 mm; a faixa de medição abrange fluxos de calor de 10 a 100.000 W/m2; o erro é de 2-5%.
Figura O princípio de funcionamento do medidor de fluxo de calor.
Com o aprimoramento desse método de medição, são utilizados tapetes de borracha em vez de uma placa sobreposta. Colando-os em superfícies não planas ou envolvendo-os em torno de uma superfície curva, é possível determinar a transferência de calor de uma superfície de uma área relativamente grande, por exemplo, de um tubo, vaso, etc. a esteira para que suas junções quente e fria fiquem exatamente uma contra a outra (Fig. 6). E neste caso, a densidade do fluxo de calor de acordo com a calibração é proporcional à diferença de temperatura. No entanto, as esteiras aplicadas atrapalham um pouco a transferência de calor inicial, que se torna perceptível com medições precisas. Portanto, este método de medição é usado principalmente para determinar as constantes termodinâmicas de uma substância, quando a violação do fluxo de calor não afeta o resultado da medição.
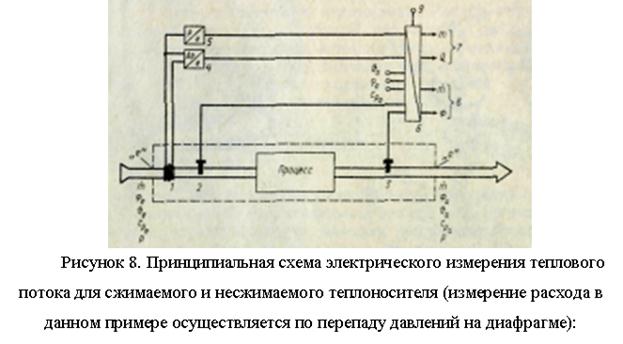
Medição de fluxos de calor em ambientes atuais.
Uma parte significativa da energia térmica é transferida por meios líquidos ou gasosos (água, vapor, etc.) que se deslocam em uma rede de dutos fechada. No entanto, em comparação com a transmissão de energia elétrica por fio, a distância sobre a qual a energia térmica pode ser transmitida é limitada. Para estudos termotécnicos de todos os tipos de sistemas de aquecimento e refrigeração, é necessário medir a liberação e o consumo de calor.
O fluxo de calor F (J/s), transmitido pelo fluxo do meio - transportador de calor (kg/s) através da seção de controle com área A (m2) em uma determinada zona, para a qual o balanço de calor é compilado (no zona de processo, Fig. 7), é igual a
A quantidade de calor liberada durante o intervalo de tempo t2 - t1 é determinada como uma integral (J):
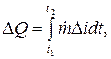
onde é a diferença no conteúdo de calor (entalpias, J/kg) do refrigerante na entrada (índice e) e na saída (índice a) da zona de equilíbrio térmico.
Como, no caso geral, o valor da entalpia é de interesse apenas em comparação com um certo nível, por exemplo, com entalpia à temperatura ambiente, todas as medições de fluxos de calor são essencialmente medições de diferenças.
As entalpias individuais incluídas na equação geral podem ser expressas em termos das temperaturas correspondentes e capacidades caloríficas específicas;
Assim, a medição do fluxo de calor é reduzida diretamente à medição de temperaturas e taxas de fluxo de massa. Em muitos casos, não é medida a massa, mas o fluxo de volume do refrigerante; neste caso, o resultado obtido diferirá apenas pelo valor da densidade do líquido refrigerante p. As capacidades caloríficas específicas, ci, são elas próprias funções da temperatura. No entanto, devido à estreita faixa de medição de muitos instrumentos, geralmente podem ser considerados valores constantes sem muita perda de precisão. A capacidade calorífica específica deve ser conhecida. Para líquidos, a equação do fluxo de calor é ainda mais simplificada, pois sua capacidades caloríficas específicas não dependem da pressão:
![]() , J/s.
, J/s.
Em todas as equações deste tipo, é necessário levar em conta os sinais das quantidades dependendo se o calor é fornecido ou removido, se o processo é endotérmico ou exotérmico, se ocorre resfriamento ou aquecimento.
