Teoria molekularno-kinetyczna gazów doskonałych
Czy wiedziałeś,
co to jest eksperyment myślowy, eksperyment gedanken?
To nieistniejąca praktyka, nieziemskie doświadczenie, wyobrażenie tego, czego tak naprawdę nie ma. Eksperymenty myślowe są jak marzenia. Rodzą potwory. W przeciwieństwie do eksperymentu fizycznego, który jest eksperymentalnym testem hipotez, „eksperyment myślowy” w magiczny sposób zastępuje test eksperymentalny pożądanymi, niesprawdzonymi wnioskami, manipulując konstrukcjami logicznymi, które faktycznie naruszają samą logikę, wykorzystując nieudowodnione przesłanki jako udowodnione, czyli poprzez podstawienie. Tak więc głównym zadaniem wnioskodawców "eksperymentów myślowych" jest oszukanie słuchacza lub czytelnika poprzez zastąpienie prawdziwego fizycznego eksperymentu jego "lalką" - fikcyjnym rozumowaniem warunkowym bez fizycznej weryfikacji.
Wypełnianie fizyki wyimaginowanymi „eksperymentami myślowymi” doprowadziło do powstania absurdalnego, surrealistycznego, mylącego obrazu świata. Prawdziwy badacz musi odróżnić takie „opakowania” od prawdziwych wartości.
Relatywiści i pozytywiści twierdzą, że „eksperyment myślowy” jest bardzo użytecznym narzędziem do testowania teorii (również powstających w naszych umysłach) pod kątem spójności. W tym oszukują ludzi, ponieważ weryfikacja może być przeprowadzona tylko przez źródło niezależne od przedmiotu weryfikacji. Sam wnioskodawca hipotezy nie może być testem własnego oświadczenia, ponieważ sam powód tego stwierdzenia jest brakiem sprzeczności widocznych dla wnioskodawcy w oświadczeniu.
Widzimy to na przykładzie SRT i GTR, które stały się rodzajem religii rządzącej nauką i… opinia publiczna. Żadna ilość sprzecznych z nimi faktów nie może pokonać formuły Einsteina: „Jeśli fakt nie odpowiada teorii, zmień fakt” (W innej wersji „Czy fakt nie odpowiada teorii? – Tym gorzej dla faktu ").
Maksymalną wartością „eksperymentu myślowego” jest jedynie wewnętrzna spójność hipotezy w ramach własnej, często bynajmniej nie prawdziwej, logiki wnioskodawcy. Zgodność z praktyką tego nie sprawdza. Prawdziwy test może mieć miejsce tylko w prawdziwym eksperymencie fizycznym.
Eksperyment jest eksperymentem, ponieważ nie jest udoskonalaniem myśli, ale testem myśli. Myśl, która jest spójna sama w sobie, nie może się sprawdzić. Udowodnił to Kurt Gödel.
W rozrzedzonym gazie odległość między cząsteczkami jest wielokrotnie większa niż ich rozmiar. W tym przypadku oddziaływanie między cząsteczkami jest znikome, a energia kinetyczna cząsteczek jest znacznie większa niż energia potencjalna ich oddziaływania.
Aby wyjaśnić właściwości substancji w stanie gazowym, zamiast gazu rzeczywistego stosuje się jej model fizyczny - gaz doskonały. Model zakłada:
odległość między cząsteczkami jest nieco większa niż ich średnica;
cząsteczki to elastyczne kulki;
nie ma przyciągających sił między cząsteczkami;
kiedy cząsteczki zderzają się ze sobą i ze ścianami naczynia, działają siły odpychające;
Ruch molekularny podlega prawom mechaniki.
Podstawowe równanie dla gazu doskonałego mkt:
Podstawowe równanie MKT umożliwia obliczenie ciśnienia gazu, jeśli znana jest masa cząsteczki, średnia wartość kwadratu prędkości i stężenie cząsteczek.
Idealne ciśnienie gazu polega na tym, że cząsteczki w zderzeniach ze ścianami naczynia oddziałują z nimi zgodnie z prawami mechaniki jako ciała elastyczne. Gdy cząsteczka zderza się ze ścianą naczynia, rzut prędkości v x wektora prędkości na oś OX, prostopadłą do ścianki, zmienia swój znak na przeciwny, ale w wartości bezwzględnej pozostaje stały. Dlatego w wyniku zderzeń cząsteczki ze ścianą rzut jej pędu na oś OX zmienia się z mv 1x = -mv x na mv 2x =mv x . Zmiana pędu cząsteczki po zderzeniu ze ścianą powoduje, że od strony ścianki działa na nią siła F 1 . Zmiana pędu cząsteczki jest równa pędowi tej siły:
Podczas zderzenia, zgodnie z trzecim prawem Newtona, cząsteczka działa na ścianę z siłą F 2 równą w wartości bezwzględnej sile F 1 i skierowaną przeciwnie.
Jest wiele cząsteczek, a każda z nich nadaje ścianie ten sam pęd po zderzeniu. W sekundę przekazują impuls 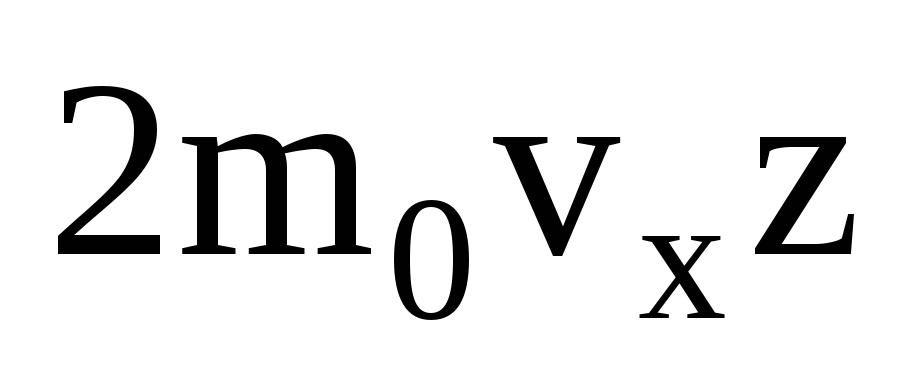 , gdzie z to liczba zderzeń wszystkich cząsteczek ze ścianą, która jest proporcjonalna do stężenia cząsteczek w gazie, prędkości cząsteczek i pola powierzchni ściany:
, gdzie z to liczba zderzeń wszystkich cząsteczek ze ścianą, która jest proporcjonalna do stężenia cząsteczek w gazie, prędkości cząsteczek i pola powierzchni ściany: 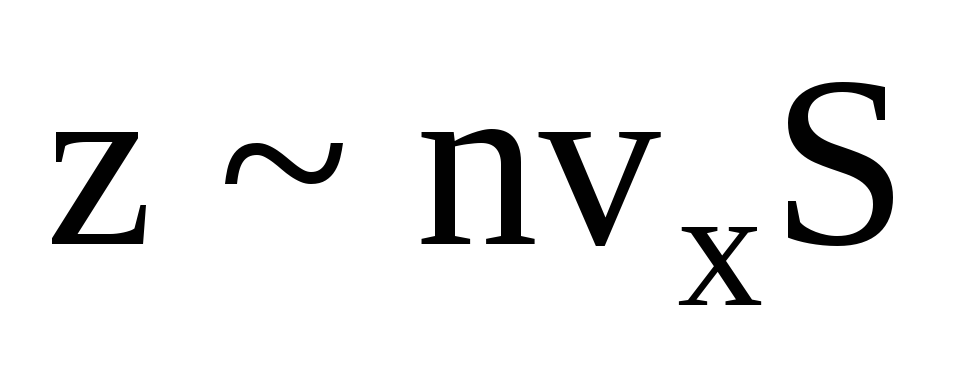 . Tylko połowa cząsteczek porusza się w kierunku ściany, reszta porusza się w przeciwnym kierunku:
. Tylko połowa cząsteczek porusza się w kierunku ściany, reszta porusza się w przeciwnym kierunku: 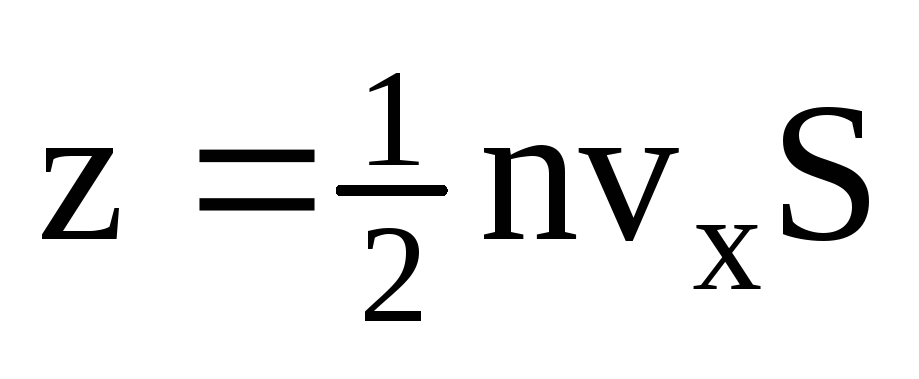 . Następnie całkowity pęd przeniósł się na ścianę w ciągu 1 sekundy:
. Następnie całkowity pęd przeniósł się na ścianę w ciągu 1 sekundy: 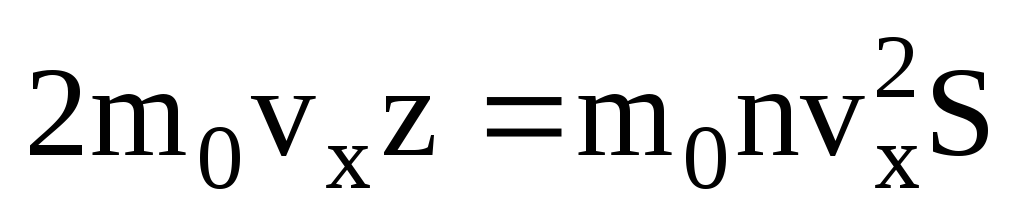 . Zgodnie z drugim prawem Newtona zmiana pędu ciała w jednostce czasu jest równa działającej na nie sile:
. Zgodnie z drugim prawem Newtona zmiana pędu ciała w jednostce czasu jest równa działającej na nie sile:
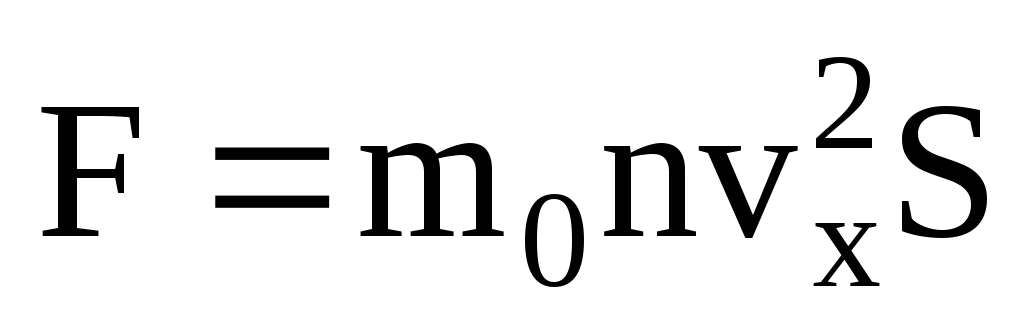
Biorąc pod uwagę, że nie wszystkie cząsteczki mają taką samą prędkość, siła działająca na ścianę będzie proporcjonalna do średniego kwadratu prędkości. Ponieważ cząsteczki poruszają się we wszystkich kierunkach, średnie wartości kwadratów rzutów prędkości są równe. Zatem średni kwadrat rzutu prędkości wynosi: 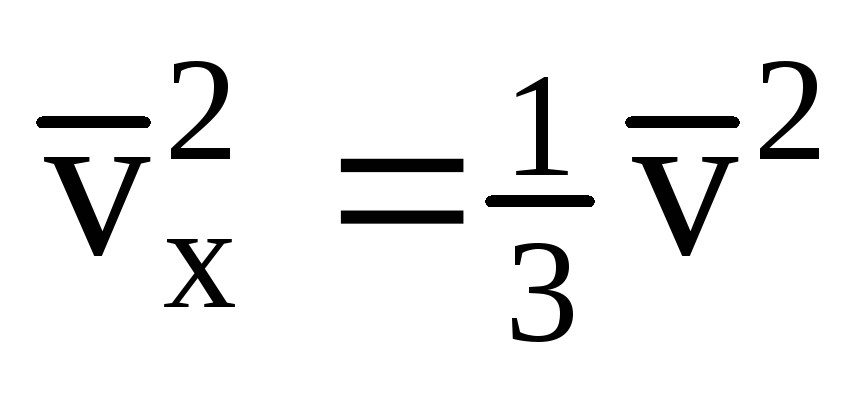 ;
;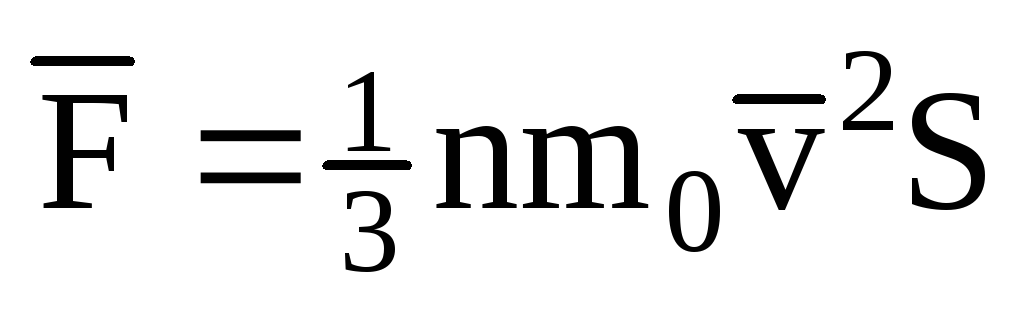 . Wtedy ciśnienie gazu na ściance naczynia wynosi:
. Wtedy ciśnienie gazu na ściance naczynia wynosi:
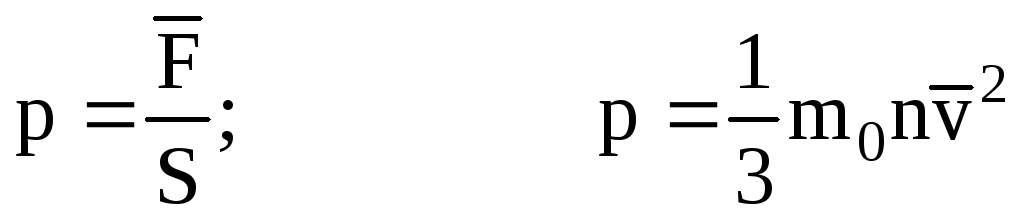 - podstawowe równanie MKT.
- podstawowe równanie MKT.
Oznaczanie średniej wartości energii kinetycznej ruchu translacyjnego cząsteczek gaz doskonały:
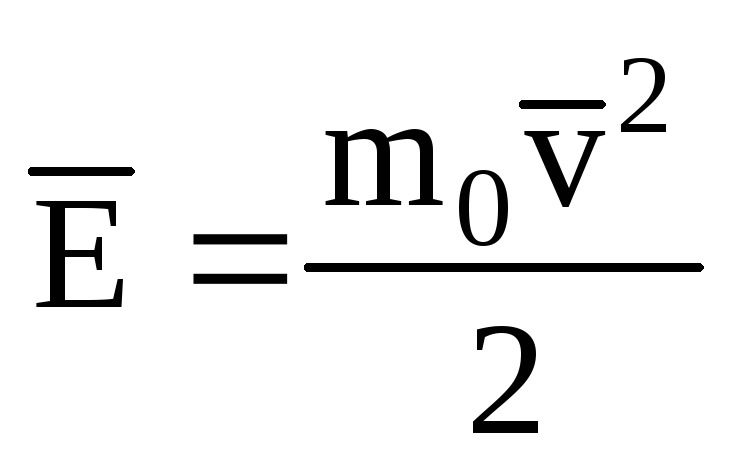 , dostajemy
, dostajemy
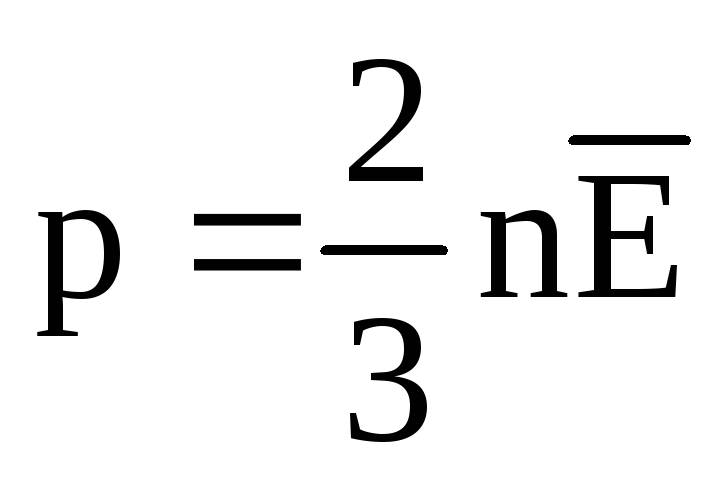
Temperatura i jej pomiar:
Podstawowe równanie MKT dla gazu doskonałego wiąże łatwo mierzalny makroskopowy parametr - ciśnienie - z takimi mikroskopijnymi parametrami gazu jak średnia energia kinetyczna i stężenie cząsteczek. Ale po zmierzeniu tylko ciśnienia nie możemy znaleźć ani średniej wartości energii kinetycznej cząsteczek osobno, ani ich stężenia. Dlatego, aby znaleźć mikroskopijne parametry gazu, potrzebne są pomiary innej wielkości fizycznej związanej ze średnią energią kinetyczną cząsteczek. Ta wartość to temperatura.
Każde makroskopowe ciało lub grupa makroskopowych ciał w stałych warunkach zewnętrznych spontanicznie przechodzi w stan równowagi termicznej. Równowaga termiczna - jest to stan, w którym wszystkie parametry makroskopowe pozostają niezmienione przez dowolnie długi czas.
Temperatura charakteryzuje stan równowagi termicznej układu ciał: wszystkie ciała układu, które są ze sobą w równowadze termicznej, mają tę samą temperaturę.
Do pomiaru temperatury można wykorzystać zmianę w dowolnej wielkości makroskopowej w zależności od temperatury: objętość, ciśnienie, opór elektryczny itp.
Najczęściej w praktyce stosuje się zależność objętości cieczy (rtęci lub alkoholu) od temperatury. Podczas kalibracji termometru za punkt odniesienia przyjmuje się zwykle temperaturę topnienia lodu (0); drugi stały punkt (100) to temperatura wrzenia wody przy normalnym ciśnieniu atmosferycznym (w skali Celsjusza). Ponieważ różne ciecze w różny sposób rozszerzają się po podgrzaniu, ustalona w ten sposób skala będzie w pewnym stopniu zależeć od właściwości danej cieczy. Oczywiście 0 i 100°C będą pasować dla wszystkich termometrów, ale 50°C nie.
W przeciwieństwie do cieczy, wszystkie rozrzedzone gazy rozszerzają się w ten sam sposób po podgrzaniu i zmieniają swoje ciśnienie w ten sam sposób wraz ze zmianą temperatury. Dlatego w fizyce, aby ustalić racjonalną skalę temperatury, stosuje się zmianę ciśnienia pewnej ilości rozrzedzonego gazu przy stałej objętości lub zmianę objętości gazu przy stałym ciśnieniu. Ta skala jest czasami nazywana idealna skala temperatury gazu.
W równowadze termicznej średnia energia kinetyczna ruchu translacyjnego cząsteczek wszystkich gazów jest taka sama. Ciśnienie jest wprost proporcjonalne do średniej energii kinetycznej ruchu translacyjnego cząsteczek: 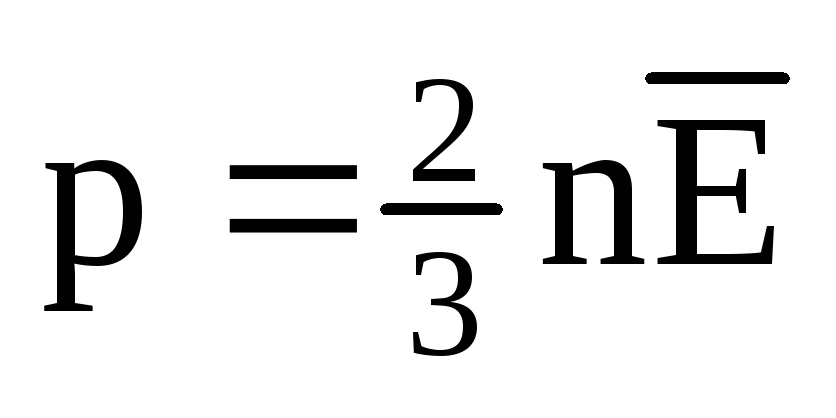 . W stanie równowagi termicznej, jeśli ciśnienie gazu o danej masie i jego objętości jest stałe, średnia energia kinetyczna cząsteczek gazu musi mieć ściśle określoną wartość, podobnie jak temperatura. Dlatego
. W stanie równowagi termicznej, jeśli ciśnienie gazu o danej masie i jego objętości jest stałe, średnia energia kinetyczna cząsteczek gazu musi mieć ściśle określoną wartość, podobnie jak temperatura. Dlatego 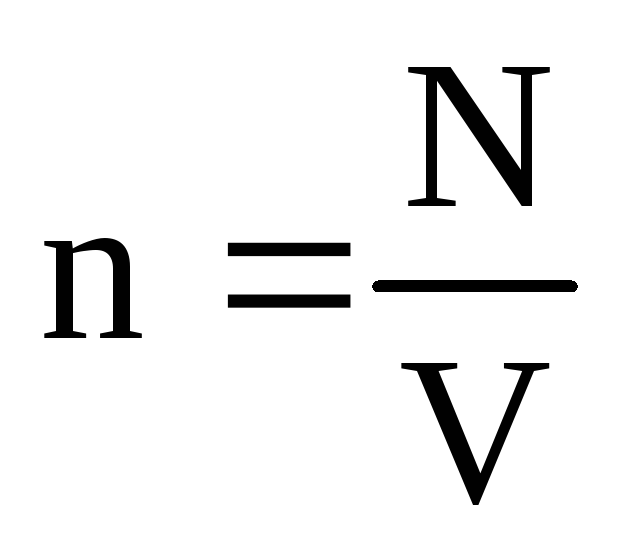 , następnie
, następnie 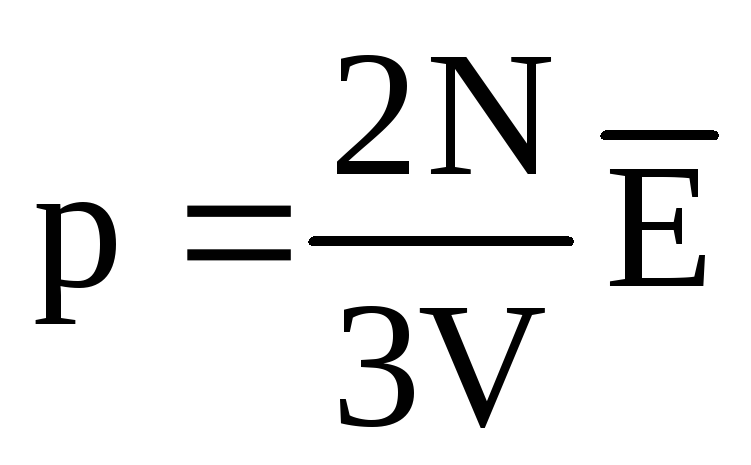 , lub
, lub 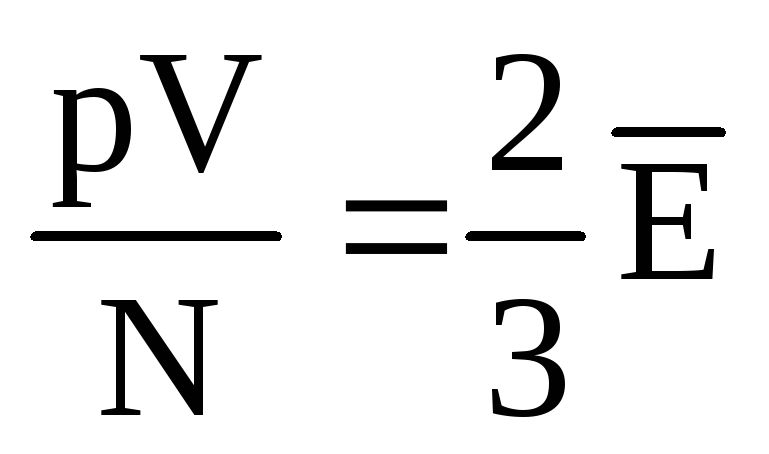 .
.
Oznaczać 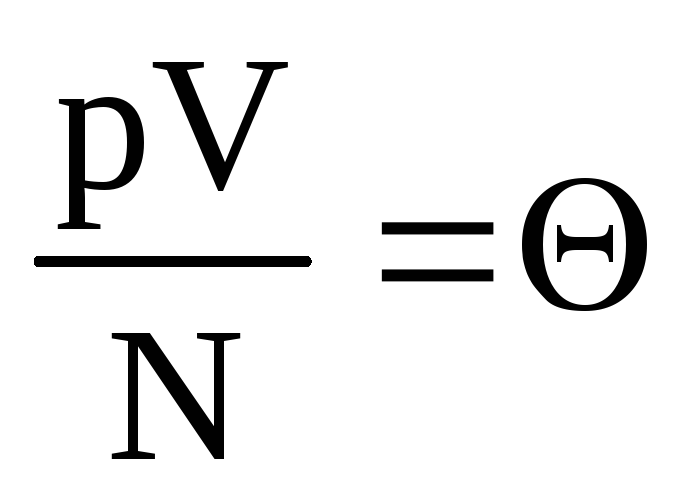 . Wartość
. Wartość  wzrasta wraz z temperaturą i nie zależy od niczego innego niż temperatura. Dlatego można go uznać za naturalną miarę temperatury.
wzrasta wraz z temperaturą i nie zależy od niczego innego niż temperatura. Dlatego można go uznać za naturalną miarę temperatury.
Teoria kinetyki molekularnej opisuje zachowanie i właściwości specjalnego idealnego obiektu zwanego gaz doskonały. Ten model fizyczny opiera się na molekularnej strukturze materii. Tworzenie teorii molekularnej wiąże się z pracami R. Clausiusa, J. Maxwella, D. Joule'a i L. Boltzmanna.
Gaz doskonały. Teoria molekularno-kinetyczna gazu doskonałego zbudowany jest na następujących założeniach:
atomy i cząsteczki można zobaczyć jako punkty materialne, które są w ciągłym ruchu;
wewnętrzna objętość cząsteczek gazu jest nieistotna w porównaniu z objętością naczynia;
wszystkie atomy i cząsteczki są rozróżnialne, to znaczy w zasadzie można śledzić ruch każdej cząstki;
przed zderzeniem cząsteczek gazu między nimi nie ma sił interakcji, a zderzenia cząsteczek między sobą i ze ścianami naczynia są uważane za absolutnie elastyczne;
ruch każdego atomu lub cząsteczki gazu jest opisany prawami mechaniki klasycznej.
Prawa uzyskane dla gazu doskonałego można wykorzystać w badaniu gazów rzeczywistych. W tym celu tworzone są eksperymentalne modele gazu doskonałego, w których właściwości gazu rzeczywistego są zbliżone do właściwości gazu doskonałego (na przykład przy niskich ciśnieniach i wysokich temperaturach).
Prawa gazu doskonałego
Prawo Boyle-Mariotte:
dla danej masy gazu w stałej temperaturze iloczyn ciśnienia gazu i jego objętości jest wartością stałą: pV = const , (1.1)
w T = stały , m = const .
Krzywa przedstawiająca zależność między wielkościami R oraz V, charakteryzuje właściwości substancji w stałej temperaturze i nazywa się izoterma jest to hiperbola (ryc. 1.1.), a proces przebiegający w stałej temperaturze nazywamy izotermicznym.
Prawa Gay-Lussaca:
Objętość danej masy gazu przy stałym ciśnieniu zmienia się liniowo wraz z temperaturą
V = V 0 (1 + t ) w P = const , m = const . (1.2)

p = p 0 (1 + t ) w V = const , m = const . (1.3)
W równaniach (1.2) i (1.3) temperatura jest wyrażona w skali Celsjusza, ciśnienie i objętość - at
0 С, podczas gdy
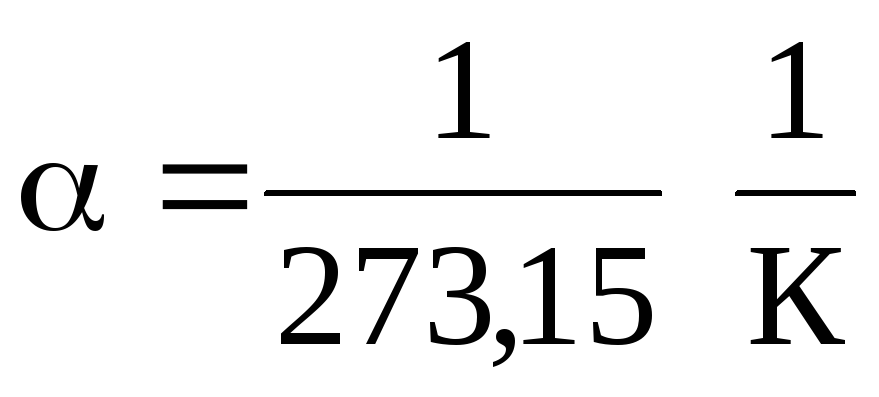 .
.
Proces, który odbywa się pod stałym ciśnieniem, nazywa się izobaryczny, może być reprezentowana jako funkcja liniowa (Rys. 1.2.).
Proces, który odbywa się przy stałej objętości, nazywa się izochoryczny(Rys. 1.3.).
Z równań (1.2) i (1.3) wynika, że izobary i izochory przecinają oś temperatury w punkcie t =1/ \u003d - 273,15 С . Jeśli przesuniemy początek do tego punktu, przejdziemy do skali Kelvina.
Wprowadzenie do wzorów (1.2) i (1.3) temperatura termodynamiczna, prawa Gay-Lussaca można nadać wygodniejszej formie:
V = V 0 (1+t) = = V 0 = =V 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
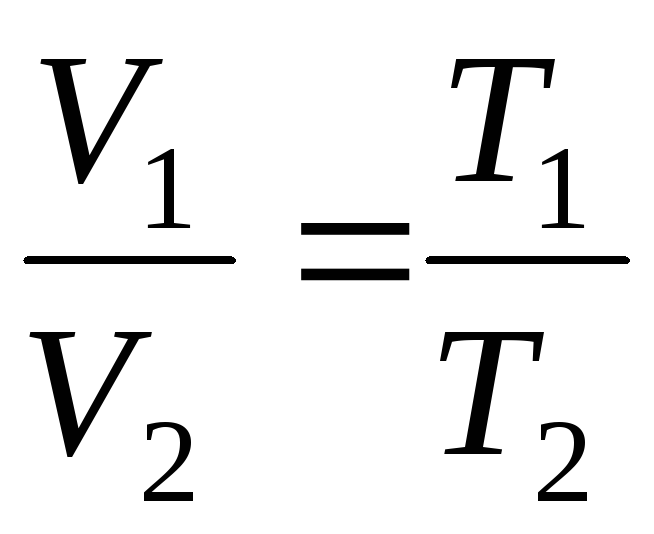 w
p=stała, m=stała
;
(1.4)
w
p=stała, m=stała
;
(1.4)
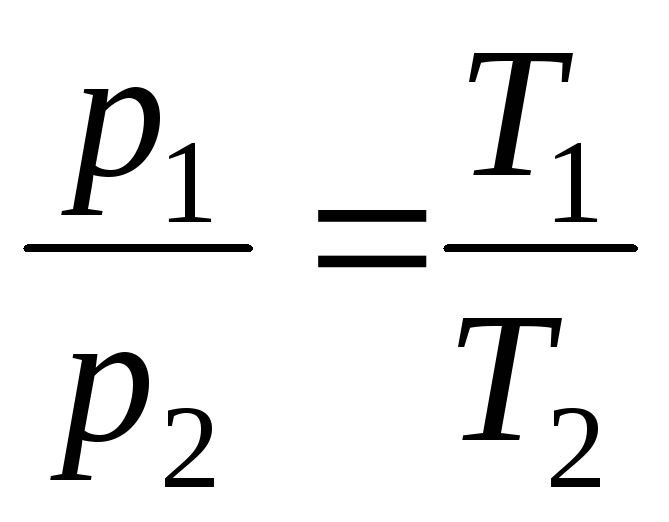 w V = const, m = const
,
(1.5)
w V = const, m = const
,
(1.5)
gdzie indeksy 1 i 2 odnoszą się do dowolnych stanów leżących na tej samej izobarze lub izochorze .
Prawo Avogadro:
mole dowolnych gazów w tych samych temperaturach i ciśnieniach zajmują te same objętości.
W normalnych warunkach ta objętość jest równa V,0 \u003d 22,4110 -3 m 3 / mol . Z definicji w jednym molu różne substancje zawiera taką samą liczbę cząsteczek, równą stały Avogadro:N A = 6,02210 23 mol -1 .
Prawo Daltona:
ciśnienie mieszanki gazy idealne równa sumie ciśnień cząstkowych R 1 , R 2 , R 3 … R n, zawarte w nim gazy:
p = p 1 + p 2 + R 3 + …+ p n .
Ciśnienie cząstkowe – to jest ciśnienie jakie wytworzyłby gaz w kompozycji mieszanka gazowa gdyby sam zajmował objętość równą objętości mieszaniny w tej samej temperaturze.
Równanie stanu gazu doskonałego
(Równanie Clapeyrona-Mendeleeva)
Istnieje wyraźna zależność między temperaturą, objętością i ciśnieniem. Ta zależność może być reprezentowana przez zależność funkcjonalną:
f(p, V, T)= 0.
Z kolei każda ze zmiennych ( p, v, t) jest funkcją dwóch innych zmiennych. Rodzaj zależności funkcjonalnej dla każdego stanu fazowego substancji (stałej, ciekłej, gazowej) znajduje się eksperymentalnie. Jest to bardzo pracochłonny proces, a równanie stanu zostało ustalone tylko dla gazów znajdujących się w stanie rozrzedzonym oraz w postaci przybliżonej dla niektórych gazów sprężonych. W przypadku substancji, które nie są w stanie gazowym, problem ten nie został jeszcze rozwiązany.
Francuski fizyk B. Clapeyron przyniósł równanie stanu gazu doskonałego, łącząc prawa Boyle-Mariotte, Gay-Lussaca, Charlesa:
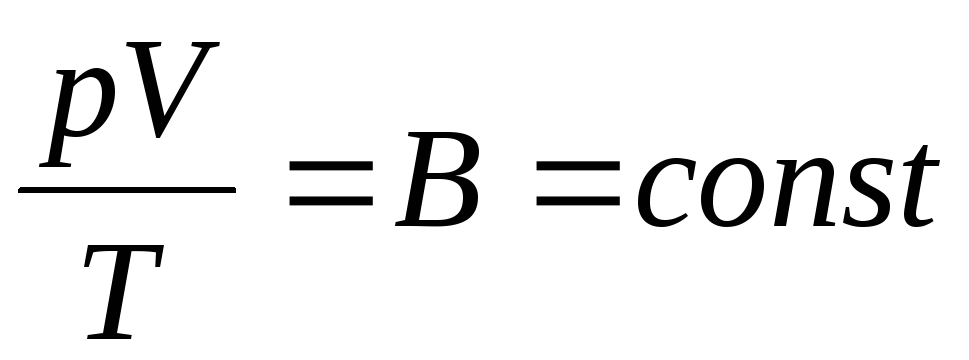 . (1.6)
. (1.6)
Wyrażenie (1.6) to równanie Clapeyrona, gdzie W jest stałą gazową. Dla różnych gazów jest inaczej.
DI. Mendelejew połączył równanie Clapeyrona z prawem Avogadro, odnosząc równanie (1.6) do jednego mola i używając objętości molowej V. Zgodnie z prawem Avogadro za to samo R oraz T mole wszystkich gazów zajmują tę samą objętość molową V .
.
Dlatego stała W będzie taki sam dla wszystkich gazów doskonałych. Ta stała jest zwykle oznaczana R i równe R=
8,31
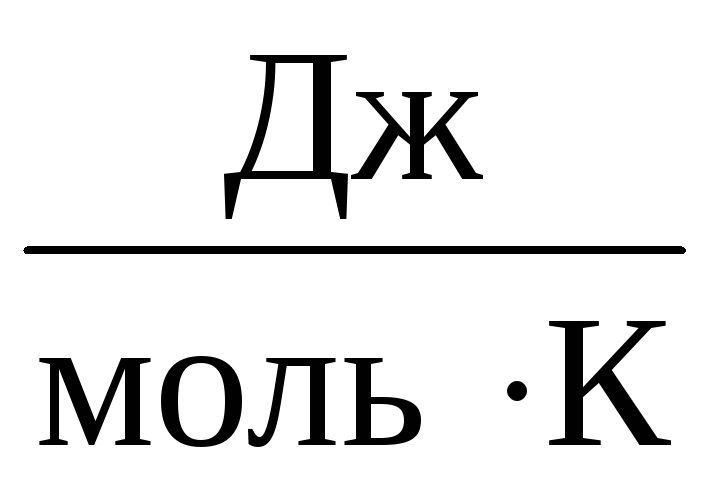 .
.
Równanie Clapeyrona-Mendeleeva ma następującą postać:
p V . = R T.
Z równania (1.7) dla jednego mola gazu można przejść do do równania Clapeyrona-Mendeleeva dla dowolnej masy gazu:
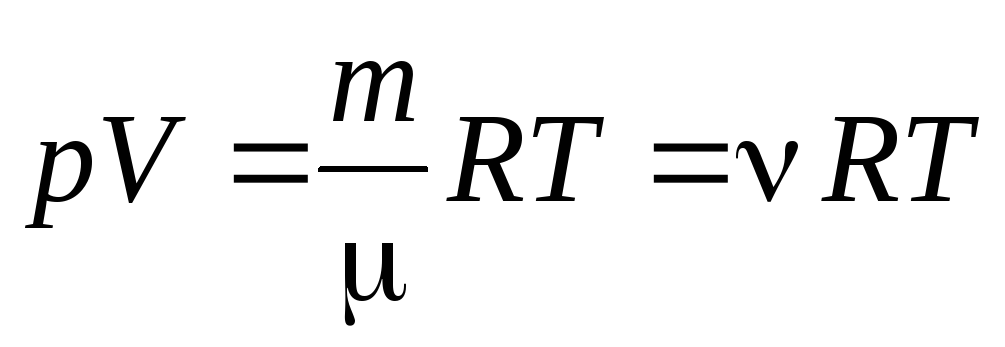 , (1.7)
, (1.7)
gdzie
–
masa cząsteczkowa
(masa jednego mola substancji, kg/mol); m
masa gazu;
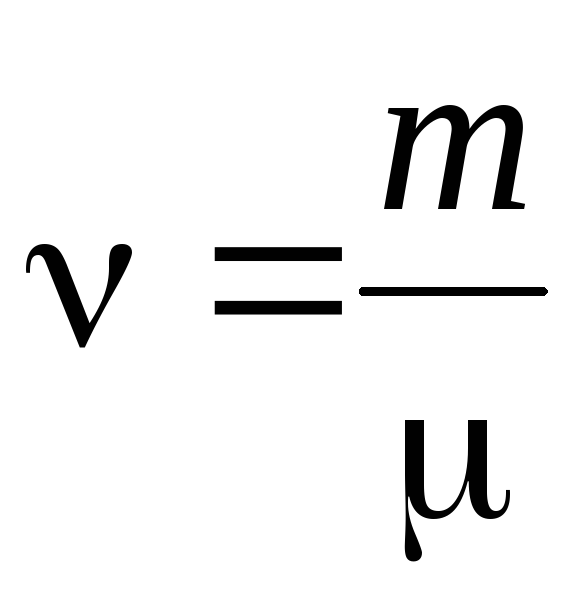 - ilość materii .
- ilość materii .
Częściej stosuje się inną postać równania stanu gazu doskonałego, wprowadzając Stała Boltzmanna: 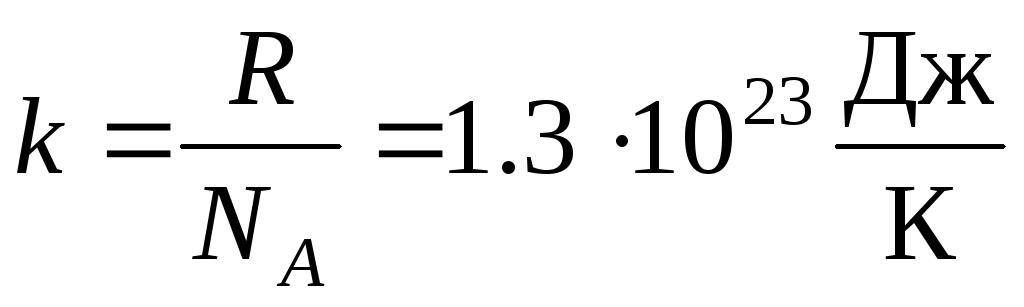 .
.
Wtedy równanie (1.7) wygląda tak:
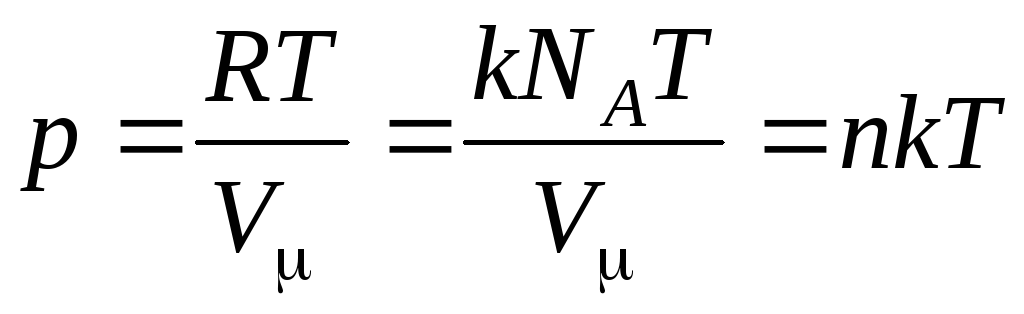 ,
(1.8)
,
(1.8)
gdzie
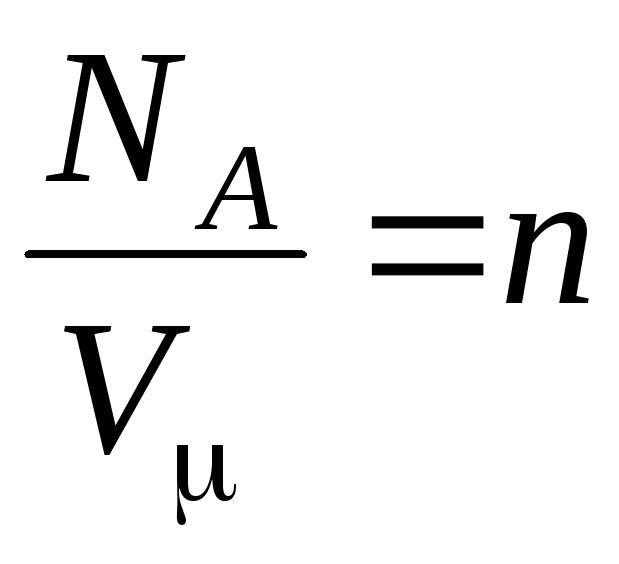 –
stężenie cząsteczek (liczba cząsteczek na jednostkę objętości). Z tego wyrażenia wynika, że ciśnienie gazu doskonałego jest wprost proporcjonalne do stężenia jego cząsteczek lub gęstości gazu. W tych samych temperaturach i ciśnieniach wszystkie gazy zawierają taką samą liczbę cząsteczek na jednostkę objętości. Nazywa się liczbę cząsteczek zawartych w 1 m 3 w normalnych warunkach
Numer Loschmidta:
–
stężenie cząsteczek (liczba cząsteczek na jednostkę objętości). Z tego wyrażenia wynika, że ciśnienie gazu doskonałego jest wprost proporcjonalne do stężenia jego cząsteczek lub gęstości gazu. W tych samych temperaturach i ciśnieniach wszystkie gazy zawierają taką samą liczbę cząsteczek na jednostkę objętości. Nazywa się liczbę cząsteczek zawartych w 1 m 3 w normalnych warunkach
Numer Loschmidta:
N L = 2,68 10 25 m -3.
Podstawowe równanie kinetyki molekularnej
teoria gazów doskonałych
Najważniejsze zadanie Kinetyczna teoria gazów to teoretyczne obliczenie ciśnienia gazu doskonałego oparte na koncepcjach kinetyki molekularnej. Podstawowe równanie teorii kinetyki molekularnej gazów doskonałych wyprowadza się za pomocą metody statystyczne.
Zakłada się, że cząsteczki gazu poruszają się losowo, liczba wzajemnych zderzeń między cząsteczkami gazu jest znikoma w porównaniu z liczbą uderzeń w ściany naczynia, a zderzenia te są absolutnie elastyczne. Na ścianie naczynia jakiś elementarny obszar S i obliczyć ciśnienie, jakie cząsteczki gazu będą wywierać na ten obszar.
Należy wziąć pod uwagę fakt, że w rzeczywistości cząsteczki mogą poruszać się w miejscu pod różnymi kątami i mogą mieć różne prędkości, który zresztą może się zmieniać przy każdej kolizji. W obliczeniach teoretycznych idealizuje się chaotyczny ruch cząsteczek, zastępuje je ruchem w trzech wzajemnie prostopadłych kierunkach.
Jeśli weźmiemy pod uwagę naczynie w formie sześcianu, w którym N cząsteczek gazu w sześciu kierunkach, łatwo zauważyć, że w każdej chwili 1/3 liczby wszystkich cząsteczek porusza się wzdłuż każdej z nich, a połowa z nich (czyli 1/6 liczby wszystkich cząsteczek) porusza się w jeden kierunek, a druga połowa (również 1/6) - w przeciwnym kierunku. Z każdym zderzeniem pojedyncza cząsteczka poruszająca się prostopadle do miejsca, odbijając się, przekazuje mu pęd, podczas gdy jej pęd (pęd) zmienia się o wielkość
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Liczba uderzeń cząsteczek poruszających się w danym kierunku na terenie będzie równa: N = 1/6 n Svt. Zderzając się z platformą, cząsteczki te przekażą jej pęd.
P= N P 1 =2 m 0 vnSvt= m 0 v 2 nSt,
gdzie n to stężenie cząsteczek. Wtedy ciśnienie jakie gaz wywiera na ściankę naczynia będzie równe:
p = 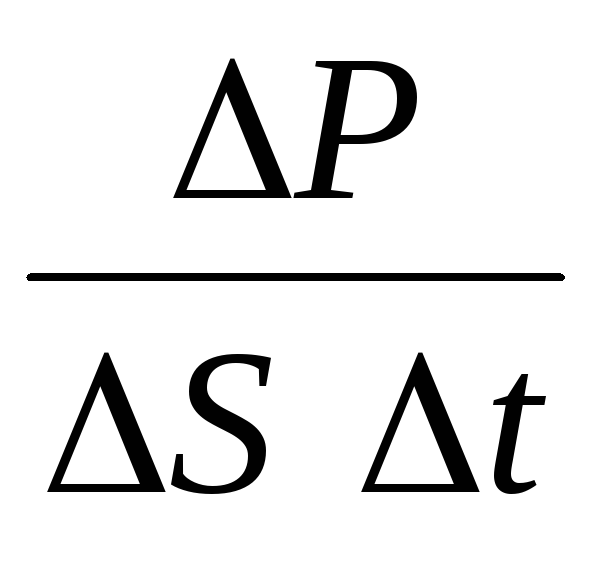 =
Nm 0
v 2
.
(1.9)
=
Nm 0
v 2
.
(1.9)
Jednak cząsteczki gazu poruszają się z różnymi prędkościami: v 1 , v 2 , …,v n, więc prędkości muszą być uśrednione. Suma kwadratów prędkości cząsteczek gazu podzielona przez ich liczbę określa pierwiastek średniej kwadratowej prędkości:
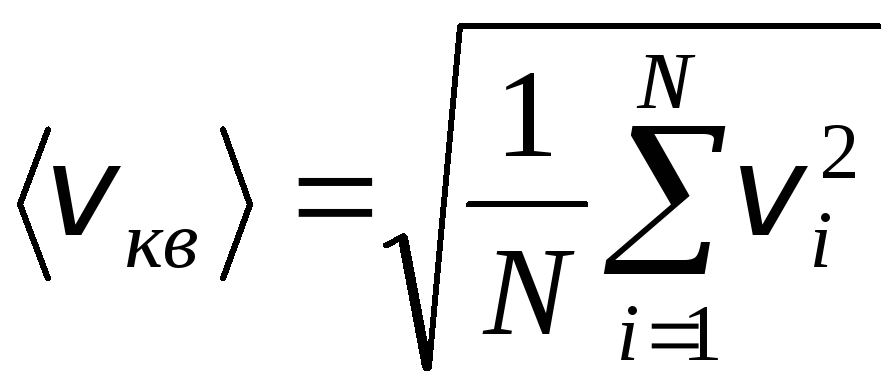 .
.
Równanie (1.9) przyjmie formę:
![]() (1.10)
(1.10)
wyrażenie (1.10) nazywa się podstawowe równanie teorii kinetyki molekularnej gazy idealne.
Jeśli się uwzględni 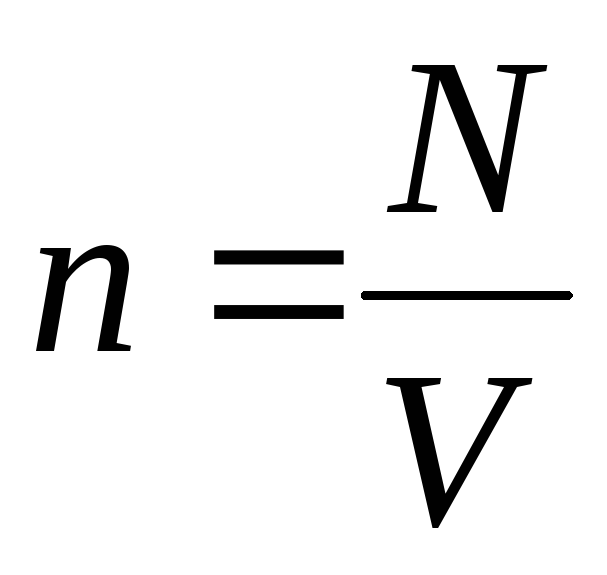 otrzymujemy:
otrzymujemy:
p V = N 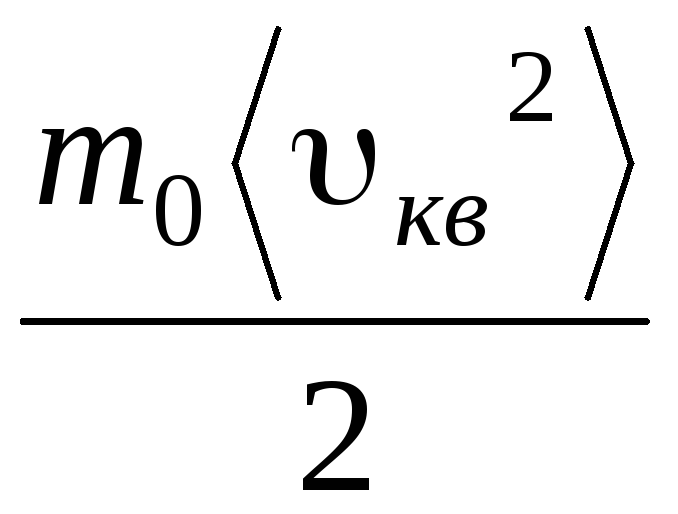 =E,
(1.11)
=E,
(1.11)
gdzie mi jest całkowitą energią kinetyczną ruchu translacyjnego wszystkich cząsteczek gazu. Dlatego ciśnienie gazu jest wprost proporcjonalne do energii kinetycznej ruchu translacyjnego cząsteczek gazu.
Za jeden mol gazu m =, a równanie Clapeyrona-Mendeleeva ma postać:
p V . = R T,
a ponieważ z (1.11) wynika, że p V . = v mkw. 2 , otrzymujemy:
R.T.= v mkw. 2 .
Stąd średnia kwadratowa prędkość cząsteczek gazu jest równa
v
mkw.
=
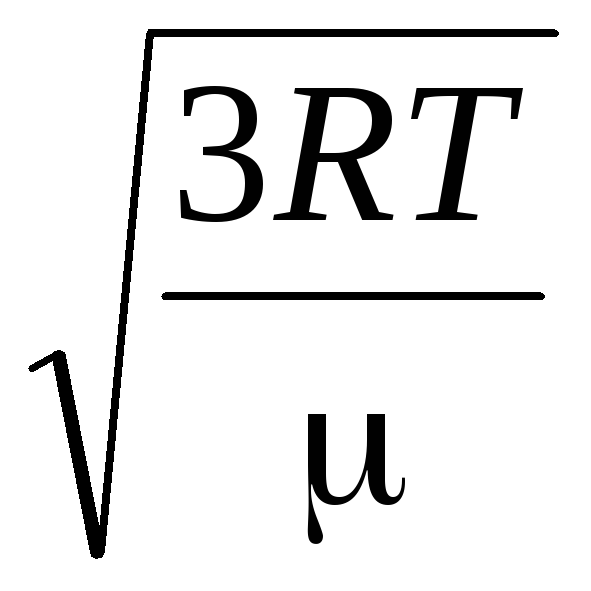 =
=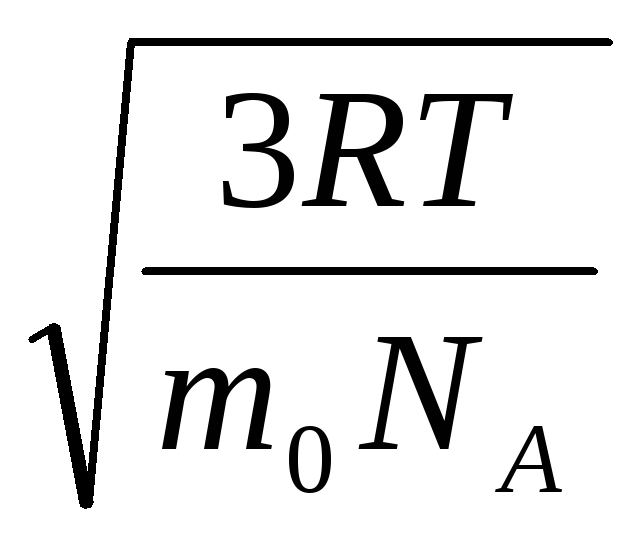 =
= ,
,
gdzie k = R/N A = 1,3810 -23 J/K – Stała Boltzmanna. Stąd średnia kwadratowa prędkość cząsteczek tlenu w temperaturze pokojowej - 480 m/s, wodoru - 1900 m/s.
Molekularno-kinetyczne znaczenie temperatury
Temperatura jest ilościową miarą tego, jak gorące jest ciało. Aby wyjaśnić fizyczne znaczenie bezwzględnej temperatury termodynamicznej T Porównajmy podstawowe równanie molekularno-kinetycznej teorii gazów (1.14) z równaniem Clapeyrona-Mendeleeva p V = R.T.
Przyrównując prawe części tych równań, znajdujemy średnią wartość energii kinetycznej 0 jednej cząsteczki ( = N/N A , k=R/N A):
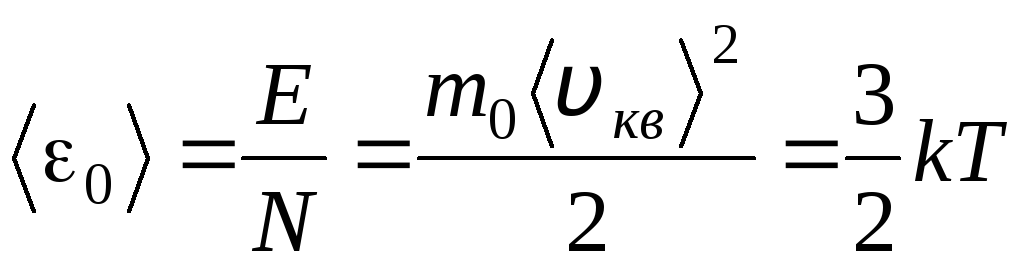 .
.
Z tego równania wynika najważniejszy wniosek teorii kinetyki molekularnej: średnia energia kinetyczna ruchu translacyjnego jednej cząsteczki gazu doskonałego zależy tylko od temperatury, natomiast jest wprost proporcjonalna do temperatury termodynamicznej. W ten sposób termodynamiczna skala temperatury nabiera bezpośredniego znaczenia fizycznego: at T= 0 energia kinetyczna idealnych cząsteczek gazu wynosi zero. W związku z tym, w oparciu o tę teorię, ruch translacyjny cząsteczek gazu zostanie zatrzymany, a jego ciśnienie stanie się równe zeru.
Teoria właściwości równowagowych gazu doskonałego
Liczba stopni swobody cząsteczek. Teoria molekularno-kinetyczna gazów doskonałych prowadzi do bardzo ważnej konsekwencji: cząsteczki gazu poruszają się losowo, a średnia energia kinetyczna ruchu translacyjnego cząsteczki zależy wyłącznie od temperatury.
Energia kinetyczna ruchu molekularnego nie jest wyczerpywana przez kinetykę energia ruchu do przodu: składa się również z kinetyki energie obrót oraz wahania Cząsteczki. Aby obliczyć energię wchodzącą we wszystkie rodzaje ruchu molekularnego, konieczne jest zdefiniowanie: liczba stopni swobody.
Pod liczba stopni swobody (i) ciała jest domniemane liczba niezależnych współrzędnych, które należy wprowadzić, aby określić położenie ciała w przestrzeni.
H  Na przykład punkt materialny ma trzy stopnie swobody, ponieważ jego położenie w przestrzeni określają trzy współrzędne: x, y oraz z. Dlatego cząsteczka jednoatomowa ma trzy stopnie swobody ruchu translacyjnego.
Na przykład punkt materialny ma trzy stopnie swobody, ponieważ jego położenie w przestrzeni określają trzy współrzędne: x, y oraz z. Dlatego cząsteczka jednoatomowa ma trzy stopnie swobody ruchu translacyjnego.
D 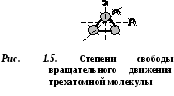 cząsteczka buchatomowa ma 5 stopni swobody (ryc. 1.4): 3 stopnie swobody ruchu translacyjnego i 2 stopnie swobody ruchu obrotowego.
cząsteczka buchatomowa ma 5 stopni swobody (ryc. 1.4): 3 stopnie swobody ruchu translacyjnego i 2 stopnie swobody ruchu obrotowego.
Cząsteczki trzech lub więcej atomów mają 6 stopni swobody: 3 stopnie swobody ruchu postępowego i 3 stopnie swobody ruchu obrotowego (rys. 1.5).
Każda cząsteczka gazu ma pewną liczbę stopni swobody, z których trzy odpowiadają jej ruchowi translacyjnemu.
Rozporządzenie w sprawie równej dystrybucji energii
według stopni swobody
Podstawowym założeniem molekularno-kinetycznej teorii gazów jest założenie całkowitej przypadkowości ruchu cząsteczek. Dotyczy to zarówno ruchów oscylacyjnych, jak i obrotowych, a nie tylko translacyjnych. Zakłada się, że wszystkie kierunki ruchu cząsteczek w gazie są jednakowo prawdopodobne. Dlatego można założyć, że dla każdego stopnia swobody cząsteczki przypada średnio taka sama ilość energii - jest to pozycja na ekwipartycji energii w stopniach swobody. Energia na jeden stopień swobody cząsteczki wynosi:
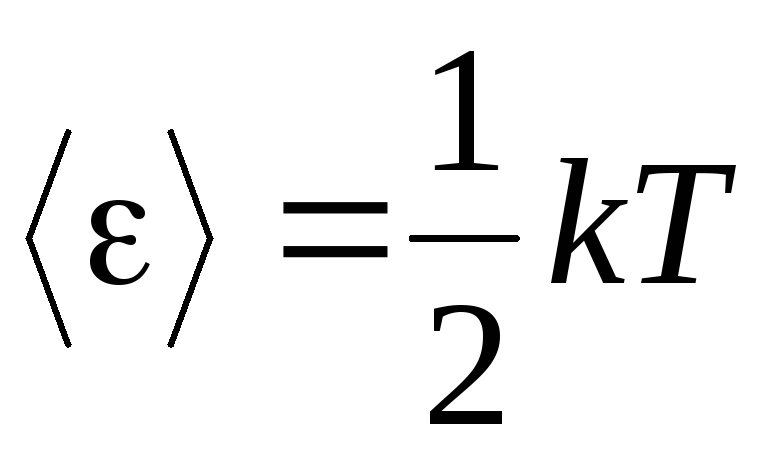 . (1.12)
. (1.12)
Jeśli cząsteczka ma i stopnie swobody, to dla każdego stopnia swobody przypada średnio:
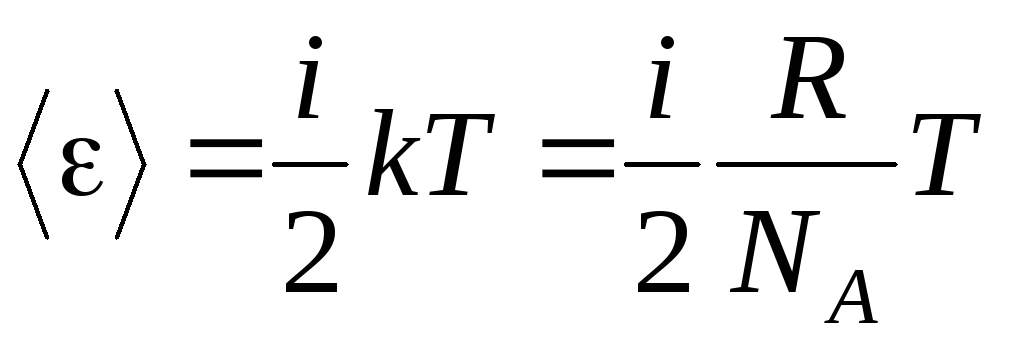 .
(1.13)
.
(1.13)
Energia wewnętrzna gazu doskonałego
Jeśli przypiszemy całkowitą podaż energii wewnętrznej gazu jednemu molowi, to otrzymamy jej wartość mnożąc przez liczbę Avogadro:
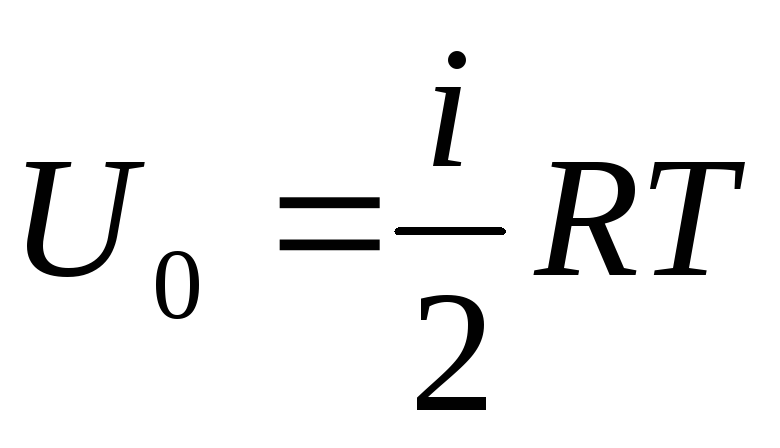 .
(1.14)
.
(1.14)
Wynika z tego, że energia wewnętrzna jednego mola gazu doskonałego zależy tylko od temperatury i liczby stopni swobody cząsteczek gazu.
Rozkłady Maxwella i Boltzmanna
Rozkład cząsteczek gazu doskonałego pod względem prędkości i energii ruchu termicznego (rozkład Maxwella). Zakłada się, że przy stałej temperaturze gazu wszystkie kierunki ruchu cząsteczek są jednakowo prawdopodobne. W tym przypadku średnia kwadratowa prędkość każdej cząsteczki pozostaje stała i wynosi
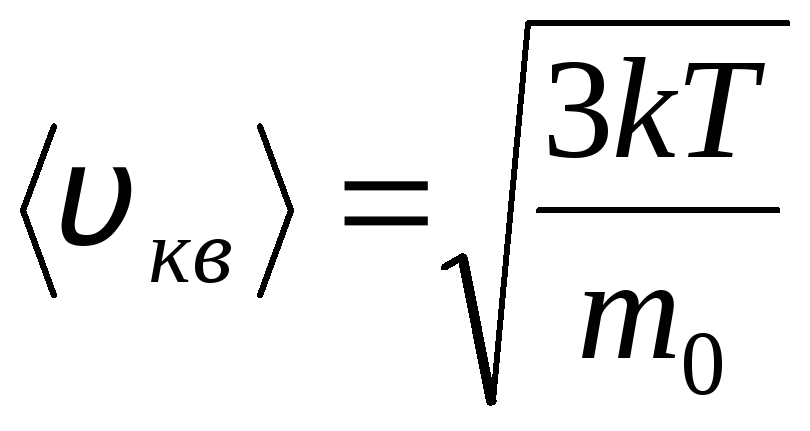 .
.
Tłumaczy się to tym, że w idealnym gazie, który jest w stanie równowagi, ustala się pewien stacjonarny rozkład prędkości cząsteczek, który nie zmienia się w czasie. rozkład ten podlega pewnemu prawu statystycznemu, wyprowadzonemu teoretycznie przez J. Maxwella. Prawo Maxwella opisuje funkcja
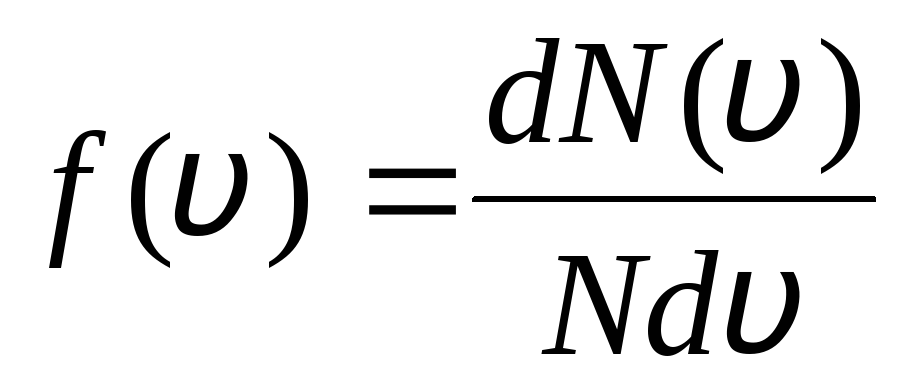 ,
,
to jest funkcja f(v) określa względną liczbę cząsteczek  , których prędkości leżą w przedziale od v
zanim v+dv. Stosując metody teorii prawdopodobieństwa, Maxwell stwierdził prawo rozkładu cząsteczek gazu doskonałego pod względem prędkości:
, których prędkości leżą w przedziale od v
zanim v+dv. Stosując metody teorii prawdopodobieństwa, Maxwell stwierdził prawo rozkładu cząsteczek gazu doskonałego pod względem prędkości:
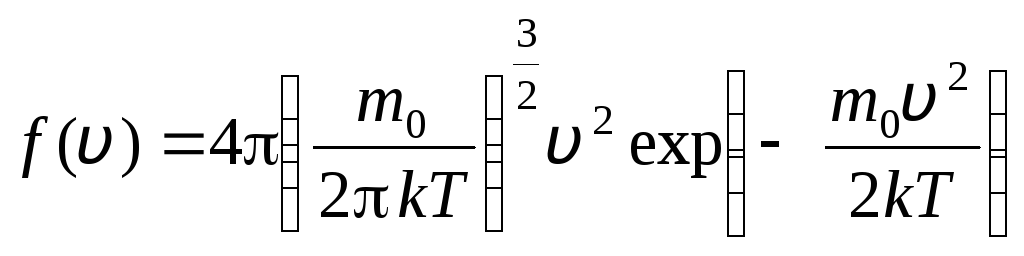 . (1.15)
. (1.15)
Rozkład funkcji przedstawiono graficznie na ryc. 1.6. Obszar ograniczony krzywą rozkładu i osią x jest równy jeden. Oznacza to, że funkcja f(v) spełnia warunek normalizacji:
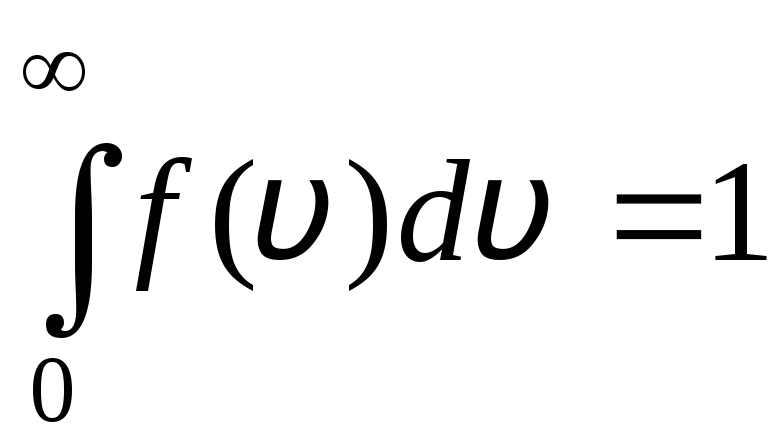 .
.
Z  prędkość, przy której funkcja rozkładu idealnych cząsteczek gazu pod względem prędkości f(v) jest maksymalna, nazywa się najprawdopodobniej
prędkość
v B .
prędkość, przy której funkcja rozkładu idealnych cząsteczek gazu pod względem prędkości f(v) jest maksymalna, nazywa się najprawdopodobniej
prędkość
v B .
Wartości v = 0 oraz v = odpowiadają minimom ekspresji (1.15). Najbardziej prawdopodobną prędkość można znaleźć, różnicując wyrażenie (1,23) i przyrównując je do zera:
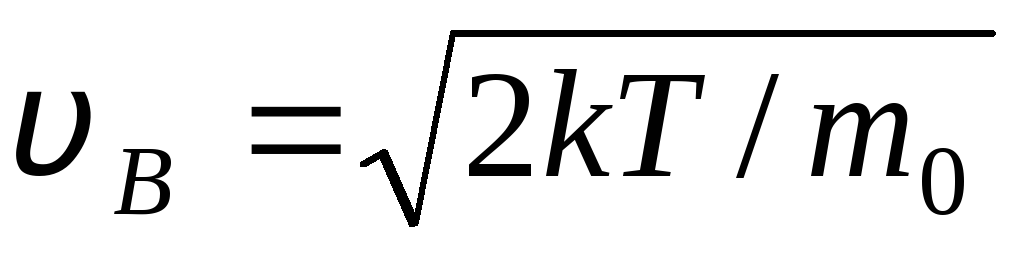 =
=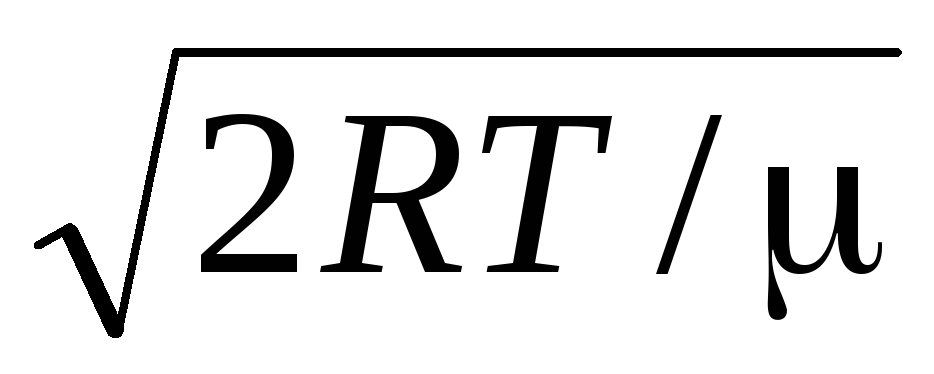 =
1,41
=
1,41
Wraz ze wzrostem temperatury maksimum funkcji przesunie się w prawo (rys. 1.6), czyli wraz ze wzrostem temperatury wzrasta również najbardziej prawdopodobna prędkość, jednak obszar ograniczony krzywą pozostaje niezmieniony. Należy zauważyć, że w gazach iw niskich temperaturach zawsze występuje niewielka liczba cząsteczek poruszających się z dużymi prędkościami. Obecność takich „gorących” cząsteczek ma bardzo ważne podczas wielu procesów.
Średnia arytmetyczna prędkość cząsteczki określa wzór
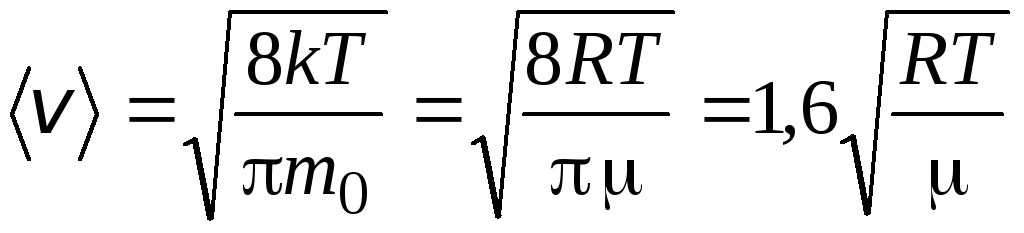 .
.
Średnia prędkość kwadratowa
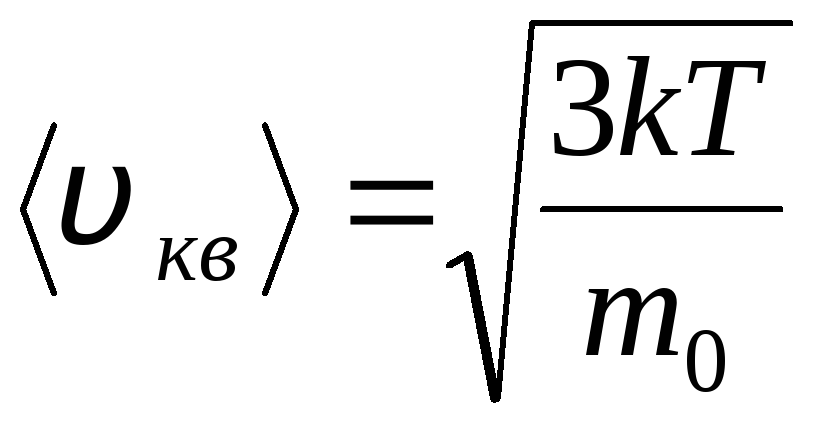 =
1,73
=
1,73 .
.
Stosunek tych prędkości nie zależy od temperatury ani od rodzaju gazu.
Funkcja dystrybucji cząsteczek według energii ruchu termicznego. Tę funkcję można uzyskać, podstawiając wartość energii kinetycznej zamiast prędkości do równania rozkładu cząsteczek (1.15):
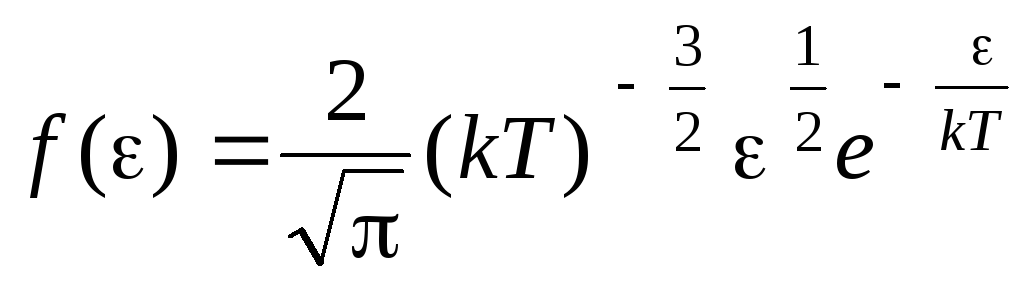 .
.
Po zintegrowaniu wyrażenia nad wartościami energetycznymi z  zanim
zanim 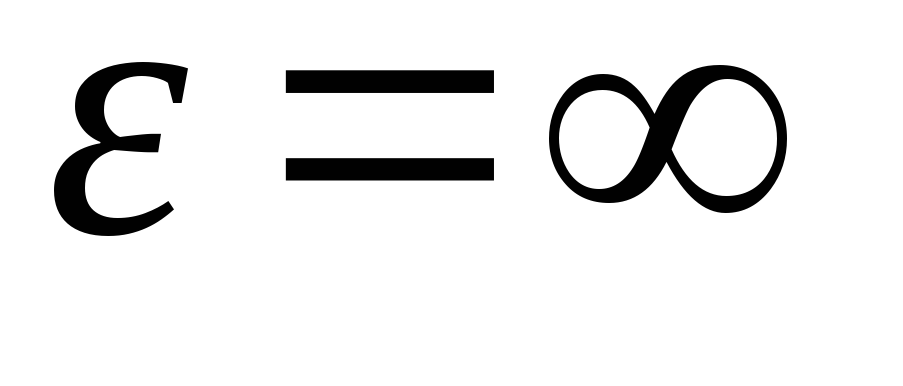
 , dostajemy średnia energia kinetyczna idealne cząsteczki gazu:
, dostajemy średnia energia kinetyczna idealne cząsteczki gazu:
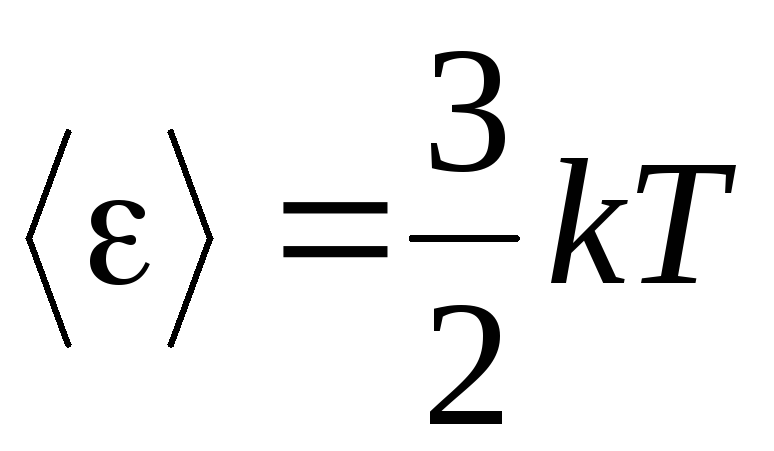 .
.
wzór barometryczny. Rozkład Boltzmanna. Wyprowadzając podstawowe równanie molekularnej teorii kinetycznej gazów i rozkład Maxwella cząsteczek według prędkości, założono, że na cząsteczki gazu doskonałego nie działają siły zewnętrzne, dlatego cząsteczki są równomiernie rozłożone w całej objętości. Jednak molekuły dowolnego gazu znajdują się w polu grawitacyjnym Ziemi. Wyprowadzając prawo zależności ciśnienia od wysokości zakłada się, że pole grawitacyjne jest jednorodne, temperatura jest stała, a masa wszystkich cząsteczek taka sama:
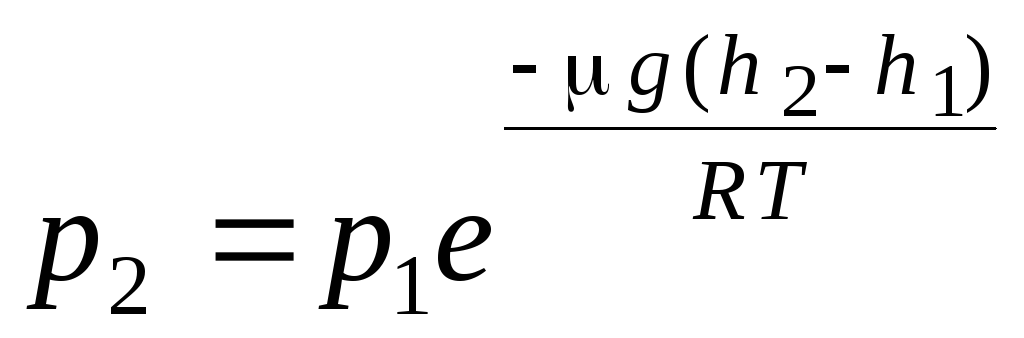 . (1.16)
. (1.16)
Wyrażenie (1.16) nazywa się formuła barometryczna. Pozwala znaleźć ciśnienie atmosferyczne w zależności od wysokości lub mierząc ciśnienie, możesz znaleźć wysokość. Dlatego h 1 to wysokość nad poziomem morza, gdzie ciśnienie jest uważane za normalne, to wyrażenie można zmodyfikować:
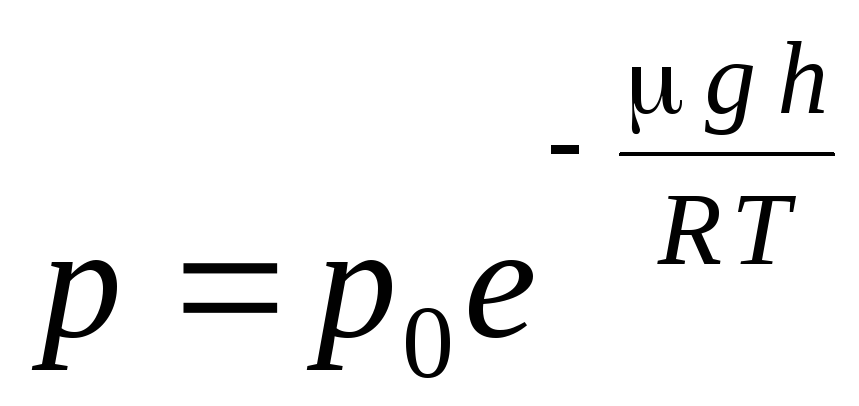 .
.
Wzór barometryczny można przekonwertować za pomocą wyrażenia p = nkT:
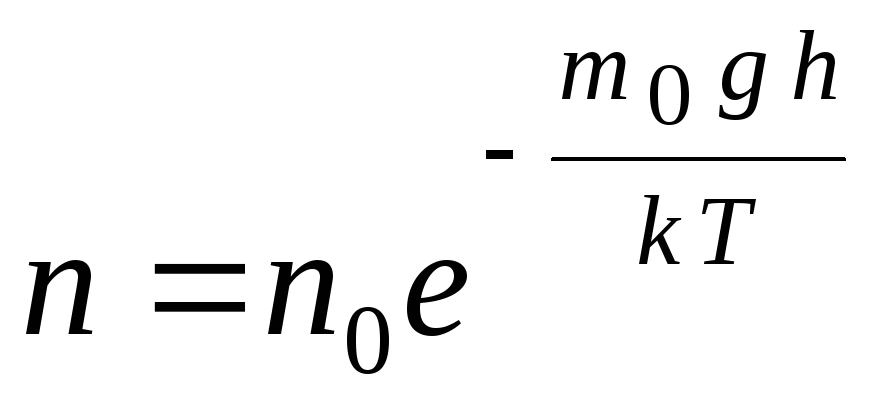 ,
,
G  de n
–
stężenie cząsteczek na wysokości h,
m 0
gh=P–
energia potencjalna cząsteczki w polu grawitacyjnym. W stałej temperaturze gęstość gazu jest większa, gdy energia potencjalna cząsteczki jest mniejsza. Graficznie prawo spadku liczby cząstek na jednostkę objętości wraz z wysokością wygląda tak, jak pokazano na ryc. 1.7.
de n
–
stężenie cząsteczek na wysokości h,
m 0
gh=P–
energia potencjalna cząsteczki w polu grawitacyjnym. W stałej temperaturze gęstość gazu jest większa, gdy energia potencjalna cząsteczki jest mniejsza. Graficznie prawo spadku liczby cząstek na jednostkę objętości wraz z wysokością wygląda tak, jak pokazano na ryc. 1.7.
Dla dowolnego pola potencjału zewnętrznego zapisujemy następujące wyrażenie ogólne:
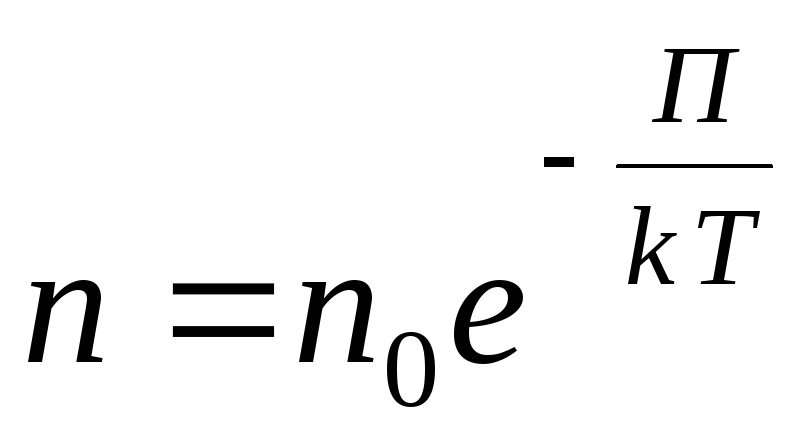 ,
,
