Ideālu gāzu molekulārā kinētiskā teorija
Vai tu zināji,
Kas ir domu eksperiments, gedanken eksperiments?
Tā ir neeksistējoša prakse, pārpasaulīga pieredze, iztēle par kaut ko tādu, kas patiesībā neeksistē. Domu eksperimenti ir kā nomoda sapņi. Viņi dzemdē monstrus. Atšķirībā no fiziskā eksperimenta, kas ir eksperimentāls hipotēžu tests, “domu eksperiments” maģiski aizvieto eksperimentālo testēšanu ar vēlamiem, praksē nepārbaudītiem secinājumiem, manipulējot ar loģiskām konstrukcijām, kas faktiski pārkāpj pašu loģiku, izmantojot nepierādītas premisas kā pierādītas, ir ar aizstāšanu. Tādējādi “domu eksperimentu” pieteicēju galvenais uzdevums ir maldināt klausītāju vai lasītāju, reālu fizisko eksperimentu aizstājot ar tā “lelli” - fiktīvu spriešanu nosacīti pirms pašas fiziskās pārbaudes.
Fizikas piepildīšana ar iedomātiem, “domu eksperimentiem” ir novedusi pie absurda, sirreāla, neskaidra pasaules attēla rašanās. Īstam pētniekam šādi “konfekšu papīrīši” jāatšķir no īstām vērtībām.
Relatīvisti un pozitīvisti apgalvo, ka “domu eksperimenti” ir ļoti noderīgs rīks, lai pārbaudītu teorijas (arī mūsu prātā radušās) konsekvenci. Ar to viņi maldina cilvēkus, jo jebkuru pārbaudi var veikt tikai no verifikācijas objekta neatkarīgs avots. Pats hipotēzes pieteicējs nevar būt sava apgalvojuma tests, jo paša šī apgalvojuma iemesls ir pieteicējam redzamā apgalvojuma pretrunu neesamība.
Mēs to redzam SRT un GTR piemērā, kas ir pārvērtušies par unikālu reliģijas veidu, kas pārvalda zinātni un sabiedriskā doma. Nekādi fakti, kas tiem ir pretrunā, nevar pārvarēt Einšteina formulu: "Ja fakts neatbilst teorijai, mainiet faktu" (Citā versijā "Vai fakts neatbilst teorijai? - Jo sliktāk faktam". ”).
Maksimums, ko var apgalvot “domu eksperiments”, ir tikai hipotēzes iekšējā konsekvence paša pieteicēja, bieži vien nepatiesas, loģikas ietvaros. Tas nepārbauda atbilstību praksei. Īsta pārbaude var notikt tikai faktiskā fiziskā eksperimentā.
Eksperiments ir eksperiments, jo tas nav domas pilnveidošana, bet gan domas pārbaude. Doma, kas ir konsekventa, nevar sevi pārbaudīt. To pierādīja Kurts Gēdels.
Retajā gāzē attālums starp molekulām ir daudzkārt lielāks par to izmēru. Šajā gadījumā mijiedarbība starp molekulām ir niecīga, un molekulu kinētiskā enerģija ir daudz lielāka par to mijiedarbības potenciālo enerģiju.
Lai izskaidrotu vielas īpašības gāzveida stāvoklī, īstas gāzes vietā tiek izmantots tās fiziskais modelis - ideāla gāze. Modelis paredz:
attālums starp molekulām ir nedaudz lielāks par to diametru;
molekulas ir elastīgas bumbiņas;
starp molekulām nav pievilcīgu spēku;
molekulām saduroties savā starpā un ar trauka sienām, iedarbojas atgrūdoši spēki;
Molekulu kustība pakļaujas mehānikas likumiem.
Ideālas gāzes pamatvienādojums ir:
MCT pamata vienādojums ļauj aprēķināt gāzes spiedienu, ja ir zināma molekulas masa, ātruma kvadrāta vidējā vērtība un molekulu koncentrācija.
Ideāls gāzes spiediens slēpjas faktā, ka molekulas, saskaroties ar trauka sienām, mijiedarbojas ar tām saskaņā ar mehānikas likumiem kā elastīgiem ķermeņiem. Molekulai saduroties ar trauka sienu, ātruma v x ātruma vektora projekcija uz OX asi, kas ir perpendikulāra sienai, maina savu zīmi uz pretējo, bet paliek nemainīga. Tāpēc molekulas sadursmes ar sienu rezultātā tās impulsa projekcija uz OX asi mainās no mv 1x = -mv x uz mv 2x =mv x. Molekulas impulsa izmaiņas, saduroties ar sienu, izraisa spēks F 1, kas uz to iedarbojas no sienas sāniem. Molekulas impulsa izmaiņas ir vienādas ar šī spēka impulsu:
Sadursmes laikā saskaņā ar Ņūtona trešo likumu molekula iedarbojas uz sienu ar spēku F 2, kas ir vienāds ar spēku F 1 un ir vērsts pretēji.
Ir daudz molekulu, un katra no tām sadursmes laikā nodod to pašu impulsu sienai. Sekundes laikā viņi pārraida impulsu 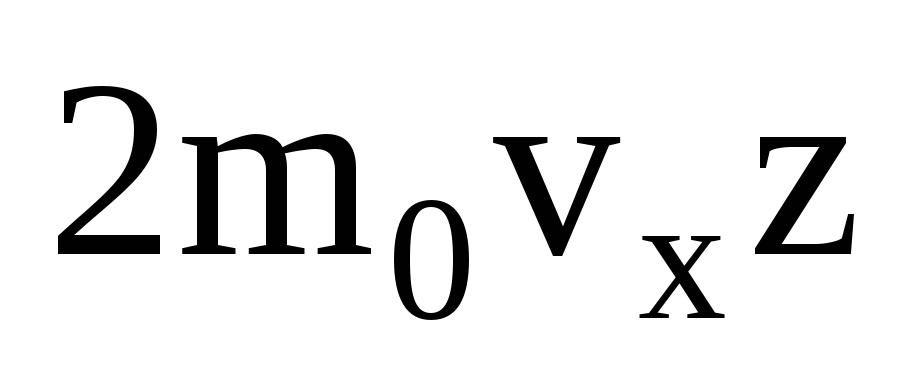 , kur z ir visu molekulu sadursmju skaits ar sienu, kas ir proporcionāls molekulu koncentrācijai gāzē, molekulu ātrumam un sienas virsmas laukumam:
, kur z ir visu molekulu sadursmju skaits ar sienu, kas ir proporcionāls molekulu koncentrācijai gāzē, molekulu ātrumam un sienas virsmas laukumam: 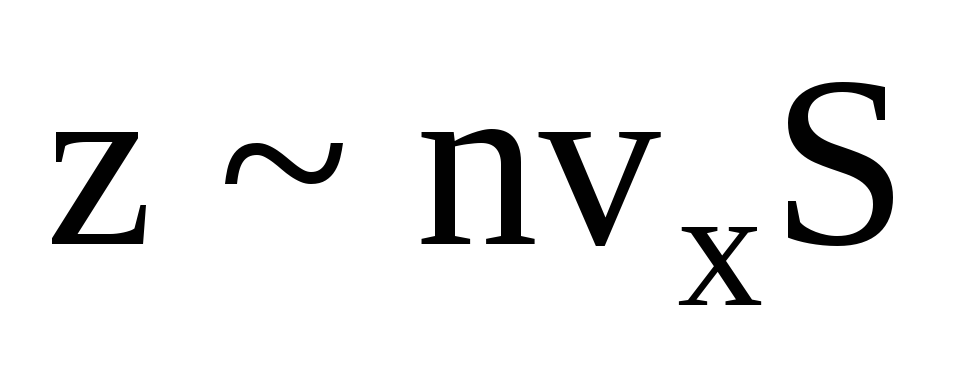 . Tikai puse molekulu virzās uz sienu, pārējās kustas pretējā virzienā:
. Tikai puse molekulu virzās uz sienu, pārējās kustas pretējā virzienā: 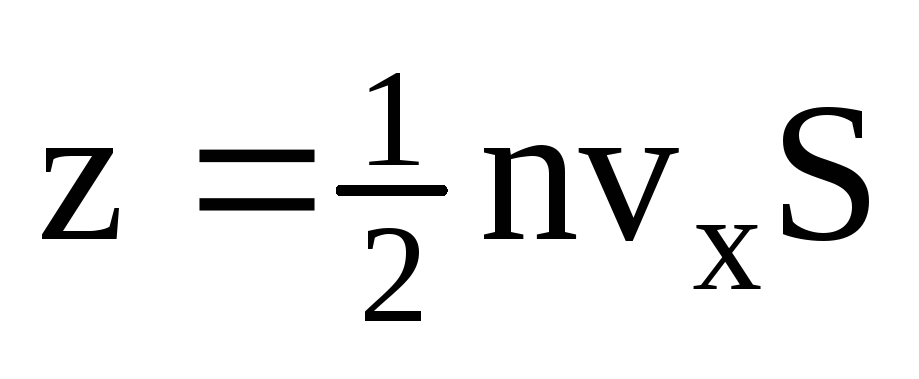 . Tad kopējais impulss tiek pārnests uz sienu 1 sekundē:
. Tad kopējais impulss tiek pārnests uz sienu 1 sekundē: 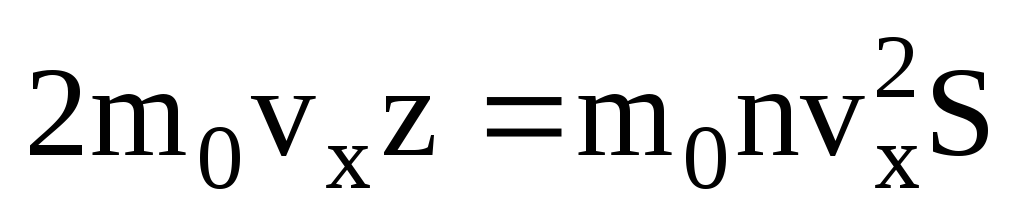 . Saskaņā ar otro Ņūtona likumu ķermeņa impulsa izmaiņas laika vienībā ir vienādas ar spēku, kas uz to iedarbojas:
. Saskaņā ar otro Ņūtona likumu ķermeņa impulsa izmaiņas laika vienībā ir vienādas ar spēku, kas uz to iedarbojas:
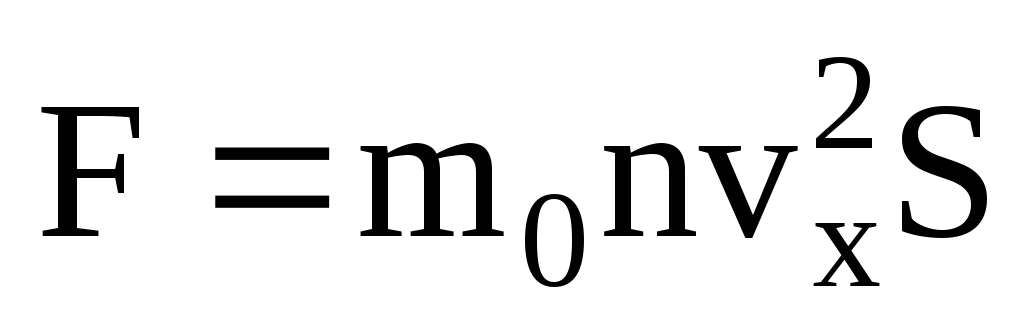
Ņemot vērā, ka ne visām molekulām ir vienāds ātrums, spēks, kas iedarbojas uz sienu, būs proporcionāls ātruma vidējam kvadrātam. Tā kā molekulas pārvietojas visos virzienos, prognozēto ātrumu kvadrātu vidējās vērtības ir vienādas. Tāpēc ātruma projekcijas vidējais kvadrāts ir: 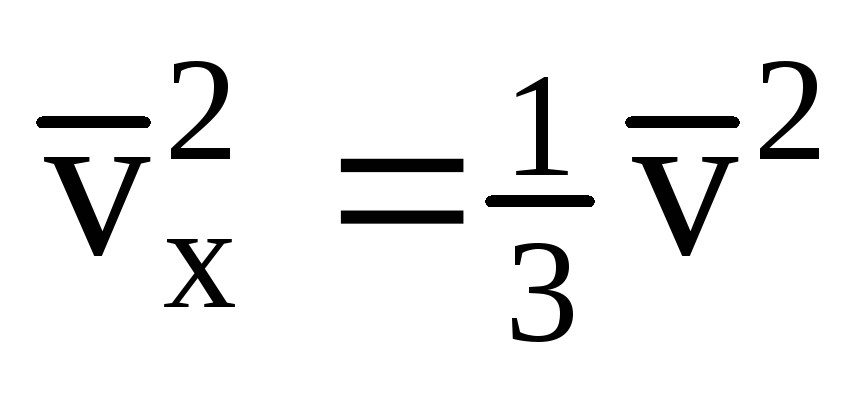 ;
;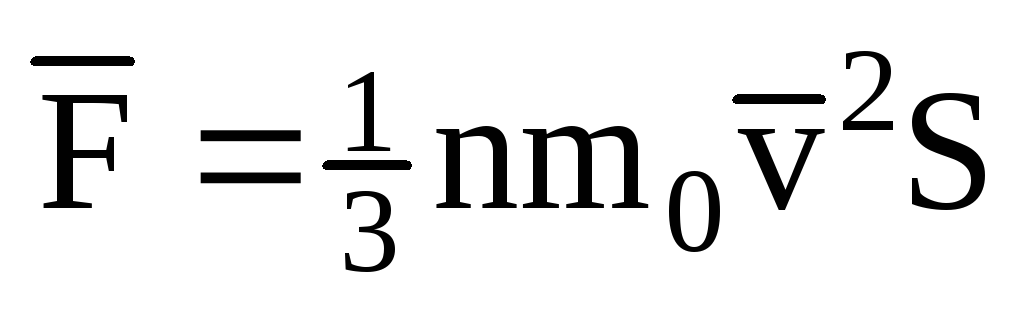 . Tad gāzes spiediens uz trauka sienu ir vienāds ar:
. Tad gāzes spiediens uz trauka sienu ir vienāds ar:
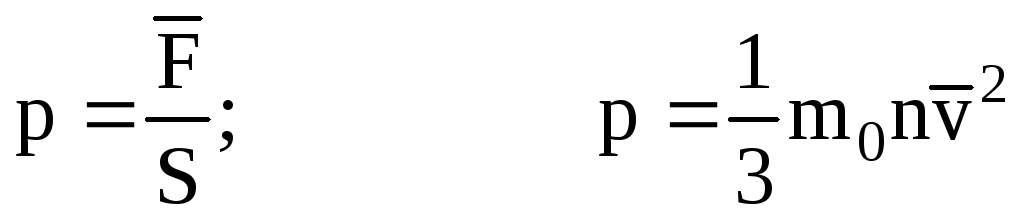 - MKT pamatvienādojums.
- MKT pamatvienādojums.
Molekulu translācijas kustības kinētiskās enerģijas vidējās vērtības noteikšana ideāla gāze:
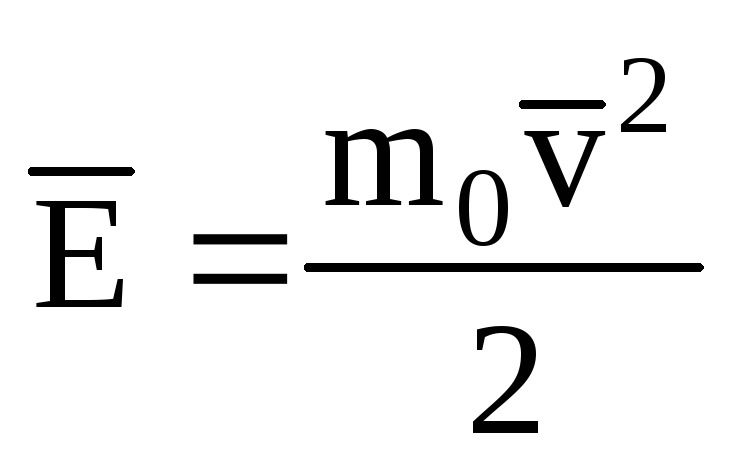 , saņemam
, saņemam
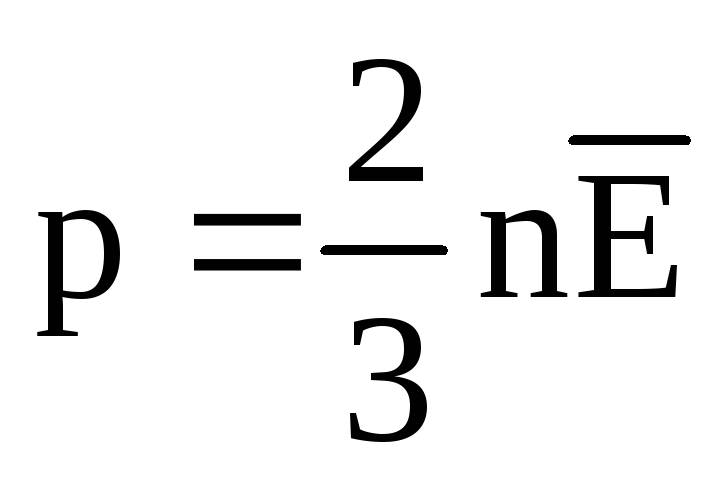
Temperatūra un tās mērīšana:
MKT pamatvienādojums ideālai gāzei izveido saikni starp viegli izmērāmu makroskopisku parametru - spiedienu - un tādiem mikroskopiskiem gāzes parametriem kā vidējā kinētiskā enerģija un molekulārā koncentrācija. Bet, mērot tikai spiedienu, mēs nevaram uzzināt ne atsevišķu molekulu vidējo kinētisko enerģiju, ne to koncentrāciju. Līdz ar to, lai atrastu gāzes mikroskopiskos parametrus, ir nepieciešami kāda cita fiziska lieluma mērījumi, kas saistīti ar molekulu vidējo kinētisko enerģiju. Šis daudzums ir temperatūra.
Jebkurš makroskopisks ķermenis vai makroskopisko ķermeņu grupa pastāvīgos ārējos apstākļos spontāni pāriet termiskā līdzsvara stāvoklī. termiskais līdzsvars -Šis ir stāvoklis, kurā visi makroskopiskie parametri paliek nemainīgi tik ilgi, cik vēlaties.
Temperatūra raksturo ķermeņu sistēmas termiskā līdzsvara stāvokli: visiem sistēmas ķermeņiem, kas atrodas termiskā līdzsvarā vienam ar otru, ir vienāda temperatūra.
Temperatūras mērīšanai varat izmantot jebkura makroskopiskā daudzuma izmaiņas atkarībā no temperatūras: tilpuma, spiediena, elektriskās pretestības utt.
Visbiežāk praksē tiek izmantota šķidruma (dzīvsudraba vai spirta) tilpuma atkarība no temperatūras. Kalibrējot termometru, par atskaites punktu parasti tiek ņemta ledus kušanas temperatūra (0); otro konstantu punktu (100) uzskata par ūdens viršanas temperatūru normālā atmosfēras spiedienā (Celsija skala). Tā kā dažādi šķidrumi karsējot izplešas atšķirīgi, šādi izveidotā skala zināmā mērā būs atkarīga no attiecīgā šķidruma īpašībām. Protams, 0 un 100°C sakritīs visiem termometriem, bet 50°C nesakritīs.
Atšķirībā no šķidrumiem, visas retinātās gāzes karsējot izplešas vienādi un mainoties temperatūrai vienādi maina spiedienu. Tāpēc fizikā, lai izveidotu racionālu temperatūras skalu, viņi izmanto noteikta daudzuma retinātas gāzes spiediena izmaiņas nemainīgā tilpumā vai gāzes tilpuma izmaiņas nemainīgā spiedienā. Šo skalu dažreiz sauc ideālās gāzes temperatūras skala.
Termiskā līdzsvara apstākļos visu gāzu molekulu translācijas kustības vidējā kinētiskā enerģija ir vienāda. Spiediens ir tieši proporcionāls molekulu translācijas kustības vidējai kinētiskajai enerģijai: 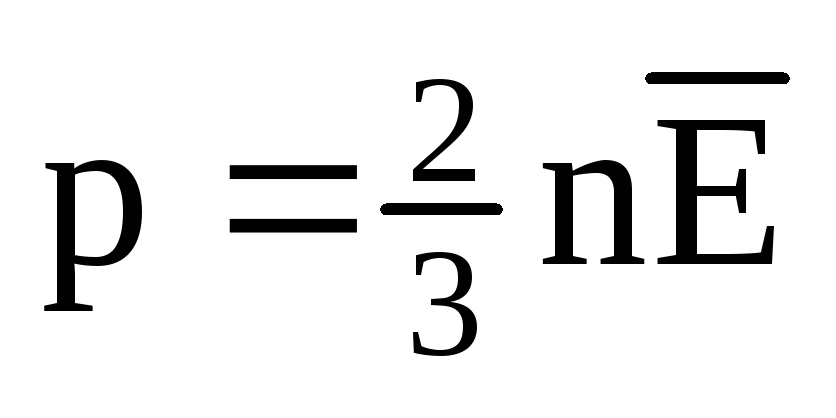 . Termiskā līdzsvara apstākļos, ja noteiktas masas gāzes spiediens un tilpums ir fiksēts, gāzes molekulu vidējai kinētiskajai enerģijai ir jābūt stingri noteiktai vērtībai, tāpat kā temperatūrai. Jo
. Termiskā līdzsvara apstākļos, ja noteiktas masas gāzes spiediens un tilpums ir fiksēts, gāzes molekulu vidējai kinētiskajai enerģijai ir jābūt stingri noteiktai vērtībai, tāpat kā temperatūrai. Jo 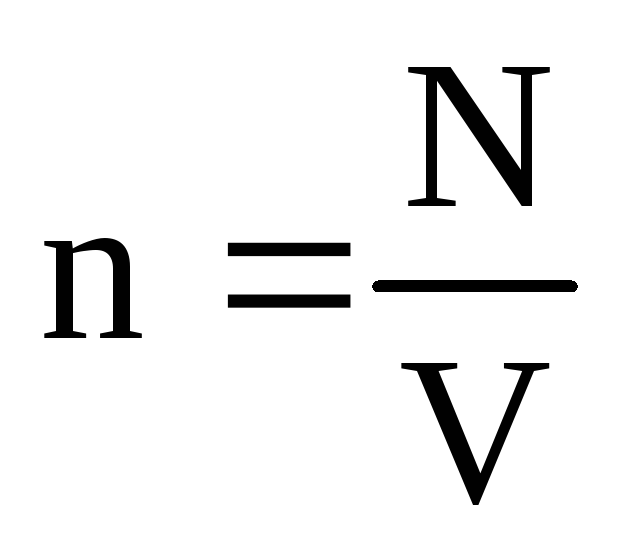 , Tas
, Tas 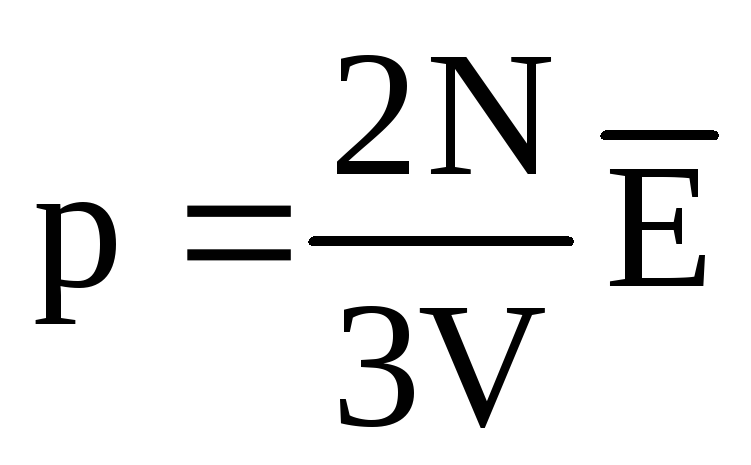 , vai
, vai 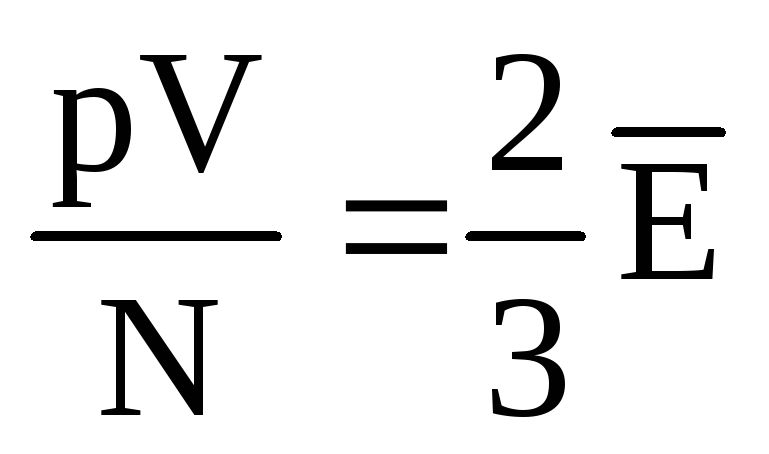 .
.
Apzīmēsim 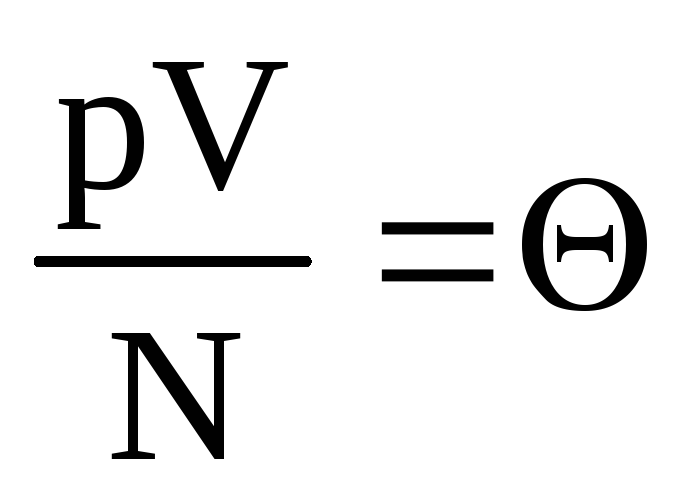 . Lielums
. Lielums  palielinās, palielinoties temperatūrai, un tas nav atkarīgs no nekā cita, izņemot temperatūru. Tāpēc to var uzskatīt par dabisku temperatūras mērauklu.
palielinās, palielinoties temperatūrai, un tas nav atkarīgs no nekā cita, izņemot temperatūru. Tāpēc to var uzskatīt par dabisku temperatūras mērauklu.
Molekulārā kinētiskā teorija apraksta īpaša ideāla objekta, ko sauc par , uzvedību un īpašības ideāla gāze. Šis fiziskais modelis ir balstīts uz vielas molekulāro struktūru. Molekulārās teorijas radīšana ir saistīta ar R. Klausiusa, Dž. Maksvela, D. Džoula un L. Bolcmaņa darbiem.
Ideāla gāze. Ideālās gāzes molekulārā kinētiskā teorija ir balstīta uz šādām telpām:
atomus un molekulas var uzskatīt par materiālie punkti, nepārtrauktā kustībā;
gāzes molekulu iekšējais tilpums ir niecīgs salīdzinājumā ar tvertnes tilpumu;
visi atomi un molekulas ir atšķirami, tas ir, ir principiāli iespējams sekot katras daļiņas kustībai;
pirms gāzes molekulas saduras, starp tām nav mijiedarbības spēku, un tiek pieņemts, ka molekulu sadursmes savā starpā un ar trauka sienām ir absolūti elastīgas;
katra gāzes atoma vai molekulas kustību apraksta klasiskās mehānikas likumi.
Ideālai gāzei iegūtos likumus var izmantot reālu gāzu izpētē. Lai to izdarītu, tiek izveidoti eksperimentāli ideālās gāzes modeļi, kuros reālās gāzes īpašības ir tuvas ideālās gāzes īpašībām (piemēram, zemā spiedienā un augstā temperatūrā).
Ideālie gāzes likumi
Boila-Mariotas likums:
noteiktai gāzes masai nemainīgā temperatūrā gāzes spiediena un tilpuma reizinājums ir nemainīga vērtība: рV = konst , (1.1)
plkst T = konst , m = konst .
Līkne, kas attēlo attiecību starp daudzumiem R Un V, raksturo vielas īpašības nemainīgā temperatūrā, un to sauc izoterma tā ir hiperbola (1.1. att.), un procesu, kas notiek nemainīgā temperatūrā, sauc par izotermisku.
Geja-Lusaka likumi:
Noteiktas gāzes masas tilpums nemainīgā spiedienā mainās lineāri atkarībā no temperatūras
V=V 0 (1 + t ) plkst P = konst , m = konst . (1.2)

lpp = lpp 0 (1 + t ) plkst V = konst , m = konst . (1.3)
(1.2) un (1.3) vienādojumos temperatūru izsaka pēc Celsija skalas, spiedienu un tilpumu - plkst.
0 С, kamēr
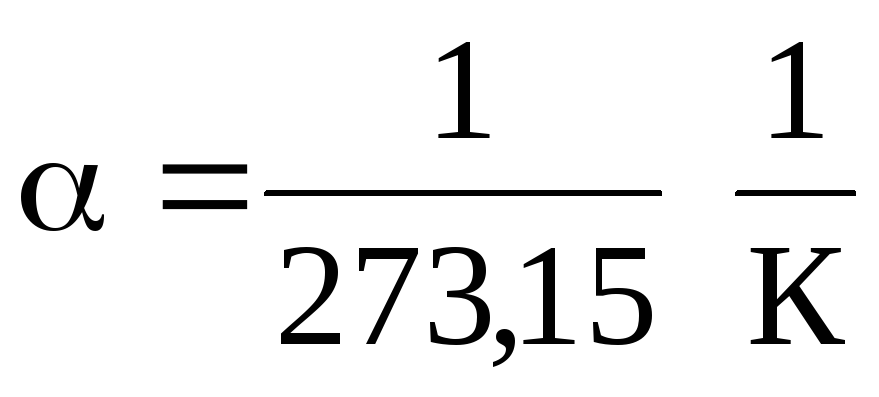 .
.
Tiek saukts process, kas notiek pastāvīgā spiedienā izobarisks, to var attēlot kā lineāru funkciju (1.2. att.).
Tiek saukts process, kas notiek nemainīgā tilpumā izohorisks(1.3. att.).
No (1.2) un (1.3) vienādojumiem izriet, ka izobāri un izohori punktā krustojas ar temperatūras asi t =1/ = 273,15 С . Ja mēs pārvietojam atskaites punktu uz šo punktu, mēs pārejam uz Kelvina skalu.
Ievadīšana formulās (1.2) un (1.3) termodinamiskā temperatūra, Gay-Lussac likumiem var piešķirt ērtāku formu:
V = V 0 (1+t) = = V 0 = =V 0 T;
lpp = lpp 0 (1+t) = lpp 0 = lpp 0 T;
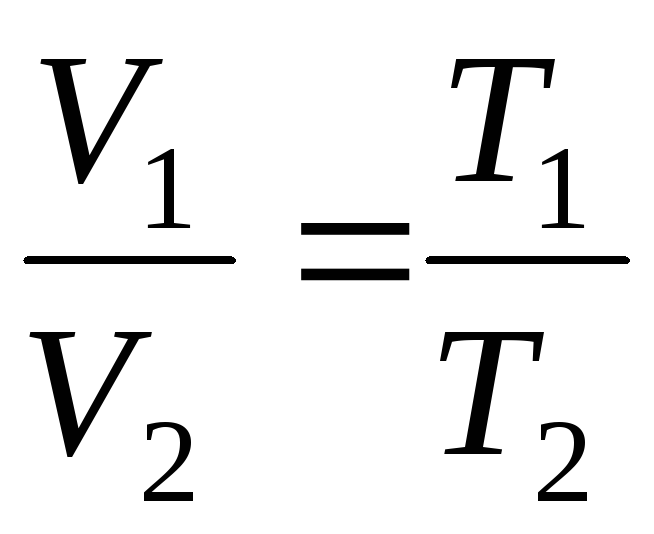 plkst
p = const, m = const
;
(1.4)
plkst
p = const, m = const
;
(1.4)
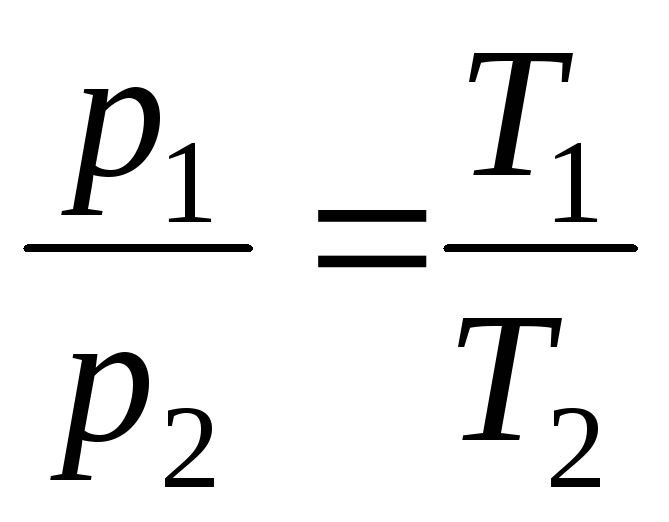 plkst V = const, m = const
,
(1.5)
plkst V = const, m = const
,
(1.5)
kur indeksi 1 un 2 attiecas uz patvaļīgiem stāvokļiem, kas atrodas uz tā paša izobāra vai izohora .
Avogadro likums:
jebkuru gāzu moli vienādās temperatūrās un spiedienā aizņem vienādus tilpumus.
Normālos apstākļos šis tilpums ir vienāds ar V,0 = 22,4110 -3 m 3 /mol . Pēc definīcijas vienā tirdzniecības centrā dažādas vielas satur tādu pašu molekulu skaitu, kas vienāds ar Avogadro konstante:N A = 6,02210 23 kurmis -1 .
Daltona likums:
dažādu ideālo gāzu maisījuma spiediens ir vienāds ar parciālo spiedienu summu R 1 , R 2 , R 3 … R n , tajā iekļautās gāzes:
p = p 1 + lpp 2 + R 3 + …+ lpp n .
Daļējs spiediens – Šis spiedienu, ko radītu sastāvā esošā gāze gāzes maisījums, ja tas viens pats aizņēma tilpumu, kas vienāds ar maisījuma tilpumu tajā pašā temperatūrā.
Ideāls gāzes stāvokļa vienādojums
(Klepeirona-Mendeļejeva vienādojums)
Pastāv noteikta saistība starp temperatūru, tilpumu un spiedienu. Šīs attiecības var attēlot ar funkcionālu atkarību:
f(p, V, T)= 0.
Savukārt katrs no mainīgajiem ( p, V, T) ir divu citu mainīgo funkcija. Eksperimentāli tiek noteikts funkcionālās atkarības veids katram vielas fāzes stāvoklim (ciets, šķidrs, gāzveida). Tas ir ļoti darbietilpīgs process, un stāvokļa vienādojums ir izveidots tikai gāzēm, kas ir retinātā stāvoklī, un aptuvenā formā dažām saspiestām gāzēm. Vielām, kas nav gāzveida stāvoklī, šī problēma vēl nav atrisināta.
Franču fiziķis B. Klepeirons secināja ideālās gāzes stāvokļa vienādojums, apvienojot Boila-Mariotas, Geja-Lusaka, Čārlza likumus:
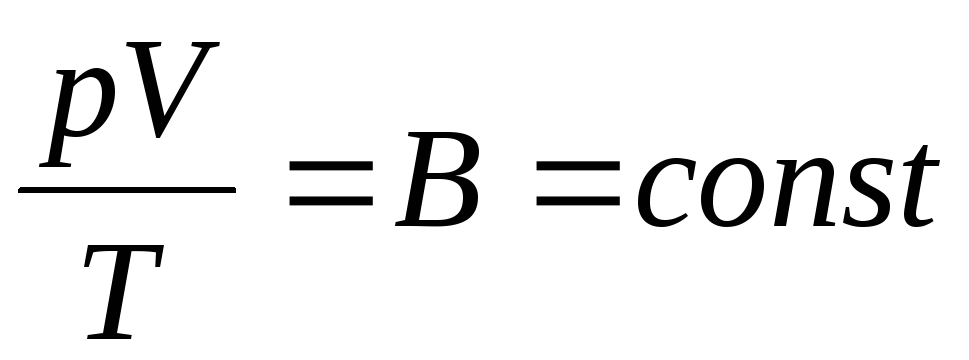 . (1.6)
. (1.6)
Izteiksme (1.6) ir Klepeirona vienādojums, kur IN- gāzes konstante. Dažādām gāzēm tas ir atšķirīgs.
DI. Mendeļejevs apvienoja Klepeirona vienādojumu ar Avogadro likumu, saistot vienādojumu (1.6) ar vienu molu un izmantojot molāro tilpumu V . Saskaņā ar Avogadro likumu, par vienādiem R Un T visu gāzu moli aizņem vienādu molāro tilpumu V .
.
Tāpēc konstante IN būs vienāds visām ideālajām gāzēm. Šo konstanti parasti apzīmē R un ir vienāds ar R=
8,31
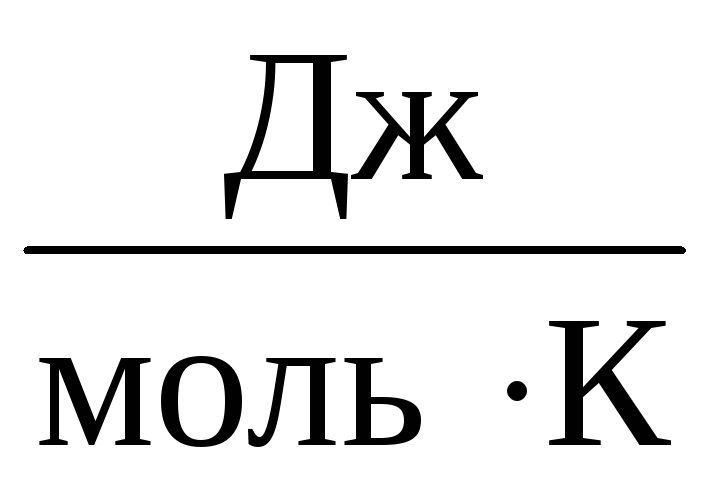 .
.
Klepeirona-Mendeļejeva vienādojums ir šāda forma:
lpp V . = R T.
No vienādojuma (1.7) vienam molam gāzes mēs varam pāriet uz Klepeirona-Mendeļejeva vienādojums patvaļīgai gāzes masai:
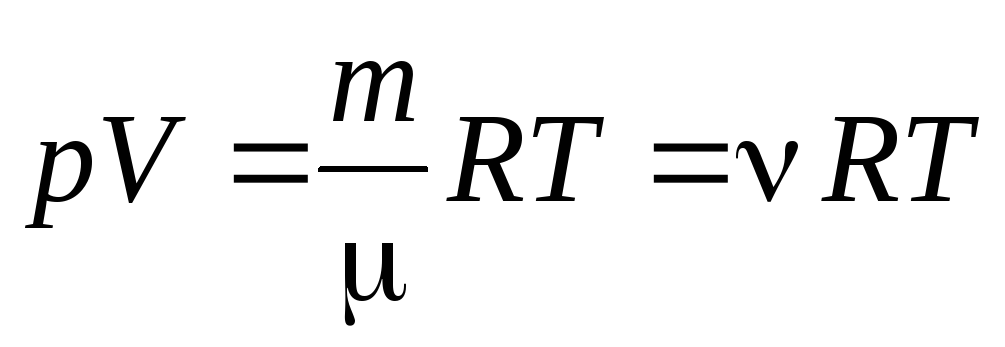 , (1.7)
, (1.7)
Kur
–
molārā masa
(viena mola vielas masa, kg/mol); m
gāzes masa;
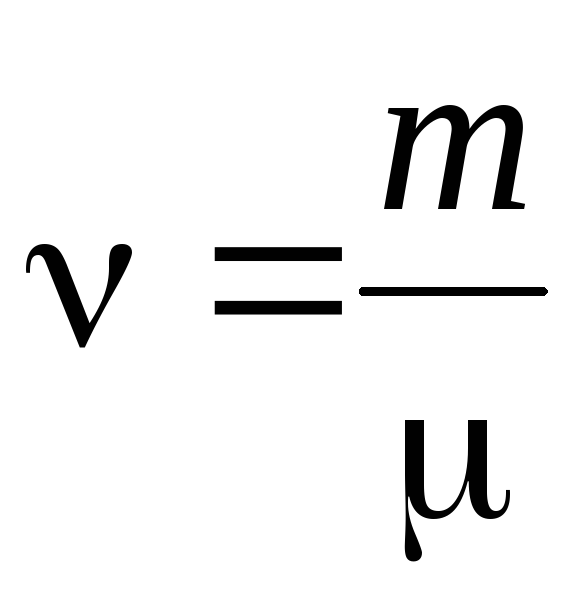 - vielas daudzums .
- vielas daudzums .
Biežāk viņi izmanto citu ideālās gāzes stāvokļa vienādojuma formu, ieviešot Bolcmana konstante: 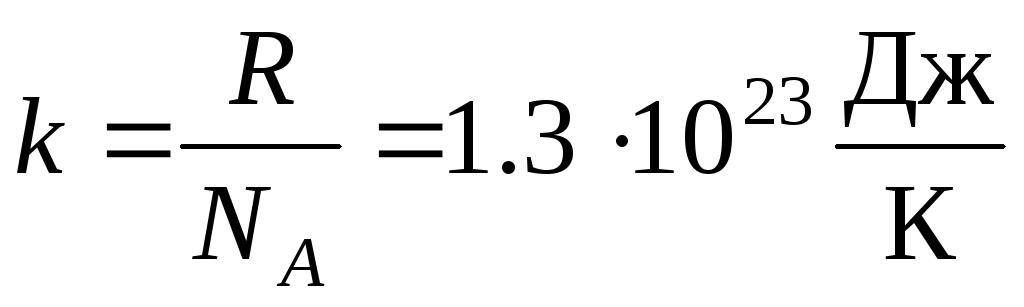 .
.
Tad vienādojums (1.7) izskatās šādi:
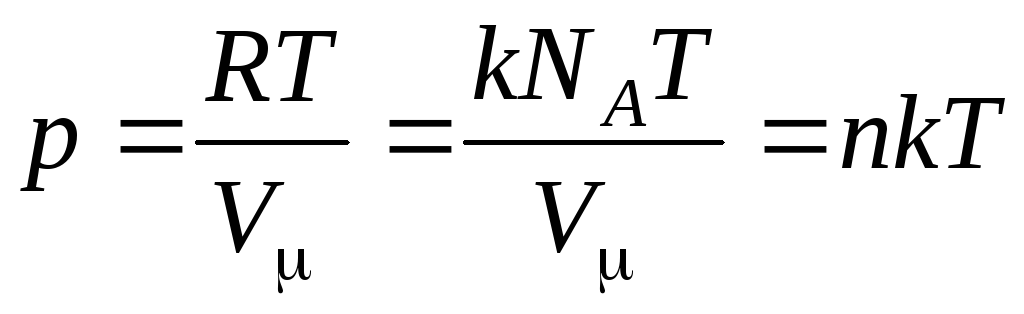 ,
(1.8)
,
(1.8)
Kur
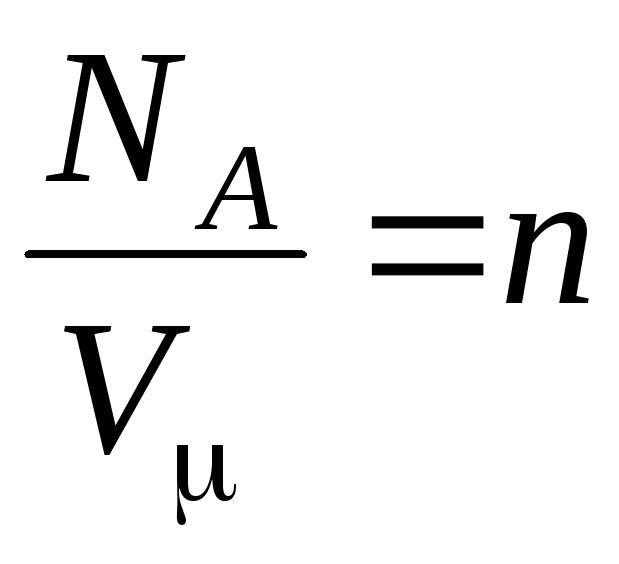 –
molekulu koncentrācija (molekulu skaits tilpuma vienībā). No šī izteiksmes izriet, ka ideālās gāzes spiediens ir tieši proporcionāls tās molekulu koncentrācijai vai gāzes blīvumam. Tajā pašā temperatūrā un spiedienā visas gāzes satur vienādu molekulu skaitu tilpuma vienībā. Tiek saukts to molekulu skaits, kas normālos apstākļos atrodas 1 m3
Loschmidt numurs:
–
molekulu koncentrācija (molekulu skaits tilpuma vienībā). No šī izteiksmes izriet, ka ideālās gāzes spiediens ir tieši proporcionāls tās molekulu koncentrācijai vai gāzes blīvumam. Tajā pašā temperatūrā un spiedienā visas gāzes satur vienādu molekulu skaitu tilpuma vienībā. Tiek saukts to molekulu skaits, kas normālos apstākļos atrodas 1 m3
Loschmidt numurs:
N L = 2,68 10 25 m -3.
Molekulārās kinētikas pamatvienādojums
ideālās gāzes teorija
Vissvarīgākais uzdevums Gāzu kinētiskā teorija ir ideālas gāzes spiediena teorētiskais aprēķins pamatojoties uz molekulāri kinētiskiem jēdzieniem. Ideālo gāzu molekulāri kinētiskās teorijas pamatvienādojums ir iegūts, izmantojot statistikas metodes.
Tiek pieņemts, ka gāzes molekulas pārvietojas haotiski, savstarpējo sadursmju skaits starp gāzes molekulām ir niecīgs, salīdzinot ar triecienu skaitu uz tvertnes sienām, un šīs sadursmes ir absolūti elastīgas. Uz trauka sienas ir identificēts noteikts elementārs laukums S un aprēķiniet spiedienu, kādu gāzes molekulas radīs šajā zonā.
Jāņem vērā, ka patiesībā molekulas var virzīties uz vietu dažādos leņķos un var būt dažādi ātrumi, kas turklāt var mainīties ar katru sadursmi. Teorētiskajos aprēķinos molekulu haotiskās kustības tiek idealizētas un aizstātas ar kustību pa trim savstarpēji perpendikulāriem virzieniem.
Ja mēs uzskatām kuģi kuba formā, kurā N gāzes molekulas sešos virzienos, tad ir viegli pamanīt, ka jebkurā laika momentā pa katru pārvietojas 1/3 no visu molekulu skaita un puse no tām (tas ir, 1/6 no visu molekulu skaita ) pārvietojas vienā virzienā, bet otrā puse (arī 1/6) - pretējā virzienā. Ar katru sadursmi atsevišķa molekula, kas pārvietojas perpendikulāri platformai, tiek atspoguļota, pārnes impulsu uz to, savukārt tās impulss (impulss) mainās par lielumu.
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Molekulu triecienu skaits, kas pārvietojas noteiktā virzienā uz platformu, būs vienāds ar: N = 1/6 n Svt. Saduroties ar platformu, šīs molekulas uz to pārnes impulsu
P= N P 1 =2 m 0 vnSvt = m 0 v 2 nSt,
Kur n– molekulu koncentrācija. Tad spiediens, ko gāze iedarbojas uz trauka sienu, būs vienāds ar:
p = 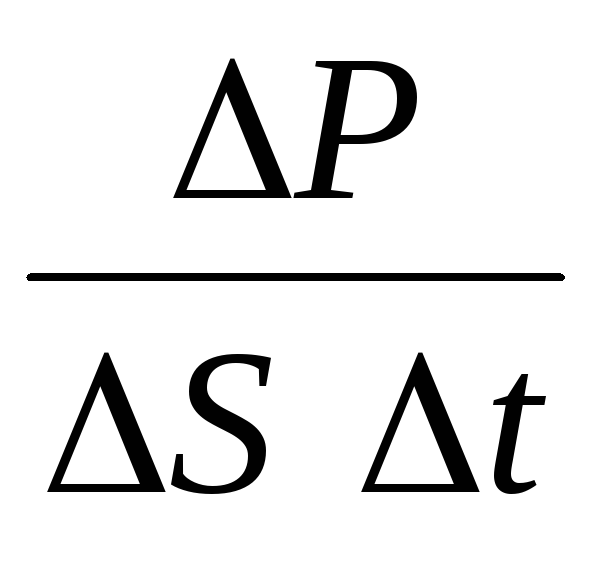 =
n m 0
v 2
.
(1.9)
=
n m 0
v 2
.
(1.9)
Tomēr gāzes molekulas pārvietojas dažādos ātrumos: v 1 , v 2 , …,v n, tāpēc ātrumiem ir jābūt vidējiem. Gāzes molekulu kustības ātruma kvadrātu summa, dalīta ar to skaitu, nosaka vidējo kvadrātisko ātrumu:
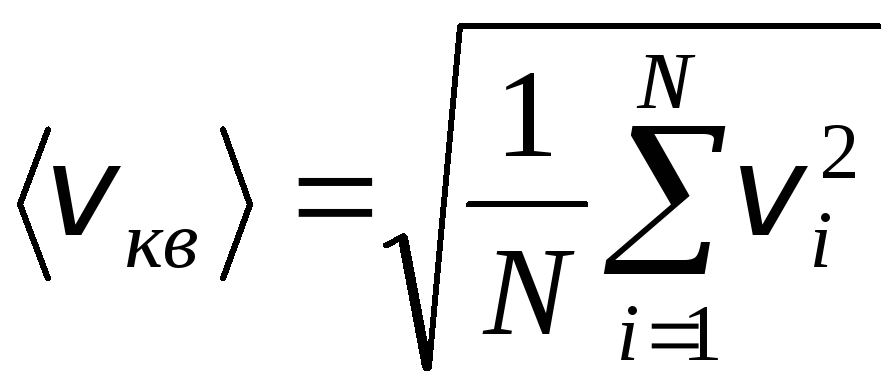 .
.
Vienādojums (1.9) būs šādā formā:
![]() (1.10)
(1.10)
izteiksme (1.10) tiek izsaukta Molekulārās kinētiskās teorijas pamatvienādojums ideālās gāzes.
Ņemot vērā, ka 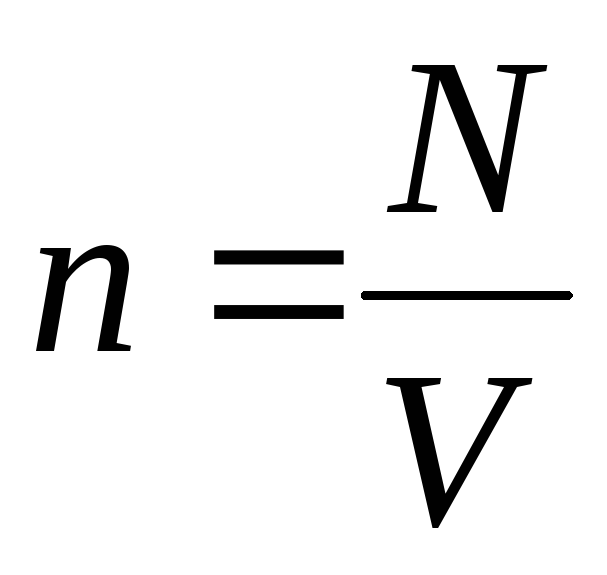 , mēs iegūstam:
, mēs iegūstam:
p V = N 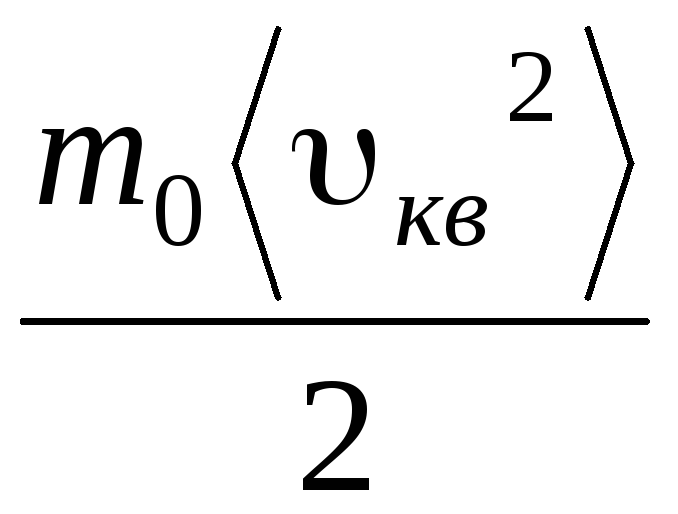 =E,
(1.11)
=E,
(1.11)
Kur E– visu gāzes molekulu translācijas kustības kopējā kinētiskā enerģija. Līdz ar to gāzes spiediens ir tieši proporcionāls gāzes molekulu translācijas kustības kinētiskajai enerģijai.
Par vienu molu gāzes m =, un Klapeirona-Mendeļejeva vienādojumam ir šāda forma:
p V . = R T,
un tā kā no (1.11.) izriet, ka pV . = v kv 2, mēs iegūstam:
RT = v kv 2 .
Tādējādi gāzes molekulu vidējais kvadrātiskais ātrums ir vienāds ar
v
kv
=
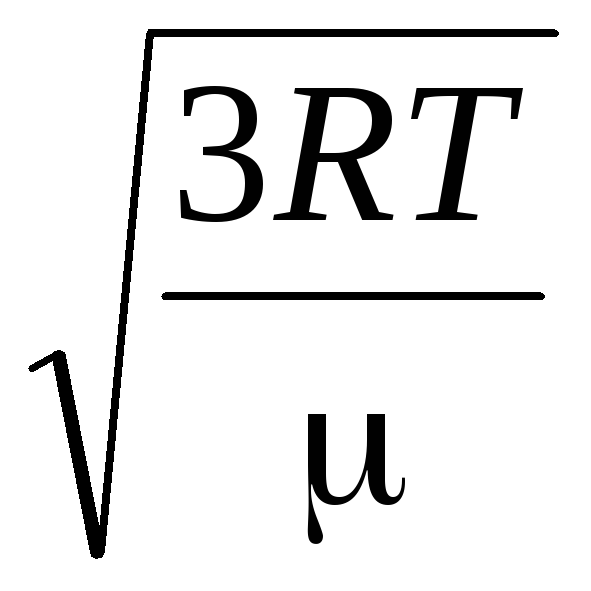 =
=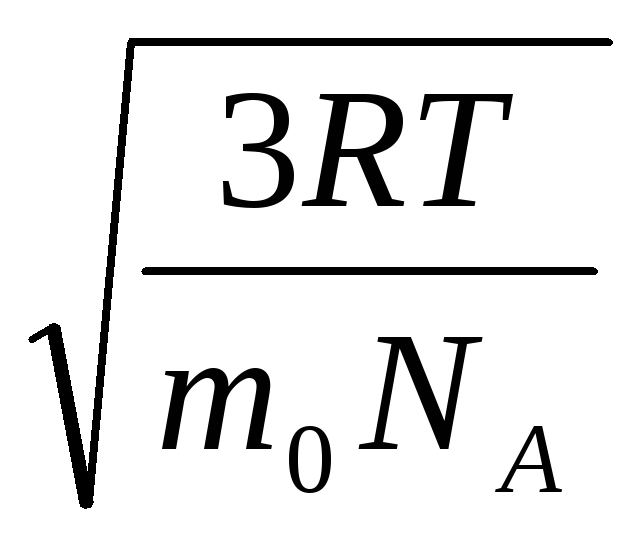 =
= ,
,
Kur k = R/N A = 1,3810 -23 J/K – Bolcmaņa konstante. No šejienes var atrast skābekļa molekulu vidējo kvadrātisko ātrumu istabas temperatūrā - 480 m/s, ūdeņraža - 1900 m/s.
Temperatūras molekulāri kinētiskā nozīme
Temperatūra ir ķermeņa “siltuma” kvantitatīvais mērs. Noskaidrot absolūtās termodinamiskās temperatūras fizisko nozīmi T Salīdzināsim gāzu molekulāri kinētiskās teorijas pamatvienādojumu (1.14) ar Klepeirona-Mendeļejeva vienādojumu. lpp V = R T.
Pielīdzinot šo vienādojumu labās puses, mēs atrodam vienas molekulas kinētiskās enerģijas vidējo vērtību 0 ( = N/N A , k=R/N A):
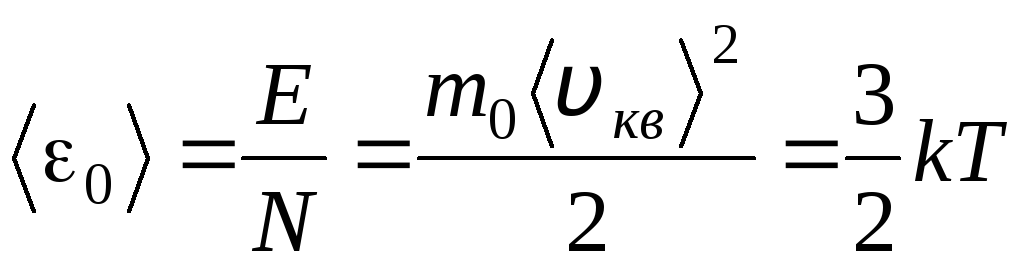 .
.
No šī vienādojuma izriet vissvarīgākais molekulārās kinētiskās teorijas secinājums: ideālas gāzes vienas molekulas translācijas kustības vidējā kinētiskā enerģija ir atkarīga tikai no temperatūras, savukārt tā ir tieši proporcionāla termodinamiskajai temperatūrai. Tādējādi termodinamiskā temperatūras skala iegūst tiešu fizikālu nozīmi: plkst T= 0 ideālu gāzes molekulu kinētiskā enerģija ir nulle. Līdz ar to, pamatojoties uz šo teoriju, gāzes molekulu translācijas kustība apstāsies un tās spiediens kļūs nulle.
Ideālas gāzes līdzsvara īpašību teorija
Molekulu brīvības pakāpju skaits. Ideālu gāzu molekulāri kinētiskā teorija rada ļoti svarīgas sekas: gāzes molekulas iziet nejaušu kustību, un molekulas translācijas kustības vidējo kinētisko enerģiju nosaka tikai temperatūra.
Molekulu kustības kinētisko enerģiju kinētika neizsmeļ uz priekšu kustības enerģija: tas arī sastāv no kinētiskā enerģijas rotācija Un svārstības molekulas. Lai aprēķinātu enerģiju, kas iztērēta visu veidu molekulu kustībām, ir jādefinē brīvības pakāpju skaits.
Zem brīvības pakāpju skaits (i) pamatteksts ir netiešs neatkarīgo koordinātu skaits, kas jāievada, lai noteiktu ķermeņa stāvokli telpā.
N  Piemēram, materiālam punktam ir trīs brīvības pakāpes, jo tā atrašanās vietu telpā nosaka trīs koordinātas: x, y Un z. Līdz ar to monatomiskajai molekulai ir trīs translācijas kustības brīvības pakāpes.
Piemēram, materiālam punktam ir trīs brīvības pakāpes, jo tā atrašanās vietu telpā nosaka trīs koordinātas: x, y Un z. Līdz ar to monatomiskajai molekulai ir trīs translācijas kustības brīvības pakāpes.
D 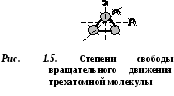 vukhatomny molekulai ir 5 brīvības pakāpes (1.4. att.): 3 translācijas kustības brīvības pakāpes un 2 rotācijas kustības brīvības pakāpes.
vukhatomny molekulai ir 5 brīvības pakāpes (1.4. att.): 3 translācijas kustības brīvības pakāpes un 2 rotācijas kustības brīvības pakāpes.
Trīs vai vairāk atomu molekulām ir 6 brīvības pakāpes: 3 translācijas kustības brīvības pakāpes un 3 rotācijas kustības brīvības pakāpes (1.5. att.).
Katrai gāzes molekulai ir noteikts brīvības pakāpju skaits, no kurām trīs atbilst tās translācijas kustībai.
Enerģijas vienlīdzības klauzula
pēc brīvības pakāpēm
Gāzu molekulārās kinētiskās teorijas galvenais priekšnoteikums ir pieņēmums par pilnīgu molekulu kustības traucējumu. Tas attiecas gan uz svārstībām, gan rotācijas kustībām, nevis tikai uz translācijas kustībām. Tiek uzskatīts, ka visi molekulu kustības virzieni gāzē ir vienādi iespējami. Tāpēc mēs varam pieņemt, ka katrai molekulas brīvības pakāpei vidēji ir vienāds enerģijas daudzums - tas ir enerģijas vienlīdzīgas sadales princips starp brīvības pakāpēm. Enerģija uz vienu molekulas brīvības pakāpi ir vienāda ar:
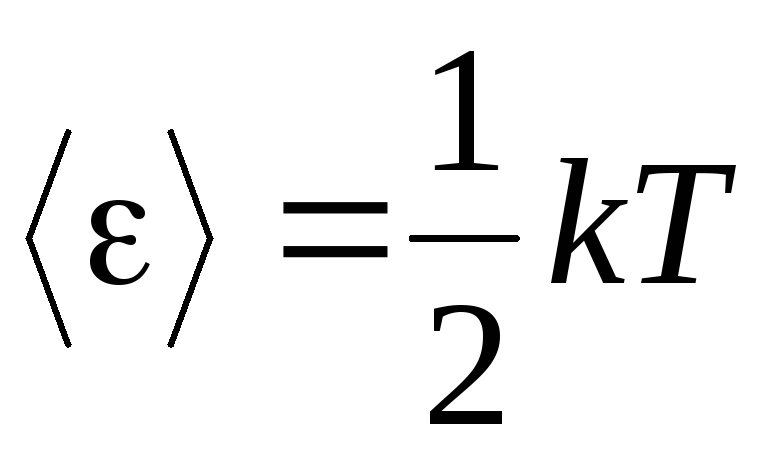 . (1.12)
. (1.12)
Ja molekulai ir i brīvības pakāpes, tad katrai brīvības pakāpei ir vidēji:
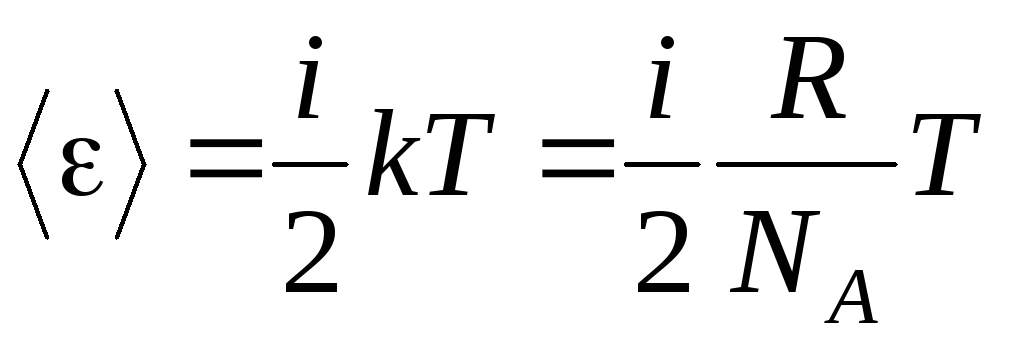 .
(1.13)
.
(1.13)
Ideālas gāzes iekšējā enerģija
Ja mēs attiecinām gāzes kopējo iekšējo enerģiju uz vienu molu, mēs iegūstam tās vērtību, reizinot ar Avogadro skaitli:
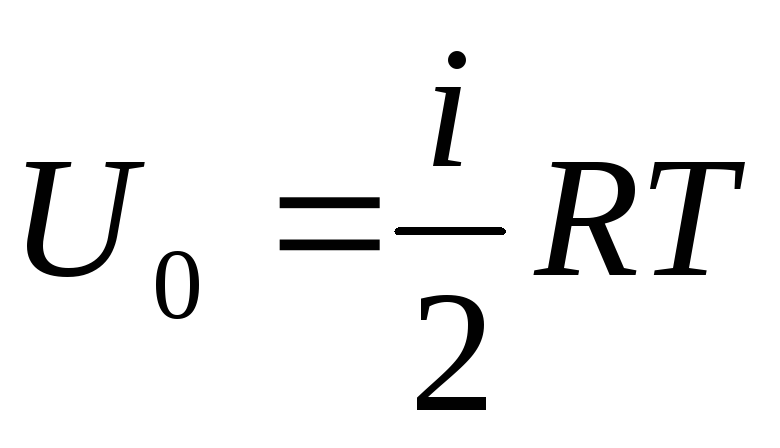 .
(1.14)
.
(1.14)
No tā izriet, ka ideālas gāzes viena mola iekšējā enerģija ir atkarīga tikai no temperatūras un gāzes molekulu brīvības pakāpju skaita.
Maksvela un Bolcmana sadalījumi
Ideālu gāzu molekulu sadalījums pēc termiskās kustības ātrumiem un enerģijām (Maksvela sadalījums). Pie nemainīgas gāzes temperatūras tiek pieņemts, ka visi molekulu kustības virzieni ir vienādi iespējami. Šajā gadījumā katras molekulas vidējais kvadrātiskais ātrums paliek nemainīgs un ir vienāds ar
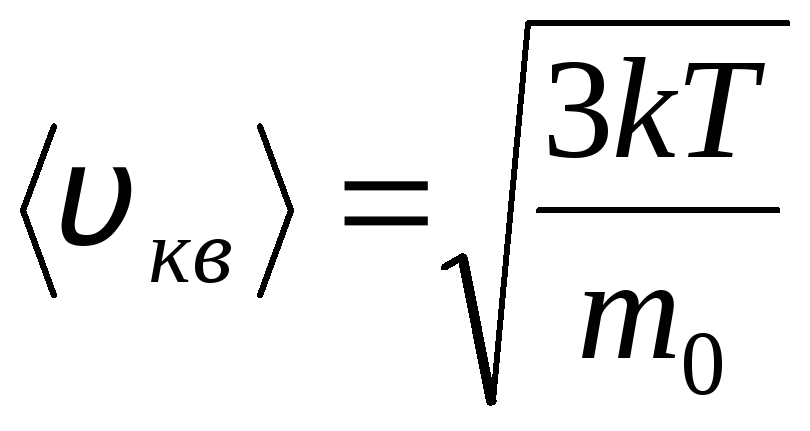 .
.
Tas izskaidrojams ar to, ka ideālā gāzē līdzsvara stāvoklī tiek izveidots noteikts molekulu stacionārs ātruma sadalījums, kas laika gaitā nemainās. šis sadalījums pakļaujas noteiktam statistikas likumam, kuru teorētiski atvasināja Dž. Maksvels. Maksvela likumu apraksta funkcija
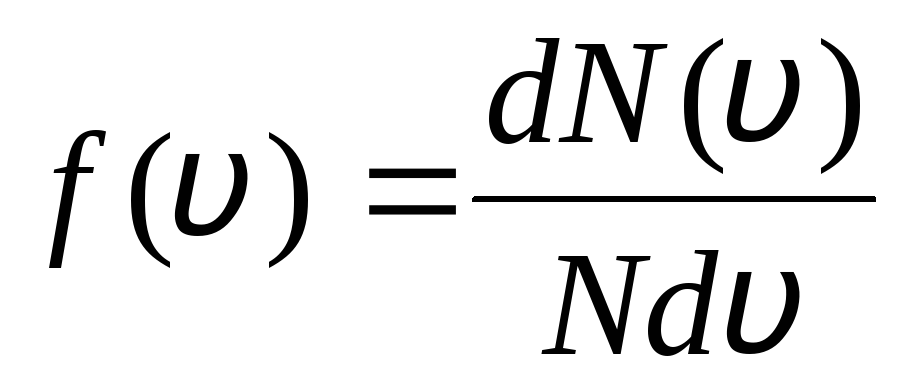 ,
,
tas ir, funkcija f(v) nosaka relatīvo molekulu skaitu  , kuru ātrumi ir diapazonā no v
pirms tam v+ dv. Izmantojot varbūtības teorijas metodes, Maksvels atklāja Ideālās gāzes molekulu sadalījuma pēc ātruma likums:
, kuru ātrumi ir diapazonā no v
pirms tam v+ dv. Izmantojot varbūtības teorijas metodes, Maksvels atklāja Ideālās gāzes molekulu sadalījuma pēc ātruma likums:
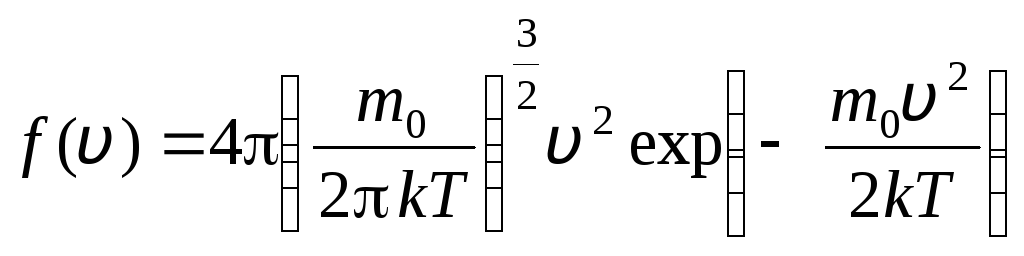 . (1.15)
. (1.15)
Sadales funkcija ir grafiski parādīta attēlā. 1.6. Laukums, ko ierobežo sadalījuma līkne un x ass, ir vienāds ar vienu. Tas nozīmē, ka funkcija f(v) atbilst normalizācijas nosacījumam:
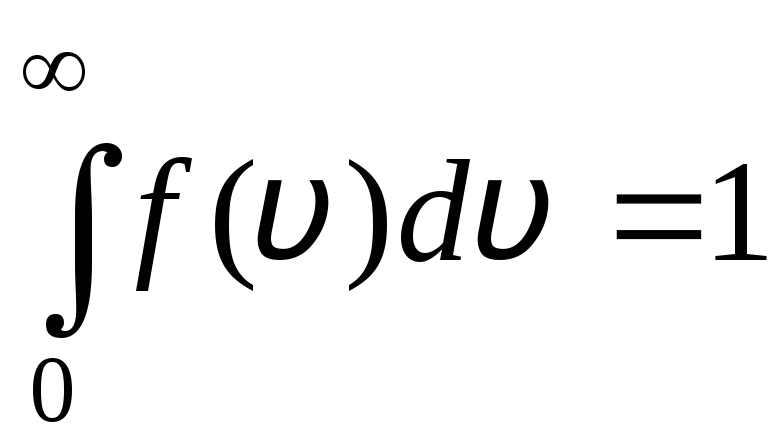 .
.
AR  ātrums, kādā ideālo gāzes molekulu ātruma sadalījuma funkcija f(v) ir maksimālais, saukts visticamāk
ātrumu
v B .
ātrums, kādā ideālo gāzes molekulu ātruma sadalījuma funkcija f(v) ir maksimālais, saukts visticamāk
ātrumu
v B .
Vērtības v = 0 Un v = atbilst izteiksmes minimumiem (1.15). Visticamāko ātrumu var atrast, diferencējot izteiksmi (1.23) un pielīdzinot to nullei:
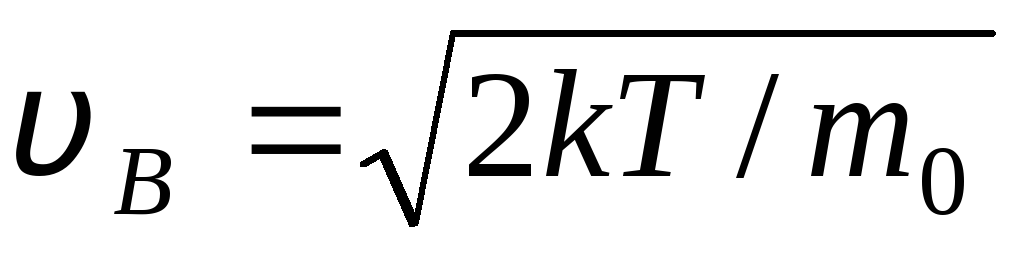 =
=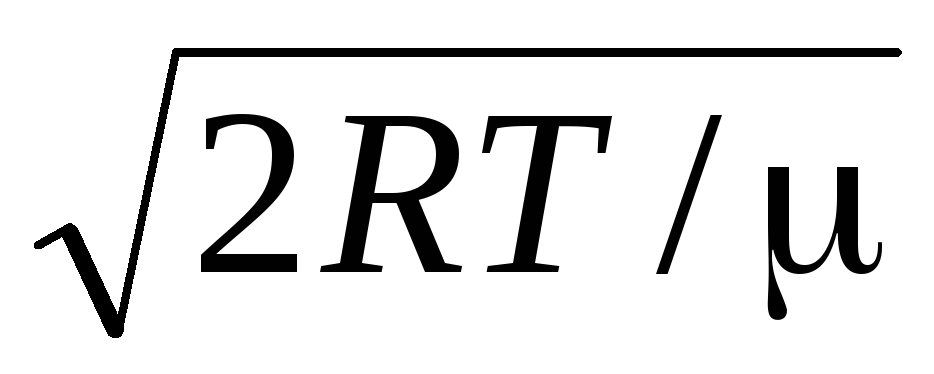 =
1,41
=
1,41
Palielinoties temperatūrai, funkcijas maksimums nobīdīsies pa labi (1.6. att.), tas ir, temperatūrai paaugstinoties, palielinās arī visticamākais ātrums, tomēr līknes ierobežotā platība paliek nemainīga. Jāņem vērā, ka gāzēs un zemā temperatūrā vienmēr ir neliels skaits molekulu, kas pārvietojas lielā ātrumā. Šādu “karstu” molekulu klātbūtne ir liela nozīme daudzu procesu gaitā.
Vidējais aritmētiskais ātrums molekulas nosaka pēc formulas
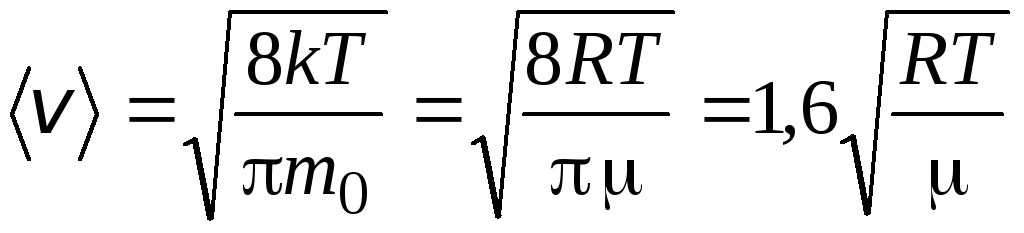 .
.
RMS ātrums
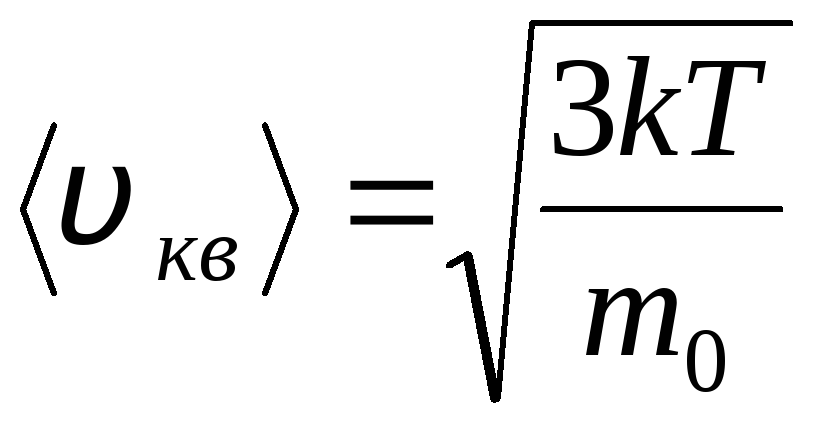 =
1,73
=
1,73 .
.
Šo ātrumu attiecība nav atkarīga ne no temperatūras, ne no gāzes veida.
Molekulu sadalījuma funkcija pēc termiskās kustības enerģijas. Šo funkciju var iegūt, ātruma vietā aizvietojot kinētiskās enerģijas vērtību molekulārā sadalījuma vienādojumā (1.15):
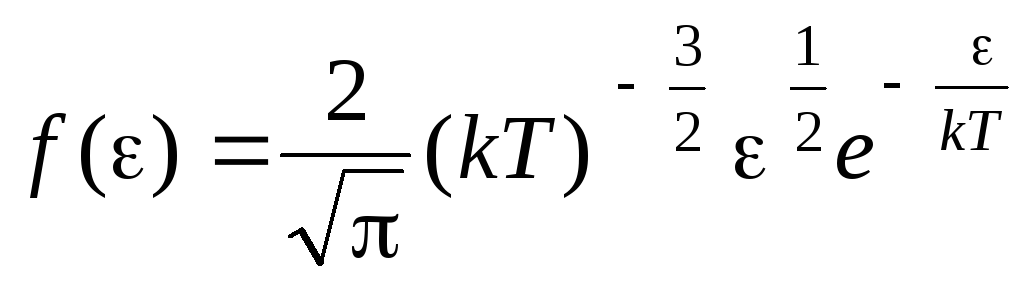 .
.
Integrējot izteiksmi pār enerģijas vērtībām no  pirms tam
pirms tam 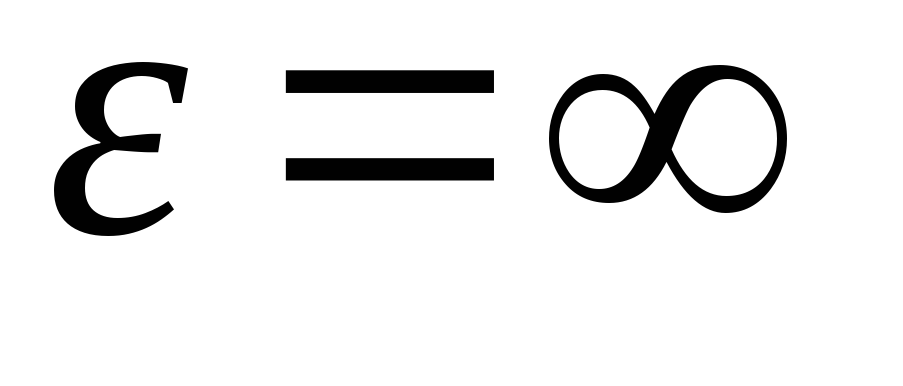
 , saņemam vidējā kinētiskā enerģija ideālās gāzes molekulas:
, saņemam vidējā kinētiskā enerģija ideālās gāzes molekulas:
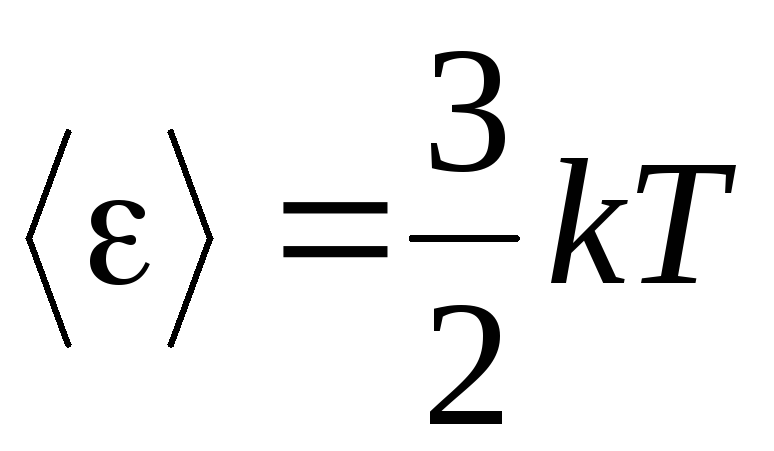 .
.
Barometriskā formula. Boltzmann izplatīšana. Atvasinot gāzu molekulāri kinētiskās teorijas pamatvienādojumu un molekulu Maksvela ātrumu sadalījumu, tika pieņemts, ka ideālās gāzes molekulas neiedarbojas ārēji spēki, tāpēc molekulas ir vienmērīgi sadalītas pa visu tilpumu. Tomēr jebkuras gāzes molekulas atrodas Zemes gravitācijas laukā. Atvasinot likumu par spiedienu pret augstumu, tiek pieņemts, ka gravitācijas lauks ir vienmērīgs, temperatūra ir nemainīga un visu molekulu masa ir vienāda:
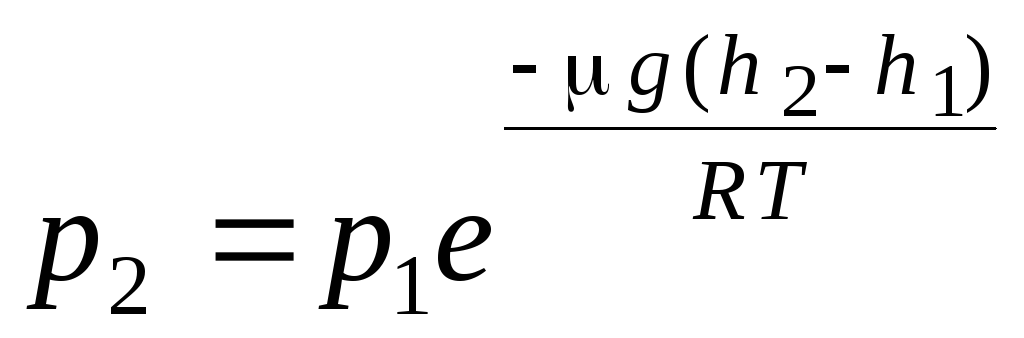 . (1.16)
. (1.16)
Izteiksme (1.16) tiek izsaukta barometriskā formula. Tas ļauj jums atrast atmosfēras spiedienu atkarībā no augstuma vai, izmērot spiedienu, varat atrast augstumu. Jo h 1 ir augstums virs jūras līmeņa, kurā spiediens tiek uzskatīts par normālu, tad izteiksmi var mainīt:
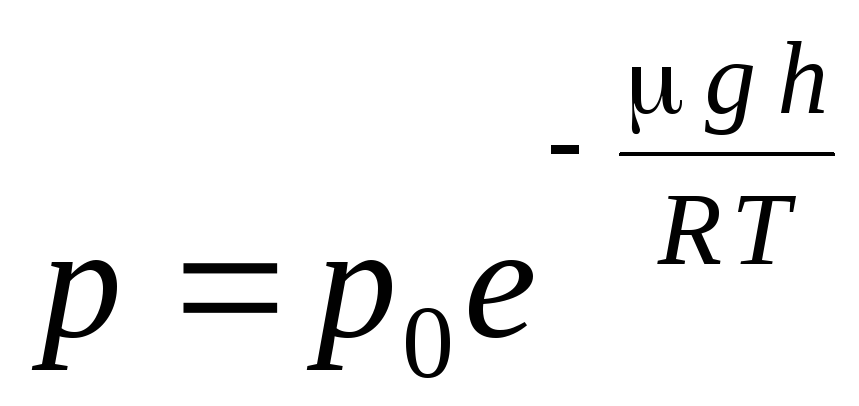 .
.
Barometrisko formulu var pārvērst, izmantojot izteiksmi p = nkT:
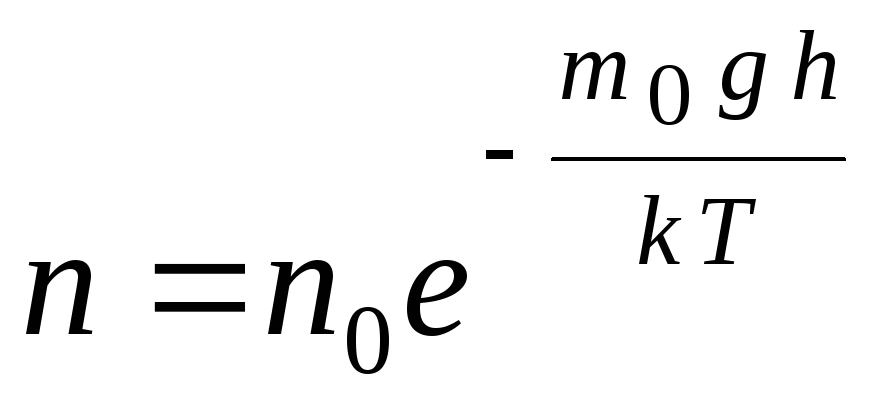 ,
,
G  de n
–
molekulu koncentrācija augstumā h,
m 0
gh=P–
molekulas potenciālā enerģija gravitācijas laukā. Pastāvīgā temperatūrā gāzes blīvums ir lielāks, ja molekulas potenciālā enerģija ir mazāka. Grafiski likums par daļiņu skaita samazināšanos tilpuma vienībā ar augstumu izskatās kā parādīts attēlā. 1.7.
de n
–
molekulu koncentrācija augstumā h,
m 0
gh=P–
molekulas potenciālā enerģija gravitācijas laukā. Pastāvīgā temperatūrā gāzes blīvums ir lielāks, ja molekulas potenciālā enerģija ir mazāka. Grafiski likums par daļiņu skaita samazināšanos tilpuma vienībā ar augstumu izskatās kā parādīts attēlā. 1.7.
Patvaļīgam ārējam potenciāla laukam mēs rakstām šādu vispārīgu izteiksmi
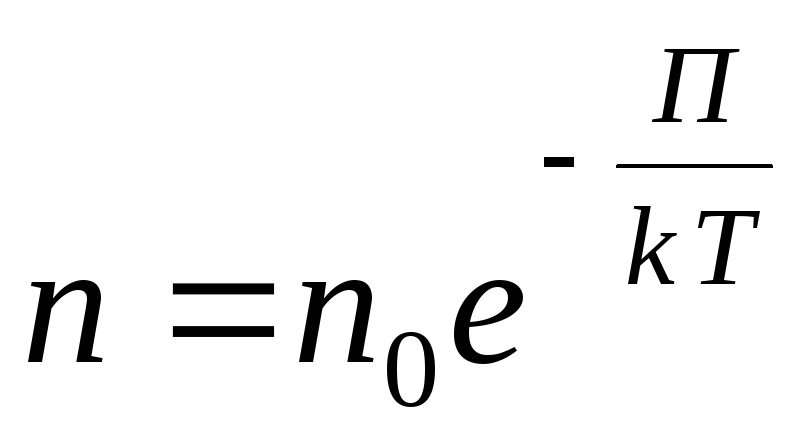 ,
,
