გაზის ნარევები. გაზების თბოტევადობა. საწვავი, გაზის ნარევები და სითბოს სიმძლავრე
1.3. მდგომარეობის იდეალური გაზის განტოლება
რეალური ნივთიერებების მდგომარეობის (1.1) განტოლების ფორმა საკმაოდ რთულია.
ამასთან დაკავშირებით, თერმოდინამიკაში გამოიყენება სამუშაო სხეულების გამარტივებული ფიზიკური მოდელები.
აირის მდგომარეობაში მოქმედი სითხეებისთვის ყველაზე მარტივი და ისტორიულად პირველი მოდელია იდეალური გაზი. იდეალური გაზი არის აირი, რომელშიც არ არის მოლეკულათაშორისი ურთიერთქმედების ძალები (მიზიდულობა და მოგერიება) და თავად მოლეკულები განიხილება როგორც მატერიალური ქულები. იდეალური გაზი ემორჩილება კლაიპერონის განტოლება– მენდელეევი
სადაც მარის გაზის მასა სისტემაში; μ არის გაზის მოლური მასა; რμ = 8314 J/(kmol K) არის უნივერსალური აირის მუდმივა, რომელიც არ არის დამოკიდებული გაზის ტიპზე ან მისი არსებობის პირობებზე. მდგომარეობის (1.2) განტოლება მიიღება კომბინაციით ბოილ-მარიოტის კანონებიდა გეი ლუსაკიიმის გათვალისწინებით ავოგადროს კანონი.
Მოლური მასა μ = მ/ნკგ/მოლი არის ნივთიერების მასა, რომელიც აღებულია ერთი მოლის ოდენობით. 1 მოლიარის ნივთიერების რაოდენობის ერთეული, რომელიც შეიცავს იმდენ ნაწილაკს, რამდენიც 12 გრამ ნახშირბადს. ნივთიერების რაოდენობა– n = N/N ა, მოლი, სად ნარის ნაწილაკების რაოდენობა (ატომები, მოლეკულები), ნ ა ≈ 6.02 10 23 - ატომების რაოდენობა 12 გრამ ნახშირბადში ( ავოგადროს ნომერი). რიცხობრივად μ = Мr 10-3, სადაც Mr არის ნივთიერების ფარდობითი მოლეკულური წონა ( ჩანართი. მენდელეევი) (მაგალითად: =2 კგ/კმოლ).
კონკრეტულად (ანუ 1 კგ გაზზე) განტოლებას (1.2) ექნება ფორმა
სადაც რ– სპეციფიკური აირის მუდმივი, J/(კგ K).
მოდით ავხსნათ კონკრეტული აირის მუდმივის ფიზიკური მნიშვნელობა რ. პირველი მდგომარეობის განტოლებისთვის (1.2) დაიწერება როგორც , მეორე მდგომარეობისთვის იმავე წნევის დროს - . გამოვაკლოთ პირველი განტოლება მეორე განტოლებას და იპოვნეთ, რომ ე.ი. სპეციფიკური აირის მუდმივი არის სამუშაო, რომელსაც ახორციელებს 1 კგ აირი, როდესაც ის თბება 1 გრადუსით მუდმივი წნევით.
ექსპერიმენტული მონაცემები აჩვენებს, რომ რეალური გაზი რაც უფრო ახლოს არის იდეალურთან, მით უფრო დაბალია მისი სიმკვრივე. სხვა სიტყვებით რომ ვთქვათ, გაზის მოცემული რაოდენობის მოცულობის შემცირებით, გამოწვეული წნევის მატებით ან ტემპერატურის შემცირებით, ნებისმიერი გაზი უფრო და უფრო მეტ გადახრებს მისცემს იდეალური გაზის თვისებებიდან. ამრიგად, "იდეალური გაზის" კონცეფციის ქვეშ ჯდება ყველა რეალური აირი მაღალ ტემპერატურაზე და დაბალ წნევაზე.
1.4. მიქსები იდეალური აირები
პრაქტიკაში, სამუშაო სითხე ხშირად არის ერთგვაროვანი აირების ნარევი (მაგალითად, ჰაერი), რომელთაგან თითოეული შეიძლება ჩაითვალოს იდეალურად და რომელიც არ შედის ქიმიური რეაქციები.
ასეთი ნარევი ასევე იდეალური აირია და ემორჩილება მდგომარეობის (1.2) განტოლებას ნარევისთვის
სადაც R=R μ / μ არის ნარევის აირის მუდმივი; μ არის ნარევის საშუალო (მოჩვენებითი) მოლური მასა(პირობითი მნიშვნელობა ეხება ერთგვაროვან წარმომადგენლობით გაზს, რომელშიც მოლეკულების რაოდენობა და მთლიანი მასა უდრის მოლეკულების რაოდენობას და ნარევის მასას).
ნარევის მასა უდრის ყველა შემადგენელი კომპონენტის მასას
მთავარი კანონი, რომელიც განსაზღვრავს აირის ნარევის ქცევას დალტონის კანონი:
ყოველი ცალკეული გაზი იქცევა აირის ნარევში ისე, თითქოს ის მარტო, ნარევის ტემპერატურაზე, იკავებს ნარევის მთელ მოცულობას.
თითოეულ ცალკეულ გაზს, რომელიც შედის აირის ნარევში, აქვს იგივე წნევა, რაც იქნებოდა, თუ ის მარტო დაიკავებდა აირის ნარევის მთელ მოცულობას.
აქედან გამომდინარეობს ღირებულება რ(აბსოლუტური ნარევის წნევა) განისაზღვრება, როგორც
სადაც რ მე – ნაწილობრივი წნევა მეე კომპონენტი, ე.ი. ზეწოლა რომ იქნებოდა მე th კომპონენტი, თუ ის მარტო იკავებდა ნარევის მთელ მოცულობას იმავე ტემპერატურაზე ().
ნარევის შემადგენლობა მოცემულია ნარევის შემადგენელი კომპონენტების მასური ან მოლური ფრაქციების, აგრეთვე მოცულობითი ფრაქციების (კონცენტრაციების) მიხედვით.
მასური წილიარის თითოეული აირის მასის თანაფარდობა ნარევის მთლიან მასასთან: .
განტოლება (1.3) გულისხმობს, რომ .
მოცულობითი ფრაქციათანაფარდობა ეწოდება ნაწილობრივი მოცულობა(მოცულობა, რომელსაც აირი დაიკავებს, თუ მისი წნევა და ტემპერატურა ტოლი იქნება აირის ნარევის წნევისა და ტემპერატურის, ე.ი.) აირის ნარევის მთლიანი მოცულობის: . ნაწილობრივი წნევის და მოცულობის და ტემპერატურის მუდმივობის განმარტებებიდან გამომდინარეობს:
![]() (1.5)
(1.5)
ნარევის ყველა კომპონენტზე ბოლო თანასწორობის შეჯამებით, ვიღებთ, ე.ი. გაზების ნაწილობრივი მოცულობების ჯამი, რომლებიც ქმნიან ნარევს, უდრის აირების ნარევის მოცულობას.
მოცულობითი წილადების ჯამი ერთის ტოლია: .
მოლური ფრაქციაკომპონენტს ეწოდება თითოეული აირის ნივთიერების რაოდენობის თანაფარდობა ნ მე აირების ნარევის ნივთიერების რაოდენობამდე ნ. ურთიერთობებიდან და და ავოგადროს კანონი(სხვადასხვა იდეალური აირების თანაბარ მოცულობაში ერთსა და იმავე ტემპერატურაზე და ერთსა და იმავე წნევაზე, მოლეკულების თანაბარი რაოდენობაა ჩასმული, ე.ი.) შემდეგნაირად:
იმათ. ნარევის მოლური ფრაქციების მითითება უდრის მისი მოცულობითი ფრაქციების მითითებას.
მასური და მოცულობითი წილადები დაკავშირებულია თანაფარდობით:
![]() .
.
თუ ნარევი მოცემულია მასის წილადებით გ მე, შემდეგ ნარევის აირის მუდმივი და ნარევის მოლური მასა გამოითვლება შემდეგნაირად:
![]()
![]()
თუ ნარევი მოცემულია მოცულობითი წილადებით რ მე, შემდეგ ნარევის მოლური მასის და ნარევის აირის მუდმივის გამოსათვლელი ფორმულები შემდეგია:
![]() (1.6)
(1.6)
გაზების ნაწილობრივი წნევა და მოცულობა განისაზღვრება იმით ბოილის კანონი–მარიოტი(გაზის მუდმივ ტემპერატურაზე, გაზის წნევის და მისი მოცულობის პროდუქტი არის მუდმივი მნიშვნელობა, ე.ი.):
![]() .
.
ტესტის კითხვები
ერთეულების საერთაშორისო სისტემა (SI) და მისი საბაზო ერთეულები.
ძირითადი თერმოდინამიკური პარამეტრები და მათი ზომები.
რას ნიშნავს თერმოდინამიკური სისტემის წონასწორობა?
წონასწორული და არაწონასწორული მდგომარეობების ცნება.
რა არის სისტემის მდგომარეობის განტოლება?
სისტემის მდგომარეობის გეომეტრიული ინტერპრეტაცია, თერმოდინამიკური პროცესი.
რა არის იდეალური გაზი? რა განსხვავებაა იდეალურ გაზსა და რეალურს შორის?
რა არის გაზის მუდმივი? მისი ფიზიკური მნიშვნელობა, განზომილება და განმარტების მეთოდები.
2. თბოტევადობა
სითბოს შეტყობინება სამუშაო სხეულს ნებისმიერ პროცესში იწვევს მისი მდგომარეობის ცვლილებას და, ზოგადად, თან ახლავს ტემპერატურის ცვლილებას. ტემპერატურის ცვლილება, ისევე როგორც სამუშაო სითხის მდგომარეობის ნებისმიერი სხვა პარამეტრი, არ არის დამოკიდებული პროცესის ტიპზე, მაგრამ დამოკიდებულია მის საწყისზე ( 1 ) და საბოლოო ( 2 ) აცხადებს, ე.ი. (ელემენტარული პროცესისთვის პარამეტრის ცვლილება იცვლება მისი დიფერენციალით).
სითბოს რაოდენობის შეფარდება δ ქეცნობა სხეულს სხეულის ტემპერატურის ცვლილებაზე dTელემენტარულ თერმოდინამიკურ პროცესს ე.წ ნამდვილი სითბოს სიმძლავრეორგანოები ამ პროცესში:
აბონენტი აქ მიუთითებს იმ ფაქტზე, რომ სითბოს სიმძლავრე, ისევე როგორც სითბო, დამოკიდებულია პროცესის ბუნებაზე. გარდა ამისა, სითბოს სიმძლავრე დამოკიდებულია სხეულის რაოდენობაზე და მის თერმოდინამიკურ მდგომარეობაზე. აქვე უნდა აღინიშნოს, რომ ამ პროცესში არ იცვლება ორგანიზმის ქიმიური შემადგენლობა, არ ხდება ნივთიერების გადასვლა აგრეგაციის ერთი მდგომარეობიდან მეორეზე, არ ხდება კომპონენტების დაშლა და ა.შ.
ნივთიერების რაოდენობის არჩეული ერთეულიდან გამომდინარე, განასხვავებენ მასის, მოცულობის და მოლური სპეციფიკური სითბოს სიმძლავრეებს:
მასობრივი სითბოს სიმძლავრის კონცეფცია ყველაზე ხშირად გამოიყენება პრაქტიკაში.
2.1. ნამდვილი და საშუალო სითბოს სიმძლავრე
რეალური ნივთიერების სითბოს სიმძლავრე არ არის მუდმივი მნიშვნელობა. ის იცვლება ტემპერატურასთან ერთად და ეს დამოკიდებულება შეიძლება იყოს ძალიან მნიშვნელოვანი (ნახ. 2.1).
პროცესის სითბოს სპეციფიკური რაოდენობა გამოითვლება ფორმულით
ამ მნიშვნელობის დასადგენად გამოიყენება შემდეგი მეთოდები:
ექსპერიმენტის შედეგების მიხედვით, სითბოს სიმძლავრის დამოკიდებულება ტემპერატურაზე წარმოდგენილია მიახლოებითი მრავალწევრის სახით.
სად არის მიახლოების კოეფიციენტები. ეს კოეფიციენტები მოცემულია საცნობარო ლიტერატურაში. მერე
ტემპერატურის დიაპაზონში პრაქტიკულ გამოთვლებში ტ 1 , ტ 2 სითბოს სიმძლავრე ითვლება მუდმივ მნიშვნელობად ტოლი
დაურეკა საშუალო სითბოს სიმძლავრეამ ინტერვალში, განსხვავებით ჭეშმარიტი სითბოს სიმძლავრისგან, რომელიც შემოღებულია (2.1). საცნობარო მონაცემები იძლევა საშუალო სითბოს სიმძლავრეებს 0-დან ფიქსირებულ ტემპერატურამდე ტმიღებული ემპირიულად, ე.ი.
საშუალო სითბოს სიმძლავრე ტემპერატურის დიაპაზონში ტ 1 , ტ 2 ამ საცნობარო მონაცემების მიხედვით შეიძლება გამოითვალოს ფორმულით
მერე კონკრეტული რაოდენობაპროცესის სითბო განისაზღვრება როგორც
2.2. იზოქორული და იზობარული სითბოს სიმძლავრეები
დიდი მნიშვნელობა აქვს თერმოდინამიკაში.
იზოქორიულისითბოს სიმძლავრე
უდრის პროცესში სითბოს რაოდენობის თანაფარდობას მუდმივ მოცულობაში სხეულის ტემპერატურის ცვლილებასთან,
იზობარულისითბოს სიმძლავრე
უდრის პროცესში სითბოს რაოდენობის თანაფარდობას მუდმივი წნევის დროს სხეულის ტემპერატურის ცვლილებასთან.
სითბოს ინჟინერიის გამოთვლებში გამოიყენება ცხრილები, სადაც ჩამოთვლილია სპეციფიკური იზობარული და იზოქორული სითბოს სიმძლავრის ექსპერიმენტულად მიღებული რიცხვითი მნიშვნელობები სხვადასხვა ნივთიერებებისთვის, ტემპერატურის მიხედვით.
2.3. გაზის ნარევების თბოტევადობა
გამოთვლებში ხშირად საჭიროა გაზების ნარევებთან გამკლავება, ხოლო თბოტევადობა ცხრილებში მოცემულია მხოლოდ ცალკეული გაზებისთვის.
თუ აირების ნარევი მოცემულია მასის წილადებით გ მე, მაშინ ნარევის სპეციფიკური მასის სითბოს სიმძლავრეები განისაზღვრება ფორმულებით
![]()
თუ აირების ნარევი მოცემულია მოცულობითი წილადებით რ მე, მაშინ ნარევის სპეციფიკური მოცულობითი სითბოს სიმძლავრეები განისაზღვრება ფორმულებით
![]()
ტესტის კითხვები
ჩამოწერეთ სპეციფიკური სითბოს სიმძლავრის ერთეულები.
როგორ დაინერგება საშუალო სითბოს სიმძლავრის კონცეფცია?
3. ენერგიის შენარჩუნებისა და ტრანსფორმაციის კანონი
ენერგიის ცნება დაკავშირებულია მატერიის მოძრაობასთან.
ენერგიას შეიძლება ჰქონდეს მრავალი ფორმა - მექანიკური სამუშაო, სითბო, ქიმიური ენერგია, ელექტრული და მაგნიტური ველების ენერგია.
თერმოდინამიკურ პროცესში გარემოსა და დახურული თერმოდინამიკური სისტემის ურთიერთქმედება ხორციელდება ენერგიის გაცვლით სითბოს და მექანიკური მუშაობის სახით.
3.1. შინაგანი ენერგია
ნებისმიერ გარემოს აქვს გარკვეული ზღვარი შინაგანი ენერგიაუ(J), რომელიც ტექნიკურ თერმოდინამიკაში წარმოდგენილია როგორც გარემოს მოლეკულების და ატომების კინეტიკური და პოტენციური ენერგიის ჯამი. ამ ნაწილაკების კინეტიკური ენერგია განისაზღვრება მათი სიჩქარითა და მასით, ხოლო პოტენციური ენერგია განისაზღვრება მათ შორის ურთიერთქმედების ძალებით, რომლებიც დამოკიდებულია მათ შედარებით მდებარეობაზე. სისტემის შიდა ენერგია არის ენერგია, რომელიც შეიცავს თავად სისტემაში. ეს ნიშნავს, რომ შინაგან ენერგიას შეუძლია ახასიათებდეს სხეულის მდგომარეობა რაოდენობასთან ერთად რ, ვ, თ.
შინაგან ენერგიას აქვს დამამატებლობის თვისება, ე.ი. რთული სისტემის შიდა ენერგია უდრის მისი შემადგენელი ნაწილების შიდა ენერგიების ჯამს:
1 კგ ნივთიერების შიდა ენერგია ე.წ სპეციფიკური შინაგანი ენერგია u= უ/ მ (ჯ/კგ).
თერმოდინამიკის ტექნიკური გამოყენების უმრავლესობისთვის მნიშვნელობა არ აქვს აბსოლუტურ მნიშვნელობას უდა ამ მნიშვნელობის ცვლილება. ამიტომ, ერთგვაროვანი სისტემის შიდა ენერგიის რაოდენობრივი განსაზღვრება ხშირად განისაზღვრება რომელიმე პირობითად არჩეული სტანდარტული მდგომარეობის მიმართ.
3.2. ენერგიის შენარჩუნების კანონი თერმოდინამიკაში
თერმოდინამიკური პროცესის შესრულებისას დახურული სისტემა ურთიერთქმედებს გარე გარემოსთან (გარე სხეულებთან და ველებთან), ე.ი. ცვლის ენერგიას. ტექნიკურ თერმოდინამიკაში განიხილება ენერგიის გადაცემის ორი ტიპი - სითბოს გადაცემით და მექანიკური სამუშაოების შესრულებით.
სითბოს გადაცემა ხდება სხვადასხვა ტემპერატურისა და კონტაქტში მოხვედრილ სხეულებს შორის, ან სხვადასხვა ტემპერატურის მქონე სხეულებს შორის, რომლებიც მდებარეობს მანძილზე, ელექტრომაგნიტური ტალღების საშუალებით ( თერმული გამოსხივება). მაუწყებლობა სითბოხდება მოლეკულურ (მიკროფიზიკურ) დონეზე სხეულების ხილული მოძრაობის გარეშე.
ენერგიის გადაცემა სამუშაოს სახით ხდება მთელი სხეულის ან მისი ნაწილის სივრცეში მოძრაობით. ამ მეთოდით სხეული ან მოძრაობს ძალის ველში, ან იცვლის მოცულობას გარე წნევის გავლენით. მუშაობაენერგიის გადაცემის მაკროფიზიკური ფორმაა.
უნდა აღინიშნოს, რომ სითბო და მუშაობა, სხეულის ენერგიისგან განსხვავებით, არ არის მისი მდგომარეობის ფუნქცია, არამედ დამოკიდებულია პროცესის ტიპზე, განსაზღვრავს ამ პროცესს, ე.ი. თავად პროცესის ფუნქციებია.
მრავალრიცხოვანმა ექსპერიმენტებმა და დაკვირვებებმა გამოიწვია ბუნების ფუნდამენტური კანონის - ენერგიის შენარჩუნების კანონის აღმოჩენა: ბუნებაში ენერგია არაფრისგან არ წარმოიქმნება და არ ქრება,ან ენერგიის რაოდენობა უცვლელია, ის მხოლოდ ერთი ფორმიდან მეორეში იცვლება,ან
სადაც ქარის სითბო ჩართული პროცესში; ლ- შესრულებული სამუშაო; Δ ეარის სისტემის ენერგიის ცვლილება. აქ და ქვემოთ, ჩვენ თანახმა ვართ განვიხილოთ:
მუშაობა დადებითითუ ეს სამუშაო შესრულებულია სამუშაო ორგანოს მიერ და უარყოფითითუ მუშაობა მიმდინარეობს სისტემის სამუშაო სხეულზე;
სხეულს მიეწოდება სითბო დადებითიდა გამოყოფილი - უარყოფითი
გარდა ამისა, ფინალურ პროცესში ნებისმიერი მდგომარეობის პარამეტრის ცვლილება აღინიშნა Δ სიმბოლოთი (დელტა), ხოლო ელემენტარულ პროცესში - დ(შესაბამისი პარამეტრის დიფერენციალი). ნებისმიერი სასრული თერმოდინამიკური პროცესისთვის მდგომარეობის პარამეტრის ცვლილება (წნევა, ტემპერატურა, შიდა ენერგია, ენთალპია, ენტროპია და ა.შ.) არ არის დამოკიდებული პროცესის ტიპზე, არამედ განისაზღვრება საწყისი და საბოლოო მდგომარეობებით.
ზოგადად, თერმოდინამიკურ სისტემას აქვს შიდა ენერგია უ, კინეტიკური ენერგია (თერმოდინამიკაში სისტემა განიხილება, როგორც მთელი სიჩქარით მოძრავი ვ) – მვტ 2/2, პოტენციალი - მგზ (ზარის სიმაღლე, რომელზეც სისტემა მდებარეობს). მთლიანი ენერგიის ცვლილება პროცესში 1 –2 შეიძლება წარმოვიდგინოთ როგორც:
ამ პროცესში შესრულებული სამუშაო არის სამუშაოს ჯამი ლდაახლოებით, დაკავშირებულია სისტემის სამუშაო სითხის მოცულობის ცვლილებასთან (დეფორმაციის სამუშაო), მუშაობა ლ dv სისტემის მოძრაობა სივრცეში, ტექნიკური სამუშაოებიისინი (სისტემის გადაადგილებისას სხვადასხვა ტექნიკურ მოწყობილობებში, მაგალითად, ძრავში, ორთქლის ქვაბში, კომპრესორში და ა.შ.), მუშაობენ ხახუნის ძალების წინააღმდეგ. ლ tr:
L \u003d L დაახლოებით + L dv + L იმ + L tr.
პროცესში ჩართული სითბო არის სითბოს ჯამი ქგარე, ჩართულია გაცვლაში გარე გარემოსთან და ხახუნის სიცხეში ქ tr:
ქ = ქგარე + ქტრ.
Იმის გათვალისწინებით, რომ ქ tr = ლ tr (ბევრმა ექსპერიმენტმა აჩვენა, რომ ხახუნის გადალახვაზე დახარჯული ნაკადის მუშაობა მთლიანად გარდაიქმნება ნაკადის მიერ აღქმულ სიცხეში), ენერგიის შენარჩუნების კანონი თერმოდინამიკაში 1 კგ მოქმედი ერთგვაროვანი ნივთიერებისთვის (ე.ი. მასის სპეციფიკურ მნიშვნელობებში). ) ელემენტარულ პროცესში შეიძლება დაიწეროს:
![]() , (3.1)
, (3.1)
(გარე ინდექსი გამოტოვებულია როგორც არასაჭირო).
ხაზგასმით უნდა აღინიშნოს, რომ (3.1)-ის მარჯვენა მხარეს დიფერენციალური ნიშნის ქვეშ არის მდგომარეობის ფუნქციები, ხოლო დანარჩენი არის სიდიდეები, რომლებიც დამოკიდებულია თერმოდინამიკური პროცესის ბუნებაზე. ვინაიდან მუშაობა და სითბო პროცესის ფუნქციებია და არა მდგომარეობის ფუნქციები, ნიშანი δ აღნიშნავს მხოლოდ იმ ფაქტს, რომ ელემენტარულ პროცესში მას შემდგომი რაოდენობები თვითნებური უსასრულო მცირეა და არა რაიმე კონკრეტული ფუნქციის ზრდა. ამრიგად, δ ქდა δ ლ- ელემენტარული (ანუ, სისტემის მდგომარეობის უსასრულო ცვლილებების შესაბამისი) სითბოს და სამუშაოს რაოდენობა.
თუ თერმოდინამიკური სისტემა არ ცვლის თავის პოზიციას სივრცეში და სამუშაოს ერთადერთი ტიპი არის სამუშაო, რომელიც დაკავშირებულია სისტემის მოცულობის ცვლილებასთან, მაშინ განტოლება (3.1) იღებს უფრო მარტივ ფორმას:
სამსახური δ ლშესახებ ხორციელდება ან გარე წნევის ძალების წინააღმდეგ და, შემდეგ, სამუშაო სითხის მოცულობა ფართოვდება, ან, პირიქით, გარე გარემო ახორციელებს მუშაობას სხეულზე, შეკუმშავს მას. წონასწორობის პროცესებისთვის, როდესაც საშუალო წნევა უდრის წნევას სამუშაო სითხეში, ეს სამუშაო გამოითვლება როგორც რdv, სად ვარის სამუშაო ნივთიერების სპეციფიკური მოცულობა.
განტოლება
დაურეკა თერმოდინამიკის პირველი კანონი: სითბო, რომელიც მიეწოდება დახურულ თერმოდინამიკურ სისტემას დასვენების დროს, იხარჯება სისტემის შიდა ენერგიის შეცვლაზე და სისტემის მოცულობის შესაცვლელად სამუშაოს შესრულებაზე.. ბალანსის მიმართებას (3.2) ასევე უწოდებენ ლექციებს onთეორიული ლიტერატურა. 1. ბაროკო: ...
L. A. Eliseeva © მეცნიერების ფედერალური სახელმწიფო საბიუჯეტო ინსტიტუტი რუსეთის მეცნიერებათა აკადემიის ციმბირის ფილიალის სახელმწიფო საჯარო სამეცნიერო და ტექნიკური ბიბლიოთეკა, 2013 წ.
პოინტერიშემთხვევითი სიარული / A.N. ბოროდინი, ი.ა.იბრაგიმოვი; ქვეშ... 241. დოროგოკუპეცი პ.ი. თერმოდინამიკამინერალები და მინერალური წონასწორობა ... კატალოგები: კომპენდიუმი ლექციები onკურსი „ცნობარი ... სახელმწიფო ტექნიკურიუნივერსიტეტი. სერია, ტექნიკურიმეცნიერება. -...
ნ.ვ.ბასოვა [და სხვები]; რედ. ნ.ვ.ბასოვა. Rostov N/a: Phoenix, 2008 წ
სახელმძღვანელოკურსი) დაწერილი D. T. სინოფსისი ლექციები onუმაღლესი მათემატიკა [ტექსტი]: ... ტექნიკური თერმოდინამიკა Rudobashta, S.P. სითბოს ინჟინერია [ტექსტი]: სახელმძღვანელო სტუდენტებისთვის. უნივერსიტეტები სწავლობენ on... 2008. - 204გვ. ათი ბოროდინი, I. F. ტექნოლოგიური პროცესების ავტომატიზაცია...
ხაზინის სამეცნიერო შრომების ნუსხა 2008 - 2013 წლის 1 ივნისი პერიოდისთვის (1)
დოკუმენტი... "რენტგენის კვლევის მეთოდები" ლექციები onკლინიკური ონკოლოგია. ალმათი... მეორე კანონის თერმოდინამიკა» 2-საერთაშორისო... და ექსპერტის მიმოხილვა ტექნიკურიჯანდაცვის ორგანიზაციების აღჭურვა ... რუსეთის სამედიცინო მეცნიერებათა აკადემიის აკადემიკოსი იუ.ი. ბოროდინი, ბიშკეკი, 2009, გვ. ...
საინჟინრო პრაქტიკაში ხშირად უწევთ საქმე არა ერთგვაროვან გაზებთან, არამედ ქიმიურად შეუსაბამო აირების ნარევებთან. აირის ნარევების მაგალითებია: ატმოსფერული ჰაერი, ბუნებრივი აირი, საწვავის წვის აირისებრი პროდუქტები და ა.შ.
გაზის ნარევებისთვის მოქმედებს შემდეგი დებულებები.
1. თითოეულ გაზს, რომელიც შედის ნარევში, აქვს ტემპერატურა, ტემპერატურის ტოლინარევები.
2. ნარევში შემავალი ნებისმიერი აირი ნაწილდება ნარევის მთელ მოცულობაში და შესაბამისად თითოეული გაზის მოცულობა უდრის მთლიანი ნარევის მოცულობას.
3. ნარევში შემავალი თითოეული აირი ემორჩილება მდგომარეობის საკუთარ განტოლებას.
4. ნარევი მთლიანობაში ჰგავს ახალ გაზს და ემორჩილება მდგომარეობის საკუთარ განტოლებას.
აირის ნარევების შესწავლა ეფუძნება დალტონის კანონს, რომლის მიხედვითაც, მუდმივ ტემპერატურაზე ნარევის წნევა უდრის ნარევში შემავალი გაზების ნაწილობრივი წნევის ჯამს:
სადაც p სმ არის ნარევის წნევა;
p i - ნარევში შემავალი i-ე აირის ნაწილობრივი წნევა;
n არის ნარევში შემავალი გაზების რაოდენობა.
ნაწილობრივი წნევა არის წნევა, რომელსაც აირი შეაღწევს ნარევში, თუ ის მარტო იკავებს ნარევის მთელ მოცულობას იმავე ტემპერატურაზე.
გაზის ნარევების დაყენების მეთოდები
გაზის ნარევის შემადგენლობა შეიძლება განისაზღვროს მასის, მოცულობის და მოლური ფრაქციების მიხედვით.
მასური წილადები. ნარევში შემავალი ნებისმიერი გაზის მასური წილი არის ამ გაზის მასის თანაფარდობა ნარევის მასასთან.
მ 1 \u003d M 1 / M სმ; მ 2 \u003d M 2 / M სმ; ..........; m n \u003d M n / M სმ,
სადაც m 1, m 2, ..., m n - აირების მასური ფრაქციები;
M 1 , M 2 , ..., M n - ცალკეული აირების მასები;
M სმ არის ნარევის მასა.
ამის დანახვა ადვილია  და
და  (100%).
(100%).
მოცულობის აქციები.ნარევში შემავალი ნებისმიერი გაზის მოცულობითი წილი არის ამ გაზის შემცირებული (ნაწილობრივი) მოცულობის თანაფარდობა ნარევის მოცულობასთან.
r 1 \u003d V 1 / V სმ; r 2 \u003d V 2 / V სმ; ........., r n = V n / V სმ;
სადაც V 1 , V 2 , ..., V n - აირების შემცირებული მოცულობები;
V სმ არის ნარევის მოცულობა;
r 1 , r 2 , ..., r n - აირების მოცულობითი ფრაქციები.
შემცირებული მოცულობა არის გაზის მოცულობა ნარევის პირობებში (ნარევის ტემპერატურასა და წნევაზე).
შემცირებული მოცულობა შეიძლება წარმოდგენილი იყოს შემდეგნაირად: თუ ერთის გარდა ყველა აირი ამოღებულია ნარევის შემცველი ჭურჭლიდან, ხოლო დარჩენილი აირი შეკუმშულია ნარევის წნევამდე ტემპერატურის შენარჩუნებისას, მაშინ მისი მოცულობა შემცირდება ან ნაწილობრივი.
შეიძლება დადასტურდეს, რომ ნარევის მოცულობა ტოლი იქნება აირების შემცირებული მოცულობების ჯამისა.
 (100%).
(100%).
მოლური ფრაქციები.ნარევში შემავალი ნებისმიერი გაზის მოლური წილი არის ამ აირის კილომოლების რაოდენობის თანაფარდობა ნარევის კილომოლებთან.
r 1 \u003d n 1 / n სმ; r 2 \u003d n 2 / n სმ; ........., r n \u003d n n / n სმ,
სადაც r 1 , r 2 , ..., r n - აირების მოლური ფრაქციები;
n სმ არის ნარევის კილომოლების რაოდენობა;
n 1 , n 2 , ..., n n არის გაზების კილომოლი რაოდენობა.
მოლური ფრაქციების მიხედვით ნარევის დაზუსტება იდენტურია ნარევის მოცულობითი ფრაქციების მიხედვით, ე.ი. მოლარულ და მოცულობით ფრაქციებს აქვთ იგივე რიცხვითი მნიშვნელობები ნარევიში შემავალი თითოეული გაზისთვის.
აირის მუდმივი და ნაზავის აშკარა (საშუალო) მოლეკულური წონა.მასის წილადებით მოცემული აირის ნარევის მუდმივის გამოსათვლელად, ჩვენ ვწერთ მდგომარეობის განტოლებებს:
ნარევისთვის
p სმ × V სმ = M სმ R სმ T; (1.9)
გაზებისთვის
 .
(1.10)
.
(1.10)
ჩვენ ვაჯამებთ განტოლებების მარცხენა და მარჯვენა ნაწილებს (1.10)
(p 1 + p 2 + .... + p n) V სმ = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
იმიტომ რომ  ,
,
შემდეგ p სმ V სმ = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
განტოლებები (1.9) და (1.11) გულისხმობს იმას
M სმ R სმ T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R სმ \u003d M 1 / M სმ R 1 + M 2 / M სმ R 2 + ...... + M n / M სმ R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
ან  ,
(1.12)
,
(1.12)
სადაც R სმ არის ნარევის აირის მუდმივი.
ვინაიდან i-ე აირის გაზის მუდმივია
R i = 8314 / მ i,
შემდეგ განტოლება (1.12) გადაიწერება შემდეგნაირად:
 .
(1.13)
.
(1.13)
აირის ნარევის პარამეტრების განსაზღვრისას მოსახერხებელია გამოვიყენოთ გარკვეული პირობითი მნიშვნელობა, რომელსაც ეწოდება აირის ნარევის აშკარა (საშუალო) მოლეკულური წონა. ნარევის აშკარა მოლეკულური წონის კონცეფცია საშუალებას გვაძლევს პირობითად განვიხილოთ ნარევი, როგორც ერთგვაროვანი აირი, რაც მნიშვნელოვნად ამარტივებს გამოთვლებს.
ცალკე გაზის გამოთქმა
ანალოგიით, ნარევისთვის შეგვიძლია დავწეროთ
მ სმ R სმ = 8314, (1.14)
სადაც m სმ არის ნარევის აშკარა მოლეკულური წონა.
განტოლებიდან (1.14) გამონათქვამების (1.12) და (1.13) გამოყენებით ვიღებთ
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
ამ გზით მსჯელობისას შეიძლება მივიღოთ Rcm და mcm მოცულობითი წილადების გამოთვლის ფორმულები, მასური წილადების მოცულობით წილადად გადაქცევის ფორმულები და, პირიქით, მოცულობითი წილადების მასის წილადებად გადაქცევის ფორმულები, ფორმულები ucm ნარევის სპეციფიკური მოცულობის გამოსათვლელად და ნარევის სიმკვრივე r სმ მასის და მოცულობითი ფრაქციების მეშვეობით და ბოლოს, ნარევში შემავალი გაზების ნაწილობრივი წნევის გამოსათვლელი ფორმულები მოცულობითი და მასური წილადების მეშვეობით. ამ ფორმულებს წარმოქმნის გარეშე წარმოგიდგენთ ცხრილში.
გაზის ნარევების გამოთვლის ფორმულები
|
ნარევის შემადგენლობის დაყენება |
ერთი კომპოზიციიდან მეორეზე გადატანა |
ნარევის სიმკვრივე და სპეციფიკური მოცულობა |
ნარევის აშკარა მოლეკულური წონა |
გაზის ნარევი მუდმივი |
ნაწილობრივი წნევა |
|
მასური წილადები |
|
|
|
|
|
|
მოცულობითი წილადები |
|
|
|
|
|
გაზების თბოტევადობა
სხეულის სითბოს სიმძლავრე არის სითბოს რაოდენობა, რომელიც საჭიროა სხეულის გასათბობად ან გაგრილებისთვის 1 კ-ით. ნივთიერების ერთეულის თბოტევადობას ეწოდება სპეციფიკური სითბოს სიმძლავრე.
ამრიგად, ნივთიერების სპეციფიკური სითბოს მოცულობა არის სითბოს რაოდენობა, რომელიც უნდა იყოს მოხსენებული ან გამოკლებული ნივთიერების ერთეულს, რათა შეიცვალოს მისი ტემპერატურა 1 K-ით ამ პროცესში.
ვინაიდან მხოლოდ სპეციფიკური სითბოს სიმძლავრეები განიხილება შემდეგში, ჩვენ მივმართავთ სპეციფიკურ სითბოს სიმძლავრეს უბრალოდ სითბოს სიმძლავრეს.
გაზის რაოდენობა შეიძლება გამოითვალოს მასით, მოცულობით და კილომოლების რაოდენობით. გასათვალისწინებელია, რომ გაზის მოცულობის დაყენებისას ეს მოცულობა მიყვანილია ნორმალურ პირობებში და იზომება ნორმალურ კუბურ მეტრში (ნმ 3).
გაზის რაოდენობის დადგენის მეთოდიდან გამომდინარე, გამოირჩევა შემდეგი სითბოს სიმძლავრეები:
გ - მასის სითბოს მოცულობა, J / (კგ × K);
c¢ - მოცულობითი სითბოს სიმძლავრე, J / (ნმ 3 × K);
c m - მოლური სითბოს სიმძლავრე, J / (kmol × K).
ამ სითბოს სიმძლავრეებს შორის არის შემდეგი ურთიერთობები:
c = c m / m; m-ით = × m-ით;
с¢ = с მ / 22,4; m = s¢ × 22.4-ით,
აქედან  ; s¢ = s × r n,
; s¢ = s × r n,
სადაც u n და r n - სპეციფიკური მოცულობა და სიმკვრივე ნორმალურ პირობებში.
იზოქორული და იზობარული სითბოს სიმძლავრეები
სამუშაო სითხეზე გადაცემული სითბოს რაოდენობა დამოკიდებულია თერმოდინამიკური პროცესის მახასიათებლებზე. თერმოდინამიკური პროცესიდან გამომდინარე პრაქტიკული მნიშვნელობისაა ორი ტიპის სითბოს სიმძლავრე: იზოქორული და იზობარული.
სითბოს სიმძლავრე u = const-ზე არის იზოქორული.
c u - მასის იზოქორული სითბოს სიმძლავრე,
გ¢ uარის მოცულობითი იზოქორული სითბოს სიმძლავრე,
სმ uარის მოლარული იზოქორული სითბოს სიმძლავრე.
სითბოს სიმძლავრე p = const-ზე არის იზობარი.
cp - მასის იზობარული სითბოს სიმძლავრე,
c¢ р - მოცულობითი იზობარული სითბოს სიმძლავრე,
c m p - მოლური იზობარული სითბოს სიმძლავრე.
ტემპერატურის იგივე ცვლილებისას p = const-ზე განხორციელებულ პროცესში, უფრო მეტი სითბო იხარჯება, ვიდრე პროცესში u = const. ეს აიხსნება იმით, რომ u = const სხეულზე გადაცემული სითბო იხარჯება მხოლოდ მისი შინაგანი ენერგიის შეცვლაზე, ხოლო p = const დროს სითბო იხარჯება როგორც შინაგანი ენერგიის გაზრდაზე, ასევე გაფართოების სამუშაოზე. განსხვავება მასის იზობარულ და მასის იზოქორიულ სითბოს სიმძლავრეებს შორის მაიერის განტოლების მიხედვით
c p - გ u=რ. (1.17)
თუ (1.17) განტოლების მარცხენა და მარჯვენა მხარეები გამრავლებულია m კილომოლ მასაზე, მაშინ მივიღებთ
c m p - c m u= 8314 J/(kmol×K) (1.18)
თერმოდინამიკაში და მის გამოყენებაში დიდი მნიშვნელობა აქვს იზობარული და იზოქორული სითბოს სიმძლავრის თანაფარდობას:
 ,
(1.19)
,
(1.19)
სადაც k არის ადიაბატური მაჩვენებელი.
გამოთვლები აჩვენებს, რომ ერთატომური აირებისთვის k » 1.67, დიატომური აირებისთვის k » 1.4 და ტრიატომური აირებისთვის k » 1.29.
ადვილი მისახვედრია, რომ ღირებულება რომტემპერატურაზე დამოკიდებული. მართლაც, (1.17) და (1.19) განტოლებიდან გამომდინარეობს, რომ
 ,
(1.20)
,
(1.20)
და განტოლებიდან (1.18) და (1.19)
 .
(1.21)
.
(1.21)
ვინაიდან სითბოს სიმძლავრეები იზრდება გაზის ტემპერატურის მატებასთან ერთად, k-ის მნიშვნელობა მცირდება, უახლოვდება ერთიანობას, მაგრამ ყოველთვის რჩება მასზე დიდი.
k-ის მნიშვნელობის ცოდნა, შეიძლება განისაზღვროს შესაბამისი სითბოს სიმძლავრის მნიშვნელობა. ასე, მაგალითად, განტოლებიდან (1.20) გვაქვს
 ,
(1.22)
,
(1.22)
და მას შემდეგ p = k × s-ით u, შემდეგ მივიღებთ
 .
(1.23)
.
(1.23)
ანალოგიურად, მოლური სითბოს სიმძლავრეებისთვის, განტოლებიდან (1.21) ვიღებთ
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
საშუალო და ნამდვილი სითბოს სიმძლავრე
აირების სითბოს სიმძლავრე დამოკიდებულია ტემპერატურაზე და გარკვეულწილად წნევაზე. სითბოს სიმძლავრის დამოკიდებულება წნევაზე მცირეა და უგულებელყოფილია უმეტეს გამოთვლებში. სითბოს სიმძლავრის დამოკიდებულება ტემპერატურაზე მნიშვნელოვანია და გასათვალისწინებელია. ეს დამოკიდებულება საკმაოდ ზუსტად არის გამოხატული განტოლებით
c = a + in t + et 2, (1.26)
სადაც ა, inდა e არის მნიშვნელობები, რომლებიც მუდმივია მოცემული გაზისთვის.
ხშირად თერმული ინჟინერიის გამოთვლებში, არაწრფივი დამოკიდებულება (1.26) იცვლება წრფივით:
c = a + inტ. (1.27)
|
თუ გრაფიკულად ავაშენებთ სითბოს სიმძლავრის დამოკიდებულებას ტემპერატურაზე (1.26) განტოლების მიხედვით, მაშინ ეს იქნება მრუდი დამოკიდებულება (ნახ. 1.4). როგორც ნახატზეა ნაჩვენები, თითოეულ ტემპერატურულ მნიშვნელობას აქვს საკუთარი სითბოს სიმძლავრის მნიშვნელობა, რომელსაც ჩვეულებრივ უწოდებენ ნამდვილ სითბოს სიმძლავრეს. მათემატიკურად, ჭეშმარიტი სითბოს სიმძლავრის გამოხატულება იწერება შემდეგნაირად:
|
|
|
|
მაშასადამე, ჭეშმარიტი თბოტევადობა არის სითბოს უსასრულო რაოდენობის dq თანაფარდობა ტემპერატურის უსასრულოდ მცირე ცვლილებასთან dt. სხვა სიტყვებით რომ ვთქვათ, ჭეშმარიტი სითბოს სიმძლავრე არის გაზის სითბოს მოცულობა მოცემულ ტემპერატურაზე. ნახ. 1.4, ჭეშმარიტი სითბოს სიმძლავრე t 1 ტემპერატურაზე მითითებულია t1-ით და გამოსახულია როგორც სეგმენტი 1-4, t 2 ტემპერატურაზე - t2-ით და გამოსახულია როგორც სეგმენტი 2-3. განტოლებიდან (1.28) ვიღებთ dq=cdt. (1.29) პრაქტიკულ გამოთვლებში ჩვენ ყოველთვის განვსაზღვრავთ სითბოს რაოდენობა საბოლოო ცვლილებაზე |
ტემპერატურა. აშკარაა, რომ q სითბოს რაოდენობა, რომელიც იტყობინება ნივთიერების ერთეულ რაოდენობას, როდესაც ის გაცხელებულია t 1-დან t 2-მდე, შეიძლება ვიპოვოთ (1.29) t 1-დან t2-მდე ინტეგრაციით.
 .
(1.30)
.
(1.30)
გრაფიკულად, ინტეგრალი (1.30) გამოიხატება 4-1-2-3 ფართობით. თუ გამოსახულებაში (1.30) ჩავანაცვლებთ ჭეშმარიტი სითბოს სიმძლავრის მნიშვნელობას წრფივი დამოკიდებულების მიხედვით (1.27), მაშინ მივიღებთ
 (1.31)
(1.31)
სადაც  - საშუალო სითბოს სიმძლავრე ტემპერატურის დიაპაზონში t 1-დან t 2-მდე.
- საშუალო სითბოს სიმძლავრე ტემპერატურის დიაპაზონში t 1-დან t 2-მდე.
 ,
(1.32)
,
(1.32)
ამრიგად, საშუალო სითბოს სიმძლავრე არის q სითბოს საბოლოო რაოდენობის თანაფარდობა საბოლოო ტემპერატურის ცვლილებასთან t 2 - t 1:
 .
(1.33)
.
(1.33)
თუ 4-3-ის საფუძველზე (ნახ. 1.4) აგებულია მართკუთხედი 4-1¢-2¢-3, ზომით ტოლი ფიგურა 4-1-2-3, მაშინ ამ მართკუთხედის სიმაღლე იქნება იყოს საშუალო სითბოს სიმძლავრის ტოლი, სადაც  არის t 1 - t 2 ტემპერატურის დიაპაზონში.
არის t 1 - t 2 ტემპერატურის დიაპაზონში.
ჩვეულებრივ, საშუალო სითბოს სიმძლავრის მნიშვნელობები მოცემულია ნივთიერებების თერმოდინამიკური თვისებების ცხრილებში. ამასთან, ამ ცხრილების მოცულობის შესამცირებლად, ისინი უზრუნველყოფენ საშუალო სითბოს სიმძლავრის მნიშვნელობებს, რომლებიც განისაზღვრება ტემპერატურის დიაპაზონში 0 ° C-დან t ° C-მდე.
თუ საჭიროა საშუალო სითბოს სიმძლავრის მნიშვნელობის გამოთვლა მოცემული ტემპერატურის დიაპაზონში t 1 - t 2, მაშინ ეს შეიძლება გაკეთდეს შემდეგნაირად.
ფართობი 0a14 მრუდის ქვეშ c \u003d f (t) (ნახ. 1.4) შეესაბამება სითბოს რაოდენობას q 1, რომელიც აუცილებელია გაზის ტემპერატურის 0 ° C-დან t 1 ° C-მდე გასაზრდელად.

ანალოგიურად, ფართობი 0a23 შეესაბამება q 2-ს, როდესაც ტემპერატურა იზრდება 0 o C-დან t 2 o C-მდე:

ამრიგად, q \u003d q 2 - q 1 (ფართი 4123) შეიძლება წარმოდგენილი იყოს როგორც
![]() (1.34)
(1.34)
q მნიშვნელობის (1.34) მიხედვით (1.33) ჩანაცვლებით, ჩვენ ვიღებთ ფორმულას საშუალო სითბოს სიმძლავრის ნებისმიერ ტემპერატურულ დიაპაზონში:
 .
(1.35)
.
(1.35)
ამრიგად, საშუალო სითბოს სიმძლავრე შეიძლება გამოითვალოს ცხრილის საშუალო სითბოს სიმძლავრეებიდან (1.35) განტოლების გამოყენებით. უფრო მეტიც, ვიღებთ არაწრფივ დამოკიდებულებას c = f(t). თქვენ ასევე შეგიძლიათ იპოვოთ საშუალო სითბოს სიმძლავრე განტოლების (1.32) გამოყენებით წრფივი ურთიერთობის გამოყენებით. ღირებულებები ა და inგანტოლებაში (1.32) სხვადასხვა აირები მოცემულია ლიტერატურაში.
მიწოდებული ან ამოღებული სითბოს რაოდენობა სამუშაო სითხიდან შეიძლება გამოითვალოს ნებისმიერი განტოლების გამოყენებით:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
სადაც 

 - შესაბამისად საშუალო მასა, მოცულობა და მოლური სითბოს სიმძლავრე; M არის გაზის მასა; n არის კილომოლების გაზის რაოდენობა; V n - გაზის მოცულობა ნორმალურ პირობებში.
- შესაბამისად საშუალო მასა, მოცულობა და მოლური სითბოს სიმძლავრე; M არის გაზის მასა; n არის კილომოლების გაზის რაოდენობა; V n - გაზის მოცულობა ნორმალურ პირობებში.
გაზის V n მოცულობა შეგიძლიათ იხილოთ შემდეგნაირად. როდესაც დავწერეთ მდგომარეობის განტოლება მოცემული პირობებისთვის: pV = MRT და ნორმალური პირობებისთვის: p n V n = MRT n, მეორე განტოლებას მივაწერთ პირველს:
 ,
,
აქედან  .
(1.39)
.
(1.39)
გაზის ნარევების თბოტევადობა
აირის ნარევის სითბოს სიმძლავრე შეიძლება გამოითვალოს, თუ ნარევის შემადგენლობაა მოცემული და ცნობილია ნარევში შემავალი კომპონენტების სითბოს სიმძლავრე.
M სმ მასის ნარევი 1 კ-ით გასათბობად, თითოეული კომპონენტის ტემპერატურა ასევე უნდა გაიზარდოს 1 კ-ით. ამავდროულად, c i M i ტოლი სითბოს რაოდენობა იხარჯება ნარევის i-ე კომპონენტის М i მასით გაცხელებაზე. მთელი ნარევისთვის, სითბოს რაოდენობა  ,
,
სადაც c i და c სმ არის i-ე კომპონენტის და ნარევის მასის სითბოს სიმძლავრეები.
ბოლო გამოხატვის M სმ-ზე გაყოფით, ვიღებთ ნარევის მასის სითბოს სიმძლავრის გამოთვლის ფორმულას:
 ,
(1.40)
,
(1.40)
სადაც m i არის i-ე კომპონენტის მასური წილი.
ანალოგიურად მსჯელობით, ჩვენ ვპოულობთ ნარევის მოცულობითი სითბოს სიმძლავრეს c¢ სმ და მოლური სითბოს სიმძლავრეს c m cm:
 (1.41)
(1.41)
სადაც c¢ i - i-ე კომპონენტის მოცულობითი სითბოს მოცულობა, r i - i-ე კომპონენტის მოცულობითი წილი,
 ,
(1.42)
,
(1.42)
სადაც c m i არის i-ე კომპონენტის მოლური სითბოს სიმძლავრე,
r i - i-ე კომპონენტის მოლური (მოცულობითი) ფრაქცია.
სითბოს ძრავებში (მანქანებში) სამუშაო სითხე არის სხვადასხვა გაზების ნარევი. თუ ნარევის კომპონენტები არ შედიან ქიმიურ რეაქციებში ერთმანეთთან და თითოეული კომპონენტი ემორჩილება კლაიპერონის მდგომარეობის განტოლებას, მაშინ ასეთი ნარევი განიხილება, როგორც იდეალური აირი.
ნარევის გამოსათვლელად საჭიროა განვსაზღვროთ μ cm - საშუალო მოლური მასა და Rc m - ნარევის სპეციფიკური აირის მუდმივი. მათი დასადგენად საჭიროა ვიცოდეთ ნარევის შემადგენლობა, ანუ რომელი კომპონენტები და რა რაოდენობით ქმნიან ამ ნარევს, რა პარამეტრები აქვს ნარევში შემავალ თითოეულ კომპონენტს.
ნარევის თითოეული კომპონენტი იქცევა ისე, თითქოს ნარევში სხვა აირები არ იყოს, იკავებს მთელ ხელმისაწვდომ მოცულობას, რომელშიც ნარევი მდებარეობს, მიჰყვება მდგომარეობის საკუთარ განტოლებას და ახორციელებს თავის ეგრეთ წოდებულ ნაწილობრივ წნევას კედლებზე, ხოლო ტემპერატურა ნარევის ყველა კომპონენტი ერთნაირია და ნარევის ტემპერატურის ტოლია.
დალტონის კანონის მიხედვით, P ნარევის წნევა ტოლია ნარევიში შემავალი ცალკეული კომპონენტების ნაწილობრივი წნევის ჯამის:
სადაც n არის ნარევი კომპონენტების რაოდენობა.
ამაგის კანონის მიხედვით - V ნარევის მოცულობა უდრის ნარევიში შემავალი ცალკეული კომპონენტების ნაწილობრივი მოცულობების ჯამს ტემპერატურისა და ნარევის წნევის ქვეშ:
 , (1.21)
, (1.21)
სადაც - ნაწილობრივი მოცულობა, მ 3; V- ნარევის მოცულობა, მ 3
ნარევის შემადგენლობა მოცემულია მოცულობითი (მოლარული) ან მასობრივი ფრაქციების მიხედვით.
i-ე კომპონენტის მოცულობითი წილიარის კომპონენტის ნაწილობრივი მოცულობის შეფარდება ნარევის მოცულობასთან, ანუ, მაშინ ნარევის კომპონენტების მოცულობითი ფრაქციების ჯამი არის 1, ე.ი. თუ მნიშვნელობა მოცემულია %-ში, მაშინ მათი ჯამი = 100%.
i-ე კომპონენტის მოლური წილი n iარის N i კომპონენტის კილომოლების რაოდენობის თანაფარდობა N ნარევის კილომოლების რაოდენობასთან, ე.ი. ![]() , , ანუ თითოეული კომპონენტის და მთლიანი ნარევის კილომოლების რაოდენობა უდრის შესაბამისი კომპონენტის და მთლიანი ნარევის თანაფარდობას ერთი კილომოლით დაკავებულ მოცულობასთან.
, , ანუ თითოეული კომპონენტის და მთლიანი ნარევის კილომოლების რაოდენობა უდრის შესაბამისი კომპონენტის და მთლიანი ნარევის თანაფარდობას ერთი კილომოლით დაკავებულ მოცულობასთან.
თუ გავითვალისწინებთ, რომ იდეალურ გაზს ერთსა და იმავე პირობებში აქვს კილომოლის იგივე მოცულობა, მაშინ ჩანაცვლების შემდეგ მივიღებთ: ანუ იდეალური აირებისთვის მოლარული და მოცულობითი წილადები რიცხობრივად ტოლია.
i-ე კომპონენტის მასური წილიარის კომპონენტის მასის შეფარდება ნარევის მასასთან: , აქედან გამომდინარეობს, რომ ნარევის მასა უდრის კომპონენტების მასების ჯამს და ასევე კომპონენტების მასური წილადების ჯამი ტოლია 1-მდე (ან 100%).
მოცულობითი წილადების გადაქცევა მასურ წილადებად და პირიქით, ეფუძნება შემდეგ თანაფარდობებს:
![]() ,
,
სადაც ρ = μ / 22.4, კგ / მ 3.
აქედან გამომდინარეობს, რომ i-ე კომპონენტის მასური წილი გამოითვლება მიმართებიდან:
 ,
,
სადაც არის ნარევის სიმკვრივე, კგ / მ 3, არის i-ე კომპონენტის მოცულობითი ფრაქცია.
მომავალში მისი დადგენა შესაძლებელია მოცულობითი წილადების საშუალებით.
 .
.
სიმჭიდროვენარევები მოცულობითი ფრაქციებისთვის განისაზღვრება თანაფარდობით
 , სად
, სად  , (1.22)
, (1.22)
 .
.
ნაწილობრივი წნევა განისაზღვრება ფორმულებით:
![]() ან
ან  (1.23)
(1.23)
კომპონენტებისა და მთლიანი ნარევის მდგომარეობის განტოლებებს აქვს ფორმა:
![]() ;
;
![]() ,
,
საიდანაც, გარდაქმნების შემდეგ, ვიღებთ ამისთვის მასიურიაქციები
 ,
,  . (1.24)
. (1.24)
ნარევის სიმკვრივე და სპეციფიკური მოცულობა მასიურიგააზიარე:
;  . (1.25)
. (1.25)
ნაწილობრივი წნევის გამოსათვლელად გამოიყენება ფორმულა:
 . (1.26)
. (1.26)
მასობრივი ფრაქციების მოცულობით წილადებად გადაქცევა ხორციელდება ფორმულის მიხედვით:
 .
.
აირების ნარევის სითბური სიმძლავრის განსაზღვრისას, ვარაუდობენ, რომ გაზის ნარევის გასათბობად (გაცივებისთვის) საჭიროა ნარევის თითოეული კომპონენტის გაცხელება (გაგრილება).
სადაც Q i =M i c i ∆t არის ნარევის i-ე კომპონენტის ტემპერატურის შეცვლაზე დახარჯული სითბო, c i არის ნარევის i-ე კომპონენტის მასის თბოტევადობა.
ნარევის სითბოს სიმძლავრე განისაზღვრება თანაფარდობით (თუ ნარევი მოცემულია მასის წილადებით)
 , ანალოგიურად
, ანალოგიურად  . (1.28)
. (1.28)
მოცულობითი ფრაქციების მიხედვით მოცემული ნარევის მოლური და მოცულობითი სითბოს სიმძლავრე განისაზღვრება
 ;
;  ;
;
 ;
; 
მაგალითი 1.5მშრალი ჰაერი მასის მიხედვით შედგება g O2 \u003d 23,3% ჟანგბადისა და g N 2 \u003d 76,6% აზოტისგან. განსაზღვრეთ ჰაერის შემადგენლობა მოცულობით (r O2 და r N 2) და ნარევის აირის მუდმივი.
გამოსავალი.
1. ცხრილიდან 1 ვხვდებით კგ/კმოლ და კგ/კმოლ
2. განსაზღვრეთ ჟანგბადისა და აზოტის მოცულობითი ფრაქციები:
1. ჰაერის (ნარევის) გაზის მუდმივი განისაზღვრება ფორმულით:
 , ჯ/კგ კ
, ჯ/კგ კ
მაგალითი 1.6. განსაზღვრეთ სითბოს რაოდენობა, რომელიც საჭიროა M = 2 კგ მასის მქონე აირის ნარევის გასათბობად P = const-ზე, რომელიც შედგება % წონის მიხედვით: ° C.
გამოსავალი:
1. განსაზღვრეთ კომპონენტების საშუალო მასის თბოტევადობა, რომლებიც ქმნიან აირის ნარევს P=const და t 1 =900 o C (P2-დან):
1.0258 კჯ/კგ კ; =1,1045 კჯ/კგ K;
1.1078 კჯ/კგ K; =2,1097 კჯ/კგ K;
2. განვსაზღვრავთ კომპონენტების საშუალო მასის თბოტევადობას, რომლებიც ქმნიან აირის ნარევს P=const და t 1 =1200 o C (P2-დან):
1.0509 კჯ/კგ კ; =1,153 კჯ/კგ K;
1.1359 კჯ/კგ K; =2.2106 კჯ/კგ K;
3. ჩვენ განვსაზღვრავთ ნარევის საშუალო მასის სითბოს სიმძლავრეს ტემპერატურის დიაპაზონისთვის: t 2 \u003d 1200 ° C და t 1 \u003d 900 ° C:
4. სითბოს რაოდენობა 2 კგ ნარევის გასათბობად P=const:
თერმოდინამიკის პირველი კანონიადგენს რაოდენობრივ კავშირს სისტემის შიდა ენერგიის ცვლილებასა და სამუშაო სითხეში სითბოს მიწოდების შედეგად გარემოს გარე წნევის ძალებთან შესრულებულ მექანიკურ სამუშაოს შორის.
დახურული თერმოდინამიკური სისტემისთვის პირველი კანონის განტოლებას აქვს ფორმა
სამუშაო სითხეზე (ან სისტემაზე) გადაცემული სითბო გამოიყენება მისი შინაგანი ენერგიის (dU) გასაზრდელად სხეულის ტემპერატურის ზრდის გამო და გარე სამუშაოს შესასრულებლად (dL) სამუშაო სითხის გაფართოებისა და მისი გაზრდის გამო. მოცულობა.
პირველი კანონი შეიძლება დაიწეროს როგორც dH=dq+VdP=dq-dL 0,
სადაც dL 0 \u003d VdP - წნევის ცვლილების ელემენტარული სამუშაო ეწოდება სასარგებლო გარე (ტექნიკური) სამუშაოს.
dU არის სამუშაო სითხის (სისტემის) შიდა ენერგიის ცვლილება, რომელიც მოიცავს მოლეკულების თერმული მოძრაობის ენერგიას (მთარგმნელობითი, ბრუნვითი და ვიბრაციული) და მოლეკულების ურთიერთქმედების პოტენციურ ენერგიას.
ვინაიდან სისტემის გადასვლა ერთი მდგომარეობიდან მეორეზე ხდება სითბოს მიწოდების შედეგად, შესაბამისად, სამუშაო სითხე თბება და მისი ტემპერატურა იზრდება dT-ით, ხოლო მოცულობა იზრდება dV-ით.
სხეულის ტემპერატურის მატება იწვევს მისი ნაწილაკების კინეტიკური ენერგიის ზრდას, ხოლო სხეულის მოცულობის ზრდა იწვევს ნაწილაკების პოტენციური ენერგიის ცვლილებას. შედეგად, სხეულის შინაგანი ენერგია იზრდება dU-ით, ამიტომ შინაგანი ენერგია U არის სხეულის მდგომარეობის ფუნქცია და შეიძლება წარმოდგენილი იყოს ორი დამოუკიდებელი პარამეტრის U=f 1 (P,V) ფუნქციად; U=f 2 (P,T), U=f 3 (υ,T). შიდა ენერგიის ცვლილება თერმოდინამიკურ პროცესში განისაზღვრება მხოლოდ საწყისი (U 1) და საბოლოო (U 2) მდგომარეობებით, ე.ი.
დიფერენციალური ფორმით იწერება შინაგანი ენერგიის ცვლილება
ა) სპეციფიკური მოცულობის და ტემპერატურის ფუნქციით

ბ) ტემპერატურის ფუნქციით, ვინაიდან , მაშინ
პრაქტიკული გამოთვლებისთვის, რომლებშიც აუცილებელია გავითვალისწინოთ C v-ის ცვლილება ტემპერატურასთან, არსებობს სპეციფიკური შიდა ენერგიის (ხშირად მოლარული) ემპირიული ფორმულები და ცხრილები. იდეალური აირებისთვის U m ნარევის მოლური შიდა ენერგია განისაზღვრება ფორმულით
 , ჯ/კმოლ
, ჯ/კმოლ
მასის წილადებით მოცემული ნარევისთვის. Ამგვარად შინაგანი ენერგიაიქ არის სისტემის თვისება და ახასიათებს სისტემის მდგომარეობას.
ენთალპიაარის თერმული მდგომარეობის ფუნქცია, რომელიც შემოიღო Kamerling-Onnes-მა, (გამარჯვებული ნობელის პრემია, 1913), რომელიც არის U სისტემის შიდა ენერგიის ჯამი და P სისტემის წნევის და მისი V მოცულობის ნამრავლი.
ვინაიდან მასში შემავალი რაოდენობები არის სახელმწიფო ფუნქციები, ამიტომ H ასევე არის სახელმწიფო ფუნქცია, ანუ H \u003d f 1 (P, V); H=f 2 (V,T); H=f 3 (P, T).
ენთალპიის dH ცვლილება ნებისმიერ თერმოდინამიკურ პროცესში განისაზღვრება საწყისი H 1 და საბოლოო H 2 მდგომარეობებით და არ არის დამოკიდებული პროცესის ბუნებაზე. თუ სისტემა შეიცავს 1 კგ ნივთიერებას, მაშინ გამოიყენება სპეციფიკური ენთალპია ჯ/კგ.
იდეალური გაზისთვის დიფერენციალურ განტოლებას აქვს ფორმა
შესაბამისად სპეციფიკური ენთალპია განისაზღვრება ფორმულით
თერმოდინამიკის პირველი კანონის განტოლებაა dq=dU+Pdυ, როდესაც სამუშაოს ერთადერთი ტიპია გაფართოების სამუშაო Pdυ=d(Pυ)-υdP, შემდეგ dq=d(U+Pυ)-υdP, საიდანაც
Პრაქტიკული სამუშაო№ 2
თემა: თბოტევადობა, ენთალპია, იდეალური აირების ნარევები, შინაგანი ენერგია, სამუშაო, თერმოდინამიკური პროცესები.
სამუშაოს მიზანი: თეორიული მომზადების დროს მიღებული ცოდნის კონსოლიდაცია, სითბოს საინჟინრო გამოთვლების განხორციელების უნარ-ჩვევების შეძენა.
ᲛᲔ.ძირითადი განმარტებები, ფორმულები და განტოლებები
1. იდეალური აირების ნარევები
აირის ნარევი არის რამდენიმე აირის მექანიკური ნარევი, რომლებიც ქიმიურად არ ურთიერთქმედებენ ერთმანეთთან. ნარევის თითოეულ გაზს ეწოდება გაზის კომპონენტი; იქცევა ისე, თითქოს ნარევში სხვა აირები არ იყოს, ე.ი. თანაბრად ნაწილდება მთელ ნარევში. ნარევის თითოეული აირის მიერ ჭურჭლის კედლებზე განხორციელებულ წნევას ნაწილობრივი წნევა ეწოდება. იდეალური აირების ნარევების ძირითადი კანონია დალტონის კანონი, რომლის მიხედვითაც ნარევის წნევა უდრის გაზების ნაწილობრივი წნევის ჯამს, რომლებიც ქმნიან ნარევს:
2. შინაგანი ენერგია
სხეულის შინაგანი ენერგია არის სხეულის შემადგენელი მიკრონაწილაკების მოძრაობის კინეტიკური ენერგიისა და მათი პოტენციური ენერგიის ერთობლიობა. განსაზღვრულია ურთიერთქმედება. ურთიერთმიზიდულობის ან მოგერიების ძალები. შეუძლებელია შინაგანი ენერგიის აბსოლუტური მნიშვნელობის დადგენა, ამიტომ თერმოდინამიკური გამოთვლების დროს გამოითვლება არა შინაგანი ენერგიის აბსოლუტური მნიშვნელობა, არამედ მისი ცვლილება, ე.ი.
![]() ან
ან ![]()
სადაც U 1 და U 2 - სამუშაო სითხის (გაზის) საწყისი და საბოლოო მდგომარეობის შიდა ენერგია;
u 1 და და 2 - სცემს. სამუშაო სითხის საწყისი და საბოლოო მდგომარეობის შიდა ენერგია.
აქედან გამომდინარეობს, რომ შინაგანი ენერგიის ცვლილება არ არის დამოკიდებული პროცესის ბუნებასა და გზაზე, არამედ განისაზღვრება სამუშაო სითხის მდგომარეობით ცვლილების პროცესის დასაწყისში და ბოლოს.
იდეალური გაზის თვისებაა მასში მოლეკულური ურთიერთქმედების ძალების არარსებობა და, შესაბამისად, შიდა პოტენციური ენერგიის არარსებობა, ე.ი. U n \u003d 0 და U „ \u003d 0. მაშასადამე, იდეალური გაზის შიდა ენერგია:
U=U k =f(T) unu u=uk =f(T).
H. გაზის სამუშაო.
თერმოდინამიკაში მოქმედი სითხის მდგომარეობის ნებისმიერი ცვლილება ენერგიის გაცვლის შედეგად გარემოპროცესს უწოდებენ. ამ შემთხვევაში იცვლება სამუშაო ორგანოს ძირითადი პარამეტრები:
სითბოს მექანიკურ სამუშაოდ გადაქცევა დაკავშირებულია სამუშაო სითხის მდგომარეობის შეცვლის პროცესთან. გაზის მდგომარეობის შეცვლის პროცესები შეიძლება იყოს გაფართოების და შეკუმშვის პროცესები. აირის თვითნებური მასისთვის M (კგ), სამუშაო უდრის:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
სადაც l \u003d p (v 2 -v 1) J / კგ არის 1 კგ გაზის სამუშაო ან კონკრეტული სამუშაო.
4. გაზის ენთალპია,
ენთალპია არის პარამეტრი, რომელიც ახასიათებს სამუშაო სითხის (აირის) გარემოსთან შეერთების პოტენციურ ენერგიას. ენთალპია და სპეციფიკური ენთალპია:
I \u003d U + pV, J და i i \u003d და + pv, J / კგ.
5. თბოტევადობა.
სპეციფიკური სითბოს სიმძლავრე არის სითბოს რაოდენობა, რომელიც უნდა მიეწოდოს 1 კგ გაზს, რათა გაცხელდეს იგი 1 ° C-ით მოცემულ ტემპერატურულ დიაპაზონში.
სპეციფიკური თბოტევადობა არის მასა, მოცულობითი და კილომოლი. არსებობს კავშირი მასის C, მოცულობა C და კილომოლ C სითბოს სიმძლავრეებს შორის:
 ;
; 
სადაც Vo 22,4 მ 3 / კმოლ - სცემს. გაზის მოცულობა ნორმალურ პირობებში.
მასა უდ. გაზის ნარევის სითბოს სიმძლავრე:

მოცულობითი სპეციფიკური სითბოგაზის ნარევი:

აირის ნარევის კილომოლარული სპეციფიკური სითბო:

6. სითბოს რაოდენობის განსაზღვრის განტოლება
სამუშაო სითხის (გაზის) მიერ გამოყოფილი ან მიღებული სითბოს რაოდენობა შეიძლება განისაზღვროს განტოლებით:
Q \u003d M C m (t 2 -t 1), J ან Q \u003d VC (t-t), J, სადაც M და V არის გაზის წონა ან მოცულობა, კგ ან m 3;
t u t - გაზის ტემპერატურა პროცესის ბოლოს და დასაწყისში ° С;
C და C - მასის და მოცულობის საშუალო დარტყმები. გაზის სითბოს სიმძლავრე
t cp \u003d J / kgK ან J / m 3 K
7. თერმოდინამიკის პირველი კანონი
ეს კანონი ითვალისწინებს სითბოს და მექანიკური მუშაობის ურთიერთკონვერსიებს. ამ კანონის მიხედვით, სითბო გარდაიქმნება მექანიკურ სამუშაოდ და პირიქით, მექანიკური სამუშაო სითბოდ მკაცრად ექვივალენტური რაოდენობით. სითბოს და სამუშაოს ეკვივალენტურ განტოლებას აქვს ფორმა:
სითბოს და მუშაობის ეკვივალენტობის პრინციპის გათვალისწინებით, სითბოს ბალანსის განტოლება აირის თვითნებური მასისთვის:
Q \u003d U + L და q \u003d u + l \u003d u -u + l
Პრობლემის გადაჭრაII
დავალება #1 (#1)
ატმოსფერულ მშრალ ჰაერს აქვს შემდეგი სავარაუდო მასის შემადგენლობა: g 02 =23,2%, g N 2 =76,8%.
განსაზღვრეთ ჰაერის მოცულობითი შემადგენლობა, მისი აირის მუდმივი, აშკარა მოლეკულური წონა, ჟანგბადის და აზოტის ნაწილობრივი წნევა, თუ ჰაერი არის P = 101325 Pa ბარომეტრის გამოყენებით.
მე ვადგენ ჰაერის მოცულობით შემადგენლობას:
 ;
; ;
;
სადაც r არის მასის წილი;
m არის ფარდობითი მოლეკულური წონა;
g არის მოცულობითი წილი.
მ ჰაერი. =m O2 r O2 +m N2 r N2 = 32 0.209 + 28 0.7908=6.688+22.14=28.83;

 ;
;
სადაც R 0 არის გაზის მუდმივი.
მე განვსაზღვრავ სხვადასხვა გაზების ნაწილობრივ წნევას:
P O 2 \u003d P სმ r O2 \u003d 101325 0.209 \u003d 21176.9 (Pa);
P N 2 \u003d P სმ r N 2 \u003d 101325 0.7908 \u003d 80127.81 (Pa);
სადაც P O 2, P N 2 - ნაწილობრივი წნევა;
P სმ არის ნარევის წნევა.
დავალება #2 (#2)
ჭურჭელი ტიხრით იყოფა 2 ნაწილად, რომელთა მოცულობებია V 1 =1,5 მ 3 და V 2 =1,0 მ 3. V 1 მოცულობის პირველი ნაწილი შეიცავს CO 2-ს P 1 =0,5 მპა და t 1 =30°C-ზე; V 2 მოცულობის მეორე ნაწილი შეიცავს O 2 P 2 =0.2 MPa და t 2 =57 ° C. განისაზღვროს CO 2 და O 2-ის მასური და მოცულობითი ფრაქციები, ნარევის აშკარა მოლეკულური წონა და მისი გაზის მუდმივი დანაყოფების მოცილების და შერევის პროცესის დასრულების შემდეგ.
მე განვსაზღვრავ გაზის ცალკეულ მუდმივებს:
ამისათვის მე განვსაზღვრავ ფარდობით მოლეკულურ წონას: m (CO 2) \u003d 32 + 12 \u003d 44; m(O 2)=32;

 ;
;
![]()
 ;
;
კლაიპერონის დამახასიათებელი განტოლების მიხედვით ვადგენ აირების მასებს:
 (კგ);
(კგ);
 (კგ);
(კგ);
მე განვსაზღვრავ მასურ წილადებს:


ვადგენ მოცულობით წილადებს:


განსაზღვრეთ ჰაერის აშკარა მოლეკულური წონა:
მ ჰაერი. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0.21 + 44 0.79 \u003d 6.72 + 34.74 \u003d 41.48;
მე ვადგენ ჰაერის ინდივიდუალური გაზის მუდმივას (R):

 ;
;
დავალება #3 (#6)
300 ლ მოცულობის ჭურჭელში არის ჟანგბადი წნევის P 1 \u003d 0.2 MPa და t 1 \u003d 20 0 C. რამდენი სითბო უნდა მიეწოდოს ისე, რომ ჟანგბადის ტემპერატურა გაიზარდოს t 2 \u003d 300 0 C-მდე. ? რა წნევა დამყარდება ჭურჭელში? გამოსათვლელად აიღეთ ჟანგბადის საშუალო მოცულობითი სპეციფიკური სითბო n.o. C 02 \u003d 0.935 
ჩარლზის კანონის მიხედვით, მე განვსაზღვრავ პროცესის საბოლოო ზეწოლას:
;  (პა);
(პა);
სადაც P, T არის გაზის პარამეტრები.
მე განვსაზღვრავ ინდივიდუალურ აირის მუდმივას ჟანგბადისთვის (R):

 ;
;
ვინაიდან პროცესი იზოქორულია, მე განვსაზღვრავ სითბოს რაოდენობას, რომელიც უნდა მიეწოდოს შესაბამისი ფორმულის მიხედვით: Q v \u003d M C cv (T 2 -T 1) ამისათვის, კლაიპერონის დამახასიათებელი განტოლების მიხედვით, მე განვსაზღვრავ მასას გაზის
 (კგ); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
(კგ); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
დავალება #4 (#7)
რამდენი სითბო უნდა დაიხარჯოს 2მ 3 ჰაერის გასათბობად მუდმივი ზედმეტი წნევის დროს P ex. \u003d 0,2 მპა 100 0 C ტემპერატურადან 500 0 C ტემპერატურამდე. რა სამუშაოს გააკეთებს ჰაერი ამ შემთხვევაში? გამოსათვლელად აიღეთ: ატმოსფერული წნევა P at. \u003d 0,1 მპა, ჰაერის საშუალო მასის იზობარული სითბოს სიმძლავრე C pm \u003d 1,022  ; გამოთვალეთ გაზის მუდმივი იმის გათვალისწინებით, რომ ჰაერის M ჰაერის აშკარა მოლეკულური წონა. =29.
; გამოთვალეთ გაზის მუდმივი იმის გათვალისწინებით, რომ ჰაერის M ჰაერის აშკარა მოლეკულური წონა. =29.
მე ვადგენ ჰაერის ინდივიდუალურ გაზის მუდმივას:

 ;
;
აბსოლუტური წნევა ტოლია ჭარბი და ატმოსფერული P=P est ჯამისა. + P at. =0,1+0,2=0,3 მპა
 (კგ);
(კგ);
ვინაიდან პროცესი იზობარულია, მე ვადგენ Q და L-ს შესაბამისი ფორმულების მიხედვით:
გეი-ლუსაკის კანონის მიხედვით, მე განვსაზღვრავ საბოლოო მოცულობას:
 მ 3;
მ 3;
Q \u003d M C pm (T 2 -T 1) \u003d 5.56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2.15 \u003d 645000 (J).
დავალება #5 (#8)
ცილინდრში არის ჰაერი წნევის P=0,5 მპა და ტემპერატურა t 1 =400 0 C. ჰაერიდან სითბო ამოღებულია P=const-ზე ისე, რომ პროცესის ბოლოს ტემპერატურა t 2 =0 0 C არის. კომპლექტი. ცილინდრის მოცულობა, რომელშიც ჰაერი V 1 \u003d 400 ლ.
განსაზღვრეთ ამოღებული სითბოს რაოდენობა, საბოლოო მოცულობა, შიდა ენერგიის ცვლილება და შეკუმშვის სრულყოფილი მოქმედება C pm =1.028  .
.
ვინაიდან პროცესი იზობარულია, გეი-ლუსაკის კანონის მიხედვით მე განვსაზღვრავ საბოლოო მოცულობას:
 მ 3;
მ 3;
კლაიპერონის დამახასიათებელი განტოლების მიხედვით ვადგენ გაზის მასას:
წინა ამოცანიდან R=286.7 
 (კგ);
(კგ);
მე განვსაზღვრავ სითბოს რაოდენობას, რომელიც გამოიყოფა:
Q=M C pm (T 2 -T 1) = 1.03 1028 (273-673) = -423536 (J);
მე ვადგენ დახარჯული სამუშაოს რაოდენობას:
L=P (V 2 -V 1)= 500,000 (0,16-0,4)=-120,000 (J);
განტოლებიდან, რომლითაც განისაზღვრება მთლიანი რაოდენობა, მე განვსაზღვრავ შიდა ენერგიის ოდენობის ცვლილებას:
![]() ; (J)
; (J)
პრობლემა #6 (#9)
ჰაერი, რომელსაც აქვს მოცულობა V 1 = 0,02 მ3 წნევის P 1 = 1,1 მპა და t 1 = 25 წმ, ფართოვდება ცილინდრში მოძრავი დგუშით P 2 =0,11 მპა წნევამდე. იპოვეთ საბოლოო მოცულობა V 2, საბოლოო ტემპერატურა t 2, ჰაერის მიერ შესრულებული სამუშაო და მიწოდებული სითბო, თუ ცილინდრში გაფართოება მოხდება:
ა) იზოთერმულად
ბ) ადიაბატურად ადიაბატური მაჩვენებლით k=1.4
გ) პოლიტროპული პოლიტროპული ინდექსით n=1.3
იზოთერმული პროცესი:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0.02 1.1 / 0.11 \u003d 0.2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1.1 10 6 0.02Ln(0.2/0.02)=22000J
ადიაბატური პროცესი:
V 1 / V 2 \u003d (P 2 / P 1) 1 / კ
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0.02 / (0.11 / 1.1) 1 / 1.4 \u003d 0.1036 M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0.11 / 1.1) 1.4-1 / 1.4 298 \u003d 20.32k
C v \u003d 727,4 ჯ / კგ კ
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1) = 2.0275 10 6 J
პოლიტროპული პროცესი:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0.02 / (0.11 / 1.1) 1 / 1.3 \u003d 0.118 M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0.11 / 1.1) 1.3-1 / 1.3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118) = 30000J
Q=(k-n/k-1) l M=((1.4-1.3)/(1.4-1)) 30000=7500J
ლიტერატურა:
1. ენერგია, მოსკოვი, 1975 წ.
2. ლიტვინი ა.მ. "თერმული ინჟინერიის თეორიული საფუძვლები", გამომცემლობა "ენერგია", მოსკოვი, 1969 წ.
3. ტუგუნოვი პ.ი., სამსონოვი ა.ა., „თბოტექნიკის საფუძვლები, სითბოს ძრავები და ორთქლის ელექტროსადგურები“, გამომცემლობა ნედრა, მოსკოვი, 1970 წ.
4. კრუტოვ V.I., "სითბო ინჟინერია", გამომცემლობა "ინჟინერია", მოსკოვი, 1986 წ.
გაზის ნარევები. გაზების თბოტევადობა
აირის ნარევები გაგებულია, როგორც რამდენიმე აირის მექანიკური ნარევი, რომლებიც ქიმიურად არ ურთიერთქმედებენ ერთმანეთთან. იდეალური აირების ნარევი ემორჩილება ყველა კანონს, რომელიც ეხება იდეალური აირები. აირის ნარევის შემადგენლობა განისაზღვრება ნარევში შემავალი თითოეული აირის რაოდენობით და შეიძლება განისაზღვროს მასის ან მოცულობითი ფრაქციების მიხედვით:
სადაც არის -th კომპონენტის მასა, არის -th კომპონენტის მოცულობა და და არის მთლიანი ნარევის მასა და მოცულობა, შესაბამისად.
აშკარაა რომ
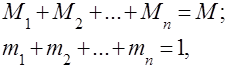
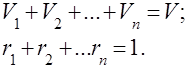
გაზების ნარევებთან პრაქტიკული პრობლემების გადაჭრის მოხერხებულობისთვის შემოღებულია აირების ნარევის აშკარა მოლეკულური წონის კონცეფცია, რომელიც წარმოადგენს ნარევის ცალკეული კომპონენტების რეალური მოლეკულური წონის საშუალო მასას.
აირების ნარევის მდგომარეობის განტოლებას აქვს ფორმა:
გაზის ნარევები ექვემდებარება უნივერსალური გაზის მუდმივობის კონცეფციას
კავშირი გაზის ნარევის წნევასა და ნარევში შემავალი ცალკეული კომპონენტების ნაწილობრივ წნევას შორის დადგენილია დალტონის კანონით:
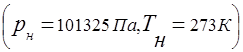
1 გაზს აქვს განსხვავებული მასა წნევისა და ტემპერატურის მიხედვით. ამასთან დაკავშირებით, მოცულობითი სითბოს სიმძლავრე ყოველთვის მოიხსენიება 1-ში ჩასმული გაზის მასაზე ნორმალურ პირობებში. ამ შემთხვევაში, სხვადასხვა გაზების 1 კმოლის მოცულობა არის 22,4/კმოლ, ხოლო უნივერსალური გაზის მუდმივი არის . აირის სითბოს მიწოდების მეთოდიდან გამომდინარე, გამოირჩევა იზობარული და იზოქორული სითბოს სიმძლავრეები. ამ სიდიდეების თანაფარდობას ეწოდება ადიაბატური მაჩვენებლები
სითბოს სიმძლავრეები და ასევე დაკავშირებულია მაიერის მიმართებით
სითბოს რაოდენობა, რომელიც უნდა დაიხარჯოს 1 კგ გაზის გაცხელების პროცესში ტემპერატურულ დიაპაზონში, განისაზღვრება ფორმულით:
სადაც და არის, შესაბამისად, საშუალო სითბოს სიმძლავრეები 0°- და 0°- ფარგლებში.
თუ (კგ) ან () გაზი ჩართულია პროცესში, მაშინ
გაზის ნარევის სითბოს სიმძლავრე უნდა განისაზღვროს ფორმულებით:
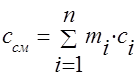
მასა - ;
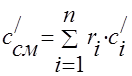
მოცულობითი -;
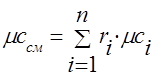
მოლარული -.
ქვაბის აგრეგატში საწვავის წვის პროდუქტების გაზების სითბოს გამოსაყენებლად, ამ უკანასკნელის გაზის სადინარებში დამონტაჟებულია საწვავის წვისთვის აუცილებელი ჰაერის გამათბობლები (ნახ. 1). ქვაბიდან გამოსული აირები ჰაერის გამათბობელში შედიან ტემპერატურით და გაცივდებიან, აძლევენ სითბოს ჰაერს, მდე. ქვაბის აგრეგატის გაზის სადინარში, კვამლის გამონაბოლქვის მუშაობის გავლენის ქვეშ, წნევა დგინდება ატმოსფერულზე ოდნავ ქვემოთ. ჰაერის გამათბობელში ჰაერი თბება ტემპერატურიდან ტემპერატურამდე.
გრიპის აირები
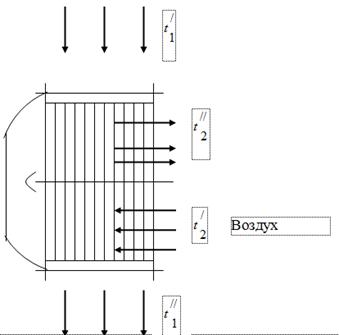
ქვაბის განყოფილების ტესტირებისას მიღებული იქნა შემდეგი მონაცემები:
აირების ტემპერატურა ჰაერის გამათბობელში შესასვლელში, = 450 °C.
გაზების ტემპერატურა ჰაერის გამათბობლის გამოსასვლელში, = 150 ° C.
ჰაერის ტემპერატურა ჰაერის გამათბობელში შესასვლელში, = 26 ° C.
ჰაერის ტემპერატურა ჰაერის გამათბობლის გამოსასვლელში, = 260 ° C.
გამონაბოლქვი აირების მოცულობითი შემადგენლობა - = 11,5%; = 6,5%; = 17,2%; = 64.8%
გაზების საათობრივი მოხმარება არის 50 ·/სთ.
ვაკუუმი გაზის სადინარში - 15 მმ წყალი. Ხელოვნება.
ბარომეტრიული წნევა 760 მმ Hg. Ხელოვნება.
განსაზღვრეთ:
გრიპის აირების აშკარა მოლეკულური წონა;
გამონაბოლქვი აირის მუდმივი;
ცალკეული კომპონენტების წონის (მასობრივი) ფრაქციები, რომლებიც ქმნიან გრიპის აირებს;
კომპონენტების ნაწილობრივი წნევა:
ჰაერის საათობრივი ნაკადი.
დავუშვათ, რომ გაზის მიერ გამოთავისუფლებული მთელი სითბო ჰაერი შეიწოვება.
სითბოს სიმძლავრის დამოკიდებულება ტემპერატურაზე ითვლება მრუდი.
1. გრიპის აირების აშკარა მოლეკულური წონა
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. გამონაბოლქვი აირის მუდმივი
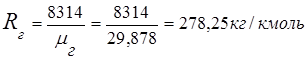
3. მასური წილადებიგაზის კომპონენტები
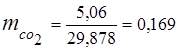
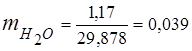
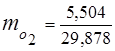
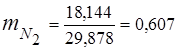
4. კომპონენტების ნაწილობრივი წნევა
გაანგარიშების შედეგები შეიტანება ცხრილში
|
Პარამეტრები |
გაზის ნარევი |
|||
|
|
||||
|
|
||||
|
|
5. ჰაერის საათობრივი მოხმარება
ჰაერის მოხმარება განისაზღვრება ჰაერის გამაცხელებლის სითბოს ბალანსის განტოლებიდან
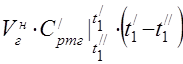
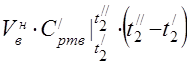
საშუალო მოლური სითბოს ტევადობა 450 °C-ზე
კომპონენტების საშუალო სპეციფიკური სითბოს სიმძლავრე ტემპერატურულ დიაპაზონში 0 ... 450 ° C.













 .
(1.28)
.
(1.28)