იდეალური აირების მოლეკულურ-კინეტიკური თეორია
Იცოდი,
რა არის სააზროვნო ექსპერიმენტი, გედანკენის ექსპერიმენტი?
ეს არის არარსებული პრაქტიკა, ამქვეყნიური გამოცდილება, იმის ფანტაზია, რაც სინამდვილეში არ არის. აზროვნების ექსპერიმენტები სიზმრების მსგავსია. ისინი შობენ მონსტრებს. ფიზიკური ექსპერიმენტისგან განსხვავებით, რომელიც ჰიპოთეზების ექსპერიმენტული ტესტია, „აზროვნების ექსპერიმენტი“ ჯადოსნურად ცვლის ექსპერიმენტულ ტესტს სასურველი, შეუმოწმებელი დასკვნებით, მანიპულირებს ლოგიკურ კონსტრუქციებს, რომლებიც ფაქტობრივად არღვევენ თავად ლოგიკას, დაუდასტურებელი საფუძვლების გამოყენებით, როგორც დადასტურებული. ცვლილება. ამრიგად, „აზრობრივი ექსპერიმენტების“ განმცხადებლების მთავარი ამოცანაა მსმენელის ან მკითხველის მოტყუება რეალური ფიზიკური ექსპერიმენტის „თოჯინით“ ჩანაცვლებით - ფიქტიური მსჯელობა პირობით ვადაზე ადრე ფიზიკური გადამოწმების გარეშე.
ფიზიკის წარმოსახვითი, „აზრობრივი ექსპერიმენტებით“ შევსებამ გამოიწვია სამყაროს აბსურდული, სიურეალისტური, დამაბნეველი სურათი. ნამდვილმა მკვლევარმა უნდა განასხვავოს ასეთი „შეფუთვები“ რეალური ღირებულებებისგან.
რელატივისტები და პოზიტივისტები ამტკიცებენ, რომ "აზროვნების ექსპერიმენტი" არის ძალიან სასარგებლო ინსტრუმენტი თეორიების შესამოწმებლად (ასევე ჩვენს გონებაში) თანმიმდევრულობისთვის. ამით ისინი ატყუებენ ხალხს, რადგან ნებისმიერი გადამოწმება შეიძლება განხორციელდეს მხოლოდ გადამოწმების ობიექტისგან დამოუკიდებელი წყაროს მიერ. თავად ჰიპოთეზის განმცხადებელი არ შეიძლება იყოს საკუთარი განცხადების ტესტი, რადგან თავად ამ განცხადების მიზეზი არის განცხადებაში განმცხადებლისთვის თვალსაჩინო წინააღმდეგობების არარსებობა.
ამას ვხედავთ SRT-ისა და GTR-ის მაგალითზე, რომლებიც გადაიქცნენ ერთგვარ რელიგიად, რომელიც მართავს მეცნიერებას და საზოგადოებრივი აზრი. ვერცერთი ფაქტი, რომელიც მათ ეწინააღმდეგება, ვერ გადალახავს აინშტაინის ფორმულას: „თუ ფაქტი არ შეესაბამება თეორიას, შეცვალე ფაქტი“ (სხვა ვერსიით, „ფაქტი არ შეესაბამება თეორიას? - მით უარესი ფაქტისთვის. ").
მაქსიმუმი, რაც შეიძლება მოითხოვოს „აზროვნების ექსპერიმენტმა“ არის მხოლოდ ჰიპოთეზის შიდა თანმიმდევრულობა განმცხადებლის საკუთარი, ხშირად არავითარ შემთხვევაში არ არის ჭეშმარიტი, ლოგიკის ფარგლებში. პრაქტიკასთან შესაბამისობა ამას არ ამოწმებს. რეალური ტესტი შეიძლება ჩატარდეს მხოლოდ რეალურ ფიზიკურ ექსპერიმენტში.
ექსპერიმენტი არის ექსპერიმენტი, რადგან ეს არ არის აზრის დახვეწა, არამედ აზრის გამოცდა. საკუთარ თავში თანმიმდევრულ აზრს არ შეუძლია საკუთარი თავის გამოცდა. ეს დაამტკიცა კურტ გოდელმა.
იშვიათ გაზში მოლეკულებს შორის მანძილი ბევრჯერ აღემატება მათ ზომას. ამ შემთხვევაში მოლეკულებს შორის ურთიერთქმედება უმნიშვნელოა და მოლეკულების კინეტიკური ენერგია გაცილებით მეტია, ვიდრე მათი ურთიერთქმედების პოტენციური ენერგია.
აირისებრ მდგომარეობაში მყოფი ნივთიერების თვისებების ასახსნელად რეალური გაზის ნაცვლად გამოიყენება მისი ფიზიკური მოდელი – იდეალური აირი. მოდელი ვარაუდობს:
მოლეკულებს შორის მანძილი ოდნავ აღემატება მათ დიამეტრს;
მოლეკულები ელასტიური ბურთულებია;
მოლეკულებს შორის არ არის მიმზიდველი ძალები;
როდესაც მოლეკულები ერთმანეთს და ჭურჭლის კედლებს ეჯახება, მოქმედებს საგრებელი ძალები;
მოლეკულური მოძრაობა ემორჩილება მექანიკის კანონებს.
იდეალური გაზის mkt ძირითადი განტოლება:
MKT-ის ძირითადი განტოლება იძლევა გაზის წნევის გამოთვლას, თუ ცნობილია მოლეკულის მასა, სიჩქარის კვადრატის საშუალო მნიშვნელობა და მოლეკულების კონცენტრაცია.
იდეალური გაზის წნევამდგომარეობს იმაში, რომ ჭურჭლის კედლებთან შეჯახებისას მოლეკულები ურთიერთქმედებენ მათთან მექანიკის კანონების მიხედვით, როგორც დრეკადი სხეულები. როდესაც მოლეკულა ჭურჭლის კედელს ეჯახება, სიჩქარის ვექტორის v x სიჩქარის პროექცია OX ღერძზე, კედელზე პერპენდიკულარულად, ცვლის თავის ნიშანს საპირისპიროდ, მაგრამ რჩება მუდმივი აბსოლუტურ მნიშვნელობაში. მაშასადამე, მოლეკულის კედელთან შეჯახების შედეგად, მისი იმპულსის პროექცია OX ღერძზე იცვლება mv 1x = -mv x-დან mv 2x =mv x-მდე. მოლეკულის იმპულსის ცვლილება კედელთან შეჯახებისას იწვევს F 1 ძალას, რომელიც მოქმედებს მასზე კედლის მხრიდან. მოლეკულის იმპულსის ცვლილება უდრის ამ ძალის იმპულსს:
შეჯახების დროს, ნიუტონის მესამე კანონის მიხედვით, მოლეკულა მოქმედებს კედელზე F 2 ძალით, რომელიც უდრის F 1 ძალის აბსოლუტურ მნიშვნელობას და მიმართულია საპირისპიროდ.
ბევრი მოლეკულაა და თითოეული შეჯახებისას კედელს ერთსა და იმავე იმპულსს ანიჭებს. წამში ისინი გადასცემენ იმპულსს 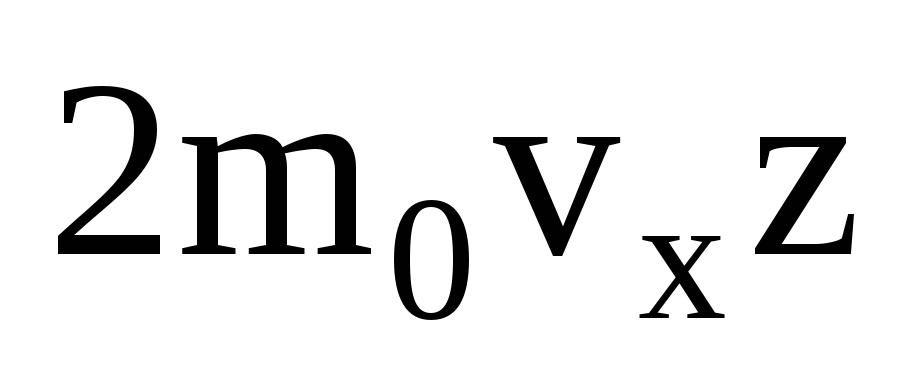 , სადაც z არის ყველა მოლეკულის კედელთან შეჯახების რაოდენობა, რომელიც პროპორციულია აირში მოლეკულების კონცენტრაციის, მოლეკულების სიჩქარისა და კედლის ზედაპირის ფართობისა:
, სადაც z არის ყველა მოლეკულის კედელთან შეჯახების რაოდენობა, რომელიც პროპორციულია აირში მოლეკულების კონცენტრაციის, მოლეკულების სიჩქარისა და კედლის ზედაპირის ფართობისა: 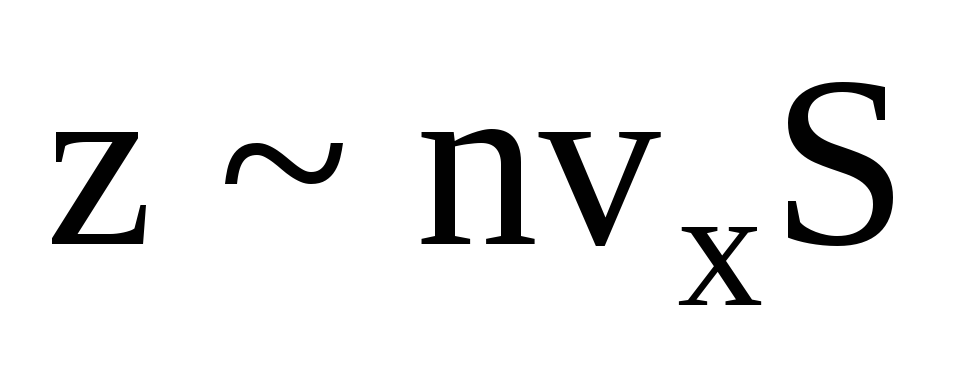 . მოლეკულების მხოლოდ ნახევარი მოძრაობს კედლისკენ, დანარჩენი კი საპირისპირო მიმართულებით:
. მოლეკულების მხოლოდ ნახევარი მოძრაობს კედლისკენ, დანარჩენი კი საპირისპირო მიმართულებით: 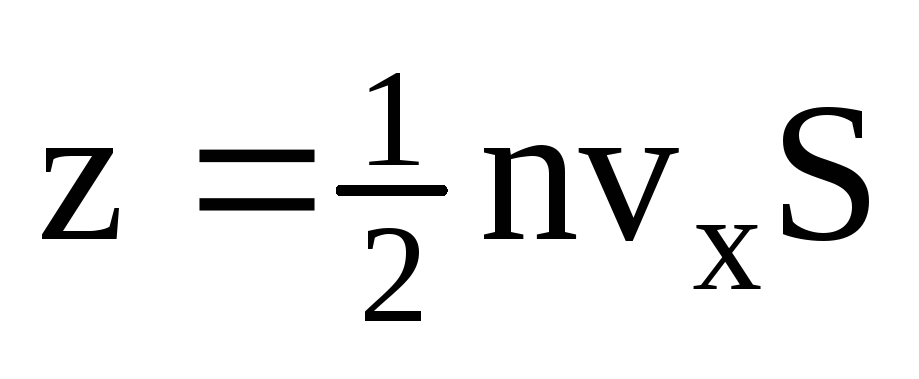 . შემდეგ მთლიანი იმპულსი გადაეცემა კედელს 1 წამში:
. შემდეგ მთლიანი იმპულსი გადაეცემა კედელს 1 წამში: 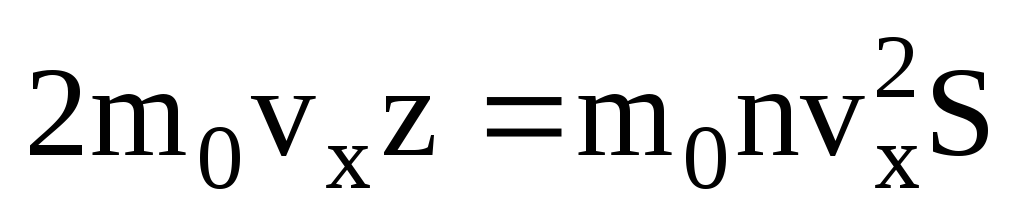 . ნიუტონის მეორე კანონის თანახმად, სხეულის იმპულსის ცვლილება დროის ერთეულზე ტოლია მასზე მოქმედი ძალის:
. ნიუტონის მეორე კანონის თანახმად, სხეულის იმპულსის ცვლილება დროის ერთეულზე ტოლია მასზე მოქმედი ძალის:
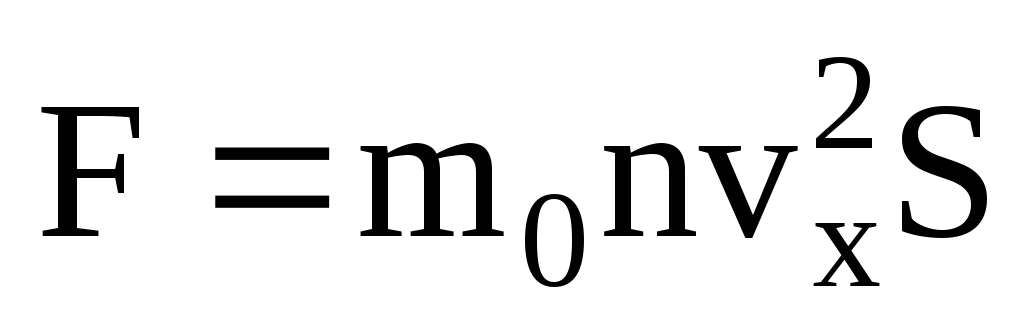
იმის გათვალისწინებით, რომ ყველა მოლეკულას არ აქვს ერთნაირი სიჩქარე, კედელზე მოქმედი ძალა იქნება სიჩქარის საშუალო კვადრატის პროპორციული. ვინაიდან მოლეკულები მოძრაობენ ყველა მიმართულებით, სიჩქარის პროგნოზების კვადრატების საშუალო მნიშვნელობები თანაბარია. ამრიგად, სიჩქარის პროექციის საშუალო კვადრატი არის: 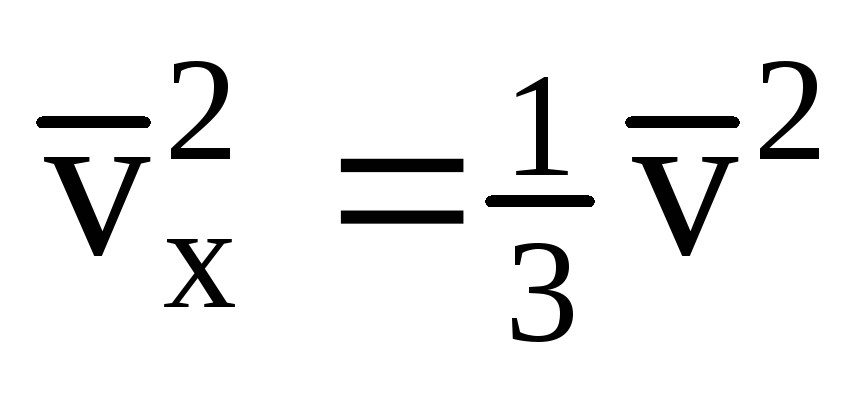 ;
;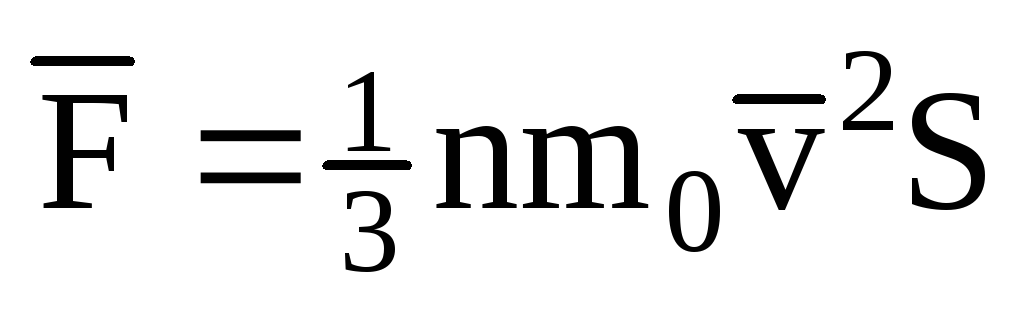 . მაშინ გაზის წნევა გემის კედელზე არის:
. მაშინ გაზის წნევა გემის კედელზე არის:
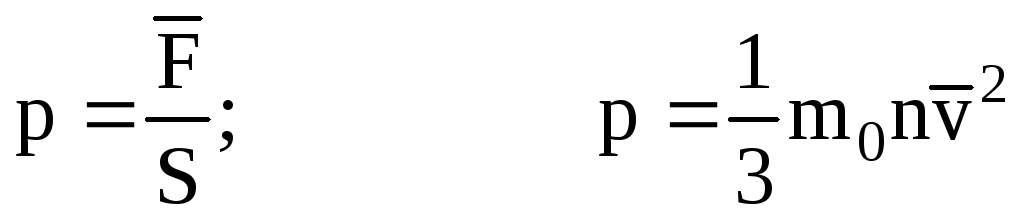 - MKT-ის ძირითადი განტოლება.
- MKT-ის ძირითადი განტოლება.
მოლეკულების მთარგმნელობითი მოძრაობის კინეტიკური ენერგიის საშუალო მნიშვნელობის აღნიშვნა იდეალური გაზი:
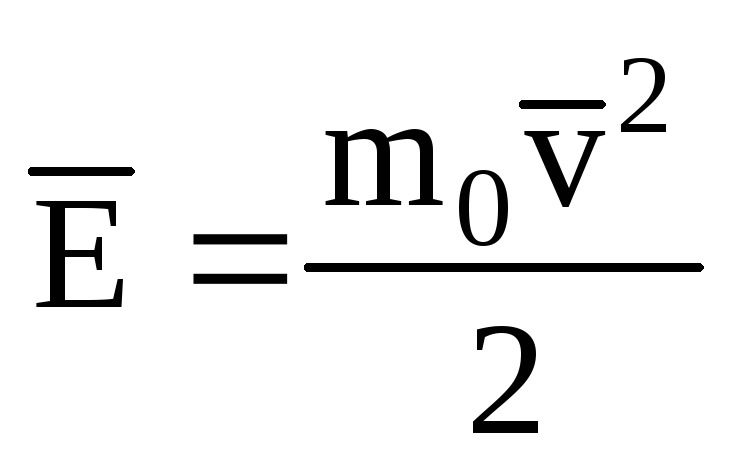 , ვიღებთ
, ვიღებთ
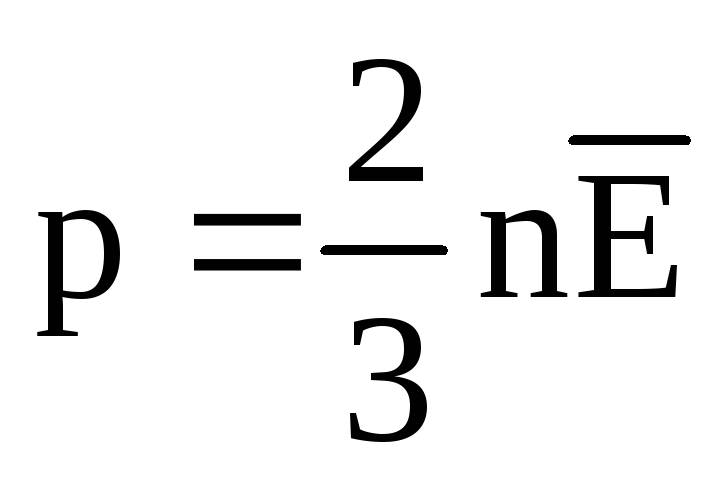
ტემპერატურა და მისი გაზომვა:
იდეალური გაზის ძირითადი MKT განტოლება აკავშირებს ადვილად გაზომვად მაკროსკოპულ პარამეტრს - წნევას - გაზის ისეთ მიკროსკოპულ პარამეტრებს, როგორიცაა საშუალო კინეტიკური ენერგია და მოლეკულების კონცენტრაცია. მაგრამ, მხოლოდ წნევის გაზომვით, ჩვენ არ შეგვიძლია გავარკვიოთ მოლეკულების კინეტიკური ენერგიის საშუალო მნიშვნელობა ცალკე და არც მათი კონცენტრაცია. ამიტომ, გაზის მიკროსკოპული პარამეტრების საპოვნელად საჭიროა სხვა ფიზიკური სიდიდის გაზომვა, რომელიც დაკავშირებულია მოლეკულების საშუალო კინეტიკურ ენერგიასთან. ეს მნიშვნელობა არის ტემპერატურა.
ნებისმიერი მაკროსკოპული სხეული ან მაკროსკოპული სხეულების ჯგუფი, მუდმივ გარე პირობებში, სპონტანურად გადადის თერმული წონასწორობის მდგომარეობაში. Თერმული წონასწორობა -ეს არის მდგომარეობა, რომელშიც ყველა მაკროსკოპული პარამეტრი უცვლელი რჩება თვითნებურად დიდი ხნის განმავლობაში.
ტემპერატურა ახასიათებს სხეულთა სისტემის თერმული წონასწორობის მდგომარეობას: სისტემის ყველა სხეულს, რომლებიც ერთმანეთთან თერმულ წონასწორობაშია, აქვთ იგივე ტემპერატურა..
ტემპერატურის გასაზომად, შეგიძლიათ გამოიყენოთ ცვლილება ნებისმიერ მაკროსკოპულ სიდიდეში, რაც დამოკიდებულია ტემპერატურაზე: მოცულობა, წნევა, ელექტრული წინააღმდეგობა და ა.შ.
ყველაზე ხშირად პრაქტიკაში გამოიყენება სითხის მოცულობის (ვერცხლისწყლის ან ალკოჰოლის) დამოკიდებულება ტემპერატურაზე. თერმომეტრის დაკალიბრებისას, ყინულის დნობის ტემპერატურა, როგორც წესი, აღებულია, როგორც საცნობარო წერტილი (0); მეორე მუდმივი წერტილი (100) არის წყლის დუღილის წერტილი ნორმალურ ატმოსფერულ წნევაზე (ცელსიუსის მასშტაბი). ვინაიდან სხვადასხვა სითხე გაცხელებისას განსხვავებულად აფართოებს, ამგვარად დადგენილი მასშტაბი გარკვეულწილად დამოკიდებული იქნება მოცემული სითხის თვისებებზე. რა თქმა უნდა, 0 და 100°C ემთხვევა ყველა თერმომეტრს, მაგრამ 50°C არ ემთხვევა.
სითხეებისგან განსხვავებით, ყველა იშვიათი გაზი გაცხელებისას ერთნაირად ფართოვდება და ტემპერატურის ცვლილებით ერთნაირად ცვლის წნევას. ამიტომ, ფიზიკაში რაციონალური ტემპერატურის სკალის დასადგენად გამოიყენება გარკვეული რაოდენობის იშვიათი გაზის წნევის ცვლილება მუდმივ მოცულობაზე ან გაზის მოცულობის ცვლილება მუდმივ წნევაზე. ამ მასშტაბს ზოგჯერ უწოდებენ იდეალური გაზის ტემპერატურის მასშტაბი.
თერმული წონასწორობისას ყველა აირის მოლეკულების გადამყვანი მოძრაობის საშუალო კინეტიკური ენერგია ერთნაირია. წნევა პირდაპირპროპორციულია მოლეკულების მთარგმნელობითი მოძრაობის საშუალო კინეტიკური ენერგიისა: 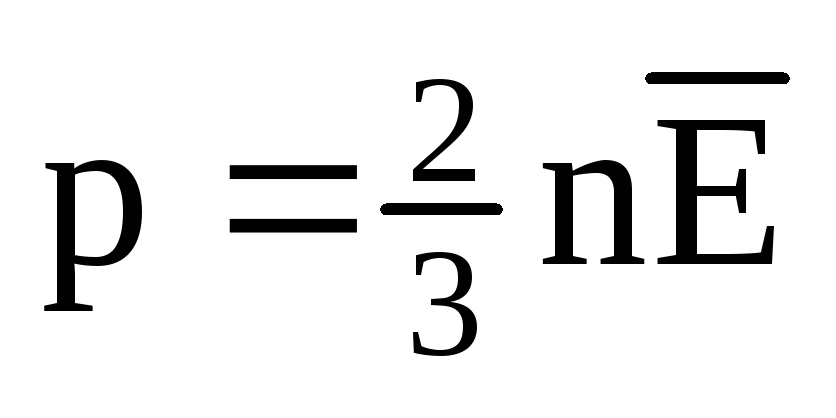 . თერმული წონასწორობის დროს, თუ მოცემული მასის გაზის წნევა და მისი მოცულობა ფიქსირდება, გაზის მოლეკულების საშუალო კინეტიკური ენერგია უნდა ჰქონდეს მკაცრად განსაზღვრული მნიშვნელობა, როგორც ტემპერატურა. იმიტომ რომ
. თერმული წონასწორობის დროს, თუ მოცემული მასის გაზის წნევა და მისი მოცულობა ფიქსირდება, გაზის მოლეკულების საშუალო კინეტიკური ენერგია უნდა ჰქონდეს მკაცრად განსაზღვრული მნიშვნელობა, როგორც ტემპერატურა. იმიტომ რომ 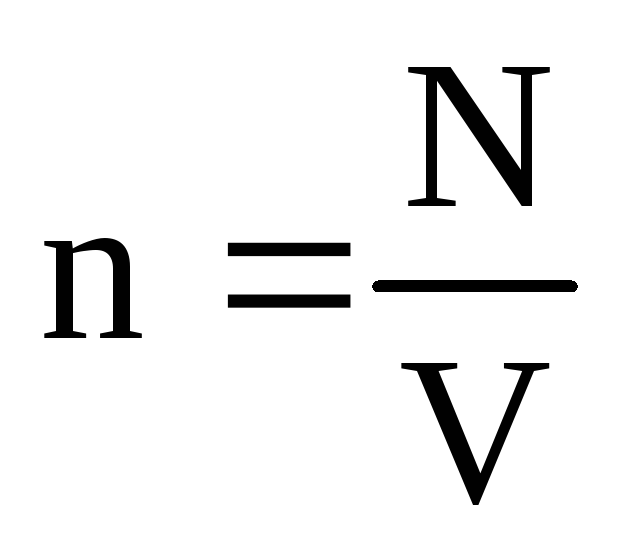 , ეს
, ეს 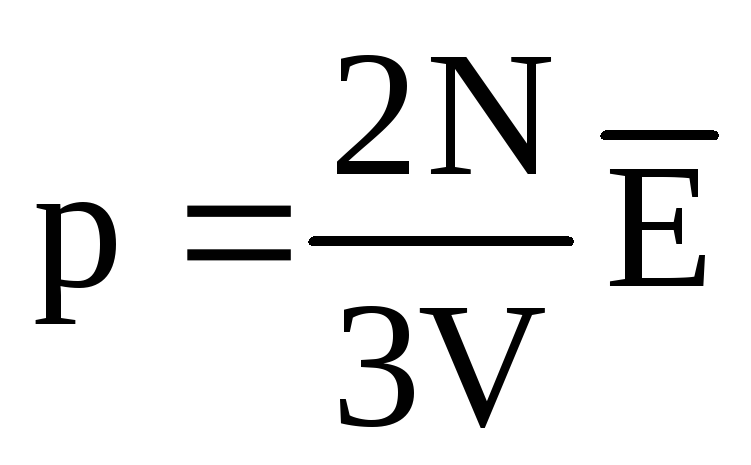 , ან
, ან 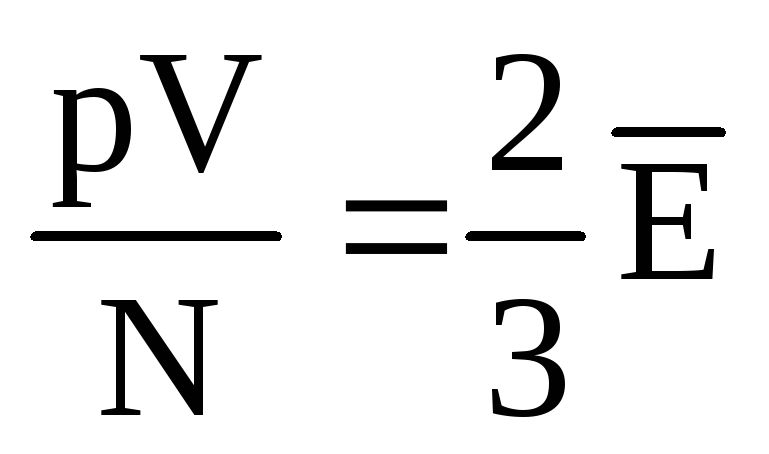 .
.
აღნიშნეთ 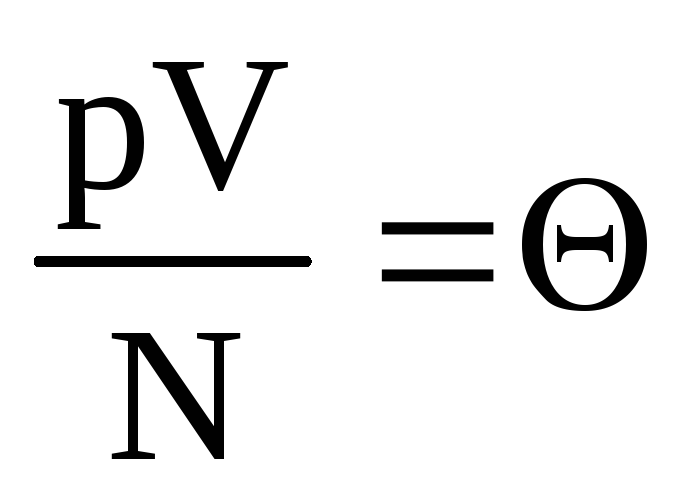 . ღირებულება
. ღირებულება  იზრდება ტემპერატურასთან ერთად და არაფერზეა დამოკიდებული ტემპერატურის გარდა. აქედან გამომდინარე, ის შეიძლება ჩაითვალოს ტემპერატურის ბუნებრივ საზომად.
იზრდება ტემპერატურასთან ერთად და არაფერზეა დამოკიდებული ტემპერატურის გარდა. აქედან გამომდინარე, ის შეიძლება ჩაითვალოს ტემპერატურის ბუნებრივ საზომად.
მოლეკულური კინეტიკური თეორია აღწერს სპეციალური იდეალური ობიექტის ქცევას და თვისებებს, რომელსაც ეწოდება იდეალური გაზი. ეს ფიზიკური მოდელი ემყარება მატერიის მოლეკულურ სტრუქტურას. მოლეკულური თეორიის შექმნა დაკავშირებულია რ. კლაუზიუსის, ჯ. მაქსველის, დ. ჯოულისა და ლ. ბოლცმანის ნაშრომებთან.
იდეალური გაზი. იდეალური აირის მოლეკულურ-კინეტიკური თეორია აგებულია შემდეგ დაშვებებზე:
ატომები და მოლეკულები ჩანს როგორც მატერიალური ქულები, რომლებიც უწყვეტ მოძრაობაში არიან;
გაზის მოლეკულების შინაგანი მოცულობა უმნიშვნელოა ჭურჭლის მოცულობასთან შედარებით;
ყველა ატომი და მოლეკულა გამოირჩევა, ანუ პრინციპში შესაძლებელია თითოეული ნაწილაკების მოძრაობა;
მათ შორის გაზის მოლეკულების შეჯახებამდე არ არსებობს ურთიერთქმედების ძალები და მოლეკულების შეჯახება მათ შორის და ჭურჭლის კედლებთან მიჩნეულია აბსოლუტურად ელასტიური;
გაზის თითოეული ატომის ან მოლეკულის მოძრაობა აღწერილია კლასიკური მექანიკის კანონებით.
იდეალური გაზისთვის მიღებული კანონები შეიძლება გამოყენებულ იქნას რეალური აირების შესწავლისას. ამისათვის იქმნება იდეალური აირის ექსპერიმენტული მოდელები, რომლებშიც რეალური აირის თვისებები ახლოსაა იდეალური აირის თვისებებთან (მაგალითად, დაბალი წნევისა და მაღალი ტემპერატურის დროს).
იდეალური გაზის კანონები
ბოილ-მარიოტის კანონი:
მუდმივ ტემპერატურაზე გაზის მოცემული მასისთვის, გაზის წნევის და მისი მოცულობის პროდუქტი არის მუდმივი მნიშვნელობა: pV = კონსტ , (1.1)
ზე თ = კონსტ , m = კონსტ .
მრუდი, რომელიც აჩვენებს რაოდენობებს შორის ურთიერთობას რდა ვ, ახასიათებს ნივთიერების თვისებებს მუდმივ ტემპერატურაზე და ე.წ იზოთერმი ეს არის ჰიპერბოლა (ნახ. 1.1.) და მუდმივ ტემპერატურაზე მიმდინარე პროცესს იზოთერმული ეწოდება.
გეი-ლუსაკის კანონები:
გაზის მოცემული მასის მოცულობა მუდმივ წნევაზე წრფივად იცვლება ტემპერატურის მიხედვით
V = V 0 (1 + ტ ) ზე P = const , m = კონსტ . (1.2)

გვ = გვ 0 (1 + ტ ) ზე V = კონსტ , m = კონსტ . (1.3)
(1.2) და (1.3) განტოლებებში ტემპერატურა გამოიხატება ცელსიუსის მასშტაბით, წნევა და მოცულობა -
0 С, ხოლო
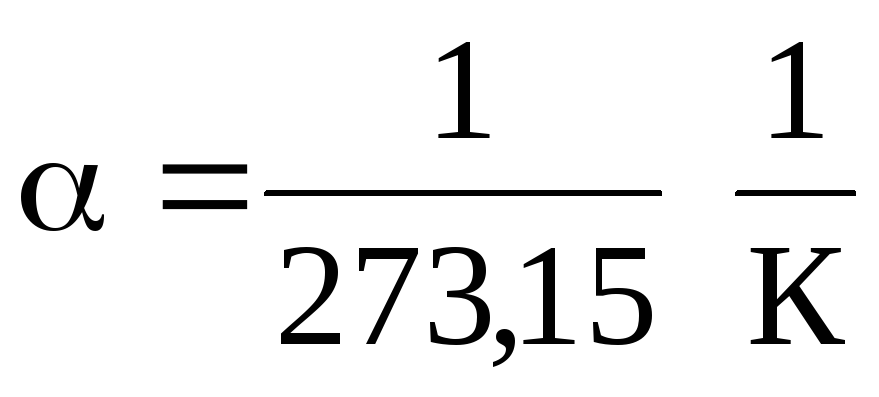 .
.
პროცესს, რომელიც მიმდინარეობს მუდმივი წნევით ეწოდება იზობარული, ის შეიძლება წარმოდგენილი იყოს როგორც წრფივი ფუნქცია (ნახ. 1.2.).
პროცესს, რომელიც მიმდინარეობს მუდმივ მოცულობაში, ეწოდება იზოქორიული(ნახ. 1.3.).
(1.2) და (1.3) განტოლებიდან გამომდინარეობს, რომ იზობარები და იზოქორები კვეთენ ტემპერატურის ღერძს წერტილში. t =1/ \u003d - 273,15 С . თუ საწყისს გადავიტანთ ამ წერტილამდე, მაშინ გადავალთ კელვინის მასშტაბზე.
გაცნობა ფორმულებში (1.2) და (1.3) თერმოდინამიკური ტემპერატურა, გეი-ლუსაკის კანონებს შეიძლება მიეცეს უფრო მოსახერხებელი ფორმა:
ვ = ვ 0 (1+ტ) = = ვ 0 = =ვ 0 თ;
გვ = გვ 0 (1+ტ) = გვ 0 = გვ 0 თ;
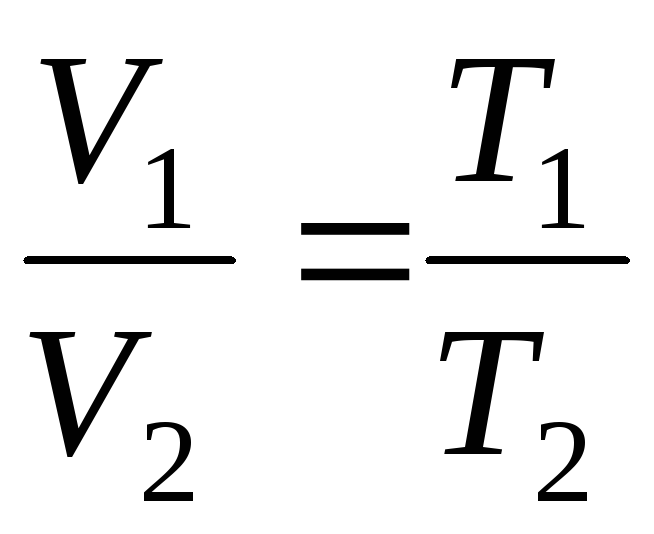 ზე
p=const, m=const
;
(1.4)
ზე
p=const, m=const
;
(1.4)
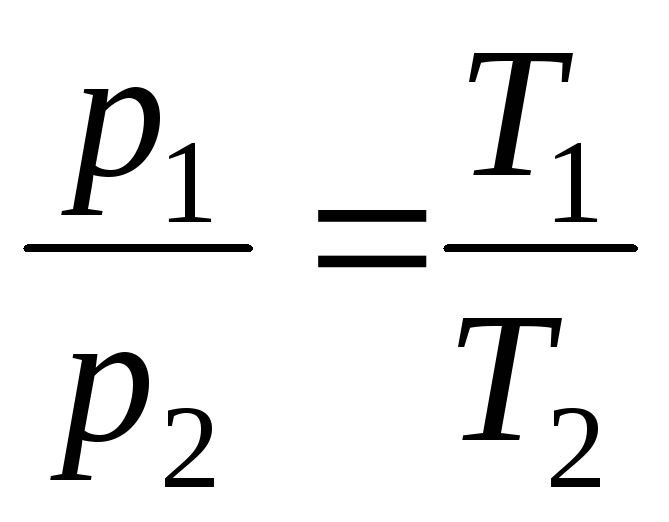 ზე V = const, m = const
,
(1.5)
ზე V = const, m = const
,
(1.5)
სადაც 1 და 2 ინდექსები ეხება თვითნებურ მდგომარეობებს, რომლებიც მდებარეობს იმავე იზობარზე ან იზოკორაზე .
ავოგადროს კანონი:
ნებისმიერი აირის მოლი იმავე ტემპერატურასა და წნევაზე იკავებს ერთსა და იმავე მოცულობას.
ნორმალურ პირობებში ეს მოცულობა უდრის ვ,0 \u003d 22.4110 -3 მ 3 / მოლი . განმარტებით, ერთ მოლში სხვადასხვა ნივთიერებებიშეიცავს მოლეკულების იგივე რაოდენობას, ტოლი მუდმივი ავოგადრო:ნ ა = 6,02210 23 მოლი -1 .
დალტონის კანონი:
სხვადასხვა იდეალური აირების ნარევის წნევა უდრის ნაწილობრივი წნევის ჯამს რ 1 , რ 2 , რ 3 … რ n, მასში შემავალი აირები:
p = p 1 + გვ 2 + რ 3 + …+ გვ ნ .
ნაწილობრივი წნევა – ეს წნევა, რომელსაც გაზი შემადგენლობაში გამოიმუშავებს გაზის ნარევითუ ის მარტო იკავებდა იმავე ტემპერატურაზე ნარევის მოცულობის ტოლ მოცულობას.
მდგომარეობის იდეალური გაზის განტოლება
(კლაპეირონ-მენდელეევის განტოლება)
არსებობს გარკვეული კავშირი ტემპერატურას, მოცულობასა და წნევას შორის. ეს ურთიერთობა შეიძლება წარმოდგენილი იყოს ფუნქციური დამოკიდებულებით:
f(p, V, T)= 0.
თავის მხრივ, თითოეული ცვლადი ( პ, ვ, ტ) არის ორი სხვა ცვლადის ფუნქცია. ნივთიერების თითოეული ფაზის მდგომარეობისთვის (მყარი, თხევადი, აირისებრი) ფუნქციური დამოკიდებულების ტიპი გვხვდება ექსპერიმენტულად. ეს ძალიან შრომატევადი პროცესია და მდგომარეობის განტოლება დადგენილია მხოლოდ იშვიათ მდგომარეობაში მყოფ გაზებზე და ზოგიერთი შეკუმშული გაზისთვის მიახლოებითი ფორმით. ნივთიერებებისთვის, რომლებიც არ არიან აირისებრ მდგომარეობაში, ეს პრობლემა ჯერ არ არის მოგვარებული.
ფრანგმა ფიზიკოსმა ბ.კლაპეირონმა მოიყვანა მდგომარეობის იდეალური გაზის განტოლებაბოილ-მარიოტის, გეი-ლუსაკის, ჩარლზის კანონების შერწყმით:
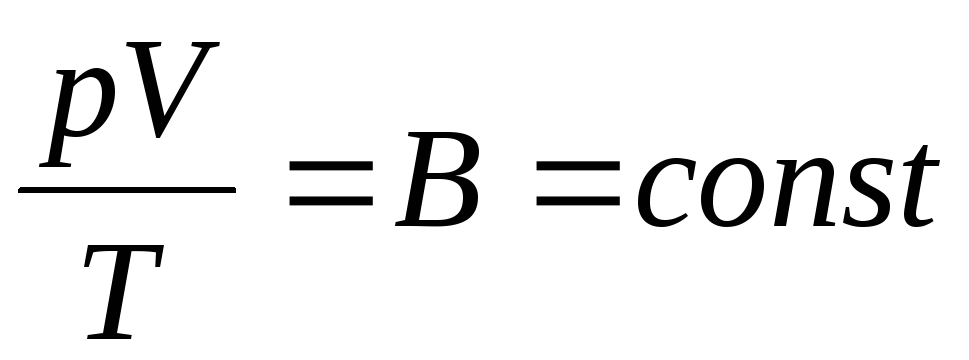 . (1.6)
. (1.6)
გამოხატულება (1.6) არის კლაპეირონის განტოლება, სადაც INარის გაზის მუდმივი. განსხვავებულია სხვადასხვა გაზისთვის.
DI. მენდელეევმა გააერთიანა კლაპეირონის განტოლება ავოგადროს კანონთან, მიუთითა განტოლება (1.6) ერთ მოლზე და გამოიყენა მოლური მოცულობა. ვ . ავოგადროს კანონის მიხედვით იგივე რდა თყველა აირის მოლი იკავებს ერთსა და იმავე მოლარულ მოცულობას ვ .
.
ამიტომ, მუდმივი INიგივე იქნება ყველა იდეალური გაზისთვის. ეს მუდმივი ჩვეულებრივ აღინიშნება რდა ტოლია რ=
8,31
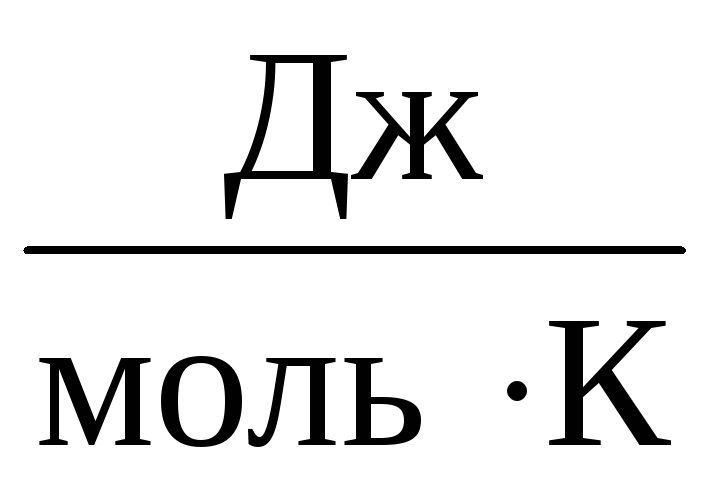 .
.
კლაპეირონ-მენდელეევის განტოლება აქვს შემდეგი ფორმა:
გვ ვ . = R T.
ერთი მოლი გაზისთვის (1.7) განტოლებიდან შეიძლება გადასვლა კლაპეირონ-მენდელეევის განტოლება აირის თვითნებური მასისთვის:
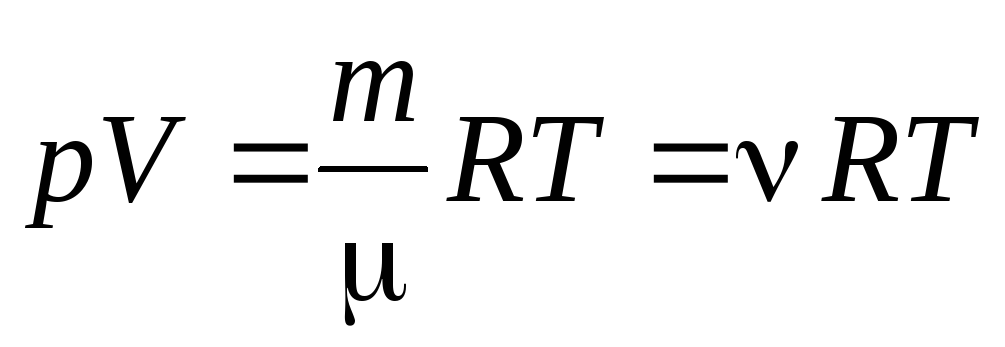 , (1.7)
, (1.7)
სად
–
მოლური მასა
(ერთი მოლი ნივთიერების მასა კგ/მოლი); მ
გაზის მასა;
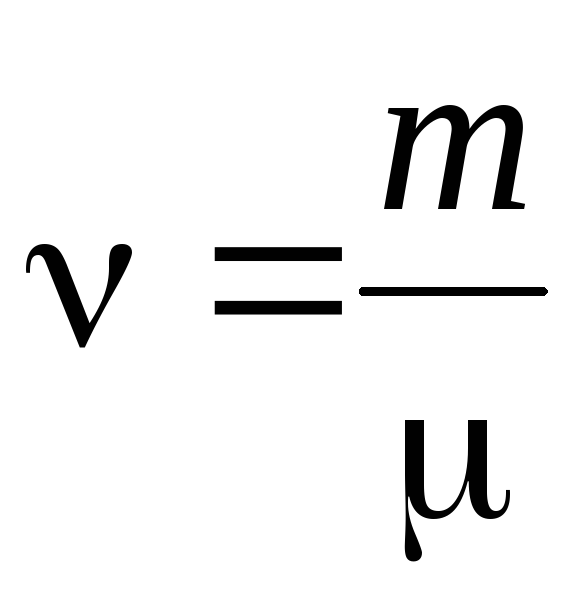 - მატერიის რაოდენობა .
- მატერიის რაოდენობა .
უფრო ხშირად, იდეალური აირის მდგომარეობის განტოლების სხვა ფორმა გამოიყენება, დანერგვა ბოლცმანის მუდმივი: 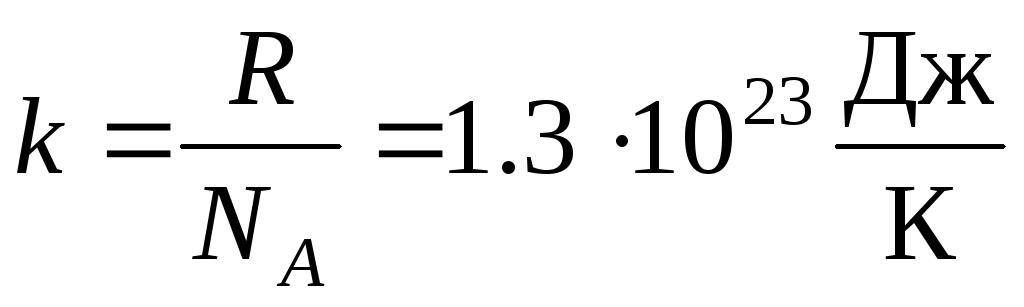 .
.
მაშინ განტოლება (1.7) ასე გამოიყურება:
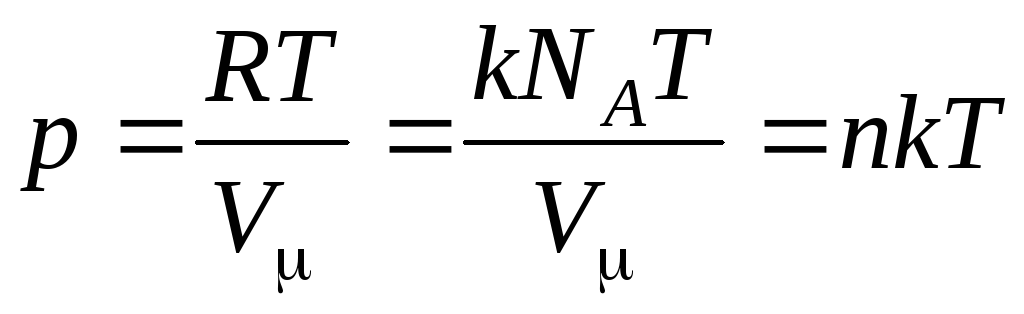 ,
(1.8)
,
(1.8)
სად
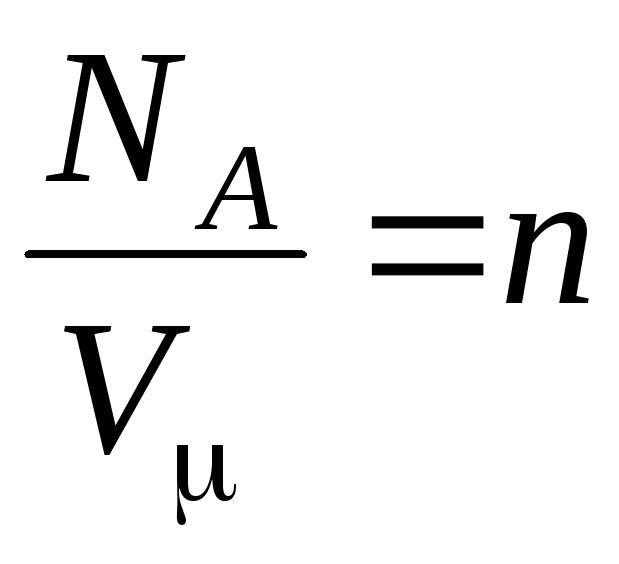 –
მოლეკულების კონცენტრაცია (მოლეკულების რაოდენობა მოცულობის ერთეულზე). ამ გამოთქმიდან გამომდინარეობს, რომ იდეალური აირის წნევა პირდაპირპროპორციულია მისი მოლეკულების კონცენტრაციისა ან გაზის სიმკვრივისა. ერთსა და იმავე ტემპერატურასა და წნევაზე, ყველა აირი შეიცავს მოლეკულების ერთსა და იმავე რაოდენობას მოცულობის ერთეულზე. ნორმალურ პირობებში 1 მ 3-ში შემავალი მოლეკულების რაოდენობას ეწოდება
ლოშმიდტის ნომერი:
–
მოლეკულების კონცენტრაცია (მოლეკულების რაოდენობა მოცულობის ერთეულზე). ამ გამოთქმიდან გამომდინარეობს, რომ იდეალური აირის წნევა პირდაპირპროპორციულია მისი მოლეკულების კონცენტრაციისა ან გაზის სიმკვრივისა. ერთსა და იმავე ტემპერატურასა და წნევაზე, ყველა აირი შეიცავს მოლეკულების ერთსა და იმავე რაოდენობას მოცულობის ერთეულზე. ნორმალურ პირობებში 1 მ 3-ში შემავალი მოლეკულების რაოდენობას ეწოდება
ლოშმიდტის ნომერი:
ნ ლ = 2.68 10 25 მ -3.
მოლეკულური კინეტიკური ძირითადი განტოლება
იდეალური გაზების თეორია
ყველაზე მნიშვნელოვანი ამოცანა აირების კინეტიკური თეორია არის იდეალური გაზის წნევის თეორიული გამოთვლა მოლეკულური კინეტიკური ცნებების საფუძველზე. იდეალური აირების მოლეკულური კინეტიკური თეორიის ძირითადი განტოლება მიღებულია გამოყენებით სტატისტიკური მეთოდები.
ვარაუდობენ, რომ გაზის მოლეკულები მოძრაობენ შემთხვევით, გაზის მოლეკულებს შორის ურთიერთშეჯახების რაოდენობა უმნიშვნელოა გემის კედლებზე ზემოქმედების რაოდენობასთან შედარებით და ეს შეჯახებები აბსოლუტურად ელასტიურია. ჭურჭლის კედელზე რაღაც ელემენტარული ფართობი სდა გამოთვალეთ წნევა, რომელსაც აირის მოლეკულები მოახდენენ ამ ზონაზე.
გასათვალისწინებელია ის ფაქტი, რომ რეალურად მოლეკულებს შეუძლიათ ადგილზე გადაადგილება სხვადასხვა კუთხით და შეიძლება ჰქონდეთ სხვადასხვა სიჩქარით, რაც, უფრო მეტიც, შეიძლება შეიცვალოს ყოველი შეჯახებისას. თეორიულ გამოთვლებში, მოლეკულების ქაოტური მოძრაობა იდეალიზებულია, ისინი იცვლება მოძრაობით სამი ერთმანეთის პერპენდიკულარული მიმართულებით.
თუ განვიხილავთ კუბის სახით ჭურჭელს, რომელშიც ნგაზის მოლეკულები ექვსი მიმართულებით, ადვილი დასანახია, რომ ნებისმიერ მომენტში ყველა მოლეკულის რაოდენობის 1/3 მოძრაობს თითოეული მათგანის გასწვრივ, ხოლო მათი ნახევარი (ანუ ყველა მოლეკულის რაოდენობის 1/6) მოძრაობს ერთი მიმართულებით, ხოლო მეორე ნახევარი (ასევე 1/6) - საპირისპირო მიმართულებით. ყოველი შეჯახებისას ცალკეული მოლეკულა, რომელიც მოძრაობს უბნის პერპენდიკულარულად, ირეკლავს, გადასცემს მას იმპულსს, ხოლო მისი იმპულსი (იმპულსი) იცვლება ოდენობით.
რ 1 =მ 0 ვ – (– მ 0 ვ) = 2 მ 0 ვ.
ადგილზე მოცემული მიმართულებით მოძრავი მოლეკულების ზემოქმედების რაოდენობა ტოლი იქნება: ნ = 1/6 ნ სვტ. პლატფორმასთან შეჯახებისას ეს მოლეკულები მას იმპულსს გადასცემენ.
პ= ნ პ 1 =2 მ 0 ვნსვt= m 0 ვ 2 ნსტ,
სად ნარის მოლეკულების კონცენტრაცია. მაშინ წნევა, რომელსაც გაზი ახდენს ჭურჭლის კედელზე, ტოლი იქნება:
p = 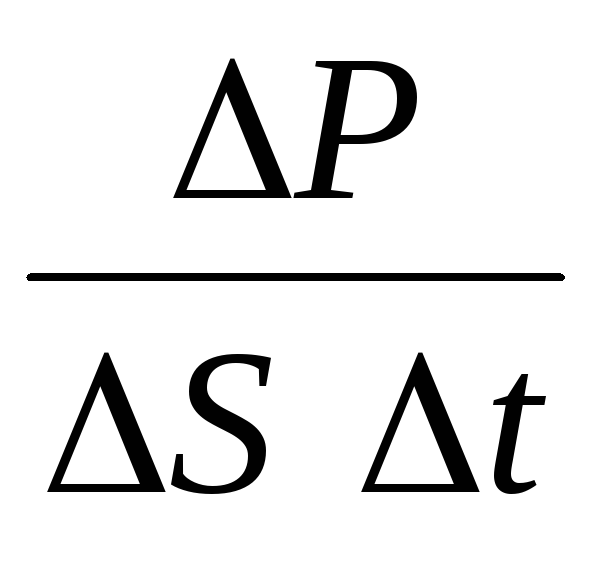 =
ნ მ 0
ვ 2
.
(1.9)
=
ნ მ 0
ვ 2
.
(1.9)
თუმცა, გაზის მოლეკულები მოძრაობენ სხვადასხვა სიჩქარით: ვ 1 , ვ 2 , …,ვ ნასე რომ, სიჩქარეები უნდა იყოს საშუალოდ. გაზის მოლეკულების სიჩქარის კვადრატების ჯამი, გაყოფილი მათ რიცხვზე, განსაზღვრავს ფესვის საშუალო კვადრატულ სიჩქარეს:
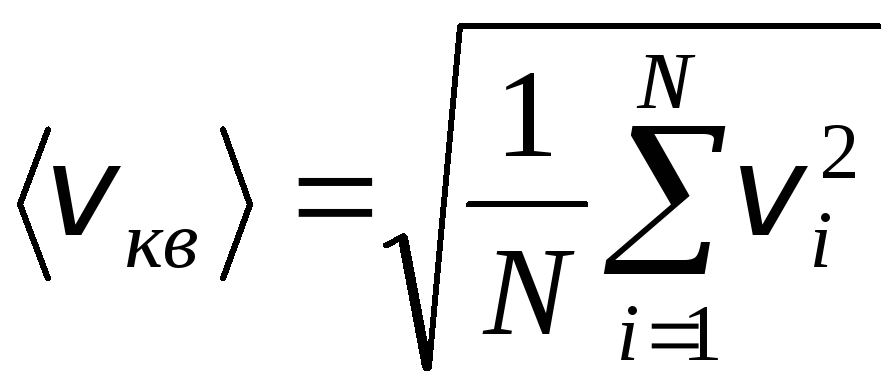 .
.
განტოლება (1.9) მიიღებს ფორმას:
![]() (1.10)
(1.10)
გამოთქმა (1.10) ეწოდება მოლეკულური კინეტიკური თეორიის ძირითადი განტოლებაიდეალური აირები.
Იმის გათვალისწინებით, რომ 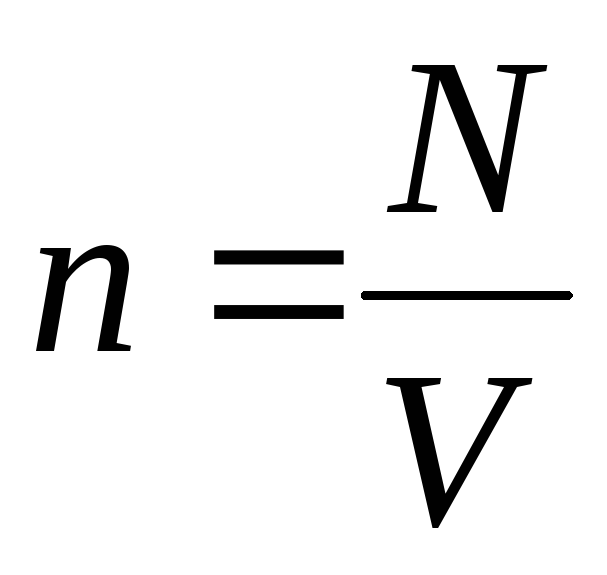 , ვიღებთ:
, ვიღებთ:
p V = N 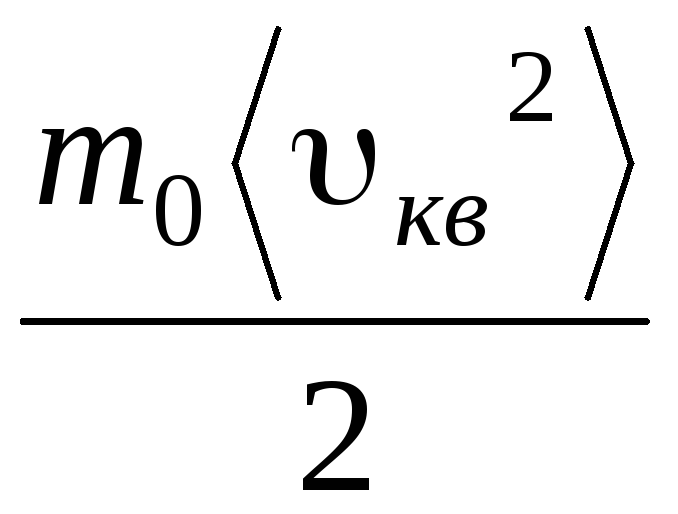 =ე,
(1.11)
=ე,
(1.11)
სად ეარის ყველა გაზის მოლეკულის მთარგმნელობითი მოძრაობის მთლიანი კინეტიკური ენერგია. ამრიგად, გაზის წნევა პირდაპირპროპორციულია აირის მოლეკულების მთარგმნელობითი მოძრაობის კინეტიკურ ენერგიასთან.
ერთი მოლი გაზისთვის მ = და კლაპეირონ-მენდელეევის განტოლებას აქვს შემდეგი ფორმა:
გვ V . = რ ტ,
და ვინაიდან (1.11)-დან გამომდინარეობს, რომ გვ V . = ვ კვ. 2, ვიღებთ:
R.T.= ვ კვ. 2 .
აქედან გამომდინარე, გაზის მოლეკულების ფესვის საშუალო კვადრატული სიჩქარე უდრის
ვ
კვ.
=
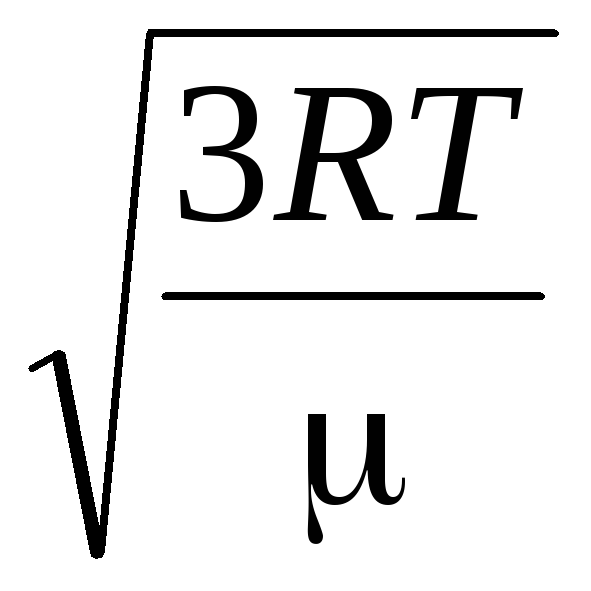 =
=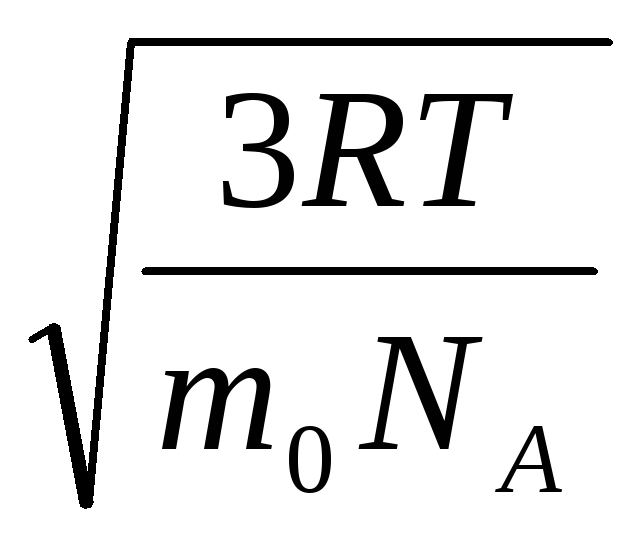 =
= ,
,
სად კ = რ/ნ ა = 1.3810 -23 J/K – ბოლცმანის მუდმივი. აქედან შეგიძლიათ იპოვოთ ჟანგბადის მოლეკულების საშუალო კვადრატული სიჩქარე ოთახის ტემპერატურაზე - 480 მ/წმ, წყალბადის - 1900 მ/წმ.
ტემპერატურის მოლეკულურ-კინეტიკური მნიშვნელობა
ტემპერატურა არის რაოდენობრივი საზომი იმისა, თუ რამდენად ცხელია სხეული. აბსოლუტური თერმოდინამიკური ტემპერატურის ფიზიკური მნიშვნელობის გასარკვევად თშევადაროთ აირების მოლეკულურ-კინეტიკური თეორიის (1.14) ძირითადი განტოლება კლაპეირონ-მენდელეევის განტოლებას. გვვ = რ.ტ.
ამ განტოლებების სწორი ნაწილების გათანაბრებისას, ჩვენ ვპოულობთ ერთი მოლეკულის კინეტიკური ენერგიის საშუალო მნიშვნელობას 0 ( = ნ/ნ ა , კ=რ/ნ ა):
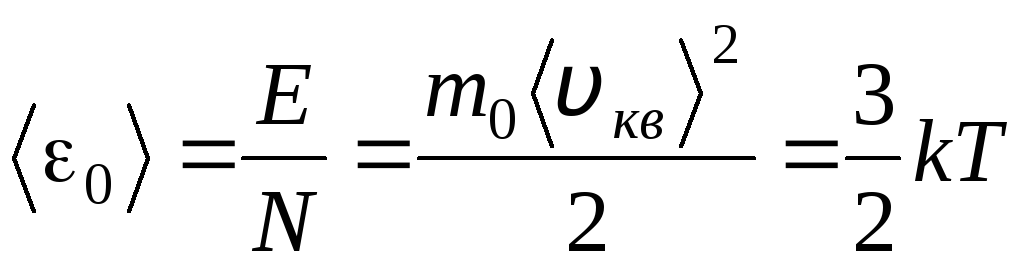 .
.
მოლეკულური კინეტიკური თეორიის ყველაზე მნიშვნელოვანი დასკვნა ამ განტოლებიდან გამომდინარეობს: იდეალური აირის ერთი მოლეკულის მთარგმნელობითი მოძრაობის საშუალო კინეტიკური ენერგია დამოკიდებულია მხოლოდ ტემპერატურაზე, მაშინ როცა ის პირდაპირპროპორციულია თერმოდინამიკური ტემპერატურისა. ამრიგად, თერმოდინამიკური ტემპერატურის მასშტაბი იძენს პირდაპირ ფიზიკურ მნიშვნელობას: ზე თ= 0 იდეალური აირის მოლეკულების კინეტიკური ენერგია ნულია. ამიტომ, ამ თეორიიდან გამომდინარე, გაზის მოლეკულების მთარგმნელობითი მოძრაობა შეჩერდება და მისი წნევა ნულის ტოლი გახდება.
იდეალური აირის წონასწორობის თვისებების თეორია
მოლეკულების თავისუფლების ხარისხების რაოდენობა. იდეალური აირების მოლეკულურ-კინეტიკური თეორია იწვევს ძალიან მნიშვნელოვან შედეგს: აირის მოლეკულები მოძრაობენ შემთხვევით, ხოლო მოლეკულის გადაადგილების მოძრაობის საშუალო კინეტიკური ენერგია განისაზღვრება მხოლოდ ტემპერატურით.
მოლეკულური მოძრაობის კინეტიკური ენერგია კინეტიკურით არ ამოიწურება წინ მოძრაობის ენერგია: ის ასევე შედგება კინეტიკისგან ენერგიები როტაციადა რყევებიმოლეკულები. ყველა სახის მოლეკულურ მოძრაობაში გადამავალი ენერგიის გამოსათვლელად აუცილებელია განვსაზღვროთ თავისუფლების ხარისხების რაოდენობა.
ქვეშ თავისუფლების ხარისხების რაოდენობა (მე) სხეულის იგულისხმება დამოუკიდებელი კოორდინატების რაოდენობა, რომელიც უნდა იყოს შეყვანილი სხეულის პოზიციის დასადგენად სივრცეში.
ჰ  მაგალითად, მატერიალურ წერტილს აქვს თავისუფლების სამი ხარისხი, რადგან მისი პოზიცია სივრცეში განისაზღვრება სამი კოორდინატით: x, yდა ზ. ამრიგად, ერთატომურ მოლეკულას აქვს მთარგმნელობითი მოძრაობის თავისუფლების სამი ხარისხი.
მაგალითად, მატერიალურ წერტილს აქვს თავისუფლების სამი ხარისხი, რადგან მისი პოზიცია სივრცეში განისაზღვრება სამი კოორდინატით: x, yდა ზ. ამრიგად, ერთატომურ მოლეკულას აქვს მთარგმნელობითი მოძრაობის თავისუფლების სამი ხარისხი.
დ 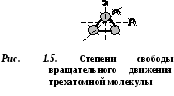 ბუკატომურ მოლეკულას აქვს თავისუფლების 5 გრადუსი (ნახ. 1.4): 3 გრადუსი მთარგმნელობითი მოძრაობის თავისუფლება და 2 გრადუსი ბრუნვითი მოძრაობის თავისუფლება.
ბუკატომურ მოლეკულას აქვს თავისუფლების 5 გრადუსი (ნახ. 1.4): 3 გრადუსი მთარგმნელობითი მოძრაობის თავისუფლება და 2 გრადუსი ბრუნვითი მოძრაობის თავისუფლება.
სამი ან მეტი ატომის მოლეკულებს აქვთ თავისუფლების 6 გრადუსი: ტრანსლაციის მოძრაობის 3 გრადუსი და ბრუნვის მოძრაობის 3 გრადუსი (ნახ. 1.5).
გაზის თითოეულ მოლეკულას აქვს თავისუფლების გარკვეული ხარისხი, რომელთაგან სამი შეესაბამება მის მთარგმნელობით მოძრაობას.
დებულება ენერგიის თანაბარი განაწილების შესახებ
თავისუფლების ხარისხით
აირების მოლეკულურ-კინეტიკური თეორიის ძირითადი საფუძველია მოლეკულების მოძრაობაში სრული შემთხვევითობის დაშვება. ეს ეხება როგორც რხევად, ისე ბრუნვის მოძრაობებს და არა მხოლოდ მთარგმნელობით. ვარაუდობენ, რომ აირში მოლეკულების მოძრაობის ყველა მიმართულება თანაბრად სავარაუდოა. მაშასადამე, შეიძლება ვივარაუდოთ, რომ მოლეკულის თავისუფლების თითოეულ ხარისხზე, საშუალოდ, არის ენერგიის იგივე რაოდენობა - ეს არის პოზიცია ენერგიის თანაბარ გადანაწილებაზე თავისუფლების ხარისხებზე. ენერგია მოლეკულის თავისუფლების ერთ გრადუსზე არის:
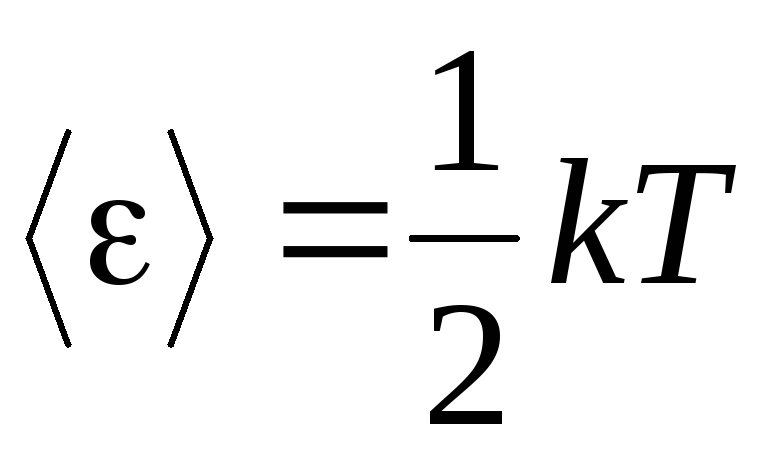 . (1.12)
. (1.12)
თუ მოლეკულას აქვს მეთავისუფლების ხარისხი, მაშინ თავისუფლების თითოეული ხარისხისთვის არის საშუალოდ:
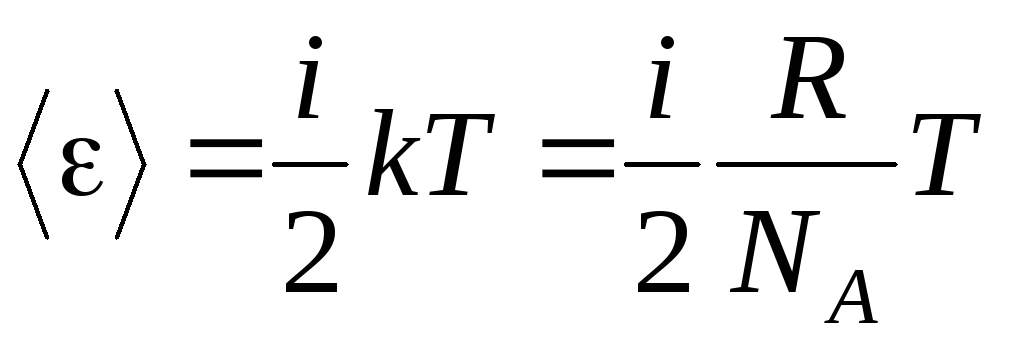 .
(1.13)
.
(1.13)
იდეალური გაზის შიდა ენერგია
თუ გაზის შიდა ენერგიის მთლიან მიწოდებას მივაწერთ ერთ მოლს, მაშინ მის მნიშვნელობას მივიღებთ ავოგადროს რიცხვზე გამრავლებით:
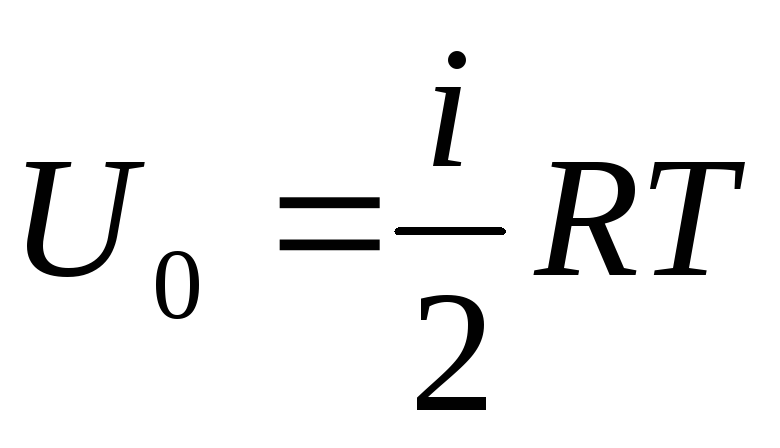 .
(1.14)
.
(1.14)
აქედან გამომდინარეობს, რომ იდეალური აირის ერთი მოლის შიდა ენერგია დამოკიდებულია მხოლოდ ტემპერატურაზე და გაზის მოლეკულების თავისუფლების ხარისხზე.
მაქსველისა და ბოლცმანის განაწილებები
იდეალური აირის მოლეკულების განაწილება თერმული მოძრაობის სიჩქარისა და ენერგიების მიხედვით (მაქსველის განაწილება). გაზის მუდმივ ტემპერატურაზე, მოლეკულური მოძრაობის ყველა მიმართულება ითვლება თანაბრად სავარაუდო. ამ შემთხვევაში, თითოეული მოლეკულის ფესვის საშუალო კვადრატული სიჩქარე მუდმივი რჩება და უდრის
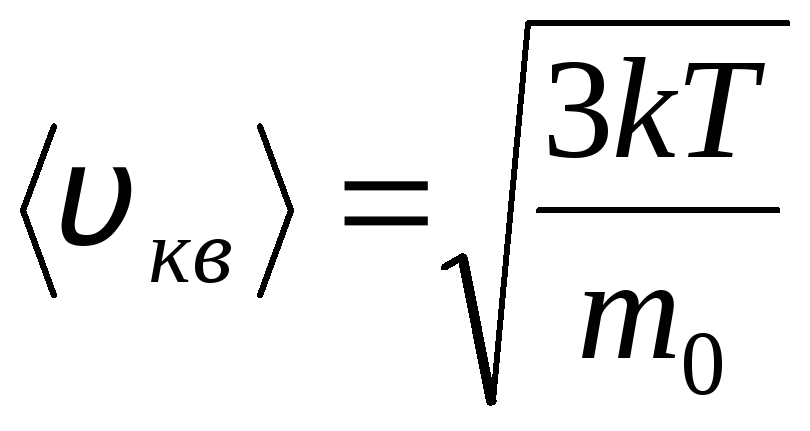 .
.
ეს აიხსნება იმით, რომ იდეალურ აირში, რომელიც წონასწორობის მდგომარეობაშია, დადგენილია მოლეკულების გარკვეული სტაციონარული სიჩქარის განაწილება, რომელიც დროთა განმავლობაში არ იცვლება. ეს განაწილება ექვემდებარება გარკვეულ სტატისტიკურ კანონს, რომელიც თეორიულად გამოიტანა ჯ. მაქსველმა. მაქსველის კანონი აღწერილია ფუნქციით
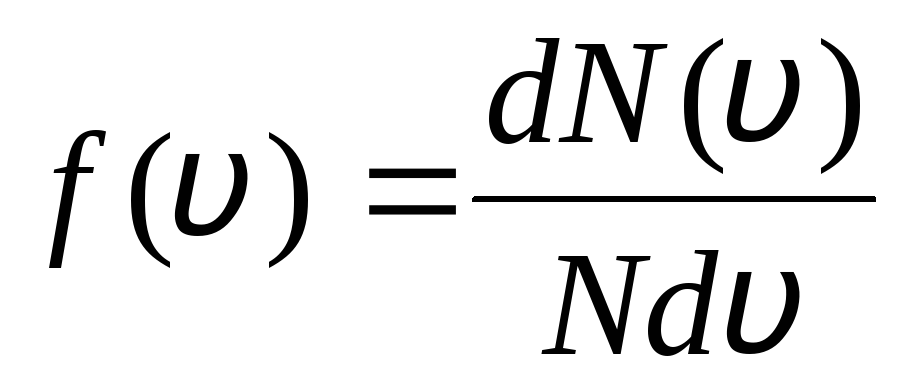 ,
,
ეს არის ფუნქცია ვ(ვ) განსაზღვრავს მოლეკულების ფარდობით რაოდენობას  , რომლის სიჩქარეები მდგომარეობს დან ინტერვალში ვ
ადრე ვ+დვ. ალბათობის თეორიის მეთოდების გამოყენებით მაქსველმა აღმოაჩინა იდეალური აირის მოლეკულების განაწილების კანონი სიჩქარის მიხედვით:
, რომლის სიჩქარეები მდგომარეობს დან ინტერვალში ვ
ადრე ვ+დვ. ალბათობის თეორიის მეთოდების გამოყენებით მაქსველმა აღმოაჩინა იდეალური აირის მოლეკულების განაწილების კანონი სიჩქარის მიხედვით:
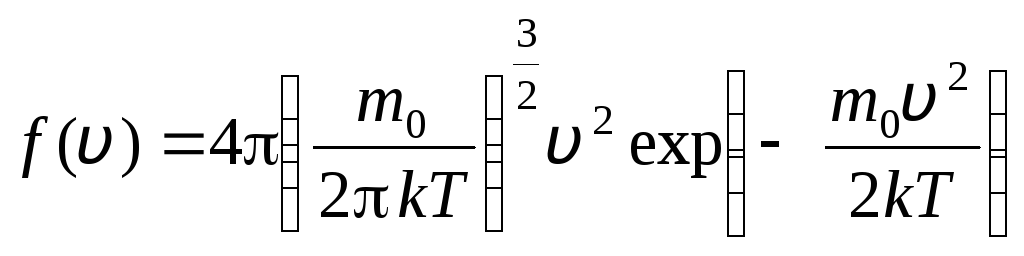 . (1.15)
. (1.15)
განაწილების ფუნქცია გრაფიკულად არის ნაჩვენები ნახ. 1.6. განაწილების მრუდით და x ღერძით შემოსაზღვრული ფართობი უდრის ერთს. ეს ნიშნავს, რომ ფუნქცია ვ(ვ) აკმაყოფილებს ნორმალიზაციის პირობას:
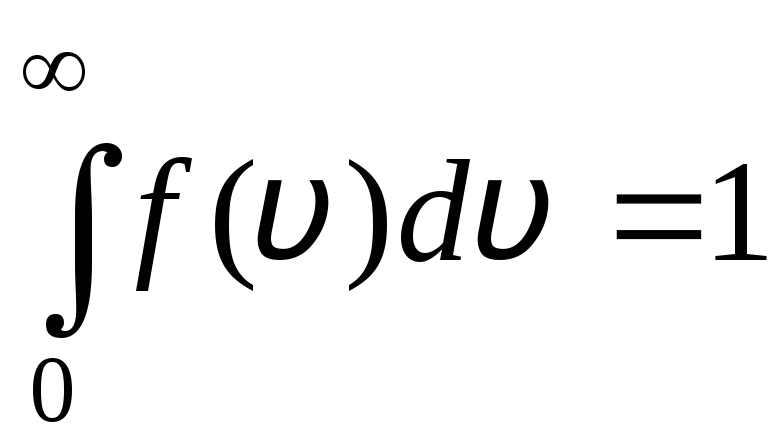 .
.
თან  სიჩქარე, რომლის დროსაც იდეალური აირის მოლეკულების განაწილების ფუნქციაა სიჩქარის მიხედვით ვ(ვ) არის მაქსიმალური, ე.წ უფრო მეტად სავარაუდოა
სიჩქარე
ვ ბ .
სიჩქარე, რომლის დროსაც იდეალური აირის მოლეკულების განაწილების ფუნქციაა სიჩქარის მიხედვით ვ(ვ) არის მაქსიმალური, ე.წ უფრო მეტად სავარაუდოა
სიჩქარე
ვ ბ .
ღირებულებები ვ = 0 და ვ = შეესაბამება გამოხატვის მინიმუმს (1.15). ყველაზე სავარაუდო სიჩქარის პოვნა შესაძლებელია გამოხატვის (1.23) დიფერენცირებით და მისი ნულთან გათანაბრებით:
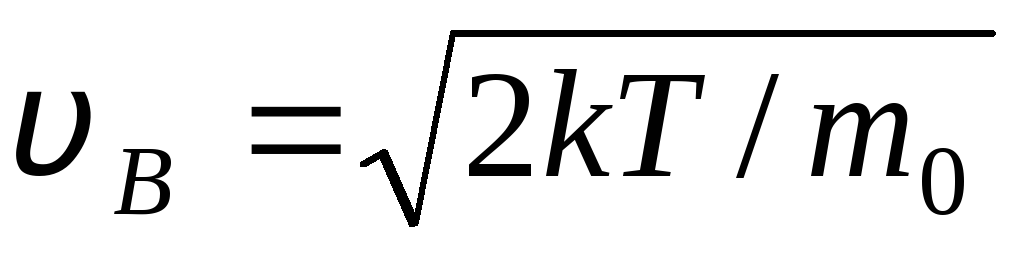 =
=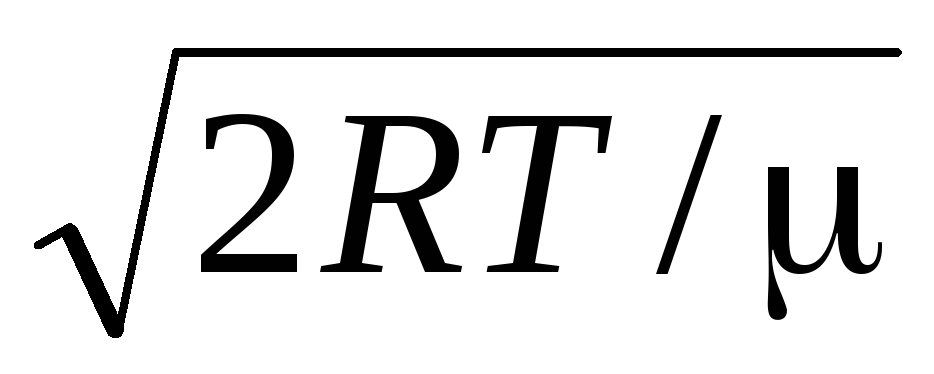 =
1,41
=
1,41
ტემპერატურის მატებასთან ერთად ფუნქციის მაქსიმუმი გადაინაცვლებს მარჯვნივ (ნახ. 1.6), ანუ ტემპერატურის მატებასთან ერთად იზრდება ყველაზე სავარაუდო სიჩქარეც, თუმცა მრუდით შემოსაზღვრული ფართობი უცვლელი რჩება. უნდა აღინიშნოს, რომ აირებში და დაბალ ტემპერატურაზე ყოველთვის არის მცირე რაოდენობით მოლეკულები, რომლებიც მოძრაობენ მაღალი სიჩქარით. ასეთი „ცხელი“ მოლეკულების არსებობა აქვს დიდი მნიშვნელობამრავალი პროცესის დროს.
საშუალო არითმეტიკული სიჩქარემოლეკულები განისაზღვრება ფორმულით
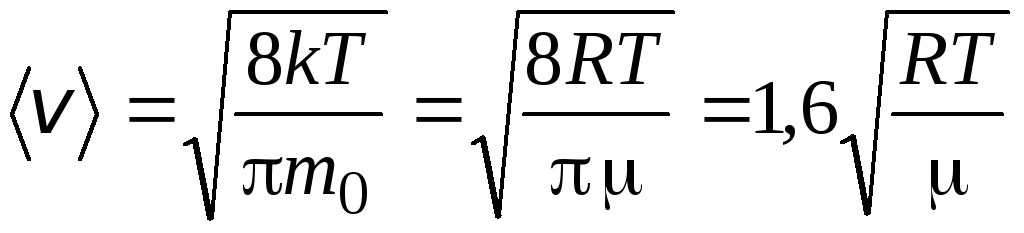 .
.
ფესვის საშუალო კვადრატული სიჩქარე
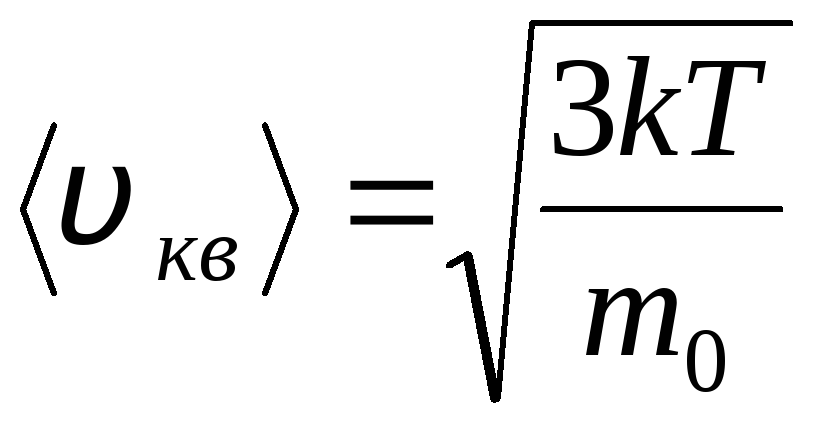 =
1,73
=
1,73 .
.
ამ სიჩქარის თანაფარდობა არ არის დამოკიდებული ტემპერატურაზე ან გაზის ტიპზე.
მოლეკულების განაწილების ფუნქცია თერმული მოძრაობის ენერგიებით. ამ ფუნქციის მიღება შესაძლებელია სიჩქარის ნაცვლად კინეტიკური ენერგიის მნიშვნელობის ჩანაცვლებით მოლეკულების განაწილების განტოლებაში (1.15):
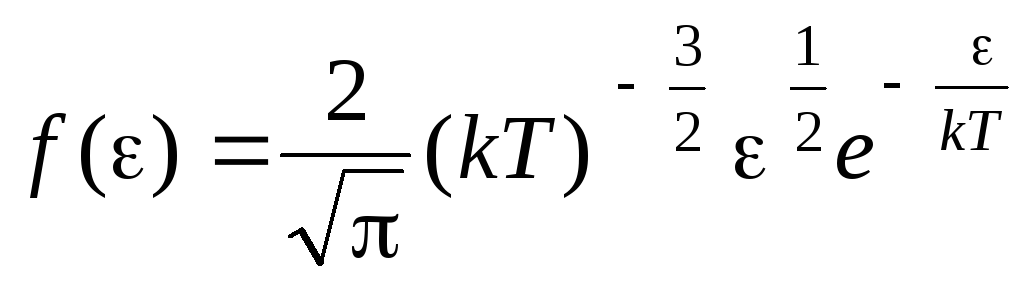 .
.
ენერგეტიკულ მნიშვნელობებზე გამოხატვის ინტეგრირება  ადრე
ადრე 
 , ვიღებთ საშუალო კინეტიკური ენერგიაიდეალური გაზის მოლეკულები:
, ვიღებთ საშუალო კინეტიკური ენერგიაიდეალური გაზის მოლეკულები:
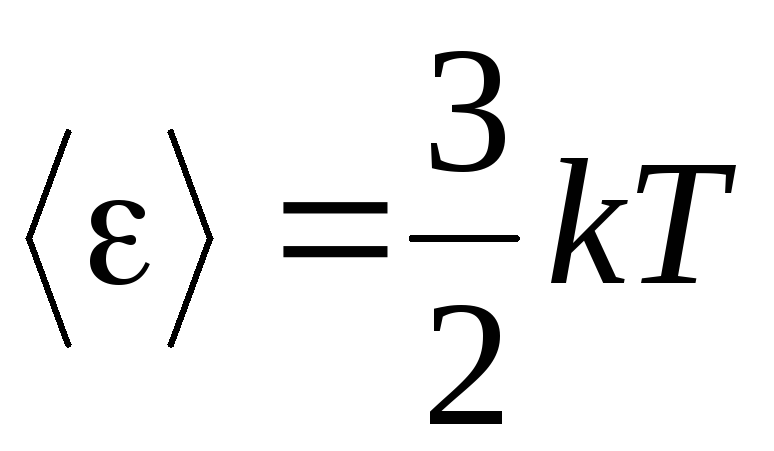 .
.
ბარომეტრული ფორმულა. ბოლცმანის განაწილება. აირების მოლეკულური კინეტიკური თეორიის ძირითადი განტოლების გამოყვანისას და მოლეკულების მაქსველის განაწილების სიჩქარეების მიხედვით, ვარაუდობდნენ, რომ იდეალური აირის მოლეკულებზე გავლენას არ ახდენს გარე ძალები, ამიტომ მოლეკულები ერთნაირად ნაწილდება მთელ მოცულობაში. თუმცა, ნებისმიერი გაზის მოლეკულები დედამიწის გრავიტაციულ ველშია. სიმაღლეზე წნევის დამოკიდებულების კანონის გამოყვანისას, ვარაუდობენ, რომ გრავიტაციული ველი ერთგვაროვანია, ტემპერატურა მუდმივია და ყველა მოლეკულის მასა ერთნაირია:
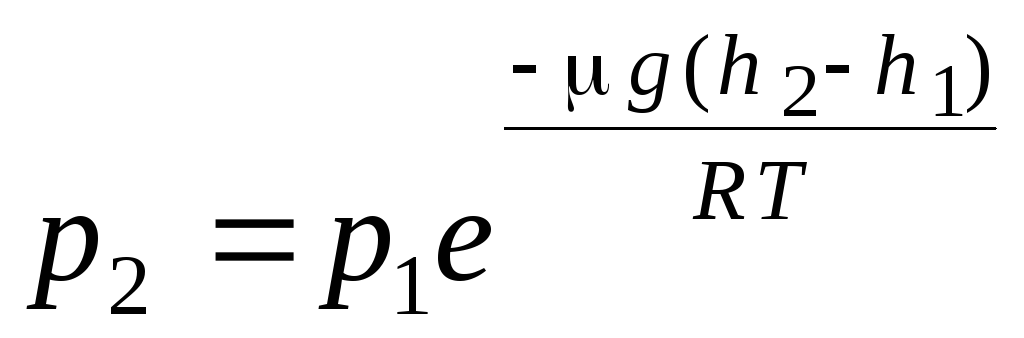 . (1.16)
. (1.16)
გამოთქმა (1.16) ეწოდება ბარომეტრული ფორმულა. ის საშუალებას გაძლევთ იპოვოთ ატმოსფერული წნევა სიმაღლის მიხედვით, ან წნევის გაზომვით შეგიძლიათ იპოვოთ სიმაღლე. იმიტომ რომ თ 1 არის სიმაღლე ზღვის დონიდან, სადაც წნევა ნორმალურად ითვლება, მაშინ გამოთქმა შეიძლება შეიცვალოს:
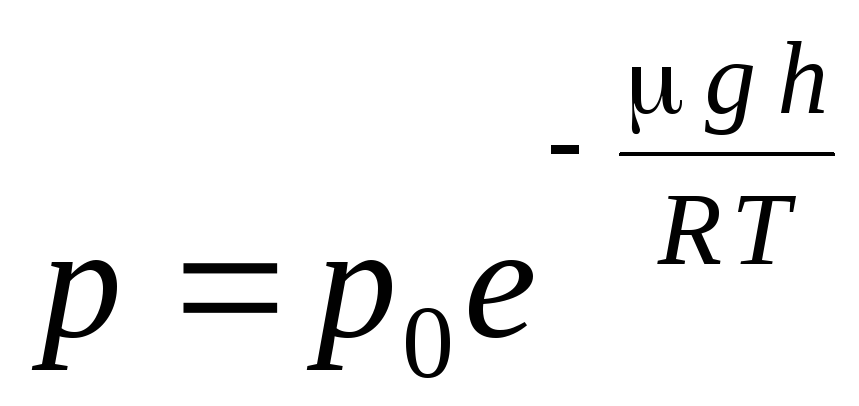 .
.
ბარომეტრული ფორმულა შეიძლება გარდაიქმნას გამოხატვის გამოყენებით p = nkT:
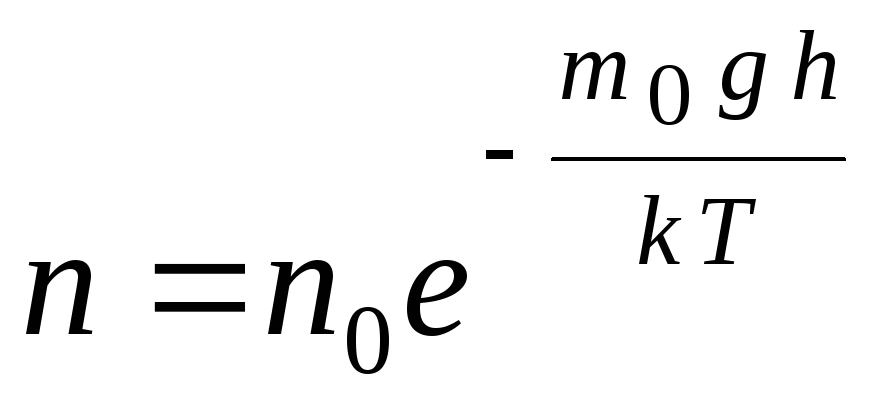 ,
,
გ  დე ნ
–
მოლეკულების კონცენტრაცია სიმაღლეზე თ,
მ 0
ღ=პ–
მოლეკულის პოტენციური ენერგია გრავიტაციულ ველში. მუდმივ ტემპერატურაზე გაზის სიმკვრივე უფრო დიდია იქ, სადაც მოლეკულის პოტენციური ენერგია დაბალია. გრაფიკულად, ნაწილაკების რაოდენობის შემცირების კანონი სიმაღლით ერთეულ მოცულობაზე გამოიყურება, როგორც ნაჩვენებია ნახ. 1.7.
დე ნ
–
მოლეკულების კონცენტრაცია სიმაღლეზე თ,
მ 0
ღ=პ–
მოლეკულის პოტენციური ენერგია გრავიტაციულ ველში. მუდმივ ტემპერატურაზე გაზის სიმკვრივე უფრო დიდია იქ, სადაც მოლეკულის პოტენციური ენერგია დაბალია. გრაფიკულად, ნაწილაკების რაოდენობის შემცირების კანონი სიმაღლით ერთეულ მოცულობაზე გამოიყურება, როგორც ნაჩვენებია ნახ. 1.7.
თვითნებური გარე პოტენციური ველისთვის ჩვენ ვწერთ შემდეგ ზოგად გამოხატულებას
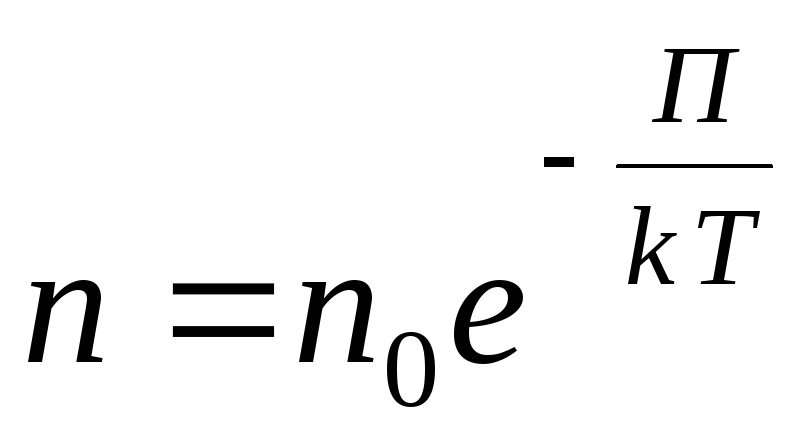 ,
,
