campuran gas. Kapasitas panas gas. Bahan bakar, campuran gas dan kapasitas panas
1.3. Persamaan keadaan gas ideal
Bentuk persamaan keadaan (1.1) untuk zat nyata agak rumit.
Dalam hal ini, model fisik benda kerja yang disederhanakan digunakan dalam termodinamika.
Untuk fluida kerja dalam keadaan gas, model pertama yang paling sederhana dan historis adalah gas ideal. Gas ideal adalah gas di mana gaya interaksi antarmolekul (tarikan dan tolakan) tidak ada, dan molekul itu sendiri dianggap sebagai poin materi. Gas ideal mematuhi persamaan Claiperon– Mendeleev
di mana m adalah massa gas dalam sistem; μ adalah massa molar gas; Rμ = 8314 J/(kmol K) adalah konstanta gas universal, yang tidak bergantung pada jenis gas atau kondisi keberadaannya. Persamaan keadaan (1.2) diperoleh dengan menggabungkan hukum Boyle-Mariotte dan Gay Lussac mempertimbangkan hukum Avogadro.
Masa molar μ = m/n, kg/mol, adalah massa zat yang diambil dalam jumlah satu mol. 1 mol adalah satuan jumlah suatu zat yang mengandung partikel sebanyak 12 gram karbon. Jumlah zat– n = N/N SEBUAH, tahi lalat, dimana N adalah jumlah partikel (atom, molekul), N SEBUAH ≈ 6,02 10 23 - jumlah atom dalam 12 gram karbon ( Nomor Avogadro). Secara numerik μ = Мr 10 -3 , dimana Mr adalah berat molekul relatif zat ( tab. Mendeleev) (misalnya: =2 kg/kmol).
Dalam istilah tertentu (yaitu untuk 1 kg gas), persamaan (1.2) akan berbentuk
di mana R– konstanta gas spesifik, J/(kg K).
Mari kita jelaskan arti fisik dari konstanta gas tertentu R. Untuk keadaan pertama persamaan (1.2) akan ditulis sebagai , untuk keadaan kedua pada tekanan yang sama - . Kurangi persamaan pertama dari persamaan kedua dan temukan bahwa , yaitu Konstanta gas spesifik adalah kerja yang dilakukan oleh 1 kg gas ketika dipanaskan 1 derajat pada tekanan konstan.
Data eksperimen menunjukkan bahwa gas nyata semakin mendekati gas ideal, semakin rendah densitasnya. Dengan kata lain, dengan penurunan volume sejumlah gas tertentu, yang disebabkan oleh peningkatan tekanan atau penurunan suhu, setiap gas akan semakin menyimpang dari sifat-sifat gas ideal. Jadi, di bawah konsep "gas ideal" cocok untuk semua gas nyata pada suhu tinggi dan tekanan rendah.
1.4. Campuran gas ideal
Dalam praktiknya, fluida kerja seringkali merupakan campuran gas homogen (misalnya udara), yang masing-masing dapat dianggap ideal dan tidak masuk ke dalam reaksi kimia.
Campuran semacam itu juga merupakan gas ideal dan mematuhi persamaan keadaan (1.2) untuk campuran tersebut
di mana R=R μ / μ adalah konstanta gas campuran; μ adalah massa molar rata-rata (nyata) dari campuran tersebut(nilai bersyarat mengacu pada gas perwakilan homogen, di mana jumlah molekul dan massa total sama dengan jumlah molekul dan massa campuran).
Massa campuran sama dengan massa semua komponen penyusunnya
Hukum utama yang menentukan perilaku campuran gas adalah hukum dalton:
setiap gas individu berperilaku dalam campuran gas seolah-olah gas itu sendiri, pada suhu campuran, menempati seluruh volume campuran,
setiap gas individu yang memasuki campuran gas memiliki tekanan yang sama seperti jika gas itu sendiri menempati seluruh volume campuran gas.
Oleh karena itu nilainya R(tekanan campuran absolut) didefinisikan sebagai
di mana R saya – tekanan parsial saya komponen ke-th, yaitu tekanan yang akan saya komponen th, jika hanya menempati seluruh volume campuran pada suhu yang sama ().
Komposisi campuran diberikan oleh fraksi massa atau mol dari komponen penyusun campuran, serta fraksi volume (konsentrasi).
Fraksi massa adalah perbandingan massa masing-masing gas dengan massa total campuran: .
Persamaan (1.3) menyiratkan bahwa .
Fraksi volume disebut rasio volume parsial(volume yang akan ditempati gas jika tekanan dan suhunya sama dengan tekanan dan suhu campuran gas, yaitu) dengan volume total campuran gas: . Dari definisi tekanan parsial dan volume dan keteguhan suhu, berikut ini:
![]() (1.5)
(1.5)
Menyimpulkan kesetaraan terakhir atas semua komponen campuran, kami memperoleh , yaitu jumlah volume parsial gas yang membentuk campuran sama dengan volume campuran gas.
Jumlah pecahan volume sama dengan satu: .
fraksi mol komponen disebut rasio jumlah zat masing-masing gas n saya dengan jumlah zat campuran gas n. Dari relasi dan dan hukum Avogadro(dalam volume yang sama dari gas ideal yang berbeda pada suhu yang sama dan tekanan yang sama, jumlah molekul yang sama tertutup, yaitu) berikut:
itu. menentukan campuran dengan fraksi mol sama dengan menentukan fraksi volumenya.
Fraksi massa dan volume dihubungkan dengan rasio:
![]() .
.
Jika campuran diberikan oleh fraksi massa g saya, maka konstanta gas campuran dan massa molar campuran dihitung sebagai berikut:
![]()
![]()
Jika campuran diberikan oleh fraksi volume r saya, maka rumus untuk menghitung massa molar campuran dan konstanta gas campuran adalah sebagai berikut:
![]() (1.6)
(1.6)
Tekanan parsial dan volume gas ditentukan oleh hukum Boyle–marriotte(pada suhu gas konstan, produk dari tekanan gas dan volumenya adalah nilai konstan, yaitu):
![]() .
.
pertanyaan tes
Sistem Satuan Internasional (SI) dan satuan dasarnya.
Parameter termodinamika dasar dan dimensinya.
Apa yang dimaksud dengan keadaan setimbang sistem termodinamika?
Konsep keadaan ekuilibrium dan non-ekuilibrium.
Bagaimana persamaan keadaan suatu sistem?
Interpretasi geometris keadaan sistem, proses termodinamika.
Apa itu gas ideal? Apa perbedaan antara gas ideal dan nyata?
Apa itu konstanta gas? Makna fisik, dimensi dan metode definisinya.
2. Kapasitas panas
Pesan panas ke benda kerja dalam proses apa pun menyebabkan perubahan keadaannya dan, dalam kasus umum, disertai dengan perubahan suhu. Perubahan suhu, serta parameter lain dari keadaan fluida kerja, tidak tergantung pada jenis prosesnya, tetapi tergantung pada awalnya ( 1 ) dan akhir ( 2 ) menyatakan, yaitu (untuk proses elementer, perubahan parameter diganti dengan diferensialnya).
Rasio jumlah panas δ Q dikomunikasikan ke tubuh untuk perubahan suhu tubuh dT dalam proses termodinamika dasar disebut kapasitas panas yang sebenarnya badan dalam proses ini:
Subskrip di sini menunjukkan fakta bahwa kapasitas panas, seperti panas, bergantung pada sifat prosesnya. Selain itu, kapasitas panas bergantung pada jumlah benda dan keadaan termodinamikanya. Perlu juga dicatat bahwa dalam proses ini komposisi kimiawi tubuh tidak berubah, tidak ada transisi suatu zat dari satu keadaan agregasi ke keadaan lain, tidak ada pembubaran komponen, dll.
Bergantung pada satuan kuantitas zat yang dipilih, massa, volume, dan kapasitas panas spesifik molar dibedakan:
Konsep kapasitas panas massal paling sering digunakan dalam praktik.
2.1. Kapasitas panas yang benar dan rata-rata
Kapasitas panas zat nyata bukanlah nilai konstan. Itu berubah dengan suhu, dan ketergantungan ini bisa sangat signifikan (Gbr. 2.1).
Jumlah spesifik panas proses dihitung dengan rumus
Metode berikut digunakan untuk menentukan nilai ini:
menurut hasil percobaan, ketergantungan kapasitas panas pada suhu direpresentasikan sebagai polinomial pendekatan
dimana adalah koefisien aproksimasi. Koefisien ini diberikan dalam literatur referensi. Kemudian
dalam perhitungan praktis dalam kisaran suhu t 1 , t 2 kapasitas panas dianggap nilai konstan sama dengan
ditelepon kapasitas panas rata-rata dalam interval ini, berbeda dengan kapasitas panas sebenarnya yang diperkenalkan pada (2.1). Data referensi memberikan kapasitas panas rata-rata dari 0 hingga suhu tetap t diperoleh secara empiris, yaitu
Kapasitas panas rata-rata dalam kisaran suhu t 1 , t 2 menurut data referensi ini dapat dihitung dengan rumus
Kemudian kuantitas tertentu proses panas didefinisikan sebagai
2.2. Kapasitas panas isokorik dan isobarik
sangat penting dalam termodinamika.
isokorikkapasitas panas
sama dengan rasio jumlah panas dalam proses pada volume konstan terhadap perubahan suhu tubuh,
isobarikkapasitas panas
sama dengan rasio jumlah panas dalam proses pada tekanan konstan terhadap perubahan suhu tubuh.
Dalam perhitungan termoteknik, tabel digunakan yang menunjukkan nilai numerik yang diperoleh secara eksperimental untuk kapasitas panas isobarik dan isokorik spesifik untuk berbagai zat tergantung pada suhu.
2.3. Kapasitas panas campuran gas
Dalam perhitungan, seringkali perlu untuk berurusan dengan campuran gas, dan kapasitas panas diberikan dalam tabel hanya untuk masing-masing gas.
Jika campuran gas diberikan oleh fraksi massa g saya, maka kapasitas panas massa spesifik campuran ditentukan oleh rumus
![]()
Jika campuran gas diberikan oleh fraksi volume r saya, maka kapasitas panas volumetrik spesifik campuran ditentukan oleh rumus
![]()
pertanyaan tes
Tuliskan satuan kapasitas panas spesifik.
Bagaimana konsep kapasitas panas rata-rata diperkenalkan?
3. Hukum kekekalan dan transformasi energi
Konsep energi dikaitkan dengan pergerakan materi.
Energi dapat mengambil banyak bentuk - kerja mekanik, panas, energi kimia, energi medan listrik dan magnet.
Dalam proses termodinamika, interaksi lingkungan dan sistem termodinamika tertutup dilakukan dengan pertukaran energi berupa kalor dan kerja mekanik.
3.1. Energi dalam
Setiap lingkungan memiliki beberapa margin energi dalamAS(J), yang dalam termodinamika teknis direpresentasikan sebagai jumlah energi kinetik dan potensial dari molekul dan atom medium. Energi kinetik partikel-partikel ini ditentukan oleh kecepatan dan massanya, sedangkan energi potensial ditentukan oleh gaya interaksi di antara mereka, yang bergantung pada posisi relatifnya. Energi dalam suatu sistem adalah energi yang terkandung dalam sistem itu sendiri. Ini berarti bahwa energi internal dapat mencirikan keadaan tubuh bersama dengan kuantitasnya R, V, T.
Energi dalam memiliki sifat aditivitas, yaitu energi internal dari suatu sistem yang kompleks sama dengan jumlah energi internal dari bagian-bagian penyusunnya:
Energi dalam 1 kg suatu zat disebut energi dalam tertentu kamu= AS/ m (J/kg).
Untuk sebagian besar aplikasi teknis termodinamika, bukan nilai absolut yang penting AS, dan perubahan nilai ini. Oleh karena itu, definisi kuantitatif dari energi internal dari sistem homogen sering ditentukan sehubungan dengan keadaan standar yang dipilih secara konvensional.
3.2. Hukum kekekalan energi dalam termodinamika
Melakukan proses termodinamika, sistem tertutup berinteraksi dengan lingkungan eksternal (badan dan medan eksternal), yaitu. bertukar energi. Dalam termodinamika teknis, dua jenis transfer energi dipertimbangkan - dengan mentransfer panas dan dengan melakukan pekerjaan mekanis.
Perpindahan panas terjadi antara benda dengan suhu berbeda dan bersentuhan, atau antara benda dengan suhu berbeda, yang terletak di kejauhan, melalui gelombang elektromagnetik ( radiasi termal). Siaran kehangatan terjadi pada tingkat molekuler (mikrofisik) tanpa gerakan tubuh yang terlihat.
Perpindahan energi dalam bentuk kerja terjadi dengan pergerakan seluruh tubuh atau sebagian darinya di ruang angkasa. Dengan metode ini, benda bergerak dalam medan gaya, atau mengubah volumenya di bawah pengaruh tekanan eksternal. Kerja adalah bentuk transfer energi makrofisika.
Perlu dicatat bahwa panas dan kerja, tidak seperti energi suatu benda, bukanlah fungsi dari keadaannya, tetapi bergantung pada jenis prosesnya, tentukan proses ini, mis. merupakan fungsi dari proses itu sendiri.
Berbagai percobaan dan pengamatan mengarah pada penemuan hukum alam yang mendasar - hukum kekekalan energi: energi di alam tidak muncul dari ketiadaan dan tidak hilang, atau jumlah energi tidak berubah, hanya berubah dari satu bentuk ke bentuk lainnya, atau
di mana Q adalah panas yang terlibat dalam proses; L- pekerjaan yang sedang dilakukan; Δ e adalah perubahan energi sistem. Di sini dan di bawah, kami setuju untuk mempertimbangkan:
kerja positif jika pekerjaan ini dilakukan oleh badan pekerja, dan negatif, jika pekerjaan dilakukan pada badan kerja sistem;
panas yang disuplai ke tubuh positif, dan jatah - negatif
selain itu, perubahan parameter keadaan apa pun dalam proses akhir akan dilambangkan dengan simbol Δ (delta), dan dalam proses dasar - d(diferensial dari parameter yang sesuai). Untuk setiap proses termodinamika terbatas, perubahan parameter keadaan (tekanan, suhu, energi dalam, entalpi, entropi, dll.) tidak bergantung pada jenis proses, tetapi ditentukan oleh keadaan awal dan akhir.
Secara umum, sistem termodinamika memiliki energi internal AS, energi kinetik (dalam termodinamika, sistem dianggap sebagai keseluruhan yang bergerak dengan kecepatan w) – mw 2 /2, potensial - mgz (z adalah ketinggian di mana sistem berada). Perubahan energi total dalam proses 1 –2 dapat dibayangkan sebagai:
Kerja yang dilakukan dalam proses ini adalah penjumlahan dari kerja L tentang, terkait dengan perubahan volume fluida kerja sistem (pekerjaan deformasi), pekerjaan L dv tentang pergerakan sistem di ruang angkasa, pekerjaan teknis L itu (saat memindahkan sistem di berbagai perangkat teknis, misalnya, di mesin, ketel uap, kompresor, dll.), bekerja melawan gaya gesekan L tr:
L \u003d L tentang + L dv + L itu + L tr.
Panas yang terlibat dalam proses adalah jumlah dari panas Q eksternal, terlibat dalam pertukaran dengan lingkungan eksternal, dan panas gesekan Q tr:
Q = Q luar + Q tr.
Mengingat bahwa Q tr = L tr (banyak percobaan telah menunjukkan bahwa kerja aliran yang dikeluarkan untuk mengatasi gesekan sepenuhnya diubah menjadi panas yang dirasakan oleh aliran), hukum kekekalan energi dalam termodinamika untuk 1 kg zat homogen yang bekerja (yaitu, dalam nilai massa tertentu ) dalam proses elementer dapat ditulis :
![]() , (3.1)
, (3.1)
(indeks eksternal dihilangkan karena tidak perlu).
Harus ditekankan bahwa di sisi kanan (3.1) di bawah tanda diferensial adalah fungsi keadaan, dan sisanya adalah besaran yang bergantung pada sifat proses termodinamika. Karena kerja dan panas adalah fungsi proses, dan bukan fungsi keadaan, tanda δ hanya menunjukkan fakta bahwa dalam proses elementer kuantitas yang mengikutinya sangat kecil, dan bukan peningkatan fungsi tertentu. Jadi, δ q dan δ l-elementer (yaitu, sesuai dengan perubahan yang sangat kecil dalam keadaan sistem) jumlah panas dan kerja.
Jika sistem termodinamika tidak mengubah posisinya dalam ruang dan satu-satunya jenis kerja adalah kerja yang berkaitan dengan perubahan volume sistem, maka persamaan (3.1) mengambil bentuk yang lebih sederhana:
Pekerjaan δ l tentang dilakukan baik melawan kekuatan tekanan eksternal dan, kemudian, volume fluida kerja mengembang, atau, sebaliknya, lingkungan eksternal bekerja pada tubuh, mengompresnya. Untuk proses kesetimbangan, ketika tekanan medium sama dengan tekanan dalam fluida kerja, kerja ini dihitung sebagai Rdv, di mana ay adalah volume spesifik zat kerja.
Persamaan
ditelepon hukum pertama termodinamika: kalor yang disuplai ke sistem termodinamika tertutup dalam keadaan diam dihabiskan untuk mengubah energi dalam sistem dan melakukan usaha untuk mengubah volume sistem. Hubungan keseimbangan (3.2) juga disebut ceramah pada literatur teoretis. 1. Barok: ...
L. A. Eliseeva © Lembaga Anggaran Negara Federal Perpustakaan Ilmiah dan Teknis Publik Negara Bagian Siberia dari Akademi Ilmu Pengetahuan Rusia, 2013
PenunjukJalan acak / A.N. Borodin, I.A.Ibragimov; di bawah... 241. Dorogokupets P.I. Termodinamika mineral dan kesetimbangan mineral ... katalog: ringkasan kuliah pada saja "Referensi ... negara bagian teknis Universitas. Seri, Teknis sains. - ...
N. V. Basova [dan lainnya]; ed. N. V. Basova. Rostov t/a: Phoenix, 2008
Buku pelajaranKursus) Tertulis D. T. Sinopsis kuliah pada matematika yang lebih tinggi [Teks]: ... Teknis termodinamika Rudobashta, S.P. Heat engineering [Teks]: buku teks untuk siswa. universitas belajar pada... 2008. - 204 hal. sepuluh Borodin, I. F. Otomasi proses teknologi...
Daftar Karya Ilmiah Departemen Keuangan Periode 2008 - 1 Juni 2013 (1)
Dokumen... "Metode penelitian sinar-X" Kuliah pada onkologi klinis. Almaty... hukum kedua termodinamika» 2-Internasional... dan tinjauan ahli teknis memperlengkapi organisasi kesehatan ... Akademisi Akademi Ilmu Kedokteran Rusia Yu.I. Borodin, Bishkek, 2009, hal. ...
Dalam praktik keteknikan, seseorang seringkali harus berurusan bukan dengan gas homogen, tetapi dengan campuran gas yang tidak berhubungan secara kimiawi. Contoh campuran gas adalah: udara atmosfer, gas alam, produk gas dari pembakaran bahan bakar, dll.
Untuk campuran gas, ketentuan berikut berlaku.
1. Setiap gas yang masuk ke dalam campuran memiliki temperatur, sama dengan suhu campuran.
2. Setiap gas yang termasuk dalam campuran didistribusikan ke seluruh volume campuran dan karenanya volume setiap gas sama dengan volume seluruh campuran.
3. Setiap gas yang termasuk dalam campuran mematuhi persamaan keadaannya sendiri.
4. Campuran secara keseluruhan seperti gas baru dan mengikuti persamaan keadaannya sendiri.
Studi tentang campuran gas didasarkan pada hukum Dalton, yang menurutnya, pada suhu konstan, tekanan campuran sama dengan jumlah tekanan parsial gas yang termasuk dalam campuran:
di mana p cm adalah tekanan campuran;
pi - tekanan parsial gas ke-i yang termasuk dalam campuran;
n adalah jumlah gas yang termasuk dalam campuran.
Tekanan parsial adalah tekanan yang akan diberikan oleh gas yang memasuki campuran jika gas itu sendiri menempati seluruh volume campuran pada suhu yang sama.
Metode untuk mengatur campuran gas
Komposisi campuran gas dapat ditentukan berdasarkan massa, volume, dan fraksi mol.
Fraksi massa. Fraksi massa dari setiap gas yang termasuk dalam campuran adalah rasio massa gas ini dengan massa campuran.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ..........; m n \u003d M n / M cm,
dimana m 1 , m 2 , ..., m n - fraksi massa gas;
M 1 , M 2 , ..., M n - massa gas individu;
M cm adalah massa campuran.
Sangat mudah untuk melihat itu  dan
dan  (100%).
(100%).
Volume saham. Fraksi volume dari setiap gas yang termasuk dalam campuran adalah rasio volume (sebagian) yang dikurangi dari gas ini dengan volume campuran.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
dimana V 1 , V 2 , ..., V n - mengurangi volume gas;
V cm adalah volume campuran;
r 1 , r 2 , ..., r n - fraksi volume gas.
Volume tereduksi adalah volume gas pada kondisi campuran (pada suhu dan tekanan campuran).
Volume yang dikurangi dapat direpresentasikan sebagai berikut: jika semua gas, kecuali satu, dikeluarkan dari bejana yang berisi campuran, dan gas yang tersisa dikompresi hingga tekanan campuran sambil mempertahankan suhu, maka volumenya akan berkurang atau sebagian.
Dapat dibuktikan bahwa volume campuran akan sama dengan jumlah volume gas yang dikurangi.
 (100%).
(100%).
Fraksi mol. Fraksi mol dari setiap gas yang termasuk dalam campuran adalah rasio jumlah kilomol gas ini dengan jumlah kilomol campuran.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
dimana r 1 , r 2 , ..., r n - fraksi mol gas;
n cm adalah jumlah kilomol campuran;
n 1 , n 2 , ..., n n adalah jumlah kilomol gas.
Menentukan campuran dengan fraksi mol identik dengan menentukan campuran dengan fraksi volume, yaitu fraksi molar dan volume memiliki nilai numerik yang sama untuk setiap gas yang termasuk dalam campuran.
Konstanta gas dan massa molekul semu (rata-rata) dari campuran. Untuk menghitung konstanta campuran gas yang diberikan oleh fraksi massa, kami menulis persamaan keadaan:
untuk campuran
p cm × V cm = M cm R cm T; (1.9)
untuk gas
 .
(1.10)
.
(1.10)
Kami menjumlahkan bagian kiri dan kanan persamaan (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Karena  ,
,
maka p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
Persamaan (1.9) dan (1.11) menyiratkan hal itu
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
atau  ,
(1.12)
,
(1.12)
di mana R cm adalah konstanta gas campuran.
Karena konstanta gas dari gas ke-i
R i = 8314 / m i ,
maka persamaan (1.12) ditulis ulang sebagai berikut:
 .
(1.13)
.
(1.13)
Saat menentukan parameter campuran gas, akan lebih mudah untuk menggunakan nilai kondisional tertentu yang disebut berat molekul (rata-rata) yang tampak dari campuran gas. Konsep berat molekul yang tampak dari suatu campuran memungkinkan kita untuk secara konvensional menganggap campuran tersebut sebagai gas homogen, yang sangat menyederhanakan perhitungan.
Untuk gas terpisah, ekspresinya
Secara analogi, untuk campuran, kita bisa menulis
m cm R cm = 8314, (1.14)
di mana m cm adalah berat molekul yang tampak dari campuran.
Dari persamaan (1.14), dengan menggunakan ekspresi (1.12) dan (1.13), kita peroleh
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Berdebat dengan cara ini, seseorang dapat memperoleh rumus untuk menghitung R cm dan m cm melalui fraksi volume, rumus untuk mengubah fraksi massa menjadi fraksi volume dan, sebaliknya, fraksi volume menjadi fraksi massa, rumus untuk menghitung volume spesifik suatu campuran u cm dan kerapatan campuran r cm melalui fraksi massa dan volume dan, terakhir, rumus untuk menghitung tekanan parsial gas yang termasuk dalam campuran, melalui fraksi volume dan massa. Kami menyajikan rumus ini tanpa derivasi dalam tabel.
Rumus untuk menghitung campuran gas
|
Pengaturan komposisi campuran |
Transfer dari satu komposisi ke komposisi lainnya |
Kepadatan dan volume spesifik campuran |
Berat molekul yang tampak dari campuran |
konstanta campuran gas |
Tekanan parsial |
|
Fraksi massa |
|
|
|
|
|
|
Fraksi volume |
|
|
|
|
|
Kapasitas panas gas
Kapasitas kalor suatu benda adalah jumlah kalor yang diperlukan untuk memanaskan atau mendinginkan benda sebesar 1 K. Kapasitas kalor dari satuan jumlah suatu zat disebut kapasitas kalor jenis.
Jadi, kapasitas panas spesifik suatu zat adalah jumlah panas yang harus diberikan atau dikurangi dari satu unit zat untuk mengubah suhunya sebesar 1 K dalam proses ini.
Karena hanya kapasitas kalor spesifik yang akan dibahas berikut ini, kita akan mengacu pada kapasitas kalor spesifik hanya sebagai kapasitas kalor.
Jumlah gas dapat diberikan oleh massa, volume dan jumlah kilomol. Perlu dicatat bahwa saat mengatur volume gas, volume ini dibawa ke kondisi normal dan diukur dalam meter kubik normal (nm 3).
Bergantung pada metode pengaturan jumlah gas, kapasitas panas berikut dibedakan:
c - kapasitas panas massa, J / (kg × K);
c¢ - kapasitas panas volumetrik, J / (nm 3 × K);
c m - kapasitas panas molar, J / (kmol × K).
Antara kapasitas panas ini ada hubungan berikut:
c = c m / m; dengan m = dengan × m;
¢ = с m / 22,4; dengan m = s¢ × 22,4,
dari sini  ; s¢ = s × rn,
; s¢ = s × rn,
dimana u n dan r n - volume dan kepadatan spesifik dalam kondisi normal.
Kapasitas panas isokorik dan isobarik
Jumlah panas yang diberikan ke fluida kerja tergantung pada fitur proses termodinamika. Dua jenis kapasitas panas sangat penting secara praktis tergantung pada proses termodinamika: isokorik dan isobarik.
Kapasitas panas pada u = const adalah isokorik.
c u - kapasitas panas isokorik massa,
c¢ kamu adalah kapasitas panas isokorik volumetrik,
c m kamu adalah kapasitas panas isokorik molar.
Kapasitas panas pada p = const adalah isobarik.
c p - massa kapasitas panas isobarik,
c¢ р - kapasitas panas isobarik volumetrik,
c m p - kapasitas panas isobarik molar.
Dengan perubahan suhu yang sama dalam proses yang dilakukan pada p = konstan, lebih banyak panas yang dikonsumsi daripada proses pada u = konstan. Hal ini dijelaskan oleh fakta bahwa pada u = const panas yang disalurkan ke benda hanya digunakan untuk mengubah energi dalam, sedangkan pada p = const panas digunakan baik untuk meningkatkan energi dalam maupun untuk melakukan usaha pemuaian. Perbedaan antara kapasitas panas massa isobarik dan massa isokorik menurut persamaan Mayer
c p - c kamu=R. (1.17)
Jika ruas kiri dan kanan persamaan (1.17) dikalikan dengan massa kilomol m, maka diperoleh
c m p - c m kamu= 8314 J/(kmol×K) (1,18)
Dalam termodinamika dan penerapannya, rasio kapasitas panas isobarik dan isokorik sangat penting:
 ,
(1.19)
,
(1.19)
di mana k adalah eksponen adiabatik.
Perhitungan menunjukkan bahwa untuk gas monoatomik k » 1,67, gas diatomik k » 1,4, dan gas triatomik k » 1,29.
Sangat mudah untuk melihat nilainya ke tergantung suhu. Memang, itu mengikuti dari persamaan (1.17) dan (1.19) bahwa
 ,
(1.20)
,
(1.20)
dan dari persamaan (1.18) dan (1.19)
 .
(1.21)
.
(1.21)
Karena kapasitas panas meningkat dengan meningkatnya suhu gas, nilai k menurun, mendekati satu, tetapi selalu lebih besar dari itu.
Mengetahui nilai k, seseorang dapat menentukan nilai kapasitas panas yang sesuai. Jadi, misalnya, dari persamaan (1.20) kita punya
 ,
(1.22)
,
(1.22)
dan sejak dengan p = k × s kamu, maka kita dapatkan
 .
(1.23)
.
(1.23)
Demikian pula, untuk kapasitas panas molar, dari persamaan (1.21) kita peroleh
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Kapasitas panas rata-rata dan sebenarnya
Kapasitas panas gas tergantung pada suhu dan, sampai batas tertentu, pada tekanan. Ketergantungan kapasitas panas pada tekanan kecil dan diabaikan dalam kebanyakan perhitungan. Ketergantungan kapasitas panas pada suhu sangat signifikan dan harus diperhitungkan. Ketergantungan ini cukup akurat diungkapkan oleh persamaan
c = a+ di t + et 2 , (1.26)
dimana, di dan e adalah nilai yang konstan untuk gas tertentu.
Seringkali dalam perhitungan teknik termal, ketergantungan nonlinier (1.26) diganti dengan ketergantungan linier:
c = a+ di t. (1.27)
|
Jika kita membangun ketergantungan kapasitas panas pada suhu secara grafis sesuai dengan persamaan (1.26), maka ini akan menjadi ketergantungan lengkung (Gbr. 1.4). Seperti yang ditunjukkan pada gambar, setiap nilai suhu memiliki nilai kapasitas panasnya sendiri, yang biasa disebut kapasitas panas sebenarnya. Secara matematis, ekspresi untuk kapasitas panas sebenarnya ditulis sebagai berikut:
|
|
|
|
Oleh karena itu, kapasitas kalor sebenarnya adalah rasio jumlah kalor dq yang sangat kecil dengan perubahan suhu dt yang sangat kecil. Dengan kata lain, kapasitas kalor sebenarnya adalah kapasitas kalor gas pada temperatur tertentu. Pada ara. 1.4, kapasitas panas sebenarnya pada suhu t 1 ditunjukkan dengan t1 dan digambarkan sebagai segmen 1-4, pada suhu t 2 - dengan t2 dan digambarkan sebagai segmen 2-3. Dari persamaan (1.28) kita dapatkan dq=cdt. (1.29) Dalam perhitungan praktis, kami selalu menentukan jumlah panas pada perubahan akhir |
suhu. Jelaslah bahwa jumlah kalor q, yang dinyatakan dalam satuan jumlah zat ketika dipanaskan dari t1 ke t2, dapat ditentukan dengan mengintegrasikan (1,29) dari t1 ke t2.
 .
(1.30)
.
(1.30)
Secara grafis, integral (1,30) dinyatakan dengan luas 4-1-2-3. Jika dalam ekspresi (1.30) kita mengganti nilai kapasitas panas yang sebenarnya dengan ketergantungan linier (1.27), maka kita peroleh
 (1.31)
(1.31)
di mana  - kapasitas panas rata-rata dalam kisaran suhu dari t 1 hingga t 2.
- kapasitas panas rata-rata dalam kisaran suhu dari t 1 hingga t 2.
 ,
(1.32)
,
(1.32)
Oleh karena itu, kapasitas panas rata-rata adalah rasio jumlah panas akhir q dengan perubahan suhu akhir t 2 - t 1:
 .
(1.33)
.
(1.33)
Jika, berdasarkan 4-3 (Gbr. 1.4), dibuat persegi panjang 4-1¢-2¢-3, ukurannya sama dengan gambar 4-1-2-3, maka tinggi persegi panjang ini akan sama dengan kapasitas panas rata-rata, di mana  berada dalam kisaran suhu t 1 - t 2 .
berada dalam kisaran suhu t 1 - t 2 .
Biasanya nilai kapasitas panas rata-rata diberikan dalam tabel sifat termodinamika zat. Namun, untuk mengurangi volume tabel ini, mereka memberikan nilai kapasitas panas rata-rata yang ditentukan dalam kisaran suhu dari 0 ° C hingga t ° C.
Jika perlu menghitung nilai kapasitas panas rata-rata dalam kisaran suhu tertentu t 1 - t 2, maka ini dapat dilakukan sebagai berikut.
Area 0a14 di bawah kurva c \u003d f (t) (Gbr. 1.4) sesuai dengan jumlah panas q 1 yang diperlukan untuk menaikkan suhu gas dari 0 ° C menjadi t 1 ° C.

Demikian pula, luas 0a23 sesuai dengan q 2 ketika suhu naik dari 0 o C ke t 2 o C:

Jadi, q \u003d q 2 - q 1 (area 4123) dapat direpresentasikan sebagai
![]() (1.34)
(1.34)
Mengganti nilai q menurut (1.34) ke dalam ekspresi (1.33), kami memperoleh rumus untuk kapasitas panas rata-rata dalam rentang suhu apa pun:
 .
(1.35)
.
(1.35)
Dengan demikian, kapasitas panas rata-rata dapat dihitung dari tabel kapasitas panas rata-rata menggunakan persamaan (1.35). Selain itu, kami memperoleh ketergantungan nonlinier c = f(t). Anda juga dapat menemukan kapasitas panas rata-rata menggunakan persamaan (1.32) menggunakan hubungan linier. Nilai a dan di dalam persamaan (1.32) untuk berbagai gas diberikan dalam literatur.
Jumlah panas yang dipasok atau dihilangkan dari fluida kerja dapat dihitung menggunakan salah satu persamaan:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
di mana 

 - masing-masing, massa rata-rata, volume, dan kapasitas panas molar; M adalah massa gas; n adalah jumlah kilomol gas; V n - volume gas dalam kondisi normal.
- masing-masing, massa rata-rata, volume, dan kapasitas panas molar; M adalah massa gas; n adalah jumlah kilomol gas; V n - volume gas dalam kondisi normal.
Volume gas V n dapat ditemukan sebagai berikut. Setelah menulis persamaan keadaan untuk kondisi yang diberikan: pV = MRT dan untuk kondisi normal: p n V n = MRT n, kami mengaitkan persamaan kedua dengan yang pertama:
 ,
,
dari sini  .
(1.39)
.
(1.39)
Kapasitas panas campuran gas
Kapasitas panas campuran gas dapat dihitung jika komposisi campuran diketahui dan kapasitas panas komponen yang termasuk dalam campuran diketahui.
Untuk memanaskan campuran bermassa M cm sebesar 1 K, suhu masing-masing komponen juga harus dinaikkan sebesar 1 K. Pada saat yang sama, jumlah panas yang sama dengan c i M i dihabiskan untuk memanaskan komponen ke-i dari campuran dengan massa М i . Untuk seluruh campuran, jumlah panasnya  ,
,
di mana c i dan c cm adalah kapasitas panas massa dari komponen dan campuran ke-i.
Membagi ekspresi terakhir dengan M cm, kami memperoleh rumus perhitungan kapasitas panas massa campuran:
 ,
(1.40)
,
(1.40)
di mana m i adalah fraksi massa komponen ke-i.
Dengan argumen serupa, kami menemukan kapasitas kalor volumetrik c¢ cm dan kapasitas kalor molar c m cm dari campuran:
 (1.41)
(1.41)
dimana c¢ i - kapasitas panas volumetrik dari komponen ke-i, r i - fraksi volume dari komponen ke-i,
 ,
(1.42)
,
(1.42)
di mana c m i adalah kapasitas panas molar komponen ke-i,
r i - fraksi mol (volume) dari komponen ke-i.
Dalam mesin panas (mesin), fluida kerja adalah campuran berbagai gas. Jika komponen campuran tidak masuk ke dalam reaksi kimia satu sama lain, dan masing-masing komponen mematuhi persamaan keadaan Claiperon, maka campuran tersebut dianggap sebagai gas ideal.
Untuk menghitung campuran, perlu ditentukan μ cm - massa molar rata-rata dan R cm - konstanta gas spesifik dari campuran. Untuk menentukannya perlu diketahui komposisi campurannya, yaitu komponen apa saja dan berapa jumlah yang membentuk campuran tersebut, parameter apa yang dimiliki oleh masing-masing komponen yang termasuk dalam campuran tersebut.
Setiap komponen campuran berperilaku seolah-olah tidak ada gas lain dalam campuran, menempati seluruh volume yang tersedia di mana campuran berada, mengikuti persamaan keadaannya sendiri dan memberikan apa yang disebut tekanan parsial pada dinding, sedangkan suhu semua komponen campuran adalah sama dan sama dengan suhu campuran.
Menurut hukum Dalton, tekanan campuran P sama dengan jumlah tekanan parsial masing-masing komponen yang termasuk dalam campuran:
di mana n adalah jumlah komponen campuran.
Menurut hukum Amag, volume campuran V sama dengan jumlah volume parsial masing-masing komponen yang termasuk dalam campuran pada suhu dan tekanan campuran:
 , (1.21)
, (1.21)
dimana - volume parsial, m 3; V- volume campuran, m 3
Komposisi campuran diberikan oleh volume (molar) atau fraksi massa.
Fraksi volume komponen ke-i adalah perbandingan volume parsial komponen dengan volume campuran, yaitu, maka jumlah fraksi volume komponen campuran adalah 1, yaitu . Jika nilainya diberikan dalam %, maka jumlahnya = 100%.
Fraksi molar komponen ke-i n i adalah perbandingan jumlah kilomol komponen N i dengan jumlah kilomol campuran N, yaitu di mana ![]() , , yaitu jumlah kilomol dari setiap komponen dan campuran secara keseluruhan sama dengan perbandingan komponen yang sesuai dan campuran secara keseluruhan terhadap volume yang ditempati oleh satu kilomol.
, , yaitu jumlah kilomol dari setiap komponen dan campuran secara keseluruhan sama dengan perbandingan komponen yang sesuai dan campuran secara keseluruhan terhadap volume yang ditempati oleh satu kilomol.
Mengingat gas ideal dalam kondisi yang sama memiliki volume kilomole yang sama, maka setelah substitusi kita dapatkan :, yaitu untuk gas ideal, fraksi molar dan volumenya sama secara numerik.
Fraksi massa komponen ke-i adalah rasio massa komponen dengan massa campuran: , maka massa campuran sama dengan jumlah massa komponen, dan juga jumlah fraksi massa komponen sama sampai 1 (atau 100%).
Konversi fraksi volume menjadi fraksi massa dan sebaliknya didasarkan pada rasio berikut:
![]() ,
,
dimana ρ = μ / 22,4, kg / m 3.
Oleh karena itu, fraksi massa komponen ke-i akan ditentukan dari hubungan:
 ,
,
dimana massa jenis campuran, kg / m 3, adalah fraksi volume komponen ke-i.
Di masa depan, itu dapat ditentukan melalui fraksi volume.
 .
.
Kepadatan campuran untuk fraksi volume ditentukan dari hubungan
 , di mana
, di mana  , (1.22)
, (1.22)
 .
.
Tekanan parsial ditentukan oleh rumus:
![]() atau
atau  (1.23)
(1.23)
Persamaan keadaan komponen dan campuran secara keseluruhan memiliki bentuk:
![]() ;
;
![]() ,
,
dari mana, setelah transformasi, kita memperoleh untuk besar sekali saham
 ,
,  . (1.24)
. (1.24)
Kepadatan dan volume spesifik campuran untuk besar sekali Bagikan:
;  . (1.25)
. (1.25)
Untuk menghitung tekanan parsial, digunakan rumus:
 . (1.26)
. (1.26)
Konversi fraksi massa menjadi fraksi volume dilakukan sesuai dengan rumus:
 .
.
Saat menentukan kapasitas panas suatu campuran gas, diasumsikan bahwa untuk memanaskan (mendinginkan) suatu campuran gas, perlu memanaskan (mendinginkan) masing-masing komponen campuran tersebut.
di mana Q i = M i c i ∆t adalah panas yang dihabiskan untuk mengubah suhu komponen ke-i dari campuran, c i adalah kapasitas panas massa dari komponen ke-i dari campuran.
Kapasitas panas campuran ditentukan dari rasio (jika campuran diberikan oleh fraksi massa)
 , sama
, sama  . (1.28)
. (1.28)
Kapasitas panas molar dan volumetrik untuk campuran yang diberikan oleh fraksi volume ditentukan oleh
 ;
;  ;
;
 ;
; 
Contoh 1.5 Massa udara kering terdiri dari g O2 \u003d 23,3% oksigen dan g N 2 \u003d 76,6% nitrogen. Tentukan komposisi udara berdasarkan volume (r O2 dan r N 2) dan konstanta gas dari campuran tersebut.
Larutan.
1. Dari Tabel 1 kita temukan kg/kmol dan kg/kmol
2. Tentukan fraksi volume oksigen dan nitrogen:
1. Konstanta gas udara (campuran) ditentukan dengan rumus:
 , J/kg K
, J/kg K
Contoh 1.6. Tentukan jumlah kalor yang diperlukan untuk memanaskan suatu campuran gas dengan massa M = 2 kg pada P = konstan, yang terdiri dari % berat: , , , , ketika suhu berubah dari t 1 =900 °C menjadi t 2 = 1200 ° C.
Larutan:
1. Tentukan kapasitas kalor massa rata-rata komponen penyusun campuran gas pada P=const dan t 1 =900 o C (dari P2):
1,0258 kJ/kg K; =1,1045 kJ/kg·K;
1,1078 kJ/kg K; =2,1097 kJ/kg·K;
2. Kita tentukan kapasitas kalor massa rata-rata dari komponen penyusun campuran gas pada P=const dan t 1 =1200 o C (dari P2):
1,0509 kJ/kg·K; =1,153 kJ/kg·K;
1,1359 kJ/kg K; =2,2106 kJ/kg·K;
3. Kami menentukan massa rata-rata kapasitas panas campuran untuk kisaran suhu: t 2 \u003d 1200 ° C dan t 1 \u003d 900 ° C:
4. Banyaknya kalor untuk memanaskan 2 kg campuran pada P=konst:
Hukum pertama termodinamika menetapkan hubungan kuantitatif antara perubahan energi internal sistem dan kerja mekanis yang dilakukan melawan kekuatan tekanan eksternal lingkungan sebagai akibat dari suplai panas ke fluida kerja.
Untuk sistem termodinamika tertutup, persamaan hukum pertama memiliki bentuk
Panas yang diberikan ke fluida kerja (atau sistem) digunakan untuk meningkatkan energi internalnya (dU) karena peningkatan suhu tubuh, dan untuk melakukan kerja eksternal (dL) karena pemuaian fluida kerja dan peningkatannya. volume.
Hukum pertama dapat ditulis sebagai dH=dq+VdP=dq-dL 0 ,
di mana dL 0 \u003d VdP - pekerjaan dasar perubahan tekanan disebut pekerjaan eksternal (teknis) yang berguna.
dU adalah perubahan energi internal fluida kerja (sistem), yang meliputi energi gerak termal molekul (translasi, rotasi, dan getaran) dan energi potensial interaksi molekul.
Karena peralihan sistem dari satu keadaan ke keadaan lain terjadi sebagai akibat dari pasokan panas, maka fluida kerja memanas dan suhunya naik sebesar dT dan volumenya meningkat sebesar dV.
Peningkatan suhu tubuh menyebabkan peningkatan energi kinetik partikelnya, dan peningkatan volume tubuh menyebabkan perubahan energi potensial partikel. Akibatnya, energi internal tubuh meningkat sebesar dU, sehingga energi internal U adalah fungsi dari keadaan tubuh dan dapat direpresentasikan sebagai fungsi dari dua parameter independen U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T). Perubahan energi dalam dalam proses termodinamika hanya ditentukan oleh keadaan awal (U 1) dan akhir (U 2), yaitu
Dalam bentuk diferensial, perubahan energi dalam ditulis
a) sebagai fungsi volume dan suhu spesifik

b) sebagai fungsi suhu, karena , kemudian
Untuk perhitungan praktis, di mana perubahan C v dengan suhu perlu diperhitungkan, ada rumus empiris dan tabel energi internal spesifik (seringkali molar). Untuk gas ideal, energi dalam molar campuran U m ditentukan oleh rumus
 , J/kmol
, J/kmol
Untuk campuran diberikan oleh fraksi massa . Lewat sini energi dalam ada milik sistem dan mencirikan keadaan sistem.
Entalpi adalah fungsi keadaan termal yang diperkenalkan oleh Kamerling-Onnes, (pemenang Penghargaan Nobel, 1913), yang merupakan jumlah energi dalam sistem U dan hasil kali tekanan sistem P dan volumenya V.
Karena besaran yang termasuk di dalamnya adalah fungsi keadaan, maka H juga merupakan fungsi keadaan, yaitu H \u003d f 1 (P, V); H=f 2 (V,T); H=f 3 (P, T).
Perubahan entalpi dH dalam setiap proses termodinamika ditentukan oleh keadaan H 1 awal dan akhir H 2 dan tidak bergantung pada sifat proses. Jika sistem mengandung 1 kg zat, maka entalpi spesifik, J/kg, diterapkan.
Untuk gas ideal, persamaan diferensial memiliki bentuk
karenanya, entalpi spesifik ditentukan oleh rumus
Persamaan hukum pertama termodinamika adalah dq=dU+Pdυ, jika satu-satunya jenis usaha adalah usaha ekspansi Pdυ=d(Pυ)-υdP, maka dq=d(U+Pυ)-υdP, dari mana
Kerja praktek№ 2
Topik: Kapasitas panas, entalpi, campuran gas ideal, energi dalam, kerja, proses termodinamika.
Tujuan pekerjaan: Konsolidasi pengetahuan yang diperoleh selama pelatihan teori, perolehan keterampilan dalam penerapan perhitungan teknik panas.
SAYA. Definisi dasar, rumus dan persamaan
1. Campuran gas ideal
Campuran gas adalah campuran mekanis dari beberapa gas yang tidak berinteraksi secara kimia satu sama lain. Setiap gas dalam campuran disebut komponen gas; berperilaku seolah-olah tidak ada gas lain dalam campuran, yaitu didistribusikan secara merata ke seluruh campuran. Tekanan yang diberikan oleh masing-masing gas campuran pada dinding bejana disebut tekanan parsial. Hukum dasar untuk campuran gas ideal adalah hukum Dalton, yang menurutnya tekanan campuran sama dengan jumlah tekanan parsial gas yang membentuk campuran:
2. Tenaga dalam
Energi dalam tubuh adalah kombinasi dari energi kinetik dari pergerakan mikropartikel penyusun tubuh, dan energi potensialnya. interaksi didefinisikan kekuatan saling tarik-menarik atau tolakan. Tidak mungkin untuk menentukan nilai absolut dari energi internal, oleh karena itu, dalam perhitungan termodinamika, bukan nilai absolut dari energi internal yang dihitung, tetapi perubahannya, yaitu.
![]() atau
atau ![]()
dimana U 1 dan U 2 - energi internal dari keadaan awal dan akhir fluida kerja (gas);
u 1 dan dan 2 - ketukan. energi internal dari keadaan awal dan akhir fluida kerja.
Oleh karena itu, perubahan energi dalam tidak bergantung pada sifat dan jalur proses, tetapi ditentukan oleh keadaan fluida kerja pada awal dan akhir proses perubahan.
Ciri gas ideal adalah tidak adanya gaya interaksi molekuler di dalamnya, dan karenanya tidak ada energi potensial internal, mis. U n \u003d 0 dan U „ \u003d 0. Oleh karena itu, energi dalam gas ideal:
U=U k =f(T) unu u=uk =f(T).
H. Pekerjaan gas.
Dalam termodinamika, setiap perubahan keadaan fluida kerja sebagai akibat dari pertukaran energi dengan lingkungan disebut proses. Dalam hal ini, parameter utama badan kerja diubah:
Transformasi panas menjadi kerja mekanis dikaitkan dengan proses perubahan keadaan fluida kerja. Proses perubahan keadaan gas dapat berupa proses ekspansi dan kontraksi. Untuk massa gas M (kg) yang sewenang-wenang, pekerjaannya sama dengan:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
dimana l \u003d p (v 2 -v 1) J / kg adalah kerja dari 1 kg gas atau kerja tertentu.
4. Entalpi gas,
Entalpi adalah parameter yang mencirikan energi potensial dari sambungan fluida kerja (gas) dengan lingkungan. Entalpi dan entalpi spesifik:
I \u003d U + pV, J dan i i \u003d dan + pv, J / kg.
5. Kapasitas panas.
Kapasitas panas spesifik adalah jumlah panas yang harus dipasok ke 1 kg gas untuk memanaskannya sebesar 1 ° C dalam kisaran suhu tertentu.
Kapasitas panas spesifik adalah massa, volumetrik dan kilomol. Ada hubungan antara massa C, volume C dan kapasitas panas kilomol C:
 ;
; 
dimana Vo 22,4 m 3 / kmol - ketukan. volume gas pada kondisi normal.
Massa ud. kapasitas panas campuran gas:

Volumetrik panas spesifik campuran gas:

Kalor jenis kilomolar campuran gas:

6. Persamaan untuk menentukan jumlah kalor
Banyaknya kalor yang dilepaskan atau diserap oleh fluida kerja (gas) dapat ditentukan dengan persamaan:
Q \u003d M C m (t 2 -t 1), J atau Q \u003d VC (t-t), J, dimana M dan V adalah berat atau jumlah volume gas, kg atau m 3;
t u t - suhu gas di akhir dan di awal proses ° С;
C dan C - ketukan rata-rata massa dan volume. kapasitas panas gas
Pada t cp \u003d J / kgK atau J / m 3 K
7. Hukum pertama termodinamika
Hukum ini mempertimbangkan interkonversi panas dan kerja mekanis. Menurut hukum ini, panas diubah menjadi kerja mekanis dan sebaliknya, kerja mekanis menjadi panas dalam jumlah yang benar-benar setara. Persamaan ekuivalensi untuk panas dan kerja memiliki bentuk:
Dengan mempertimbangkan prinsip kesetaraan panas dan kerja, persamaan keseimbangan panas untuk massa gas yang berubah-ubah:
Q \u003d U + L dan q \u003d u + l \u003d u -u + l
Penyelesaian masalahII
Tugas #1 (#1)
Udara kering atmosfer memiliki perkiraan komposisi massa sebagai berikut: g 02 =23,2%, g N 2 =76,8%.
Tentukan komposisi volumetrik udara, konstanta gasnya, berat molekul semu, tekanan parsial oksigen dan nitrogen, jika udara adalah P = 101325 Pa menggunakan barometer.
Saya menentukan komposisi volumetrik udara:
 ;
; ;
;
di mana r adalah fraksi massa;
m adalah berat molekul relatif;
g adalah fraksi volume.
m udara. =m O2 r O2 + m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
di mana R 0 adalah konstanta gas.
Saya menentukan tekanan parsial berbagai gas:
P O 2 \u003d P cm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
dimana P O 2 , P N 2 - tekanan parsial;
P cm adalah tekanan campuran.
Tugas #2 (#2)
Kapal dibagi oleh sekat menjadi 2 bagian, yang volumenya adalah V 1 =1,5 m 3 dan V 2 =1,0 m 3 . Bagian pertama volume V 1 mengandung CO 2 pada P 1 =0,5 MPa dan t 1 =30°C; bagian kedua volume V 2 mengandung O 2 pada P 2 =0,2 MPa dan t 2 =57°C. Tentukan fraksi massa dan volume CO 2 dan O 2, berat molekul yang tampak dari campuran dan konstanta gasnya setelah partisi dihilangkan dan proses pencampuran selesai.
Saya menentukan konstanta gas individu:
Untuk melakukan ini, saya menentukan berat molekul relatif: m (CO 2) \u003d 32 + 12 \u003d 44; m(O2)=32;

 ;
;
![]()
 ;
;
Menurut persamaan karakteristik Klaiperon, saya menentukan massa gas:
 (kg);
(kg);
 (kg);
(kg);
Saya menentukan fraksi massa:


Saya menentukan fraksi volume:


Tentukan berat molekul udara yang tampak:
m udara. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 \u003d 41,48;
Saya menentukan konstanta gas individu untuk udara (R):

 ;
;
Tugas #3 (#6)
Dalam bejana dengan volume 300 l terdapat oksigen pada tekanan P 1 \u003d 0,2 MPa dan t 1 \u003d 20 0 C. Berapa kalor yang harus diberikan agar suhu oksigen naik menjadi t 2 \u003d 300 0 C ? Tekanan apa yang akan dibuat di bejana? Untuk perhitungan, ambil panas spesifik volumetrik rata-rata oksigen pada n.o. C 02 \u003d 0,935 
Menurut hukum Charles, saya menentukan tekanan akhir dari proses tersebut:
;  (Pa);
(Pa);
dimana P, T adalah parameter gas.
Saya menentukan konstanta gas individu untuk oksigen (R):

 ;
;
Karena prosesnya isokorik, saya menentukan jumlah panas yang perlu diberikan sesuai dengan rumus yang sesuai: Q v \u003d M C cv (T 2 -T 1) untuk ini, menurut persamaan karakteristik Claiperon, saya menentukan massa gas
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
Tugas #4 (#7)
Berapa banyak panas yang harus dikeluarkan untuk memanaskan 2 m 3 udara pada tekanan berlebih konstan P ex. \u003d 0,2 MPa dari suhu 100 0 C ke suhu 500 0 C. Usaha apa yang akan dilakukan udara dalam kasus ini? Untuk perhitungan, ambil: tekanan atmosfer P di. \u003d 0,1 MPa, kapasitas panas isobarik massa rata-rata udara C pm \u003d 1,022  ; hitung konstanta gas mengingat berat molekul semu udara M udara. =29.
; hitung konstanta gas mengingat berat molekul semu udara M udara. =29.
Saya menentukan konstanta gas individu untuk udara:

 ;
;
Tekanan absolut sama dengan jumlah kelebihan dan atmosfer P=P est. + P di. =0,1+0,2=0,3 MPa
 (kg);
(kg);
Karena prosesnya isobarik, saya menentukan Q dan L sesuai dengan rumus yang sesuai:
menurut hukum Gay-Lussac, saya menentukan volume akhir:
 m 3;
m 3;
Q \u003d M C pm (T 2 -T 1) \u003d 5,56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2,15 \u003d 645000 (J).
Tugas #5 (#8)
Ada udara di dalam silinder dengan tekanan P=0,5 MPa dan suhu t 1 =400 0 C. Panas dikeluarkan dari udara pada P=const sehingga pada akhir proses suhu t 2 =0 0 C adalah set Volume silinder di mana udara V 1 \u003d 400l.
Tentukan jumlah kalor yang dibuang, volume akhir, perubahan energi dalam dan kerja sempurna kompresi C pm = 1,028  .
.
Karena prosesnya isobarik, maka menurut hukum Gay-Lussac saya menentukan volume akhir:
 m 3;
m 3;
Menurut persamaan karakteristik Klaiperon, saya menentukan massa gas:
Dari soal sebelumnya R=286.7 
 (kg);
(kg);
Saya menentukan jumlah panas yang dilepaskan:
Q=M C pm (T 2 -T 1)=1,03 1028 (273-673)=-423536 (J);
Saya menentukan jumlah pekerjaan yang dihabiskan:
L=P (V 2 -V 1)= 500.000 (0,16-0,4)=-120.000 (J);
Dari persamaan yang menentukan jumlah total, saya menentukan perubahan jumlah energi internal:
![]() ; (J)
; (J)
Masalah #6 (#9)
Udara yang memiliki volume V 1 =0,02 m3 pada tekanan P 1 =1,1 MPa dan t 1 =25 s mengembang dalam silinder dengan piston yang dapat digerakkan hingga tekanan P 2 =0,11 MPa. Temukan volume akhir V 2, suhu akhir t 2 , kerja yang dilakukan oleh udara, dan kalor yang diberikan, jika terjadi pemuaian di dalam silinder:
a) isotermal
b) secara adiabatik dengan eksponen adiabatik k=1.4
c) politropik dengan indeks politropik n=1,3
Proses isotermal:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0,02 1,1 / 0,11 \u003d 0,2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000 J
proses adiabatik:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 298 \u003d 20,32k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1)=2.0275 10 6 J
Proses politropik:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118)=30000J
Q=(k-n/k-1) l M=((1,4-1,3)/(1,4-1)) 30000=7500J
Literatur:
1. Energi, Moskow, 1975.
2. Litvin A.M. "Fondasi teoretis teknik panas", penerbit "Energy", Moskow, 1969.
3. Tugunov P.I., Samsonov A.A., "Dasar-dasar teknik panas, mesin panas dan fasilitas tenaga uap", penerbit Nedra, Moskow, 1970.
4. Krutov V.I., "Teknik panas", penerbit "Teknik", Moskow, 1986.
Campuran gas. Kapasitas panas gas
Campuran gas dipahami sebagai campuran mekanis dari beberapa gas yang tidak berinteraksi secara kimia satu sama lain. Campuran gas ideal mematuhi semua hukum yang berkaitan dengan gas ideal. Komposisi campuran gas ditentukan oleh jumlah masing-masing gas yang termasuk dalam campuran, dan dapat ditentukan oleh fraksi massa atau volume:
dimana adalah massa komponen ke -, adalah volume komponen - ke, dan dan adalah massa dan volume seluruh campuran.
Jelas itu
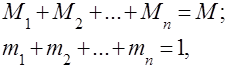
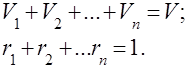
Untuk memudahkan penyelesaian masalah praktis dengan campuran gas, konsep berat molekul yang tampak dari campuran gas diperkenalkan, yang merupakan massa rata-rata dari berat molekul sebenarnya dari masing-masing komponen campuran.
Persamaan keadaan untuk campuran gas memiliki bentuk:
Campuran gas tunduk pada konsep konstanta gas universal
Hubungan antara tekanan campuran gas dan tekanan parsial masing-masing komponen yang termasuk dalam campuran ditetapkan oleh hukum Dalton:
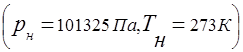
1 gas memiliki massa yang berbeda tergantung pada tekanan dan suhu. Dalam hal ini, kapasitas kalor volumetrik selalu mengacu pada massa gas yang tertutup 1 dalam kondisi normal. Dalam hal ini, volume 1 kmol berbagai gas adalah 22,4 / kmol, dan konstanta gas universal adalah . Bergantung pada metode suplai panas ke gas, ada kapasitas panas isobarik dan isokorik. Rasio jumlah ini disebut eksponen adiabatik
Kapasitas panas dan juga terkait dengan hubungan Mayer
Jumlah panas yang harus dikeluarkan dalam proses memanaskan 1 kg gas dalam kisaran suhu dari hingga ditentukan dengan rumus:
di mana dan adalah, masing-masing, kapasitas panas rata-rata dalam 0°- dan 0°-.
Jika (kg) atau () gas terlibat dalam proses, maka
Kapasitas panas campuran gas harus ditentukan dengan rumus:
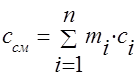
massa - ;
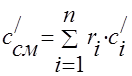
volumetrik -;
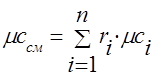
molar - .
Untuk menggunakan panas gas yang merupakan produk pembakaran bahan bakar di unit ketel, pemanas udara dari udara yang diperlukan untuk pembakaran bahan bakar dipasang di saluran gas yang terakhir (Gbr. 1). Gas yang keluar dari ketel memasuki pemanas udara dengan suhu dan didinginkan, melepaskan panas ke udara, hingga. Di saluran gas unit ketel, di bawah pengaruh pengoperasian penghisap asap, tekanan diatur sedikit di bawah atmosfer. Udara di pemanas udara dipanaskan dari suhu ke suhu.
gas buang
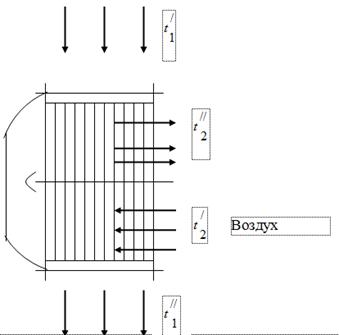
Saat menguji unit boiler, data berikut diperoleh:
Suhu gas di saluran masuk ke pemanas udara, = 450 °C.
Suhu gas di outlet pemanas udara, = 150 ° C.
Temperatur udara pada inlet menuju air heater, = 26°C.
Temperatur udara di outlet air heater, = 260 °C.
Komposisi volumetrik gas buang - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Konsumsi gas per jam pada adalah 50 ·/jam.
Vakum di saluran gas - 15 mm air. Seni.
Tekanan udara 760 mm Hg. Seni.
Mendefinisikan:
berat molekul yang jelas dari gas buang;
konstanta gas buang gas;
fraksi berat (massa) dari masing-masing komponen yang membentuk gas buang;
tekanan parsial komponen:
aliran udara per jam.
Asumsikan bahwa semua panas yang dilepaskan oleh gas diambil oleh udara.
Ketergantungan kapasitas panas pada suhu dianggap lengkung.
1. Berat molekul gas buang yang tampak
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Konstanta gas gas buang
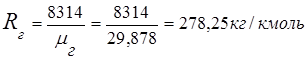
3. Fraksi massa komponen gas
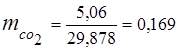
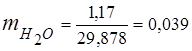
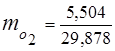
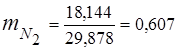
4. Tekanan parsial komponen
Hasil perhitungan akan dimasukkan ke dalam tabel
|
Pilihan |
campuran gas |
|||
|
|
||||
|
|
||||
|
|
5. Konsumsi udara setiap jam
Konsumsi udara ditentukan dari persamaan keseimbangan panas dari pemanas udara
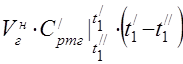
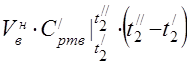
kapasitas panas molar rata-rata pada 450 °C
Kapasitas panas spesifik rata-rata komponen pada kisaran suhu 0 ... 450 ° C.













 .
(1.28)
.
(1.28)