Se mide la cantidad de calor en el sistema SI. Métodos y medios para medir la cantidad de calor.
Calor- la energía transferida de un cuerpo más caliente a uno menos calentado por contacto directo o por radiación.
La temperatura es una medida de la intensidad del movimiento molecular.
La cantidad de calor que posee un cuerpo a una temperatura dada depende de su masa; Por ejemplo, a la misma temperatura, se almacena más calor en una taza grande de agua que en una pequeña, y en un balde de agua fría puede almacenarse más que en una taza de agua. agua caliente(aunque la temperatura del agua en el cubo es más baja).
El calor juega un papel importante en la vida humana, incluso en el funcionamiento de su cuerpo. Parte de la energía química contenida en los alimentos se convierte en calor, por lo que la temperatura corporal se mantiene cercana a los 37°C. El balance de calor del cuerpo humano también depende de la temperatura. ambiente, y la gente se ve obligada a gastar mucha energía en calentar locales residenciales e industriales en invierno y enfriarlos en verano. La mayor parte de esta energía es suministrada por máquinas térmicas, como plantas de calderas y turbinas de vapor de centrales eléctricas que funcionan con combustibles fósiles (carbón, petróleo) y generan electricidad.
Hasta finales del siglo XVIII. el calor era considerado una sustancia material, creyendo que la temperatura de un cuerpo está determinada por la cantidad de<калорической жидкости>, o<теплорода>. Más tarde, B. Rumford, J. Joule y otros físicos de la época, a través de ingeniosos experimentos y razonamientos, refutó<калорическую>teoría, demostrando que el calor no tiene peso y puede obtenerse en cualquier cantidad simplemente debido al movimiento mecánico. El calor en sí mismo no es una sustancia, es solo la energía del movimiento de sus átomos o moléculas. Es esta comprensión del calor a la que se adhiere la física moderna.
En este artículo, veremos cómo se relacionan el calor y la temperatura y cómo se miden estas cantidades. El tema de nuestra discusión también serán las siguientes preguntas: la transferencia de calor de una parte del cuerpo a otra; transferencia de calor en el vacío (un espacio que no contiene materia); El papel del calor en el mundo moderno.
Calor y temperatura
La cantidad de energía térmica en una sustancia no se puede determinar observando el movimiento de cada una de sus moléculas por separado. Por el contrario, solo estudiando las propiedades macroscópicas de la materia, se pueden encontrar las características del movimiento microscópico de muchas moléculas promediadas durante un cierto período de tiempo. La temperatura de una sustancia es el indicador promedio de la intensidad del movimiento de las moléculas, cuya energía es energía térmica sustancias
Una de las formas más familiares, pero también menos precisas, de estimar la temperatura es mediante el tacto. Al tocar un objeto, juzgamos si está caliente o frío, enfocándonos en nuestros sentimientos. Por supuesto, estas sensaciones dependen de la temperatura de nuestro cuerpo, lo que nos lleva al concepto de equilibrio térmico, uno de los más importantes en la medición de la temperatura.
Equilibrio termal
Equilibrio térmico entre los cuerpos A y B
Obviamente, si dos cuerpos A y B se presionan fuertemente uno contra el otro, luego de tocarlos después de un tiempo suficientemente largo, notaremos que su temperatura es la misma. En este caso, se dice que los cuerpos A y B están en equilibrio térmico entre sí. Sin embargo, los cuerpos, en términos generales, no tienen que estar en contacto para que exista un equilibrio térmico entre ellos, basta con que sus temperaturas sean las mismas. Esto se puede verificar usando el tercer cuerpo C, primero poniéndolo en equilibrio térmico con el cuerpo A, y luego comparando las temperaturas de los cuerpos C y B. El cuerpo C aquí juega el papel de un termómetro. En una formulación estricta, este principio se denomina ley cero de la termodinámica: si los cuerpos A y B están en equilibrio térmico con un tercer cuerpo C, entonces estos cuerpos también están en equilibrio térmico entre sí. Esta ley es la base de todos los métodos de medición de la temperatura.
Medición de temperatura

Escalas de temperatura

termómetros
Termómetros basados en efectos eléctricos
Si queremos realizar experimentos y cálculos precisos, entonces las clasificaciones de temperatura como calor, tibio, fresco, frío no son suficientes: necesitamos una escala de temperatura graduada. Hay varias escalas de este tipo, y los puntos de congelación y ebullición del agua se suelen tomar como puntos de referencia. Las cuatro escalas más comunes se muestran en la figura. La escala centígrada, según la cual el punto de congelación del agua corresponde a 0 ° y el punto de ebullición a 100 °, se llama escala Celsius y lleva el nombre de A. Celsius, un astrónomo sueco que la describió en 1742. Se cree que el El naturalista sueco K. Linnaeus aplicó por primera vez esta escala. Ahora la escala Celsius es la más común en el mundo. La escala de temperatura Fahrenheit, en la que los puntos de congelación y ebullición del agua corresponden a números sumamente incómodos de 32 y 212°, fue propuesta en 1724 por G. Fahrenheit. La escala Fahrenheit se usa mucho en los países de habla inglesa, pero apenas se usa en la literatura científica. Para convertir temperatura Celsius (°C) a temperatura Fahrenheit (°F), hay una fórmula °F = (9/5)°C + 32, y para la traducción inversa - la fórmula °C = (5/9) ( °F-32).
Ambas escalas, tanto Fahrenheit como Celsius, son muy inconvenientes cuando se realizan experimentos en condiciones en las que la temperatura cae por debajo del punto de congelación del agua y se expresa como un número negativo. Para tales casos, se introdujeron escalas de temperatura absoluta, que se basan en la extrapolación al llamado cero absoluto, el punto en el que debe detenerse el movimiento molecular. Una de ellas se llama escala de Rankin y la otra se llama escala termodinámica absoluta; las temperaturas se miden en grados Rankine (°R) y kelvins (K). Ambas escalas comienzan en el cero absoluto, y el punto de congelación del agua corresponde a 491,7 ° R y 273,16 K. El número de grados y kelvin entre los puntos de congelación y ebullición del agua en la escala Celsius y la escala termodinámica absoluta es el mismo e igual. a 100; para las escalas Fahrenheit y Rankine, también es lo mismo, pero igual a 180. Los grados Celsius se convierten en kelvin usando la fórmula K \u003d ° C + 273.16, y los grados Fahrenheit se convierten en grados Rankine usando la fórmula ° R \u003d °F + 459.7.
El funcionamiento de los dispositivos diseñados para medir la temperatura se basa en varios fenómenos físicos asociados con un cambio en la energía térmica de una sustancia: cambios en la resistencia eléctrica, volumen, presión, características radiativas, propiedades termoeléctricas. Uno de los instrumentos de medición de temperatura más simples y familiares es el termómetro de vidrio que se muestra en la figura. La bola c de la parte inferior del termómetro se coloca en el medio o se presiona contra el objeto cuya temperatura se quiere medir, y dependiendo de si la bola recibe calor o lo cede, se dilata o se contrae y su columna sube o baja en el capilar Si el termómetro está precalibrado y equipado con una escala, puede averiguar directamente la temperatura corporal.
Otro dispositivo cuya acción se basa en la expansión térmica es el termómetro bimetálico que se muestra en la figura. Su elemento principal es una placa espiral de dos metales soldados con diferentes coeficientes de expansión térmica. Cuando se calienta, uno de los metales se expande más que el otro, la espiral gira y gira la flecha en relación con la escala. Dichos dispositivos se utilizan a menudo para medir la temperatura del aire interior y exterior, pero no son adecuados para determinar la temperatura local.
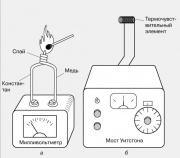
La temperatura local generalmente se mide con un termopar, que consiste en dos cables de diferentes metales soldados en un extremo. Cuando se calienta una unión de este tipo, surge un EMF en los extremos libres de los cables, generalmente de unos pocos milivoltios. Los termopares están hechos de diferentes pares de metales: hierro y constantán, cobre y constantán, cromel y alumel. Su termo-EMF cambia casi linealmente con la temperatura en un amplio rango de temperatura.
También se conoce otro efecto termoeléctrico: la dependencia de la resistencia de un material conductor con la temperatura. Es la base del funcionamiento de los termómetros de resistencia eléctrica, uno de los cuales se muestra en la figura. La resistencia de un elemento sensor de temperatura pequeño (termopar), generalmente bobinas de alambre delgado, se compara con la resistencia de una resistencia variable calibrada utilizando un puente de Wheatstone. El instrumento de salida se puede graduar directamente en grados.
Los pirómetros ópticos se utilizan para medir la temperatura de cuerpos calientes que emiten luz visible. En una versión de este dispositivo, la luz emitida por el cuerpo se compara con la radiación de un filamento de lámpara incandescente colocado en el plano focal de los binoculares a través de los cuales se ve el cuerpo emisor. La corriente eléctrica, que calienta el filamento de la lámpara, se cambia hasta que, al comparar visualmente el brillo del filamento y el cuerpo, se encuentra que se ha establecido el equilibrio térmico entre ellos. La escala del dispositivo se puede graduar directamente en unidades de temperatura.
avances tecnicos años recientes permitió crear nuevos sensores de temperatura. Por ejemplo, en los casos en que se necesita una sensibilidad particularmente alta, en lugar de un termopar o un termómetro de resistencia convencional, se usa un dispositivo semiconductor: termistor. Los colorantes y los cristales líquidos que cambian su estado de fase también se utilizan como convertidores térmicos, especialmente en los casos en que la temperatura de la superficie del cuerpo varía en un amplio rango. Por último, se utiliza la termografía infrarroja, en la que se obtiene una imagen infrarroja de un objeto en colores condicionales, donde cada color corresponde a una determinada temperatura. Este método de medición de temperatura encuentra la aplicación más amplia - desde diagnostico medico antes de comprobar el aislamiento térmico del local.
Midiendo la cantidad de calor
calorímetro de agua
La energía térmica (cantidad de calor) de un cuerpo se puede medir directamente con el llamado calorímetro; En la figura se muestra una versión simple de dicho dispositivo. Es un recipiente cerrado cuidadosamente aislado, equipado con dispositivos para medir la temperatura en su interior y, a veces, lleno de un fluido de trabajo de propiedades conocidas, como el agua. Para medir la cantidad de calor en un cuerpo pequeño calentado, se coloca en un calorímetro y se espera que el sistema entre en equilibrio térmico. La cantidad de calor transferido al calorímetro (más precisamente, al agua que lo llena) está determinada por el aumento de la temperatura del agua.
La cantidad de calor liberado durante una reacción química, como la combustión, se puede medir colocando un pequeño<бомбу>. A<бомбе>se ubica una muestra, a la cual se conectan cables eléctricos para el encendido, y la correspondiente cantidad de oxígeno. Una vez que la muestra se quema por completo y se establece el equilibrio térmico, se determina cuánto ha aumentado la temperatura del agua en el calorímetro y, por lo tanto, la cantidad de calor liberado.
unidades de calor
El calor es una forma de energía y, por lo tanto, debe medirse en unidades de energía. En el sistema internacional SI, la unidad de energía es el joule (J). También está permitido usar unidades fuera del sistema de la cantidad de calor: calorías: una caloría internacional es 4.1868 J, una caloría termoquímica es 4.1840 J. En laboratorios extranjeros, los resultados de la investigación a menudo se expresan utilizando el llamado. Una caloría de 15 grados equivalente a 4,1855 J. La unidad térmica británica (BTU) fuera del sistema está cayendo en desuso: BTU avg = 1,055 J.
Fuentes de calor
Las principales fuentes de calor son las reacciones químicas y nucleares, así como diversos procesos de conversión de energía. Ejemplos de reacciones químicas con liberación de calor son la combustión y la descomposición de los componentes de los alimentos. Casi todo el calor que recibe la Tierra es proporcionado por reacciones nucleares que ocurren en las profundidades del Sol. La humanidad ha aprendido a obtener calor con la ayuda de procesos controlados de fisión nuclear, y ahora está tratando de utilizar las reacciones de fusión termonuclear con el mismo propósito. Otros tipos de energía también se pueden convertir en calor, como el trabajo mecánico y la energía eléctrica. Es importante recordar que la energía térmica (como cualquier otra) solo se puede convertir en otra forma, pero no se puede obtener.<из ничего>, ni destruir. Este es uno de los principios básicos de la ciencia llamada termodinámica.
Termodinámica
Termodinámica es la ciencia de la relación entre el calor, el trabajo y la materia. Las ideas modernas sobre estas relaciones se formaron sobre la base de los trabajos de grandes científicos del pasado como Carnot, Clausius, Gibbs, Joule, Kelvin y otros.La termodinámica explica el significado de la capacidad calorífica y la conductividad térmica de una sustancia, la expansión térmica de los cuerpos y el calor de las transiciones de fase. Esta ciencia se basa en varias leyes establecidas experimentalmente: principios.
Calor y propiedades de las sustancias.
Varias sustancias tienen diferente capacidad para acumular energía térmica; depende de su estructura molecular y densidad. La cantidad de calor necesaria para elevar la temperatura de una unidad de masa de una sustancia en un grado se denomina capacidad calorífica específica. La capacidad calorífica depende de las condiciones en las que se encuentra la sustancia. Por ejemplo, para calentar un gramo de aire en un globo en 1 K, se requiere más calor que para calentarlo de la misma manera en un recipiente sellado con paredes rígidas, ya que parte de la energía impartida al globo se gasta en expandir el aire. , y no en calentarlo. Por lo tanto, en particular, la capacidad calorífica de los gases se mide por separado a presión constante ya volumen constante.
Con un aumento de la temperatura, aumenta la intensidad del movimiento caótico de las moléculas: la mayoría de las sustancias se expanden cuando se calientan. El grado de expansión de una sustancia con un aumento de temperatura de 1 K se llama coeficiente de expansión termal.
Para que una sustancia pase de un estado de fase a otro, por ejemplo, de sólido a líquido (ya veces inmediatamente a gaseoso), debe recibir una cierta cantidad de calor. si se calienta sólido, luego su temperatura subirá hasta que comience a derretirse; hasta que se complete la fusión, la temperatura del cuerpo permanecerá constante a pesar de la entrada de calor. La cantidad de calor necesaria para fundir una unidad de masa de una sustancia se denomina calor de fusión. Si continúa suministrando calor, la sustancia fundida se calentará hasta hervir. La cantidad de calor requerida para vaporizar una unidad de masa de un líquido a una temperatura dada se llama calor de vaporización.
El papel del calor y su uso.
Esquema de operación de una central eléctrica de turbina de vapor.
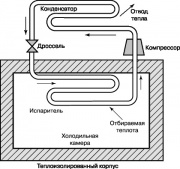
Diagrama del ciclo de refrigeración
Los procesos globales de transferencia de calor no se reducen al calentamiento de la Tierra por la radiación solar. Las corrientes de convección masivas en la atmósfera determinan los cambios diarios en las condiciones climáticas en todo el mundo. Las diferencias de temperatura en la atmósfera entre las regiones ecuatorial y polar, junto con las fuerzas de Coriolis debidas a la rotación de la Tierra, dan lugar a la aparición de corrientes de convección en constante cambio, como los vientos alisios, las corrientes en chorro y los frentes cálidos y fríos.
La transferencia de calor (debido a la conductividad térmica) desde el núcleo fundido de la Tierra a su superficie provoca erupciones volcánicas y la aparición de géiseres. En algunas regiones, la energía geotérmica se utiliza para calentar espacios y generar energía.
El calor es un participante indispensable en casi todas procesos de producción. Mencionaremos los más importantes, como la fundición y el procesamiento de metales, la operación de motores, la producción de alimentos, la síntesis química, la refinación de petróleo, la fabricación de una variedad de artículos, desde ladrillos y platos hasta automóviles y dispositivos electrónicos.
Muchas producciones y transportes industriales, así como centrales térmicas, no podrían funcionar sin motores térmicos, dispositivos que convierten el calor en trabajo útil. Ejemplos de tales máquinas son compresores, turbinas, vapor, gasolina y motores a reacción.
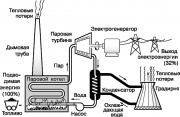
Uno de los motores térmicos más conocidos es la turbina de vapor, que implementa parte del ciclo Rankine utilizado en las centrales eléctricas modernas. En la figura se muestra un diagrama simplificado de este ciclo. El fluido de trabajo, el agua, se convierte en vapor sobrecalentado en una caldera de vapor calentada por la quema de combustibles fósiles (carbón, petróleo o gas natural). Vapor alto
Gasovik: equipos de gas industrial Directorio de GOST, SNiP, PB Unidades de cantidades físicas, conceptos fisicoquímicos, proporciones, composición y características de los gases.
Unidades de medida de temperatura y cantidad de calor.
La unidad básica de medida de la temperatura era el grado de la Escala Internacional de Temperatura, que prácticamente corresponde al grado Celsius. Este valor es igual a 1/100 del intervalo de temperatura entre 0 y 100 °C, es decir, entre los puntos de fusión del hielo y el agua hirviendo a una presión de 760 mm Hg. Arte.
La temperatura absoluta es la temperatura medida desde el cero absoluto, es decir, desde -273,16 °C, y medida en grados Kelvin (°K). El grado Kelvin es lo mismo que el grado Celsius. Por lo tanto, la temperatura absoluta se expresa en grados centígrados de la siguiente manera:
T, °K = t, °C + 273,16
En el sistema SI, la unidad de temperatura es el Kelvin. Se permite expresar los resultados prácticos de las mediciones de temperatura usando el grado Celsius junto con el grado Kelvin, dependiendo del origen (posición del cero) en la escala.
Ejemplo: 250 ±5 °С = 523,16 ±5 °K.
En el sistema SI, el trabajo, la energía y el calor se miden en julios (J). A veces se usa una unidad más grande y más conveniente para fines prácticos: un kilojulio (kJ), igual a 1000 J. Una unidad de trabajo en el SI es el trabajo realizado por una fuerza de 1 N con un desplazamiento de 1 m. cantidad física mostrando cuánto trabajo puede hacer el cuerpo.
Las calorías y las kilocalorías se pueden utilizar como unidades de calor fuera del sistema. Una caloría es la cantidad de calor necesaria para elevar la temperatura de 1 gramo de agua en 1°C (19,5 a 20,5°C).
1 cal (caloría) = 4,1868 J;
1 kcal (kilocaloría) \u003d 1000 cal \u003d 4186.8 J \u003d 4.187 kJ;
1 Mcal (megacaloría) \u003d 10 6 cal \u003d 4.1868 MJ;
1 Gcal (gigacaloría) \u003d 10 9 cal \u003d 4186.8 MJ.
A modo de comparación, al evaluar el combustible, se utiliza el llamado calor condicional, cuyo valor calorífico para el cálculo se supone condicionalmente igual a 7 Mcal/kg o 7 Gcal/t. En tales casos, se habla, respectivamente, de 1 kg o 1 tonelada de combustible estándar (t.c.f.).
El calor juega un papel importante en la vida humana, incluso en el funcionamiento de su cuerpo. Parte de la energía química contenida en los alimentos se convierte en calor, por lo que la temperatura corporal se mantiene cerca de los 37
° C. El equilibrio térmico del cuerpo humano también depende de la temperatura ambiente, y las personas se ven obligadas a gastar mucha energía en calentar locales residenciales e industriales en invierno y enfriarlos en verano. La mayor parte de esta energía es suministrada por máquinas térmicas, como plantas de calderas y turbinas de vapor de centrales eléctricas que funcionan con combustibles fósiles (carbón, petróleo) y generan electricidad.Hasta finales del siglo XVIII. el calor era considerado una sustancia material, creyendo que la temperatura de un cuerpo está determinada por la cantidad de "líquido calórico" o "calórico" contenido en él. Más tarde, B. Rumford, J. Joule y otros físicos de la época, a través de ingeniosos experimentos y razonamientos, refutó la teoría "calórica", demostrando que el calor es ingrávido y puede obtenerse en cualquier cantidad simplemente debido al movimiento mecánico. El calor en sí mismo no es una sustancia, es solo la energía del movimiento de sus átomos o moléculas. Es esta comprensión del calor a la que se adhiere la física moderna. ver también FÍSICA.
En este artículo, veremos cómo se relacionan el calor y la temperatura y cómo se miden estas cantidades. El tema de nuestra discusión también serán las siguientes preguntas: la transferencia de calor de una parte del cuerpo a otra; transferencia de calor en el vacío (un espacio que no contiene materia); El papel del calor en el mundo moderno.
CALOR Y TEMPERATURA La cantidad de energía térmica en una sustancia no se puede determinar observando el movimiento de cada una de sus moléculas por separado. Por el contrario, solo estudiando las propiedades macroscópicas de la materia, se pueden encontrar las características del movimiento microscópico de muchas moléculas promediadas durante un cierto período de tiempo. La temperatura de una sustancia es un indicador promedio de la intensidad del movimiento de las moléculas, cuya energía es la energía térmica de una sustancia.Una de las formas más conocidas, pero también las menos precisas, de evaluar la temperatura al tacto. Al tocar un objeto, juzgamos si está caliente o frío, enfocándonos en nuestros sentimientos. Por supuesto, estas sensaciones dependen de la temperatura de nuestro cuerpo, lo que nos lleva al concepto de equilibrio térmico, uno de los más importantes a la hora de medir la temperatura.
Equilibrio térmico. Obviamente, si dos cuerpos un y B (Fig. 1) apretados uno contra el otro, luego, habiéndolos tocado después de un tiempo suficientemente largo, notaremos que su temperatura es la misma. En este caso, se dice que los cuerpos son un y B están en equilibrio térmico entre sí. Sin embargo, los cuerpos, en general, no tienen que estar en contacto para que exista equilibrio térmico entre ellos, basta que sus temperaturas sean las mismas. Esto se puede verificar usando el tercer cuerpo. C , llevándolo primero al equilibrio térmico con el cuerpo A , y luego comparando las temperaturas de los cuerpos C y b. Cuerpo C Aquí juega el papel de un termómetro. En una formulación estricta, este principio se llama ley cero de la termodinámica: si los cuerpos A y B están en equilibrio térmico con un tercer cuerpo C, entonces estos cuerpos también están en equilibrio térmico entre sí. Esta ley es la base de todos los métodos de medición de la temperatura.Medición de temperatura. Si queremos realizar experimentos y cálculos precisos, entonces las clasificaciones de temperatura como calor, tibio, fresco, frío no son suficientes, necesitamos una escala de temperatura graduada. Hay varias escalas de este tipo, y los puntos de congelación y ebullición del agua se suelen tomar como puntos de referencia. Las cuatro escalas más comunes se muestran en la fig. 2. Escala centígrada, según la cual el punto de congelación del agua corresponde a 0° , y el punto de ebullición es 100° , se llama la escala Celsius que lleva el nombre de A. Celsius, un astrónomo sueco que la describió en 1742. Se cree que el naturalista sueco K. Linney fue el primero en utilizar esta escala. Ahora la escala Celsius es la más común en el mundo. La escala de temperatura Fahrenheit, en la que los puntos de congelación y ebullición del agua corresponden a los extremadamente incómodos números 32 y 212° , fue propuesto en 1724 por G. Fahrenheit. La escala Fahrenheit se usa mucho en los países de habla inglesa, pero apenas se usa en la literatura científica. Para convertir la temperatura a Celsius (° C) a la temperatura Fahrenheit (° F) hay una fórmula°F = (9/5) ° C + 32, y para la fórmula de traducción inversa°C = (5/9)(°F - 32). Ambas escalas, tanto Fahrenheit como Celsius, son muy inconvenientes cuando se realizan experimentos en condiciones en las que la temperatura cae por debajo del punto de congelación del agua y se expresa como un número negativo. Para tales casos, se han introducido escalas de temperatura absoluta, que se basan en la extrapolación al llamado cero absoluto, el punto en el que debe detenerse el movimiento molecular. Una de ellas se llama escala de Rankin y la otra se llama escala termodinámica absoluta; Las temperaturas se miden en grados Rankine (° R) y Kelvin (K). Ambas escalas comienzan en el cero absoluto y el punto de congelación del agua es 491,7° R y 273,16 K. El número de grados y kelvins entre los puntos de congelación y ebullición del agua en la escala Celsius y la escala termodinámica absoluta es el mismo e igual a 100; para las escalas Fahrenheit y Rankine, también es lo mismo, pero igual a 180. Los grados Celsius se convierten en kelvin usando la fórmula K \u003d° C + 273.16, y grados Fahrenheit a grados Rankine usando la fórmula°R = °F + 459,7. El funcionamiento de los dispositivos diseñados para medir la temperatura se basa en varios fenómenos físicos asociados con un cambio en la energía térmica de una sustancia, cambios en la resistencia eléctrica, volumen, presión, características radiativas y propiedades termoeléctricas. Uno de los instrumentos más simples y familiares para medir la temperatura es el termómetro de mercurio en vidrio que se muestra en la fig. 3, una. La bola con mercurio en la parte inferior del termómetro se coloca en el medio o se presiona contra el objeto cuya temperatura se quiere medir, y dependiendo de si la bola recibe calor o lo cede, el mercurio se dilata o se contrae y su columna sube. o cae en el capilar. Si el termómetro está precalibrado y equipado con una escala, puede averiguar directamente la temperatura corporal.Otro dispositivo cuyo funcionamiento se basa en la expansión térmica es el termómetro bimetálico que se muestra en la fig.
3, b. Su elemento principal placa espiral de dos metales soldados con diferentes coeficientes de dilatación térmica. Cuando se calienta, uno de los metales se expande más que el otro, la espiral gira y gira la flecha en relación con la escala. Dichos dispositivos se utilizan a menudo para medir la temperatura del aire interior y exterior, pero no son adecuados para determinar la temperatura local.La temperatura local generalmente se mide usando un termopar, que son dos alambres de diferentes metales soldados en un extremo (Fig.
4, a). Cuando se calienta una unión de este tipo, surge una fem en los extremos libres de los cables, generalmente de unos pocos milivoltios. Los termopares están hechos de diferentes pares de metales: hierro y constantán, cobre y constantán, cromel y alumel. Su termo-EMF cambia casi linealmente con la temperatura en un amplio rango de temperatura.También se conoce otro efecto termoeléctrico: la dependencia de la resistencia de un material conductor con la temperatura. Es la base del funcionamiento de los termómetros de resistencia eléctrica, uno de los cuales se muestra en la Fig.
4, b. La resistencia de un pequeño elemento sensible a la temperatura (sensor térmico), generalmente bobinas de alambre delgado, se compara con la resistencia de una resistencia variable calibrada utilizando un puente de Wheatstone. El instrumento de salida se puede graduar directamente en grados.Los pirómetros ópticos se utilizan para medir la temperatura de cuerpos incandescentes que emiten luz visible. En una versión de este dispositivo, la luz emitida por el cuerpo se compara con la radiación de un filamento de lámpara incandescente colocado en el plano focal de los binoculares a través de los cuales se ve el cuerpo emisor. La corriente eléctrica que calienta el filamento de la lámpara cambia hasta que una comparación visual del brillo del filamento y el cuerpo revela que se ha establecido el equilibrio térmico entre ellos. La escala del dispositivo se puede graduar directamente en unidades de temperatura.
Los avances técnicos de los últimos años han hecho posible la creación de nuevos sensores de temperatura. Por ejemplo, en los casos en que se necesita una sensibilidad particularmente alta, se utiliza un dispositivo semiconductor, el termistor, en lugar de un termopar o un termómetro de resistencia convencional. Los colorantes y los cristales líquidos que cambian su estado de fase también se utilizan como convertidores térmicos, especialmente en los casos en que la temperatura de la superficie del cuerpo varía en un amplio rango. Por último, se utiliza la termografía infrarroja, en la que se obtiene una imagen infrarroja de un objeto en colores condicionales, donde cada color corresponde a una determinada temperatura. Este método de medición de temperatura encuentra la aplicación más amplia desde el diagnóstico médico hasta la verificación del aislamiento térmico de las habitaciones. ver también FÍSICA DEL ESTADO SÓLIDO; CRISTAL LIQUIDO.
Medición de la cantidad de calor. La energía térmica (cantidad de calor) de un cuerpo se puede medir directamente con el llamado calorímetro; Una versión simple de dicho dispositivo se muestra en la Fig. 5. Este es un recipiente cerrado cuidadosamente aislado, equipado con dispositivos para medir la temperatura en su interior y, a veces, lleno de un fluido de trabajo con propiedades conocidas, como el agua. Para medir la cantidad de calor en un cuerpo pequeño calentado, se coloca en un calorímetro y se espera que el sistema entre en equilibrio térmico. La cantidad de calor transferido al calorímetro (más precisamente, al agua que lo llena) está determinada por el aumento de la temperatura del agua.La cantidad de calor liberado durante una reacción química, como la combustión, se puede medir colocando una pequeña "bomba" en el calorímetro. La "bomba" contiene una muestra, a la que se conectan cables eléctricos para la ignición, y la cantidad correspondiente de oxígeno. Una vez que la muestra se quema por completo y se establece el equilibrio térmico, se determina cuánto ha aumentado la temperatura del agua en el calorímetro y, por lo tanto, la cantidad de calor liberado. ver también CALORIMETRÍA.
Unidades de calor. El calor es una forma de energía y, por lo tanto, debe medirse en unidades de energía. En el sistema internacional SI, la unidad de energía es el joule (J). También está permitido usar unidades no sistémicas de la cantidad de calorías de calor: una caloría internacional es 4.1868 J, una caloría termoquímica es 4.1840 J. En laboratorios extranjeros, los resultados de la investigación a menudo se expresan utilizando el llamado. Una caloría de 15 grados equivalente a 4,1855 J. La unidad térmica británica (BTU) fuera del sistema está cayendo en desuso: BTU avg = 1,055 J. Las principales fuentes de calor son las reacciones químicas y nucleares, así como diversos procesos de conversión de energía. Ejemplos de reacciones químicas con liberación de calor son la combustión y la descomposición de los componentes de los alimentos. Casi todo el calor que recibe la Tierra es proporcionado por reacciones nucleares que ocurren en las profundidades del Sol. La humanidad ha aprendido a obtener calor con la ayuda de procesos controlados de fisión nuclear, y ahora está tratando de utilizar las reacciones de fusión termonuclear con el mismo propósito. Otros tipos de energía también se pueden convertir en calor, como el trabajo mecánico y la energía eléctrica. Es importante recordar que la energía térmica (como cualquier otra) solo puede transformarse en otra forma, pero no puede obtenerse "de la nada" ni destruirse. Este es uno de los principios básicos de la ciencia llamada termodinámica. TERMODINÁMICA La termodinámica es la ciencia de la relación entre el calor, el trabajo y la materia. Las ideas modernas sobre estas relaciones se formaron sobre la base de los trabajos de grandes científicos del pasado como Carnot, Clausius, Gibbs, Joule, Kelvin y otros.La termodinámica explica el significado de la capacidad calorífica y la conductividad térmica de una sustancia, la expansión térmica de los cuerpos y el calor de las transiciones de fase. Esta ciencia se basa en varios principios legales establecidos experimentalmente.Principios de la termodinámica. La ley cero de la termodinámica formulada anteriormente introduce los conceptos de equilibrio térmico, temperatura y termometría. La primera ley de la termodinámica es una declaración de importancia clave para toda la ciencia en su conjunto: la energía no se puede destruir ni obtener "de la nada", por lo que la energía total del Universo es un valor constante. En su forma más simple, la primera ley de la termodinámica puede enunciarse de la siguiente manera: la energía que recibe el sistema, menos la energía que cede, es igual a la energía que queda en el sistema. A primera vista, esta afirmación parece obvia, pero no en tal, por ejemplo, situaciones como la combustión de gasolina en los cilindros del motor de un automóvil: aquí la energía recibida es química, la energía desprendida es mecánica (trabajo) y la energía que queda en el sistema es térmica.Entonces, está claro que la energía puede cambiar de una forma a otra y que tales transformaciones ocurren constantemente en la naturaleza y la tecnología. Hace más de cien años, J. Joule demostró esto para el caso de la conversión de energía mecánica en energía térmica utilizando el dispositivo que se muestra en la fig. 6, a. En este dispositivo, los pesos que descendían y ascendían hacían girar un eje con cuchillas en un calorímetro lleno de agua, como resultado de lo cual se calentaba el agua. Las mediciones precisas permitieron a Joule determinar que una caloría de calor equivale a 4,186 J de trabajo mecánico. El dispositivo mostrado en la fig.
6, b, se utilizó para determinar el equivalente térmico de la energía eléctrica.La primera ley de la termodinámica explica muchos fenómenos comunes. Por ejemplo, queda claro por qué es imposible enfriar la cocina con un refrigerador abierto. Supongamos que hemos aislado térmicamente la cocina del entorno. La energía se suministra continuamente al sistema a través del cable de alimentación del refrigerador, pero el sistema no emite energía. Por lo tanto, su energía total aumenta y la cocina se calienta: solo toque los tubos del intercambiador de calor (condensador) en la parte posterior del refrigerador y comprenderá su inutilidad como dispositivo de "enfriamiento". Pero si estas tuberías se sacaran del sistema (por ejemplo, por la ventana), la cocina daría más energía de la que recibe, es decir, se enfriaría, y el refrigerador funcionaba como un acondicionador de aire de ventana.
La primera ley de la termodinámica es una ley de la naturaleza que excluye la creación o destrucción de energía. Sin embargo, no dice nada acerca de cómo proceden los procesos de transferencia de energía en la naturaleza. Así, sabemos que un cuerpo caliente calentará a uno frío si estos cuerpos se ponen en contacto. Pero, ¿puede un cuerpo frío por sí mismo transferir su reserva de calor a uno caliente? Última oportunidad categóricamente rechazada por la segunda ley de la termodinámica.
La primera ley también excluye la posibilidad de crear un motor con un coeficiente acción útil(eficiencia) más del 100% (similar
" eterno " el motor podría emitir más energía durante un tiempo arbitrariamente largo de la que consume). Es imposible construir un motor incluso con una eficiencia igual al 100%, ya que una parte de la energía que se le suministra necesariamente debe perderla en forma de energía térmica menos útil. Entonces, la rueda no girará indefinidamente sin suministro de energía, porque debido a la fricción en los rodamientos, la energía del movimiento mecánico se convertirá gradualmente en calor hasta que la rueda se detenga.La tendencia a convertir el trabajo "útil" en calor de energía menos útil puede compararse con otro proceso que ocurre cuando se conectan dos recipientes que contienen diferentes gases. Después de esperar lo suficiente, encontramos en ambos recipientes una mezcla homogénea de gases que la naturaleza actúa de tal manera que el orden del sistema disminuye. La medida termodinámica de este desorden se llama entropía, y la segunda ley de la termodinámica se puede formular de otra manera: los procesos en la naturaleza siempre se desarrollan de tal manera que aumenta la entropía del sistema y su entorno. Así, la energía del Universo permanece constante, mientras que su entropía crece continuamente.
Calor y propiedades de las sustancias. Diferentes sustancias tienen diferente capacidad para almacenar energía térmica; depende de su estructura molecular y densidad. La cantidad de calor requerida para elevar la temperatura de una unidad de masa de una sustancia en un grado se llama su calor especifico. La capacidad calorífica depende de las condiciones en las que se encuentra la sustancia. Por ejemplo, para calentar un gramo de aire en un globo en 1 K, se requiere más calor que para calentarlo de la misma manera en un recipiente sellado con paredes rígidas, ya que parte de la energía impartida al globo se gasta en expandir el aire. , y no en calentarlo. Por lo tanto, en particular, la capacidad calorífica de los gases se mide por separado a presión constante ya volumen constante.Con un aumento de la temperatura, la intensidad del movimiento caótico de las moléculas aumenta. La mayoría de las sustancias se expanden cuando se calientan. El grado de expansión de una sustancia con un aumento de temperatura de 1 K se denomina coeficiente de expansión térmica.
Para que una sustancia pase de un estado de fase a otro, por ejemplo, de sólido a líquido (ya veces inmediatamente a gaseoso), debe recibir una cierta cantidad de calor. Si se calienta un cuerpo sólido, su temperatura aumentará hasta que comience a fundirse; hasta que se complete la fusión, la temperatura del cuerpo permanecerá constante, a pesar del suministro de calor. La cantidad de calor necesaria para fundir una unidad de masa de una sustancia se denomina calor de fusión. Si continúa suministrando calor, la sustancia fundida se calentará hasta hervir. La cantidad de calor requerida para vaporizar una unidad de masa de un líquido a una temperatura dada se llama calor de vaporización.
Teoría cinética molecular. La teoría cinética molecular explica las propiedades macroscópicas de una sustancia considerando a nivel microscópico el comportamiento de los átomos y moléculas que componen dicha sustancia. En este caso, se usa un enfoque estadístico y se hacen algunas suposiciones sobre las partículas mismas y la naturaleza de su movimiento. Así, las moléculas se consideran bolas sólidas, que en medios gaseosos están en continuo movimiento caótico y recorren distancias considerables de una colisión a otra. Las colisiones se consideran elásticas y ocurren entre partículas cuyo tamaño es pequeño y el número es muy grande. Ninguno de los gases reales se corresponde exactamente con este modelo, pero la mayoría de los gases se aproximan bastante a él, lo que explica el valor práctico de la teoría cinética molecular.Sobre la base de estas ideas y utilizando un enfoque estadístico, Maxwell derivó la distribución de las velocidades de las moléculas de gas en un volumen limitado, que más tarde recibió su nombre. Esta distribución se presenta gráficamente en la fig. 7 para una masa dada de hidrógeno a temperaturas de 100 y 1000
° C. La ordenada representa el número de moléculas que se mueven a la velocidad indicada en la abscisa. El número total de partículas es igual al área bajo cada curva y es el mismo en ambos casos. Se puede ver en el gráfico que la mayoría de las partículas tienen velocidades cercanas a algún valor promedio, y solo un pequeño número de ellas tienen velocidades muy altas o bajas. Las velocidades medias a estas temperaturas se encuentran en el rango de 2000-3000 m/s, es decir muy grande.Una gran cantidad de estas moléculas de gas que se mueven rápidamente actúa con una fuerza completamente medible sobre los cuerpos circundantes. Las fuerzas microscópicas con las que numerosas moléculas de gas golpean las paredes del recipiente se suman a una cantidad macroscópica llamada presión. Cuando se suministra energía a un gas (la temperatura aumenta), la energía cinética promedio de sus moléculas aumenta, las partículas de gas golpean las paredes con más frecuencia y más fuerza, la presión aumenta y, si las paredes no son completamente rígidas, entonces se estiran y el volumen del gas aumenta. Así, el enfoque estadístico microscópico que subyace en la teoría cinética molecular permite explicar el fenómeno de expansión térmica que hemos discutido.
Otro resultado de la teoría cinética molecular es una ley que describe las propiedades de un gas que satisface los requisitos enumerados anteriormente. Esta es la llamada ecuación de estado. gas ideal conecta la presión, el volumen y la temperatura de un mol de gas y tiene la forma de igualdad
PV = RT donde PAGS presión, volumen V, T temperatura, y R constante universal de los gases igual a (8.31441± 0,00026) J/(mol H A). ver también TEORÍA MOLECULAR-CINÉTICA; TERMODINÁMICA. TRANSFERENCIA DE CALOR La transferencia de calor es el proceso de transferir calor dentro de un cuerpo o de un cuerpo a otro, debido a una diferencia de temperatura. La intensidad de la transferencia de calor depende de las propiedades de la sustancia, la diferencia de temperatura y obedece a las leyes de la naturaleza establecidas experimentalmente. Para crear sistemas eficientes de calefacción o refrigeración, varios motores, centrales eléctricas, sistemas de aislamiento térmico, debe conocer los principios de la transferencia de calor. En algunos casos, el intercambio de calor no es deseable (aislamiento térmico de hornos de fusión, naves espaciales, etc.), mientras que en otros debe ser lo más grande posible (calderas de vapor, intercambiadores de calor, utensilios de cocina).Hay tres tipos principales de transferencia de calor: conducción, convección y transferencia de calor radiante.
Conductividad térmica. Si hay una diferencia de temperatura dentro del cuerpo, entonces la energía térmica pasa de su parte más caliente a la más fría. Este tipo de transferencia de calor, debido a movimientos térmicos y colisiones de moléculas, se denomina conductividad térmica; en suficiente altas temperaturas en sólidos se puede observar visualmente. Entonces, cuando una barra de acero se calienta desde un extremo en la llama de un quemador de gas, la energía térmica se transfiere a través de la barra y un resplandor se propaga a cierta distancia del extremo calentado (cada vez menos intenso con la distancia desde el lugar de calefacción).La intensidad de la transferencia de calor debido a la conductividad térmica depende del gradiente de temperatura, es decir, relaciones
D T/D X diferencia de temperatura en los extremos de la varilla a la distancia entre ellos. También depende del área de la sección transversal de la varilla (en m 2 ) y la conductividad térmica del material[ en las unidades correspondientes W/(m ChK)] . La relación entre estas cantidades fue deducida por el matemático francés J. Fourier y tiene la siguiente forma: dónde q flujo de calor, k coeficiente de conductividad térmica, y A área de la sección transversal. Esta relación se llama ley de conducción de calor de Fourier; el signo menos indica que el calor se transfiere en dirección opuesta al gradiente de temperatura.De la ley de Fourier se deduce que el flujo de calor se puede reducir reduciendo una de las cantidades: el coeficiente de conductividad térmica, el área o el gradiente de temperatura. Para un edificio en condiciones invernales, estos últimos valores son prácticamente constantes y, por lo tanto, para mantener la temperatura deseada en la habitación, queda reducir la conductividad térmica de las paredes, es decir. mejorar su aislamiento térmico.
La tabla muestra los coeficientes de conductividad térmica de algunas sustancias y materiales. La tabla muestra que algunos metales conducen el calor mucho mejor que otros, pero todos son mejores conductores del calor que el aire y los materiales porosos.
|
CONDUCTIVIDAD TÉRMICA DE ALGUNAS SUSTANCIAS Y MATERIALES |
|
|
Sustancias y materiales |
Conductividad térmica, W / (m × K) |
| Aluminio | |
| Bronce | |
| Bismuto | |
| Tungsteno | |
| Hierro | |
| Oro | |
| Cadmio | |
| Magnesio | |
| Cobre | |
| Arsénico | |
| Níquel | |
| Platino | |
| Mercurio | |
| Guiar | |
| Zinc | |
|
Otros materiales |
|
| Amianto | |
| Concreto | |
| Aire | |
| Edredón plumón (suelto) | |
| Arbol de nuez) | |
| Magnesia (MgO) | |
| Serrín | |
| Goma (esponja) | |
| Mica | |
| Vidrio | |
| Carbono (grafito) | |
La resistencia térmica y eléctrica de muchas sustancias disminuye bruscamente a medida que la temperatura desciende por debajo de la temperatura del helio líquido (1,8 K). Este fenómeno, llamado superconductividad, se usa para mejorar la eficiencia de muchos dispositivos, desde dispositivos microelectrónicos hasta líneas eléctricas y grandes electroimanes. ver también SUPERCONDUCTIVIDAD.
Convección. Como ya hemos dicho, cuando se aplica calor a un líquido o gas, aumenta la intensidad del movimiento de las moléculas y, en consecuencia, aumenta la presión. Si un líquido o gas no tiene un volumen limitado, entonces se expanden; la densidad local del líquido (gas) se vuelve menor y, debido a las fuerzas de flotación (de Arquímedes), la parte calentada del medio se mueve hacia arriba (es por eso que el aire caliente en la habitación sube desde las baterías hasta el techo). Este fenómeno se llama convección. Para no desperdiciar el calor del sistema de calefacción en vano, debe usar calentadores modernos que proporcionen circulación de aire forzado.El flujo de calor convectivo del calentador al medio calentado depende de la velocidad inicial de las moléculas, la densidad, la viscosidad, la conductividad térmica y la capacidad calorífica, y el medio; el tamaño y la forma del calentador también son muy importantes. La relación entre las cantidades correspondientes obedece la ley de Newton
q = hA( T W- T ), donde q flujo de calor (medido en vatios), A superficie de la fuente de calor (en m 2), T W y T temperatura de la fuente y su entorno (en kelvin). Coeficiente de transferencia de calor por convección h depende de las propiedades del medio, la velocidad inicial de sus moléculas y también de la forma de la fuente de calor, y se mide en unidades de W/(m 2 horas A).Valor
h no es lo mismo para los casos en que el aire alrededor del calentador está estacionario (convección libre) y cuando el mismo calentador está en el flujo de aire (convección forzada). En casos simples de flujo de fluido a través de una tubería o flujo alrededor de una superficie plana, el coeficiente h se puede calcular teóricamente. Sin embargo, aún no ha sido posible encontrar una solución analítica al problema de la convección para un flujo turbulento de un medio. La turbulencia es un movimiento complejo de un líquido (gas), caótico en una escala que excede significativamente las moleculares.Si un cuerpo calentado (o, por el contrario, frío) se coloca en un medio estacionario o en un flujo, se forman corrientes convectivas y una capa límite a su alrededor. La temperatura, la presión y la velocidad de las moléculas en esta capa juegan un papel importante en la determinación del coeficiente de transferencia de calor por convección.
La convección debe tenerse en cuenta en el diseño de intercambiadores de calor, sistemas de aire acondicionado, aeronaves de alta velocidad y muchas otras aplicaciones. En todos estos sistemas, la conducción de calor tiene lugar simultáneamente con la convección, tanto entre los sólidos como en su entorno. A temperaturas elevadas La transferencia de calor radiante también puede desempeñar un papel importante.
Transferencia de calor radiante. El tercer tipo de transferencia de calor, la transferencia de calor radiante difiere de la conducción y la convección de calor en que, en este caso, el calor se puede transferir a través del vacío. Su similitud con otros métodos de transferencia de calor es que también se debe a la diferencia de temperatura. La radiación térmica es uno de los tipos radiación electromagnética. Otros tipos de radiación de ondas de radio, ultravioleta y gamma se producen en ausencia de una diferencia de temperatura.En la fig. 8 muestra la dependencia de la energía de la radiación térmica (infrarroja) en la longitud de onda. La radiación térmica puede ir acompañada de la emisión de luz visible, pero su energía es pequeña en comparación con la energía de radiación de la parte invisible del espectro.
La intensidad de la transferencia de calor por conducción y convección de calor es proporcional a la temperatura, y el flujo de calor radiante es proporcional a la cuarta potencia de la temperatura y obedece a la ley de Stefan Boltzmann.
Los espacios residenciales y de oficinas a menudo se calientan con pequeños emisores de calor eléctricos; el brillo rojizo de sus espirales es radiación térmica visible, cerca del borde de la parte infrarroja del espectro. La habitación se calienta con calor, que es transportado principalmente por la parte infrarroja invisible de la radiación. En dispositivos de visión nocturna
^ Se utiliza una fuente de radiación térmica y un receptor sensible a IR para permitir la visión en la oscuridad.El Sol es un poderoso emisor de energía térmica; calienta la Tierra incluso a una distancia de 150 millones de km. La intensidad de la radiación solar, registrada año tras año por estaciones ubicadas en muchas partes del globo, es de aproximadamente 1,37 W
/ m 2 . La energía solar es la fuente de vida en la Tierra. Se están realizando búsquedas de formas de usarlo de la manera más efectiva. Se han creado paneles solares para calentar casas y generar electricidad para las necesidades domésticas. EL PAPEL DEL CALOR Y SU USO Los procesos globales de transferencia de calor no se reducen al calentamiento de la Tierra por la radiación solar. Las corrientes de convección masivas en la atmósfera determinan los cambios diarios en las condiciones climáticas en todo el mundo. Las diferencias de temperatura en la atmósfera entre las regiones ecuatorial y polar, junto con las fuerzas de Coriolis debidas a la rotación de la Tierra, dan lugar a la aparición de corrientes de convección en constante cambio, como los vientos alisios, las corrientes en chorro y los frentes cálidos y fríos. ver también CLIMATIZADO; METEOROLOGIA Y CLIMATOLOGIA.La transferencia de calor (debido a la conductividad térmica) desde el núcleo fundido de la Tierra a su superficie provoca erupciones volcánicas y la aparición de géiseres. En algunas regiones, la energía geotérmica se utiliza para calentar espacios y generar energía.
El calor es un participante indispensable en casi todos los procesos de producción. Mencionaremos los más importantes de ellos, como la fundición y procesamiento de metales, la operación de motores, la producción de productos alimenticios, la síntesis química, la refinación de petróleo, la fabricación de una variedad de artículos desde ladrillos y platos hasta automóviles y electrónicos. dispositivos.
Muchas producciones y transportes industriales, así como centrales térmicas, no podrían funcionar sin motores térmicos, dispositivos que convierten el calor en trabajo útil. Ejemplos de tales máquinas son compresores, turbinas, vapor, gasolina y motores a reacción.
Una de las máquinas térmicas más famosas es la turbina de vapor, que implementa parte del ciclo de Rankine utilizado en las centrales eléctricas modernas. Un diagrama simplificado de este ciclo se muestra en la fig. 9. El agua del fluido de trabajo se convierte en vapor sobrecalentado en una caldera de vapor calentada por la quema de combustibles fósiles (carbón, petróleo o gas natural). Vapor alta presión hace girar el eje de una turbina de vapor, que impulsa un generador que genera electricidad. El vapor de escape se condensa cuando se enfría con agua corriente, que absorbe parte del calor que no se utiliza en el ciclo de Rankine. A continuación, el agua se alimenta a la torre de refrigeración (cooling tower), desde donde se libera parte del calor a la atmósfera. El condensado se devuelve a la caldera de vapor mediante una bomba y se repite todo el ciclo.
Todos los procesos en el ciclo de Rankine ilustran los principios de la termodinámica descritos anteriormente. En particular, según la segunda ley, parte de la energía consumida por la central eléctrica debe disiparse en el medio ambiente en forma de calor. Resulta que alrededor del 68% de la energía contenida originalmente en los combustibles fósiles se pierde de esta manera. Solo se podría lograr un aumento notable en la eficiencia de la planta de energía elevando la temperatura de la caldera de vapor (que está limitada por la resistencia al calor de los materiales) o bajando la temperatura del medio donde va el calor, es decir. atmósfera.
Otro ciclo termodinámico que tiene gran importancia en nuestro La vida cotidiana, es el ciclo de refrigeración del compresor de vapor Rankin, cuyo esquema se muestra en la fig. 10. En los frigoríficos y acondicionadores de aire domésticos se aporta energía del exterior para su provisión. El compresor aumenta la temperatura y la presión de la sustancia de trabajo del frigorífico freón, amoníaco o dióxido de carbono. El gas sobrecalentado se alimenta al condensador, donde se enfría y condensa, emitiendo calor al medio ambiente. El líquido que sale de las boquillas del condensador pasa a través de la válvula de estrangulamiento al evaporador y parte de él se evapora, lo que va acompañado de una fuerte caída de temperatura. El evaporador toma calor de la cámara del refrigerador, que calienta el fluido de trabajo en las boquillas; este líquido es suministrado por el compresor al condensador, y el ciclo se repite nuevamente.
El ciclo de refrigeración mostrado en la fig. 10 también se puede utilizar en una bomba de calor. Tales bombas de calor en verano emiten calor al aire atmosférico caliente y acondicionan la habitación, y en invierno, por el contrario, toman calor del aire frío y calientan la habitación.
Las reacciones nucleares son una fuente importante de calor para fines como la generación de energía y el transporte. En 1905, A. Einstein demostró que la masa y la energía están relacionadas por la relación
E=mc2 , es decir. pueden pasar unos a otros. velocidad de la luz C muy grande: 300 mil km/ Con. Esto significa que incluso una pequeña cantidad de materia puede proporcionar una gran cantidad de energía. Entonces, a partir de 1 kg de material fisionable (por ejemplo, uranio), es teóricamente posible obtener energía que, en 1000 días de funcionamiento continuo, es producida por una central eléctrica con una capacidad de 1 MW. ver también ESTRUCTURA DEL ÁTOMO; HORNOS Y TECNOLOGÍA DE HORNOS; RADIACIÓN ELECTROMAGNÉTICA; INTERCAMBIADOR DE CALOR; TURBINA; UNIDADES DE MEDIDA DE MAGNITUDES FÍSICAS.LITERATURA Zemansky M. Temperaturas muy altas y muy bajas. m., 1968pablo r Mecánica, acústica y la doctrina del calor.. M., 1971
Smorodinsky Ya.A. La temperatura. M, 1981
feng j. Máquinas, energía y entropía. M., 1986
Atkins P. V. Orden y desorden en la naturaleza. M., 1987
calorímetros líquidos
Este tipo de calorímetro, el más utilizado en tecnología, es de diseño simple y fácil de mantener. La cantidad de calor producido por una reacción inducida externamente se transfiere primero al recipiente de reacción (en el que tuvo lugar la reacción) y luego al baño líquido. El líquido del baño se agita continuamente por medio de un impulsor, un tornillo elevador o bombas, lo que acelera la igualación de temperaturas. El baño está aislado térmicamente (protegido) del medio ambiente tanto como sea posible. El cambio de temperatura del baño líquido es una medida de la cantidad de calor detectada. La capacidad calorífica de las masas a calentar no debe ser demasiado alta para garantizar un cambio de temperatura suficiente y para que el proceso de medición no dure demasiado (debido a lo cual aumentan las pérdidas de calor).
Figura Dispositivo de un calorímetro líquido.
Con altas demandas de constancia de las condiciones ambientales, es posible colocar todo el calorímetro en otro baño y estabilizar la temperatura en él con alta precisión utilizando un circuito de control. Esto es necesario en primer lugar en los casos en que se requiere realizar un experimento a temperaturas que difieren significativamente de la temperatura ambiente.
Para el análisis a bajas temperaturas (hasta aproximadamente -150 °C), se utiliza nitrógeno líquido como medio refrigerante. En este caso, es necesario prestar atención al hecho de que al cambiarlos, la escarcha del aire húmedo circundante no se precipita sobre las muestras o los recipientes de muestra, ya que su capa puede afectar el proceso de medición. Para evitar esto, cuando el calorímetro está abierto, la muestra y el recipiente de la muestra se purgan con gas nitrógeno frío.
Calorímetros de cuerpo metálico
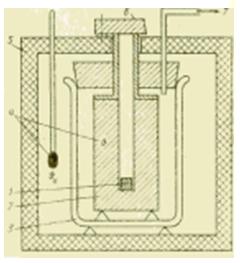
Figura Esquema del dispositivo de un calorímetro de metal.
Si se requiere realizar estudios calorimétricos en un rango de temperatura más amplio, los calorímetros líquidos ya no son adecuados. En los calorímetros de cuerpo metálico adecuados para este fin, la cantidad de calor transferida es absorbida por un bloque metálico (plata, cobre, aluminio) que suele estar a temperatura ambiente. Dicho calorímetro está destinado principalmente a determinar la capacidad calorífica específica c, J / (kg * K), sustancias líquidas y sólidas.
La muestra se enfría primero fuera del calorímetro en planta de refrigeración o se calienta en un horno y, después de alcanzar un estado estable, se baja (se deja caer) en un agujero en un bloque de metal. De acuerdo con el método de operación, dicho dispositivo se denomina calorímetro de caída libre y, de acuerdo con la naturaleza de los procesos termodinámicos en él, a veces se denomina calorímetro de desplazamiento.
La cantidad de calor transferido durante esta mezcla desde la muestra (con parámetros m1, c1, ) al bloque de metal (m2, c2, ) provoca un cambio medible en la temperatura del bloque. Esto hace posible determinar el valor generalmente desconocido de la capacidad calorífica específica de la muestra para condiciones ideales(en ausencia de intercambio de calor con el medio ambiente) de la expresión:
El bloque de metal en sí se encuentra en un recipiente Dewar al vacío y, a veces, en un baño líquido. En este último caso, para obtener la capacidad calorífica del calorímetro Ck, a la capacidad calorífica del bloque metálico C2 se debe sumar la capacidad calorífica del baño Cw:
CK=C2+CW=c2m2+cWmW .
MÉTODOS CALORIMÉTRICOS DE MEDICIÓN
La mayoría de las veces, los calorímetros se usan en el modo de condiciones ambientales constantes. Esto se aplica principalmente a la mayoría de los calorímetros de combustión, en los que el tiempo de reacción es muy corto. Mientras que la temperatura de las partes internas del calorímetro cambia debido a la reacción, la temperatura del aire ambiente permanece constante. En muchos casos, se requiere un baño de temperatura controlada. utilizado como entorno para evitar la influencia de interferencias externas en el valor medido: fluctuaciones de temperatura en la habitación, radiación, corrientes de aire, etc.
La ventaja de este esquema de medición es el costo relativamente bajo del equipo, que puede usarse para realizar la parte predominante de las mediciones calorimétricas. La principal desventaja se debe considerar el intercambio de calor del calorímetro con el medio ambiente, lo que complica la interpretación de los resultados. Este método de medición siempre se llama isoperibólico (diatérmico). En cualquier caso, no puede llamarse isotérmico, cuya esencia radica en el hecho de que la temperatura del calorímetro permanece constante durante el curso de la reacción, como, por ejemplo, los calorímetros diseñados para medir transformaciones de fase.
método adiabático
Si es posible excluir el intercambio de calor con el medio ambiente, es decir, para garantizar el curso adiabático del proceso, entonces el experimento y la interpretación de los resultados se simplifican y el resultado de la medición es más preciso, ya que no es necesario registrar continuamente cambios de temperatura y calcular las correcciones. Además, en este caso, se puede tolerar un aumento de temperatura algo mayor en el recipiente del calorímetro; para dispositivos no adiabáticos, esto es inaceptable debido a un aumento en las pérdidas de calor.
Para evitar el intercambio de calor entre el recipiente del calorímetro y su entorno inmediato (generalmente el baño líquido), la temperatura del baño debe corregirse constantemente de acuerdo con los cambios de temperatura dentro del recipiente. Con la ayuda de un controlador electrónico (circuito de seguimiento) es posible mantener constantemente la diferencia de estas temperaturas prácticamente igual a cero. Esto aumenta el costo del equipo de medición dependiendo de la precisión de medición requerida.
Los elementos de hardware deben ser rápidos y estables durante mucho tiempo (tener una deriva mínima). La zona muerta del bucle de control de seguimiento debe estar en el rango de ± 10-3 a ± 10-5 K. Como dispositivos de medición, puede usar cualquier termómetro de contacto eléctrico de respuesta rápida que, cuando se incluye en el circuito del puente, da un impulso al controlador para cambiar la potencia de calefacción. El calentamiento se realiza por medio de una bobina de resistencia eléctrica o directamente en un baño líquido, que actúa como una resistencia de calentamiento debido a una disociación débil (el llamado calentamiento electrolítico). Este segundo método es prácticamente inercial. El resultado se puede obtener utilizando medios ya existentes para la medición eléctrica de la temperatura o utilizando un termómetro de líquido instalado adicionalmente (Beckmann).
El método de medición adiabático es adecuado para estudiar principalmente procesos lentos y efectos térmicos. Con cambios rápidos en la cantidad de calor (en calorímetros de combustión), la inercia de la igualación de temperatura tiene un efecto tan desfavorable que ni siquiera se logra la precisión de los métodos no adiabáticos convencionales. Sin embargo, proporcionando una baja capacidad calorífica de los elementos calefactores y sensores de temperatura y mezclando intensamente el líquido del baño, es posible obtener valores pequeños de varias constantes de tiempo (reducir la inercia).
Método de compensación
Usando calorímetros diferenciales o duales basados en el principio de compensación, es posible eliminar en gran medida las influencias externas en el proceso de medición. Dos recipientes calorimétricos idénticos con accesorios idénticos se colocan en un ambiente en las mismas condiciones. En un recipiente, se produce el proceso investigado con un efecto térmico, y el otro recipiente se calienta con la ayuda de un sistema de servocontrol de tal manera que la pérdida de calor al medio ambiente para ambos recipientes es la misma. Por lo tanto, la potencia de calentamiento de entrada se puede poner en proporción directa a la cantidad de calor liberado durante el proceso en estudio. En este caso, la tarea experimental de medición va a otra área y se reduce a una determinación muy precisa de la potencia eléctrica de calefacción suministrada (W * s, J):
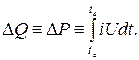
El calorímetro diferencial se utiliza, en particular, en condiciones ambientales adiabáticas, especialmente cuando se esperan cambios muy pequeños o muy lentos en la cantidad de calor. En procesos endotérmicos, es suficiente tener un recipiente calorimétrico. La entrada de calor se controla de tal manera que la temperatura en el recipiente permanece constante todo el tiempo (método isotérmico). La desventaja de los calorímetros diferenciales es el alto costo de los equipos e instrumentos de medición.
CALORÍMETROS DE COMBUSTIÓN
El combustible utilizado en las instalaciones de calor y energía se examina para determinar su poder calorífico H (J/kg). Este indicador es necesario para determinar factores de eficiencia, estudiar la eficiencia y calcular la energía consumida en diversas instalaciones, así como para un control óptimo del proceso de combustión. Las fluctuaciones significativas en la composición de los componentes combustibles a menudo requieren una determinación continua del poder calorífico.
Cuando una sustancia se quema por completo, se libera una cierta cantidad de calor Q (calor de combustión). Si lo dividimos por la masa m (o por el volumen en condiciones normales Vn), obtenemos el calor (específico) de combustión:
Según el estado de los productos de combustión, se distinguen dos tipos de poder calorífico: mayor H0 y menor H, que también se denominan calor de combustión y poder calorífico. Al determinar el poder calorífico neto de Ni, el agua formada durante reacciones químicas debe estar en estado de vapor. La diferencia entre ambos calores H0 - Ni corresponde al calor de vaporización del agua condensada (índice KO - condensado) r, que es igual a 2.441 MJ/kg.
Para combustibles sólidos y líquidos, la cantidad de agua resultante se puede determinar sobre la base del análisis elemental y, cuando se queman combustibles gaseosos, midiendo la cantidad de condensado.
En los hornos industriales, la temperatura de los productos de combustión siempre supera el punto de ebullición del agua. Por lo tanto, normalmente sólo interesa el poder calorífico neto H1, ya que no se puede aprovechar el calor de condensación del agua.
Calorímetros de combustión para sólidos y líquidos
Para procesos de combustión rápida, se ha desarrollado una forma especial de calorímetro líquido: la llamada bomba calorimétrica Berthelot (Fig. 3).
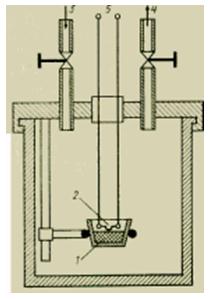
Figura El dispositivo de una bomba calorimétrica.
La combustión de una pequeña cantidad de una sustancia, medida con precisión, se produce a un volumen constante en una bomba sellada en una atmósfera del oxígeno más puro posible a una presión de ~30 atm (3 MPa). La bomba llena se coloca en el baño líquido del calorímetro, que absorbe el calor de combustión liberado.
Sólidos generalmente prensado en pequeñas briquetas (tabletas) y pesado con mucha precisión. Es aconsejable mezclar sustancias que ardan mal con líquidos que ardan bien con un calor de combustión conocido (por ejemplo, ácido benzoico). Las sustancias líquidas se colocan en copas (botes) hechas de platino o cuarzo o en pequeñas cápsulas de plástico. En la tapa, atornillada al cuerpo de la bomba, se encuentran todos los dispositivos necesarios para la investigación: válvulas para suministrar oxígeno y eliminar los productos de la combustión, portamuestras y un encendedor eléctrico. El encendido se lleva a cabo suministrando electricidad a un delgado cable de platino. El calor suministrado para la ignición debe medirse con precisión para que pueda tenerse en cuenta al descifrar los resultados del experimento. En una bomba calorimétrica se determina el valor calorífico máximo de H0. Durante la verificación, el equivalente térmico del calorímetro Ck se determina quemando una sustancia de referencia (por ejemplo, ácido benzoico) o utilizando un dispositivo de calentamiento eléctrico.
Calorímetro de combustión para sustancias gaseosas
Para determinar el calor de combustión de medios gaseosos, existen varios métodos. Todos ellos, a diferencia de la bomba calorimétrica para sustancias sólidas y líquidas, se basan en la medición continua. El principio de medición utilizado es bastante simple. El gas de prueba se quema continuamente en un quemador a una presión constante. Todo el calor liberado durante la combustión es absorbido por el flujo del medio refrigerante en el intercambiador de calor (calorímetro húmedo o de intercambio de calor) o mezclando los productos de la combustión con el flujo de aire a un caudal conocido (calorímetro seco o de mezcla). Por lo general, determine el poder calorífico neto Hu. Para determinar el poder calorífico bruto H0, es necesario condensar el vapor de agua (índice KO) contenido en los gases de combustión. Conociendo los caudales másicos y la diferencia de temperatura a la entrada (índice e) ya la salida (índice a) del calorímetro, es posible calcular el poder calorífico correspondiente utilizando la ecuación de balance térmico.
El tratamiento de gas requerido es básicamente el mismo en todos los calorímetros de gas. Antes de la combustión, el gas (índice G) primero se limpia de impurezas mecánicas sólidas (en el filtro) y se humedece (hasta la saturación con humedad, 100%), y luego se lleva a los valores especificados de presión preliminar (usando un reductor de presión válvula) y la temperatura del medio refrigerante (índice K) . El aire necesario para la combustión (índice L) también se humedece y se lleva a la temperatura del medio refrigerante.
Según la precisión requerida y los costos de instrumentación permitidos, es posible que no se cumplan algunas de estas condiciones. Los calorímetros deben verificarse con un gas de referencia (por ejemplo, hidrógeno) para determinar la desviación de la ecuación para el estado ideal del calorímetro. Para un calorímetro de intercambio de calor (húmedo), la ecuación anterior tiene la forma
donde y son los caudales másicos del medio refrigerante y el combustible, kg/s; sk - capacidad calorífica específica del medio de enfriamiento, J / (kg * K); - aumento de la temperatura del medio refrigerante, K.
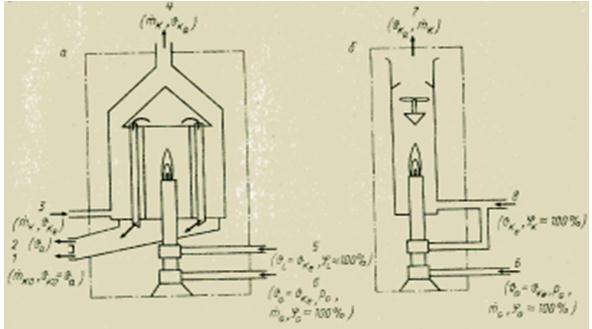
Figura Dispositivo de calorímetros húmedo (a) y seco (b) para combustible gaseoso.
El aumento de temperatura suele ser de 5 a 15 K. Debido a la gran masa térmica, los calorímetros de transferencia de calor tienen una constante de tiempo muy larga, que puede durar varios minutos. Por lo tanto, son menos adecuados para su uso en un circuito de control cerrado como sensor que los calorímetros secos (de mezcla), cuya constante de tiempo es de solo unos pocos segundos. Por otro lado, la precisión alcanzable de los calorímetros de intercambio de calor es comparativamente alta. Su error no supera el ±0,25-1 %, por lo que también se pueden utilizar para trabajos de laboratorio y verificación. Los calorímetros secos (mezcla) tienen un error de ±1 a ±2% del límite superior del rango de medición.
Las versiones de diseño de los calorímetros de varios fabricantes difieren principalmente en los dispositivos auxiliares y de seguridad, los elementos de detección y los circuitos computacionales que brindan compensación de errores. Por lo tanto, en los calorímetros de intercambio de calor, la relación de flujo de gas y medio refrigerante se mantiene de varias maneras (consulte la ecuación del calorímetro anterior), debido a que el poder calorífico más alto H0 depende directamente solo del aumento de temperatura.
En los calorímetros secos, el aumento de temperatura se mide directamente usando termómetros de contacto eléctrico o indirectamente usando un sensor dilatométrico, un tubo de expansión ubicado en la corriente de gas de escape. En el calorímetro ADOS, el alargamiento térmico del tubo del dilatómetro corresponde directamente al calor de combustión y se puede convertir en cualquier señal usando un enlace y un medidor de longitud. En el calorímetro de Reinecke, la extensión de la varilla se usa como señal de medición en un circuito de control que controla el flujo de aire de enfriamiento para que su aumento de temperatura permanezca casi constante. En este caso, el bucle de control resulta ser puramente proporcional, pero es inevitable alguna desviación residual. En este caso, el consumo de aire de refrigeración o el alargamiento del tubo dilatométrico (varilla) son una medida del poder calorífico determinado. Un requisito previo para obtener suficiente precisión en todos los calorímetros secos es una buena mezcla de aire de refrigeración y productos de combustión.
MEDICIONES DE FLUJO DE CALOR
El calor como tipo de energía se transfiere de tres formas: a través de un cuerpo sólido (conducción térmica), medio líquido o gaseoso (convección) y sin la participación de materia (radiación). En tecnología, los tres componentes casi siempre están involucrados en la transferencia de calor; sin embargo, en muchos casos es posible obtener resultados de precisión aceptable midiendo solo un componente.
Medición flujo de calor con conductividad térmica
La transferencia de calor a través de paredes conductoras de calor es de gran importancia en muchas áreas de la tecnología (intercambiadores de calor de todo tipo, aislamiento térmico, etc.). Al mismo tiempo, no es tanto el control actual de las cantidades de producción lo que interesa, sino los resultados de mediciones únicas utilizadas para evaluar la carga, verificar el cumplimiento de los indicadores garantizados y la eficiencia.
De acuerdo con las leyes de la conducción de calor estacionaria, el flujo de calor está determinado por las siguientes fórmulas (J/s):
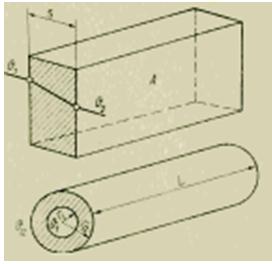
Dado que se conocen la conductividad térmica de la pared [J/(m*s*K)] y sus dimensiones geométricas, la medición del flujo de calor se reduce a medir la diferencia de temperatura. Sin embargo, esta técnica requiere una determinación muy precisa de las temperaturas superficiales. Los errores asociados con los cambios en las condiciones de transferencia de calor al instalar elementos sensibles a la temperatura en las superficies pueden ser bastante grandes. Por lo tanto, para mediciones más precisas, se recomiendan los siguientes métodos, en los que se utilizan simultáneamente la conductividad térmica y la transferencia de calor.
Medición de flujos de calor en transferencia de calor (transferencia de calor combinada con conducción de calor)
Para la pared plana mencionada en el apartado anterior, es válida la siguiente ley de transferencia de calor (J/s):
![]() ,
,
donde en el coeficiente de transferencia de calor k 1J/(m2*s*K)], junto con el coeficiente de transferencia de calor [J/Dm*s*K)], los coeficientes de transferencia de calor y [J/(m2*s*K) ] de ambos lados de la pared también se tienen en cuenta.
En una pared plana a través de la cual pasa el flujo de calor medido, se coloca una pequeña placa delgada, cuya temperatura superficial está determinada por termopares de película delgada incorporados. La ventaja de medir de esta manera es que no requiere el conocimiento de las propiedades térmicas de la pared y las propiedades correspondientes de la placa se pueden reducir a un único valor constante durante la calibración. Dichos elementos sensibles tienen un tamaño de aproximadamente 30x30x0,5 mm; el rango de medida cubre flujos de calor de 10 a 100.000 W/m2; el error es 2-5%.
Figura El principio de funcionamiento del medidor de flujo de calor.
Con la mejora de este método de medición, se utilizan tapetes de goma en lugar de una placa superpuesta. Pegándolos a superficies no planas o envolviéndolos alrededor de una superficie curva, es posible determinar la transferencia de calor desde una superficie de un área relativamente grande, por ejemplo, desde una tubería, recipiente, etc. Los termopares están integrados en ambas superficies de la estera de modo que sus uniones calientes y frías estén ubicadas exactamente una contra la otra (Fig. 6). Y en este caso, la densidad de flujo de calor de acuerdo con la calibración es proporcional a la diferencia de temperatura. Sin embargo, las esteras aplicadas interrumpen un poco la transferencia de calor inicial, lo que se vuelve perceptible con mediciones precisas. Por lo tanto, este método de medición se usa principalmente para determinar las constantes termodinámicas de una sustancia, cuando la violación del flujo de calor no afecta el resultado de la medición.
Medida de flujos de calor en ambientes actuales.
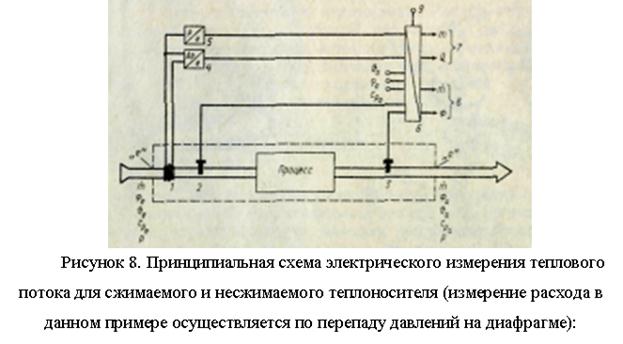
Una parte importante de la energía térmica se transfiere por medios líquidos o gaseosos (agua, vapor, etc.) que se mueven en una red de tuberías cerrada. Sin embargo, en comparación con la transmisión de energía eléctrica por cable, la distancia a la que se puede transmitir la energía térmica es limitada. Para los estudios termotécnicos de todo tipo de sistemas de calefacción y refrigeración, es necesario medir la liberación y el consumo de calor.
El flujo de calor F (J/s), transmitido por el flujo del medio - portador de calor (kg/s) a través de la sección de control con área A (m2) en una zona determinada, para la cual se compila el balance de calor (en el zona de proceso, Fig. 7), es igual a
La cantidad de calor liberado durante el intervalo de tiempo t2 - t1 se determina como una integral (J):
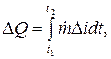
donde es la diferencia en el contenido de calor (entalpías, J/kg) del refrigerante en la entrada (índice e) y en la salida (índice a) de la zona de equilibrio térmico.
Dado que, en el caso general, el valor de la entalpía es de interés solo en comparación con un cierto nivel, por ejemplo, con la entalpía a temperatura ambiente, todas las mediciones de flujos de calor son esencialmente mediciones de diferencia.
Las entalpías individuales incluidas en la ecuación general pueden expresarse en términos de las correspondientes temperaturas y capacidades caloríficas específicas;
Por lo tanto, la medición del flujo de calor se reduce directamente a la medición de temperaturas y caudales másicos. En muchos casos, no se mide la masa, sino el caudal volumétrico del refrigerante; en este caso, el resultado obtenido diferirá solo por el valor de la densidad del refrigerante p. Las capacidades caloríficas específicas, ci, son en sí mismas funciones de la temperatura. Sin embargo, debido al estrecho rango de medición de muchos instrumentos, por lo general se pueden considerar valores constantes sin mucha pérdida de precisión. La capacidad calorífica específica debe ser conocida. Para los líquidos, la ecuación del flujo de calor se simplifica aún más, ya que su capacidades caloríficas específicas no depende de la presión:
![]() , J/s.
, J/s.
En todas las ecuaciones de este tipo es necesario tener en cuenta los signos de las magnitudes según se aporte o se extraiga calor, si el proceso es endotérmico o exotérmico, si se produce enfriamiento o calentamiento.
