Gas ideal. Teoría cinética molecular de los gases ideales
La teoría cinética molecular describe el comportamiento y las propiedades de un objeto ideal especial llamado gas ideal. Este modelo físico se basa en la estructura molecular de la materia. La creación de la teoría molecular está asociada con los trabajos de R. Clausius, J. Maxwell, D. Joule y L. Boltzmann.
Gas ideal. Teoría cinética molecular del gas ideal se basa en los siguientes supuestos:
Los átomos y las moléculas pueden verse como puntos materiales, que están en continuo movimiento;
el volumen intrínseco de las moléculas de gas es insignificante en comparación con el volumen del recipiente;
todos los átomos y moléculas son distinguibles, es decir, es posible en principio seguir el movimiento de cada partícula;
antes de la colisión de las moléculas de gas entre ellas, no hay fuerzas de interacción, y se supone que las colisiones de las moléculas entre sí y con las paredes del recipiente son absolutamente elásticas;
el movimiento de cada átomo o molécula de un gas está descrito por las leyes de la mecánica clásica.
Las leyes obtenidas para un gas ideal se pueden utilizar en el estudio de gases reales. Para ello se crean modelos experimentales de un gas ideal, en los que las propiedades de un gas real son cercanas a las de un gas ideal (por ejemplo, a bajas presiones y altas temperaturas).
leyes de los gases ideales
Ley de Boyle-Mariotte:
para una masa dada de gas a temperatura constante, el producto de la presión del gas y su volumen es un valor constante: pV = constante , (1.1)
a T = constante , m = constante .
Curva que muestra la relación entre cantidades R y V, caracteriza las propiedades de una sustancia a temperatura constante, y se llama isoterma esto es una hipérbola (Fig. 1.1.), y el proceso que se desarrolla a una temperatura constante se llama isotérmico.
Leyes de Gay-Lussac:
El volumen de una masa dada de gas a presión constante varía linealmente con la temperatura
V = V 0 (1 + t ) a P = constante , m = constante . (1.2)

pags = pags 0 (1 + t ) a V = constante , m = constante . (1.3)
En las ecuaciones (1.2) y (1.3), la temperatura se expresa en la escala Celsius, la presión y el volumen - en
0 С, mientras
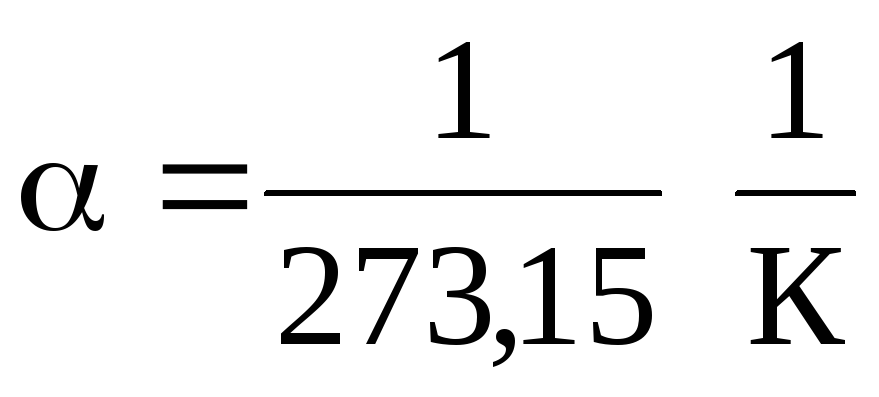 .
.
Un proceso que tiene lugar a presión constante se llama isobárico, se puede representar como una función lineal (Fig. 1.2.).
Un proceso que tiene lugar a volumen constante se llama isocorico(Figura 1.3.).
De las ecuaciones (1.2) y (1.3) se deduce que las isobaras y las isocoras intersecan el eje de la temperatura en el punto t =1/ \u003d - 273.15 С . Si movemos el origen a este punto, pasamos a la escala Kelvin.
Introduciendo en las fórmulas (1.2) y (1.3) temperatura termodinámica, las leyes de Gay-Lussac se pueden dar de una forma más conveniente:
V = V 0 (1+t) = = V 0 = =V 0 T;
pags = pags 0 (1+t) = pags 0 = pags 0 T;
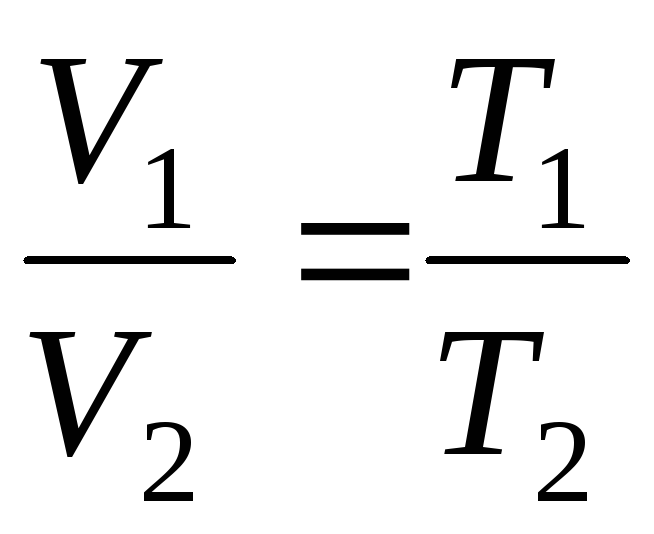 a
p=constante, m=constante
;
(1.4)
a
p=constante, m=constante
;
(1.4)
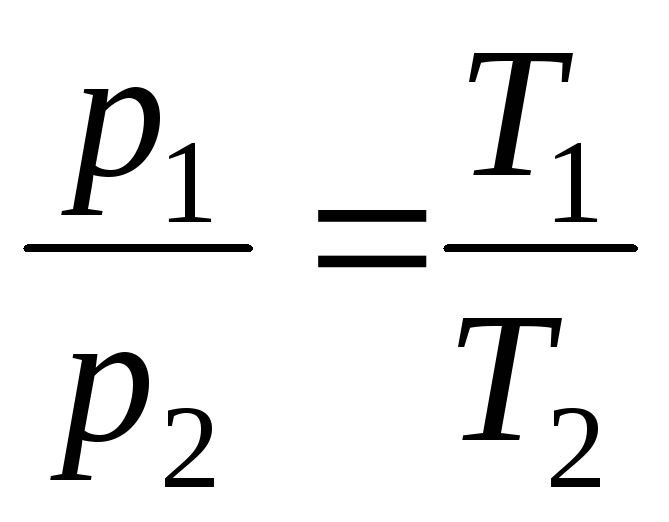 a V = constante, m = constante
,
(1.5)
a V = constante, m = constante
,
(1.5)
donde los índices 1 y 2 se refieren a estados arbitrarios que se encuentran en la misma isobara o isocora .
ley de avogadro:
Los moles de cualquier gas a las mismas temperaturas y presiones ocupan los mismos volúmenes.
En condiciones normales, este volumen es igual a V,0 \u003d 22.4110 -3 m 3 / mol . Por definición, en un mol varias sustancias contiene el mismo número de moléculas, igual a Avogadro constante:norte A = 6,02210 23 mol-1 .
Ley de Dalton:
presión de mezcla gases ideales igual a la suma de las presiones parciales R 1 , R 2 , R 3 … R n, gases incluidos en él:
pags = pags 1 + pag 2 + R 3 + …+ pag norte .
Presión parcial – esto es la presión que produciría el gas en la composición mezcla de gases si solo ocupa un volumen igual al volumen de la mezcla a la misma temperatura.
Ecuación de estado de los gases ideales
(Ecuación de Clapeyron-Mendeleev)
Existe una relación definida entre la temperatura, el volumen y la presión. Esta relación se puede representar mediante una dependencia funcional:
f(p, V, T)= 0.
A su vez, cada una de las variables ( p, v, t) es una función de otras dos variables. El tipo de dependencia funcional para cada estado de fase de una sustancia (sólido, líquido, gaseoso) se encuentra experimentalmente. Este es un proceso muy laborioso y la ecuación de estado se ha establecido sólo para gases que se encuentran en estado enrarecido, y en forma aproximada para algunos gases comprimidos. Para las sustancias que no están en estado gaseoso, este problema aún no se ha resuelto.
El físico francés B. Clapeyron trajo ecuación de estado de los gases ideales, combinando las leyes de Boyle-Mariotte, Gay-Lussac, Charles:
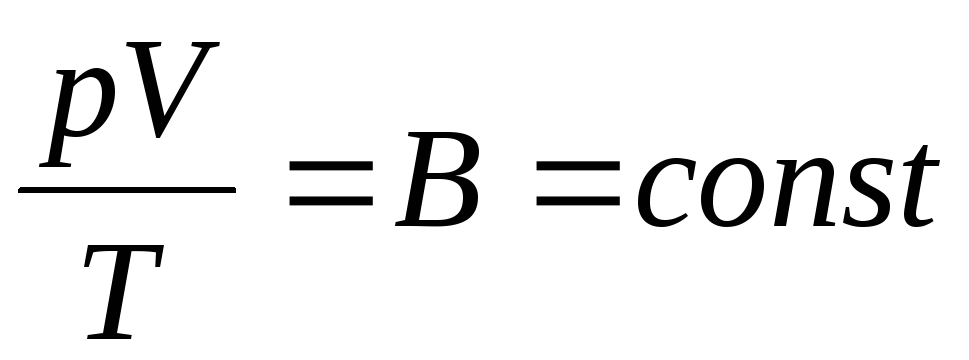 . (1.6)
. (1.6)
La expresión (1.6) es la ecuación de Clapeyron, donde A es la constante de los gases. Es diferente para diferentes gases.
D.I. Mendeleev combinó la ecuación de Clapeyron con la ley de Avogadro, refiriendo la ecuación (1.6) a un mol y usando el volumen molar V. De acuerdo con la ley de Avogadro, para el mismo R y T moles de todos los gases ocupan el mismo volumen molar V .
.
Por lo tanto, la constante A será el mismo para todos los gases ideales. Esta constante se suele denotar R e igual a R=
8,31
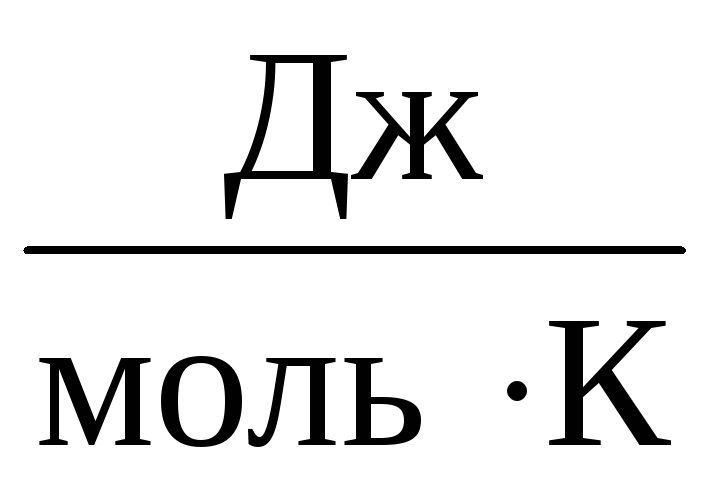 .
.
Ecuación de Clapeyron-Mendeleev tiene la siguiente forma:
pags V . = RT.
De la ecuación (1.7) para un mol de gas, uno puede ir a a la ecuación de Clapeyron-Mendeleev para una masa arbitraria de gas:
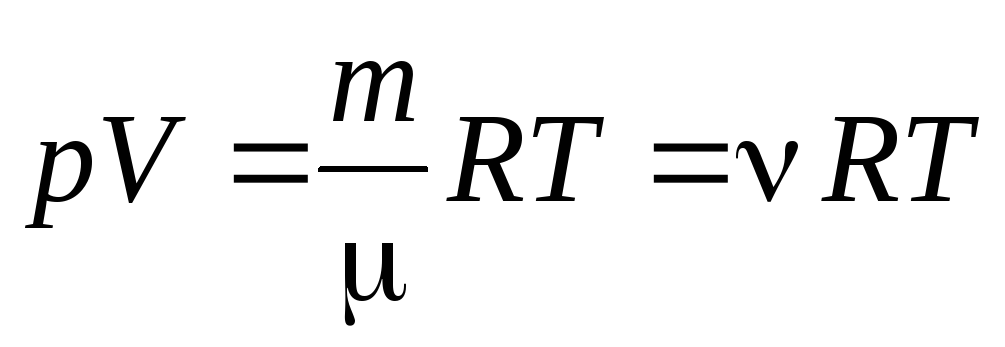 , (1.7)
, (1.7)
dónde
–
masa molar
(masa de un mol de sustancia, kg/mol); metro
masa de gas;
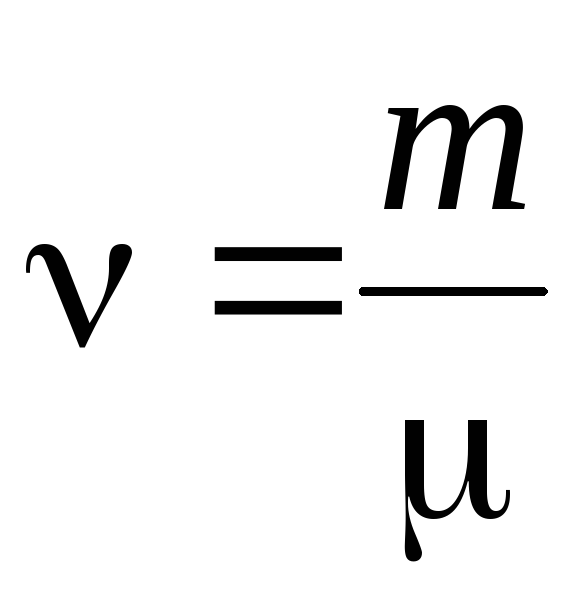 - Cantidad de materia .
- Cantidad de materia .
Más a menudo, se usa otra forma de la ecuación de estado del gas ideal, introduciendo constante de Boltzmann: 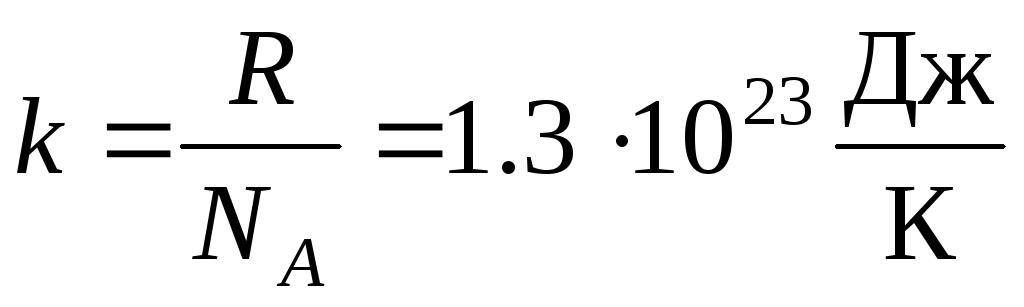 .
.
Entonces la ecuación (1.7) queda así:
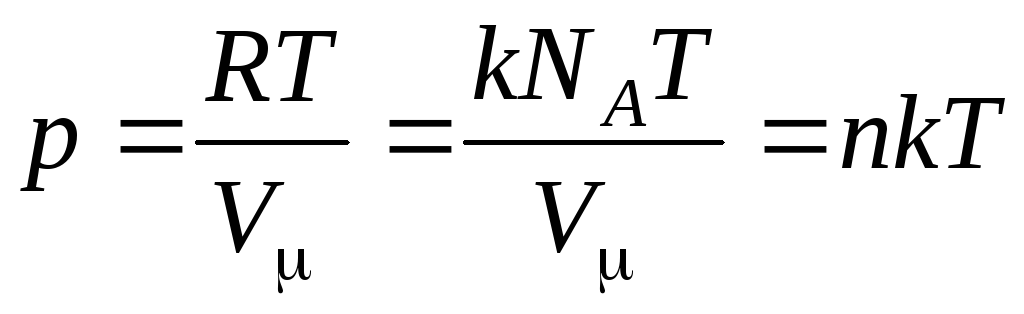 ,
(1.8)
,
(1.8)
dónde
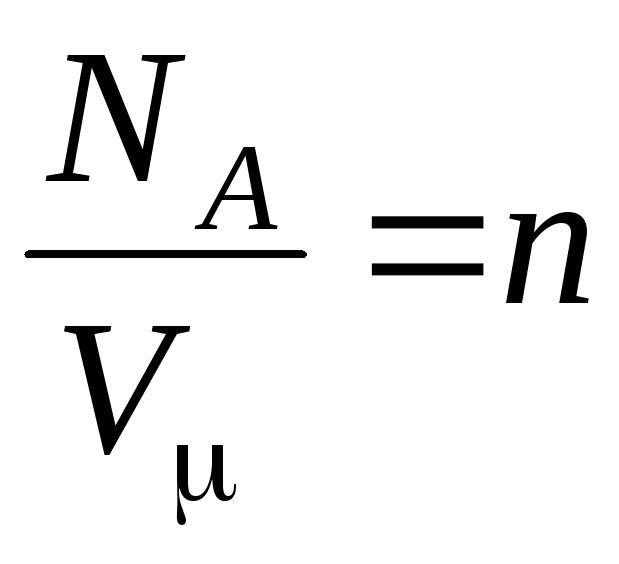 –
concentración de moléculas (número de moléculas por unidad de volumen). De esta expresión se sigue que la presión de un gas ideal es directamente proporcional a la concentración de sus moléculas oa la densidad del gas. A las mismas temperaturas y presiones, todos los gases contienen el mismo número de moléculas por unidad de volumen. El número de moléculas contenidas en 1 m 3 en condiciones normales se llama
número de Loschmidt:
–
concentración de moléculas (número de moléculas por unidad de volumen). De esta expresión se sigue que la presión de un gas ideal es directamente proporcional a la concentración de sus moléculas oa la densidad del gas. A las mismas temperaturas y presiones, todos los gases contienen el mismo número de moléculas por unidad de volumen. El número de moléculas contenidas en 1 m 3 en condiciones normales se llama
número de Loschmidt:
norte L = 2.68 10 25 m -3.
Ecuación básica de cinética molecular
teoría de los gases ideales
La tarea más importante La teoría cinética de los gases es el cálculo teórico de la presión de un gas ideal. basado en conceptos de cinética molecular. La ecuación básica de la teoría cinética molecular de los gases ideales se deriva usando métodos de estadística.
Se supone que las moléculas de gas se mueven al azar, el número de colisiones mutuas entre las moléculas de gas es insignificante en comparación con el número de impactos en las paredes del recipiente y estas colisiones son absolutamente elásticas. En la pared de la vasija, alguna zona elemental S y calcule la presión que las moléculas de gas ejercerán sobre esta área.
Es necesario tener en cuenta el hecho de que en realidad las moléculas pueden moverse al sitio en diferentes ángulos y pueden tener varias velocidades, que, además, puede cambiar con cada colisión. En los cálculos teóricos, el movimiento caótico de las moléculas se idealiza, se reemplazan por un movimiento a lo largo de tres direcciones perpendiculares entre sí.
Si consideramos un recipiente en forma de cubo, en el que norte moléculas de gas en seis direcciones, es fácil ver que en cualquier momento 1/3 del número de todas las moléculas se mueve a lo largo de cada una de ellas, y la mitad de ellas (es decir, 1/6 del número de todas las moléculas) se mueve en una dirección, y la segunda mitad (también 1/6) - en la dirección opuesta. Con cada colisión, una molécula individual que se mueve perpendicularmente al sitio, reflejando, le transfiere impulso, mientras que su impulso (impulso) cambia en la cantidad
R 1 =metro 0 v – (– metro 0 v) = 2 metro 0 v.
El número de impactos de moléculas que se mueven en una dirección dada en el sitio será igual a: norte = 1/6 norte Svt. Al chocar con la plataforma, estas moléculas le transferirán impulso.
PAGS= norte PAGS 1 =2 metro 0 vnorteSvt=m 0 v 2 norteSt,
dónde norte es la concentración de moléculas. Entonces la presión que ejerce el gas sobre la pared del recipiente será igual a:
p = 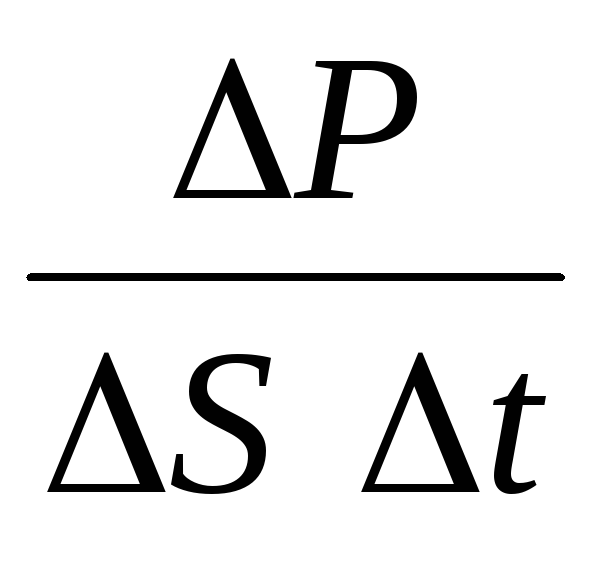 =
nm 0
v 2
.
(1.9)
=
nm 0
v 2
.
(1.9)
Sin embargo, las moléculas de gas se mueven a diferentes velocidades: v 1 , v 2 , …,v norte, por lo que las velocidades deben promediarse. La suma de los cuadrados de las velocidades de las moléculas de gas, dividida por su número, determina la velocidad cuadrática media:
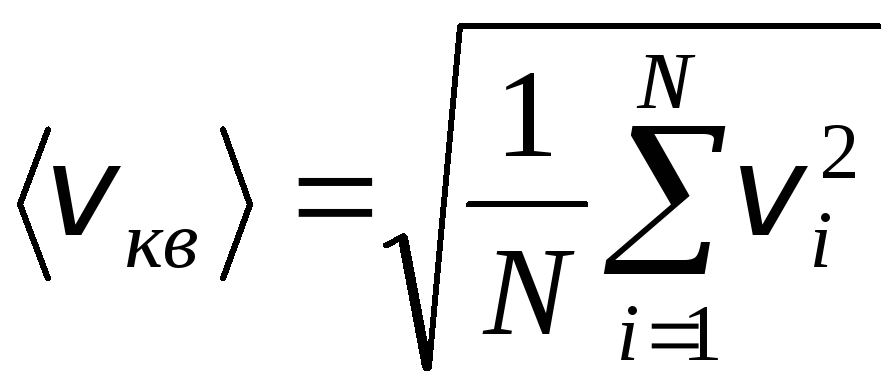 .
.
Ecuación (1.9) tomará la forma:
![]() (1.10)
(1.10)
la expresión (1.10) se llama la ecuación básica de la teoría cinética molecular gases ideales.
Dado que 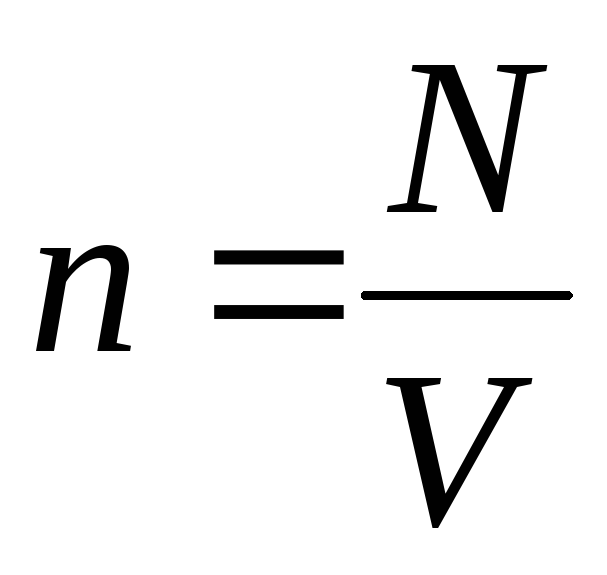 , obtenemos:
, obtenemos:
pag V = norte 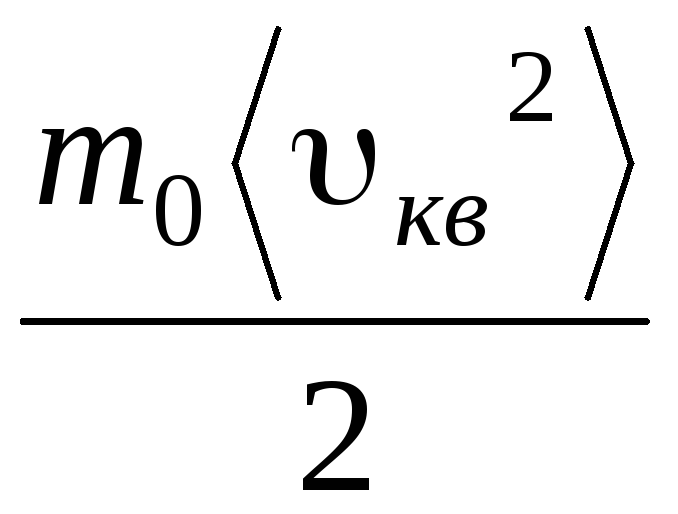 =E,
(1.11)
=E,
(1.11)
dónde mi es la energía cinética total del movimiento de traslación de todas las moléculas de gas. Por lo tanto, la presión del gas es directamente proporcional a la energía cinética del movimiento de traslación de las moléculas del gas.
Por un mol de gas metro =, y la ecuación de Clapeyron-Mendeleev tiene la siguiente forma:
pag v . = R T,
y como se sigue de (1.11) que pag v . = v cuadrados 2 , obtenemos:
RT= v cuadrados 2 .
Por lo tanto, la velocidad cuadrática media de las moléculas de gas es igual a
v
cuadrados
=
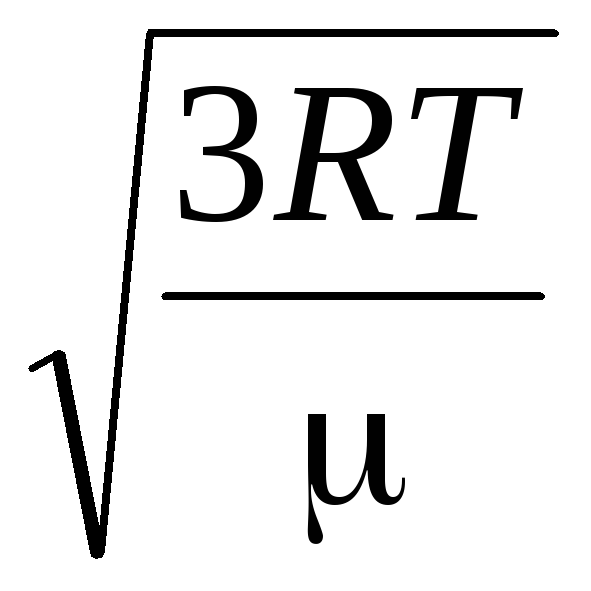 =
=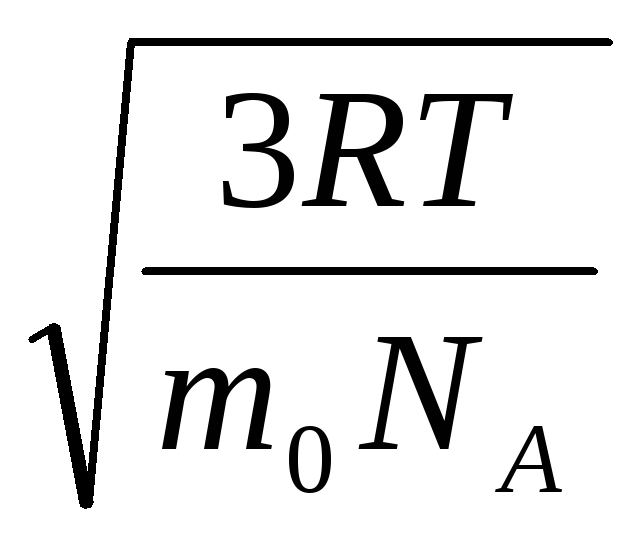 =
= ,
,
dónde k = R/norte A = 1,3810 -23 J/K – constante de Boltzmann. Desde aquí puede encontrar la velocidad cuadrática media de las moléculas de oxígeno a temperatura ambiente - 480 m/s, hidrógeno - 1900 m/s.
Significado molecular-cinético de la temperatura
La temperatura es una medida cuantitativa de la temperatura de un cuerpo. Para aclarar el significado físico de la temperatura termodinámica absoluta T Comparemos la ecuación básica de la teoría cinética molecular de los gases (1.14) con la ecuación de Clapeyron-Mendeleev pags V = RT
Igualando las partes correctas de estas ecuaciones, encontramos el valor promedio de la energía cinética 0 de una molécula ( = norte/norte A , k=R/norte A):
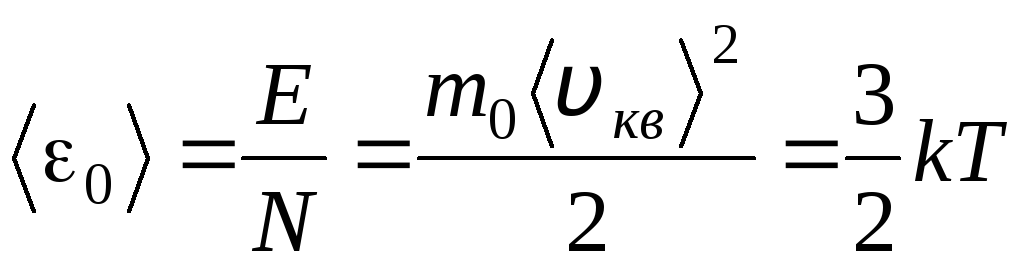 .
.
La conclusión más importante de la teoría cinética molecular se deriva de esta ecuación: la energía cinética promedio del movimiento de traslación de una molécula de un gas ideal depende solo de la temperatura, mientras que es directamente proporcional a la temperatura termodinámica. Así, la escala de temperatura termodinámica adquiere un significado físico directo: en T= 0 la energía cinética de las moléculas de un gas ideal es cero. Por lo tanto, según esta teoría, el movimiento de traslación de las moléculas de gas se detendrá y su presión será igual a cero.
Teoría de las propiedades de equilibrio de un gas ideal
Número de grados de libertad de las moléculas.. La teoría cinética molecular de los gases ideales conduce a una consecuencia muy importante: las moléculas de gas se mueven al azar, y la energía cinética promedio del movimiento de traslación de la molécula está determinada únicamente por la temperatura.
La energía cinética del movimiento molecular no se agota por la energía cinética. energía de movimiento hacia adelante: también consta de cinética energías rotación y fluctuaciones moléculas. Para calcular la energía que entra en todos los tipos de movimiento molecular, es necesario definir número de grados de libertad.
Por debajo número de grados de libertad (i) del cuerpo está implícito el número de coordenadas independientes que se deben ingresar para determinar la posición del cuerpo en el espacio.
H  Por ejemplo, un punto material tiene tres grados de libertad, ya que su posición en el espacio está determinada por tres coordenadas: x, y y z. Por lo tanto, una molécula monoatómica tiene tres grados de libertad de movimiento de traslación.
Por ejemplo, un punto material tiene tres grados de libertad, ya que su posición en el espacio está determinada por tres coordenadas: x, y y z. Por lo tanto, una molécula monoatómica tiene tres grados de libertad de movimiento de traslación.
D 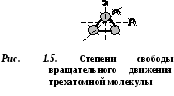 una molécula buchatómica tiene 5 grados de libertad (Fig. 1.4): 3 grados de libertad de movimiento de traslación y 2 grados de libertad de movimiento de rotación.
una molécula buchatómica tiene 5 grados de libertad (Fig. 1.4): 3 grados de libertad de movimiento de traslación y 2 grados de libertad de movimiento de rotación.
Las moléculas de tres o más átomos tienen 6 grados de libertad: 3 grados de libertad de movimiento de traslación y 3 grados de libertad de movimiento de rotación (Fig. 1.5).
Cada molécula de gas tiene un cierto número de grados de libertad, tres de los cuales corresponden a su movimiento de traslación.
Reglamento sobre la distribución equitativa de la energía
por grados de libertad
La premisa básica de la teoría cinética molecular de los gases es la suposición de una completa aleatoriedad en el movimiento de las moléculas. Esto se aplica tanto a los movimientos oscilatorios como rotacionales, y no solo a los de traslación. Se supone que todas las direcciones de movimiento de las moléculas en un gas son igualmente probables. Por lo tanto, podemos suponer que para cada grado de libertad de una molécula, en promedio, hay la misma cantidad de energía; esta es la posición sobre la equipartición de energía sobre grados de libertad. La energía por un grado de libertad de una molécula es:
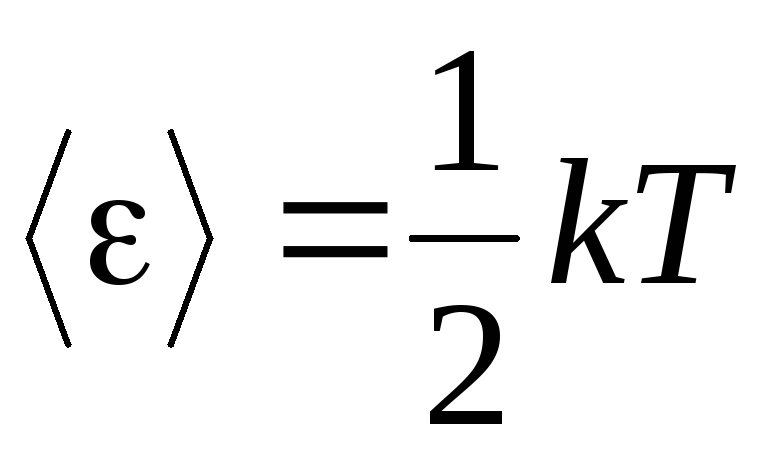 . (1.12)
. (1.12)
Si la molécula tiene i grados de libertad, entonces para cada grado de libertad hay en promedio:
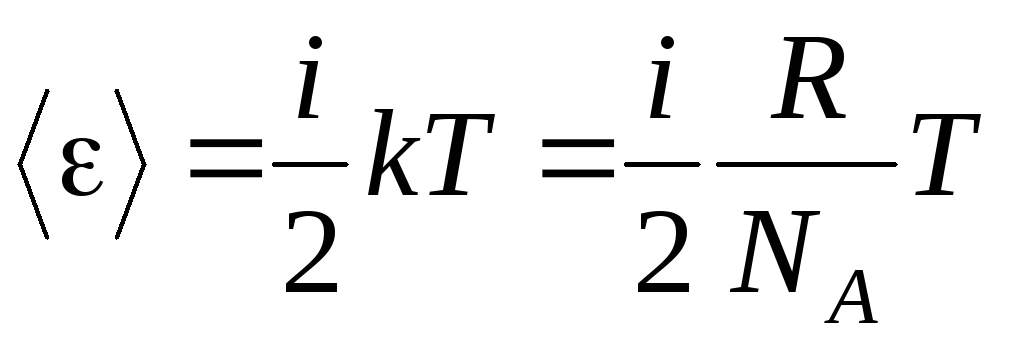 .
(1.13)
.
(1.13)
Energía interna de un gas ideal
Si atribuimos el suministro total de energía interna del gas a un mol, entonces obtenemos su valor multiplicando por el número de Avogadro:
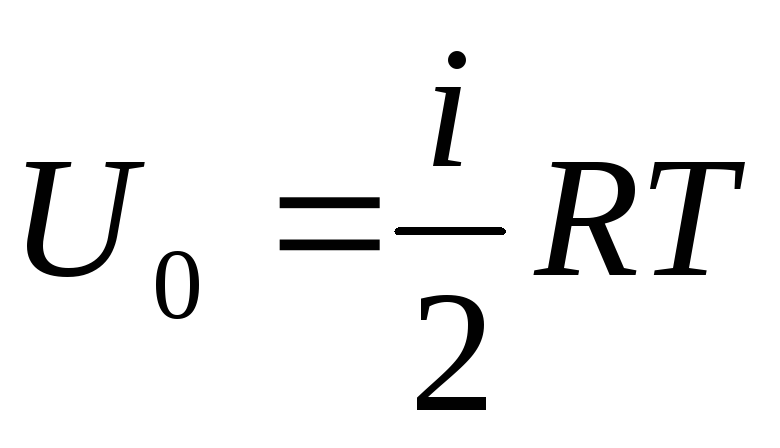 .
(1.14)
.
(1.14)
De ello se deduce que la energía interna de un mol de un gas ideal depende únicamente de la temperatura y del número de grados de libertad de las moléculas del gas.
Distribuciones de Maxwell y Boltzmann
Distribución de moléculas de un gas ideal en términos de velocidades y energías de movimiento térmico (distribución de Maxwell). A una temperatura constante del gas, se supone que todas las direcciones del movimiento molecular son igualmente probables. En este caso, la velocidad cuadrática media de cada molécula permanece constante y es igual a
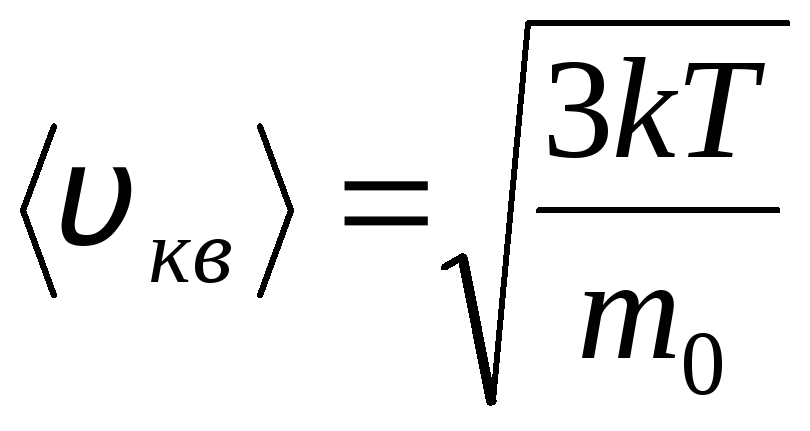 .
.
Esto se explica por el hecho de que en un gas ideal, que se encuentra en estado de equilibrio, se establece una cierta distribución estacionaria de velocidades de las moléculas que no cambia con el tiempo. esta distribución está sujeta a cierta ley estadística, que fue teóricamente derivada por J. Maxwell. La ley de Maxwell está descrita por la función
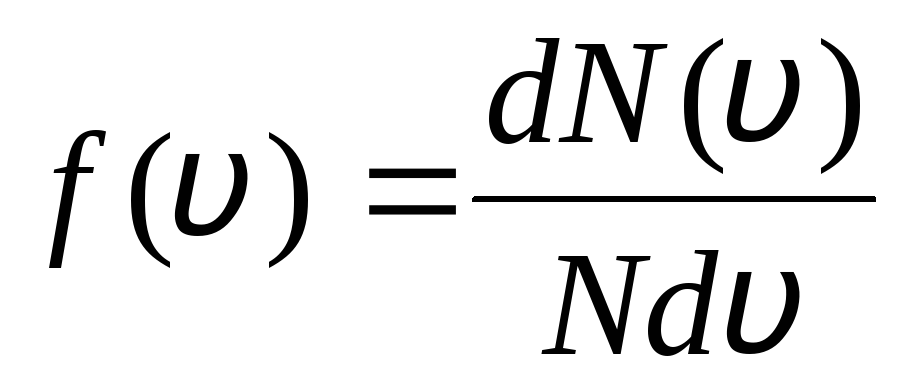 ,
,
esa es la funcion F(v) determina el número relativo de moléculas  , cuyas velocidades se encuentran en el intervalo de v
antes de v+dv. Aplicando los métodos de la teoría de la probabilidad, Maxwell encontró la ley de distribución de moléculas de un gas ideal en términos de velocidades:
, cuyas velocidades se encuentran en el intervalo de v
antes de v+dv. Aplicando los métodos de la teoría de la probabilidad, Maxwell encontró la ley de distribución de moléculas de un gas ideal en términos de velocidades:
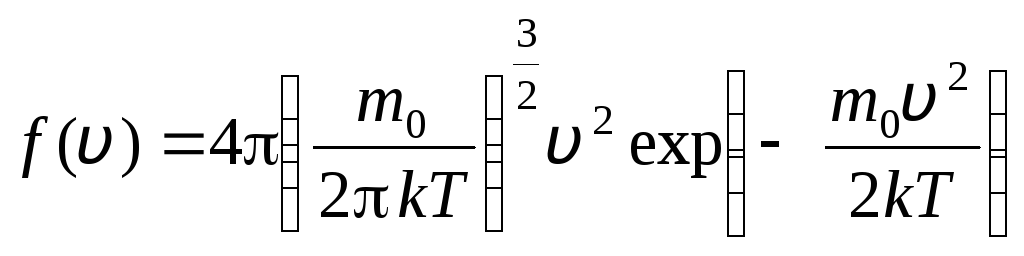 . (1.15)
. (1.15)
La función de distribución se muestra gráficamente en la fig. 1.6. El área delimitada por la curva de distribución y el eje x es igual a uno. Esto significa que la función F(v) satisface la condición de normalización:
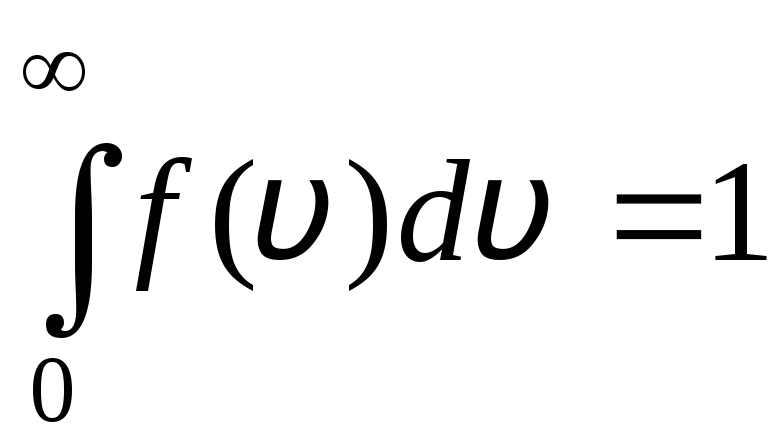 .
.
DE  velocidad a la que la función de distribución de las moléculas de gas ideal en términos de velocidades F(v) es máximo, se llama más probable
velocidad
v B .
velocidad a la que la función de distribución de las moléculas de gas ideal en términos de velocidades F(v) es máximo, se llama más probable
velocidad
v B .
Valores v = 0 y v = corresponden a los mínimos de la expresión (1.15). La velocidad más probable se puede encontrar derivando la expresión (1.23) e igualándola a cero:
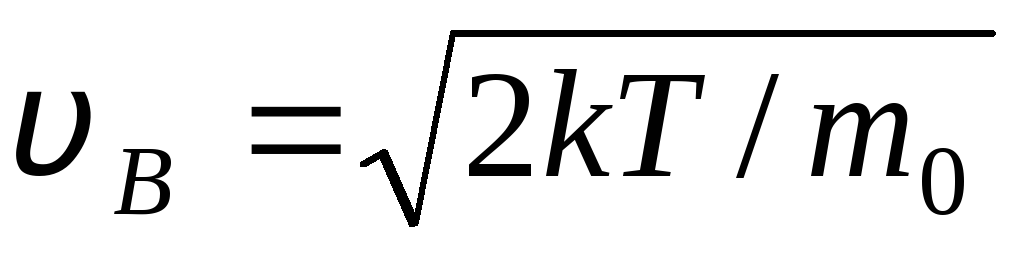 =
=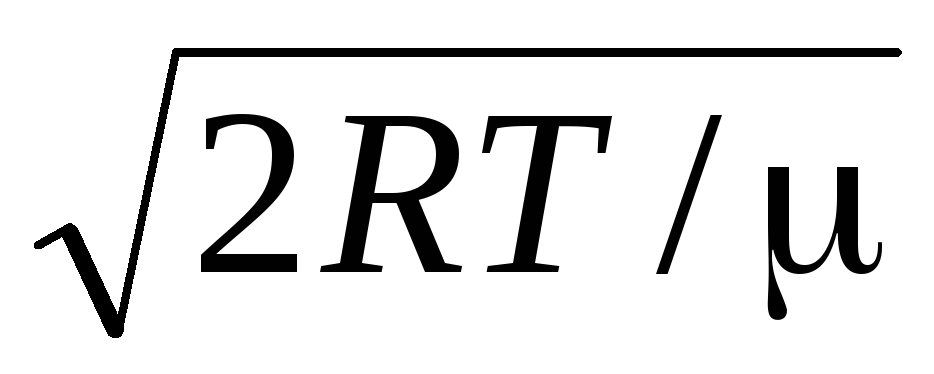 =
1,41
=
1,41
Con un aumento de temperatura, el máximo de la función se desplazará hacia la derecha (Fig. 1.6), es decir, con un aumento de temperatura, la velocidad más probable también aumenta, sin embargo, el área delimitada por la curva permanece sin cambios. Cabe señalar que en los gases ya bajas temperaturas siempre hay un pequeño número de moléculas que se mueven a altas velocidades. La presencia de tales moléculas "calientes" ha gran importancia durante muchos procesos.
Velocidad media aritmética moléculas está determinada por la fórmula
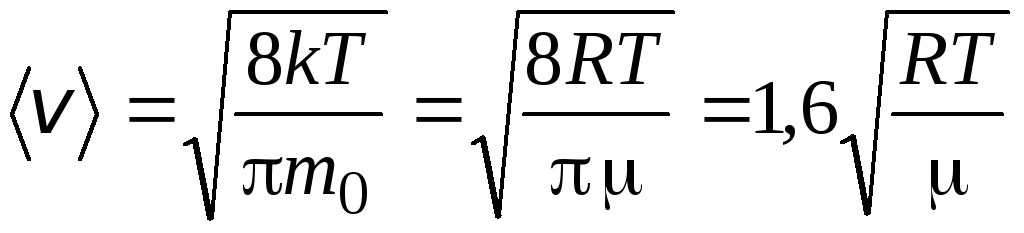 .
.
Raíz cuadrática media de la velocidad
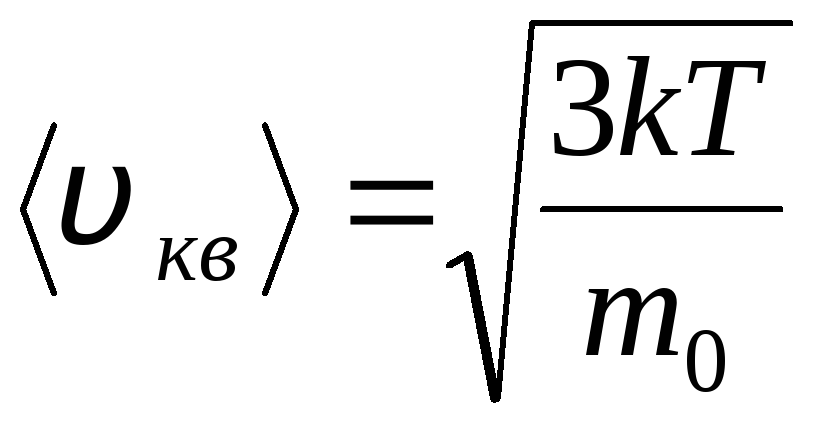 =
1,73
=
1,73 .
.
La relación de estas velocidades no depende de la temperatura ni del tipo de gas.
Función de distribución de moléculas por energías de movimiento térmico.. Esta función se puede obtener sustituyendo el valor de la energía cinética en lugar de la velocidad en la ecuación de distribución de moléculas (1.15):
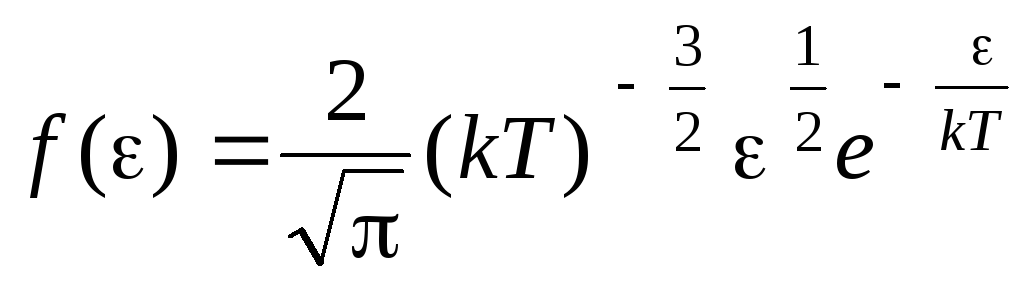 .
.
Habiendo integrado la expresión sobre los valores de energía de  antes de
antes de 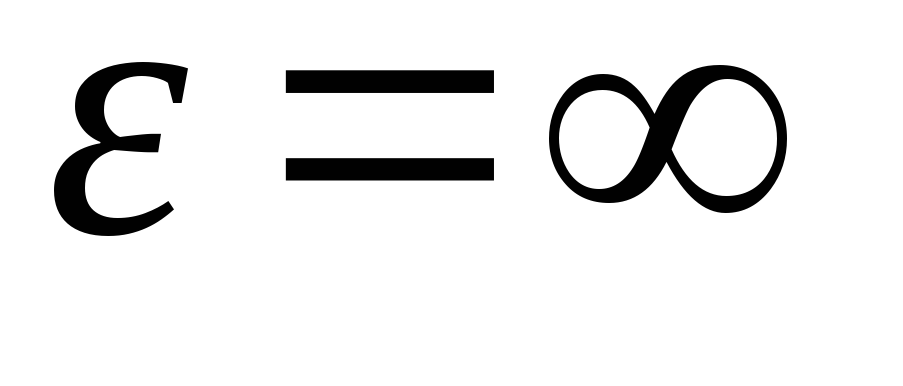
 , obtenemos energía cinética promedio Moléculas de gases ideales:
, obtenemos energía cinética promedio Moléculas de gases ideales:
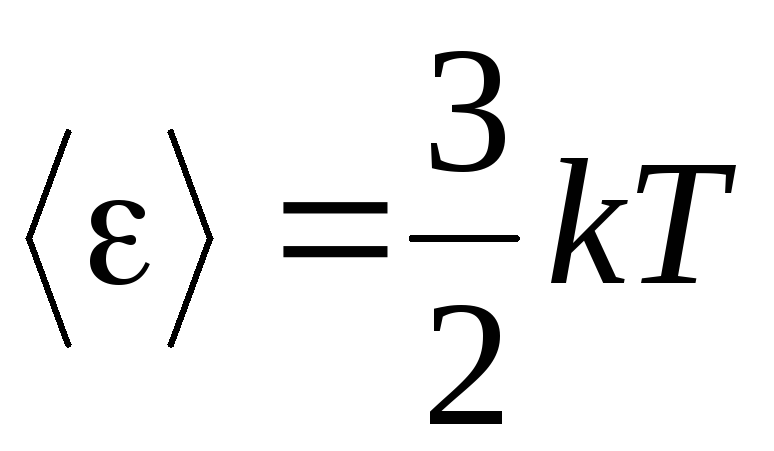 .
.
fórmula barométrica. Distribución de Boltzmann. Al derivar la ecuación básica de la teoría cinético-molecular de los gases y la distribución de moléculas de Maxwell por velocidades, se supuso que las moléculas de un gas ideal no se ven afectadas por fuerzas externas, por lo tanto, las moléculas se distribuyen uniformemente en todo el volumen. Sin embargo, las moléculas de cualquier gas están en el campo gravitatorio de la Tierra. Al derivar la ley de dependencia de la presión con la altura, se supone que el campo gravitatorio es uniforme, la temperatura es constante y la masa de todas las moléculas es la misma:
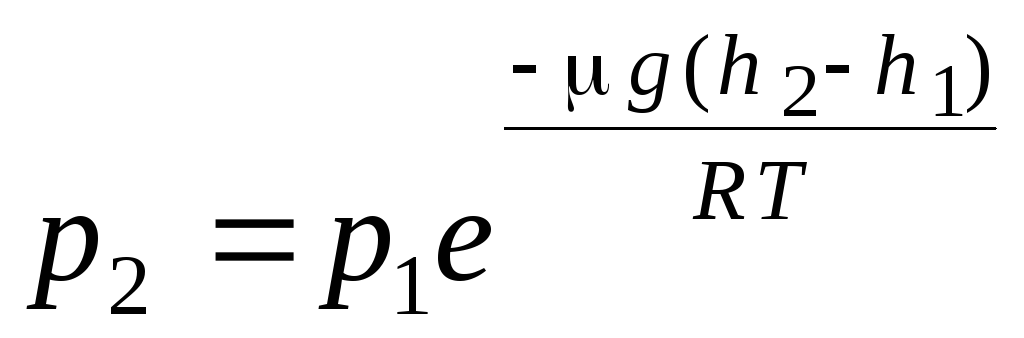 . (1.16)
. (1.16)
La expresión (1.16) se llama fórmula barométrica. Te permite encontrar la presión atmosférica dependiendo de la altitud, o midiendo la presión, puedes encontrar la altitud. Porque h 1 es la altura sobre el nivel del mar, donde la presión se considera normal, entonces se puede modificar la expresión:
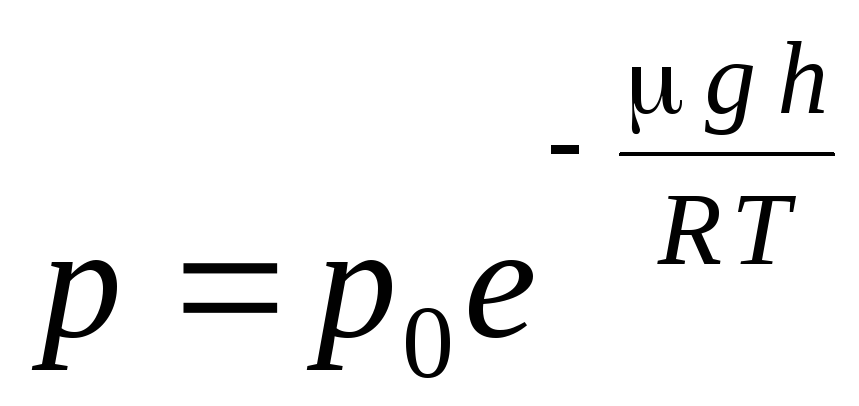 .
.
La fórmula barométrica se puede convertir usando la expresión p = nkT:
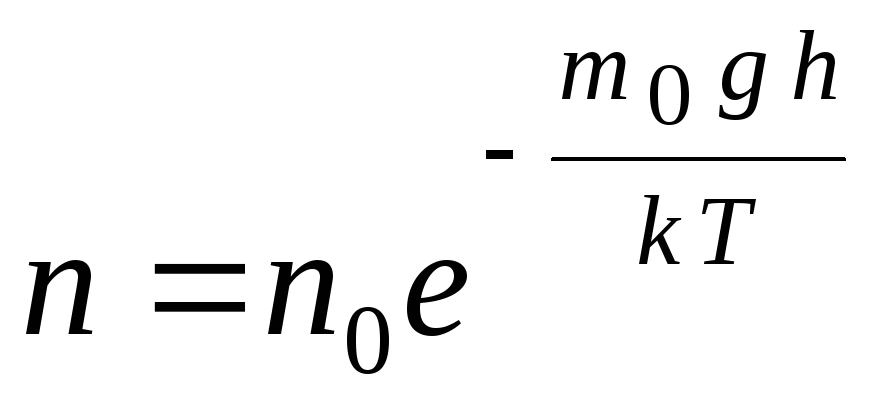 ,
,
GRAMO  Delaware norte
–
concentración de moléculas en altitud h,
metro 0
gh=PAGS–
energía potencial de una molécula en un campo gravitatorio. A temperatura constante, la densidad del gas es mayor donde la energía potencial de la molécula es menor. Gráficamente, la ley de disminución en el número de partículas por unidad de volumen con altura se ve como se muestra en la Fig. 1.7.
Delaware norte
–
concentración de moléculas en altitud h,
metro 0
gh=PAGS–
energía potencial de una molécula en un campo gravitatorio. A temperatura constante, la densidad del gas es mayor donde la energía potencial de la molécula es menor. Gráficamente, la ley de disminución en el número de partículas por unidad de volumen con altura se ve como se muestra en la Fig. 1.7.
Para un campo potencial externo arbitrario, escribimos la siguiente expresión general
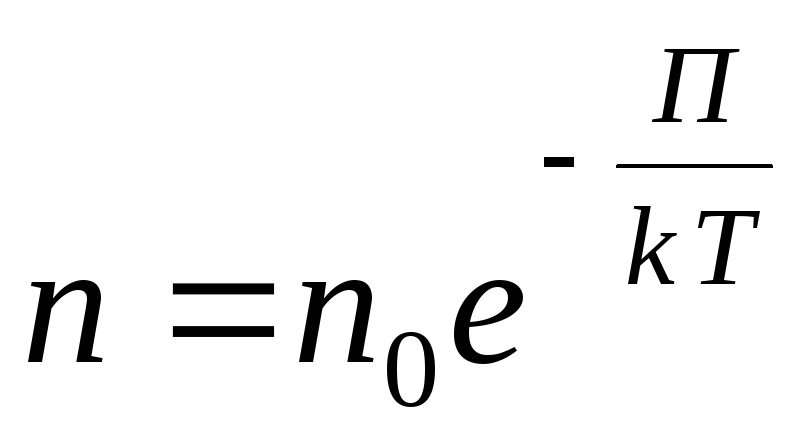 ,
,
En un gas enrarecido, la distancia entre las moléculas es muchas veces mayor que su tamaño. En este caso, la interacción entre moléculas es insignificante y la energía cinética de las moléculas es mucho mayor que la energía potencial de su interacción.
Para explicar las propiedades de una sustancia en estado gaseoso, en lugar de un gas real, se usa su modelo físico: un gas ideal. El modelo asume:
la distancia entre las moléculas es ligeramente mayor que su diámetro;
las moléculas son bolas elásticas;
no hay fuerzas de atracción entre las moléculas;
cuando las moléculas chocan entre sí y con las paredes del vaso, actúan fuerzas repulsivas;
El movimiento molecular obedece a las leyes de la mecánica.
La ecuación básica para un mercado de gas ideal:
La ecuación básica del MKT permite calcular la presión de un gas si se conocen la masa de la molécula, el valor medio del cuadrado de la velocidad y la concentración de las moléculas.
Presión de gases ideales radica en el hecho de que las moléculas al chocar con las paredes del vaso interactúan con ellas según las leyes de la mecánica como cuerpos elásticos. Cuando una molécula choca contra la pared del recipiente, la proyección de la velocidad vx del vector velocidad sobre el eje OX, perpendicular a la pared, cambia de signo al contrario, pero permanece constante en valor absoluto. Por lo tanto, como resultado de las colisiones de una molécula con una pared, la proyección de su cantidad de movimiento sobre el eje OX cambia de mv 1x = -mv x a mv 2x =mv x . Un cambio en el impulso de una molécula al chocar con una pared provoca una fuerza F 1 que actúa sobre ella desde el lado de la pared. El cambio en el momento de una molécula es igual al momento de esta fuerza:
Durante la colisión, según la tercera ley de Newton, la molécula actúa sobre la pared con una fuerza F 2 igual en valor absoluto a la fuerza F 1 y en dirección opuesta.
Hay muchas moléculas, y cada una imparte el mismo impulso a la pared al chocar. En un segundo transmiten un impulso 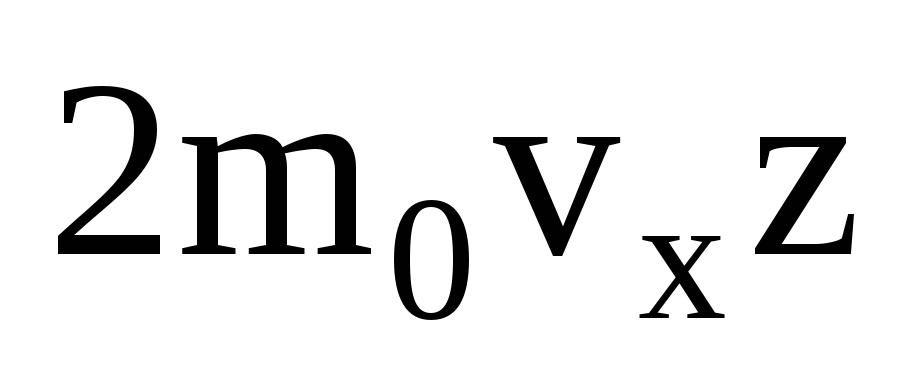 , donde z es el número de colisiones de todas las moléculas con la pared, que es proporcional a la concentración de moléculas en el gas, la velocidad de las moléculas y el área superficial de la pared:
, donde z es el número de colisiones de todas las moléculas con la pared, que es proporcional a la concentración de moléculas en el gas, la velocidad de las moléculas y el área superficial de la pared: 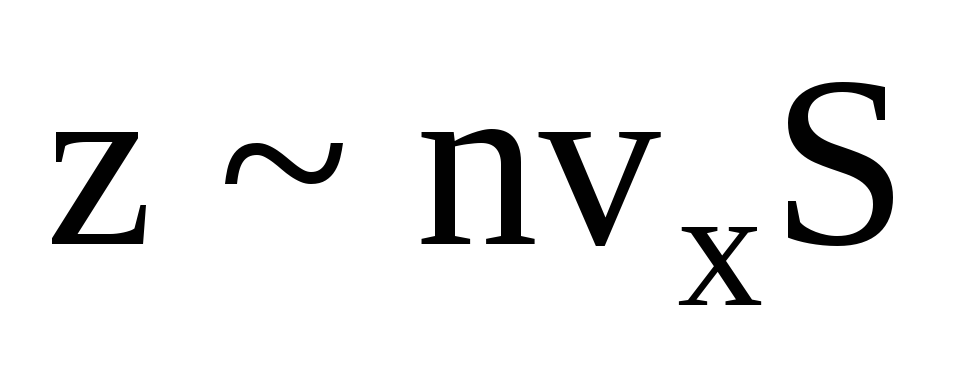 . Solo la mitad de las moléculas se mueven hacia la pared, el resto se mueve en dirección opuesta:
. Solo la mitad de las moléculas se mueven hacia la pared, el resto se mueve en dirección opuesta: 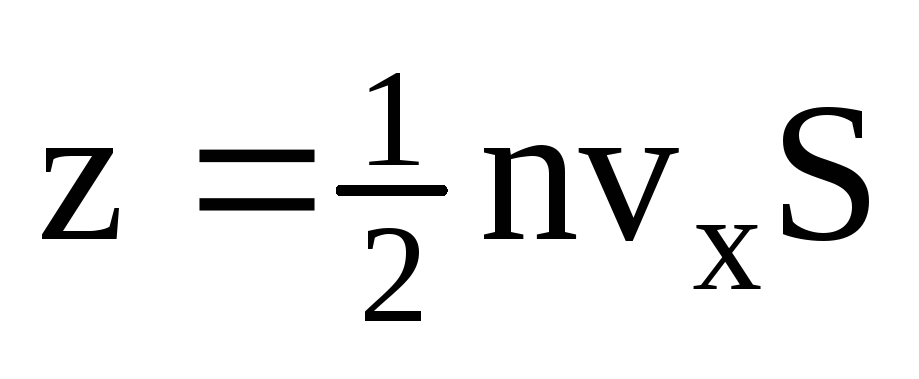 . Luego, el momento total transferido a la pared en 1 segundo:
. Luego, el momento total transferido a la pared en 1 segundo: 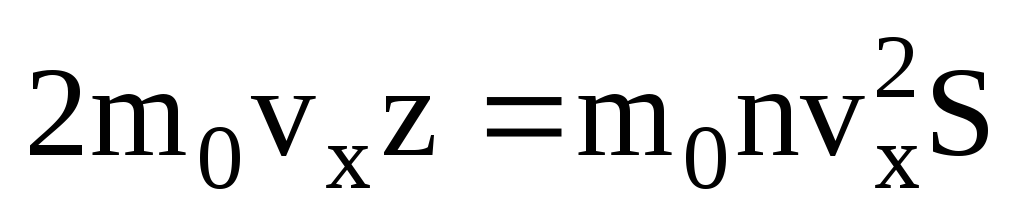 . De acuerdo con la segunda ley de Newton, el cambio en el momento de un cuerpo por unidad de tiempo es igual a la fuerza que actúa sobre él:
. De acuerdo con la segunda ley de Newton, el cambio en el momento de un cuerpo por unidad de tiempo es igual a la fuerza que actúa sobre él:
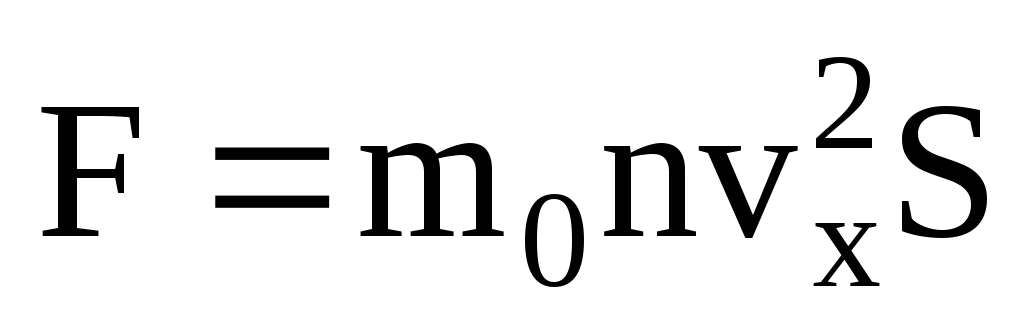
Dado que no todas las moléculas tienen la misma velocidad, la fuerza que actúa sobre la pared será proporcional al cuadrado medio de la velocidad. Dado que las moléculas se mueven en todas las direcciones, los valores promedio de los cuadrados de las proyecciones de velocidad son iguales. Por lo tanto, el cuadrado medio de la proyección de velocidad es: 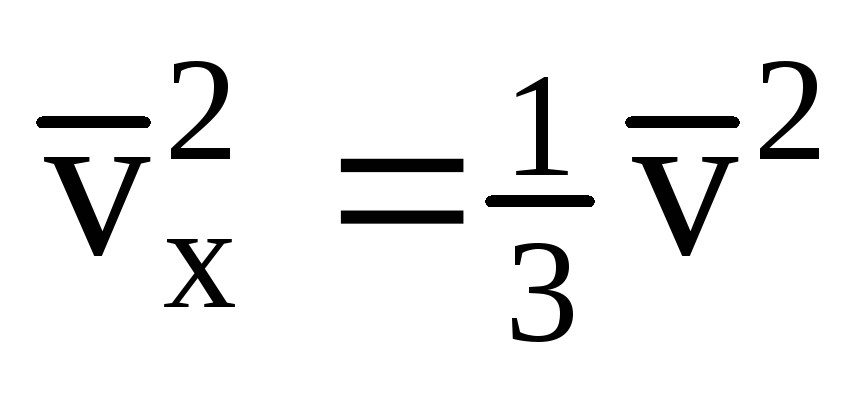 ;
;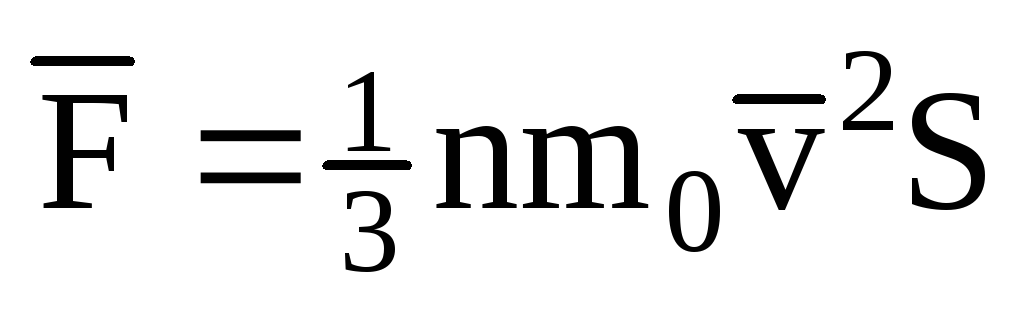 . Entonces la presión del gas en la pared del recipiente es:
. Entonces la presión del gas en la pared del recipiente es:
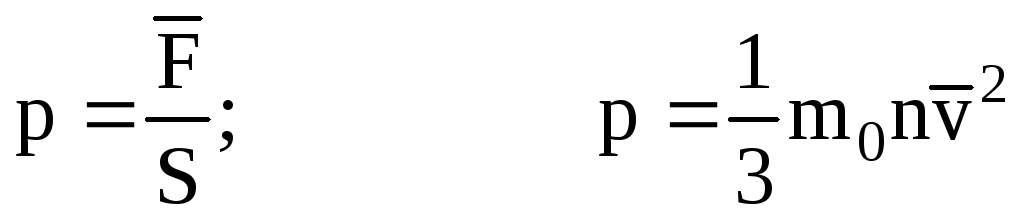 - la ecuación básica del MKT.
- la ecuación básica del MKT.
Denotando el valor promedio de la energía cinética del movimiento de traslación de las moléculas de gas ideal:
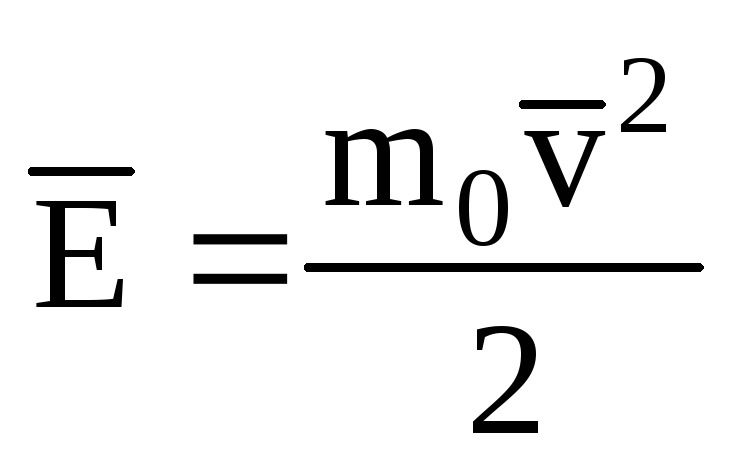 , obtenemos
, obtenemos
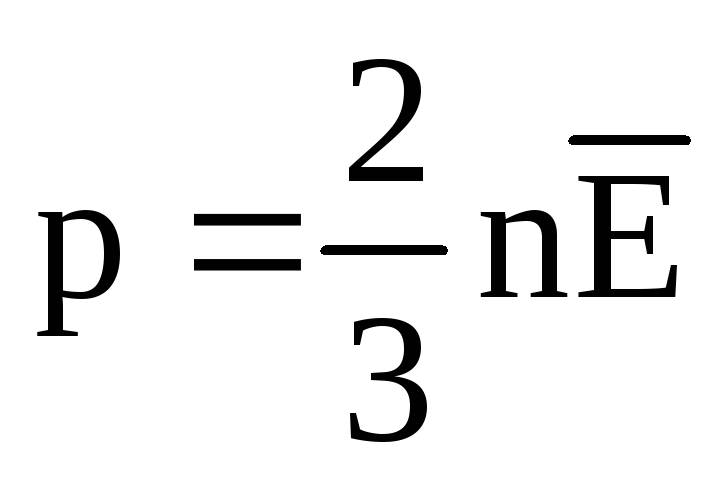
La temperatura y su medida:
La ecuación MKT básica para un gas ideal relaciona un parámetro macroscópico fácilmente medible, la presión, con parámetros de gas microscópicos como la energía cinética promedio y la concentración de moléculas. Pero, habiendo medido solo la presión, no podemos averiguar ni el valor promedio de la energía cinética de las moléculas por separado, ni su concentración. Por lo tanto, para encontrar los parámetros microscópicos del gas, se necesitan mediciones de alguna otra cantidad física relacionada con la energía cinética promedio de las moléculas. Este valor es la temperatura.
Cualquier cuerpo macroscópico o grupo de cuerpos macroscópicos, bajo condiciones externas constantes, pasa espontáneamente a un estado de equilibrio térmico. Equilibrio termal - este es un estado en el que todos los parámetros macroscópicos permanecen sin cambios durante un tiempo arbitrariamente largo.
La temperatura caracteriza el estado de equilibrio térmico de un sistema de cuerpos: todos los cuerpos del sistema que están en equilibrio térmico entre sí tienen la misma temperatura.
Para medir la temperatura se puede utilizar la variación de cualquier magnitud macroscópica en función de la temperatura: volumen, presión, resistencia eléctrica, etc.
En la práctica, con mayor frecuencia, se utiliza la dependencia del volumen de líquido (mercurio o alcohol) de la temperatura. Al calibrar un termómetro, se suele tomar como punto de referencia (0) la temperatura de fusión del hielo; el segundo punto constante (100) es el punto de ebullición del agua a presión atmosférica normal (escala Celsius). Dado que diferentes líquidos se expanden de manera diferente cuando se calientan, la escala así establecida dependerá en cierta medida de las propiedades del líquido dado. Por supuesto, 0 y 100 °C coincidirán con todos los termómetros, pero 50 °C no coincidirán.
A diferencia de los líquidos, todos los gases enrarecidos se expanden de la misma manera cuando se calientan y cambian su presión de la misma manera con un cambio de temperatura. Por lo tanto, en física, para establecer una escala racional de temperatura, se utiliza un cambio en la presión de una cierta cantidad de gas enrarecido a un volumen constante o un cambio en el volumen de un gas a una presión constante. Esta escala a veces se llama escala de temperatura de gases ideales.
En el equilibrio térmico, la energía cinética promedio del movimiento de traslación de las moléculas de todos los gases es la misma. La presión es directamente proporcional a la energía cinética promedio del movimiento de traslación de las moléculas: 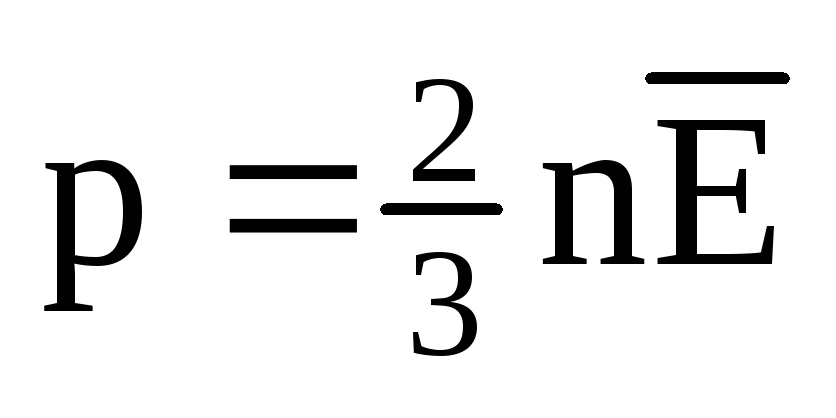 . En el equilibrio térmico, si se fijan la presión de un gas de una masa dada y su volumen, la energía cinética media de las moléculas del gas debe tener un valor estrictamente definido, como la temperatura. Porque
. En el equilibrio térmico, si se fijan la presión de un gas de una masa dada y su volumen, la energía cinética media de las moléculas del gas debe tener un valor estrictamente definido, como la temperatura. Porque 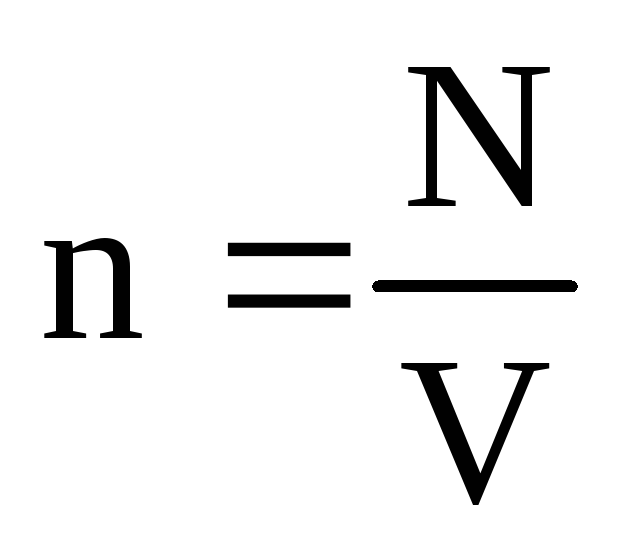 , después
, después 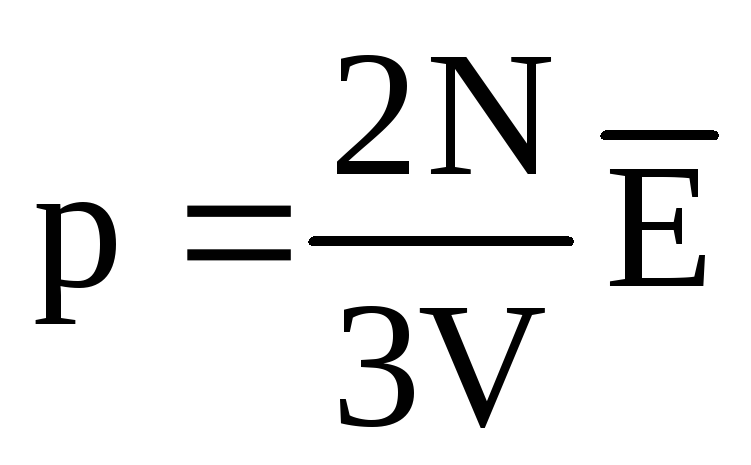 , o
, o 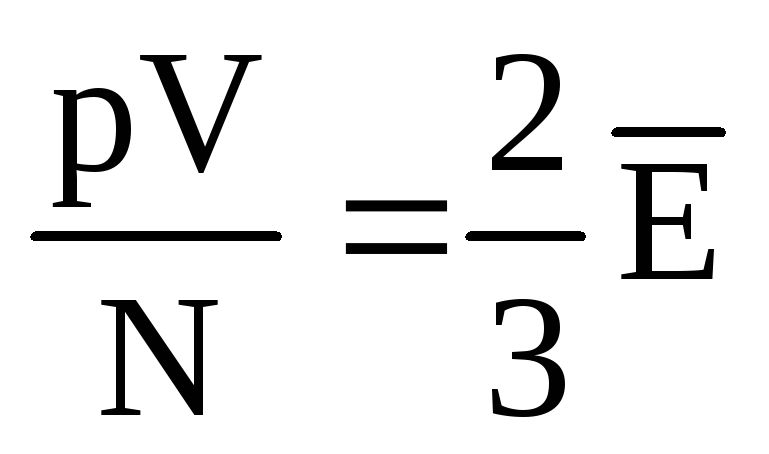 .
.
Denotar 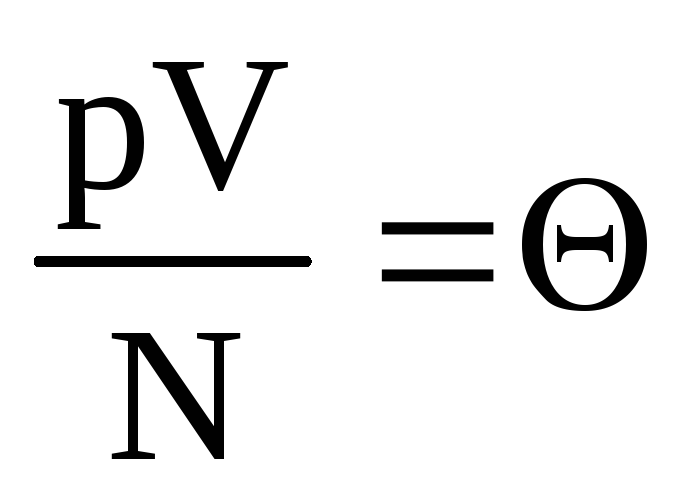 . Valor
. Valor  aumenta con la temperatura y no depende de nada más que de la temperatura. Por lo tanto, puede considerarse una medida natural de la temperatura.
aumenta con la temperatura y no depende de nada más que de la temperatura. Por lo tanto, puede considerarse una medida natural de la temperatura.
Sabías,
¿Qué es un experimento mental, experimento gedanken?
Es una práctica inexistente, una experiencia de otro mundo, la imaginación de lo que realmente no está ahí. Los experimentos mentales son como ensoñaciones. Ellos dan a luz a los monstruos. A diferencia de un experimento físico, que es una prueba experimental de hipótesis, un "experimento mental" reemplaza mágicamente una prueba experimental con las conclusiones no probadas deseadas, manipulando construcciones lógicas que en realidad violan la lógica misma al usar premisas no probadas como probadas, es decir, al sustitución. Por lo tanto, la tarea principal de los solicitantes de "experimentos mentales" es engañar al oyente o al lector reemplazando un experimento físico real con su "muñeco": razonamiento ficticio en libertad condicional sin verificación física en sí.
Llenar la física con "experimentos mentales" imaginarios ha llevado a una imagen absurda, surrealista y confusa del mundo. Un verdadero investigador debe distinguir tales "envolturas" de los valores reales.
Los relativistas y los positivistas argumentan que el "experimento mental" es una herramienta muy útil para probar la consistencia de las teorías (que también surgen en nuestras mentes). En esto engañan a la gente, ya que cualquier verificación solo puede ser realizada por una fuente independiente del objeto de verificación. El propio solicitante de la hipótesis no puede ser una verificación de su propia declaración, ya que la razón de esta declaración en sí misma es la ausencia de contradicciones visibles para el solicitante en la declaración.
Vemos esto en el ejemplo de SRT y GTR, que se han convertido en una especie de religión que rige la ciencia y la opinión pública. Ninguna cantidad de hechos que los contradiga puede superar la fórmula de Einstein: "Si el hecho no corresponde a la teoría, cambia el hecho" (En otra versión, "¿No corresponde el hecho a la teoría? - Tanto peor para el hecho ").
Lo máximo que puede reclamar un "experimento mental" es solo la consistencia interna de la hipótesis dentro del marco de la propia lógica del solicitante, a menudo de ninguna manera verdadera. El cumplimiento de la práctica no comprueba esto. Una prueba real solo puede tener lugar en un experimento físico real.
Un experimento es un experimento, porque no es un refinamiento del pensamiento, sino una prueba del pensamiento. El pensamiento que es consistente consigo mismo no puede probarse a sí mismo. Esto ha sido probado por Kurt Gödel.
