Capacidad calorífica del sulfuro de hidrógeno a varias temperaturas. Capacidad calorífica específica del gas natural
La capacidad térmica no específica, sino total, en el sentido físico generalmente aceptado, es la capacidad de una sustancia para calentarse. Al menos eso es lo que nos dice cualquier libro de texto sobre física térmica: esto es definición clásica capacidad calorífica(redacción correcta). De hecho, esta es una característica física interesante. Poco conocido por nosotros en la vida cotidiana "cara de la moneda". Resulta que cuando se suministra calor desde el exterior (calentamiento, calentamiento), no todas las sustancias reaccionan de la misma manera al calor ( energía térmica) y calentar de manera diferente. Capacidad GAS de origen natural utilizado como combustible recibir, recibir, retener y acumular (acumular) energía térmica se denomina capacidad calorífica del gas combustible NATURAL. y ella misma capacidad calorífica del metano, es una característica física que describe las propiedades termofísicas del combustible gaseoso. Al mismo tiempo, en diferentes aspectos aplicados, dependiendo de un caso práctico concreto, una cosa puede resultarnos importante. Por ejemplo: la capacidad de una sustancia para tomar cálido o la capacidad de acumular energía térmica o "talento" para mantenerlo. Sin embargo, a pesar de alguna diferencia, en el sentido físico, las propiedades que necesitamos se describirán capacidad calorífica del metano.
Un pequeño pero muy "problema desagradable" de naturaleza fundamental es que la capacidad de calentar - capacidad térmica del metano, está directamente relacionado no sólo con composición química, la estructura molecular de una sustancia, sino también con su cantidad (peso, masa, volumen). Debido a una conexión tan "desagradable", el general capacidad calorífica del metano se convierte en una característica física demasiado inconveniente de la sustancia. Dado que un parámetro medido describe simultáneamente "dos cosas diferentes". A saber: realmente caracteriza PROPIEDADES TERMOFÍSICAS DEL GAS NATURAL, sin embargo, "de paso" también tiene en cuenta su cantidad. Formando una especie de característica integral, en la que la física térmica "alta" y una cantidad "banal" de materia (en nuestro caso: combustible de gas) se conectan automáticamente.
Bueno, ¿por qué necesitamos tales características termofísicas, en las que se rastrea claramente la "psique inadecuada"? Desde el punto de vista de la física, el total capacidad calorífica del metano(de la forma más torpe), intenta no sólo describir la cantidad de energía térmica capaz de acumularse en el combustible gaseoso, sino también "de paso informarnos" sobre la cantidad GAS NATURAL COMBUSTIBLE. Resulta absurdo, y no un claro, comprensible, estable, correcto característica termofísica del metano. En lugar de una constante útil adecuada para fines prácticos cálculos termofísicos, se nos da un parámetro flotante, que es la suma (integral) de la cantidad de calor recibido GAS NATURAL y su masa o volumen de metano.
Gracias, por supuesto, por tanto "entusiasmo", pero la cantidad GAS COMBUSTIBLE NATURAL Puedo medirme. Habiendo recibido resultados en una forma mucho más conveniente, "humana". Cantidad GAS NATURAL COMBUSTIBLE Me gustaría no "extraer" por métodos matemáticos y cálculos usando una fórmula compleja del general capacidad calorífica del metano, a diferentes temperaturas, y averigüe el peso (masa) en gramos (g, g), kilogramos (kg), toneladas (tons), cubos (metros cúbicos, metros cúbicos, m3), litros (l) o mililitros (ml ). Especialmente desde gente inteligente Hace mucho tiempo se le ocurrieron instrumentos de medición bastante adecuados para estos fines. Por ejemplo: balanzas u otros dispositivos.
Especialmente la "naturaleza flotante molesta" del parámetro: general capacidad calorífica del GAS natural. Su "estado de ánimo" inestable y cambiante. Al cambiar el "tamaño de la porción o la dosis", capacidad calorífica del GAS NATURAL a diferentes temperaturas cambia inmediatamente. Mezcla de gases más combustibles, cantidad física, valor absoluto capacidad calorífica del metano- aumenta. Menos cantidad de mezcla de gases combustibles, valor capacidad térmica del metano disminuye "Desgracia" algunos resulta! En otras palabras, lo que "tenemos" no puede de ninguna manera ser considerado una constante que describe Características termofísicas del GAS NATURAL a diferentes temperaturas. Y es deseable que "tengamos" un coeficiente constante comprensible, un parámetro de referencia que caracterice propiedades termales combustible gas, sin "referencias" a la cantidad de metano (peso, masa, volumen). ¿Qué hacer?
Aquí es donde un método muy simple pero "muy científico" viene a nuestro rescate. Todo se reduce no solo al alguacil "ud. - específico", antes de cantidad física, sino a una solución elegante que implica la exclusión de la consideración de la cantidad de materia. Naturalmente, parámetros "incómodos, superfluos": masa o volumen GAS NATURAL COMBUSTIBLE absolutamente imposible de descartar. Al menos por la razón de que si no hay cantidad de metano, entonces no habrá un "tema de discusión" en sí mismo. Y la sustancia debe ser. Por lo tanto, elegimos algún estándar condicional de masa o volumen, que puede considerarse una unidad adecuada para determinar el valor del coeficiente "C" que necesitamos. Para peso del combustible GAS NATURAL, tal unidad de masa de metano, conveniente en el uso práctico, resultó ser 1 kilogramo (kg).
Ahora nosotros calentamos un kilogramo de GAS NATURAL en 1 grado, y la cantidad de calor (energía térmica) necesitamos calentar mezcla de gases un grado - este es nuestro parámetro físico correcto, coeficiente "C", bueno, bastante completa y claramente describiendo uno de PROPIEDADES TERMOFÍSICAS DEL GAS NATURAL A DIFERENTES TEMPERATURAS. Tenga en cuenta que ahora estamos tratando con una característica que describe propiedad fisica sustancia, pero sin tratar de "informarnos adicionalmente" sobre su cantidad. ¿Cómodo? No hay palabras. Es un asunto completamente diferente. Por cierto, ahora no estamos hablando del general capacidad térmica del metano. Todo ha cambiado. ESTE ES EL CALOR ESPECÍFICO DEL GAS NATURAL, que a veces se llama con otro nombre. ¿Cómo? Simplemente MASIVO CAPACIDAD TÉRMICA DEL GAS NATURAL COMBUSTIBLE. Específico (ud.) Y masa (m.) - en este caso: sinónimos, significan aquí el que necesitamos coeficiente "C".
Tabla 1. Coeficiente: capacidad calorífica específica del GAS NATURAL (sp.). Capacidad térmica másica del GAS combustible NATURAL. Dato de referencia.
En pocas palabras, la capacidad de calor DE cuerpo se llama la cantidad de calor que necesita gastarse en este proceso para calentar el cuerpo en un grado: .
Habitualmente, la capacidad calorífica se refiere a una unidad de la cantidad de una sustancia y, dependiendo de la unidad elegida, se distinguen:
capacidad calorífica de masa específica Con, referido a 1 kg de gas, J/(kgK);
capacidad calorífica volumétrica específica Con´, referido a la cantidad de gas contenido en 1 m 3 de volumen en condiciones físicas normales, J/(m 3 K);
capacidad calorífica molar específica μ Con, referido a un kilomol, J / (kmolK).
La relación entre las capacidades caloríficas específicas se establece mediante las relaciones obvias:
Con= μ Con/μ; Con´= Con n. (2.13)
Aquí ρ n es la densidad del gas en condiciones normales.
El cambio en la temperatura corporal con la misma cantidad de calor suministrado depende de la naturaleza del proceso que se lleva a cabo, por lo tanto La capacidad calorífica es una función del proceso.. Esto significa que el mismo fluido de trabajo, según el proceso, requiere una cantidad diferente de calor para calentarse en 1 K. Magnitud numérica Con varía de + ∞ a – ∞.
En cálculos termodinámicos gran importancia tener:
capacidad calorífica a presión constante
Con p = δ q pags/ dT, (2.14)
q p , llevado al cuerpo en el proceso a presión constante, a un cambio en la temperatura corporal dT;
capacidad calorífica a volumen constante
Con v = δ q v /dT, (2.15)
igual a la relación de la cantidad de calor δ q v, traído al cuerpo en el proceso a un volumen constante, a un cambio en la temperatura corporal dT.
De acuerdo con la primera ley de la termodinámica para sistemas cerrados δ q = du + pdv.
Teniendo en cuenta el hecho de que 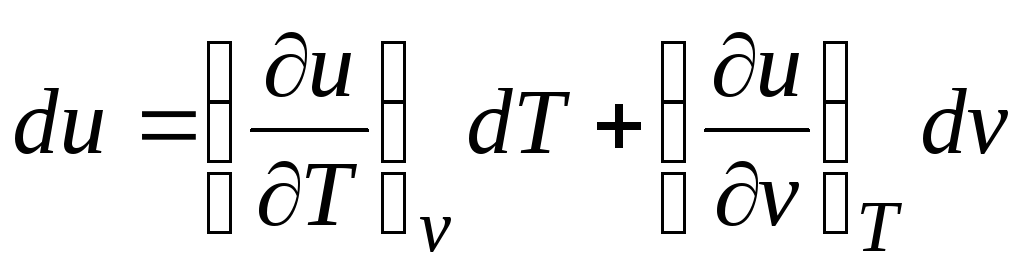 (relaciones (2.1))
(relaciones (2.1))
Δ q = (∂tu/∂T) v dT + [(∂tu/∂v) T + pags]dv. (2.16)
Para un proceso isocórico ( v=const) esta ecuación toma la forma 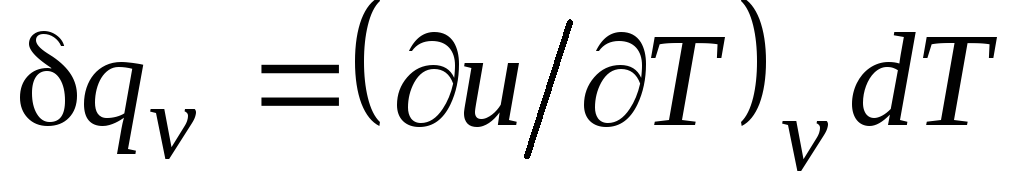 , y, teniendo en cuenta (2.15), obtenemos que
, y, teniendo en cuenta (2.15), obtenemos que
C v = (∂tu/∂T) v . (2.17)
Para un gas ideal
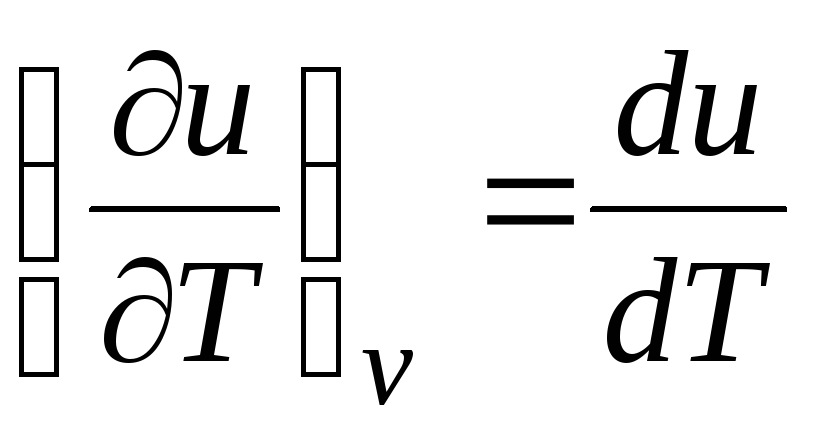 (ecuación 2.2), entonces
(ecuación 2.2), entonces
C v = du/dT. (2.18)
Para un proceso isobárico ( R=const) de las ecuaciones (2.16) y (2.14) obtenemos
C pag = (∂ tu/∂T) v + [(∂tu/∂v) T + pags](dv/dT) pags
Dado que la energía interna gas ideal está determinado solo por su temperatura y no depende del volumen específico, entonces
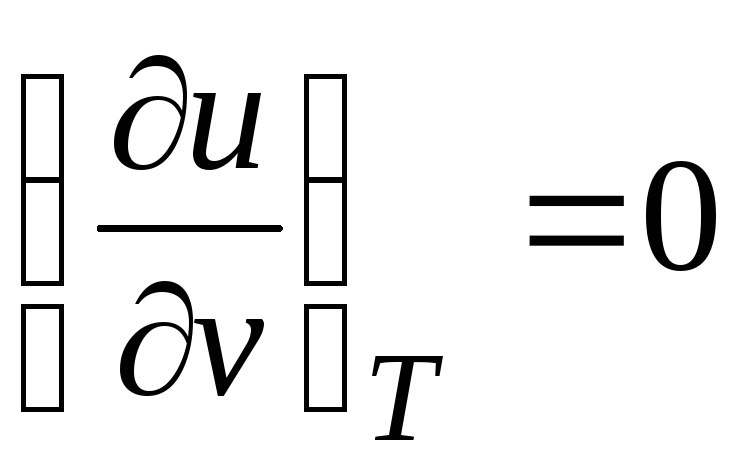 .
(2.19)
.
(2.19)
De la ecuación de Clapeyron (1.4) p.v.
= RT(1.3) sigue 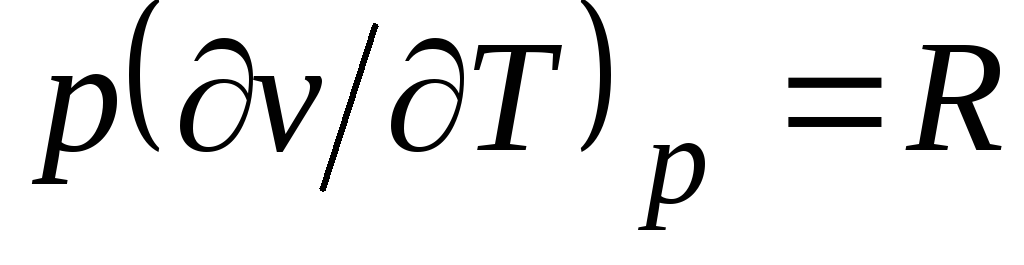 , dónde
, dónde
C pag= Con v + R. (2.20)
La relación (2.20) se denomina ecuación de Mayer y es una de las principales en termodinámica técnica de gases ideales.
En el proceso v\u003d const, el calor impartido al gas solo cambia su energía interna, mientras que en el proceso p \u003d const, el calor se gasta tanto para aumentar la energía interna como para realizar el trabajo de expansión. Es por eso C pag mas Con v por el importe de este trabajo.
Fórmula ![]() determina la llamada capacidad calorífica verdadera, es decir, el valor de la capacidad calorífica a una temperatura dada. En la práctica, la capacidad calorífica se usa ampliamente para calcular la cantidad de calor q 12, que debe gastarse para calentar el cuerpo desde una temperatura ( t 1) a otro ( t 2) (o que se liberará al enfriarse de t 2 a t 1).
determina la llamada capacidad calorífica verdadera, es decir, el valor de la capacidad calorífica a una temperatura dada. En la práctica, la capacidad calorífica se usa ampliamente para calcular la cantidad de calor q 12, que debe gastarse para calentar el cuerpo desde una temperatura ( t 1) a otro ( t 2) (o que se liberará al enfriarse de t 2 a t 1).
Si la capacidad de calor no cambia en el rango de temperatura indicado, entonces
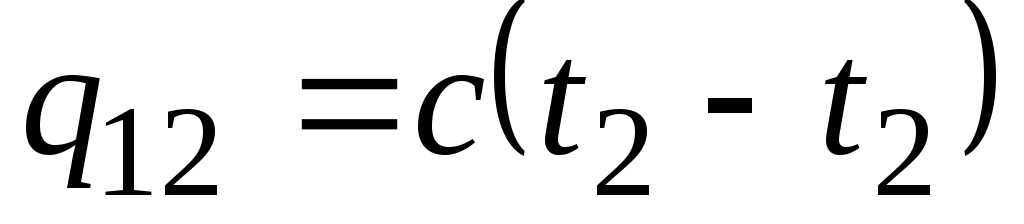 , kJ/kg y
, kJ/kg y 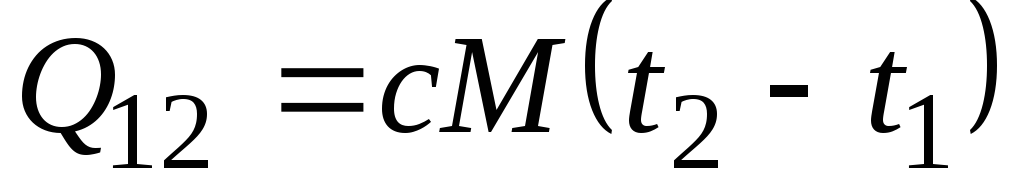 , kJ. (2.21)
, kJ. (2.21)
Esta fórmula también se puede utilizar para cálculos aproximados (no muy precisos). Por ejemplo, la capacidad calorífica específica del agua a temperatura ambiente es 4,187 kJ/(kgC) y la del aire 1 kJ/(kgC). Dado que la capacidad calorífica de casi todas las sustancias cambia (la mayoría de las veces aumenta) al aumentar la temperatura, es necesario, estrictamente hablando, usar la fórmula
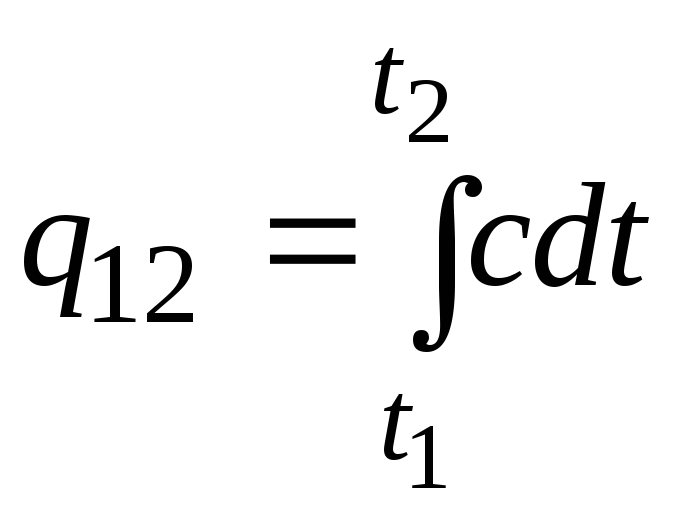 .
(2.21a)
.
(2.21a)
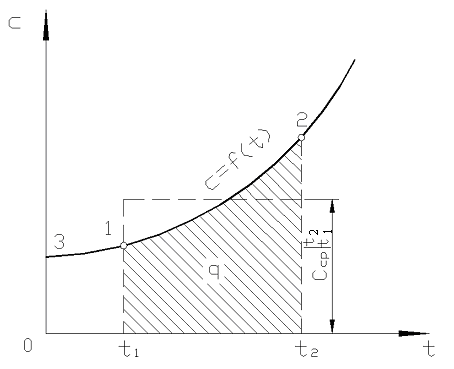
En la fig. 2.2 magnitud q 12 se muestra como un área sombreada. Parecería que la forma más fácil, aplicando el teorema del valor medio, es escribir
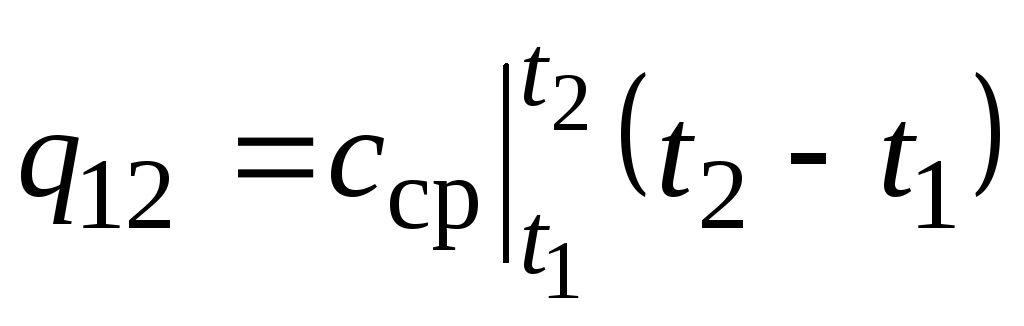 ,
(2.22)
,
(2.22)
dónde 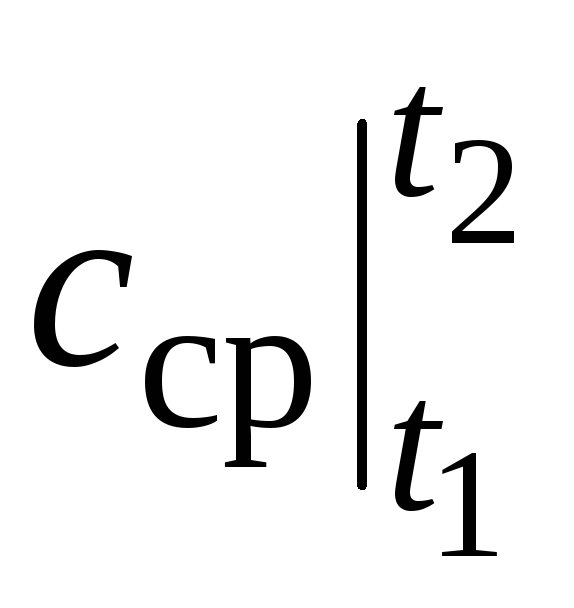 es la capacidad calorífica promedio en el rango de temperatura t 1 …t 2 .
es la capacidad calorífica promedio en el rango de temperatura t 1 …t 2 .
Arroz. 2.2. Dependencia de la capacidad calorífica real de la temperatura.
Sin embargo, para cálculos reales, tal notación es muy inconveniente, ya que la capacidad calorífica se elige de las tablas y 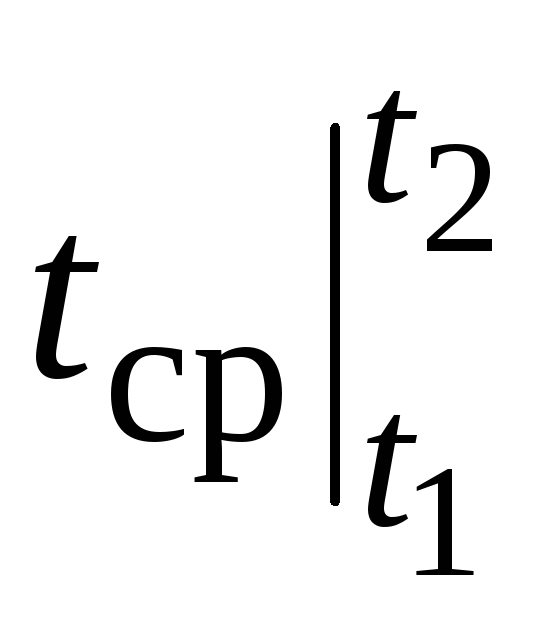 depende de como t 1 y desde t 2. Una tabla de funciones de dos argumentos sería muy engorrosa.
depende de como t 1 y desde t 2. Una tabla de funciones de dos argumentos sería muy engorrosa.
En la práctica, proceda de la siguiente manera. La cantidad deseada de calor se presenta como la diferencia entre sus cantidades requeridas para calentar el cuerpo desde 0 С hasta temperaturas t 2 y t 1 respectivamente (Fig. 2.2)
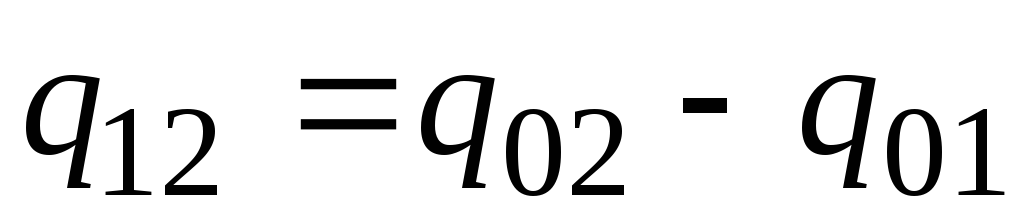 . (2.23)
. (2.23)
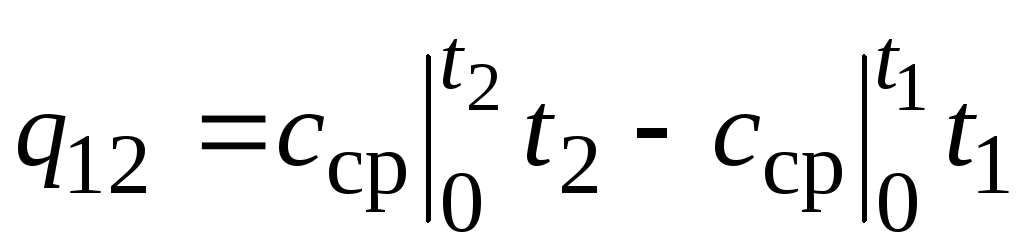 ,
(2.24)
,
(2.24)
dónde  - capacidad calorífica media en el rango de temperatura 0… tC.
- capacidad calorífica media en el rango de temperatura 0… tC.
El valor de la capacidad calorífica promedio.  para una sustancia dada (y un proceso dado, i.e. Con R o C v) depende solo de una temperatura t. Son estas capacidades caloríficas las que se dan en todas las tablas bajo el nombre de "promedio". Lo que se ha dicho es cierto para Con
(Con R y C v), así como para Con y Con. Como ejemplo, la siguiente tabla muestra la capacidad calorífica frente a la temperatura de algunos de los gases más comunes. Cabe recalcar que en la fórmula (2.24) la temperatura se sustituye en grados Celsius.
para una sustancia dada (y un proceso dado, i.e. Con R o C v) depende solo de una temperatura t. Son estas capacidades caloríficas las que se dan en todas las tablas bajo el nombre de "promedio". Lo que se ha dicho es cierto para Con
(Con R y C v), así como para Con y Con. Como ejemplo, la siguiente tabla muestra la capacidad calorífica frente a la temperatura de algunos de los gases más comunes. Cabe recalcar que en la fórmula (2.24) la temperatura se sustituye en grados Celsius.
La capacidad calorífica molar promedio de varios gases a R= constante
(según M.P. Vukalovich, V.A. Kirillin, V.N. Timofeev)
|
t, C |
Con R, kJ/(kmolK) |
|||||||
|
N 2 atmosférico | ||||||||
En esta tabla, los valores Con p se dan hasta 100 С. Como no cambian mucho con la temperatura, se pueden encontrar valores intermedios por extrapolación lineal. Recuerda cómo se hace esto. Hay valores de funciones tabulares. y
= F(X) a 1 (cuando X= X 1) y a 2 (cuando X= X 2). Valor de función a(X) a X 1 <X<X 2 es igual 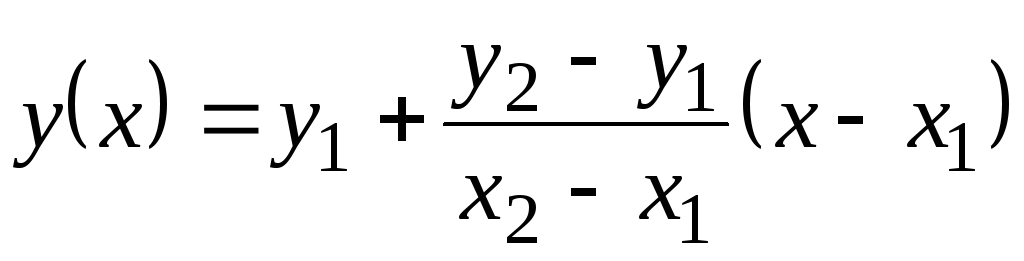 . Esta fórmula es cierta tanto para una función monótonamente creciente (cuando a 2 >a 1) y para monótonamente decreciente ( a 2 <a una); En este caso, la fracción será negativa, ya que X 2 > X 1 siempre
. Esta fórmula es cierta tanto para una función monótonamente creciente (cuando a 2 >a 1) y para monótonamente decreciente ( a 2 <a una); En este caso, la fracción será negativa, ya que X 2 > X 1 siempre
La tabla muestra los valores de conductividad térmica de los gases en función de la temperatura y la presión.
Los valores de conductividad térmica se indican para temperaturas en el rango de 20 K (-253 °C) a 1500 K (1227 °C) y presión de 1 a 1000 atmósferas.
Mesa dada la conductividad térmica de los siguientes gases: , , freon-14 CF 4 , etileno C 2 H 4 . La unidad de conductividad térmica es W/(m deg).
se debe notar que la conductividad térmica de los gases aumenta al aumentar la temperatura y la presión. Por ejemplo, la conductividad térmica del gas amoníaco a temperatura ambiente y presión atmosférica normal es de 0,024 W/(m deg), y cuando se calienta 300 grados, la conductividad térmica aumenta a un valor de 0,067 W/(m deg). Si la presión de este gas aumenta a 300 atmósferas, entonces el valor de la conductividad térmica será aún mayor y tendrá un valor de 0,108 W / (m deg).
Nota: ¡Cuidado! La conductividad térmica en la tabla se indica con un factor de 10 3 . ¡No olvides dividir por 1000!
Conductividad térmica de gases inorgánicos en función de la temperatura.
La tabla da los valores de la conductividad térmica de los gases inorgánicos en función de la temperatura a la presión atmosférica normal. Los valores de conductividad térmica de los gases se indican a temperaturas de 80 a 1500 K (-193 ... 1227 ° C).
La tabla muestra la conductividad térmica de los siguientes gases: óxido nitroso N 2 O, hexafluoruro de azufre SF 6, óxido nítrico NO, sulfuro de hidrógeno H 2 S, amoníaco NH 3, dióxido de azufre SO 2, vapor H 2 O, dióxido de carbono CO 2 , vapor de agua pesada D 2 O, aire.
se debe notar que la conductividad térmica de los gases inorgánicos aumenta al aumentar la temperatura del gas.
Nota: La conductividad térmica de los gases en la tabla se indica con un factor de 10 3 . ¡No olvides dividir por 1000!
Conductividad térmica de gases orgánicos en función de la temperatura
La tabla muestra los valores de conductividad térmica de gases orgánicos y vapores de algunos líquidos en función de la temperatura a presión atmosférica normal. Los valores de la conductividad térmica de los gases se dan en la tabla en el rango de temperatura de 120 a 800 K.
Se da la conductividad térmica de los siguientes gases y líquidos orgánicos: acetona CH 3 COCH 3, octano C 8 H 18, pentano C 5 H 12, butano C 4 H 10, hexano C 6 H 14, propileno C 3 H 6, heptano C 7 H 16, alcohol amílico C 5 H 11 OH, xileno C 8 H 10, alcohol isopropílico C 2 H 7 OH, metano CH 4, alcohol metílico CH 3 OH, tetracloruro de carbono CCl 4, ciclohexano C 6 H 12, etano C 2 H 6, tetrafluoruro de carbono CF 4, freón-11 CFCl 3, cloruro de etilo C 2 H 5 Cl, freón-12 CF 2 Cl 2, etileno C 2 H 4, freón-13 CF 3 Cl, formiato de etilo HCOOC 2 H 5, freón-21 CHFCl 2, éter dietílico (C 2 H 5 ) 2O.
Como se puede ver en la tabla, el valor de la conductividad térmica de los gases orgánicos también aumenta con el aumento de la temperatura del gas.
¡Ten cuidado! La conductividad térmica en la tabla se indica con un factor de 10 3 . ¡No olvides dividir por 1000! Por ejemplo, la conductividad térmica del vapor de acetona a una temperatura de 400 K (127 °C) es de 0,0204 W/(m deg).
