mezclas de gases Capacidad calorífica de los gases. Combustible, mezclas de gases y capacidad calorífica
1.3. Ecuación de estado de los gases ideales
La forma de las ecuaciones de estado (1.1) para sustancias reales es bastante complicada.
En este sentido, en termodinámica se utilizan modelos físicos simplificados de cuerpos de trabajo.
Para fluidos de trabajo en estado gaseoso, el modelo más simple e históricamente el primero es gas ideal. Un gas ideal es un gas en el que las fuerzas de interacción intermolecular (atracción y repulsión) están ausentes y las moléculas mismas se consideran como puntos materiales. Un gas ideal obedece la ecuación de Claiperon– Mendeleiev
dónde metro es la masa de gas en el sistema; μ es la masa molar del gas; Rμ = 8314 J/(kmol K) es la constante universal de los gases, que no depende del tipo de gas ni de las condiciones de su existencia. La ecuación de estado (1.2) se obtiene combinando Leyes de Boyle-Mariotte y Gay Lussac teniendo en cuenta ley de avogadro.
Masa molar μ = metro/norte, kg/mol, es la masa de una sustancia tomada en la cantidad de un mol. 1 mol es una unidad de la cantidad de una sustancia que contiene tantas partículas como 12 gramos de carbono. Cantidad de sustancia– n = N/N A, topo, donde norte es el número de partículas (átomos, moléculas), norte A ≈ 6.02 10 23 - el número de átomos en 12 gramos de carbono ( El número de Avogadro). Numéricamente μ = Мr 10 -3 , donde Mr es el peso molecular relativo de la sustancia ( pestaña. Mendeleiev) (por ejemplo: =2 kg/kmol).
En términos específicos (es decir, para 1 kg de gas), la ecuación (1.2) tendrá la forma
dónde R– constante de gas específica, J/(kg K).
Expliquemos el significado físico de la constante de gas específica R. Para el primer estado la ecuación (1.2) se escribirá como , para el segundo estado a la misma presión - . Resta la primera ecuación de la segunda ecuación y encuentra que , es decir La constante específica del gas es el trabajo realizado por 1 kg de gas cuando se calienta 1 grado a presión constante.
Los datos experimentales muestran que un gas real está cuanto más cerca de uno ideal, menor es su densidad. En otras palabras, con una disminución en el volumen de una cantidad dada de gas, causada por un aumento en la presión o una disminución en la temperatura, cualquier gas se desviará cada vez más de las propiedades de un gas ideal. Así, bajo el concepto de "gas ideal" caben todos los gases reales a altas temperaturas y bajas presiones.
1.4. mezclas gases ideales
En la práctica, el fluido de trabajo suele ser una mezcla de gases homogéneos (por ejemplo, aire), cada uno de los cuales puede considerarse ideal y que no entran en reacciones químicas.
Tal mezcla es también un gas ideal y obedece a la ecuación de estado (1.2) para la mezcla
dónde R=R μ / μ es la constante de los gases de la mezcla; m es la masa molar promedio (aparente) de la mezcla(un valor condicional que se refiere a un gas representativo homogéneo, en el que el número de moléculas y la masa total son iguales al número de moléculas y la masa de la mezcla).
La masa de la mezcla es igual a la masa de todos los componentes constituyentes
La principal ley que determina el comportamiento de una mezcla de gases es ley de dalton:
cada gas individual se comporta en una mezcla de gases como si solo, a la temperatura de la mezcla, ocupara todo el volumen de la mezcla,
cada gas individual que ingresa a la mezcla de gases tiene la misma presión que tendría si ocupara solo todo el volumen de la mezcla de gases.
De ahí el valor R(presión absoluta de la mezcla) se define como
dónde R i – presión parcial i th componente, es decir presión que sería i th componente, si solo ocupaba todo el volumen de la mezcla a la misma temperatura ().
La composición de la mezcla viene dada por fracciones másicas o molares de los componentes constituyentes de la mezcla, así como por fracciones volumétricas (concentraciones).
Fracción de masa es la relación entre la masa de cada gas y la masa total de la mezcla: .
La ecuación (1.3) implica que .
Fracción de volumen se llama la relación volumen parcial(el volumen que ocuparía el gas si su presión y temperatura fueran iguales a la presión y temperatura de la mezcla de gases, es decir) al volumen total de la mezcla de gases: . De las definiciones de presión y volumen parciales y de la constancia de la temperatura, se sigue:
![]() (1.5)
(1.5)
Sumando la última igualdad sobre todos los componentes de la mezcla, obtenemos , es decir la suma de los volúmenes parciales de los gases que componen la mezcla es igual al volumen de la mezcla de gases.
La suma de las fracciones de volumen es igual a uno: .
fracción molar componente se llama la relación de la cantidad de sustancia de cada gas norte i a la cantidad de sustancia de la mezcla de gases norte. De las relaciones y y ley de avogadro(en volúmenes iguales de diferentes gases ideales a las mismas temperaturas y las mismas presiones, se encierran un número igual de moléculas, es decir) sigue:
aquellos. especificar una mezcla por fracciones molares es equivalente a especificar sus fracciones de volumen.
Las fracciones de masa y volumen están relacionadas por la razón:
![]() .
.
Si la mezcla está dada por fracciones de masa gramo i, entonces la constante de gas de la mezcla y la masa molar de la mezcla se calculan de la siguiente manera:
![]()
![]()
Si la mezcla está dada por fracciones de volumen r i, entonces las fórmulas para calcular la masa molar de la mezcla y la constante de gas de la mezcla son las siguientes:
![]() (1.6)
(1.6)
Las presiones parciales y los volúmenes de los gases están determinados por Ley de Boyle–marriotte(a una temperatura constante del gas, el producto de la presión del gas y su volumen es un valor constante, es decir):
![]() .
.
preguntas de examen
Sistema Internacional de Unidades (SI) y sus unidades base.
Parámetros termodinámicos básicos y sus dimensiones.
¿Qué se entiende por estado de equilibrio de un sistema termodinámico?
El concepto de estados de equilibrio y de no equilibrio.
¿Qué es la ecuación de estado de un sistema?
Interpretación geométrica del estado del sistema, proceso termodinámico.
¿Qué es un gas ideal? ¿Cuál es la diferencia entre un gas ideal y uno real?
¿Cuál es la constante de los gases? Su significado físico, dimensión y métodos de definición.
2. Capacidad calorífica
El mensaje de calor al cuerpo de trabajo en cualquier proceso provoca un cambio en su estado y, en el caso general, va acompañado de un cambio de temperatura. El cambio de temperatura, así como cualquier otro parámetro del estado del fluido de trabajo, no depende del tipo de proceso, sino de su inicial ( 1 ) y final ( 2 ) afirma, es decir (para un proceso elemental, el cambio en un parámetro se reemplaza por su diferencial).
La relación de la cantidad de calor δ q comunicado al cuerpo a un cambio en la temperatura corporal dT en un proceso termodinámico elemental se llama capacidad calorífica real cuerpos en este proceso:
El subíndice aquí indica el hecho de que la capacidad calorífica, como el calor, depende de la naturaleza del proceso. Además, la capacidad calorífica depende de la cantidad del cuerpo y de su estado termodinámico. También se debe tener en cuenta que en este proceso la composición química del cuerpo no cambia, no hay transición de una sustancia de un estado de agregación a otro, no hay disolución de componentes, etc.
Dependiendo de la unidad de cantidad elegida de una sustancia, se distinguen las capacidades de calor específico de masa, volumen y molar:
El concepto de capacidad calorífica de masa se usa con mayor frecuencia en la práctica.
2.1. Capacidad calorífica verdadera y media
La capacidad calorífica de una sustancia real no es un valor constante. Cambia con la temperatura, y esta dependencia puede ser muy significativa (Fig. 2.1).
La cantidad específica de calor de proceso se calcula mediante la fórmula
Los siguientes métodos se utilizan para determinar este valor:
de acuerdo con los resultados del experimento, la dependencia de la capacidad calorífica con la temperatura se representa como un polinomio de aproximación
donde son los coeficientes de aproximación. Estos coeficientes se dan en la literatura de referencia. Después
en cálculos prácticos en el rango de temperatura t 1 , t 2 la capacidad calorífica se considera un valor constante igual a
llamó capacidad calorífica media en este intervalo, en contraste con la verdadera capacidad calorífica introducida en (2.1). Los datos de referencia dan capacidades caloríficas promedio de 0 a temperatura fija t obtenido empíricamente, es decir
Capacidad calorífica media en el rango de temperatura t 1 , t 2 de acuerdo con estos datos de referencia se puede calcular mediante la fórmula
Después cantidad especifica El calor de proceso se define como
2.2. Capacidades caloríficas isocóricas e isobáricas
son de gran importancia en la termodinámica.
isocoricocapacidad calorífica
igual a la relación entre la cantidad de calor en el proceso a un volumen constante y el cambio en la temperatura corporal,
isobáricocapacidad calorífica
igual a la relación entre la cantidad de calor en el proceso a presión constante y el cambio en la temperatura corporal.
En los cálculos termotécnicos, se utilizan tablas que muestran valores numéricos obtenidos experimentalmente para capacidades caloríficas isobáricas e isocóricas específicas para diversas sustancias según la temperatura.
2.3. Capacidad calorífica de las mezclas de gases.
En los cálculos, a menudo es necesario tratar con mezclas de gases, y las capacidades caloríficas se dan en las tablas solo para gases individuales.
Si la mezcla de gases viene dada por fracciones de masa gramo i, entonces las capacidades caloríficas de masa específicas de la mezcla están determinadas por las fórmulas
![]()
Si la mezcla de gases viene dada por fracciones volumétricas r i, entonces las capacidades caloríficas volumétricas específicas de la mezcla están determinadas por las fórmulas
![]()
preguntas de examen
Escriba las unidades de capacidad calorífica específica.
¿Cómo se introduce el concepto de capacidad calorífica media?
3. La ley de conservación y transformación de la energía
El concepto de energía está asociado al movimiento de la materia.
La energía puede adoptar muchas formas: trabajo mecánico, calor, energía química, energía de campos eléctricos y magnéticos.
En un proceso termodinámico, la interacción del medio ambiente y un sistema termodinámico cerrado se lleva a cabo mediante el intercambio de energía en forma de calor y trabajo mecánico.
3.1. Energía interna
Cualquier ambiente tiene algún margen energía internatu(J), que en termodinámica técnica se representa como la suma de las energías cinética y potencial de las moléculas y átomos del medio. La energía cinética de estas partículas está determinada por su velocidad y masa, mientras que la energía potencial está determinada por las fuerzas de interacción entre ellas, que dependen de su posición relativa. La energía interna de un sistema es la energía contenida en el propio sistema. Esto significa que la energía interna puede caracterizar el estado del cuerpo junto con las cantidades R, V, T.
La energía interna tiene la propiedad de aditividad, es decir la energía interna de un sistema complejo es igual a la suma de las energías internas de sus partes constituyentes:
La energía interna de 1 kg de una sustancia se llama energía interna específica tu= tu/ metro (J/kg).
Para la mayoría de las aplicaciones técnicas de la termodinámica, no es el valor absoluto lo que importa. tu, y el cambio en este valor. Por lo tanto, la definición cuantitativa de la energía interna de un sistema homogéneo a menudo se determina con respecto a algún estado estándar elegido convencionalmente.
3.2. Ley de conservación de la energía en termodinámica.
Al realizar un proceso termodinámico, un sistema cerrado interactúa con el entorno externo (cuerpos y campos externos), es decir, intercambia energía. En termodinámica técnica, se consideran dos tipos de transferencia de energía: mediante la transferencia de calor y mediante la realización de trabajo mecánico.
La transferencia de calor se produce entre cuerpos de distinta temperatura y puestos en contacto, o entre cuerpos de distinta temperatura, situados a cierta distancia, por medio de ondas electromagnéticas ( Radiación termal). Transmisión calor ocurre a nivel molecular (microfísico) sin movimiento visible de los cuerpos.
La transferencia de energía en forma de trabajo se produce con el movimiento de todo el cuerpo o de parte de él en el espacio. Con este método, el cuerpo se mueve en un campo de fuerza o cambia su volumen bajo la influencia de la presión externa. Trabajar es una forma macrofísica de transferencia de energía.
Cabe señalar que el calor y el trabajo, a diferencia de la energía de un cuerpo, no son funciones de su estado, sino que dependen del tipo de proceso, determinan este proceso, es decir. son funciones del proceso mismo.
Numerosos experimentos y observaciones llevaron al descubrimiento de una ley fundamental de la naturaleza: la ley de conservación de la energía: la energía en la naturaleza no surge de la nada y no desaparece, o la cantidad de energía no cambia, solo cambia de una forma a otra, o
dónde q es el calor involucrado en el proceso; L- el trabajo que se está realizando; Δ mi es el cambio en la energía del sistema. Aquí y más abajo, acordamos considerar:
trabajar positivo si este trabajo es realizado por el cuerpo de trabajo, y negativo, si se realiza trabajo en el cuerpo de trabajo del sistema;
calor suministrado al cuerpo positivo, y lo asignado - negativo
además, un cambio en cualquier parámetro de estado en el proceso final se denotará con el símbolo Δ (delta), y en el proceso elemental - d(diferencial del parámetro correspondiente). Para cualquier proceso termodinámico finito, el cambio en el parámetro de estado (presión, temperatura, energía interna, entalpía, entropía, etc.) no depende del tipo de proceso, sino que está determinado por los estados inicial y final.
En general, un sistema termodinámico tiene una energía interna tu, energía cinética (en termodinámica, el sistema se considera como un todo moviéndose a una velocidad w) – mw 2/2, potencial - mgz (z es la altura a la que se encuentra el sistema). Cambio en la energía total en el proceso 1 –2 se puede imaginar como:
El trabajo realizado en este proceso es la suma del trabajo L sobre, asociado con un cambio en el volumen del fluido de trabajo del sistema (trabajo de deformación), trabajo L dv sobre el movimiento del sistema en el espacio, trabajo técnico L aquellos (al mover el sistema en varios dispositivos técnicos, por ejemplo, en un motor, caldera de vapor, compresor, etc.), trabajan contra fuerzas de fricción L tr:
L \u003d L sobre + L dv + L esos + L tr.
El calor involucrado en el proceso es la suma del calor q externo, involucrado en el intercambio con el ambiente externo, y el calor de fricción q tr:
q = q externo + q tr.
Dado que q tr = L tr (numerosos experimentos han demostrado que el trabajo del flujo gastado en vencer la fricción se convierte completamente en calor percibido por el flujo), la ley de conservación de la energía en termodinámica para 1 kg de una sustancia homogénea en funcionamiento (es decir, en valores específicos de masa ) en un proceso elemental se puede escribir:
![]() , (3.1)
, (3.1)
(Índice externo omitido por innecesario).
Cabe destacar que del lado derecho de (3.1) bajo el signo de la diferencial se encuentran funciones de estado, y el resto son cantidades que dependen de la naturaleza del proceso termodinámico. Dado que el trabajo y el calor son funciones de proceso y no funciones de estado, el signo δ denota solo el hecho de que en un proceso elemental las cantidades que le siguen son infinitesimales arbitrarias y no incrementos de ninguna función específica. Así, d q y d yo-cantidades elementales (es decir, correspondientes a cambios infinitesimales en el estado del sistema) de calor y trabajo.
Si el sistema termodinámico no cambia su posición en el espacio y el único tipo de trabajo es el trabajo asociado con un cambio en el volumen del sistema, entonces la ecuación (3.1) toma una forma más simple:
Trabajo δ yo sobre se realiza contra las fuerzas de la presión externa y, luego, el volumen del fluido de trabajo se expande o, por el contrario, el entorno externo realiza un trabajo sobre el cuerpo, comprimiéndolo. Para procesos de equilibrio, cuando la presión del medio es igual a la presión en el fluido de trabajo, este trabajo se calcula como Rdv, dónde v es el volumen específico de la sustancia de trabajo.
La ecuacion
llamó la primera ley de la termodinámica: el calor suministrado a un sistema termodinámico cerrado en reposo se gasta en cambiar la energía interna del sistema y en hacer trabajo para cambiar el volumen del sistema. La relación de equilibrio (3.2) también se llama lecturas en literatura teórica. 1. Barroco: ...
L. A. Eliseeva © Institución Presupuestaria del Estado Federal de Ciencias Biblioteca Pública Científica y Técnica del Estado de la Rama Siberiana de la Academia Rusa de Ciencias, 2013
PunteroPaseos aleatorios / A.N. Borodin, I. A. Ibragimov; bajo... 241. Dorogokupets P.I. Termodinámica minerales y equilibrios minerales ... catálogos: compendio conferencias en curso "Referencia ... estado técnico Universidad. Serie, Técnico Ciencias. - ...
N. V. Basova [y otros]; ed. N. V. Basova. Rostov n/d: Fénix, 2008
Libro de textoCurso) Escrito D. T. Sinopsis conferencias en matemáticas superiores [Texto]: ... Técnico termodinámica Rudobashta, S.P. Ingeniería térmica [Texto]: libro de texto para estudiantes. universidades estudiando en... 2008. - 204 págs. diez Borodin, I. F. Automatización de procesos tecnológicos...
Lista de trabajos científicos del Tesoro para el período 2008 - 1 de junio de 2013 (1)
Documento... "Métodos de investigación de rayos X" Conferencias en oncología clínica. Almaty... de la segunda ley termodinámica» 2-Internacional... y revisión de expertos técnico equipamiento de organizaciones de atención médica ... Académico de la Academia Rusa de Ciencias Médicas Yu.I. Borodin, Bishkek, 2009, pág. ...
En la práctica de la ingeniería, a menudo no se trata de gases homogéneos, sino de mezclas de gases químicamente no relacionados. Ejemplos de mezclas de gases son: aire atmosférico, gas natural, productos gaseosos de la combustión de combustibles, etc.
Para mezclas de gases, son válidas las siguientes disposiciones.
1. Cada gas que entra en la mezcla tiene una temperatura, igual a la temperatura mezclas
2. Cualquiera de los gases incluidos en la mezcla está repartido por todo el volumen de la mezcla y por tanto el volumen de cada gas es igual al volumen de la mezcla entera.
3. Cada uno de los gases incluidos en la mezcla obedece a su propia ecuación de estado.
4. La mezcla en su conjunto es como un gas nuevo y obedece a su propia ecuación de estado.
El estudio de las mezclas de gases se basa en la ley de Dalton, según la cual, a temperatura constante, la presión de la mezcla es igual a la suma de las presiones parciales de los gases incluidos en la mezcla:
donde p cm es la presión de la mezcla;
pi - presión parcial del i-ésimo gas incluido en la mezcla;
n es el número de gases incluidos en la mezcla.
La presión parcial es la presión que ejercerá el gas que entra en la mezcla si él solo ocupa todo el volumen de la mezcla a la misma temperatura.
Métodos para establecer mezclas de gases.
La composición de la mezcla de gases se puede especificar por fracciones de masa, volumen y mol.
fracciones de masa. La fracción de masa de cualquier gas incluido en la mezcla es la relación entre la masa de este gas y la masa de la mezcla.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ..........; m n \u003d M n / M cm,
donde m 1 , m 2 , ..., m n - fracciones de masa de gases;
M 1 , M 2 , ..., M n - masas de gases individuales;
M cm es la masa de la mezcla.
Es fácil ver eso  y
y  (100%).
(100%).
Acciones de volumen. La fracción de volumen de cualquier gas incluido en la mezcla es la relación entre el volumen reducido (parcial) de este gas y el volumen de la mezcla.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
donde V 1 , V 2 , ..., V n - volúmenes reducidos de gases;
V cm es el volumen de la mezcla;
r 1 , r 2 , ..., r n - fracciones volumétricas de gases.
El volumen reducido es el volumen de gas en las condiciones de la mezcla (a la temperatura y presión de la mezcla).
El volumen reducido se puede representar de la siguiente manera: si todos los gases excepto uno se eliminan del recipiente que contiene la mezcla y el gas restante se comprime a la presión de la mezcla mientras se mantiene la temperatura, entonces su volumen será reducido o parcial.
Se puede probar que el volumen de la mezcla será igual a la suma de los volúmenes reducidos de gases.
 (100%).
(100%).
Fracciones molares. La fracción molar de cualquier gas incluido en una mezcla es la relación entre el número de kilomoles de este gas y el número de kilomoles de la mezcla.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
donde r 1 , r 2 , ..., r n - fracciones molares de gases;
n cm es el número de kilomoles de la mezcla;
n 1 , n 2 , ..., n n es el número de kilomoles de gases.
Especificar una mezcla por fracciones molares es idéntico a especificar una mezcla por fracciones de volumen, es decir las fracciones molares y volumétricas tienen los mismos valores numéricos para cada gas incluido en la mezcla.
Constante de gas y peso molecular aparente (promedio) de la mezcla. Para calcular la constante de la mezcla de gases dada por fracciones de masa, escribimos las ecuaciones de estado:
para mezcla
p cm × V cm = M cm R cm T; (1.9)
para gases
 .
(1.10)
.
(1.10)
Sumamos las partes izquierda y derecha de las ecuaciones (1.10)
(pag 1 + pag 2 + .... + pag norte) V cm = (METRO 1 R 1 + METRO 2 R 2 + ..... + METRO norte R norte) T.
Porque  ,
,
entonces p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
Las ecuaciones (1.9) y (1.11) implican que
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
METRO 1 R 1 + metro 2 R 2 + ...... + metro norte R norte
o  ,
(1.12)
,
(1.12)
donde R cm es la constante de los gases de la mezcla.
Dado que la constante de gas del i-ésimo gas
R yo = 8314 / metro yo ,
entonces la ecuación (1.12) se reescribe como sigue:
 .
(1.13)
.
(1.13)
Al determinar los parámetros de una mezcla de gases, es conveniente utilizar un cierto valor condicional denominado peso molecular aparente (promedio) de la mezcla de gases. El concepto de peso molecular aparente de una mezcla nos permite considerar convencionalmente la mezcla como un gas homogéneo, lo que simplifica mucho los cálculos.
Para un gas separado, la expresión
Por analogía, para una mezcla, podemos escribir
m cm R cm = 8314, (1,14)
donde m cm es el peso molecular aparente de la mezcla.
De la ecuación (1.14), usando las expresiones (1.12) y (1.13), obtenemos
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Argumentando de esta manera, se pueden obtener fórmulas para calcular R cm y m cm a través de fracciones de volumen, fórmulas para convertir fracciones de masa en fracciones de volumen y, a la inversa, fracciones de volumen en fracciones de masa, fórmulas para calcular el volumen específico de una mezcla u cm y densidad de la mezcla r cm a través de fracciones másicas y volumétricas y, finalmente, fórmulas para el cálculo de las presiones parciales de los gases incluidos en la mezcla, a través de fracciones volumétricas y másicas. Presentamos estas fórmulas sin derivación en la tabla.
Fórmulas para calcular mezclas de gases
|
Ajuste de la composición de la mezcla. |
Pasar de una composición a otra |
Densidad y volumen específico de la mezcla. |
peso molecular aparente de la mezcla |
constante de mezcla de gases |
Presión parcial |
|
fracciones de masa |
|
|
|
|
|
|
fracciones de volumen |
|
|
|
|
|
Capacidad calorífica de los gases.
La capacidad calorífica de un cuerpo es la cantidad de calor requerida para calentar o enfriar el cuerpo en 1 K. La capacidad calorífica de una cantidad unitaria de una sustancia se llama capacidad calorífica específica.
Entonces, la capacidad calorífica específica de una sustancia es la cantidad de calor que se debe impartir o restar de una unidad de sustancia para cambiar su temperatura en 1 K en este proceso.
Dado que en lo que sigue sólo se considerarán las capacidades caloríficas específicas, nos referiremos a la capacidad calorífica específica simplemente como la capacidad calorífica.
La cantidad de gas se puede dar por masa, volumen y número de kilomoles. Cabe señalar que al establecer un volumen de gas, este volumen se lleva a condiciones normales y se mide en metros cúbicos normales (nm 3).
Dependiendo del método de ajuste de la cantidad de gas, se distinguen las siguientes capacidades caloríficas:
c - capacidad calorífica de masa, J / (kg × K);
c¢ - capacidad calorífica volumétrica, J / (nm 3 × K);
c m - capacidad calorífica molar, J / (kmol × K).
Entre estas capacidades caloríficas existen las siguientes relaciones:
c = c metro / metro; con m = con × m;
с¢ = с m / 22,4; con m = s¢ × 22,4,
de aquí  ; s¢ = s × r norte,
; s¢ = s × r norte,
donde u n y r n - volumen y densidad específicos en condiciones normales.
Capacidades caloríficas isocóricas e isobáricas
La cantidad de calor impartida al fluido de trabajo depende de las características del proceso termodinámico. Dos tipos de capacidad calorífica son de importancia práctica dependiendo del proceso termodinámico: isocórica e isobárica.
La capacidad calorífica en u = const es isocórica.
c u - capacidad calorífica isocórica de masa,
do¢ tu es la capacidad calorífica volumétrica isocórica,
cm tu es la capacidad calorífica isocórica molar.
La capacidad calorífica en p = const es isobárica.
c p - capacidad calorífica isobárica de masa,
c¢ р - capacidad calorífica isobárica volumétrica,
c m p - capacidad calorífica isobárica molar.
Con el mismo cambio de temperatura en el proceso realizado a p = const, se consume más calor que en el proceso a u = const. Esto se explica por el hecho de que en u = const el calor impartido al cuerpo se gasta solo en cambiar su energía interna, mientras que en p = const el calor se gasta tanto en aumentar la energía interna como en realizar el trabajo de expansión. La diferencia entre las capacidades caloríficas de masa isobárica e isocórica de masa según la ecuación de Mayer
c p - c tu=R. (1.17)
Si los lados izquierdo y derecho de la ecuación (1.17) se multiplican por la masa en kilomol m, entonces obtenemos
c m p - c m tu= 8314 J/(kmol×K) (1.18)
En la termodinámica y sus aplicaciones, la relación de las capacidades caloríficas isobáricas e isocóricas es de gran importancia:
 ,
(1.19)
,
(1.19)
donde k es el exponente adiabático.
Los cálculos muestran que para gases monoatómicos k » 1.67, gases diatómicos k » 1.4 y gases triatómicos k » 1.29.
Es fácil ver que el valor a dependiente de la temperatura. De hecho, de las ecuaciones (1.17) y (1.19) se sigue que
 ,
(1.20)
,
(1.20)
y de las ecuaciones (1.18) y (1.19)
 .
(1.21)
.
(1.21)
Dado que las capacidades caloríficas aumentan al aumentar la temperatura del gas, el valor de k disminuye, acercándose a la unidad, pero siempre permanece mayor que ella.
Conociendo el valor de k, se puede determinar el valor de la capacidad calorífica correspondiente. Entonces, por ejemplo, de la ecuación (1.20) tenemos
 ,
(1.22)
,
(1.22)
y desde con p = k × s tu, entonces obtenemos
 .
(1.23)
.
(1.23)
De manera similar, para las capacidades caloríficas molares, de la ecuación (1.21) obtenemos
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Capacidad calorífica media y verdadera
La capacidad calorífica de los gases depende de la temperatura y, en cierta medida, de la presión. La dependencia de la capacidad calorífica de la presión es pequeña y se desprecia en la mayoría de los cálculos. La dependencia de la capacidad calorífica de la temperatura es significativa y debe tenerse en cuenta. Esta dependencia se expresa con bastante precisión mediante la ecuación
c = un + en t + et 2 , (1.26)
donde un, en ye son valores que son constantes para un gas dado.
A menudo, en los cálculos de ingeniería térmica, la dependencia no lineal (1.26) se reemplaza por una lineal:
c = un + en t. (1.27)
|
Si construimos gráficamente la dependencia de la capacidad calorífica de la temperatura de acuerdo con la ecuación (1.26), entonces esta será una dependencia curvilínea (Fig. 1.4). Como se muestra en la figura, cada valor de temperatura tiene su propio valor de capacidad calorífica, que comúnmente se denomina capacidad calorífica verdadera. Matemáticamente, la expresión de la capacidad calorífica verdadera se escribe de la siguiente manera:
|
|
|
|
Por lo tanto, la verdadera capacidad calorífica es la relación entre una cantidad infinitesimal de calor dq y un cambio infinitesimal de temperatura dt. En otras palabras, la verdadera capacidad calorífica es la capacidad calorífica del gas a una temperatura dada. En la fig. 1.4, la capacidad calorífica real a una temperatura t 1 se indica con t1 y se representa como un segmento 1-4, a una temperatura t 2 - con t2 y se representa como un segmento 2-3. De la ecuación (1.28) obtenemos dq=cdt. (1.29) En los cálculos prácticos, siempre determinamos la cantidad de calor en el cambio final |
la temperatura. Es obvio que la cantidad de calor q, que se expresa como una unidad de cantidad de una sustancia cuando se calienta de t 1 a t 2, se puede encontrar integrando (1.29) de t 1 a t 2.
 .
(1.30)
.
(1.30)
Gráficamente, la integral (1.30) se expresa por el área 4-1-2-3. Si en la expresión (1.30) sustituimos el valor de la capacidad calorífica verdadera según la dependencia lineal (1.27), entonces obtenemos
 (1.31)
(1.31)
dónde  - capacidad calorífica promedio en el rango de temperatura de t 1 a t 2.
- capacidad calorífica promedio en el rango de temperatura de t 1 a t 2.
 ,
(1.32)
,
(1.32)
Por lo tanto, la capacidad calorífica promedio es la relación entre la cantidad final de calor q y el cambio de temperatura final t 2 - t 1:
 .
(1.33)
.
(1.33)
Si, sobre la base de 4-3 (Fig. 1.4), se construye un rectángulo 4-1¢-2¢-3, del mismo tamaño que la figura 4-1-2-3, entonces la altura de este rectángulo será ser igual a la capacidad calorífica promedio, donde  está en el rango de temperatura t 1 - t 2 .
está en el rango de temperatura t 1 - t 2 .
Por lo general, los valores de las capacidades caloríficas promedio se dan en las tablas de propiedades termodinámicas de las sustancias. Sin embargo, para reducir el volumen de estas tablas, proporcionan los valores de las capacidades caloríficas promedio determinadas en el rango de temperatura de 0 ° C a t ° C.
Si es necesario calcular el valor de la capacidad calorífica promedio en un rango de temperatura dado t 1 - t 2, entonces esto se puede hacer de la siguiente manera.
El área 0a14 bajo la curva c \u003d f (t) (Fig. 1.4) corresponde a la cantidad de calor q 1 requerida para aumentar la temperatura del gas de 0 ° C a t 1 ° C.

De manera similar, el área 0a23 corresponde a q 2 cuando la temperatura sube de 0 o C a t 2 o C:

Por lo tanto, q \u003d q 2 - q 1 (área 4123) se puede representar como
![]() (1.34)
(1.34)
Sustituyendo el valor de q según (1.34) en la expresión (1.33), obtenemos la fórmula para la capacidad calorífica promedio en cualquier rango de temperatura:
 .
(1.35)
.
(1.35)
Por lo tanto, la capacidad calorífica promedio se puede calcular a partir de las capacidades caloríficas promedio tabulares utilizando la ecuación (1.35). Además, obtenemos una dependencia no lineal c = f(t). También puede encontrar la capacidad calorífica promedio usando la ecuación (1.32) usando una relación lineal. Valores a y en en la ecuación (1.32) para varios gases se dan en la literatura.
La cantidad de calor suministrado o eliminado del fluido de trabajo se puede calcular utilizando cualquiera de las ecuaciones:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
dónde 

 - respectivamente, la capacidad calorífica media másica, volumétrica y molar; M es la masa de gas; n es el número de kilomoles de gas; V n - el volumen de gas en condiciones normales.
- respectivamente, la capacidad calorífica media másica, volumétrica y molar; M es la masa de gas; n es el número de kilomoles de gas; V n - el volumen de gas en condiciones normales.
El volumen de gas V n se puede encontrar de la siguiente manera. Habiendo escrito la ecuación de estado para las condiciones dadas: pV = MRT y para condiciones normales: p n V n = MRT n, atribuimos la segunda ecuación a la primera:
 ,
,
de aquí  .
(1.39)
.
(1.39)
Capacidad calorífica de las mezclas de gases.
La capacidad calorífica de una mezcla de gases se puede calcular si se da la composición de la mezcla y se conocen las capacidades caloríficas de los componentes incluidos en la mezcla.
Para calentar una mezcla de masa M cm en 1 K, la temperatura de cada uno de los componentes también debe aumentarse en 1 K. Al mismo tiempo, la cantidad de calor igual a c i M i se gasta en calentar el i-ésimo componente de la mezcla con masa М i . Para toda la mezcla, la cantidad de calor  ,
,
donde c i y c cm son las capacidades caloríficas másicas del i-ésimo componente y la mezcla.
Dividiendo la última expresión por M cm, obtenemos la fórmula de cálculo de la capacidad calorífica másica de la mezcla:
 ,
(1.40)
,
(1.40)
donde m i es la fracción de masa del i-ésimo componente.
Argumentando de manera similar, encontramos la capacidad calorífica volumétrica c¢ cm y la capacidad calorífica molar c m cm de la mezcla:
 (1.41)
(1.41)
donde c¢ i - capacidad calorífica volumétrica del i-ésimo componente, r i - fracción de volumen del i-ésimo componente,
 ,
(1.42)
,
(1.42)
donde c m i es la capacidad calorífica molar del i-ésimo componente,
r i - fracción molar (volumen) del i-ésimo componente.
En los motores térmicos (máquinas), el fluido de trabajo es una mezcla de varios gases. Si los componentes de la mezcla no entran en reacciones químicas entre sí, y cada componente obedece a la ecuación de estado de Claiperon, entonces dicha mezcla se considera un gas ideal.
Para calcular la mezcla, es necesario determinar μ cm, la masa molar promedio y R cm, la constante de gas específica de la mezcla. Para determinarlos, es necesario conocer la composición de la mezcla, es decir, qué componentes y en qué cantidades forman esta mezcla, qué parámetros tiene cada componente incluido en la mezcla.
Cada componente de la mezcla se comporta como si no hubiera otros gases en la mezcla, ocupa todo el volumen disponible en el que se encuentra la mezcla, sigue su propia ecuación de estado y ejerce su llamada presión parcial sobre las paredes, mientras que la temperatura de todos los componentes de la mezcla es el mismo e igual a la temperatura de la mezcla.
Según la ley de Dalton, la presión de la mezcla P es igual a la suma de las presiones parciales de los componentes individuales incluidos en la mezcla:
donde n es el número de componentes de la mezcla.
De acuerdo con la ley de Amag, el volumen de la mezcla V es igual a la suma de los volúmenes parciales de los componentes individuales incluidos en la mezcla a la temperatura y presión de la mezcla:
 , (1.21)
, (1.21)
donde - volumen parcial, m 3; V- volumen de la mezcla, m 3
La composición de la mezcla viene dada por fracciones de volumen (molar) o de masa.
Fracción de volumen de la i-ésima componente es la relación entre el volumen parcial del componente y el volumen de la mezcla, es decir, entonces la suma de las fracciones de volumen de los componentes de la mezcla es 1, es decir, . Si el valor se da en %, entonces su suma = 100%.
Fracción molar de la i-ésima componente n i es la relación entre el número de kilomoles del componente N i y el número de kilomoles de la mezcla N, es decir, donde ![]() , , es decir, el número de kilomoles de cada componente y la mezcla como un todo es igual a la relación del componente correspondiente y la mezcla como un todo al volumen ocupado por un kilomol.
, , es decir, el número de kilomoles de cada componente y la mezcla como un todo es igual a la relación del componente correspondiente y la mezcla como un todo al volumen ocupado por un kilomol.
Teniendo en cuenta que un gas ideal en las mismas condiciones tiene el mismo volumen de kilomoles, luego de la sustitución obtenemos:, es decir, para gases ideales, las fracciones molar y de volumen son numéricamente iguales.
Fracción de masa de la i-ésima componente es la relación entre la masa del componente y la masa de la mezcla: , se deduce que la masa de la mezcla es igual a la suma de las masas de los componentes, y también la suma de las fracciones de masa de los componentes es igual a 1 (o 100%).
La conversión de fracciones de volumen a fracciones de masa y viceversa se basa en las siguientes proporciones:
![]() ,
,
donde ρ = μ / 22.4, kg / m 3.
De donde se sigue que la fracción de masa de la i-ésima componente se determinará a partir de la relación:
 ,
,
donde está la densidad de la mezcla, kg / m 3, es la fracción de volumen del i-ésimo componente.
En el futuro, se puede determinar a través de fracciones de volumen.
 .
.
Densidad mezclas para fracciones de volumen se determina a partir de la relación
 , dónde
, dónde  , (1.22)
, (1.22)
 .
.
La presión parcial está determinada por las fórmulas:
![]() o
o  (1.23)
(1.23)
Las ecuaciones de estado de los componentes y de la mezcla en su conjunto tienen la forma:
![]() ;
;
![]() ,
,
de donde, después de transformaciones, obtenemos para masivo Comparte
 ,
,  . (1.24)
. (1.24)
Densidad y volumen específico de la mezcla para masivo Cuota:
;  . (1.25)
. (1.25)
Para calcular las presiones parciales se utiliza la fórmula:
 . (1.26)
. (1.26)
La conversión de fracciones de masa en fracciones de volumen se lleva a cabo de acuerdo con la fórmula:
 .
.
Al determinar la capacidad calorífica de una mezcla de gases, se supone que para calentar (enfriar) una mezcla de gases, es necesario calentar (enfriar) cada uno de los componentes de la mezcla
donde Q i =M i c i ∆t es el calor gastado en cambiar la temperatura del i-ésimo componente de la mezcla, c i es la capacidad calorífica másica del i-ésimo componente de la mezcla.
La capacidad calorífica de la mezcla se determina a partir de la relación (si la mezcla está dada por fracciones de masa)
 , similar
, similar  . (1.28)
. (1.28)
Las capacidades caloríficas molares y volumétricas para una mezcla dadas por fracciones de volumen están determinadas por
 ;
;  ;
;
 ;
; 
Ejemplo 1.5 El aire seco en masa consiste en g O2 \u003d 23,3% de oxígeno y g N 2 \u003d 76,6% de nitrógeno. Determine la composición del aire por volumen (r O2 yr N 2) y la constante de gas de la mezcla.
Solución.
1. De la Tabla 1 encontramos kg/kmol y kg/kmol
2. Determinar las fracciones de volumen de oxígeno y nitrógeno:
1. La constante de gas del aire (mezcla) está determinada por la fórmula:
 , J/kg K
, J/kg K
Ejemplo 1.6. Determine la cantidad de calor requerida para calentar una mezcla de gases con una masa de M = 2 kg en P = const, que consiste en % en peso: , , , , cuando la temperatura cambia de t 1 = 900 ° C a t 2 = 1200 °C
Solución:
1. Determine la capacidad calorífica másica promedio de los componentes que forman la mezcla de gases en P=const y t 1 =900 o C (de P2):
1,0258 kJ/kg K; =1,1045 kJ/kg K;
1,1078 kJ/kg K; =2,1097 kJ/kg K;
2. Determinamos la capacidad calorífica másica promedio de los componentes que forman la mezcla de gases en P=const y t 1 =1200 o C (de P2):
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kg K; =2,2106 kJ/kg K;
3. Determinamos la capacidad calorífica de masa promedio de la mezcla para el rango de temperatura: t 2 \u003d 1200 ° C y t 1 \u003d 900 ° C:
4. La cantidad de calor para calentar 2 kg de la mezcla a P=const:
Primera ley de la termodinámica establece una relación cuantitativa entre el cambio en la energía interna del sistema y el trabajo mecánico realizado contra las fuerzas de presión externa del ambiente como resultado del suministro de calor al fluido de trabajo.
Para un sistema termodinámico cerrado, la ecuación de la primera ley tiene la forma
El calor impartido al fluido (o sistema) de trabajo se usa para aumentar su energía interna (dU) debido a un aumento en la temperatura corporal, y para realizar un trabajo externo (dL) debido a la expansión del fluido de trabajo y un aumento en su volumen.
La primera ley se puede escribir como dH=dq+VdP=dq-dL 0 ,
donde dL 0 \u003d VdP: el trabajo elemental de cambio de presión se denomina trabajo externo útil (técnico).
dU es el cambio en la energía interna del fluido de trabajo (sistema), que incluye la energía del movimiento térmico de las moléculas (traslación, rotación y vibración) y la energía potencial de la interacción de las moléculas.
Dado que la transición del sistema de un estado a otro ocurre como resultado del suministro de calor, el fluido de trabajo se calienta y su temperatura aumenta en dT y el volumen aumenta en dV.
Un aumento de la temperatura corporal provoca un aumento de la energía cinética de sus partículas, y un aumento del volumen corporal provoca un cambio en la energía potencial de las partículas. Como resultado, la energía interna del cuerpo aumenta en dU, por lo que la energía interna U es una función del estado del cuerpo y puede representarse como una función de dos parámetros independientes U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T). El cambio en la energía interna en un proceso termodinámico está determinado solo por los estados inicial (U 1) y final (U 2), es decir
En forma diferencial, el cambio de energía interna se escribe
a) en función del volumen específico y la temperatura

b) en función de la temperatura, ya que , después
Para cálculos prácticos, en los que es necesario tener en cuenta el cambio de C v con la temperatura, existen fórmulas empíricas y tablas de energía interna específica (a menudo molar). Para gases ideales, la energía interna molar de la mezcla U m está determinada por la fórmula
 , J/kmol
, J/kmol
Para una mezcla dada por fracciones de masa. De este modo energía interna hay propiedad del sistema y caracteriza el estado del sistema.
entalpía es la función de estado térmico introducida por Kamerling-Onnes, (ganador premio Nobel, 1913), que es la suma de la energía interna del sistema U y el producto de la presión del sistema P y su volumen V.
Dado que las cantidades incluidas en él son funciones de estado, por lo tanto, H también es una función de estado, es decir, H \u003d f 1 (P, V); H=f2 (V,T); H=f3 (P, T).
El cambio en la entalpía dH en cualquier proceso termodinámico está determinado por los estados inicial H 1 y final H 2 y no depende de la naturaleza del proceso. Si el sistema contiene 1 kg de una sustancia, entonces se aplica la entalpía específica, J/kg.
Para un gas ideal, la ecuación diferencial tiene la forma
en consecuencia, la entalpía específica está determinada por la fórmula
La ecuación de la primera ley de la termodinámica es dq=dU+Pdυ, cuando el único tipo de trabajo es el trabajo de expansión Pdυ=d(Pυ)-υdP, entonces dq=d(U+Pυ)-υdP, de donde
Trabajo practico№ 2
Tema: Capacidad calorífica, entalpía, mezclas de gases ideales, energía interna, trabajo, procesos termodinámicos.
El propósito del trabajo: consolidación de los conocimientos adquiridos durante la formación teórica, adquisición de habilidades en la implementación de cálculos de ingeniería térmica.
YO. Definiciones básicas, fórmulas y ecuaciones
1. Mezclas de gases ideales
Una mezcla de gases es una mezcla mecánica de varios gases que no interactúan químicamente entre sí. Cada uno de los gases de la mezcla se denomina componente gaseoso; se comporta como si no hubiera otros gases en la mezcla, es decir distribuida uniformemente por toda la mezcla. La presión que ejerce cada gas de la mezcla sobre las paredes del recipiente se denomina presión parcial. La ley básica para las mezclas de gases ideales es la ley de Dalton, según la cual la presión de la mezcla es igual a la suma de las presiones parciales de los gases que la forman:
2. Energía interna
La energía interna del cuerpo es una combinación de la energía cinética del movimiento de las micropartículas que componen el cuerpo, y su energía potencial. interacción definida. fuerzas de atracción o repulsión mutua. Es imposible determinar el valor absoluto de la energía interna, por lo tanto, en los cálculos termodinámicos, no es el valor absoluto de la energía interna lo que se calcula, sino su cambio, es decir
![]() o
o ![]()
donde U 1 y U 2 - la energía interna del estado inicial y final del fluido de trabajo (gas);
u 1 y y 2 - latidos. energía interna del estado inicial y final del fluido de trabajo.
De esto se deduce que el cambio en la energía interna no depende de la naturaleza y el camino del proceso, sino que está determinado por el estado del fluido de trabajo al principio y al final del proceso de cambio.
Una característica de un gas ideal es la ausencia de fuerzas de interacciones moleculares en él y, por lo tanto, la ausencia de energía potencial interna, es decir. U n \u003d 0 y U „ \u003d 0. Por lo tanto, la energía interna de un gas ideal:
U=U k =f(T) unu u=uk =f(T).
H. Trabajo de gas.
En termodinámica, cualquier cambio en el estado del fluido de trabajo como resultado del intercambio de energía con ambiente llamado proceso. En este caso, se cambian los parámetros principales del cuerpo de trabajo:
La transformación de calor en trabajo mecánico está asociada con el proceso de cambio de estado del fluido de trabajo. Los procesos de cambio de estado de un gas pueden ser procesos de expansión y contracción. Para una masa arbitraria de gas M (kg), el trabajo es igual a:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
donde l \u003d p (v 2 -v 1) J / kg es el trabajo de 1 kg de gas o trabajo específico.
4. Entalpía de gas,
La entalpía es un parámetro que caracteriza la energía potencial de la conexión del fluido de trabajo (gas) con el medio ambiente. Entalpía y entalpía específica:
I \u003d U + pV, J y yo i \u003d y + pv, J / kg.
5. Capacidad calorífica.
La capacidad calorífica específica es la cantidad de calor que debe suministrarse a 1 kg de gas para calentarlo 1 ° C en un rango de temperatura dado.
La capacidad calorífica específica es másica, volumétrica y kilomol. Existe una conexión entre la masa C, el volumen C y las capacidades caloríficas en kilomol C:
 ;
; 
donde Vo 22,4 m 3 / kmol - late. volumen de gas en condiciones normales.
Misa ud. capacidad calorífica de la mezcla de gases:

Volumétrico calor especifico mezcla de gases:

Calor específico kilomolar de la mezcla de gases:

6. Ecuación para determinar la cantidad de calor.
La cantidad de calor emitido o absorbido por el fluido de trabajo (gas) se puede determinar mediante la ecuación:
Q \u003d M C m (t 2 -t 1), J o Q \u003d VC (t-t), J, donde M y V son la cantidad de gas en peso o volumen, kg o m 3;
t u t - temperatura del gas al final y al comienzo del proceso ° С;
C y C - latidos promedio de masa y volumen. capacidad calorifica del gas
En t cp \u003d J / kgK o J / m 3 K
7. Primera ley de la termodinámica
Esta ley considera las interconversiones de calor y trabajo mecánico. Según esta ley, el calor se convierte en trabajo mecánico y viceversa, el trabajo mecánico en calor en cantidades estrictamente equivalentes. La ecuación de equivalencia de calor y trabajo tiene la forma:
Teniendo en cuenta el principio de equivalencia de calor y trabajo, la ecuación de balance de calor para una masa arbitraria de gas:
Q \u003d U + L y q \u003d u + l \u003d u -u + l
resolución de problemasYo
Tarea #1 (#1)
El aire seco atmosférico tiene la siguiente composición de masa aproximada: g 02 = 23,2 %, g N 2 = 76,8 %.
Determine la composición volumétrica del aire, su constante de gas, peso molecular aparente, presión parcial de oxígeno y nitrógeno, si el aire es P = 101325 Pa utilizando un barómetro.
Determino la composición volumétrica del aire:
 ;
; ;
;
donde r es la fracción de masa;
m es el peso molecular relativo;
g es la fracción de volumen.
m aire =m O2 r O2 +m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
donde R 0 es la constante de los gases.
Determino las presiones parciales de varios gases:
P O 2 \u003d P cm r O2 \u003d 101325 0.209 \u003d 21176.9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0.7908 \u003d 80127.81 (Pa);
donde P O 2 , P N 2 - presión parcial;
Pcm es la presión de la mezcla.
Tarea #2 (#2)
El recipiente está dividido por un tabique en 2 partes, cuyos volúmenes son V 1 = 1,5 m 3 y V 2 = 1,0 m 3 . La primera parte del volumen V 1 contiene CO 2 a P 1 =0,5 MPa y t 1 =30°C; la segunda parte del volumen V 2 contiene O 2 a P 2 =0.2 MPa y t 2 =57°C. Determine las fracciones de masa y volumen de CO 2 y O 2, el peso molecular aparente de la mezcla y su constante de gas después de que se retira la partición y se completa el proceso de mezclado.
Determino las constantes de gas individuales:
Para hacer esto, determino el peso molecular relativo: m (CO 2) \u003d 32 + 12 \u003d 44; m(O2)=32;

 ;
;
![]()
 ;
;
Según la ecuación característica de Klaiperon, determino las masas de los gases:
 (kg);
(kg);
 (kg);
(kg);
Determino las fracciones de masa:


Determino las fracciones de volumen:


Determine el peso molecular aparente del aire:
m aire \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0.21 + 44 0.79 \u003d 6.72 + 34.74 \u003d 41.48;
Determino la constante de gas individual para el aire (R):

 ;
;
Tarea #3 (#6)
En un recipiente con un volumen de 300 l hay oxígeno a una presión P 1 \u003d 0.2 MPa y t 1 \u003d 20 0 C. ¿Cuánto calor se debe suministrar para que la temperatura del oxígeno aumente a t 2 \u003d 300 0 C? ? ¿Qué presión se establecerá en el recipiente? Para el cálculo, tome el calor específico volumétrico promedio del oxígeno en n.o. C 02 \u003d 0.935 
De acuerdo con la ley de Charles, determino la presión final del proceso:
;  (Pensilvania);
(Pensilvania);
donde P, T son parámetros de gas.
Determino la constante de gas individual para el oxígeno (R):

 ;
;
Dado que el proceso es isocórico, determino la cantidad de calor que debe suministrarse de acuerdo con la fórmula apropiada: Q v \u003d M C cv (T 2 -T 1) para esto, de acuerdo con la ecuación característica de Claiperon, determino la masa de gasolina
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1.27 935 280 \u003d 332486 (J).
Tarea #4 (#7)
¿Cuánto calor se debe gastar para calentar 2m 3 de aire a una sobrepresión constante P ex. \u003d 0.2 MPa desde una temperatura de 100 0 C hasta una temperatura de 500 0 C. ¿Qué trabajo hará el aire en este caso? Para el cálculo, tome: presión atmosférica P at. \u003d 0.1 MPa, capacidad calorífica isobárica de masa promedio del aire C pm \u003d 1.022  ; calcule la constante de los gases teniendo en cuenta que el peso molecular aparente del aire M aire. =29.
; calcule la constante de los gases teniendo en cuenta que el peso molecular aparente del aire M aire. =29.
Determino la constante de gas individual para el aire:

 ;
;
La presión absoluta es igual a la suma del exceso y la atmosférica P=P est. + P en. =0,1+0,2=0,3MPa
 (kg);
(kg);
Como el proceso es isobárico, determino Q y L según las fórmulas correspondientes:
de acuerdo con la ley de Gay-Lussac, determino el volumen final:
 m3;
m3;
Q \u003d M C pm (T 2 -T 1) \u003d 5.56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2.15 \u003d 645000 (J).
Tarea #5 (#8)
Hay aire en el cilindro a una presión P=0.5 MPa y una temperatura t 1 =400 0 C. Se extrae calor del aire a P=const de modo que al final del proceso la temperatura t 2 =0 0 C es establecer El volumen del cilindro en el que se encuentra el aire V 1 \u003d 400l.
Determine la cantidad de calor removido, el volumen final, el cambio en energía interna y el trabajo perfecto de compresión C pm =1.028  .
.
Como el proceso es isobárico, entonces de acuerdo con la ley de Gay-Lussac determino el volumen final:
 m3;
m3;
De acuerdo con la ecuación característica de Klaiperon, determino la masa de gas:
Del problema anterior R=286.7 
 (kg);
(kg);
Determino la cantidad de calor que se libera:
Q=MC pm (T2-T1)=1,03 1028 (273-673)=-423536 (J);
Determino la cantidad de trabajo gastado:
L=P (V 2 -V 1)= 500.000 (0,16-0,4)=-120.000 (J);
A partir de la ecuación por la cual se determina la cantidad total, determino el cambio en la cantidad de energía interna:
![]() ; (J)
; (J)
Problema #6 (#9)
Aire que tiene un volumen V 1 = 0.02 m3 a una presión P 1 = 1.1 MPa y t 1 = 25 s se expande en un cilindro con un pistón móvil a una presión P 2 = 0.11 MPa. Encuentre el volumen final V 2, la temperatura final t 2 , el trabajo realizado por el aire y el calor suministrado, si ocurre la expansión en el cilindro:
a) isotérmicamente
b) adiabáticamente con exponente adiabático k=1.4
c) politrópico con índice politrópico n=1.3
Proceso isotérmico:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0.02 1.1 / 0.11 \u003d 0.2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000J
proceso adiabático:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0.02 / (0.11 / 1.1) 1 / 1.4 \u003d 0.1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0.11 / 1.1) 1.4-1 / 1.4 298 \u003d 20.32k
C v \u003d 727.4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1.4-1) (1.1 10 6 0.02 -0.11 10 6 0, 1)=2.0275 10 6 J
Proceso politrópico:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0.02 / (0.11 / 1.1) 1 / 1.3 \u003d 0.118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0.11 / 1.1) 1.3-1 / 1.3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1.3-1)) (1.1 10 6 0.02 -0.11 10 6 0.118)=30000J
Q=(k-n/k-1) l M=((1.4-1.3)/(1.4-1)) 30000=7500J
Literatura:
1. Energía, Moscú, 1975.
2. Litvin A.M. "Fundamentos teóricos de la ingeniería térmica", editorial "Energía", Moscú, 1969.
3. Tugunov P.I., Samsonov A.A., "Fundamentos de ingeniería térmica, motores térmicos e instalaciones de energía de vapor", editorial Nedra, Moscú, 1970.
4. Krutov V.I., "Ingeniería térmica", editorial "Ingeniería", Moscú, 1986.
Mezclas de gases. Capacidad calorífica de los gases.
Las mezclas de gases se entienden como una mezcla mecánica de varios gases que no interactúan químicamente entre sí. Una mezcla de gases ideales obedece todas las leyes relativas a gases ideales. La composición de la mezcla de gases viene determinada por la cantidad de cada uno de los gases incluidos en la mezcla, y puede especificarse por fracciones másicas o volumétricas:
donde es la masa del -ésimo componente, es el volumen del -ésimo componente y y son la masa y el volumen de toda la mezcla, respectivamente.
Es obvio que
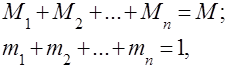
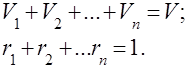
Para facilitar la resolución de problemas prácticos con mezclas de gases, se introduce el concepto de peso molecular aparente de una mezcla de gases, que es la masa promedio de los pesos moleculares reales de los componentes individuales de la mezcla.
La ecuación de estado de una mezcla de gases tiene la forma:
Las mezclas de gases están sujetas al concepto de la constante universal de los gases.
La relación entre la presión de una mezcla de gases y la presión parcial de los componentes individuales incluidos en la mezcla se establece mediante la ley de Dalton:
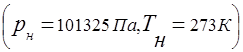
1 gas tiene una masa diferente dependiendo de la presión y la temperatura. En este sentido, la capacidad calorífica volumétrica siempre se refiere a la masa de gas encerrada en 1 en condiciones normales. En este caso, el volumen de 1 kmol de varios gases es 22,4 / kmol, y la constante universal de los gases es . Dependiendo del método de suministro de calor al gas, existen capacidades caloríficas isobáricas e isocóricas. La relación de estas cantidades se llama exponente adiabático.
Las capacidades caloríficas y también están relacionadas por la relación de Mayer
La cantidad de calor que debe gastarse en el proceso de calentamiento de 1 kg de gas en el rango de temperatura de a está determinada por la fórmula:
donde y son, respectivamente, las capacidades caloríficas promedio dentro de 0°- y 0°-.
Si (kg) o () gas está involucrado en el proceso, entonces
La capacidad calorífica de la mezcla de gases debe determinarse mediante las fórmulas:
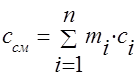
masa - ;
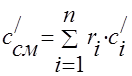
volumétrico -;
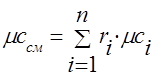
muela - .
Para aprovechar el calor de los gases que son productos de la combustión del combustible en la unidad de caldera, se instalan aerotermos del aire necesario para la combustión del combustible en los conductos de gas de esta última (Fig. 1). Los gases que salen de la caldera ingresan al calentador de aire con una temperatura y se enfrían, cediendo calor al aire, hasta. En el conducto de gas de la unidad de caldera, bajo la influencia del funcionamiento del extractor de humo, se establece una presión ligeramente inferior a la atmosférica. El aire en el calentador de aire se calienta de temperatura a temperatura.
gases de combustión
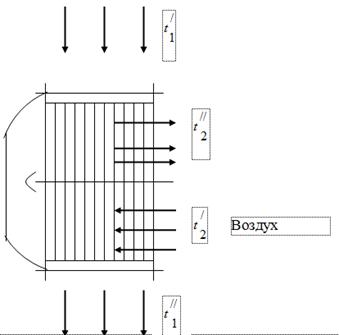
Al probar la unidad de caldera, se obtuvieron los siguientes datos:
La temperatura de los gases a la entrada del calentador de aire, = 450 °C.
La temperatura de los gases a la salida del calentador de aire, = 150°C.
Temperatura del aire a la entrada del calentador de aire, = 26 °C.
Temperatura del aire a la salida del calentador de aire, = 260 °C.
Composición volumétrica de los gases de combustión - = 11,5%; = 6,5%; = 17,2%; = 64,8%
El consumo horario de gases a es de 50 ·/h.
Vacío en el conducto de gas - 15 mm de agua. Arte.
Presión barométrica 760 mm Hg. Arte.
Definir:
peso molecular aparente de los gases de combustión;
constante de gas de los gases de combustión;
fracciones de peso (masa) de los componentes individuales que componen los gases de combustión;
presiones parciales de los componentes:
flujo de aire por hora.
Suponga que todo el calor que desprende el gas es absorbido por el aire.
La dependencia de la capacidad calorífica con la temperatura se considera curvilínea.
1. Peso molecular aparente de los gases de combustión
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Constante de gas de los gases de combustión
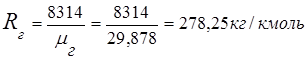
3. fracciones de masa componentes de gas
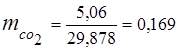
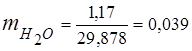
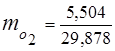
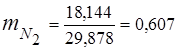
4. Presiones parciales de los componentes
Los resultados del cálculo se ingresarán en la tabla.
|
Opciones |
mezcla de gases |
|||
|
|
||||
|
|
||||
|
|
5. Consumo de aire por hora
El consumo de aire se determina a partir de la ecuación de balance de calor del calentador de aire
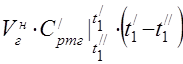
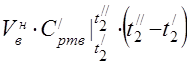
capacidad calorífica molar media a 450 °C
La capacidad calorífica específica promedio de los componentes en el rango de temperatura 0 ... 450 ° C.













 .
(1.28)
.
(1.28)