يتم قياس كمية الحرارة في نظام SI. طرق ووسائل قياس كمية الحرارة
الحرارة- الطاقة المنقولة من جسم أكثر سخونة إلى جسم أقل سخونة عن طريق الاتصال المباشر أو الإشعاع.
درجة الحرارة هي مقياس لشدة الحركة الجزيئية.
تعتمد كمية الحرارة التي يمتلكها الجسم عند درجة حرارة معينة على كتلته ؛ على سبيل المثال ، عند نفس درجة الحرارة ، يتم احتواء قدر أكبر من الحرارة في كوب كبير من الماء مقارنة بكوب صغير ، وفي دلو من الماء البارد يمكن أن يكون أكثر من كوب ماء ماء ساخن(على الرغم من أن درجة حرارة الماء في الدلو أقل).
تلعب الحرارة دورًا مهمًا في حياة الإنسان ، بما في ذلك أداء جسده. يتم تحويل جزء من الطاقة الكيميائية الموجودة في الطعام إلى حرارة ، مما يؤدي إلى الحفاظ على درجة حرارة الجسم بالقرب من 37 درجة مئوية. يعتمد التوازن الحراري لجسم الإنسان أيضًا على درجة الحرارة. بيئةويضطر الناس إلى إنفاق الكثير من الطاقة على تدفئة المباني السكنية والصناعية في الشتاء وتبريدها في الصيف. يتم توفير معظم هذه الطاقة من خلال المحركات الحرارية ، مثل محطات الغلايات والتوربينات البخارية لمحطات الطاقة التي تعمل بالوقود الأحفوري (الفحم والنفط) وتوليد الكهرباء.
حتى نهاية القرن الثامن عشر. تعتبر الحرارة مادة مادية ، معتقدين أن درجة حرارة الجسم تتحدد بكمية<калорической жидкости>، أو<теплорода>. لاحقًا ، دحض ب.<калорическую>نظرية ، تثبت أن الحرارة عديمة الوزن ويمكن الحصول عليها بأي كمية ببساطة بسبب الحركة الميكانيكية. الحرارة في حد ذاتها ليست مادة - إنها مجرد طاقة حركة ذراتها أو جزيئاتها. هذا هو فهم الحرارة الذي تلتزم به الفيزياء الحديثة.
في هذه المقالة ، سوف ننظر في كيفية ارتباط الحرارة ودرجة الحرارة وكيف يتم قياس هذه الكميات. سيكون موضوع مناقشتنا أيضًا الأسئلة التالية: انتقال الحرارة من جزء من الجسم إلى جزء آخر ؛ انتقال الحرارة في الفراغ (مساحة لا تحتوي على مادة) ؛ دور الحرارة في العالم الحديث.
الحرارة ودرجة الحرارة
لا يمكن تحديد كمية الطاقة الحرارية في مادة ما من خلال مراقبة حركة كل جزيء من جزيئاتها على حدة. على العكس من ذلك ، فقط من خلال دراسة الخصائص العيانية للمادة ، يمكن للمرء أن يجد خصائص الحركة المجهرية للعديد من الجزيئات في المتوسط خلال فترة زمنية معينة. درجة حرارة المادة هي المؤشر المتوسط لشدة حركة الجزيئات ، طاقتها طاقة حراريةمواد.
يعد اللمس أحد أكثر الطرق شيوعًا ، ولكن أيضًا أقلها دقة لتقدير درجة الحرارة. عند لمس شيء ما ، نحكم على ما إذا كان ساخنًا أم باردًا ، مع التركيز على مشاعرنا. بالطبع ، تعتمد هذه الأحاسيس على درجة حرارة أجسامنا ، وهو ما يقودنا إلى مفهوم التوازن الحراري - وهو أحد أهم الأمور في قياس درجة الحرارة.
توازن حراري
التوازن الحراري بين الهيئتين A و B
من الواضح أنه إذا تم الضغط على جسمين A و B بإحكام ضد بعضهما البعض ، فبعد لمسهما بعد وقت طويل بما فيه الكفاية ، سنلاحظ أن درجة حرارتهما هي نفسها. في هذه الحالة ، يقال إن الجسمين A و B في حالة توازن حراري مع بعضهما البعض. ومع ذلك ، لا يجب أن تكون الأجسام ، بشكل عام ، على اتصال حتى يوجد توازن حراري بينها - يكفي أن تكون درجات حرارتها متماثلة. يمكن التحقق من ذلك باستخدام الجسم الثالث C ، أولاً بإدخاله في حالة توازن حراري مع الجسم A ، ثم مقارنة درجات حرارة الجسمين C و B. يلعب الجسم C هنا دور مقياس الحرارة. في صيغة صارمة ، يسمى هذا المبدأ القانون الصفري للديناميكا الحرارية: إذا كان الجسمان A و B في حالة توازن حراري مع جسم ثالث C ، فإن هذه الأجسام تكون أيضًا في حالة توازن حراري مع بعضها البعض. هذا القانون هو الأساس لجميع طرق قياس درجة الحرارة.
قياس الحرارة

موازين درجة الحرارة

موازين الحرارة
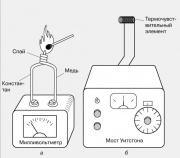
موازين الحرارة على أساس التأثيرات الكهربائية
إذا أردنا إجراء تجارب وحسابات دقيقة ، فإن تصنيفات درجات الحرارة مثل الساخنة والدافئة والباردة والباردة ليست كافية - فنحن بحاجة إلى مقياس درجة حرارة متدرج. هناك العديد من هذه المقاييس ، وعادة ما تؤخذ نقاط التجمد والغليان للماء كنقاط مرجعية. تظهر المقاييس الأربعة الأكثر شيوعًا في الشكل. المقياس المئوي ، الذي بموجبه تقابل نقطة تجمد الماء 0 درجة ، ونقطة الغليان عند 100 درجة ، يسمى مقياس سلزيوس المسمى على اسم ألف سلزيوس ، عالم الفلك السويدي الذي وصفه في عام 1742. ويعتقد أن قام عالم الطبيعة السويدي K. Linnaeus بتطبيق هذا المقياس لأول مرة. الآن مقياس سيليزيوس هو الأكثر شيوعًا في العالم. مقياس درجة حرارة فهرنهايت ، حيث تتوافق نقاط التجمد والغليان للماء مع أرقام غير مريحة للغاية تبلغ 32 و 212 درجة ، تم اقتراحه في عام 1724 من قبل ج.فهرنهايت. يستخدم مقياس فهرنهايت على نطاق واسع في البلدان الناطقة باللغة الإنجليزية ، ولكنه نادرًا ما يستخدم في الأدبيات العلمية. لتحويل درجة حرارة مئوية (درجة مئوية) إلى درجة حرارة فهرنهايت (درجة فهرنهايت) ، هناك صيغة درجة فهرنهايت = (9/5) درجة مئوية + 32 ، وللترجمة العكسية - الصيغة درجة مئوية = (5/9) ( درجة فهرنهايت - 32).
كلا المقياسين - فهرنهايت ودرجة مئوية - غير مريحين للغاية عند إجراء التجارب في ظروف تنخفض فيها درجة الحرارة إلى ما دون نقطة تجمد الماء ويتم التعبير عنها كرقم سالب. في مثل هذه الحالات ، تم إدخال مقاييس درجة الحرارة المطلقة ، والتي تستند إلى الاستقراء لما يسمى الصفر المطلق - النقطة التي يجب أن تتوقف عندها الحركة الجزيئية. أحدهما يسمى مقياس رانكين ، والآخر يسمى مقياس الديناميكا الحرارية المطلقة ؛ تُقاس درجات الحرارة بالدرجات رانكين (° R) والكلفن (K). يبدأ كلا المقياسين عند الصفر المطلق ، وتقابل نقطة تجمد الماء 491.7 درجة روبية و 273.16 كلفن. عدد الدرجات والكلفن بين نقطتي التجمد والغليان للماء على مقياس سلزيوس والمقياس الديناميكي الحراري المطلق هو نفسه ومتساو إلى 100 ؛ بالنسبة لمقاييس فهرنهايت ورانكين ، فهي أيضًا متشابهة ، ولكنها تساوي 180. يتم تحويل الدرجات المئوية إلى كلفن باستخدام الصيغة K \ u003d ° C + 273.16 ، ويتم تحويل درجات فهرنهايت إلى درجات رانكين باستخدام الصيغة ° R \ u003d درجة فهرنهايت +459.7.
يعتمد تشغيل الأجهزة المصممة لقياس درجة الحرارة على ظواهر فيزيائية مختلفة مرتبطة بتغير في الطاقة الحرارية لمادة ما - التغيرات في المقاومة الكهربائية ، الحجم ، الضغط ، الخصائص الإشعاعية ، الخواص الكهروحرارية. يعد مقياس الحرارة الزجاجي الموضح في الشكل أحد أبسط أدوات قياس درجة الحرارة وأكثرها شيوعًا. توضع الكرة ج الموجودة في الجزء السفلي من مقياس الحرارة في الوسط أو تضغط على الجسم الذي يريدون قياس درجة حرارته ، ويعتمد ذلك على ما إذا كانت الكرة تتلقى الحرارة أو تنبعث منها ، أو تتوسع أو تنقبض ويرتفع عمودها أو ينخفض. الشعيرات الدموية. إذا تمت معايرة مقياس الحرارة مسبقًا وتجهيزه بمقياس ، فيمكنك معرفة درجة حرارة الجسم مباشرةً.
جهاز آخر يعتمد عمله على التمدد الحراري هو موازين الحرارة ثنائية المعدن الموضحة في الشكل. عنصرها الرئيسي هو صفيحة لولبية من معدنين ملحومين مع معاملات مختلفة للتمدد الحراري. عند التسخين ، يتمدد أحد المعادن أكثر من الآخر ، ويلتوي اللولب ويدير السهم بالنسبة إلى المقياس. غالبًا ما تستخدم هذه الأجهزة لقياس درجة حرارة الهواء الداخلي والخارجي ، ولكنها غير مناسبة لتحديد درجة الحرارة المحلية.
تُقاس درجة الحرارة المحلية عادةً باستخدام مزدوج حراري ، وهو عبارة عن سلكين من معادن غير متشابهة ملحومة في أحد طرفيها. عندما يتم تسخين مثل هذا التقاطع ، تنشأ EMF عند الأطراف الحرة للأسلاك ، وعادةً ما تكون بضعة ملي فولت. تصنع المزدوجات الحرارية من أزواج معدنية مختلفة: الحديد والقسطنطين والنحاس والكونستانتان والكروم والألوميل. تتغير EMF الحرارية بشكل خطي تقريبًا مع درجة الحرارة على نطاق واسع من درجات الحرارة.
يُعرف أيضًا تأثير كهربائي حراري آخر - اعتماد مقاومة مادة موصلة على درجة الحرارة. إنه أساس تشغيل موازين الحرارة المقاومة الكهربائية ، أحدها موضح في الشكل. تتم مقارنة مقاومة عنصر استشعار درجة حرارة صغير (مزدوج حراري) - عادة ملفات من سلك رفيع - بمقاومة المقاوم المتغير المعاير باستخدام جسر ويتستون. يمكن تخرج أداة الإخراج مباشرة بالدرجات.
تستخدم البيرومترات الضوئية لقياس درجة حرارة الأجسام الساخنة التي ينبعث منها الضوء المرئي. في إصدار واحد من هذا الجهاز ، تتم مقارنة الضوء المنبعث من الجسم بإشعاع خيوط المصباح المتوهج الموضوعة في المستوى البؤري للمنظار الذي يُرى من خلاله الجسم المنبعث. يتم تغيير التيار الكهربائي ، الذي يسخن فتيل المصباح ، حتى ، عند مقارنة توهج الشعيرة والجسم بصريًا ، يتم العثور على توازن حراري بينهما. يمكن أن يتدرج مقياس الجهاز مباشرة بوحدات درجة الحرارة.
التقدم التقني السنوات الأخيرةيسمح بإنشاء مجسات درجة حرارة جديدة. على سبيل المثال ، في الحالات التي تتطلب حساسية عالية بشكل خاص ، بدلاً من المزدوج الحراري أو مقياس حرارة المقاومة التقليدي ، يتم استخدام جهاز أشباه الموصلات - الثرمستور. تستخدم الأصباغ والبلورات السائلة التي تغير حالة طورها أيضًا كمحولات حرارية ، خاصة في الحالات التي تختلف فيها درجة حرارة سطح الجسم على نطاق واسع. أخيرًا ، يتم استخدام التصوير الحراري بالأشعة تحت الحمراء ، حيث يتم الحصول على صورة الأشعة تحت الحمراء لجسم ما بألوان شرطية ، حيث يتوافق كل لون مع درجة حرارة معينة. تجد طريقة قياس درجة الحرارة هذه أوسع تطبيق - من التشخيص الطبيقبل فحص العزل الحراري للمباني.
قياس كمية الحرارة
مسعر الماء
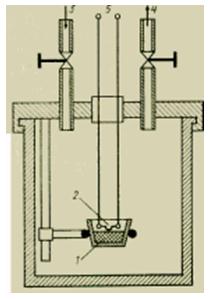
يمكن قياس الطاقة الحرارية (مقدار الحرارة) للجسم مباشرة باستخدام ما يسمى بالمُسعر ؛ يتم عرض نسخة بسيطة من هذا الجهاز في الشكل. وهي عبارة عن وعاء مغلق معزول بعناية ، ومجهز بأجهزة لقياس درجة الحرارة بداخله ، وأحيانًا يكون مملوءًا بسائل عامل له خصائص معروفة ، مثل الماء. لقياس كمية الحرارة في جسم صغير ساخن ، يتم وضعه في جهاز قياس السعرات الحرارية وانتظار وصول النظام إلى التوازن الحراري. يتم تحديد كمية الحرارة المنقولة إلى المسعر (بتعبير أدق ، إلى الماء الذي يملأه) من خلال زيادة درجة حرارة الماء.
يمكن قياس كمية الحرارة المنبعثة أثناء تفاعل كيميائي ، مثل الاحتراق ، عن طريق وضع قطعة صغيرة<бомбу>. في<бомбе>توجد عينة يتم توصيل الأسلاك الكهربائية بها للاشتعال وكمية الأكسجين المقابلة لها. بعد احتراق العينة تمامًا وإنشاء التوازن الحراري ، يتم تحديد مقدار زيادة درجة حرارة الماء في المسعر ، وبالتالي كمية الحرارة المنبعثة.
وحدات حرارية
الحرارة هي شكل من أشكال الطاقة ولذلك يجب قياسها بوحدات الطاقة. في نظام SI الدولي ، وحدة الطاقة هي الجول (J). يُسمح أيضًا باستخدام وحدات خارج النظام لمقدار الحرارة - السعرات الحرارية: السعرات الحرارية الدولية هي 4.1868 J ، والسعرات الحرارية الكيميائية هي 4.1840 J. في المعامل الأجنبية ، غالبًا ما يتم التعبير عن نتائج البحث باستخدام ما يسمى. سعر حراري 15 درجة يساوي 4.1855 ج.الوحدة الحرارية البريطانية (BTU) خارج النظام تتعرض للتلف: BTU avg = 1.055 J.
مصادر الحرارة
المصادر الرئيسية للحرارة هي التفاعلات الكيميائية والنووية ، وكذلك عمليات تحويل الطاقة المختلفة. من أمثلة التفاعلات الكيميائية مع إطلاق الحرارة الاحتراق وانهيار مكونات الطعام. يتم توفير كل الحرارة التي تتلقاها الأرض تقريبًا من التفاعلات النووية التي تحدث في أعماق الشمس. لقد تعلمت البشرية كيفية الحصول على الحرارة بمساعدة عمليات الانشطار النووي الخاضعة للرقابة ، وهي الآن تحاول استخدام تفاعلات الاندماج النووي الحراري لنفس الغرض. يمكن أيضًا تحويل أنواع أخرى من الطاقة إلى حرارة ، مثل الأعمال الميكانيكية والطاقة الكهربائية. من المهم أن تتذكر أن الطاقة الحرارية (مثل أي طاقة أخرى) لا يمكن تحويلها إلا إلى شكل آخر ، ولكن لا يمكن الحصول عليها.<из ничего>ولا تدمير. هذا هو أحد المبادئ الأساسية لعلم يسمى الديناميكا الحرارية.
الديناميكا الحرارية
الديناميكا الحراريةهو علم العلاقة بين الحرارة والعمل والمادة. تشكلت الأفكار الحديثة حول هذه العلاقات على أساس أعمال علماء عظماء في الماضي مثل كارنو ، وكلوزيوس ، وجيبس ، وجول ، وكلفن ، وغيرهم. وتشرح الديناميكا الحرارية معنى السعة الحرارية والتوصيل الحراري للمادة ، التمدد الحراري للأجسام ، وحرارة انتقالات الطور. يعتمد هذا العلم على العديد من القوانين المعمول بها تجريبياً - المبادئ.
الحرارة وخصائص المواد
مواد مختلفةلديهم قدرة مختلفة على تجميع الطاقة الحرارية ؛ يعتمد ذلك على تركيبها الجزيئي وكثافتها. كمية الحرارة المطلوبة لرفع درجة حرارة وحدة كتلة من مادة ما بمقدار درجة واحدة تسمى سعتها الحرارية النوعية. تعتمد السعة الحرارية على الظروف التي توجد فيها المادة. على سبيل المثال ، لتسخين غرام واحد من الهواء في بالون بمقدار 1 كلفن ، يلزم مزيد من الحرارة بدلاً من تسخينه بنفس الطريقة في وعاء مغلق بجدران صلبة ، حيث يتم إنفاق جزء من الطاقة المنقولة إلى البالون على توسيع الهواء وليس عند تسخينها. لذلك ، على وجه الخصوص ، يتم قياس السعة الحرارية للغازات بشكل منفصل عند ضغط ثابت وبحجم ثابت.
مع زيادة درجة الحرارة ، تزداد شدة الحركة الفوضوية للجزيئات - تتمدد معظم المواد عند تسخينها. تسمى درجة تمدد مادة مع زيادة درجة الحرارة بمقدار 1 كلفن معامل التمدد الحراري.
لكي تنتقل مادة ما من حالة طور إلى أخرى ، على سبيل المثال ، من الحالة الصلبة إلى السائلة (وأحيانًا على الفور إلى الغازية) ، يجب أن تتلقى قدرًا معينًا من الحرارة. إذا تم تسخينه صلب، ثم ترتفع درجة حرارته حتى يبدأ في الذوبان ؛ حتى اكتمال الذوبان ، ستبقى درجة حرارة الجسم ثابتة على الرغم من مدخلات الحرارة. تسمى كمية الحرارة المطلوبة لإذابة وحدة كتلة من مادة حرارة الانصهار. إذا واصلت توفير الحرارة ، فسوف تسخن المادة المنصهرة حتى الغليان. كمية الحرارة المطلوبة لتبخير كتلة وحدة من سائل عند درجة حرارة معينة تسمى حرارة التبخر.
دور الحرارة واستخدامها
مخطط تشغيل محطة توليد الطاقة التوربينية البخارية
مخطط دورة التبريد
لا يتم اختزال عمليات نقل الحرارة العالمية لتسخين الأرض عن طريق الإشعاع الشمسي. تحدد التيارات الحرارية الهائلة في الغلاف الجوي التغيرات اليومية في الظروف الجوية في جميع أنحاء العالم. تؤدي الاختلافات في درجات الحرارة في الغلاف الجوي بين المناطق الاستوائية والقطبية ، جنبًا إلى جنب مع قوى كوريوليس بسبب دوران الأرض ، إلى ظهور تيارات الحمل المتغيرة باستمرار ، مثل الرياح التجارية ، والتيارات النفاثة ، والجبهات الدافئة والباردة.
يؤدي انتقال الحرارة (بسبب التوصيل الحراري) من لب الأرض المنصهر إلى سطحه إلى ثورات بركانية وظهور السخانات. في بعض المناطق ، تُستخدم الطاقة الحرارية الأرضية لتدفئة الأماكن وتوليد الطاقة.
الدفء مشارك لا غنى عنه في كل شيء تقريبًا عمليات الانتاج. وسنذكر أهمها ، مثل صهر ومعالجة المعادن ، وتشغيل المحركات ، وإنتاج الغذاء ، والتخليق الكيميائي ، وتكرير الزيت ، وتصنيع أصناف متنوعة - من الطوب والأطباق إلى السيارات والأجهزة الإلكترونية.
العديد من المنتجات الصناعية والنقل ، وكذلك محطات الطاقة الحرارية ، لا يمكن أن تعمل بدون المحركات الحرارية - الأجهزة التي تحول الحرارة إلى عمل مفيد. ومن أمثلة هذه الآلات الضواغط والتوربينات والبخار والبنزين والمحركات النفاثة.
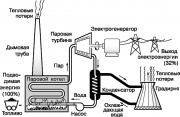
أحد أشهر المحركات الحرارية هو التوربينات البخارية ، والتي تنفذ جزءًا من دورة رانكين المستخدمة في محطات الطاقة الحديثة. يظهر رسم تخطيطي مبسط لهذه الدورة في الشكل. يتم تحويل سائل العمل - الماء - إلى بخار شديد الحرارة في غلاية بخارية يتم تسخينها عن طريق حرق الوقود الأحفوري (الفحم أو الزيت أو الغاز الطبيعي). بخار عالي
Gasovik - معدات الغاز الصناعي دليل وحدات GOST و SNiP و PB للكميات الفيزيائية والمفاهيم الفيزيائية والكيميائية والنسب والتكوين وخصائص الغازات
وحدات قياس درجة الحرارة وكمية الحرارة
كانت الوحدة الأساسية لقياس درجة الحرارة هي درجة مقياس درجة الحرارة الدولي ، والتي تتوافق عمليًا مع الدرجة المئوية. هذه القيمة تساوي 1/100 من فترة درجة الحرارة بين 0 و 100 درجة مئوية ، أي بين نقاط انصهار الجليد والماء المغلي عند ضغط 760 ملم زئبق. فن.
درجة الحرارة المطلقة هي درجة الحرارة المقاسة من الصفر المطلق ، أي من -273.16 درجة مئوية ، وتُقاس بالدرجات كلفن (درجة كلفن). درجة كلفن هي نفس درجة سلزيوس. لذلك ، يتم التعبير عن درجة الحرارة المطلقة بالدرجات المئوية على النحو التالي:
T ، ° K = t ، ° C + 273.16
في نظام SI ، وحدة درجة الحرارة هي كلفن. يُسمح بالتعبير عن النتائج العملية لقياسات درجة الحرارة باستخدام الدرجة المئوية جنبًا إلى جنب مع درجة كلفن ، اعتمادًا على الأصل (موضع الصفر) على المقياس.
مثال: 250 ± 5 ° С = 523.16 ± 5 ° ك.
في نظام SI ، يتم قياس الشغل والطاقة والحرارة بالجول (J). في بعض الأحيان ، يتم استخدام وحدة أكبر وأكثر ملاءمة للأغراض العملية - كيلو جول (kJ) ، يساوي 1000 J. الكمية الماديةإظهار مقدار العمل الذي يمكن للجسم القيام به.
يمكن استخدام السعرات الحرارية والسعرات الحرارية كوحدات حرارية خارج النظام. السعرات الحرارية هي كمية الحرارة المطلوبة لرفع درجة حرارة 1 جرام من الماء بمقدار 1 درجة مئوية (19.5 إلى 20.5 درجة مئوية).
1 كالوري = 4.1868 جول ؛
1 كيلو كالوري (كيلو كالوري) \ u003d 1000 كالوري \ u003d 4186.8 J \ u003d 4.187 كيلو جول ؛
1 Mcal (megacalorie) \ u003d 10 6 cal \ u003d 4.1868 MJ ؛
1 جرام كالوري (جيجا كالوري) = 10 9 كالوري \ u003d 4186.8 ميجا جول.
للمقارنة ، عند تقييم الوقود ، يتم استخدام ما يسمى بالحرارة الشرطية ، والتي يُفترض أن تكون قيمتها الحرارية للحساب تساوي 7 مكل / كغ أو 7 جي كالوري / طن. في مثل هذه الحالات ، يتحدث المرء ، على التوالي ، عن 1 كجم أو 1 طن من الوقود القياسي (t.c.f.).
تلعب الحرارة دورًا مهمًا في حياة الإنسان ، بما في ذلك أداء جسده. يتم تحويل جزء من الطاقة الكيميائية الموجودة في الطعام إلى حرارة ، مما يؤدي إلى الحفاظ على درجة حرارة الجسم بالقرب من 37
° ج- يعتمد التوازن الحراري لجسم الإنسان أيضًا على درجة الحرارة المحيطة ، ويضطر الناس إلى إنفاق الكثير من الطاقة على تدفئة المباني السكنية والصناعية في الشتاء وتبريدها في الصيف. يتم توفير معظم هذه الطاقة من خلال المحركات الحرارية ، مثل محطات الغلايات والتوربينات البخارية لمحطات الطاقة التي تعمل بالوقود الأحفوري (الفحم والنفط) وتوليد الكهرباء.حتى نهاية القرن الثامن عشر. تعتبر الحرارة مادة مادية ، معتقدين أن درجة حرارة الجسم تتحدد بكمية "السعرات الحرارية السائلة" أو "السعرات الحرارية" الموجودة فيه. لاحقًا ، قام ب. رومفورد وجي جول وغيرهما من علماء الفيزياء في ذلك الوقت ، من خلال التجارب والتفكير البارعين ، بدحض نظرية "السعرات الحرارية" ، مما يثبت أن الحرارة عديمة الوزن ويمكن الحصول عليها بأي كمية بسبب الحركة الميكانيكية ببساطة. الحرارة بحد ذاتها ليست مادة ، إنها مجرد طاقة حركة ذراتها أو جزيئاتها. هذا هو فهم الحرارة الذي تلتزم به الفيزياء الحديثة. أنظر أيضاالفيزياء.
في هذه المقالة ، سوف ننظر في كيفية ارتباط الحرارة ودرجة الحرارة وكيف يتم قياس هذه الكميات. سيكون موضوع مناقشتنا أيضًا الأسئلة التالية: انتقال الحرارة من جزء من الجسم إلى جزء آخر ؛ انتقال الحرارة في الفراغ (مساحة لا تحتوي على مادة) ؛ دور الحرارة في العالم الحديث.
الحرارة ودرجة الحرارة لا يمكن تحديد كمية الطاقة الحرارية في مادة ما من خلال مراقبة حركة كل جزيء من جزيئاتها على حدة. على العكس من ذلك ، فقط من خلال دراسة الخصائص العيانية للمادة ، يمكن للمرء أن يجد خصائص الحركة المجهرية للعديد من الجزيئات في المتوسط خلال فترة زمنية معينة. درجة حرارة المادة هي مؤشر متوسط لشدة حركة الجزيئات ، وطاقتها هي الطاقة الحرارية للمادة.واحدة من أكثر الطرق شيوعًا ، ولكنها أيضًا أقل دقة لتقييم درجة الحرارة عن طريق اللمس. عند لمس شيء ما ، نحكم على ما إذا كان ساخنًا أم باردًا ، مع التركيز على مشاعرنا. بالطبع ، هذه الأحاسيس تعتمد على درجة حرارة أجسامنا ، وهو ما يقودنا إلى مفهوم التوازن الحراري ، وهو أحد أهم الأمور في قياس درجة الحرارة.
التوازن الحراري. من الواضح ، إذا كانت جثتين أ و ب (الشكل 1) الضغط بشدة على بعضنا البعض ، ثم بعد لمسهم بعد وقت طويل بما فيه الكفاية ، سنلاحظ أن درجة حرارتهم هي نفسها. في هذه الحالة ، يقال إن الجثث أ و ب في حالة توازن حراري مع بعضها البعض. ومع ذلك ، لا يجب أن تكون الأجسام ، بشكل عام ، على اتصال حتى يوجد توازن حراري بينها ، يكفي أن تكون درجات حرارتها متماثلة. يمكن التحقق من ذلك باستخدام الجسد الثالث ج ، مما يجعله أولًا في حالة التوازن الحراري مع الجسم أ ثم مقارنة درجات حرارة الأجسام ج و ب. الجسم ج هنا يلعب دور مقياس الحرارة. في صيغة صارمة ، يسمى هذا المبدأ القانون الصفري للديناميكا الحرارية: إذا كان الجسمان A و B في حالة توازن حراري مع جسم ثالث C ، فإن هذه الأجسام تكون أيضًا في حالة توازن حراري مع بعضها البعض.هذا القانون هو الأساس لجميع طرق قياس درجة الحرارة.قياس الحرارة. إذا أردنا إجراء تجارب وحسابات دقيقة ، فإن تصنيفات درجات الحرارة مثل الساخنة والدافئة والباردة والباردة ليست كافية ، فنحن بحاجة إلى مقياس درجة حرارة متدرج. هناك العديد من هذه المقاييس ، وعادة ما تؤخذ نقاط التجمد والغليان للماء كنقاط مرجعية. تظهر المقاييس الأربعة الأكثر شيوعًا في الشكل. 2. مقياس درجة مئوية ، والذي بموجبه تقابل نقطة تجمد الماء الصفر° ، ونقطة الغليان 100° ، يسمى مقياس سيليزيوس المسمى على اسم A.Celsius ، عالم الفلك السويدي الذي وصفه عام 1742. ويعتقد أن عالم الطبيعة السويدي K. Linney كان أول من استخدم هذا المقياس. الآن مقياس سيليزيوس هو الأكثر شيوعًا في العالم. مقياس درجة حرارة فهرنهايت ، حيث تتوافق نقاط التجمد والغليان للماء مع الأرقام غير المريحة للغاية 32 و 212° ، في عام 1724 من قبل ج. فهرنهايت. يستخدم مقياس فهرنهايت على نطاق واسع في البلدان الناطقة باللغة الإنجليزية ، ولكنه نادرًا ما يستخدم في الأدبيات العلمية. لتحويل درجة الحرارة إلى مئوية (° ج) إلى درجة حرارة فهرنهايت (° و) هناك معادلةدرجة فهرنهايت = (9/5) درجة C + 32 ، ولصيغة الترجمة العكسيةدرجة مئوية = (5/9) (درجة فهرنهايت - 32). كلا المقياسين ، فهرنهايت ودرجة مئوية ، غير مريحين للغاية عند إجراء التجارب في ظروف تنخفض فيها درجة الحرارة إلى ما دون نقطة تجمد الماء ويتم التعبير عنها كرقم سالب. في مثل هذه الحالات ، تم إدخال مقاييس درجة الحرارة المطلقة ، والتي تستند إلى الاستقراء لما يسمى الصفر المطلق ، وهي النقطة التي يجب أن تتوقف عندها الحركة الجزيئية. أحدهما يسمى مقياس رانكين ، والآخر يسمى مقياس الديناميكا الحرارية المطلقة ؛ تُقاس درجات الحرارة بالدرجات رانكين (° R) و kelvins (K). يبدأ كلا المقياسين عند الصفر المطلق وتبلغ درجة تجمد الماء 491.7° R و 273.16 K. عدد الدرجات والكلفين بين نقطتي التجمد والغليان للماء على مقياس سلزيوس والمقياس الديناميكي الحراري المطلق هو نفسه ويساوي 100 ؛ بالنسبة لمقاييس فهرنهايت ورانكين ، فهي أيضًا متشابهة ، ولكنها تساوي 180. يتم تحويل الدرجات المئوية إلى كلفن باستخدام الصيغة K \ u003d° C + 273.16 ، ودرجات فهرنهايت إلى درجات رانكين باستخدام الصيغة° R = ° F + 459.7. يعتمد تشغيل الأجهزة المصممة لقياس درجة الحرارة على ظواهر فيزيائية مختلفة مرتبطة بالتغير في الطاقة الحرارية لمادة ، والتغيرات في المقاومة الكهربائية ، والحجم ، والضغط ، والخصائص الإشعاعية ، والخصائص الكهروحرارية. أحد أبسط الأدوات وأكثرها شيوعًا لقياس درجة الحرارة هو مقياس الحرارة الزئبقي الموضح في الشكل. 3, أ. يتم وضع الكرة التي تحتوي على الزئبق في الجزء السفلي من مقياس الحرارة في الوسط أو الضغط على الجسم الذي يريدون قياس درجة حرارته ، واعتمادًا على ما إذا كانت الكرة تتلقى الحرارة أو تنبعث منها ، يتمدد الزئبق أو يتقلص ويرتفع عموده أو يقع في الشعيرات الدموية. إذا تمت معايرة مقياس الحرارة مسبقًا وتجهيزه بمقياس ، فيمكنك معرفة درجة حرارة الجسم مباشرةً.جهاز آخر يعتمد تشغيله على التمدد الحراري هو مقياس الحرارة ثنائي المعدن الموضح في الشكل.
3, ب. عنصرها الرئيسي صفيحة لولبية من معدنين ملحومين مع معاملات مختلفة للتمدد الحراري. عند التسخين ، يتمدد أحد المعادن أكثر من الآخر ، ويلتوي اللولب ويدير السهم بالنسبة إلى المقياس. غالبًا ما تستخدم هذه الأجهزة لقياس درجة حرارة الهواء الداخلي والخارجي ، ولكنها غير مناسبة لتحديد درجة الحرارة المحلية.عادة ما يتم قياس درجة الحرارة المحلية باستخدام مزدوج حراري ، وهو عبارة عن سلكين من معادن غير متشابهة ملحومة في أحد طرفيها (الشكل.
4, أ). عندما يتم تسخين مثل هذا التقاطع ، تنشأ قوة emf عند الأطراف الحرة للأسلاك ، وعادةً ما تكون بضعة ملي فولت. تصنع المزدوجات الحرارية من أزواج معدنية مختلفة: الحديد والقسطنطين والنحاس والكونستانتان والكروم والألوميل. تتغير EMF الحرارية بشكل خطي تقريبًا مع درجة الحرارة على نطاق واسع من درجات الحرارة.يُعرف أيضًا تأثير كهربائي حراري آخر - اعتماد مقاومة مادة موصلة على درجة الحرارة. إنه أساس تشغيل موازين الحرارة المقاومة الكهربائية ، أحدها موضح في الشكل.
4, ب. عادة ما تتم مقارنة مقاومة عنصر صغير حساس لدرجة الحرارة (مستشعر حراري) لفائف من الأسلاك الرقيقة بمقاومة المقاوم المتغير المعاير باستخدام جسر ويتستون. يمكن تخرج أداة الإخراج مباشرة بالدرجات.تستخدم البيرومترات الضوئية لقياس درجة حرارة الأجسام المتوهجة التي تنبعث منها الضوء المرئي. في إصدار واحد من هذا الجهاز ، تتم مقارنة الضوء المنبعث من الجسم بإشعاع خيوط المصباح المتوهج الموضوعة في المستوى البؤري للمنظار الذي يُرى من خلاله الجسم المنبعث. يتم تغيير التيار الكهربي الذي يسخن فتيل المصباح حتى تكشف المقارنة البصرية لتوهج الشعيرة والجسم أن التوازن الحراري قد تم إنشاؤه بينهما. يمكن أن يتدرج مقياس الجهاز مباشرة بوحدات درجة الحرارة.
أتاحت التطورات التقنية في السنوات الأخيرة إنشاء مستشعرات درجة حرارة جديدة. على سبيل المثال ، في الحالات التي تتطلب حساسية عالية بشكل خاص ، يتم استخدام جهاز أشباه الموصلات ، الثرمستور ، بدلاً من مقياس الحرارة التقليدي أو المزدوج الحراري. تستخدم الأصباغ والبلورات السائلة التي تغير حالة طورها أيضًا كمحولات حرارية ، خاصة في الحالات التي تختلف فيها درجة حرارة سطح الجسم على نطاق واسع. أخيرًا ، يتم استخدام التصوير الحراري بالأشعة تحت الحمراء ، حيث يتم الحصول على صورة الأشعة تحت الحمراء لجسم ما بألوان شرطية ، حيث يتوافق كل لون مع درجة حرارة معينة. تجد طريقة قياس درجة الحرارة هذه أوسع تطبيق من التشخيص الطبي إلى فحص العزل الحراري للغرف. أنظر أيضافيزياء الدولة الصلبة ؛ سائل كريستال.
قياس كمية الحرارة. يمكن قياس الطاقة الحرارية (مقدار الحرارة) للجسم مباشرة باستخدام ما يسمى بالمُسعر ؛ يتم عرض نسخة بسيطة من هذا الجهاز في الشكل. 5. هو وعاء مغلق معزول بعناية ومجهز بأجهزة لقياس درجة الحرارة بداخله وأحيانًا يكون مملوءًا بسائل عامل له خصائص معروفة مثل الماء. لقياس كمية الحرارة في جسم صغير ساخن ، يتم وضعه في جهاز قياس السعرات الحرارية وانتظار وصول النظام إلى التوازن الحراري. يتم تحديد كمية الحرارة المنقولة إلى المسعر (بتعبير أدق ، إلى الماء الذي يملأه) من خلال زيادة درجة حرارة الماء.يمكن قياس كمية الحرارة المنبعثة أثناء تفاعل كيميائي ، مثل الاحتراق ، عن طريق وضع "قنبلة" صغيرة في المسعر. تحتوي "القنبلة" على عينة موصلة بأسلاك كهربائية للاشتعال وكمية مماثلة من الأكسجين. بعد احتراق العينة تمامًا وإنشاء التوازن الحراري ، يتم تحديد مقدار زيادة درجة حرارة الماء في المسعر ، وبالتالي كمية الحرارة المنبعثة. أنظر أيضاقياس السعرات.
وحدات حرارية. الحرارة هي شكل من أشكال الطاقة ولذلك يجب قياسها بوحدات الطاقة. في نظام SI الدولي ، وحدة الطاقة هي الجول (J). يُسمح أيضًا باستخدام الوحدات غير النظامية لكمية السعرات الحرارية الحرارية: السعرات الحرارية الدولية هي 4.1868 J ، والسعرات الحرارية الكيميائية هي 4.1840 J. في المعامل الأجنبية ، غالبًا ما يتم التعبير عن نتائج البحث باستخدام ما يسمى. سعر حراري 15 درجة يساوي 4.1855 ج.الوحدة الحرارية البريطانية (BTU) خارج النظام تتعرض للتلف: BTU avg = 1.055 J. المصادر الرئيسية للحرارة هي التفاعلات الكيميائية والنووية ، وكذلك عمليات تحويل الطاقة المختلفة. من أمثلة التفاعلات الكيميائية مع إطلاق الحرارة الاحتراق وانهيار مكونات الطعام. يتم توفير كل الحرارة التي تتلقاها الأرض تقريبًا من التفاعلات النووية التي تحدث في أعماق الشمس. لقد تعلمت البشرية كيفية الحصول على الحرارة بمساعدة عمليات الانشطار النووي الخاضعة للرقابة ، وهي الآن تحاول استخدام تفاعلات الاندماج النووي الحراري لنفس الغرض. يمكن أيضًا تحويل أنواع أخرى من الطاقة إلى حرارة ، مثل الأعمال الميكانيكية والطاقة الكهربائية. من المهم أن نتذكر أن الطاقة الحرارية (مثل أي طاقة أخرى) لا يمكن تحويلها إلا إلى شكل آخر ، ولكن لا يمكن الحصول عليها "من لا شيء" ولا تدميرها. هذا هو أحد المبادئ الأساسية لعلم يسمى الديناميكا الحرارية. الديناميكا الحرارية الديناميكا الحرارية هي علم العلاقة بين الحرارة والعمل والمادة. تشكلت الأفكار الحديثة حول هذه العلاقات على أساس أعمال علماء عظماء في الماضي مثل كارنو ، وكلوزيوس ، وجيبس ، وجول ، وكلفن ، وغيرهم. وتشرح الديناميكا الحرارية معنى السعة الحرارية والتوصيل الحراري للمادة ، التمدد الحراري للأجسام ، وحرارة انتقالات الطور. يعتمد هذا العلم على العديد من مبادئ القوانين المعمول بها تجريبياً.بدايات الديناميكا الحرارية. يقدم القانون الصفري للديناميكا الحرارية الذي تمت صياغته أعلاه مفاهيم التوازن الحراري ودرجة الحرارة والقياس الحراري. القانون الأول للديناميكا الحرارية هو بيان ذو أهمية رئيسية لكل العلوم ككل: لا يمكن تدمير الطاقة أو الحصول عليها "من لا شيء" ، وبالتالي فإن الطاقة الكلية للكون هي قيمة ثابتة. في أبسط أشكاله ، يمكن تحديد القانون الأول للديناميكا الحرارية على النحو التالي: الطاقة التي يتلقاها النظام ، مطروحًا منها الطاقة التي يتخلى عنها ، تساوي الطاقة المتبقية في النظام. للوهلة الأولى ، يبدو هذا البيان واضحًا ، ولكن ليس في مثل هذا ، على سبيل المثال, حالات مثل احتراق البنزين في أسطوانات محرك السيارة: هنا تكون الطاقة المستلمة كيميائية ، والطاقة المنبعثة ميكانيكية (عمل) ، والطاقة المتبقية في النظام هي طاقة حرارية.لذلك ، من الواضح أن الطاقة يمكن أن تتغير من شكل إلى آخر وأن مثل هذه التحولات تحدث باستمرار في الطبيعة والتكنولوجيا. منذ أكثر من مائة عام ، أثبت J. Joule هذا في حالة تحويل الطاقة الميكانيكية إلى طاقة حرارية باستخدام الجهاز الموضح في الشكل. 6 ، أ. في هذا الجهاز ، تقوم الأوزان الهابطة والمتصاعدة بتدوير عمود مع شفرات في مسعر مملوء بالماء ، ونتيجة لذلك تم تسخين الماء. سمحت القياسات الدقيقة لـ Joule بتحديد أن سعر حراري واحد من الحرارة يعادل 4.186 J من العمل الميكانيكي. الجهاز الموضح في الشكل.
6, ب ، لتحديد المكافئ الحراري للطاقة الكهربائية.يشرح القانون الأول للديناميكا الحرارية العديد من الظواهر الشائعة. على سبيل المثال ، يتضح سبب استحالة تبريد المطبخ بثلاجة مفتوحة. لنفترض أننا عزلنا المطبخ حرارياً عن البيئة. يتم توفير الطاقة باستمرار للنظام من خلال سلك الطاقة الخاص بالثلاجة ، لكن النظام لا يعطي أي طاقة. وبالتالي ، تزداد طاقته الإجمالية ، ويصبح المطبخ أكثر دفئًا: ما عليك سوى لمس أنابيب المبادل الحراري (المكثف) الموجود في الجزء الخلفي من الثلاجة ، وسوف تفهم عدم جدواها على أنها جهاز "تبريد". ولكن إذا تم إخراج هذه الأنابيب من النظام (على سبيل المثال ، من النافذة) ، فسيقوم المطبخ بإنتاج طاقة أكثر مما يستقبله ، أي سيتم تبريده ، وكانت الثلاجة تعمل كمكيف هواء للشباك.
القانون الأول للديناميكا الحرارية هو قانون الطبيعة الذي يمنع خلق أو تدمير الطاقة. ومع ذلك ، فإنه لا يذكر شيئًا عن كيفية سير عمليات نقل الطاقة في الطبيعة. وهكذا ، نعلم أن الجسم الساخن يسخن الجسم البارد إذا لامست هذه الأجسام. ولكن هل يمكن لجسم بارد بمفرده أن ينقل احتياطيه الحراري إلى آخر ساخن؟ آخر فرصةرفضه القانون الثاني للديناميكا الحرارية رفضًا قاطعًا.
يستبعد القانون الأول أيضًا إمكانية إنشاء محرك بمعامل عمل مفيد(الكفاءة) أكثر من 100٪ (مماثلة
" أبدي " يمكن للمحرك أن يعطي طاقة أكبر لفترة طويلة بشكل تعسفي مما يستهلكه). من المستحيل بناء محرك حتى بكفاءة تساوي 100٪ ، لأنه يجب بالضرورة أن يضيع جزء من الطاقة المزودة إليه في شكل طاقة حرارية أقل فائدة. لذلك ، لن تدور العجلة إلى أجل غير مسمى بدون مصدر طاقة ، لأنه بسبب الاحتكاك في المحامل ، ستتحول طاقة الحركة الميكانيكية تدريجياً إلى حرارة حتى تتوقف العجلة.يمكن مقارنة الميل إلى تحويل العمل "المفيد" إلى حرارة طاقة أقل فائدة مع عملية أخرى تحدث عندما يتم توصيل سفينتين تحتويان على غازات مختلفة. بعد الانتظار لفترة طويلة ، نجد في كلتا السفينتين خليطًا متجانسًا من الغازات الطبيعة يعمل بطريقة تقلص ترتيب النظام. يُطلق على المقياس الديناميكي الحراري لهذا الاضطراب الانتروبيا ، ويمكن صياغة القانون الثاني للديناميكا الحرارية بشكل مختلف: تسير العمليات في الطبيعة دائمًا بطريقة تزيد فيها إنتروبيا النظام وبيئته. وهكذا ، تظل طاقة الكون ثابتة ، بينما تتزايد إنتروبيا الكون باستمرار.
الحرارة وخصائص المواد. المواد المختلفة لها قدرة مختلفة على تخزين الطاقة الحرارية ؛ يعتمد ذلك على تركيبها الجزيئي وكثافتها. تسمى كمية الحرارة المطلوبة لرفع درجة حرارة وحدة كتلة من مادة ما بمقدار درجة واحدة حرارة نوعية. تعتمد السعة الحرارية على الظروف التي توجد فيها المادة. على سبيل المثال ، لتسخين غرام واحد من الهواء في بالون بمقدار 1 كلفن ، يلزم مزيد من الحرارة بدلاً من تسخينه بنفس الطريقة في وعاء مغلق بجدران صلبة ، حيث يتم إنفاق جزء من الطاقة المنقولة إلى البالون على توسيع الهواء وليس عند تسخينها. لذلك ، على وجه الخصوص ، يتم قياس السعة الحرارية للغازات بشكل منفصل عند ضغط ثابت وبحجم ثابت.مع زيادة درجة الحرارة ، تزيد شدة الحركة الفوضوية للجزيئات من تمدد معظم المواد عند تسخينها. تسمى درجة تمدد مادة مع زيادة درجة الحرارة بمقدار 1 كلفن معامل التمدد الحراري.
لكي تنتقل مادة ما من حالة طور إلى أخرى ، على سبيل المثال ، من الحالة الصلبة إلى السائلة (وأحيانًا على الفور إلى الغازية) ، يجب أن تتلقى قدرًا معينًا من الحرارة. إذا تم تسخين جسم صلب ، ترتفع درجة حرارته حتى يبدأ في الذوبان ؛ حتى اكتمال الذوبان ، تظل درجة حرارة الجسم ثابتة ، على الرغم من إمداد الحرارة. تسمى كمية الحرارة المطلوبة لإذابة وحدة كتلة من مادة حرارة الانصهار. إذا واصلت توفير الحرارة ، فسوف تسخن المادة المنصهرة حتى الغليان. كمية الحرارة المطلوبة لتبخير كتلة وحدة من سائل عند درجة حرارة معينة تسمى حرارة التبخر.
النظرية الجزيئية الحركية. تشرح النظرية الحركية الجزيئية الخصائص العيانية للمادة من خلال النظر على المستوى المجهري في سلوك الذرات والجزيئات التي تتكون منها هذه المادة. في هذه الحالة ، يتم استخدام نهج إحصائي ويتم عمل بعض الافتراضات حول الجسيمات نفسها وطبيعة حركتها. وبالتالي ، تعتبر الجزيئات كرات صلبة ، والتي في الوسائط الغازية تكون في حركة فوضوية مستمرة وتقطع مسافات كبيرة من تصادم إلى آخر. تعتبر التصادمات مرنة وتحدث بين الجسيمات التي يكون حجمها صغيرًا وعددها كبير جدًا. لا يتوافق أي من الغازات الحقيقية مع هذا النموذج تمامًا ، ولكن معظم الغازات قريبة جدًا منه ، وهذا هو سبب القيمة العملية لنظرية الحركية الجزيئية.بناءً على هذه الأفكار وباستخدام نهج إحصائي ، اشتق ماكسويل توزيع سرعات جزيئات الغاز في حجم محدود ، والذي سمي لاحقًا باسمه. يتم تقديم هذا التوزيع بيانياً في الشكل. 7 لكتلة معينة من الهيدروجين عند درجات حرارة 100 و 1000
° جيم يمثل الإحداثي عدد الجزيئات التي تتحرك بالسرعة المشار إليها على الإحداثي. إجمالي عدد الجسيمات يساوي المساحة الواقعة أسفل كل منحنى وهو نفسه في كلتا الحالتين. يمكن أن نرى من الرسم البياني أن معظم الجسيمات لها سرعات قريبة من قيمة متوسطة ، وأن عددًا صغيرًا منها فقط لديه سرعات عالية جدًا أو منخفضة جدًا. يقع متوسط السرعات في درجات الحرارة هذه في النطاق 2000-3000 م / ث ، أي كبير جدا.يعمل عدد كبير من جزيئات الغاز سريعة الحركة هذه بقوة قابلة للقياس تمامًا على الأجسام المحيطة. تضيف القوى المجهرية التي تضرب بها العديد من جزيئات الغاز جدران الوعاء كمية كبيرة تسمى الضغط. عندما يتم إمداد الغاز بالطاقة (ارتفاع درجة الحرارة) ، يزداد متوسط الطاقة الحركية لجزيئاته ، وتصطدم جزيئات الغاز بالجدران في كثير من الأحيان وأصعب ، ويزداد الضغط ، وإذا لم تكن الجدران صلبة تمامًا ، فإنها تتمدد والحجم يزيد من الغاز. وبالتالي ، فإن النهج الإحصائي المجهري الذي تقوم عليه النظرية الحركية الجزيئية يجعل من الممكن شرح ظاهرة التمدد الحراري التي ناقشناها.
النتيجة الأخرى للنظرية الحركية الجزيئية هي قانون يصف خصائص الغاز التي تفي بالمتطلبات المذكورة أعلاه. هذا هو ما يسمى بمعادلة الدولة غاز مثالييتعلق بضغط وحجم ودرجة حرارة مول واحد من الغاز وله شكل المساواة
PV = RT أين ص الضغط، حجم V ، تي درجة الحرارة و ص ثابت غاز عام يساوي (8.31441± 0.00026) جول / (مول H. إلى). أنظر أيضاالنظرية الحركية الجزيئية.الديناميكا الحرارية. انتقال الحرارة نقل الحرارة هو عملية نقل الحرارة داخل الجسم أو من جسم إلى آخر بسبب اختلاف درجة الحرارة. تعتمد شدة انتقال الحرارة على خصائص المادة واختلاف درجة الحرارة وتتبع قوانين الطبيعة الموضوعة تجريبياً. لإنشاء أنظمة تدفئة أو تبريد فعالة ، ومحركات مختلفة ، ومحطات توليد الطاقة ، وأنظمة عزل حراري ، تحتاج إلى معرفة مبادئ نقل الحرارة. في بعض الحالات ، يكون التبادل الحراري غير مرغوب فيه (العزل الحراري لأفران الصهر وسفن الفضاء وما إلى ذلك) ، بينما في حالات أخرى يجب أن يكون أكبر ما يمكن (غلايات البخار والمبادلات الحرارية وأدوات المطبخ).هناك ثلاثة أنواع رئيسية من نقل الحرارة: التوصيل ، والحمل الحراري ، ونقل الحرارة بالإشعاع.
توصيل حراري. إذا كان هناك اختلاف في درجة الحرارة داخل الجسم ، فإن الطاقة الحرارية تنتقل من الجزء الأكثر سخونة إلى الجزء الأكثر برودة. يسمى هذا النوع من نقل الحرارة ، بسبب الحركات الحرارية وتصادم الجزيئات ، بالتوصيل الحراري ؛ بما يكفي درجات حرارة عاليةفي المواد الصلبة يمكن ملاحظتها بصريا. لذلك ، عندما يتم تسخين قضيب فولاذي من أحد أطراف لهب موقد غاز ، تنتقل الطاقة الحرارية من خلال القضيب ، وينتشر الوهج على مسافة معينة من الطرف الساخن (أقل وأقل شدة مع المسافة من مكان تدفئة).تعتمد شدة انتقال الحرارة بسبب التوصيل الحراري على تدرج درجة الحرارة ، أي علاقات
د تي / د x فرق درجة الحرارة في نهايات القضيب إلى المسافة بينهما. يعتمد أيضًا على مساحة المقطع العرضي للقضيب (بالمتر 2 ) والتوصيل الحراري للمادة[ في الوحدات المقابلة W / (مالفصل ك)] . تم اشتقاق العلاقة بين هذه الكميات من قبل عالم الرياضيات الفرنسي ج. فورييه ولها الشكل التالي:أين ف تدفق الحرارة، ك معامل التوصيل الحراري و أ مساحة المقطع العرضي. هذه العلاقة تسمى قانون فورييه للتوصيل الحراري. تشير علامة الطرح الموجودة فيه إلى أن الحرارة تنتقل في الاتجاه المعاكس لتدرج درجة الحرارة.ويترتب على قانون فورييه أنه يمكن تقليل تدفق الحرارة عن طريق تقليل إحدى كميات معامل التوصيل الحراري أو المنطقة أو التدرج الحراري. بالنسبة للمبنى في ظروف الشتاء ، تكون القيم الأخيرة ثابتة عمليًا ، وبالتالي ، من أجل الحفاظ على درجة الحرارة المطلوبة في الغرفة ، يبقى تقليل التوصيل الحراري للجدران ، أي تحسين العزل الحراري.
يوضح الجدول معاملات التوصيل الحراري لبعض المواد والمواد. يوضح الجدول أن بعض المعادن توصل الحرارة بشكل أفضل بكثير من غيرها ، ولكنها جميعًا موصلات حرارة أفضل بكثير من الهواء والمواد المسامية.
|
التوصيل الحراري لبعض المواد والمواد |
|
|
المواد والمواد |
الموصلية الحرارية ، W / (م × ك) |
| الألومنيوم | |
| برونزية | |
| البزموت | |
| التنغستن | |
| حديد | |
| ذهب | |
| الكادميوم | |
| المغنيسيوم | |
| نحاس | |
| الزرنيخ | |
| نيكل | |
| البلاتين | |
| الزئبق | |
| قيادة | |
| الزنك | |
|
مواد اخرى |
|
| الاسبستوس | |
| أسمنت | |
| هواء | |
| ايدر داون (سائب) | |
| شجرة الجوز) | |
| المغنيسيا (MgO) | |
| نشارة الخشب | |
| مطاط (إسفنج) | |
| ميكا | |
| زجاج | |
| الكربون (الجرافيت) | |
تنخفض المقاومة الحرارية والكهربائية للعديد من المواد بشكل حاد حيث تنخفض درجة الحرارة عن درجة حرارة الهيليوم السائل (1.8 كلفن). تُستخدم هذه الظاهرة ، التي تسمى الموصلية الفائقة ، لتحسين كفاءة العديد من الأجهزة ، من الأجهزة الإلكترونية الدقيقة إلى خطوط الطاقة والمغناطيسات الكهربائية الكبيرة. أنظر أيضاالموصلية الفائقة.
الحمل. كما قلنا بالفعل ، عندما يتم تطبيق الحرارة على سائل أو غاز ، تزداد شدة حركة الجزيئات ، ونتيجة لذلك ، يزداد الضغط. إذا لم يكن حجم السائل أو الغاز محدودًا ، فسيتمددان ؛ تصبح الكثافة المحلية للسائل (الغاز) أقل ، وبسبب قوى الطفو (أرخميدس) ، يتحرك الجزء المسخن من الوسط لأعلى (وهذا هو سبب ارتفاع الهواء الدافئ في الغرفة من البطاريات إلى السقف). هذه الظاهرة تسمى الحمل الحراري. لكي لا تضيع حرارة نظام التدفئة من أجل لا شيء ، فأنت بحاجة إلى استخدام السخانات الحديثة التي توفر دورانًا قسريًا للهواء.يعتمد تدفق الحرارة بالحمل الحراري من السخان إلى الوسط المسخن على السرعة الأولية للجزيئات ، والكثافة ، واللزوجة ، والتوصيل الحراري ، والسعة الحرارية ، والوسيط ؛ حجم وشكل السخان مهمان للغاية أيضًا. النسبة بين الكميات المقابلة تخضع لقانون نيوتن
ف = ها ( تي دبليو- TҐ) ، أين ف التدفق الحراري (يقاس بالواط) ، أ مساحة سطح مصدر الحرارة (بالمتر المربع) 2), تي دبليوو تي درجة حرارة المصدر وبيئته (بالكلفن). معامل انتقال الحرارة الحراري ح يعتمد على خصائص الوسط ، والسرعة الابتدائية لجزيئاته ، وكذلك على شكل مصدر الحرارة ، ويقاس بوحدات W / (م 2 ح إلى).قيمة
ح ليس هو نفسه في الحالات التي يكون فيها الهواء المحيط بالسخان ثابتًا (الحمل الحراري) وعندما يكون السخان نفسه في تدفق الهواء (الحمل الحراري القسري). في حالات بسيطة من تدفق السوائل عبر أنبوب أو يتدفق حول سطح مستو ، المعامل ح يمكن حسابها نظريًا. ومع ذلك ، لم يكن من الممكن حتى الآن إيجاد حل تحليلي لمشكلة الحمل الحراري لتدفق مضطرب لوسط ما. الاضطراب هو حركة معقدة لسائل (غاز) ، فوضوية على نطاق يتجاوز بكثير الجزيئات.إذا تم وضع جسم ساخن (أو بارد على العكس) في وسط ثابت أو في تدفق ، فإن تيارات الحمل الحراري وطبقة حدية تتشكل حوله. تلعب درجة حرارة وضغط وسرعة الجزيئات في هذه الطبقة دورًا مهمًا في تحديد معامل انتقال الحرارة بالحمل الحراري.
يجب مراعاة الحمل الحراري في تصميم المبادلات الحرارية وأنظمة تكييف الهواء والطائرات عالية السرعة والعديد من التطبيقات الأخرى. في جميع هذه الأنظمة ، يحدث التوصيل الحراري في وقت واحد مع الحمل الحراري ، بين المواد الصلبة وفي بيئتها. في درجات حرارة مرتفعةيمكن أن يلعب نقل الحرارة المشع دورًا مهمًا أيضًا.
إشعاع انتقال الحرارة. النوع الثالث من نقل الحرارة بالإشعاع يختلف عن التوصيل الحراري والحمل الحراري في هذه الحالة يمكن نقل الحرارة في هذه الحالة من خلال الفراغ. تشابهه مع طرق نقل الحرارة الأخرى هو أنه يرجع أيضًا إلى اختلاف درجة الحرارة. الإشعاع الحراري هو أحد الأنواع الاشعاع الكهرومغناطيسي. تحدث أنواع أخرى من الموجات الراديوية والأشعة فوق البنفسجية وجاما في حالة عدم وجود اختلاف في درجة الحرارة.على التين. يوضح الشكل 8 اعتماد طاقة الإشعاع الحراري (الأشعة تحت الحمراء) على الطول الموجي. يمكن أن يصاحب الإشعاع الحراري انبعاث الضوء المرئي ، لكن طاقته صغيرة مقارنة بالطاقة الإشعاعية للجزء غير المرئي من الطيف.
تتناسب شدة انتقال الحرارة عن طريق التوصيل الحراري والحمل الحراري مع درجة الحرارة ، ويتناسب تدفق الحرارة المشع مع القوة الرابعة لدرجة الحرارة ويتبع قانون ستيفان بولتزمان
غالبًا ما يتم تسخين المساحات السكنية والمكتبية ببواعث حرارة كهربائية صغيرة ؛ التوهج المحمر لدواماتها هو إشعاع حراري مرئي بالقرب من حافة جزء الأشعة تحت الحمراء من الطيف. يتم تسخين الغرفة بالحرارة ، والتي تحملها بشكل أساسي الجزء غير المرئي من الأشعة تحت الحمراء. في أجهزة الرؤية الليلية
^ تستخدم الكاميرا مصدر إشعاع حراري وجهاز استقبال حساس للأشعة تحت الحمراء يسمح لك بالرؤية في الظلام.الشمس باعث قوي للطاقة الحرارية. تسخن الأرض حتى على مسافة 150 مليون كيلومتر. تبلغ شدة الإشعاع الشمسي ، التي يتم تسجيلها عامًا بعد عام بواسطة المحطات الموجودة في أجزاء كثيرة من العالم ، حوالي 1.37 واط
/ م 2 . الطاقة الشمسية هي مصدر الحياة على الأرض. يتم البحث عن طرق لاستخدامه بشكل أكثر فاعلية. تم إنشاء الألواح الشمسية لتدفئة المنازل وتوليد الكهرباء للاحتياجات المنزلية. دور الحرارة واستخدامها لا يتم اختزال عمليات نقل الحرارة العالمية لتسخين الأرض عن طريق الإشعاع الشمسي. تحدد التيارات الحرارية الهائلة في الغلاف الجوي التغيرات اليومية في الظروف الجوية في جميع أنحاء العالم. تؤدي الاختلافات في درجات الحرارة في الغلاف الجوي بين المناطق الاستوائية والقطبية ، جنبًا إلى جنب مع قوى كوريوليس بسبب دوران الأرض ، إلى ظهور تيارات الحمل المتغيرة باستمرار ، مثل الرياح التجارية ، والتيارات النفاثة ، والجبهات الدافئة والباردة. أنظر أيضامناخ؛ الأرصاد الجوية وعلم المناخ.يؤدي انتقال الحرارة (بسبب التوصيل الحراري) من لب الأرض المنصهر إلى سطحه إلى ثورات بركانية وظهور السخانات. في بعض المناطق ، تُستخدم الطاقة الحرارية الأرضية لتدفئة الأماكن وتوليد الطاقة.
تعتبر Heat مشاركًا لا غنى عنه في جميع عمليات الإنتاج تقريبًا. سنذكر أهمها ، مثل صهر ومعالجة المعادن ، وتشغيل المحركات ، وإنتاج المنتجات الغذائية ، والتخليق الكيميائي ، وتكرير الزيت ، وتصنيع أصناف متنوعة من الطوب والأطباق إلى السيارات والإلكترونيات. الأجهزة.
العديد من المنتجات الصناعية والنقل ، وكذلك محطات الطاقة الحرارية ، لا يمكن أن تعمل بدون المحركات الحرارية - الأجهزة التي تحول الحرارة إلى عمل مفيد. ومن أمثلة هذه الآلات الضواغط والتوربينات والبخار والبنزين والمحركات النفاثة.
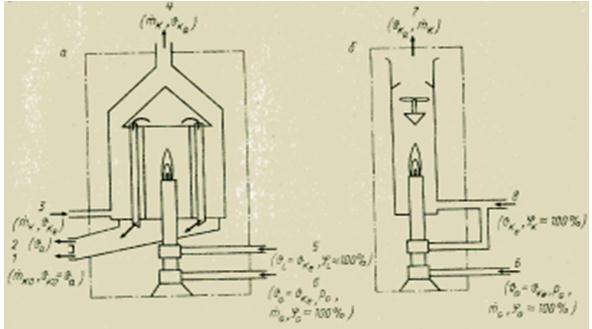
من أشهر المحركات الحرارية التوربينات البخارية ، والتي تنفذ جزءًا من دورة رانكين المستخدمة في محطات الطاقة الحديثة. يظهر رسم تخطيطي مبسط لهذه الدورة في الشكل. 9. يتم تحويل الماء السائل العامل إلى بخار شديد التسخين في غلاية بخارية يتم تسخينها عن طريق حرق الوقود الأحفوري (الفحم أو الزيت أو الغاز الطبيعي). بخار ضغط مرتفعيقوم بتدوير عمود التوربينات البخارية ، والذي يقوم بتشغيل المولد الذي يولد الكهرباء. يتكثف بخار العادم عند تبريده بالماء الجاري ، والذي يمتص بعض الحرارة غير المستخدمة في دورة رانكين. بعد ذلك ، يتم تغذية الماء في برج التبريد (برج التبريد) ، حيث يتم إطلاق جزء من الحرارة في الغلاف الجوي. يتم إرجاع المكثف إلى غلاية البخار بواسطة مضخة ، وتتكرر الدورة بأكملها.
توضح جميع العمليات في دورة رانكين مبادئ الديناميكا الحرارية الموضحة أعلاه. على وجه الخصوص ، وفقًا للقانون الثاني ، يجب تبديد جزء من الطاقة التي تستهلكها محطة الطاقة في البيئة على شكل حرارة. اتضح أن حوالي 68٪ من الطاقة الموجودة أصلاً في الوقود الأحفوري تُفقد بهذه الطريقة. لا يمكن تحقيق زيادة ملحوظة في كفاءة محطة توليد الطاقة إلا من خلال رفع درجة حرارة غلاية البخار (التي تحدها مقاومة المواد للحرارة) أو عن طريق خفض درجة حرارة الوسط الذي تذهب إليه الحرارة ، أي أَجواء.
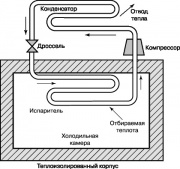
دورة ديناميكية حرارية أخرى لها أهمية عظيمةفي منطقتنا الحياة اليومية، هي دورة تبريد ضاغط بخار رانكين ، ويظهر مخططها في الشكل. 10. في الثلاجات ومكيفات الهواء المنزلية ، يتم توفير الطاقة من الخارج لتوفيرها. يعمل الضاغط على زيادة درجة حرارة وضغط مادة عمل الثلاجة الفريون أو الأمونيا أو ثاني أكسيد الكربون. يتم إدخال الغاز المسخن في المكثف ، حيث يبرد ويتكثف ، مما يعطي حرارة للبيئة. يمر السائل الذي يخرج من فوهات المكثف عبر صمام الاختناق إلى المبخر ، ويتبخر جزء منه ، ويصاحب ذلك انخفاض حاد في درجة الحرارة. يأخذ المبخر الحرارة من حجرة الثلاجة ، مما يؤدي إلى تسخين سائل العمل في الفتحات ؛ يتم توفير هذا السائل بواسطة الضاغط للمكثف ، وتتكرر الدورة مرة أخرى.
دورة التبريد الموضحة في الشكل. يمكن أيضًا استخدام 10 في مضخة حرارية. تضخ هذه المضخات الحرارية في الصيف حرارة الهواء الساخن وتكييف الغرفة ، وفي الشتاء ، على العكس من ذلك ، فإنها تأخذ الحرارة من الهواء البارد وتسخن الغرفة.
التفاعلات النووية هي مصدر مهم للحرارة لأغراض مثل توليد الطاقة والنقل. في عام 1905 ، أظهر أ. أينشتاين أن الكتلة والطاقة يرتبطان بالعلاقة
E = mc2 ، بمعنى آخر. يمكن أن تنتقل إلى بعضها البعض. سرعة الضوء ج كبير جدا: 300 الف كم/ مع. هذا يعني أنه حتى كمية صغيرة من المادة يمكن أن توفر كمية هائلة من الطاقة. لذلك ، من 1 كجم من المواد الانشطارية (على سبيل المثال ، اليورانيوم) ، من الممكن نظريًا الحصول على الطاقة ، والتي يتم توفيرها لمدة 1000 يوم من التشغيل المستمر بواسطة محطة طاقة بسعة 1 ميجاوات. أنظر أيضاهيكل الذرة تكنولوجيا الأفران والأفران؛ الاشعاع الكهرومغناطيسي؛مبادل حراري؛ عنفة؛ وحدات قياس الكميات الفيزيائية.المؤلفات زيمانسكي م. درجات حرارة عالية جدا ومنخفضة جدا. م ، 1968بول ر. الميكانيكا والصوتيات وعقيدة الحرارة. م ، 1971
Smorodinsky Ya.A. درجة الحرارة. م ، 1981
فان ج. الآلات والطاقة والانتروبيا. م ، 1986
أتكينز ب. النظام والفوضى في الطبيعة.م ، 1987
المسعرات السائلة
هذا النوع من المسعرات ، الأكثر استخدامًا في التكنولوجيا ، بسيط في التصميم وسهل الصيانة. يتم أولاً نقل كمية الحرارة الناتجة عن تفاعل مستحث خارجيًا إلى وعاء التفاعل (الذي حدث فيه التفاعل) ثم إلى الحمام السائل. يتم تحريك السائل الموجود في الحمام باستمرار عن طريق دافع أو برغي رفع أو مضخات ، مما يسرع من معادلة درجات الحرارة. الحمام معزول حرارياً (محمي) عن البيئة قدر الإمكان. تغيير درجة حرارة الحمام السائل هو مقياس لكمية الحرارة المكتشفة. يجب ألا تكون السعة الحرارية للكتل المراد تسخينها عالية جدًا من أجل ضمان تغيير كافٍ في درجة الحرارة وحتى لا تستمر عملية القياس لفترة طويلة (بسبب زيادة فقد الحرارة).
جهاز قياس المسعر السائل.
مع المتطلبات العالية لثبات الظروف المحيطة ، من الممكن وضع المسعر بالكامل في حمام آخر وتثبيت درجة الحرارة فيه بدقة عالية باستخدام حلقة تحكم. هذا ضروري في المقام الأول في الحالات التي يكون فيها مطلوبًا لإجراء تجربة في درجات حرارة تختلف اختلافًا كبيرًا عن درجة الحرارة المحيطة.
للتحليل في درجات حرارة منخفضة (حتى حوالي -150 درجة مئوية) ، يتم استخدام النيتروجين السائل كوسيط تبريد. في هذه الحالة ، من الضروري الانتباه إلى حقيقة أنه عند تغييرها ، لا يترسب الصقيع من الهواء الرطب المحيط على العينات أو أوعية العينات ، حيث يمكن أن تؤثر طبقتها على عملية القياس. لتجنب ذلك ، عندما يكون المسعر مفتوحًا ، يتم تطهير العينة وحاوية العينة بغاز النيتروجين البارد.
مسعرات الجسم المعدني
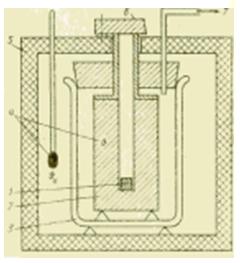
مخطط الشكل لجهاز مسعر معدني.
إذا كان مطلوبًا إجراء دراسات المسعرات في نطاق درجة حرارة أوسع ، فإن المسعرات السائلة لم تعد مناسبة. في المسعرات ذات الجسم المعدني المناسبة لهذا الغرض ، يتم امتصاص كمية الحرارة المنقولة بواسطة كتلة معدنية (الفضة والنحاس والألمنيوم) والتي تكون عادة في درجة حرارة الغرفة. تم تصميم هذا المسعر بشكل أساسي لتحديد السعة الحرارية النوعية c ، J / (kg * K) ، والمواد السائلة والصلبة.
يتم تبريد العينة أولاً خارج المسعر مصنع التبريدأو تسخينها في فرن ، وبعد الوصول إلى حالة مستقرة ، يتم إنزالها (إسقاطها) في حفرة في كتلة معدنية. وفقًا لطريقة التشغيل ، يُطلق على هذا الجهاز مقياس السقوط الحر ، ووفقًا لطبيعة العمليات الديناميكية الحرارية فيه ، يُسمى أحيانًا مقياس الإزاحة.
كمية الحرارة المنقولة أثناء هذا الخلط من العينة (مع المعلمات m1 ، c1 ،) إلى الكتلة المعدنية (m2 ، c2 ،) تسبب تغيرًا ملموسًا في درجة حرارة الكتلة. هذا يجعل من الممكن تحديد القيمة غير المعروفة عادة للسعة الحرارية المحددة للعينة الظروف المثالية(في حالة عدم وجود التبادل الحراري مع البيئة) من التعبير:
توجد الكتلة المعدنية نفسها في وعاء ديوار الذي تم إخلاؤه ، وأحيانًا في حمام سائل. في الحالة الأخيرة ، للحصول على السعة الحرارية للمسعر Ck ، يجب إضافة السعة الحرارية للحمام Cw إلى السعة الحرارية للكتلة المعدنية C2:
CK = C2 + CW = c2m2 + cWmW.
طرق قياس السعرات الحرارية
في أغلب الأحيان ، يتم استخدام المسعرات في وضع الظروف البيئية الثابتة. ينطبق هذا بشكل أساسي على معظم مسعرات الاحتراق ، حيث يكون وقت التفاعل قصيرًا جدًا. وبينما تتغير درجة حرارة الأجزاء الداخلية من المسعر بسبب التفاعل ، تظل درجة حرارة الهواء المحيط ثابتة. وفي كثير من الحالات ، يكون الحمام الذي يتم التحكم في درجة حرارته تستخدم كبيئة لتجنب التأثير على القيمة المقاسة للتداخل الخارجي - تقلبات درجات الحرارة في الغرفة ، والإشعاع ، والمسودات ، إلخ.
تتمثل ميزة نظام القياس هذا في التكلفة المنخفضة نسبيًا للمعدات ، والتي يمكن استخدامها لأداء الجزء السائد من القياسات المسعرية. يجب اعتبار العيب الرئيسي هو التبادل الحراري للمسعر مع البيئة ، مما يعقد تفسير النتائج. تسمى طريقة القياس هذه دائمًا بـ isoperibol (الإنفاذ الحراري). على أي حال ، لا يمكن تسميته متساوي الحرارة ، يكمن جوهره في حقيقة أن درجة حرارة المسعر تظل ثابتة أثناء مسار التفاعل ، على سبيل المثال ، المسعرات المصممة لقياس تحولات الطور.
طريقة ثابت الحرارة
إذا كان من الممكن استبعاد التبادل الحراري مع البيئة ، أي لضمان المسار الثابت للعملية ، فسيتم تبسيط التجربة وتفسير النتائج ، وتكون نتيجة القياس أكثر دقة ، حيث لا توجد حاجة للتسجيل المستمر التغيرات في درجات الحرارة وحساب التصحيحات. بالإضافة إلى ذلك ، في هذه الحالة ، يمكن تحمل ارتفاع أكبر إلى حد ما في درجة الحرارة في وعاء المسعر ؛ بالنسبة للأجهزة غير الثابتة الحرارة ، فهذا غير مقبول بسبب زيادة فقد الحرارة.
لتجنب التبادل الحراري بين وعاء المسعر ومحيطه المباشر (عادةً الحمام السائل) ، يجب تصحيح درجة حرارة الحمام باستمرار وفقًا لتغيرات درجة الحرارة داخل الوعاء. بمساعدة منظم إلكتروني (دائرة تتبع) ، من الممكن الحفاظ باستمرار على فرق درجات الحرارة هذه بما يعادل الصفر تقريبًا. هذا يزيد من تكلفة معدات القياس اعتمادًا على دقة القياس المطلوبة.
يجب أن تكون عناصر الأجهزة سريعة ومستقرة لفترة طويلة (بأقل قدر من الانجراف). يجب أن تكون المنطقة الميتة في حلقة التحكم في التتبع في النطاق من ± 10-3 إلى ± 10-5 K. كأجهزة قياس ، يمكنك استخدام أي موازين حرارة تلامسية كهربائية سريعة الاستجابة ، والتي ، عند تضمينها في دائرة الجسر ، تعطي دافع لوحدة التحكم لتغيير طاقة التسخين. يتم التسخين إما عن طريق ملف مقاومة كهربائية أو مباشرة في حمام سائل ، والذي يعمل كمقاوم تسخين بسبب ضعف التفكك (ما يسمى بالتسخين الإلكتروليتي). هذه الطريقة الثانية هي عمليا بالقصور الذاتي. يمكن الحصول على النتيجة باستخدام الوسائل الموجودة بالفعل لقياس درجة الحرارة الكهربائية أو باستخدام مقياس حرارة سائل مركب بشكل إضافي (بيكمان).
طريقة قياس الحرارة مناسبة لدراسة العمليات البطيئة والتأثيرات الحرارية بشكل أساسي. مع التغيرات السريعة في كمية الحرارة (في مسعرات الاحتراق) ، فإن القصور الذاتي في معادلة درجة الحرارة له تأثير غير مواتٍ لدرجة أنه حتى دقة الطرق التقليدية غير الثابتة الحرارة لا تتحقق. ومع ذلك ، من خلال توفير سعة حرارية منخفضة لعناصر التسخين وأجهزة استشعار درجة الحرارة والخلط المكثف لسائل الحمام ، من الممكن الحصول على قيم صغيرة لثوابت زمنية مختلفة (تقليل القصور الذاتي).
طريقة التعويض
باستخدام المسعرات التفاضلية أو المزدوجة بناءً على مبدأ التعويض ، من الممكن إزالة التأثيرات الخارجية إلى حد كبير على عملية القياس. يتم وضع وعاءين متطابقين مع ملحقات متطابقة في بيئة تحت نفس الظروف. في أحد الأوعية ، تحدث العملية التي تم فحصها ذات التأثير الحراري ، ويتم تسخين الوعاء الآخر بمساعدة نظام تحكم مؤازر بطريقة تجعل فقدان الحرارة في البيئة لكلا السفينتين هو نفسه. لذلك ، يمكن وضع طاقة تسخين الإدخال في تناسب مباشر مع كمية الحرارة المنبعثة أثناء العملية قيد الدراسة. في هذه الحالة ، تنتقل المهمة التجريبية للقياس إلى منطقة أخرى ويتم تقليلها إلى تحديد دقيق للغاية لقدرة التسخين الكهربائي المزودة (W * s ، J):
يتم استخدام المسعر التفاضلي ، على وجه الخصوص ، في ظل الظروف المحيطة الحافظة للحرارة ، خاصةً عندما يكون من المتوقع حدوث تغييرات صغيرة جدًا أو بطيئة جدًا في كمية الحرارة. في العمليات الماصة للحرارة ، يكفي وجود وعاء مسعر واحد. يتم التحكم في مدخلات الحرارة بحيث تظل درجة الحرارة في الوعاء كما هي طوال الوقت (طريقة متساوية الحرارة). عيب المسعرات التفاضلية هو التكلفة العالية للمعدات وأدوات القياس.
مقاييس الاحتراق
يتم فحص الوقود المستخدم في منشآت الطاقة والحرارة لتحديد قيمته الحرارية H (J / kg). هذا المؤشر ضروري لتحديد عوامل الكفاءة ، ودراسة الكفاءة وحساب الطاقة المستهلكة في التركيبات المختلفة ، وكذلك للتحكم الأمثل في عملية الاحتراق. غالبًا ما تتطلب التقلبات الكبيرة في تكوين المكونات القابلة للاحتراق تحديدًا مستمرًا للقيمة الحرارية.
عندما يتم حرق مادة ما تمامًا ، يتم إطلاق قدر معين من الحرارة Q (حرارة الاحتراق). إذا قسمناه على الكتلة m (أو بالحجم تحت الظروف العادية Vn) ، نحصل على حرارة الاحتراق (المحددة):
اعتمادًا على حالة منتجات الاحتراق ، يتم تمييز نوعين من القيمة الحرارية: أعلى H0 و H أقل ، والتي تسمى أيضًا حرارة الاحتراق والقيمة الحرارية. عند تحديد القيمة الحرارية الصافية لـ Ni ، تشكل الماء أثناء تفاعلات كيميائيةيجب أن يكون في حالة بخار. الفرق بين كلتا درجات الحرارة H0 - Ni يتوافق مع حرارة تبخير الماء المكثف (مؤشر KO - المكثف) r ، والذي يساوي 2.441 MJ / kg.
بالنسبة للوقود الصلب والسائل ، يمكن تحديد كمية الماء الناتجة على أساس التحليل الأولي ، وعند حرق الوقود الغازي ، عن طريق قياس كمية المكثفات.
في الأفران الصناعية ، تتجاوز درجة حرارة منتجات الاحتراق دائمًا درجة غليان الماء. لذلك ، فإن القيمة الحرارية الصافية فقط هي التي تهم عادة ، حيث لا يمكن استخدام حرارة تكثيف الماء.
مسعر الاحتراق للمواد الصلبة والسوائل
لعمليات الاحتراق السريع ، تم تطوير شكل خاص من مقياس المسعر السائل - ما يسمى بقنبلة Berthelot Calorimetric (الشكل 3).
الشكل جهاز القنبلة المسعرية.
يحدث احتراق كمية صغيرة ومقاسة بدقة من مادة ما بحجم ثابت في قنبلة مختومة في جو من أنقى أكسجين ممكن عند ضغط ~ 30 ضغط جوي (3 ميجا باسكال). يتم وضع القنبلة المملوءة في الحمام السائل في المسعر ، والذي يمتص حرارة الاحتراق المنبعثة.
المواد الصلبةعادة ما يتم ضغطها في قوالب صغيرة (أقراص) ويتم وزنها بدقة شديدة. يُنصح بخلط المواد السيئة الاحتراق مع السوائل المحترقة جيدًا مع حرارة احتراق معروفة (على سبيل المثال ، حمض البنزويك). توضع المواد السائلة في أكواب (قوارب) مصنوعة من البلاتين أو الكوارتز أو في كبسولات بلاستيكية صغيرة. يوجد على الغطاء ، المثبت بجسم القنبلة ، جميع الأجهزة اللازمة للبحث: صمامات لتزويد الأكسجين وإزالة منتجات الاحتراق ، وحاملات العينات ، وجهاز إشعال كهربائي. يتم الاشتعال عن طريق إمداد سلك بلاتيني رقيق بالكهرباء. يجب قياس الحرارة الموفرة للاشتعال بدقة بحيث يمكن أخذها في الاعتبار عند فك شفرة نتائج التجربة. يتم تحديد أعلى قيمة حرارية في القنبلة المسعرية H0. أثناء التحقق ، يتم تحديد المكافئ الحراري للمُسعر الكوني بحرق مادة مرجعية (على سبيل المثال ، حمض البنزويك) أو باستخدام جهاز تسخين كهربائي.
مسعر الاحتراق للمواد الغازية
لتحديد حرارة احتراق الوسائط الغازية ، هناك طرق مختلفة. كل منهم ، على عكس القنبلة المسعرية للمواد الصلبة والسائلة ، تعتمد على القياس المستمر. مبدأ القياس المستخدم بسيط للغاية. يتم حرق غاز الاختبار باستمرار في موقد تحت ضغط مستمر. يتم امتصاص كل الحرارة المنبعثة أثناء الاحتراق إما عن طريق تدفق وسط التبريد في المبادل الحراري (المسعر الرطب أو مسعر التبادل الحراري) ، أو عن طريق خلط منتجات الاحتراق مع تدفق الهواء بمعدل تدفق معروف (مسعر جاف أو مختلط). عادة تحديد صافي القيمة الحرارية هو جين تاو. لتحديد القيمة الحرارية الإجمالية H0 ، من الضروري تكثيف بخار الماء (مؤشر KO) الموجود في غازات المداخن. معرفة معدلات تدفق الكتلة وفرق درجة الحرارة عند المدخل (الفهرس e) والمخرج (الفهرس أ) من المسعر ، من الممكن حساب القيمة الحرارية المقابلة باستخدام معادلة توازن الحرارة.
معالجة الغاز المطلوبة هي نفسها بشكل أساسي في جميع المسعرات الغازية. قبل الاحتراق ، يتم تنظيف الغاز (المؤشر G) أولاً من الشوائب الميكانيكية الصلبة (في المرشح) وترطيبه (حتى التشبع بالرطوبة ، 100٪) ، ثم يتم إحضاره إلى القيم المحددة للضغط الأولي (باستخدام خفض الضغط صمام) ودرجة حرارة وسط التبريد (مؤشر K). يتم أيضًا ترطيب الهواء المطلوب للاحتراق (الفهرس L) ونقله إلى درجة حرارة وسط التبريد.
اعتمادًا على الدقة المطلوبة وتكاليف الأجهزة المسموح بها ، قد لا يتم استيفاء بعض هذه الشروط. يجب التحقق من المسعرات باستخدام غاز مرجعي (مثل الهيدروجين) لتحديد الانحراف عن المعادلة للحالة المثالية للمسعر. بالنسبة لمسعر التبادل الحراري (الرطب) ، فإن المعادلة أعلاه لها الشكل
أين و هي معدلات التدفق الكتلي لوسط التبريد والوقود ، كجم / ث ؛ sk - السعة الحرارية النوعية لوسط التبريد ، J / (kg * K) ؛ - زيادة درجة حرارة وسط التبريد K.
الشكل جهاز من المسعرات الرطبة (أ) والجافة (ب) للوقود الغازي.
عادةً ما يكون ارتفاع درجة الحرارة من 5 إلى 15 كلفن نظرًا للكتلة الحرارية الكبيرة ، فإن مسعرات نقل الحرارة لها ثابت وقت طويل جدًا ، والذي يمكن أن يصل إلى عدة دقائق. لذلك ، فهي أقل ملاءمة للاستخدام في حلقة تحكم مغلقة كمستشعر من المسعرات الجافة (المزج) ، التي لا يتجاوز وقتها الثابت بضع ثوانٍ. من ناحية أخرى ، فإن الدقة التي يمكن تحقيقها لمقاييس التبادل الحراري عالية نسبيًا. لا يتجاوز خطأهم ± 0.25-1٪ ، لذا يمكن استخدامها أيضًا في العمل المخبري وللتحقق. المسعرات الجافة (الخلط) لها خطأ ± 1 إلى ± 2٪ من الحد الأعلى لنطاق القياس.
تختلف إصدارات تصميم المسعرات من مختلف الشركات المصنعة بشكل أساسي في الأجهزة المساعدة والسلامة وعناصر الاستشعار والدوائر الحسابية التي توفر تعويضًا عن الخطأ. وبالتالي ، في المسعرات الحرارية للتبادل الحراري ، يتم الحفاظ على نسبة الغاز ومعدلات التدفق المتوسط للتبريد بطرق مختلفة (انظر معادلة المسعر أعلاه) ، نظرًا لأن القيمة الحرارية العالية H0 تعتمد بشكل مباشر فقط على زيادة درجة الحرارة.
في المسعرات الجافة ، يتم قياس ارتفاع درجة الحرارة إما بشكل مباشر باستخدام موازين الحرارة الملامسة الكهربائية أو بشكل غير مباشر باستخدام مستشعر قياس التوسيع ، وهو أنبوب تمدد يقع في تيار غاز العادم. في المسعر ADOS ، يتوافق الاستطالة الحرارية لأنبوب مقياس التوسيع مباشرة مع حرارة الاحتراق ويمكن تحويلها إلى أي إشارة باستخدام وصلة ومقياس طول. في مسعر Reinecke ، يتم استخدام امتداد القضيب كإشارة قياس في دائرة تحكم تتحكم في تدفق هواء التبريد بحيث يظل ارتفاع درجة حرارته ثابتًا تقريبًا. في هذه الحالة ، تكون حلقة التحكم متناسبة تمامًا ، ولكن لا مفر من وجود بعض الانحراف المتبقي فيها. في هذه الحالة ، يعتبر استهلاك هواء التبريد أو استطالة أنبوب القياس (القضيب) مقياسًا للقيمة الحرارية المحددة. من المتطلبات الأساسية للحصول على دقة كافية في جميع المسعرات الجافة الخلط الجيد لهواء التبريد ومنتجات الاحتراق.
قياسات تدفق الحرارة
يتم نقل الحرارة كنوع من الطاقة بثلاث طرق: من خلال الجسم الصلب (التوصيل الحراري) ، أو الوسائط السائلة أو الغازية (الحمل الحراري) وبدون مشاركة المادة (الإشعاع). في التكنولوجيا ، تشارك جميع المكونات الثلاثة دائمًا في نقل الحرارة ؛ ومع ذلك ، في كثير من الحالات يمكن الحصول على نتائج دقة مقبولة بقياس مكون واحد فقط.
قياس تدفق الحرارةمع التوصيل الحراري
يعتبر نقل الحرارة عبر الجدران الموصلة للحرارة ذا أهمية كبيرة في العديد من مجالات التكنولوجيا (المبادلات الحرارية بجميع أنواعها ، العزل الحراري ، إلخ). في الوقت نفسه ، لا يهم التحكم الحالي بكميات الإنتاج بقدر ما هو مهم ، ولكن نتائج القياسات الفردية المستخدمة لتقييم الحمل ، والتحقق من استيفاء المؤشرات والكفاءة المضمونة.
وفقًا لقوانين التوصيل الحراري الثابت ، يتم تحديد تدفق الحرارة بالصيغ التالية (J / s):
نظرًا لأن التوصيل الحراري للجدار [J / (m * s * K)] وأبعاده الهندسية معروفة ، يتم تقليل قياس التدفق الحراري إلى قياس فرق درجة الحرارة. ومع ذلك ، تتطلب هذه التقنية تحديدًا دقيقًا للغاية لدرجات حرارة السطح. يمكن أن تكون الأخطاء المرتبطة بالتغيرات في ظروف نقل الحرارة عند تركيب عناصر حساسة لدرجة الحرارة على الأسطح كبيرة جدًا. لذلك ، للحصول على قياسات أكثر دقة ، يوصى بالطرق التالية ، حيث يتم استخدام كل من التوصيل الحراري ونقل الحرارة في وقت واحد.
قياس التدفقات الحرارية في انتقال الحرارة (انتقال الحرارة مقترنًا بالتوصيل الحراري)
بالنسبة للجدار المسطح المذكور في القسم السابق ، فإن قانون نقل الحرارة التالي (J / s) ساري المفعول:
![]() ,
,
حيث في معامل نقل الحرارة k 1J / (m2 * s * K)] ، جنبًا إلى جنب مع معامل نقل الحرارة [J / Dm * s * K)] ، ومعاملات نقل الحرارة و [J / (m2 * s * K) ] من جانبي الجدار أيضًا.
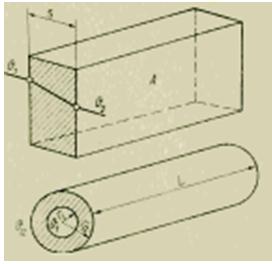
على جدار مسطح يمر من خلاله تدفق الحرارة المقاس ، يتم وضع صفيحة رفيعة صغيرة ، يتم تحديد درجة حرارة سطحها بواسطة مزدوجات حرارية مدمجة من الأغشية الرقيقة. تتمثل ميزة القياس بهذه الطريقة في أنه لا يتطلب معرفة الخصائص الحرارية للجدار ، ويمكن تقليل الخصائص المقابلة للوحة إلى قيمة ثابتة واحدة أثناء المعايرة. يبلغ حجم هذه العناصر الحساسة حوالي 30x30x0.5 مم ؛ نطاق القياس يغطي التدفقات الحرارية من 10 إلى 100000 واط / م 2 ؛ الخطأ هو 2-5٪.
الشكل مبدأ تشغيل مقياس تدفق الحرارة.
مع تحسين طريقة القياس هذه ، يتم استخدام الحصائر المطاطية بدلاً من اللوح المتراكب. من خلال لصقها على الأسطح غير المستوية أو لفها حول سطح منحني ، من الممكن تحديد انتقال الحرارة من سطح مساحة كبيرة نسبيًا ، على سبيل المثال ، من أنبوب أو وعاء ، إلخ. الحصيرة بحيث تقع التقاطعات الساخنة والباردة بينهما بالضبط مقابل الأخرى (الشكل 6). وفي هذه الحالة ، تتناسب كثافة تدفق الحرارة وفقًا للمعايرة مع اختلاف درجة الحرارة. ومع ذلك ، فإن الحصائر المطبقة تعطل إلى حد ما انتقال الحرارة الأولي ، والتي تصبح ملحوظة بقياسات دقيقة. لذلك ، تُستخدم طريقة القياس هذه بشكل أساسي لتحديد الثوابت الديناميكية الحرارية لمادة ، عندما لا يؤثر انتهاك تدفق الحرارة على نتيجة القياس.
قياس التدفقات الحرارية في البيئات الحالية.
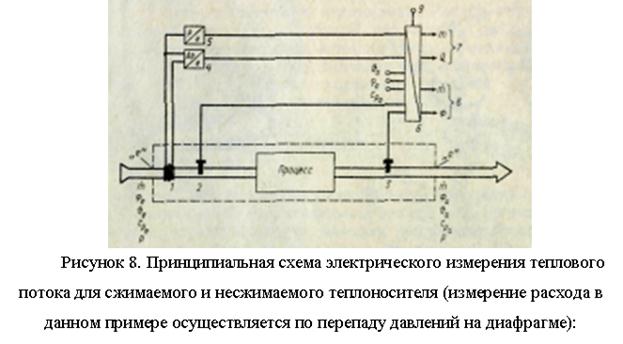
يتم نقل جزء كبير من الطاقة الحرارية عن طريق وسائط سائلة أو غازية (ماء ، بخار ، إلخ) تتحرك في شبكة خطوط أنابيب مغلقة. ومع ذلك ، بالمقارنة مع نقل الطاقة الكهربائية عن طريق الأسلاك ، فإن المسافة التي يمكن أن تنتقل عبرها الطاقة الحرارية محدودة. للدراسات الحرارية لجميع أنواع أنظمة التدفئة والتبريد ، من الضروري قياس إطلاق واستهلاك الحرارة.
تدفق الحرارة F (J / s) ، الذي ينتقل عن طريق تدفق الناقل الحراري المتوسط (kg / s) عبر قسم التحكم مع المنطقة A (m2) في منطقة معينة ، والتي يتم تجميع توازن الحرارة من أجلها (في منطقة المعالجة ، الشكل 7) ، تساوي
يتم تحديد كمية الحرارة المنبعثة خلال الفترة الزمنية t2 - t1 على أنها جزء لا يتجزأ (J):
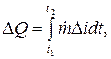
أين هو الاختلاف في المحتوى الحراري (المحتوى الحراري ، J / كجم) لسائل التبريد عند المدخل (الفهرس e) وعند مخرج (الفهرس أ) لمنطقة التوازن الحراري.
نظرًا لأنه ، في الحالة العامة ، تكون قيمة المحتوى الحراري ذات أهمية فقط بالمقارنة مع مستوى معين ، على سبيل المثال ، مع المحتوى الحراري عند درجة الحرارة المحيطة ، فإن جميع قياسات تدفقات الحرارة هي في الأساس قياسات فرق.
يمكن التعبير عن المحتوى الحراري الفردي المتضمن في المعادلة العامة من حيث درجات الحرارة المقابلة والقدرات الحرارية المحددة ؛
وبالتالي ، يتم تقليل قياس التدفق الحراري بشكل مباشر إلى قياس درجات الحرارة ومعدلات تدفق الكتلة. في كثير من الحالات ، لا يتم قياس الكتلة ، ولكن حجم تدفق المبرد ؛ في هذه الحالة ، ستختلف النتيجة التي تم الحصول عليها فقط من خلال قيمة كثافة سائل التبريد ص. السعات الحرارية المحددة ، ci ، هي نفسها وظائف لدرجة الحرارة. ومع ذلك ، نظرًا للنطاق الضيق للقياس للعديد من الأدوات ، يمكن عادةً اعتبارها قيمًا ثابتة دون فقد كبير في الدقة. يجب معرفة السعة الحرارية النوعية. بالنسبة للسوائل ، تكون معادلة التدفق الحراري أكثر بساطة ، حيث إنها القدرات الحرارية المحددةلا تعتمد على الضغط:
![]() ، J / s.
، J / s.
في جميع المعادلات من هذا النوع ، من الضروري مراعاة علامات الكميات اعتمادًا على ما إذا كان يتم توفير الحرارة أو إزالتها ، سواء كانت العملية ماصة للحرارة أو طاردة للحرارة ، سواء حدث التبريد أو التسخين.
