السعة الحرارية لكبريتيد الهيدروجين في درجات حرارة مختلفة. السعة الحرارية النوعية للغاز الطبيعي
ليست القدرة الحرارية الكلية محددة ، بالمعنى المادي المقبول عمومًا ، هي قدرة المادة على التسخين. على الأقل هذا ما يخبرنا به أي كتاب مدرسي عن الفيزياء الحرارية - هذا هو التعريف الكلاسيكيالسعة الحرارية(صياغة صحيحة). في الواقع ، هذه ميزة جسدية مثيرة للاهتمام. غير معروف لنا في الحياة اليومية "جانب العملة". اتضح أنه عندما يتم توفير الحرارة من الخارج (التسخين ، التسخين) ، لا تتفاعل جميع المواد بالتساوي مع الحرارة ( طاقة حرارية) وتسخين بشكل مختلف. قدرة يستخدم الغاز الطبيعي المصدر كوقودتلقي واستقبال وحفظ وتجميع (تراكم) الطاقة الحرارية تسمى السعة الحرارية للغاز الطبيعي القابل للاحتراق. ونفسها السعة الحرارية للميثان، هي خاصية فيزيائية تصف الخصائص الفيزيائية الحرارية لوقود الغاز. في الوقت نفسه ، في جوانب تطبيقية مختلفة ، اعتمادًا على حالة عملية محددة ، قد يكون هناك شيء واحد مهم بالنسبة لنا. على سبيل المثال: قدرة المادة على تناولها دافيءأو القدرة على التراكم طاقة حراريةأو "الموهبة" للحفاظ عليها. ومع ذلك ، على الرغم من بعض الاختلاف ، بالمعنى المادي ، سيتم وصف الخصائص التي نحتاجها السعة الحرارية للميثان.
هناك عقبة صغيرة ولكنها "سيئة للغاية" ذات طبيعة أساسية وهي القدرة على التسخين - السعة الحرارية للميثان، لا يرتبط ارتباطًا مباشرًا بـ التركيب الكيميائي، التركيب الجزيئي للمادة ، ولكن أيضًا بكميتها (الوزن ، الكتلة ، الحجم). بسبب هذا الاتصال "غير السار" الجنرال السعة الحرارية للميثانيصبح خاصية فيزيائية غير ملائمة للمادة. منذ ذلك الحين ، تصف إحدى المعلمات المقاسة في وقت واحد "شيئين مختلفين". وهي: حقا يميز الخصائص الفيزيائية الحرارية للغاز الطبيعي، ومع ذلك ، "بشكل عابر" يأخذ في الاعتبار أيضا كميتها. تشكيل نوع من الخصائص المتكاملة ، حيث يتم ربط الفيزياء الحرارية "العالية" وكمية "عادية" من المادة (في حالتنا: وقود الغاز) تلقائيًا.
حسنًا ، لماذا نحتاج إلى مثل هذه الخصائص الفيزيائية الحرارية ، والتي يتم فيها تتبع "النفس غير الملائمة" بوضوح؟ من وجهة نظر الفيزياء ، المجموع السعة الحرارية للميثان(بأكثر الطرق خرقاء) ، لا يحاول فقط وصف كمية الطاقة الحرارية التي يمكن أن تتراكم في وقود الغاز ، ولكن أيضًا "أخبرنا بالمرور" عن الكمية الغازات الطبيعية القابلة للاحتراق. لقد اتضح أنها سخيفة وليست واضحة ومفهومة ومستقرة وصحيحة الخاصية الحرارية الفيزيائية للميثان. بدلا من ثابت مفيد مناسب للعملي الحسابات الفيزيائية الحرارية، نحصل على معلمة عائمة ، وهي مجموع (متكامل) كمية الحرارة المستلمة غاز طبيعيوكتلته أو حجم الميثان.
شكرا لك بالطبع على هذا "الحماس" ولكن الكمية وقود طبيعييمكنني قياس نفسي. الحصول على النتائج في شكل "بشري" أكثر ملاءمة. كمية الغازات الطبيعية القابلة للاحتراقلا أريد "الاستخراج" بالطرق والحسابات الرياضية باستخدام صيغة معقدة من العام السعة الحرارية للميثان، بدرجات حرارة مختلفة ، لكن اعرف الوزن (الكتلة) بالجرام (g ، g) ، الكيلوجرام (kg) ، الأطنان (الأطنان) ، المكعبات (الأمتار المكعبة ، الأمتار المكعبة ، m3) ، اللتر (اللتر) أو المليلتر (مل) ). خاصة منذ ذلك الحين ناس اذكياءمنذ فترة طويلة توصلنا إلى أدوات قياس مناسبة تمامًا لهذه الأغراض. على سبيل المثال: موازين أو أجهزة أخرى.
خاصة "الطبيعة العائمة المزعجة" للمعامل: عام السعة الحرارية للغاز الطبيعي. "مزاجه" غير المستقر والمتغير. عند تغيير "حجم الحصة أو الجرعة" ، السعة الحرارية للغاز الطبيعي عند درجات حرارة مختلفةيتغير على الفور. خليط غاز أكثر قابلية للاحتراق ، الكمية الفيزيائية ، القيمة المطلقة السعة الحرارية للميثان- يزيد. كمية أقل من خليط الغاز القابل للاحتراق ، القيمة السعة الحرارية للميثانالنقصان. "وصمة عار" اتضح بعض! بعبارة أخرى ، ما "لدينا" لا يمكن بأي حال من الأحوال اعتباره وصفًا ثابتًا الخصائص الفيزيائية الحرارية للغاز الطبيعي عند درجات حرارة مختلفة. ومن المرغوب فيه أن يكون لدينا "معامل" ثابت ومفهوم ومعيار مرجعي يميز الخصائص الحراريةوقود الغاز ، بدون "إشارات" إلى كمية الميثان (الوزن ، الكتلة ، الحجم). ماذا أفعل؟
هذا هو المكان الذي تأتي فيه طريقة بسيطة للغاية ولكنها "علمية للغاية" لإنقاذنا. لا يقتصر الأمر على المأمور فقط "ud. - خاص"، قبل الكمية المادية، ولكن إلى حل أنيق يتضمن استبعاد مقدار المادة من الاعتبار. بطبيعة الحال ، المعلمات "غير المريحة وغير الضرورية": الكتلة أو الحجم الغازات الطبيعية القابلة للاحتراقمن المستحيل تماما استبعاده. على الأقل لسبب أنه إذا لم تكن هناك كمية من الميثان ، فلن يكون هناك "موضوع للنقاش" بحد ذاته. ويجب أن تكون المادة. لذلك ، نختار بعض المعايير الشرطية للكتلة أو الحجم ، والتي يمكن اعتبارها وحدة مناسبة لتحديد قيمة المعامل "C" الذي نحتاجه. إلى عن على وزن وقود الغاز الطبيعي، هذه الوحدة من كتلة الميثان ، المريحة في الاستخدام العملي ، تبين أنها 1 كيلوغرام (كجم).
الآن نحن نقوم بتسخين كيلو جرام من الغاز الطبيعي بدرجة واحدة وكمية الحرارة (طاقة حرارية)نحن بحاجة للتسخين خليط الغازدرجة واحدة - هذه هي المعلمة المادية الصحيحة لدينا ، المعامل "C"، حسنًا ، وصفًا كاملًا وواضحًا لأحد الخصائص الفيزيائية الحرارية للغاز الطبيعي عند درجات حرارة مختلفة. يرجى ملاحظة أننا الآن نتعامل مع وصف مميز خاصية فيزيائيةالجوهر ، ولكن لا تحاول "إبلاغنا بشكل إضافي" عن كميتها. مريح؟ لا توجد كلمات. إنها مسألة مختلفة تمامًا. بالمناسبة ، نحن الآن لا نتحدث عن الجنرال السعة الحرارية للميثان. كل شئ تغير. هذه هي الحرارة المحددة للغاز الطبيعي، والذي يطلق عليه أحيانًا اسم آخر. كيف؟ فقط ضخمة السعة الحرارية للغاز الطبيعي القابل للاحتراق. محددة (ud.) وكتلة (م) - في هذه الحالة: المرادفات ، تعني هنا ما نحتاجه المعامل "C".
الجدول 1. المعامل: السعة الحرارية النوعية للغاز الطبيعي (sp.). القدرة الحرارية الجماعية للغاز الطبيعي القابل للاحتراق. البيانات المرجعية.
ببساطة ، السعة الحرارية منيسمى الجسم بكمية الحرارة التي يجب إنفاقها هذه العمليةلتسخين الجسم بدرجة واحدة:.
يُشار عادةً إلى السعة الحرارية إلى وحدة مقدارها من مادة ما ، واعتمادًا على الوحدة المختارة ، فإنها تميز:
السعة الحرارية للكتلة النوعية مع، يشير إلى 1 كجم من الغاز ، J / (kgK) ؛
السعة الحرارية الحجمية المحددة مع´ ، يشير إلى كمية الغاز الموجودة في 1 م 3 من الحجم في ظل الظروف الفيزيائية العادية ، J / (م 3 كلفن) ؛
السعة الحرارية المولية المحددة μ مع، المشار إليها كيلو مول واحد ، J / (kmolK).
يتم تحديد العلاقة بين السعات الحرارية المحددة من خلال العلاقات الواضحة:
مع= μ مع/μ; مع´= معρ ن. (2.13)
هنا ρ n هي كثافة الغاز في ظل الظروف العادية.
وبالتالي ، فإن التغيير في درجة حرارة الجسم بنفس كمية الحرارة التي يتم توفيرها يعتمد على طبيعة العملية الجارية السعة الحرارية هي إحدى وظائف العملية. هذا يعني أن نفس سائل العمل ، اعتمادًا على العملية ، يتطلب كمية مختلفة من الحرارة لتسخينه بمقدار 1 كلفن. المقدار العددي معيختلف من + إلى - ∞.
في الحسابات الديناميكية الحرارية أهمية عظيمةلديك:
السعة الحرارية عند ضغط ثابت
معع = δ فع / دي تي, (2.14)
ف p ، يتم إحضارها إلى الجسم أثناء العملية بضغط ثابت ، لتغير درجة حرارة الجسم دي تي;
السعة الحرارية في حجم ثابت
مع الخامس = δ ف الخامس /دي تي, (2.15)
يساوي نسبة كمية الحرارة δ ف الخامسجلبت إلى الجسم في هذه العملية بحجم ثابت ، لتغير في درجة حرارة الجسم دي تي.
وفقًا للقانون الأول للديناميكا الحرارية للأنظمة المغلقة δ ف = دو + pdv.
مع الأخذ في الاعتبار حقيقة أن 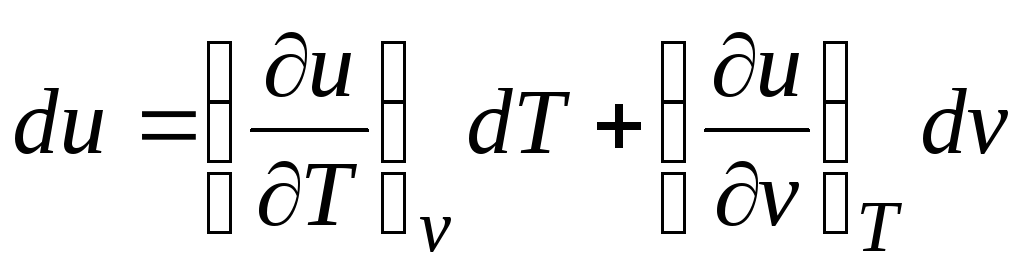 (العلاقات (2.1))
(العلاقات (2.1))
Δ ف = (∂ش/∂تي) الخامس دي تي + [(∂ش/∂الخامس) تي + ص]دي في. (2.16)
لعملية isochoric ( الخامس= const) تأخذ هذه المعادلة الشكل 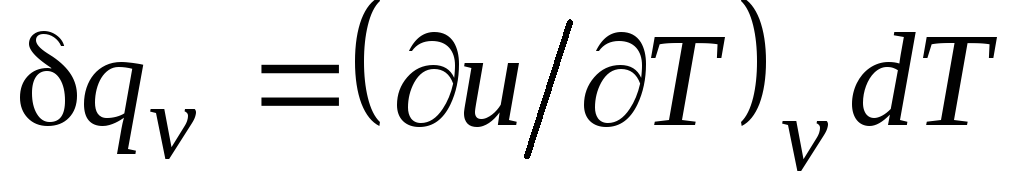 ، ومع مراعاة (2.15) نحصل على ذلك
، ومع مراعاة (2.15) نحصل على ذلك
ج الخامس = (∂ش/∂تي) الخامس . (2.17)
للحصول على غاز مثالي
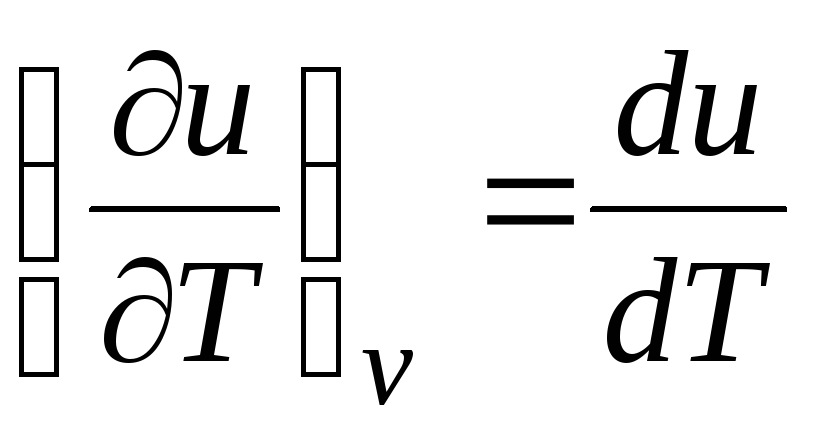 (المعادلة 2.2) ، إذن
(المعادلة 2.2) ، إذن
ج الخامس = دو/دي تي. (2.18)
لعملية متساوية الضغط ( ص= const) من المعادلتين (2.16) و (2.14) نحصل عليها
جع = (∂ ش/∂تي) الخامس + [(∂ش/∂الخامس) تي + ص](دي في/دي تي) ص
منذ الطاقة الداخلية غاز مثالييتم تحديده فقط من خلال درجة حرارته ولا يعتمد على الحجم المحدد ، إذن
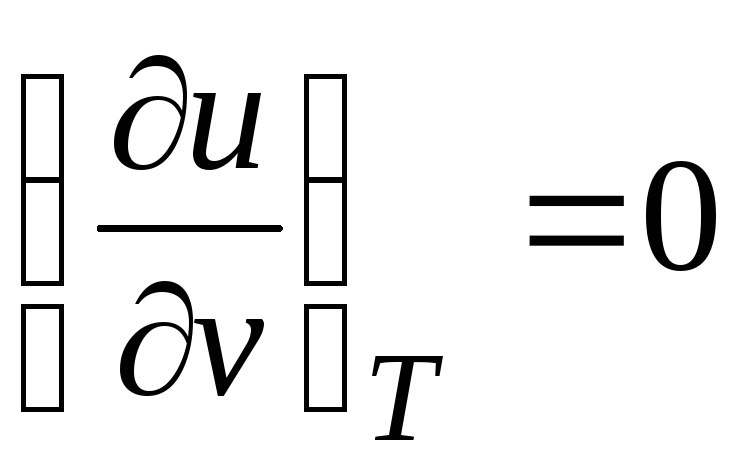 .
(2.19)
.
(2.19)
من معادلة كلابيرون (1.4) الكهروضوئية
= RT(1.3) يتبع 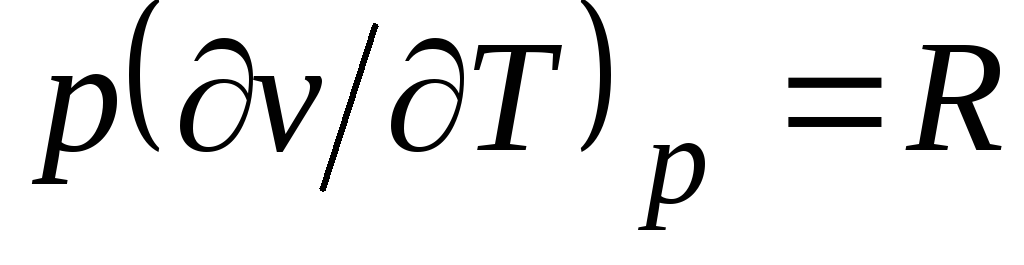 ، أين
، أين
جع = مع الخامس + ص. (2.20)
العلاقة (2.20) تسمى معادلة ماير وهي واحدة من المعادلات الرئيسية في الديناميكا الحرارية التقنية للغازات المثالية.
فى المعالجة الخامس\ u003d const ، فإن الحرارة المنقولة إلى الغاز تذهب فقط لتغيير طاقته الداخلية ، بينما في العملية p \ u003d const ، يتم إنفاق الحرارة لزيادة الطاقة الداخلية وأداء عمل التمدد. لهذا جص أكثر مع v بمقدار هذا العمل.
معادلة ![]() يحدد ما يسمى بالسعة الحرارية الحقيقية ، أي قيمة السعة الحرارية عند درجة حرارة معينة. في الممارسة العملية ، تُستخدم السعة الحرارية على نطاق واسع لحساب كمية الحرارة ف 12 ، والتي يجب إنفاقها لتسخين الجسم من درجة حرارة واحدة ( ر 1) لآخر ( ر 2) (أو التي سيتم إطلاقها عند التبريد من رمن 2 إلى ر 1).
يحدد ما يسمى بالسعة الحرارية الحقيقية ، أي قيمة السعة الحرارية عند درجة حرارة معينة. في الممارسة العملية ، تُستخدم السعة الحرارية على نطاق واسع لحساب كمية الحرارة ف 12 ، والتي يجب إنفاقها لتسخين الجسم من درجة حرارة واحدة ( ر 1) لآخر ( ر 2) (أو التي سيتم إطلاقها عند التبريد من رمن 2 إلى ر 1).
إذا لم تتغير السعة الحرارية في نطاق درجة الحرارة المشار إليه ، فحينئذٍ
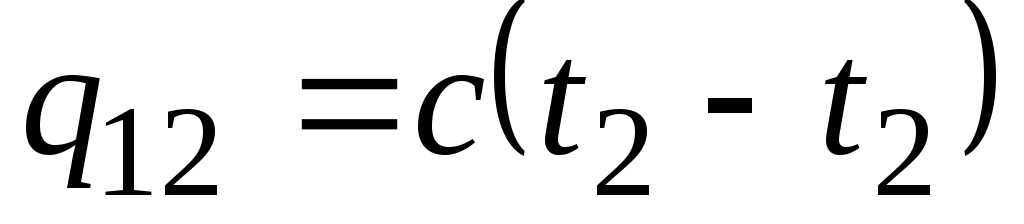 ، كيلوجول / كجم و
، كيلوجول / كجم و 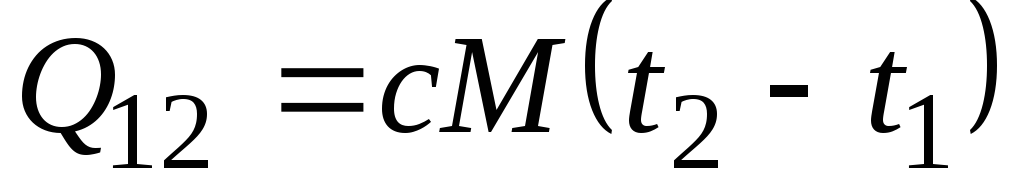 ، كيلوجول. (2.21)
، كيلوجول. (2.21)
يمكن أيضًا استخدام هذه الصيغة لإجراء حسابات تقريبية (ليست دقيقة جدًا). على سبيل المثال ، السعة الحرارية النوعية للماء عند درجة حرارة الغرفة هي 4.187 kJ / (kgC) ، والهواء 1 kJ / (kgC). نظرًا لأن السعة الحرارية لجميع المواد تقريبًا تتغير (تزداد غالبًا) مع زيادة درجة الحرارة ، فمن الضروري ، بالمعنى الدقيق للكلمة ، استخدام الصيغة
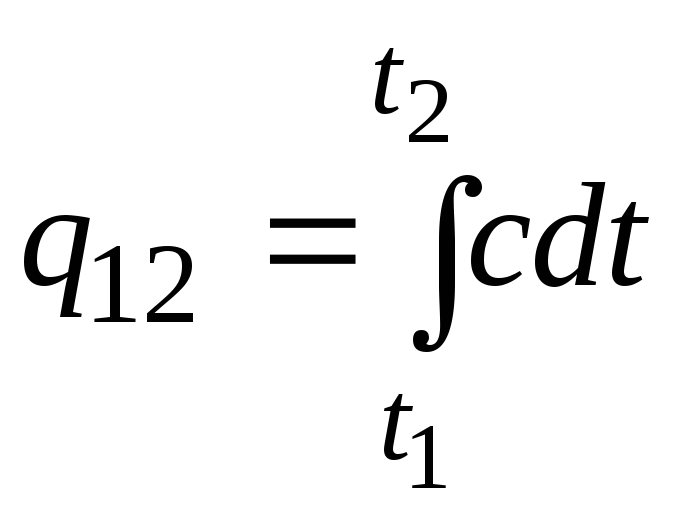 .
(2.21أ)
.
(2.21أ)
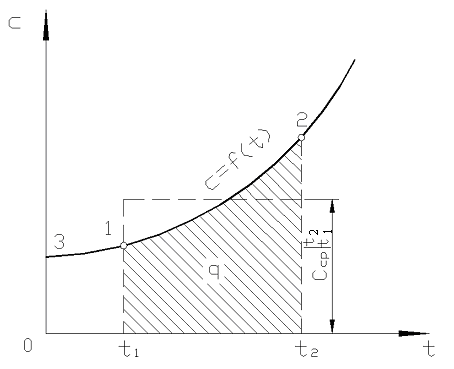
على التين. 2.2 درجة فيتم عرض 12 كمنطقة مظللة. يبدو أن أسهل طريقة لتطبيق نظرية القيمة المتوسطة هي الكتابة
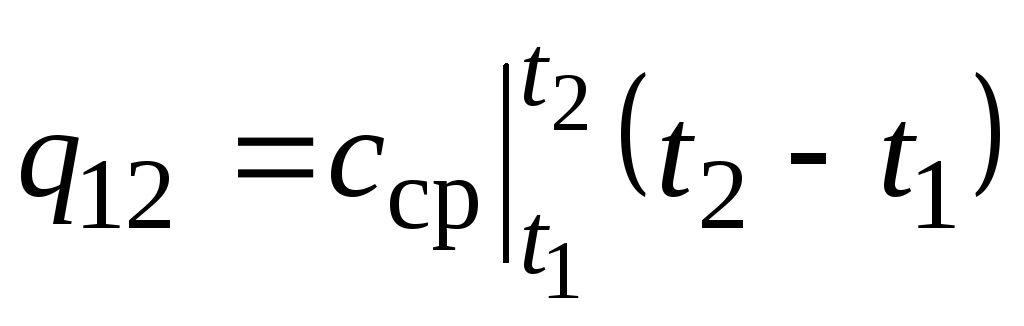 ,
(2.22)
,
(2.22)
أين 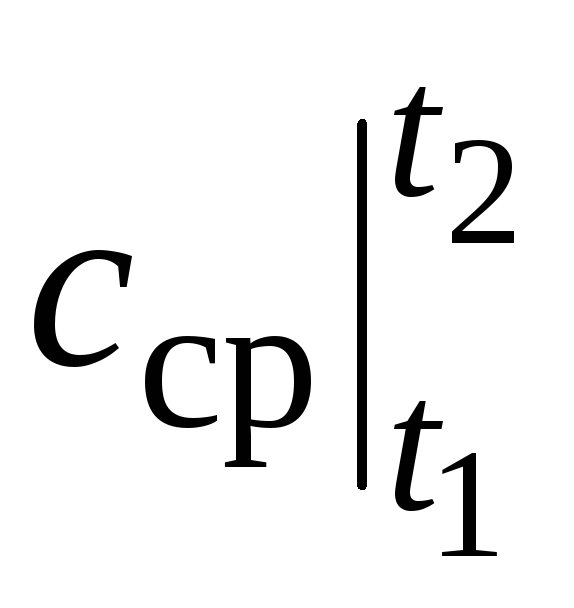 هو متوسط السعة الحرارية في نطاق درجة الحرارة ر 1 …ر 2 .
هو متوسط السعة الحرارية في نطاق درجة الحرارة ر 1 …ر 2 .
أرز. 2.2. اعتماد السعة الحرارية الحقيقية على درجة الحرارة
ومع ذلك ، بالنسبة للحسابات الحقيقية ، فإن مثل هذا الترميز غير مريح للغاية ، حيث يتم اختيار السعة الحرارية من الجداول ، و  يعتمد على الكيفية ر 1 ومن ر 2. سيكون جدول دالة من وسيطتين مرهقًا للغاية.
يعتمد على الكيفية ر 1 ومن ر 2. سيكون جدول دالة من وسيطتين مرهقًا للغاية.
في الممارسة العملية ، تابع ما يلي. يتم تقديم كمية الحرارة المطلوبة على أنها الفرق بين الكميات المطلوبة لتسخين الجسم من 0 درجة مئوية إلى درجات الحرارة ر 2 و ر 1 على التوالي (الشكل 2.2)
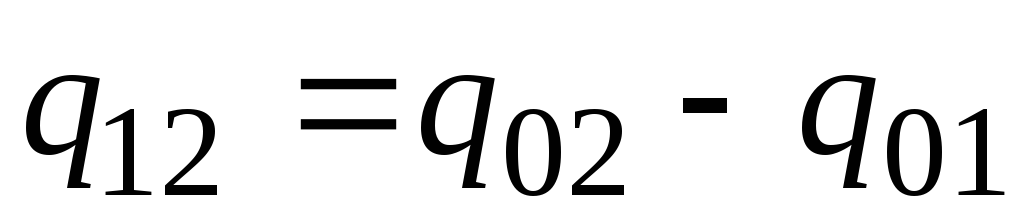 . (2.23)
. (2.23)
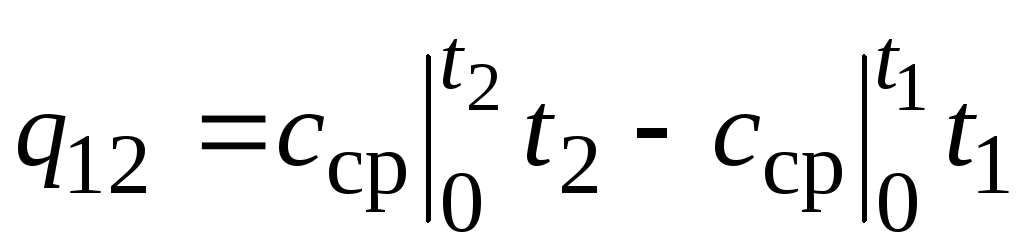 ,
(2.24)
,
(2.24)
أين  - متوسط السعة الحرارية في نطاق درجة الحرارة 0 ... ر ج.
- متوسط السعة الحرارية في نطاق درجة الحرارة 0 ... ر ج.
قيمة متوسط السعة الحرارية  لمادة معينة (وعملية معينة ، أي مع صأو ج الخامس) يعتمد على درجة حرارة واحدة فقط ر. هذه السعات الحرارية هي التي ترد في جميع الجداول تحت اسم "متوسط". ما قيل صحيح ل مع
(مع صو ج الخامس)، وكذلك ل مع و مع. كمثال ، يوضح الجدول أدناه السعة الحرارية مقابل درجة الحرارة لبعض الغازات الأكثر شيوعًا. يجب التأكيد على أنه في الصيغة (2.24) يتم استبدال درجة الحرارة بالدرجات المئوية.
لمادة معينة (وعملية معينة ، أي مع صأو ج الخامس) يعتمد على درجة حرارة واحدة فقط ر. هذه السعات الحرارية هي التي ترد في جميع الجداول تحت اسم "متوسط". ما قيل صحيح ل مع
(مع صو ج الخامس)، وكذلك ل مع و مع. كمثال ، يوضح الجدول أدناه السعة الحرارية مقابل درجة الحرارة لبعض الغازات الأكثر شيوعًا. يجب التأكيد على أنه في الصيغة (2.24) يتم استبدال درجة الحرارة بالدرجات المئوية.
متوسط السعة الحرارية المولارية للغازات المختلفة عند ص= const
(وفقًا لـ MP Vukalovich، V.A. Kirillin، V.N. Timofeev)
|
ر، درجة مئوية |
مع ص، كيلوجول / (kmolK) |
|||||||
|
N 2 الغلاف الجوي | ||||||||
في هذا الجدول ، القيم معيتم إعطاء p من خلال 100 درجة مئوية. نظرًا لأنها لا تتغير كثيرًا مع درجة الحرارة ، يمكن العثور على القيم الوسيطة عن طريق الاستقراء الخطي. تذكر كيف يتم ذلك. هناك قيم دالة مجدولة ذ
= F(x) في 1 (متى X= X 1) و في 2 (متى X= X 2). قيمة الوظيفة في(X) في X 1 <X<X 2 يساوي 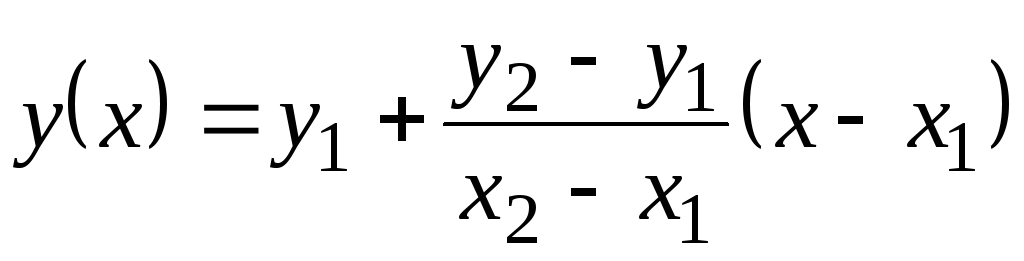 . هذه الصيغة صحيحة لكل من دالة الزيادة الرتيبة (متى في 2 >في 1) وللتناقص الرتيب ( في 2 <فيواحد)؛ في هذه الحالة ، سيكون الكسر سالبًا منذ ذلك الحين X 2 > X 1 دائما.
. هذه الصيغة صحيحة لكل من دالة الزيادة الرتيبة (متى في 2 >في 1) وللتناقص الرتيب ( في 2 <فيواحد)؛ في هذه الحالة ، سيكون الكسر سالبًا منذ ذلك الحين X 2 > X 1 دائما.
يوضح الجدول قيم التوصيل الحراري للغازات حسب درجة الحرارة والضغط.
يشار إلى قيم التوصيل الحراري لدرجات حرارة تتراوح من 20 كلفن (-253 درجة مئوية) إلى 1500 كلفن (1227 درجة مئوية) والضغط من 1 إلى 1000 جو.
الطاولة بالنظر إلى التوصيل الحراري للغازات التالية: ، ، فريون -14 CF 4 ، إيثيلين سي 2 ساعة 4. وحدة التوصيل الحراري W / (م درجة).
تجدر الإشارة إلى أن تزداد الموصلية الحرارية للغازات مع زيادة درجة الحرارة والضغط. على سبيل المثال ، الموصلية الحرارية لغاز الأمونيا عند درجة حرارة الغرفة والضغط الجوي العادي هي 0.024 وات / (م درجة) ، وعندما يتم تسخينها بمقدار 300 درجة ، تزداد الموصلية الحرارية إلى قيمة 0.067 وات / (م درجة). إذا زاد ضغط هذا الغاز إلى 300 ضغط جوي ، فإن قيمة التوصيل الحراري ستصبح أعلى وستكون قيمتها 0.108 واط / (م درجة).
ملاحظة: انتبه! يشار إلى الموصلية الحرارية في الجدول بمعامل 10 3. لا تنسى القسمة على 1000!
الموصلية الحرارية للغازات غير العضوية حسب درجة الحرارة
يعطي الجدول قيم التوصيل الحراري للغازات غير العضوية حسب درجة الحرارة عند الضغط الجوي العادي. يشار إلى قيم التوصيل الحراري للغازات عند درجات حرارة من 80 إلى 1500 كلفن (-193 ... 1227 درجة مئوية).
يوضح الجدول الموصلية الحرارية للغازات التالية: أكسيد النيتروز N 2 O ، سادس فلوريد الكبريت SF 6 ، أكسيد النيتريك NO ، كبريتيد الهيدروجين H 2 S ، الأمونيا NH 3 ، ثاني أكسيد الكبريت SO 2 ، بخار H 2 O ، ثاني أكسيد الكربون CO 2 ، بخار الماء الثقيل D 2 O ، الهواء.
تجدر الإشارة إلى أن تزداد الموصلية الحرارية للغازات غير العضوية مع زيادة درجة حرارة الغاز.
ملاحظة: يُشار إلى الموصلية الحرارية للغازات في الجدول بمعامل 10 3. لا تنسى القسمة على 1000!
الموصلية الحرارية للغازات العضوية كدالة لدرجة الحرارة
يوضح الجدول قيم التوصيل الحراري للغازات العضوية وأبخرة بعض السوائل حسب درجة الحرارة عند الضغط الجوي العادي. ترد قيم التوصيل الحراري للغازات في الجدول في نطاق درجة الحرارة من 120 إلى 800 كلفن.
يتم إعطاء الموصلية الحرارية للغازات والسوائل العضوية التالية:الأسيتون CH 3 COCH 3 ، الأوكتان C 8 H 18 ، البنتان C 5 H 12 ، البيوتان C 4 H 10 ، الهكسان C 6 H 14 ، البروبيلين C 3 H 6 ، الهبتان C 7 H 16 ، كحول الأميل C 5 H 11 OH ، زيلين C 8 H 10 ، كحول أيزوبروبيل C 2 H 7 OH ، ميثان CH 4 ، كحول الميثيل CH 3 OH ، رابع كلوريد الكربون CCl 4 ، سيكلوهكسان C 6 H 12 ، إيثان C 2 H 6 ، رباعي فلوريد الكربون CF 4 ، فريون -11 CFCl 3 ، كلوريد الإيثيل C 2 H 5 Cl ، الفريون 12 CF 2 Cl 2 ، الإيثيلين C 2 H 4 ، الفريون 13 CF 3 Cl ، فورمات الإيثيل HCOOC 2 H 5 ، الفريون -21 CHFCl 2 ، ثنائي إيثيل الأثير (C 2 H 5) 2O.
كما يتضح من الجدول ، تزداد قيمة التوصيل الحراري للغازات العضوية أيضًا مع زيادة درجة حرارة الغاز.
كن حذرا! يشار إلى الموصلية الحرارية في الجدول بمعامل 10 3. لا تنسى القسمة على 1000!على سبيل المثال ، الموصلية الحرارية لبخار الأسيتون عند درجة حرارة 400 كلفن (127 درجة مئوية) هي 0.0204 واط / (م درجة).
