gaz aralashmalari. Gazlarning issiqlik sig'imi. Yoqilg'i, gaz aralashmalari va issiqlik sig'imi
1.3. Ideal gaz holati tenglamasi
Haqiqiy moddalar uchun (1.1) holat tenglamalarining shakli ancha murakkab.
Shu munosabat bilan termodinamikada ishchi jismlarning soddalashtirilgan fizik modellaridan foydalaniladi.
Gaz holatidagi ishlaydigan suyuqliklar uchun eng oddiy va tarixiy jihatdan birinchi model ideal gaz. Ideal gaz - bu molekulalararo o'zaro ta'sir kuchlari (tortishish va itarish) bo'lmagan va molekulalarning o'zi gaz deb hisoblanadi. moddiy nuqtalar. Ideal gaz bo'ysunadi Claiperon tenglamasi– Mendeleev
qayerda m- tizimdagi gazning massasi; m - gazning molyar massasi; R m = 8314 J/(kmol K) universal gaz konstantasi bo'lib, u gaz turiga yoki uning mavjudligi sharoitiga bog'liq emas. (1.2) holat tenglamasi birlashtirib olinadi Boyl-Mariot qonunlari va Gey Lussak hisobga olgan holda Avogadro qonuni.
Molyar massa μ = m/n, kg/mol - bir mol miqdorida olingan moddaning massasi. 1 mol 12 gramm uglerod kabi ko'p zarrachalarni o'z ichiga olgan modda miqdorining birligi. Moddaning miqdori– n = N/N A, mol, qayerda N zarralar soni (atomlar, molekulalar), N A ≈ 6,02 10 23 - 12 gramm ugleroddagi atomlar soni ( Avogadro raqami). Raqamli ravishda m = Mr 10 -3 , bu erda janob moddaning nisbiy molekulyar og'irligi ( tab. Mendeleev) (masalan: =2 kg/kmol).
Maxsus shartlarda (ya'ni 1 kg gaz uchun) tenglama (1.2) shaklga ega bo'ladi
qayerda R– solishtirma gaz konstantasi, J/(kg K).
Keling, o'ziga xos gaz konstantasining fizik ma'nosini tushuntiramiz R. Birinchi holat tenglamasi uchun (1.2) quyidagicha yoziladi, ikkinchi holat uchun bir xil bosimdagi - . Ikkinchi tenglamadan birinchi tenglamani ayirib, toping, ya'ni. Maxsus gaz konstantasi - 1 kg gaz doimiy bosimda 1 daraja qizdirilganda bajargan ishi.
Eksperimental ma'lumotlar shuni ko'rsatadiki, haqiqiy gaz idealga qanchalik yaqin bo'lsa, uning zichligi shunchalik past bo'ladi. Boshqacha qilib aytganda, bosimning oshishi yoki haroratning pasayishi natijasida ma'lum miqdordagi gaz hajmining pasayishi bilan har qanday gaz ideal gazning xususiyatlaridan tobora ko'proq og'ishlarni keltirib chiqaradi. Shunday qilib, "ideal gaz" kontseptsiyasi ostida yuqori harorat va past bosimdagi barcha haqiqiy gazlar mos keladi.
1.4. Aralashmalar ideal gazlar
Amalda, ishchi suyuqlik ko'pincha bir hil gazlar (masalan, havo) aralashmasi bo'lib, ularning har birini ideal deb hisoblash mumkin va ular tarkibiga kirmaydi. kimyoviy reaksiyalar.
Bunday aralashma ham ideal gaz bo'lib, aralashmaning (1.2) holat tenglamasiga bo'ysunadi
qayerda R=R μ / m - aralashmaning gaz konstantasi; m aralashmaning o'rtacha (ko'rinadigan) molyar massasi(molekulalar soni va umumiy massasi molekulalar soni va aralashmaning massasiga teng bo'lgan bir hil vakil gazga tegishli shartli qiymat).
Aralashmaning massasi barcha tarkibiy qismlarning massasiga teng
Gaz aralashmasining harakatini belgilaydigan asosiy qonun Dalton qonuni:
Har bir alohida gaz gaz aralashmasida o'zini tutadi, go'yo u aralashmaning haroratida aralashmaning butun hajmini egallaydi;
gaz aralashmasiga kiradigan har bir alohida gaz, agar u gaz aralashmasining butun hajmini egallagan bo'lsa, xuddi shunday bosimga ega.
Shuning uchun qiymat R(mutlaq aralashma bosimi) sifatida aniqlanadi
qayerda R i – qisman bosim i th komponenti, ya'ni. bo'ladigan bosim i th komponent, agar u bir xil haroratda aralashmaning butun hajmini egallagan bo'lsa ().
Aralashmaning tarkibi aralashmaning tarkibiy qismlarining massa yoki mol ulushlari, shuningdek hajm ulushlari (konsentratsiyalar) bilan beriladi.
Massa ulushi har bir gaz massasining aralashmaning umumiy massasiga nisbati: .
(1.3) tenglama shuni bildiradi.
Hajm ulushi nisbati deyiladi qisman hajm(agar uning bosimi va harorati gaz aralashmasining bosimi va haroratiga teng bo'lsa, gaz egallaydigan hajm, ya'ni) gaz aralashmasining umumiy hajmiga: . Qisman bosim va hajm va haroratning doimiyligi ta'riflaridan quyidagicha:
![]() (1.5)
(1.5)
Aralashmaning barcha komponentlari bo'yicha oxirgi tenglikni umumlashtirib, biz olamiz , ya'ni. aralashmani tashkil etuvchi gazlarning qisman hajmlarining yig'indisi gazlar aralashmasining hajmiga teng.
Hajm kasrlarining yig'indisi birga teng: .
mol fraktsiyasi komponent har bir gazning modda miqdoriga nisbati deyiladi n i gazlar aralashmasining moddasi miqdoriga n. Munosabatlardan va va Avogadro qonuni(bir xil harorat va bir xil bosimdagi turli ideal gazlarning teng hajmlarida teng miqdordagi molekulalar o'ralgan, ya'ni) quyidagicha:
bular. aralashmani mol ulushlari bo'yicha ko'rsatish uning hajm kasrlarini ko'rsatishga teng.
Massa va hajm ulushlari nisbati bilan bog'lanadi:
![]() .
.
Agar aralashma massa ulushlari bilan berilgan bo'lsa g i, keyin aralashmaning gaz konstantasi va aralashmaning molyar massasi quyidagicha hisoblanadi:
![]()
![]()
Agar aralashma hajm kasrlari bilan berilgan bo'lsa r i, keyin aralashmaning molyar massasini va aralashmaning gaz doimiyligini hisoblash uchun formulalar quyidagicha:
![]() (1.6)
(1.6)
Gazlarning qisman bosimi va hajmlari bilan aniqlanadi Boyl qonuni–marriotte(doimiy gaz haroratida gaz bosimi va uning hajmining mahsuloti doimiy qiymatdir, ya'ni):
![]() .
.
test savollari
Xalqaro birliklar tizimi (SI) va uning asosiy birliklari.
Asosiy termodinamik parametrlar va ularning o'lchamlari.
Termodinamik tizimning muvozanat holati deganda nima tushuniladi?
Muvozanatli va muvozanatsiz holatlar tushunchasi.
Tizimning holat tenglamasi nima?
Sistema holatini, termodinamik jarayonning geometrik talqini.
Ideal gaz nima? Ideal gaz va haqiqiy gaz o'rtasidagi farq nima?
Gaz konstantasi nima? Uning jismoniy ma'nosi, o'lchovi va aniqlash usullari.
2. Issiqlik sig'imi
Har qanday jarayonda ishchi organga issiqlik xabari uning holatining o'zgarishiga olib keladi va umumiy holatda haroratning o'zgarishi bilan birga keladi. Haroratning o'zgarishi, shuningdek ishchi suyuqlik holatining boshqa parametrlari jarayonning turiga bog'liq emas, balki uning boshlang'ich darajasiga bog'liq ( 1 ) va yakuniy ( 2 ) davlatlar, ya'ni. (elementar jarayon uchun parametrning o'zgarishi uning differentsialiga almashtiriladi).
Issiqlik miqdorining nisbati d Q tana haroratining o'zgarishi haqida tanaga xabar beriladi dT elementar termodinamik jarayonda deyiladi haqiqiy issiqlik sig'imi Ushbu jarayondagi organlar:
Bu yerdagi pastki belgi issiqlik kabi issiqlik sig'imi jarayonning tabiatiga bog'liqligini ko'rsatadi. Bundan tashqari, issiqlik sig'imi tananing miqdori va uning termodinamik holatiga bog'liq. Shuni ham ta'kidlash kerakki, bu jarayonda organizmning kimyoviy tarkibi o'zgarmaydi, moddaning bir agregatsiya holatidan ikkinchisiga o'tmaydi, komponentlarning erishi yo'q va hokazo.
Tanlangan moddaning miqdori birligiga qarab, massa, hajm va molyar o'ziga xos issiqlik sig'imlari ajratiladi:
Massa issiqlik sig'imi tushunchasi amaliyotda ko'pincha qo'llaniladi.
2.1. Haqiqiy va o'rtacha issiqlik sig'imi
Haqiqiy moddaning issiqlik sig'imi doimiy qiymat emas. U harorat bilan o'zgaradi va bu bog'liqlik juda muhim bo'lishi mumkin (2.1-rasm).
Texnologik issiqlikning o'ziga xos miqdori formula bo'yicha hisoblanadi
Ushbu qiymatni aniqlash uchun quyidagi usullar qo'llaniladi:
eksperiment natijalariga ko'ra issiqlik sig'imining haroratga bog'liqligi taxminiy polinom sifatida ifodalanadi.
yaqinlik koeffitsientlari qayerda. Ushbu koeffitsientlar ma'lumotnoma adabiyotida keltirilgan. Keyin
harorat oralig'ida amaliy hisob-kitoblarda t 1 , t 2 issiqlik sig'imi teng doimiy qiymat hisoblanadi
chaqirdi o'rtacha issiqlik quvvati bu oraliqda, (2.1) da kiritilgan haqiqiy issiqlik sig'imidan farqli o'laroq. Malumot ma'lumotlari o'rtacha issiqlik sig'imlarini 0 dan belgilangan haroratgacha beradi t empirik tarzda olingan, ya'ni.
Harorat oralig'ida o'rtacha issiqlik quvvati t 1 , t Ushbu ma'lumotnoma ma'lumotlariga ko'ra 2 formula bo'yicha hisoblanishi mumkin
Keyin aniq miqdor jarayon issiqligi sifatida aniqlanadi
2.2. Izoxorik va izobar issiqlik sig'imlari
termodinamikada katta ahamiyatga ega.
izoxorikissiqlik sig'imi
doimiy hajmdagi jarayondagi issiqlik miqdorining tana haroratining o'zgarishiga nisbatiga teng;
izobarikissiqlik sig'imi
doimiy bosimdagi jarayondagi issiqlik miqdorining tana haroratining o'zgarishiga nisbatiga teng.
Issiqlik texnikasi hisob-kitoblarida haroratga qarab turli moddalar uchun o'ziga xos izobarik va izoxorik issiqlik sig'imlarining eksperimental ravishda olingan raqamli qiymatlari ro'yxati keltirilgan jadvallardan foydalaniladi.
2.3. Gaz aralashmalarining issiqlik sig'imi
Hisob-kitoblarda ko'pincha gazlar aralashmalari bilan shug'ullanish kerak bo'ladi va issiqlik quvvatlari jadvallarda faqat alohida gazlar uchun berilgan.
Agar gazlar aralashmasi massa ulushlari bilan berilgan bo'lsa g i, keyin aralashmaning o'ziga xos massa issiqlik sig'imlari formulalar bilan aniqlanadi
![]()
Agar gazlar aralashmasi hajm ulushlari bilan berilgan bo'lsa r i, keyin aralashmaning o'ziga xos hajmli issiqlik sig'imlari formulalar bilan aniqlanadi
![]()
test savollari
O'ziga xos issiqlik sig'imi birliklarini yozing.
O'rtacha issiqlik sig'imi tushunchasi qanday kiritiladi?
3. Energiyaning saqlanish va aylanish qonuni
Energiya tushunchasi materiya harakati bilan bog'liq.
Energiya turli shakllarda bo'lishi mumkin - mexanik ish, issiqlik, kimyoviy energiya, elektr va magnit maydonlarning energiyasi.
Termodinamik jarayonda atrof-muhit va yopiq termodinamik tizimning o'zaro ta'siri issiqlik va mexanik ish shaklida energiya almashinuvi orqali amalga oshiriladi.
3.1. Ichki energiya
Har qanday muhit ma'lum chegaraga ega ichki energiyaU(J), texnik termodinamikada muhit molekulalari va atomlarining kinetik va potentsial energiyalari yig'indisi sifatida ifodalanadi. Bu zarralarning kinetik energiyasi ularning tezligi va massasi bilan, potentsial energiya esa ularning nisbiy holatiga bog'liq bo'lgan o'zaro ta'sir kuchlari bilan belgilanadi. Tizimning ichki energiyasi - bu tizimning o'zida mavjud bo'lgan energiya. Bu shuni anglatadiki, ichki energiya miqdorlar bilan birga tananing holatini tavsiflashi mumkin R, V, T.
Ichki energiya qo'shilish xususiyatiga ega, ya'ni. Murakkab tizimning ichki energiyasi uning tarkibiy qismlarining ichki energiyalari yig'indisiga teng:
1 kg moddaning ichki energiyasi deyiladi o'ziga xos ichki energiya u= U/ m (J/kg).
Termodinamikaning ko'pgina texnik ilovalari uchun mutlaq qiymat muhim emas U, va bu qiymatning o'zgarishi. Shuning uchun bir hil tizimning ichki energiyasining miqdoriy ta'rifi ko'pincha qandaydir shartli tanlangan standart holatga nisbatan aniqlanadi.
3.2. Termodinamikada energiyaning saqlanish qonuni
Termodinamik jarayonni amalga oshirish, yopiq tizim tashqi muhit (tashqi jismlar va maydonlar) bilan o'zaro ta'sir qiladi, ya'ni. energiya almashadi. Texnik termodinamikada energiya uzatishning ikki turi ko'rib chiqiladi - issiqlik uzatish va mexanik ishlarni bajarish.
Issiqlik almashinuvi elektromagnit to'lqinlar yordamida har xil haroratli jismlar o'rtasida sodir bo'ladi va aloqada bo'ladi yoki masofada joylashgan turli haroratli jismlar o'rtasida ( termal nurlanish). Translyatsiya issiqlik jismlarning ko'rinadigan harakatisiz molekulyar (mikrofizik) darajada sodir bo'ladi.
Energiyani ish shaklida o'tkazish butun tananing yoki uning bir qismining kosmosda harakati bilan sodir bo'ladi. Ushbu usul yordamida tana kuch maydonida harakat qiladi yoki tashqi bosim ta'sirida hajmini o'zgartiradi. Ish energiya uzatishning makrofizik shaklidir.
Shuni ta'kidlash kerakki, issiqlik va ish, tananing energiyasidan farqli o'laroq, uning holatining funktsiyalari emas, balki jarayonning turiga bog'liq, bu jarayonni aniqlaydi, ya'ni. jarayonning o'ziga xos funktsiyalari.
Ko'plab tajribalar va kuzatishlar tabiatning asosiy qonunini - energiyaning saqlanish qonunini ochishga olib keldi: tabiatdagi energiya yo'qdan paydo bo'lmaydi va yo'qolmaydi, yoki energiya miqdori o'zgarmaydi, u faqat bir shakldan ikkinchisiga o'zgaradi, yoki
qayerda Q bu jarayonda ishtirok etadigan issiqlik; L- bajarilayotgan ishlar; D E sistema energiyasining o'zgarishidir. Bu erda va quyida biz ko'rib chiqishga rozimiz:
ish ijobiy agar bu ish ishchi organ tomonidan amalga oshirilsa va salbiy, agar tizimning ishchi organida ish bajarilsa;
tanaga berilgan issiqlik ijobiy, va ajratilgan - salbiy
Bundan tashqari, yakuniy jarayonda har qanday holat parametrining o'zgarishi D (delta) belgisi bilan belgilanadi va elementar jarayonda - d(tegishli parametrning differensialligi). Har qanday chekli termodinamik jarayon uchun holat parametrining o'zgarishi (bosim, harorat, ichki energiya, entalpiya, entropiya va boshqalar) jarayonning turiga bog'liq emas, balki boshlang'ich va oxirgi holatlar bilan belgilanadi.
Umuman olganda, termodinamik tizim ichki energiyaga ega U, kinetik energiya (termodinamikada tizim tezlik bilan harakatlanuvchi bir butun deb hisoblanadi w) – mw 2/2, potentsial - mgz (z tizim joylashgan balandlik). Jarayondagi umumiy energiyaning o'zgarishi 1 –2 quyidagicha tasavvur qilish mumkin:
Bu jarayonda bajarilgan ishlar ishlarning yig'indisidir L haqida, tizimning ishchi suyuqligi hajmining o'zgarishi bilan bog'liq (deformatsiya ishi), ish L dv tizimning kosmosdagi harakati haqida, texnik ish L ular (tizimni turli xil texnik qurilmalarda, masalan, dvigatelda, bug 'qozonida, kompressorda va hokazolarda harakatlantirganda) ishqalanish kuchlariga qarshi ishlaydi. L tr:
L \u003d L haqida + L dv + L o'sha + L tr.
Jarayondagi issiqlik issiqlik yig'indisidir Q tashqi, tashqi muhit bilan almashinishda va ishqalanish issiqligida ishtirok etadi Q tr:
Q = Q tashqi + Q tr.
Sharti bilan; inobatga olgan holda Q tr = L tr (ko'plab tajribalar ishqalanishni engish uchun sarflangan oqim ishi to'liq oqim tomonidan qabul qilinadigan issiqlikka aylanishini ko'rsatdi), 1 kg ishlaydigan bir hil modda uchun termodinamikada energiyaning saqlanish qonuni (ya'ni, o'ziga xos massa qiymatlarida). ) elementar jarayonda yozilishi mumkin:
![]() , (3.1)
, (3.1)
(tashqi indeks keraksiz deb tashlab qo'yilgan).
Shuni ta'kidlash kerakki, (3.1) ning o'ng tomonida differentsial belgisi ostida holat funktsiyalari, qolganlari esa termodinamik jarayonning tabiatiga bog'liq bo'lgan kattaliklardir. Ish va issiqlik holatning funksiyasi emas, balki jarayonning funksiyasi bo'lganligi sababli, d belgisi faqat elementar jarayonda undan keyingi miqdorlarning biron bir maxsus funktsiyaning o'sishi emas, balki ixtiyoriy cheksiz kichik ekanligini bildiradi. Shunday qilib, d q va d l-elementar (ya'ni tizim holatidagi cheksiz kichik o'zgarishlarga mos keladigan) issiqlik va ish miqdorlari.
Agar termodinamik tizim kosmosdagi o'rnini o'zgartirmasa va ishning yagona turi tizim hajmining o'zgarishi bilan bog'liq ish bo'lsa, (3.1) tenglama oddiyroq shaklni oladi:
Ish d l haqida tashqi bosim kuchlariga qarshi amalga oshiriladi va keyin ishchi suyuqlikning hajmi kengayadi yoki aksincha, tashqi muhit tanani siqib, tanada ish olib boradi. Muvozanat jarayonlari uchun muhitning bosimi ishchi suyuqlikdagi bosimga teng bo'lganda, bu ish quyidagicha hisoblanadi. Rdv, qayerda v ishlovchi moddaning solishtirma hajmidir.
Tenglama
chaqirdi termodinamikaning birinchi qonuni: yopiq termodinamik tizimga tinch holatda berilgan issiqlik tizimning ichki energiyasini o'zgartirishga va tizim hajmini o'zgartirishga sarflanadi.. Balans munosabati (3.2) ma'ruza deb ham ataladi yoqilgan nazariy adabiyotlar. 1. Barokko: ...
L. A. Eliseeva © Federal davlat byudjeti fan instituti Rossiya Fanlar akademiyasining Sibir filiali Davlat jamoat ilmiy-texnik kutubxonasi, 2013 yil
PointerTasodifiy yurishlar / A.N. Borodin, I. A. Ibragimov; ostida... 241. Dorogokupets P.I. Termodinamika minerallar va mineral muvozanatlar ... kataloglar: kompendium ma'ruzalar yoqilgan kurs "Ma'lumotnoma ... davlat texnik universitet. Seriya, Texnik fan. - ...
N. V. Basova [va boshqalar]; tahrir. N. V. Basova. Rostov n/a: Feniks, 2008 yil
DarslikKurs) Yozma D. T. Konspekt ma'ruzalar yoqilgan oliy matematika [Matn]: ... Texnik termodinamika Rudobashta, S.P. Issiqlik muhandisligi [Matn]: talabalar uchun darslik. tahsil olayotgan universitetlar yoqilgan... 2008. - 204 b. o'n Borodin, I. F. Texnologik jarayonlarni avtomatlashtirish...
G‘aznachilikning 2008 yil - 2013 yil 1 iyun davridagi ilmiy ishlari ro‘yxati (1)
Hujjat... "Tadqiqotning rentgen usullari" Ma'ruzalar yoqilgan klinik onkologiya. Olmaota ... ikkinchi qonun termodinamika» 2-Xalqaro... va ekspert tekshiruvi texnik sog'liqni saqlash tashkilotlarini jihozlash ... Rossiya Tibbiyot fanlari akademiyasining akademigi Yu.I. Borodin, Bishkek, 2009, b. ...
Muhandislik amaliyotida ko'pincha bir hil gazlar bilan emas, balki kimyoviy jihatdan bog'liq bo'lmagan gazlar aralashmalari bilan shug'ullanish kerak. Gaz aralashmalariga misollar: atmosfera havosi, tabiiy gaz, yoqilg'ining yonishining gazsimon mahsulotlari va boshqalar.
Gaz aralashmalari uchun quyidagi qoidalar amal qiladi.
1. Aralashmaga kiradigan har bir gazning harorati, haroratga teng aralashmalar.
2. Aralashmaga kiritilgan gazlarning har qandayi aralashmaning butun hajmiga taqsimlanadi va shuning uchun har bir gazning hajmi butun aralashmaning hajmiga teng.
3. Aralashma tarkibiga kiruvchi gazlarning har biri o'ziga xos holat tenglamasiga bo'ysunadi.
4. Aralashma butun holda yangi gazga o'xshaydi va o'zining holat tenglamasiga bo'ysunadi.
Gaz aralashmalarini o'rganish Dalton qonuniga asoslanadi, unga ko'ra doimiy haroratda aralashmaning bosimi aralashma tarkibiga kiruvchi gazlarning qisman bosimlari yig'indisiga teng:
bu erda p sm - aralashmaning bosimi;
p i - aralashmaga kiritilgan i-chi gazning qisman bosimi;
n - aralashmaga kiritilgan gazlar soni.
Parsial bosim - bu aralashmaga kiradigan gazning bir xil haroratda aralashmaning butun hajmini egallagan bosimi.
Gaz aralashmalarini sozlash usullari
Gaz aralashmasining tarkibi massa, hajm va mol fraktsiyalari bilan aniqlanishi mumkin.
Massa ulushlari. Aralashmaga kiritilgan har qanday gazning massa ulushi bu gaz massasining aralashmaning massasiga nisbati hisoblanadi.
m 1 \u003d M 1 / M sm; m 2 \u003d M 2 / M sm; ............; m n \u003d M n / M sm,
bu erda m 1, m 2, ..., m n - gazlarning massa ulushlari;
M 1, M 2, ..., M n - alohida gazlarning massalari;
M sm - aralashmaning massasi.
Buni ko'rish oson  va
va  (100%).
(100%).
Hajmi ulushlari. Aralashmaga kiritilgan har qanday gazning hajm ulushi bu gazning kamaytirilgan (qisman) hajmining aralashmaning hajmiga nisbati hisoblanadi.
r 1 \u003d V 1 / V sm; r 2 \u003d V 2 / V sm; ........., r n = V n / V sm;
bu erda V 1, V 2, ..., V n - gazlarning kamaytirilgan hajmlari;
V sm - aralashmaning hajmi;
r 1, r 2, ..., r n - gazlarning hajm ulushlari.
Qisqartirilgan hajm - aralashmaning sharoitida (aralashmaning harorati va bosimida) gazning hajmi.
Qisqartirilgan hajmni quyidagicha ifodalash mumkin: agar aralashmani o'z ichiga olgan idishdan bittasidan tashqari barcha gazlar chiqarilsa va qolgan gaz haroratni saqlab turganda aralashmaning bosimiga qadar siqilsa, u holda uning hajmi kamayadi yoki qisman bo'ladi.
Aralashmaning hajmi gazlarning kamaytirilgan hajmlari yig'indisiga teng bo'lishini isbotlash mumkin.
 (100%).
(100%).
Mol fraktsiyalari. Aralashmaga kiritilgan har qanday gazning mol ulushi bu gazning kilomollari sonining aralashmaning kilomollari soniga nisbati hisoblanadi.
r 1 \u003d n 1 / n sm; r 2 \u003d n 2 / n sm; ........., r n \u003d n n / n sm,
bu yerda r 1, r 2, ..., r n - gazlarning mol fraktsiyalari;
n sm - aralashmaning kilomollari soni;
n 1 , n 2 , ..., n n - gazlarning kilomollari soni.
Aralashmani mol kasrlari bo'yicha ko'rsatish aralashmani hajm kasrlari bo'yicha ko'rsatish bilan bir xil, ya'ni. molyar va hajmli fraktsiyalar aralashmaga kiritilgan har bir gaz uchun bir xil sonli qiymatlarga ega.
Gaz konstantasi va aralashmaning ko'rinadigan (o'rtacha) molekulyar og'irligi. Massa ulushlari bilan berilgan gaz aralashmasi konstantasini hisoblash uchun holat tenglamalarini yozamiz:
aralashmasi uchun
p sm × V sm = M sm R sm T; (1.9)
gazlar uchun
 .
(1.10)
.
(1.10)
Tenglamalarning chap va o'ng qismlarini yig'amiz (1.10)
(p 1 + p 2 + .... + p n) V sm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Chunki  ,
,
keyin p sm V sm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11)
(1.9) va (1.11) tenglamalar shuni bildiradi
M sm R sm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R sm \u003d M 1 / M sm R 1 + M 2 / M sm R 2 + ...... + M n / M sm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
yoki  ,
(1.12)
,
(1.12)
bu yerda R sm aralashmaning gaz konstantasi.
i-chi gazning gaz doimiyligidan
R i = 8314 / m i,
keyin (1.12) tenglama quyidagicha qayta yoziladi:
 .
(1.13)
.
(1.13)
Gaz aralashmasining parametrlarini aniqlashda gaz aralashmasining ko'rinadigan (o'rtacha) molekulyar og'irligi deb ataladigan ma'lum bir shartli qiymatdan foydalanish qulay. Aralashmaning ko'rinadigan molekulyar og'irligi tushunchasi aralashmani shartli ravishda bir hil gaz sifatida ko'rib chiqishga imkon beradi, bu esa hisob-kitoblarni sezilarli darajada osonlashtiradi.
Alohida gaz uchun ifoda
Analogiya bo'yicha, aralashma uchun biz yozishimiz mumkin
m sm R sm = 8314, (1.14)
bu erda m sm - aralashmaning ko'rinadigan molekulyar og'irligi.
(1.14) tenglamadan (1.12) va (1.13) ifodalardan foydalanib, biz hosil bo'lamiz.
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Shu tarzda bahslashsak, R sm va m sm hajmli kasrlar orqali hisoblash formulalarini, massa ulushlarini hajm kasrlariga va aksincha, hajmli ulushlarni massa ulushlariga aylantirish formulalarini, aralashmaning solishtirma hajmini hisoblash formulalarini olish mumkin u sm va aralashmaning zichligi r sm massa va hajm ulushlari bo'yicha va nihoyat, aralashma tarkibiga kiradigan gazlarning qisman bosimini, hajm va massa ulushlari orqali hisoblash uchun formulalar. Biz ushbu formulalarni jadvalda hosilasiz taqdim etamiz.
Gaz aralashmalarini hisoblash formulalari
|
Aralashmaning tarkibini sozlash |
Bir kompozitsiyadan boshqasiga o'tkazish |
Aralashmaning zichligi va solishtirma hajmi |
Aralashmaning ko'rinadigan molekulyar og'irligi |
Gaz aralashmasi doimiy |
Qisman bosim |
|
Massa ulushlari |
|
|
|
|
|
|
Hajm kasrlari |
|
|
|
|
|
Gazlarning issiqlik sig'imi
Jismning issiqlik sig'imi - tanani 1 K ga qizdirish yoki sovutish uchun zarur bo'lgan issiqlik miqdori. Moddaning birlik miqdorining issiqlik sig'imi solishtirma issiqlik sig'imi deyiladi.
Demak, moddaning o'ziga xos issiqlik sig'imi - bu jarayonda uning haroratini 1 K ga o'zgartirish uchun moddaning birligidan xabar qilinishi yoki ayirilishi kerak bo'lgan issiqlik miqdori.
Kelgusida faqat o'ziga xos issiqlik sig'imlari ko'rib chiqilishi sababli, biz o'ziga xos issiqlik sig'imini oddiygina issiqlik sig'imi deb ataymiz.
Gaz miqdori massa, hajm va kilomol soni bo'yicha berilishi mumkin. Shuni ta'kidlash kerakki, gaz hajmini belgilashda bu hajm normal holatga keltiriladi va oddiy kubometrlarda (nm 3) o'lchanadi.
Gaz miqdorini belgilash usuliga qarab, quyidagi issiqlik quvvatlari ajratiladi:
c - massa issiqlik sig'imi, J / (kg × K);
c¢ - hajmli issiqlik sig'imi, J / (nm 3 × K);
c m - molyar issiqlik sig'imi, J / (kmol × K).
Ushbu issiqlik sig'imlari o'rtasida quyidagi munosabatlar mavjud:
c = c m / m; m bilan = × m bilan;
s¢ = s m / 22,4; m = s¢ × 22,4 bilan,
bu yerdan  ; s¢ = s × r n,
; s¢ = s × r n,
bu yerda u n va r n - normal sharoitda solishtirma hajm va zichlik.
Izoxorik va izobar issiqlik sig'imlari
Ishchi suyuqlikka beriladigan issiqlik miqdori termodinamik jarayonning xususiyatlariga bog'liq. Termodinamik jarayonga qarab ikki xil issiqlik sig'imi amaliy ahamiyatga ega: izoxorik va izobar.
u = const da issiqlik sig'imi izoxorikdir.
c u - massa izoxorik issiqlik sig'imi,
c¢ u hajmiy izoxorik issiqlik sig'imi,
sm u molyar izoxorik issiqlik sig'imi.
p = const da issiqlik sig'imi izobarikdir.
c p - massa izobarik issiqlik sig'imi,
c¢ r - hajmli izobarik issiqlik sig'imi,
c m p - molyar izobarik issiqlik sig'imi.
P = const da amalga oshirilgan jarayonda haroratning bir xil o'zgarishi bilan u = constdagi jarayonga qaraganda ko'proq issiqlik sarflanadi. Bu u = const da tanaga berilgan issiqlik faqat uning ichki energiyasini o'zgartirishga, p = konstda esa issiqlik ham ichki energiyani oshirishga, ham kengayish ishini bajarishga sarflanishi bilan izohlanadi. Mayer tenglamasiga ko'ra massa izobarik va massa izoxorik issiqlik sig'imlari o'rtasidagi farq
c p - c u=R. (1.17)
Agar (1.17) tenglamaning chap va o'ng tomonlari kilomol massasi m ga ko'paytirilsa, biz hosil bo'lamiz.
c m p - c m u= 8314 J/(kmol×K) (1,18)
Termodinamikada va uni qo'llashda izobar va izoxorik issiqlik sig'imlarining nisbati katta ahamiyatga ega:
 ,
(1.19)
,
(1.19)
Bu erda k - adiabatik ko'rsatkich.
Hisob-kitoblar shuni ko'rsatadiki, bir atomli gazlar uchun k » 1,67, ikki atomli gazlar k » 1,4 va uch atomli gazlar uchun k » 1,29.
Qiymat ekanligini ko'rish oson uchun haroratga bog'liq. Darhaqiqat, (1.17) va (1.19) tenglamalardan kelib chiqadi
 ,
(1.20)
,
(1.20)
va (1.18) va (1.19) tenglamalardan
 .
(1.21)
.
(1.21)
Issiqlik sig'imlari gaz harorati oshishi bilan ortib borayotganligi sababli, k qiymati birlikka yaqinlashib, kamayadi, lekin har doim undan katta bo'lib qoladi.
K qiymatini bilib, mos keladigan issiqlik sig'imi qiymatini aniqlash mumkin. Shunday qilib, masalan, (1.20) tenglamadan biz bor
 ,
(1.22)
,
(1.22)
va beri p = k × s bilan u, keyin olamiz
 .
(1.23)
.
(1.23)
Xuddi shunday, molyar issiqlik sig'imlari uchun (1.21) tenglamadan olamiz
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
O'rtacha va haqiqiy issiqlik sig'imi
Gazlarning issiqlik sig'imi haroratga va ma'lum darajada bosimga bog'liq. Issiqlik sig'imining bosimga bog'liqligi kichik va ko'pchilik hisob-kitoblarda e'tiborga olinmaydi. Issiqlik sig'imining haroratga bog'liqligi muhim va hisobga olinishi kerak. Bu bog'liqlik tenglama bilan juda aniq ifodalangan
c = a + ichida t + et 2 , (1.26)
qayerda, ichida va e - ma'lum bir gaz uchun doimiy bo'lgan qiymatlar.
Ko'pincha issiqlik muhandislik hisoblarida chiziqli bo'lmagan bog'liqlik (1.26) chiziqli bilan almashtiriladi:
c = a + ichida t. (1,27)
|
Agar (1.26) tenglama bo'yicha issiqlik sig'imining haroratga bog'liqligini grafik tarzda tuzadigan bo'lsak, bu egri chiziqli bog'liqlik bo'ladi (1.4-rasm). Rasmda ko'rsatilganidek, har bir harorat qiymati o'z issiqlik sig'imi qiymatiga ega, bu odatda haqiqiy issiqlik sig'imi deb ataladi. Matematik jihatdan haqiqiy issiqlik sig'imining ifodasi quyidagicha yoziladi:
|
|
|
|
Demak, haqiqiy issiqlik sig'imi cheksiz kichik dq issiqlik miqdorining dt haroratning cheksiz kichik o'zgarishiga nisbati hisoblanadi. Boshqacha qilib aytganda, haqiqiy issiqlik sig'imi gazning ma'lum bir haroratdagi issiqlik sig'imidir. Shaklda. 1.4, t 1 haroratdagi haqiqiy issiqlik sig'imi t1 bilan ko'rsatilgan va 1-4 segment sifatida, t 2 haroratda - t2 bilan tasvirlangan va 2-3 segment sifatida tasvirlangan. (1.28) tenglamadan olamiz dq=cdt. (1,29) Amaliy hisob-kitoblarda biz doimo aniqlaymiz oxirgi o'zgarishdagi issiqlik miqdori |
harorat. Ko‘rinib turibdiki, moddaning t 1 dan t 2 gacha qizdirilganda uning birlik miqdoriga bildiriladigan issiqlik miqdori q ni t 1 dan t 2 gacha integrallash orqali (1.29) topish mumkin.
 .
(1.30)
.
(1.30)
Grafik jihatdan integral (1.30) 4-1-2-3 maydoni bilan ifodalanadi. Agar (1.30) ifodada haqiqiy issiqlik sig'imi qiymatini chiziqli bog'liqlik (1.27) ga almashtirsak, unda biz hosil bo'lamiz.
 (1.31)
(1.31)
qayerda  - t 1 dan t 2 gacha bo'lgan harorat oralig'ida o'rtacha issiqlik quvvati.
- t 1 dan t 2 gacha bo'lgan harorat oralig'ida o'rtacha issiqlik quvvati.
 ,
(1.32)
,
(1.32)
Shuning uchun o'rtacha issiqlik sig'imi - bu issiqlikning yakuniy miqdori q ning oxirgi harorat o'zgarishi t 2 - t 1 nisbati:
 .
(1.33)
.
(1.33)
Agar 4-3 (1.4-rasm) asosida 4-1¢-2¢-3 o'lchamdagi to'rtburchaklar 4-1-2-3 shakliga teng bo'lsa, u holda bu to'rtburchakning balandligi bo'ladi. o'rtacha issiqlik quvvatiga teng bo'lishi, bu erda  t 1 - t 2 harorat oralig'ida bo'ladi.
t 1 - t 2 harorat oralig'ida bo'ladi.
Odatda, o'rtacha issiqlik sig'imlarining qiymatlari moddalarning termodinamik xususiyatlari jadvallarida keltirilgan. Biroq, ushbu jadvallarning hajmini kamaytirish uchun ular 0 ° C dan t ° C gacha bo'lgan harorat oralig'ida aniqlangan o'rtacha issiqlik quvvatlarining qiymatlarini beradi.
Agar ma'lum bir harorat oralig'ida t 1 - t 2 o'rtacha issiqlik sig'imi qiymatini hisoblash zarur bo'lsa, u holda buni quyidagicha amalga oshirish mumkin.
c \u003d f (t) egri chizig'i ostidagi 0a14 maydoni (1.4-rasm) gaz haroratini 0 ° C dan t 1 ° C gacha oshirish uchun zarur bo'lgan q 1 issiqlik miqdoriga mos keladi.

Xuddi shunday, harorat 0 o C dan t 2 o C gacha ko'tarilganda 0a23 maydoni q 2 ga to'g'ri keladi:

Shunday qilib, q \u003d q 2 - q 1 (maydon 4123) quyidagicha ifodalanishi mumkin
![]() (1.34)
(1.34)
(1.34) ga muvofiq q qiymatini (1.33) ifodaga almashtirib, har qanday harorat oralig'idagi o'rtacha issiqlik sig'imi formulasini olamiz:
 .
(1.35)
.
(1.35)
Shunday qilib, o'rtacha issiqlik sig'imi (1.35) tenglamadan foydalangan holda jadvaldagi o'rtacha issiqlik quvvatlaridan hisoblanishi mumkin. Bundan tashqari, biz c = f (t) chiziqli bo'lmagan bog'liqlikni olamiz. Chiziqli munosabat yordamida (1.32) tenglama yordamida o'rtacha issiqlik sig'imini ham topishingiz mumkin. a va qiymatlari ichida(1.32) tenglamada turli gazlar uchun adabiyotda keltirilgan.
Ishchi suyuqlik bilan ta'minlangan yoki undan chiqarilgan issiqlik miqdori har qanday tenglama yordamida hisoblanishi mumkin:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
qayerda 

 - mos ravishda o'rtacha massa, hajm va molyar issiqlik sig'imi; M - gazning massasi; n - gazning kilomollari soni; V n - normal sharoitdagi gaz hajmi.
- mos ravishda o'rtacha massa, hajm va molyar issiqlik sig'imi; M - gazning massasi; n - gazning kilomollari soni; V n - normal sharoitdagi gaz hajmi.
Gazning V n hajmini quyidagicha topish mumkin. Berilgan shartlar uchun holat tenglamasini yozgandan so'ng: pV = MRT va normal sharoit uchun: p n V n = MRT n, biz ikkinchi tenglamani birinchisiga bog'laymiz:
 ,
,
bu yerdan  .
(1.39)
.
(1.39)
Gaz aralashmalarining issiqlik sig'imi
Agar aralashmaning tarkibi berilgan bo'lsa va aralashmaning tarkibiga kiruvchi komponentlarning issiqlik sig'imlari ma'lum bo'lsa, gaz aralashmasining issiqlik sig'imi hisoblanishi mumkin.
M sm massali aralashmani 1 K ga qizdirish uchun har bir komponentning haroratini ham 1 K ga oshirish kerak. Shu bilan birga, c i M i ga teng issiqlik miqdori aralashmaning i-chi komponentini M i massa bilan qizdirishga sarflanadi. Butun aralashma uchun issiqlik miqdori  ,
,
bu erda c i va c sm - i-chi komponent va aralashmaning massa issiqlik sig'imlari.
Oxirgi ifodani M sm ga bo'lib, aralashmaning massa issiqlik sig'imi uchun hisoblash formulasini olamiz:
 ,
(1.40)
,
(1.40)
bu yerda m i - i-komponentning massa ulushi.
Shunga o'xshab, biz aralashmaning hajmli issiqlik sig'imi c¢ sm va molyar issiqlik sig'imi c m sm ni topamiz:
 (1.41)
(1.41)
Bu erda c¢ i - i-komponentning hajmli issiqlik sig'imi, r i - i-chi komponentning hajm ulushi,
 ,
(1.42)
,
(1.42)
Bu erda c m i - i-komponentning molyar issiqlik sig'imi,
r i - i-komponentning mol (hajm) ulushi.
Issiqlik dvigatellarida (mashinalarda) ishchi suyuqlik turli gazlar aralashmasidir. Agar aralashmaning tarkibiy qismlari bir-biri bilan kimyoviy reaksiyaga kirmasa va har bir komponent Kleyperon holat tenglamasiga bo'ysunsa, bunday aralashma ideal gaz hisoblanadi.
Aralashmani hisoblash uchun m sm - o'rtacha molyar massa va R c m - aralashmaning o'ziga xos gaz konstantasini aniqlash kerak. Ularni aniqlash uchun aralashmaning tarkibini bilish kerak, ya'ni qaysi komponentlar va qanday miqdorda bu aralashmani hosil qiladi, aralashmaga kiritilgan har bir komponent qanday parametrlarga ega.
Aralashmaning har bir komponenti aralashmada boshqa gazlar yo'qdek harakat qiladi, aralashma joylashgan butun mavjud hajmni egallaydi, o'z holat tenglamasiga amal qiladi va devorlarga qisman bosim deb ataladigan bosimni o'tkazadi. aralashmaning barcha komponentlari bir xil va aralashmaning haroratiga teng.
Dalton qonuniga ko'ra, aralashmaning bosimi P aralashmaning tarkibiga kiradigan alohida komponentlarning qisman bosimlari yig'indisiga teng:
bu erda n - aralashmaning tarkibiy qismlari soni.
Amag qonuniga ko'ra, aralashmaning hajmi V aralashmaning harorati va bosimida aralashmaning tarkibiga kiradigan alohida komponentlarning qisman hajmlari yig'indisiga teng:
 , (1.21)
, (1.21)
bu erda - qisman hajm, m 3; V- aralashmaning hajmi, m 3
Aralashmaning tarkibi hajm (molyar) yoki massa ulushlari bilan beriladi.
i-komponentning hajm ulushi komponentning qisman hajmining aralashmaning hajmiga nisbati, ya'ni, keyin aralashmaning tarkibiy qismlarining hajm ulushlari yig'indisi 1 ga teng, ya'ni. Agar qiymat % da berilgan bo'lsa, ularning yig'indisi = 100%.
i-komponentning molyar ulushi n i N i komponentining kilomollari sonining N aralashmaning kilomollari soniga nisbati, ya'ni bu erda. ![]() , , ya'ni har bir komponentning va umuman aralashmaning kilomollari soni mos keladigan komponent va aralashmaning bir kilomol egallagan hajmga nisbatiga teng.
, , ya'ni har bir komponentning va umuman aralashmaning kilomollari soni mos keladigan komponent va aralashmaning bir kilomol egallagan hajmga nisbatiga teng.
Xuddi shu sharoitda ideal gazning bir xil hajmdagi kilomolga ega ekanligini hisobga olsak, almashtirishdan keyin biz quyidagilarga ega bo'lamiz:, ya'ni ideal gazlar uchun molyar va hajm kasrlari son jihatdan tengdir.
i-komponentning massa ulushi komponent massasining aralashma massasiga nisbati: , shundan kelib chiqadiki, aralashmaning massasi tarkibiy qismlarning massalari yig'indisiga teng, shuningdek, tarkibiy qismlarning massa ulushlari yig'indisi tengdir. 1 ga (yoki 100%).
Hajm ulushlarini massa ulushlariga va aksincha aylantirish quyidagi nisbatlarga asoslanadi:
![]() ,
,
bu erda r = m / 22,4, kg / m 3.
Bundan kelib chiqadiki, i-komponentning massa ulushi quyidagi munosabatdan aniqlanadi:
 ,
,
bu erda aralashmaning zichligi, kg / m 3, i-chi komponentning hajm ulushi.
Kelajakda uni hajm kasrlari orqali aniqlash mumkin.
 .
.
Zichlik hajmli fraktsiyalar uchun aralashmalar nisbatdan aniqlanadi
 , qayerda
, qayerda  , (1.22)
, (1.22)
 .
.
Qisman bosim quyidagi formulalar bilan aniqlanadi:
![]() yoki
yoki  (1.23)
(1.23)
Komponentlarning va umuman aralashmaning holati tenglamalari quyidagi shaklga ega:
![]() ;
;
![]() ,
,
bu erdan, transformatsiyalardan so'ng, biz uchun olamiz katta ulushlar
 ,
,  . (1.24)
. (1.24)
Uchun aralashmaning zichligi va solishtirma hajmi katta baham ko'ring:
;  . (1.25)
. (1.25)
Qisman bosimni hisoblash uchun quyidagi formuladan foydalaniladi:
 . (1.26)
. (1.26)
Massa ulushlarini hajm kasrlariga aylantirish quyidagi formula bo'yicha amalga oshiriladi:
 .
.
Gazlar aralashmasining issiqlik sig'imini aniqlashda, gaz aralashmasini isitish (sovutish) uchun aralashmaning har bir komponentini isitish (sovutish) kerak deb taxmin qilinadi.
Bu yerda Q i =M i c i ∆t - aralashmaning i-komponentining haroratini o'zgartirishga sarflangan issiqlik, c i - aralashmaning i-komponentining massa issiqlik sig'imi.
Aralashmaning issiqlik sig'imi nisbatdan aniqlanadi (agar aralashma massa ulushlari bilan berilgan bo'lsa)
 , xuddi shunday
, xuddi shunday  . (1.28)
. (1.28)
Hajm ulushlari bilan berilgan aralashmaning molyar va hajmli issiqlik sig'imlari bilan aniqlanadi
 ;
;  ;
;
 ;
; 
1.5-misol Quruq havo massasi g O2 \u003d 23,3% kislorod va g N 2 \u003d 76,6% azotdan iborat. Havo tarkibini hajm bo'yicha (r O2 va r N 2) va aralashmaning gaz doimiyligini aniqlang.
Yechim.
1. 1-jadvaldan kg/kmol va kg/kmol ni topamiz
2. Kislorod va azotning hajm ulushlarini aniqlang:
1. Havoning (aralashmaning) gaz konstantasi quyidagi formula bilan aniqlanadi:
 , J/kg K
, J/kg K
1.6-misol. Massasi M = 2 kg bo‘lgan gaz aralashmasini P = const da og‘irlik bo‘yicha % dan iborat bo‘lgan issiqlik miqdorini aniqlang: , , , , harorat t 1 =900 ° C dan t 2 = 1200 gacha o‘zgarganda. ° C.
Yechim:
1. P=const va t 1 =900 o C (P2 dan) da gaz aralashmasini tashkil etuvchi komponentlarning o‘rtacha massa issiqlik sig‘imini aniqlang:
1,0258 kJ/kg K; =1,1045 kJ/kg K;
1,1078 kJ/kg K; =2,1097 kJ/kg K;
2. P=const va t 1 =1200 o C (P2 dan) da gaz aralashmasini tashkil etuvchi komponentlarning o‘rtacha massa issiqlik sig‘imini aniqlaymiz:
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kg K; =2,2106 kJ/kg K;
3. Biz aralashmaning o'rtacha massa issiqlik sig'imini harorat oralig'i uchun aniqlaymiz: t 2 \u003d 1200 ° C va t 1 \u003d 900 ° C:
4. P=const da 2 kg aralashmani isitish uchun issiqlik miqdori:
Termodinamikaning birinchi qonuni tizimning ichki energiyasining o'zgarishi va ishchi suyuqlikni issiqlik bilan ta'minlash natijasida atrof-muhitning tashqi bosim kuchlariga qarshi bajarilgan mexanik ish o'rtasidagi miqdoriy bog'liqlikni o'rnatadi.
Yopiq termodinamik tizim uchun birinchi qonun tenglamasi shaklga ega
Ishchi suyuqlikka (yoki tizimga) berilgan issiqlik tana haroratining ko'tarilishi tufayli uning ichki energiyasini (dU) oshirishga va ishchi suyuqlikning kengayishi va uning ko'payishi hisobiga tashqi ishlarni bajarishga (dL) sarflanadi. hajmi.
Birinchi qonunni dH=dq+VdP=dq-dL 0 shaklida yozish mumkin,
Bu erda dL 0 \u003d VdP - bosim o'zgarishining elementar ishi foydali tashqi (texnik) ish deb ataladi.
dU - molekulalarning issiqlik harakati energiyasini (translyatsiya, aylanish va tebranish) va molekulalarning o'zaro ta'sirining potentsial energiyasini o'z ichiga olgan ishchi suyuqlikning (tizimning) ichki energiyasining o'zgarishi.
Tizimning bir holatdan ikkinchi holatga o'tishi issiqlik ta'minoti natijasida sodir bo'lganligi sababli, ishchi suyuqlik qiziydi va uning harorati dT ga ko'tariladi va hajmi dV ga ortadi.
Tana haroratining oshishi uning zarrachalarining kinetik energiyasining oshishiga olib keladi va tana hajmining oshishi zarrachalarning potentsial energiyasining o'zgarishiga olib keladi. Natijada tananing ichki energiyasi dU ga ortadi, shuning uchun ichki energiya U tananing holatiga bog'liq va ikkita mustaqil parametr U=f 1 (P,V) funktsiyasi sifatida ifodalanishi mumkin; U=f 2 (P,T), U=f 3 (y,T). Termodinamik jarayonda ichki energiyaning o'zgarishi faqat boshlang'ich (U 1) va yakuniy (U 2) holatlar bilan belgilanadi, ya'ni.
Differensial shaklda ichki energiyaning o'zgarishi yoziladi
a) solishtirma hajm va harorat funksiyasi sifatida

b) haroratning funksiyasi sifatida, chunki , keyin
C v ning harorat bilan o'zgarishini hisobga olish kerak bo'lgan amaliy hisoblar uchun maxsus ichki energiyaning empirik formulalari va jadvallari mavjud (ko'pincha molyar). Ideal gazlar uchun aralashmaning molyar ichki energiyasi U m formula bilan aniqlanadi
 , J/kmol
, J/kmol
Massa ulushlari bilan berilgan aralashma uchun. Shunday qilib ichki energiya u yerda tizimning xossasi va tizim holatini tavsiflaydi.
Entalpiya Kamerling-Onnes tomonidan kiritilgan termal holat funksiyasi, (g'olib Nobel mukofoti, 1913), bu tizimning ichki energiyasining yig'indisi U va tizim bosimi P va uning hajmi V.
Unga kiritilgan miqdorlar davlat funktsiyalari bo'lganligi sababli, H ham holat funktsiyasidir, ya'ni H \u003d f 1 (P, V); H=f 2 (V,T); H=f 3 (P, T).
Har qanday termodinamik jarayonda dH entalpiyasining o'zgarishi dastlabki H 1 va oxirgi H 2 holatlari bilan belgilanadi va jarayonning tabiatiga bog'liq emas. Agar tizimda 1 kg modda bo'lsa, u holda o'ziga xos entalpiya, J / kg qo'llaniladi.
Ideal gaz uchun differentsial tenglama shaklga ega
shunga ko'ra, o'ziga xos entalpiya formula bilan aniqlanadi
Termodinamikaning birinchi qonuni tenglamasi dq=dU+Pdy bo'lib, ishning yagona turi kengayish ishi Pdy=d(Py)-ydP bo'lsa, u holda dq=d(U+Py)-ydP, bu erdan
Amaliy ish№ 2
Mavzu: Issiqlik sigimi, entalpiya, ideal gazlar aralashmalari, ichki energiya, ish, termodinamik jarayonlar.
Ishning maqsadi: Nazariy mashg'ulot davomida olingan bilimlarni mustahkamlash, issiqlik texnikasi hisob-kitoblarini amalga oshirish ko'nikmalarini egallash.
I. Asosiy ta'riflar, formulalar va tenglamalar
1. Ideal gazlarning aralashmalari
Gaz aralashmasi - bu bir-biri bilan kimyoviy ta'sir o'tkazmaydigan bir nechta gazlarning mexanik aralashmasi. Aralashmadagi gazlarning har biri gaz komponenti deyiladi; aralashmada boshqa gazlar yo'qdek o'zini tutadi, ya'ni. aralashma bo'ylab teng ravishda taqsimlanadi. Aralashmaning har bir gazining idish devorlariga ta'sir qiladigan bosimi qisman bosim deb ataladi. Ideal gazlar aralashmalari uchun asosiy qonun Dalton qonuni bo'lib, unga ko'ra aralashmaning bosimi aralashmani hosil qiluvchi gazlarning qisman bosimlari yig'indisiga teng:
2. Ichki energiya
Tananing ichki energiyasi - bu tanani tashkil etuvchi mikrozarrachalar harakatining kinetik energiyasi va ularning potentsial energiyasi. o'zaro ta'sir belgilangan. o'zaro tortishish yoki itarish kuchlari. Ichki energiyaning mutlaq qiymatini aniqlash mumkin emas, shuning uchun termodinamik hisob-kitoblarda ichki energiyaning mutlaq qiymati emas, balki uning o'zgarishi, ya'ni.
![]() yoki
yoki ![]()
bu erda U 1 va U 2 - ishchi suyuqlikning (gaz) boshlang'ich va yakuniy holatining ichki energiyasi;
u 1 va va 2 - urish. ishchi suyuqlikning dastlabki va oxirgi holatining ichki energiyasi.
Bundan kelib chiqadiki, ichki energiyaning o'zgarishi jarayonning tabiati va yo'liga bog'liq emas, balki o'zgarish jarayonining boshida va oxirida ishchi suyuqlikning holati bilan belgilanadi.
Ideal gazning o'ziga xos xususiyati - unda molekulyar o'zaro ta'sir kuchlarining yo'qligi va shuning uchun ichki potentsial energiyaning yo'qligi, ya'ni. U n \u003d 0 va U „ \u003d 0. Shuning uchun ideal gazning ichki energiyasi:
U=U k =f(T) unu u=uk =f(T).
H. Gaz ishi.
Termodinamikada energiya almashinuvi natijasida ishchi suyuqlik holatining har qanday o'zgarishi muhit jarayon deb ataladi. Bunday holda, ishchi organning asosiy parametrlari o'zgartiriladi:
Issiqlikning mexanik ishga aylanishi ishchi suyuqlik holatini o'zgartirish jarayoni bilan bog'liq. Gaz holatini o'zgartirish jarayonlari kengayish va qisqarish jarayonlari bo'lishi mumkin. M (kg) gazning ixtiyoriy massasi uchun ish quyidagilarga teng:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
bu erda l \u003d p (v 2 -v 1) J / kg - 1 kg gazning ishi yoki muayyan ish.
4. Gaz entalpiyasi,
Entalpiya - bu ishchi suyuqlikning (gazning) atrof-muhit bilan bog'lanishining potentsial energiyasini tavsiflovchi parametr. Entalpiya va xususiy entalpiya:
I \u003d U + pV, J va i i \u003d va + pv, J / kg.
5. Issiqlik sig'imi.
Maxsus issiqlik sig'imi - 1 kg gazni ma'lum bir harorat oralig'ida 1 ° C ga isitish uchun berilishi kerak bo'lgan issiqlik miqdori.
Maxsus issiqlik sig'imi massa, hajm va kilomol. C massasi, hajm C va kilomol C issiqlik sig'imlari o'rtasida bog'liqlik mavjud:
 ;
; 
bu erda Vo 22,4 m 3 / kmol - uradi. normal sharoitda gaz hajmi.
Ommaviy ud. gaz aralashmasining issiqlik sig'imi:

Volumetrik o'ziga xos issiqlik gaz aralashmasi:

Gaz aralashmasining kilomolyar solishtirma issiqligi:

6. Issiqlik miqdorini aniqlash tenglamasi
Ishchi suyuqlik (gaz) tomonidan chiqarilgan yoki qabul qilingan issiqlik miqdorini tenglama bilan aniqlash mumkin:
Q \u003d M C m (t 2 -t 1), J yoki Q \u003d VC (t-t), J, bu erda M va V - gazning og'irligi yoki hajmi, kg yoki m 3;
t u t - jarayonning oxirida va boshida gaz harorati ° S;
C va C - massa va hajmning o'rtacha zarbalari. gazning issiqlik sig'imi
T cp \u003d J / kgK yoki J / m 3 K da
7. Termodinamikaning birinchi qonuni
Bu qonun issiqlik va mexanik ishlarning o'zaro konversiyalarini ko'rib chiqadi. Bu qonunga ko'ra issiqlik mexanik ishga va aksincha, mexanik ish issiqlikka qat'iy ekvivalent miqdorda aylanadi. Issiqlik va ish uchun ekvivalent tenglama quyidagi ko'rinishga ega:
Issiqlik va ishning ekvivalentligi printsipini hisobga olgan holda, gazning ixtiyoriy massasi uchun issiqlik balansi tenglamasi:
Q \u003d U + L va q \u003d u + l \u003d u -u + l
Muammoni hal qilishII
№1 vazifa (№1)
Atmosfera quruq havosi quyidagi taxminiy massa tarkibiga ega: g 02 =23,2%, g N 2 =76,8%.
Havoning hajmli tarkibini, uning gaz konstantasini, ko'rinadigan molekulyar og'irligini, kislorod va azotning parsial bosimini, agar havo P = 101325 Pa bo'lsa, barometr yordamida aniqlang.
Men havoning hajmli tarkibini aniqlayman:
 ;
; ;
;
bu erda r - massa ulushi;
m - nisbiy molekulyar og'irlik;
g - hajm ulushi.
m havo. =m O2 r O2 +m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
bu erda R 0 - gaz doimiysi.
Men turli gazlarning qisman bosimlarini aniqlayman:
P O 2 \u003d P sm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P sm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
bu erda P O 2, P N 2 - qisman bosim;
P sm - aralashmaning bosimi.
Vazifa №2 (№2)
Idish qism bilan 2 qismga bo'linadi, ularning hajmlari V 1 =1,5 m 3 va V 2 =1,0 m 3 . V 1 hajmning birinchi qismida P 1 =0,5 MPa va t 1 =30 ° S da CO 2 mavjud; V 2 hajmning ikkinchi qismi P 2 =0,2 MPa va t 2 =57 ° S da O 2 ni o'z ichiga oladi. CO 2 va O 2 ning massa va hajm ulushlarini, aralashmaning ko'rinadigan molekulyar og'irligini va bo'linish olib tashlanganidan va aralashtirish jarayoni tugagandan so'ng uning gaz doimiyligini aniqlang.
Men individual gaz konstantalarini aniqlayman:
Buning uchun men nisbiy molekulyar og'irlikni aniqlayman: m (CO 2) \u003d 32 + 12 \u003d 44; m(O 2)=32;

 ;
;
![]()
 ;
;
Klaiperonning xarakterli tenglamasiga ko'ra, men gazlarning massalarini aniqlayman:
 (kg);
(kg);
 (kg);
(kg);
Men massa ulushlarini aniqlayman:


Men hajm kasrlarini aniqlayman:


Havoning ko'rinadigan molekulyar og'irligini aniqlang:
m havo. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 \u003d 41,48;
Men havo uchun individual gaz konstantasini aniqlayman (R):

 ;
;
№3 vazifa (№6)
Hajmi 300 l bo'lgan idishda P 1 \u003d 0,2 MPa va t 1 \u003d 20 0 S bosimda kislorod mavjud. Kislorod harorati t 2 \u003d 300 0 S gacha ko'tarilishi uchun qancha issiqlik berilishi kerak. ? Idishda qanday bosim o'rnatiladi? Hisoblash uchun kislorodning n.o.dagi oʻrtacha hajmli solishtirma issiqligini oling. C 02 \u003d 0,935 
Charlz qonuniga ko'ra, men jarayonning yakuniy bosimini aniqlayman:
;  (Pa);
(Pa);
bu erda P, T - gaz parametrlari.
Men kislorod (R) uchun individual gaz konstantasini aniqlayman:

 ;
;
Jarayon izoxorik bo'lganligi sababli, men mos keladigan formula bo'yicha etkazib berilishi kerak bo'lgan issiqlik miqdorini aniqlayman: Q v \u003d M C cv (T 2 -T 1) buning uchun Claiperon xarakteristikasi tenglamasiga ko'ra, men massani aniqlayman. gaz
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
№4 vazifa (№7)
Doimiy ortiqcha bosimda 2m 3 havoni isitish uchun qancha issiqlik sarflash kerak P ex. \u003d 0,2 MPa 100 0 S haroratdan 500 0 S haroratgacha. Bu holda havo qanday ish qiladi? Hisoblash uchun qabul qiling: atmosfera bosimi P at. \u003d 0,1 MPa, havoning o'rtacha massa izobar issiqlik sig'imi C pm \u003d 1,022  ; havoning ko'rinadigan molekulyar og'irligi M havo ekanligini hisobga olib, gaz konstantasini hisoblang. =29.
; havoning ko'rinadigan molekulyar og'irligi M havo ekanligini hisobga olib, gaz konstantasini hisoblang. =29.
Men havo uchun individual gaz konstantasini aniqlayman:

 ;
;
Mutlaq bosim ortiqcha va atmosfera P=P est yig'indisiga teng. + P da. =0,1+0,2=0,3 MPa
 (kg);
(kg);
Jarayon izobarik bo'lgani uchun men Q va L ni tegishli formulalar bo'yicha aniqlayman:
Gey-Lyusak qonuniga ko'ra, men yakuniy hajmni aniqlayman:
 m 3;
m 3;
Q \u003d M C pm (T 2 -T 1) \u003d 5,56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2,15 \u003d 645000 (J).
Vazifa №5 (№8)
Tsilindrda P=0,5 MPa bosim va t 1 =400 0 S haroratda havo mavjud. P=const da issiqlik havodan chiqariladi, jarayon oxirida harorat t 2 =0 0 C bo'ladi. Havo bo'lgan silindrning hajmi V 1 \u003d 400l.
Chiqarilgan issiqlik miqdorini, yakuniy hajmni, ichki energiyaning o'zgarishini va siqishning mukammal ishini aniqlang C pm =1,028  .
.
Jarayon izobarik bo'lganligi sababli, Gey-Lyussak qonuniga binoan men yakuniy hajmni aniqlayman:
 m 3;
m 3;
Klaiperonning xarakterli tenglamasiga ko'ra, men gazning massasini aniqlayman:
Oldingi masaladan R=286,7 
 (kg);
(kg);
Men chiqarilgan issiqlik miqdorini aniqlayman:
Q=M C pm (T 2 -T 1)=1,03 1028 (273-673)=-423536 (J);
Men sarflangan ish hajmini aniqlayman:
L=P (V 2 -V 1)= 500 000 (0,16-0,4)=-120 000 (J);
Umumiy miqdor aniqlanadigan tenglamadan men ichki energiya miqdorining o'zgarishini aniqlayman:
![]() ; (J)
; (J)
Muammo №6 (#9)
P 1 =1,1 MPa va t 1 =25 s bosimda V 1 =0,02 m3 hajmli havo harakatlanuvchi pistonli silindrda P 2 =0,11 MPa bosimgacha kengayadi. Agar silindrda kengayish sodir bo'lsa, yakuniy hajm V 2, oxirgi harorat t 2, havo tomonidan bajarilgan ish va berilgan issiqlikni toping:
a) izotermik
b) adiabatik ko'rsatkich k=1,4 bilan adiabatik
v) politropik ko'rsatkich n=1,3 bo'lgan politropik
Izotermik jarayon:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0,02 1,1 / 0,11 \u003d 0,2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000J
adiabatik jarayon:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036M 3
T 2 / T 1 \u003d (P 2 / P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 298 \u003d 20,32k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1,4-1) (1,1 10 6 0,02 -0,11 10 6 0, 1)=2,0275 10 6 J
Politropik jarayon:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118M 3
T 2 / T 1 \u003d (P 2 / P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1,3-1)) (1,1 10 6 0,02 -0,11 10 6 0,118)=30000J
Q=(k-n/k-1) l M=((1,4-1,3)/(1,4-1)) 30000=7500J
Adabiyot:
1. Energetika, Moskva, 1975 yil.
2. Litvin A.M. "Issiqlik texnikasining nazariy asoslari", "Energiya" nashriyoti, Moskva, 1969 yil.
3. Tugunov P.I., Samsonov A.A., "Issiqlik texnikasi, issiqlik dvigatellari va bug 'energetikasi asoslari", Nedra nashriyoti, Moskva, 1970 y.
4. Krutov V.I., "Issiqlik texnikasi", "Muhandislik" nashriyoti, Moskva, 1986 yil.
Gaz aralashmalari. Gazlarning issiqlik sig'imi
Gaz aralashmalari deganda bir-biri bilan kimyoviy ta'sir o'tkazmaydigan bir nechta gazlarning mexanik aralashmasi tushuniladi. Ideal gazlar aralashmasi tegishli barcha qonunlarga bo'ysunadi ideal gazlar. Gaz aralashmasining tarkibi aralashma tarkibiga kiradigan har bir gazning miqdori bilan belgilanadi va massa yoki hajm ulushlari bilan belgilanishi mumkin:
bu yerda --chi komponentning massasi, --chi komponentning hajmi va va - mos ravishda butun aralashmaning massasi va hajmi.
Bu aniq
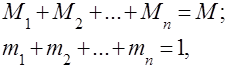
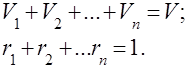
Gazlar aralashmalari bilan amaliy masalalarni echish qulayligi uchun gazlar aralashmasining ko'rinadigan molekulyar og'irligi tushunchasi kiritilgan, bu aralashmaning alohida tarkibiy qismlarining haqiqiy molekulyar og'irliklarining o'rtacha massasi.
Gazlar aralashmasi uchun holat tenglamasi quyidagi ko'rinishga ega:
Gaz aralashmalari universal gaz konstantasi kontseptsiyasiga bo'ysunadi
Gaz aralashmasining bosimi va aralashmaning tarkibiga kiradigan alohida komponentlarning qisman bosimi o'rtasidagi bog'liqlik Dalton qonuni bilan belgilanadi:
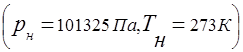
1 gaz bosim va haroratga qarab har xil massaga ega. Shu munosabat bilan, hajmli issiqlik sig'imi har doim normal sharoitda 1 ga o'ralgan gaz massasiga aytiladi. Bunda har xil gazlarning 1 kmol hajmi 22,4/kmol, universal gaz konstantasi esa . Gazni issiqlik bilan ta'minlash usuliga ko'ra, izobarik va izoxorik issiqlik sig'imlari mavjud. Bu miqdorlarning nisbati adiabatik ko'rsatkich deyiladi
Issiqlik sig'imlari Mayer munosabati bilan ham bog'liq
dan gacha bo'lgan harorat oralig'ida 1 kg gazni isitish jarayonida sarflanishi kerak bo'lgan issiqlik miqdori formula bilan aniqlanadi:
qayerda va mos ravishda 0°- va 0°- ichidagi o'rtacha issiqlik sig'imlari.
Agar jarayonda (kg) yoki () gaz ishtirok etsa, u holda
Gaz aralashmasining issiqlik sig'imi quyidagi formulalar bilan aniqlanishi kerak:
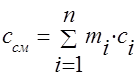
massa - ;
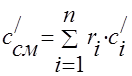
volumetrik -;
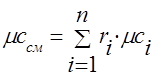
molar -.
Qozon agregatida yonilg'i yonishi mahsuloti bo'lgan gazlarning issiqligini ishlatish uchun ikkinchisining gaz kanallariga yonilg'i yoqish uchun zarur bo'lgan havoning havo isitgichlari o'rnatiladi (1-rasm). Qozondan chiqadigan gazlar havo isitgichiga harorat bilan kiradi va sovutiladi, havoga issiqlik beradi. Qozon agregatining gaz kanalida tutun chiqarish moslamasining ishlashi ta'siri ostida atmosferadan biroz pastroq bosim o'rnatiladi. Havo isitgichidagi havo haroratdan haroratgacha isitiladi.
tutun gazlari
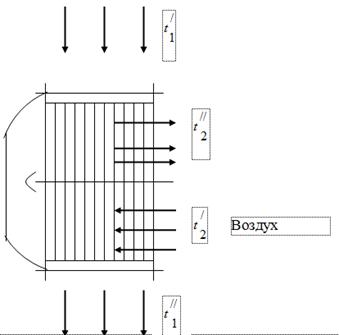
Qozon blokini sinovdan o'tkazishda quyidagi ma'lumotlar olindi:
Havo isitgichiga kirish joyidagi gazlarning harorati, = 450 ° C.
Havo isitgichining chiqishidagi gazlarning harorati, = 150 ° S.
Havo isitgichiga kirish joyidagi havo harorati, = 26 ° S.
Havo isitgichining chiqishidagi havo harorati, = 260 ° S.
Tutun gazlarining hajmli tarkibi - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Gazlarning soatlik iste'moli 50 ·/soat.
Gaz kanalidagi vakuum - 15 mm suv. Art.
Barometrik bosim 760 mm Hg. Art.
Belgilang:
tutun gazlarining aniq molekulyar og'irligi;
chiqindi gaz doimiy;
chiqindi gazlarni tashkil etuvchi alohida komponentlarning og'irlik (massa) ulushlari;
Komponentlarning qisman bosimi:
soatlik havo oqimi.
Faraz qilaylik, gaz chiqaradigan barcha issiqlik havo tomonidan olinadi.
Issiqlik sig'imining haroratga bog'liqligi egri chiziqli deb hisoblanadi.
1. Tutun gazlarining ko'rinadigan molekulyar og'irligi
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Tutun gazining doimiysi
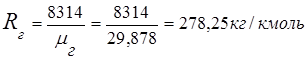
3. Massa ulushlari gaz komponentlari
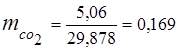
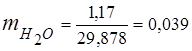
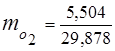
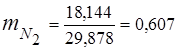
4. Komponentlarning qisman bosimlari
Hisoblash natijalari jadvalga kiritiladi
|
Variantlar |
gaz aralashmasi |
|||
|
|
||||
|
|
||||
|
|
5. Soatlik havo sarfi
Havo iste'moli havo isitgichining issiqlik balansi tenglamasidan aniqlanadi
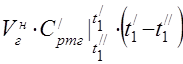
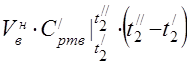
450 ° S da o'rtacha molyar issiqlik quvvati
0 ... 450 ° S harorat oralig'ida komponentlarning o'rtacha o'ziga xos issiqlik quvvati.













 .
(1.28)
.
(1.28)