Ideal gazlarning molekulyar-kinetik nazariyasi
Bilasizmi,
fikrlash tajribasi, gedanken tajribasi nima?
Bu mavjud bo'lmagan amaliyot, boshqa dunyo tajribasi, aslida mavjud bo'lmagan narsaning tasavvuridir. Tafakkur tajribalari kunduzgi tushga o'xshaydi. Ular yirtqich hayvonlarni tug'adilar. Gipotezalarning eksperimental sinovi bo'lgan fizik eksperimentdan farqli o'laroq, "fikr tajribasi" eksperimental testni sehrli tarzda kerakli, tekshirilmagan xulosalar bilan almashtiradi, mantiqning o'zini haqiqatda buzadigan mantiqiy tuzilmalarni manipulyatsiya qiladi, isbotlanmagan binolarni isbotlanganlar sifatida ishlatadi, ya'ni almashtirish. Shunday qilib, "fikr tajribalari" da'vogarlarining asosiy vazifasi haqiqiy jismoniy eksperimentni o'zining "qo'g'irchog'i" bilan almashtirish orqali tinglovchini yoki o'quvchini aldashdir - jismoniy tekshiruvsiz shartli ravishda soxta fikr yuritish.
Fizikani xayoliy, "fikr tajribalari" bilan to'ldirish dunyoning bema'ni, surreal, chalkash manzarasiga olib keldi. Haqiqiy tadqiqotchi bunday "o'ramlarni" haqiqiy qadriyatlardan farqlashi kerak.
Relyativistlar va pozitivistlarning ta'kidlashicha, "fikr tajribasi" nazariyalarni (shuningdek, ongimizda paydo bo'lgan) izchillik uchun tekshirish uchun juda foydali vositadir. Bunda ular odamlarni aldashadi, chunki har qanday tekshirish faqat tekshirish ob'ektidan mustaqil manba tomonidan amalga oshirilishi mumkin. Gipotezani talab qiluvchining o'zi o'z bayonotining sinovi bo'la olmaydi, chunki bu bayonotning sababi arizachiga ko'rinadigan qarama-qarshiliklarning yo'qligidir.
Buni biz ilm-fanni boshqaradigan dinning bir turiga aylangan SRT va GTR misolida ko'ramiz va jamoatchilik fikri. Ularga qarama-qarshi bo'lgan ko'p faktlar Eynshteyn formulasini yengib chiqa olmaydi: "Agar fakt nazariyaga to'g'ri kelmasa, faktni o'zgartiring" (Boshqa versiyada "Fakt nazariyaga mos kelmaydimi? - Fakt uchun bundan ham yomoni. ").
"Fikrlash tajribasi" da'vo qilishi mumkin bo'lgan maksimal narsa bu gipotezaning arizachining o'ziga xosligi doirasidagi ichki izchilligi, ko'pincha to'g'ri, mantiqiy emas. Amaliyotga rioya qilish buni tekshirmaydi. Haqiqiy sinov faqat haqiqiy jismoniy tajribada bo'lishi mumkin.
Tajriba - bu tajriba, chunki u fikrni takomillashtirish emas, balki fikrni sinashdir. O'z ichida izchil bo'lgan fikr o'zini sinab ko'ra olmaydi. Bu Kurt Gödel tomonidan isbotlangan.
Noyob gazda molekulalar orasidagi masofa ularning o'lchamidan ko'p marta kattaroqdir. Bu holda molekulalar orasidagi o'zaro ta'sir ahamiyatsiz va molekulalarning kinetik energiyasi ularning o'zaro ta'sirining potentsial energiyasidan ancha katta bo'ladi.
Gaz holatidagi moddaning xossalarini tushuntirish uchun haqiqiy gaz o'rniga uning fizik modeli - ideal gazdan foydalaniladi. Model quyidagilarni nazarda tutadi:
molekulalar orasidagi masofa ularning diametridan biroz kattaroqdir;
molekulalar elastik sharlardir;
molekulalar orasida jozibador kuchlar yo'q;
molekulalar bir-biri bilan va tomir devorlari bilan to'qnashganda, itaruvchi kuchlar harakat qiladi;
Molekulyar harakat mexanika qonunlariga bo'ysunadi.
Ideal gaz mkt uchun asosiy tenglama:
MKT ning asosiy tenglamasi molekula massasi, tezlik kvadratining o'rtacha qiymati va molekulalarning konsentratsiyasi ma'lum bo'lsa, gaz bosimini hisoblash imkonini beradi.
Ideal gaz bosimi tomir devorlari bilan to'qnashuvdagi molekulalar elastik jismlar sifatida mexanika qonunlariga ko'ra ular bilan o'zaro ta'sir qilishida yotadi. Molekula tomir devori bilan to'qnashganda tezlik vektorining v x tezligining devorga perpendikulyar OX o'qidagi proyeksiyasi o'z ishorasini teskari tomonga o'zgartiradi, lekin mutlaq qiymatda doimiy bo'lib qoladi. Shuning uchun molekulaning devor bilan to'qnashuvi natijasida uning impulsining OX o'qidagi proyeksiyasi mv 1x = -mv x dan mv 2x =mv x ga o'zgaradi. Devor bilan to'qnashganda molekula impulsining o'zgarishi devor tomonidan unga F 1 kuchini keltirib chiqaradi. Molekula impulsining o'zgarishi ushbu kuchning impulsiga teng:
Toʻqnashuv vaqtida Nyutonning uchinchi qonuniga koʻra molekula devorga mutlaq qiymati boʻyicha F 1 kuchiga teng va teskari yoʻnaltirilgan F 2 kuchi bilan taʼsir qiladi.
Ko'p molekulalar mavjud va ularning har biri to'qnashganda devorga bir xil impuls beradi. Bir soniyada ular impulsni uzatadilar 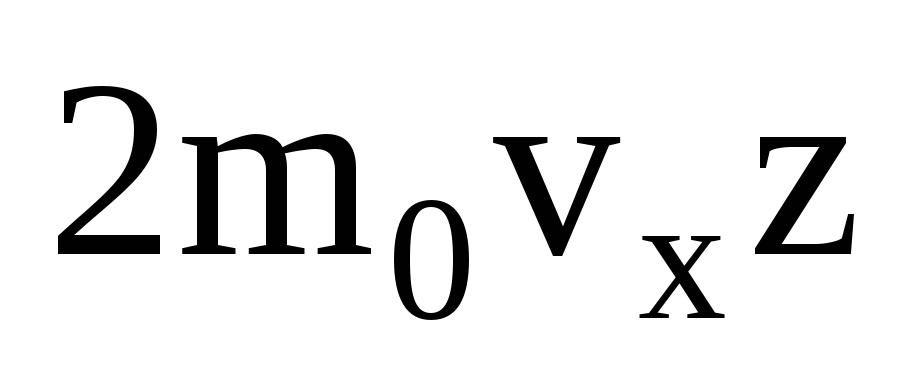 , bu erda z - barcha molekulalarning devor bilan to'qnashuvlari soni, bu gazdagi molekulalarning kontsentratsiyasiga, molekulalarning tezligiga va devorning sirt maydoniga proportsionaldir:
, bu erda z - barcha molekulalarning devor bilan to'qnashuvlari soni, bu gazdagi molekulalarning kontsentratsiyasiga, molekulalarning tezligiga va devorning sirt maydoniga proportsionaldir: 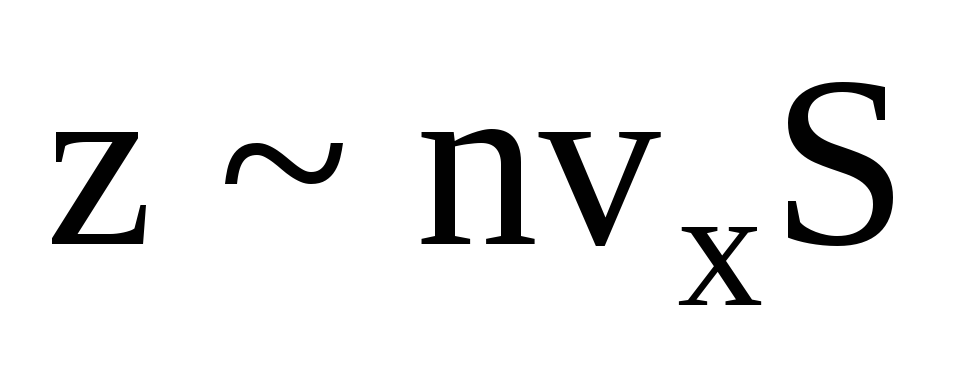 . Molekulalarning faqat yarmi devorga qarab harakatlanadi, qolganlari teskari yo'nalishda harakat qiladi:
. Molekulalarning faqat yarmi devorga qarab harakatlanadi, qolganlari teskari yo'nalishda harakat qiladi: 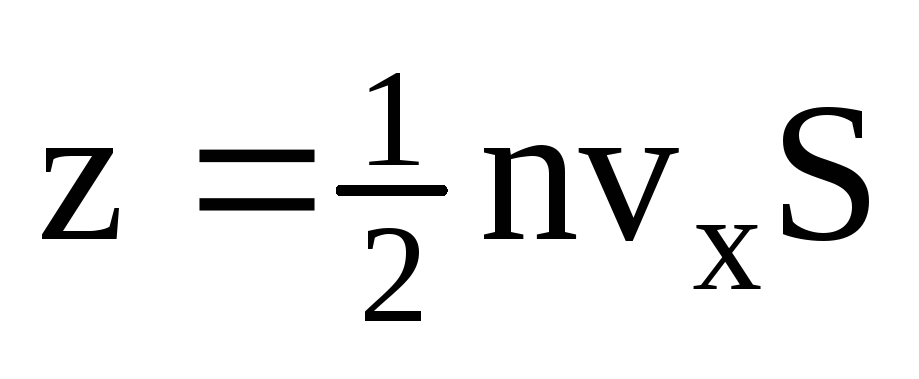 . Keyin umumiy impuls 1 soniyada devorga o'tkaziladi:
. Keyin umumiy impuls 1 soniyada devorga o'tkaziladi: 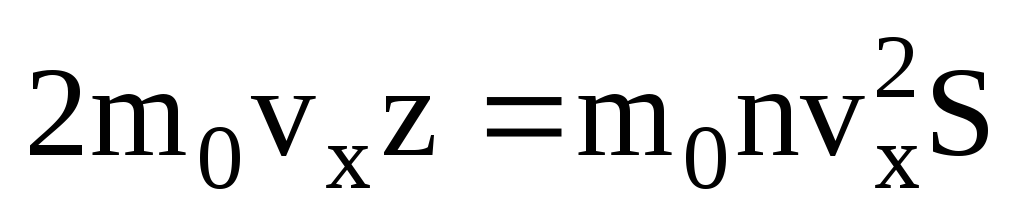 . Nyutonning ikkinchi qonuniga ko'ra, jismning impuls momentining vaqt birligidagi o'zgarishi unga ta'sir qiluvchi kuchga teng:
. Nyutonning ikkinchi qonuniga ko'ra, jismning impuls momentining vaqt birligidagi o'zgarishi unga ta'sir qiluvchi kuchga teng:
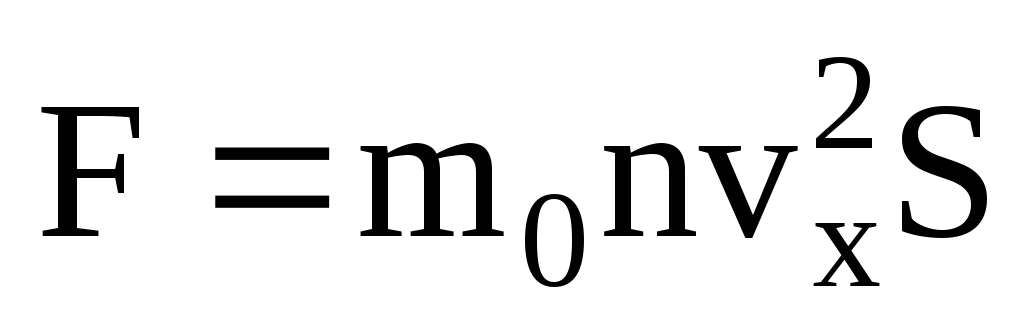
Barcha molekulalar bir xil tezlikka ega emasligini hisobga olsak, devorga ta'sir qiluvchi kuch tezlikning o'rtacha kvadratiga proportsional bo'ladi. Molekulalar barcha yo'nalishlarda harakat qilganligi sababli, tezlik proektsiyalari kvadratlarining o'rtacha qiymatlari tengdir. Shunday qilib, tezlik proyeksiyasining o'rtacha kvadrati: 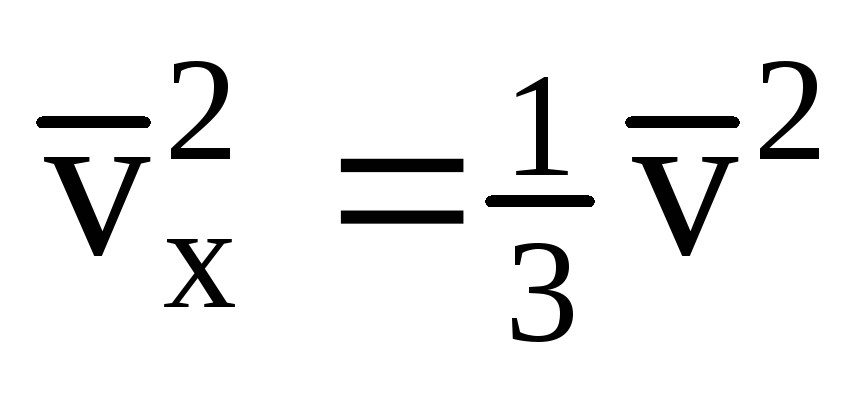 ;
;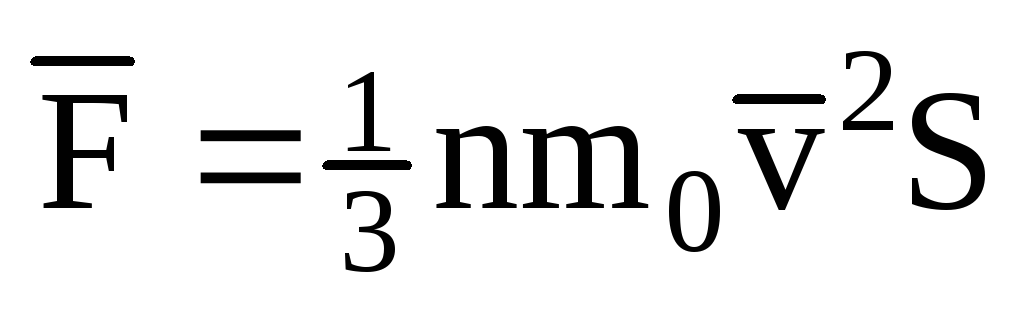 . Keyin idish devoridagi gazning bosimi:
. Keyin idish devoridagi gazning bosimi:
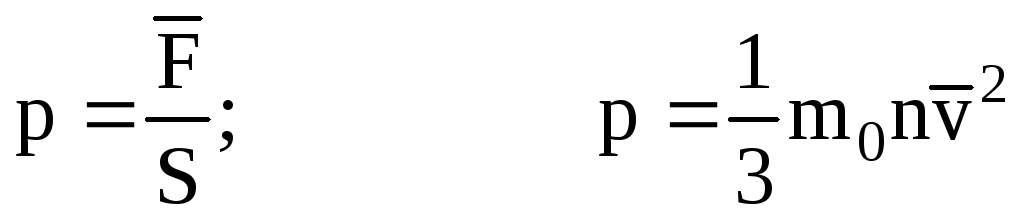 - MKT ning asosiy tenglamasi.
- MKT ning asosiy tenglamasi.
Molekulalarning translatsion harakatining kinetik energiyasining o'rtacha qiymatini belgilash ideal gaz:
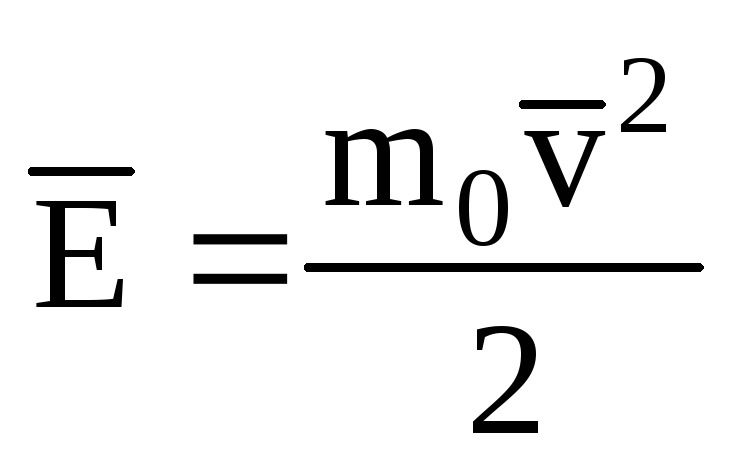 , olamiz
, olamiz
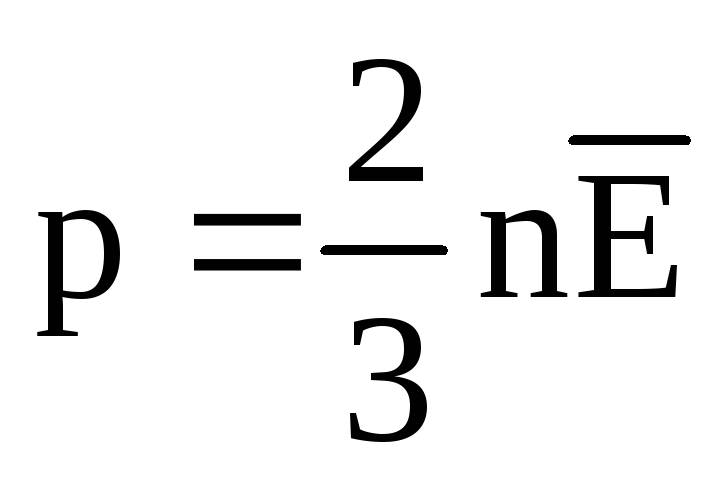
Harorat va uni o'lchash:
Ideal gaz uchun asosiy MKT tenglamasi oson o'lchanadigan makroskopik parametr - bosimni o'rtacha kinetik energiya va molekulalarning kontsentratsiyasi kabi mikroskopik gaz parametrlari bilan bog'laydi. Ammo, faqat bosimni o'lchab, biz molekulalarning kinetik energiyasining o'rtacha qiymatini ham, ularning kontsentratsiyasini ham topa olmaymiz. Shuning uchun gazning mikroskopik parametrlarini topish uchun molekulalarning o'rtacha kinetik energiyasi bilan bog'liq boshqa ba'zi jismoniy miqdorlarni o'lchash kerak. Bu qiymat harorat.
Har qanday makroskopik jism yoki makroskopik jismlar guruhi doimiy tashqi sharoitda o'z-o'zidan termal muvozanat holatiga o'tadi. Issiqlik muvozanati - bu barcha makroskopik parametrlar o'zboshimchalik bilan uzoq vaqt davomida o'zgarishsiz qoladigan holat.
Harorat jismlar tizimining issiqlik muvozanatining holatini tavsiflaydi: bir-biri bilan issiqlik muvozanatida bo'lgan tizimning barcha jismlari bir xil haroratga ega..
Haroratni o'lchash uchun siz haroratga qarab har qanday makroskopik miqdorning o'zgarishidan foydalanishingiz mumkin: hajm, bosim, elektr qarshilik va boshqalar.
Ko'pincha amaliyotda suyuqlik (simob yoki spirt) hajmining haroratga bog'liqligi qo'llaniladi. Termometrni kalibrlashda odatda muzning erish harorati mos yozuvlar nuqtasi (0) sifatida olinadi; ikkinchi doimiy nuqta (100) - normal atmosfera bosimida suvning qaynash nuqtasi (Tselsiy shkalasi). Turli suyuqliklar qizdirilganda turlicha kengayganligi sababli, shu tarzda tashkil etilgan shkala ma'lum darajada berilgan suyuqlikning xususiyatlariga bog'liq bo'ladi. Albatta, 0 va 100 ° C barcha termometrlar uchun mos keladi, lekin 50 ° C mos kelmaydi.
Suyuqliklardan farqli o'laroq, barcha nodir gazlar qizdirilganda bir xil kengayadi va harorat o'zgarishi bilan bir xil tarzda o'z bosimini o'zgartiradi. Shuning uchun fizikada ratsional harorat shkalasini o'rnatish uchun doimiy hajmdagi ma'lum miqdordagi siyrak gaz bosimining o'zgarishi yoki doimiy bosimdagi gaz hajmining o'zgarishi qo'llaniladi. Bu o'lchov ba'zan deyiladi ideal gaz harorati shkalasi.
Issiqlik muvozanatida barcha gazlar molekulalarining translatsiya harakatining o'rtacha kinetik energiyasi bir xil bo'ladi. Bosim molekulalarning translatsiya harakatining o'rtacha kinetik energiyasiga to'g'ridan-to'g'ri proportsionaldir: 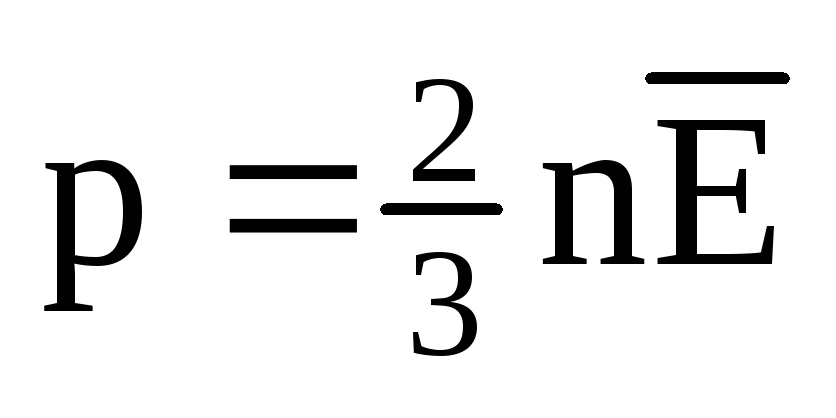 . Issiqlik muvozanatida, agar ma'lum bir massali gazning bosimi va uning hajmi o'zgarmas bo'lsa, gaz molekulalarining o'rtacha kinetik energiyasi harorat kabi qat'iy belgilangan qiymatga ega bo'lishi kerak. Chunki
. Issiqlik muvozanatida, agar ma'lum bir massali gazning bosimi va uning hajmi o'zgarmas bo'lsa, gaz molekulalarining o'rtacha kinetik energiyasi harorat kabi qat'iy belgilangan qiymatga ega bo'lishi kerak. Chunki 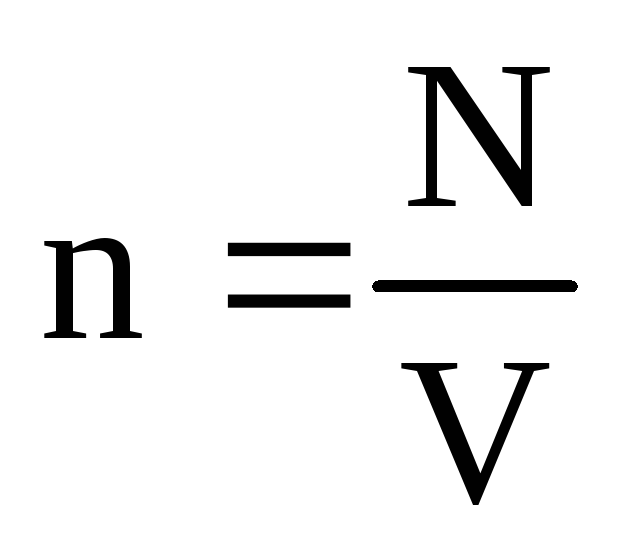 , keyin
, keyin 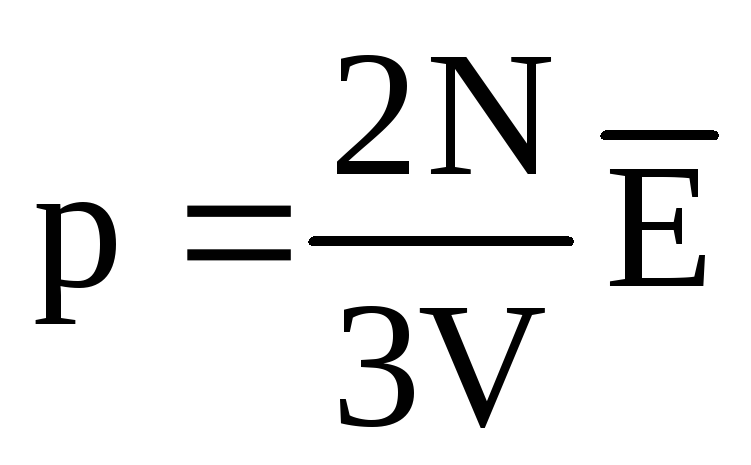 , yoki
, yoki 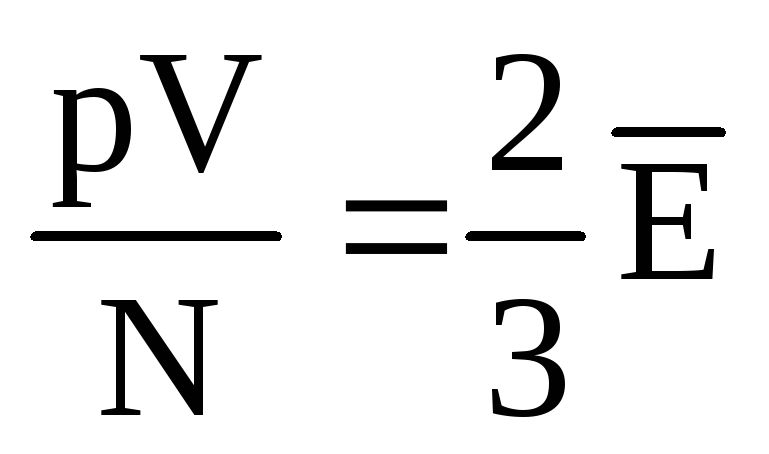 .
.
Belgilamoq 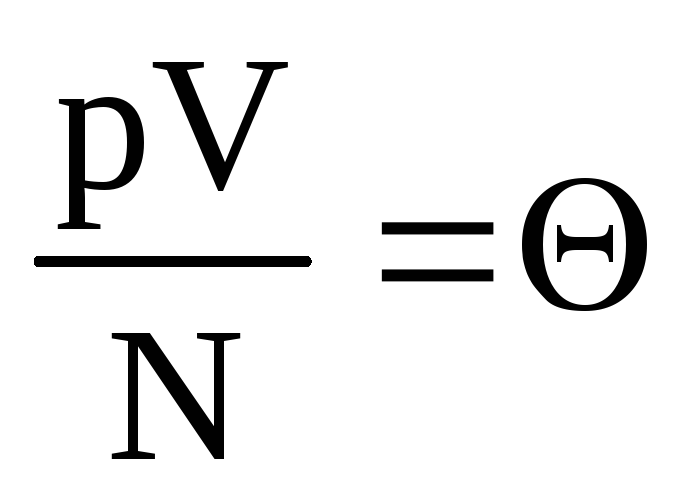 . Qiymat
. Qiymat  harorat bilan ortadi va haroratdan boshqa hech narsaga bog'liq emas. Shuning uchun uni haroratning tabiiy o'lchovi deb hisoblash mumkin.
harorat bilan ortadi va haroratdan boshqa hech narsaga bog'liq emas. Shuning uchun uni haroratning tabiiy o'lchovi deb hisoblash mumkin.
Molekulyar kinetik nazariya deb nomlangan maxsus ideal ob'ektning xatti-harakati va xususiyatlarini tavsiflaydi ideal gaz. Ushbu fizik model moddaning molekulyar tuzilishiga asoslangan. Molekulyar nazariyaning yaratilishi R. Klauzius, J. Maksvell, D. Joul va L. Boltsmanning asarlari bilan bog'liq.
Ideal gaz. Ideal gazning molekulyar-kinetik nazariyasi quyidagi taxminlar asosida qurilgan:
atomlar va molekulalar sifatida ko'rish mumkin moddiy nuqtalar, ular uzluksiz harakatda;
gaz molekulalarining ichki hajmi idish hajmiga nisbatan ahamiyatsiz;
barcha atomlar va molekulalar ajralib turadi, ya'ni printsipial jihatdan har bir zarrachaning harakatini kuzatish mumkin;
ular orasidagi gaz molekulalarining to'qnashuvidan oldin o'zaro ta'sir kuchlari mavjud emas va molekulalarning o'zaro va idish devorlari bilan to'qnashuvi mutlaqo elastik deb hisoblanadi;
gazning har bir atomi yoki molekulasining harakati klassik mexanika qonunlari bilan tavsiflanadi.
Haqiqiy gazlarni o'rganishda ideal gaz uchun olingan qonunlardan foydalanish mumkin. Buning uchun ideal gazning eksperimental modellari yaratiladi, ularda haqiqiy gazning xossalari ideal gaznikiga yaqin (masalan, past bosim va yuqori haroratlarda).
Ideal gaz qonunlari
Boyl-Mariot qonuni:
Doimiy haroratda berilgan gaz massasi uchun gaz bosimi va uning hajmining mahsuloti doimiy qiymatdir: pV = konst , (1.1)
da T = const , m = const .
Miqdorlar orasidagi munosabatni ko'rsatadigan egri chiziq R va V, doimiy haroratda moddaning xossalarini xarakterlaydi va deyiladi izoterm bu giperbola (1.1-rasm) va doimiy haroratda kechadigan jarayon izotermik deyiladi.
Gey-Lyussak qonunlari:
Doimiy bosimda berilgan gaz massasining hajmi haroratga qarab chiziqli ravishda o'zgaradi
V = V 0 (1 + t ) da P = konst , m = const . (1.2)

p = p 0 (1 + t ) da V = const , m = const . (1.3)
(1.2) va (1.3) tenglamalarda harorat Selsiy shkalasida, bosim va hajmda ifodalanadi.
0 S, esa
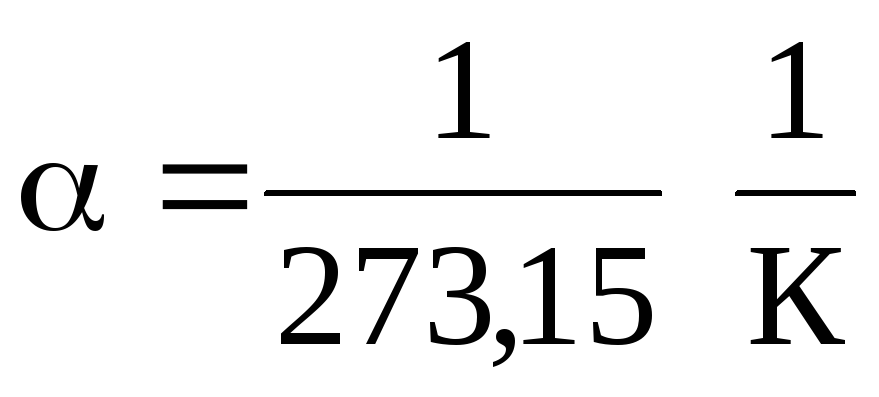 .
.
Doimiy bosim ostida sodir bo'ladigan jarayon deyiladi izobarik, chiziqli funksiya sifatida ifodalanishi mumkin (1.2-rasm).
Doimiy hajmda sodir bo'ladigan jarayon deyiladi izoxorik(1.3-rasm).
(1.2) va (1.3) tenglamalardan kelib chiqadiki, izobarlar va izoxorlar harorat o'qini nuqtada kesishadi. t =1/ \u003d - 273,15 S . Agar biz boshlang'ichni shu nuqtaga ko'chirsak, u holda Kelvin shkalasiga o'tamiz.
(1.2) va (1.3) formulalarni kiritish termodinamik harorat, Gey-Lyussak qonunlariga qulayroq shakl berilishi mumkin:
V = V 0 (1+t) = = V 0 = =V 0 T;
p = p 0 (1+t) = p 0 = p 0 T;
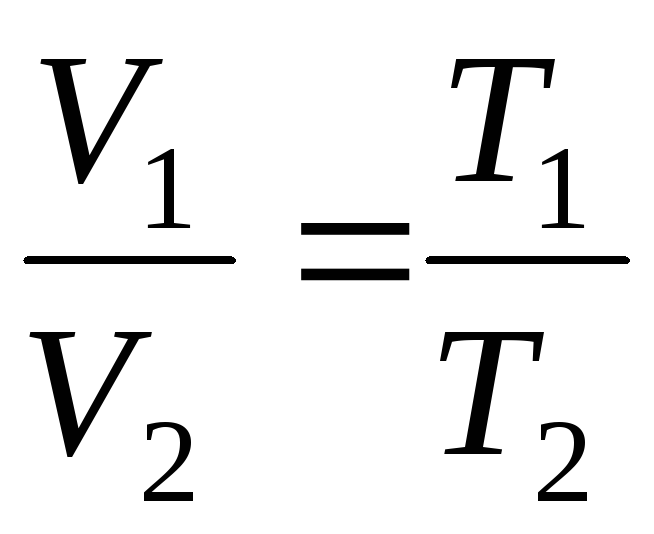 da
p=const, m=const
;
(1.4)
da
p=const, m=const
;
(1.4)
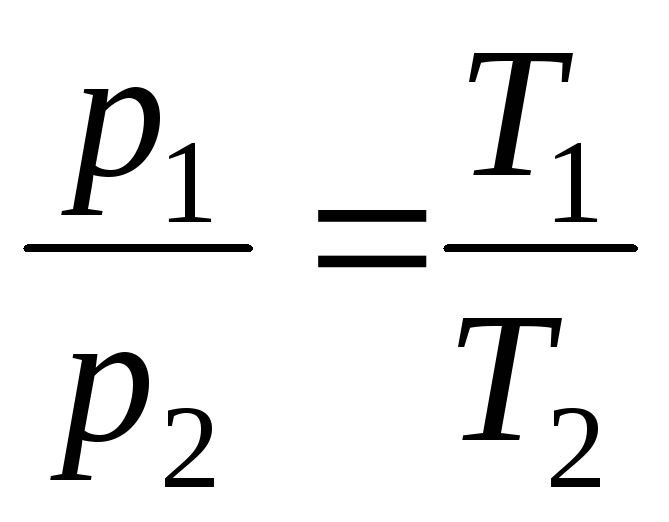 da V = const, m = const
,
(1.5)
da V = const, m = const
,
(1.5)
Bu erda 1 va 2 indekslar bir xil izobar yoki izoxorada joylashgan ixtiyoriy holatlarga ishora qiladi. .
Avogadro qonuni:
bir xil harorat va bosimdagi har qanday gazning mollari bir xil hajmlarni egallaydi.
Oddiy sharoitlarda bu hajm ga teng V,0 \u003d 22,4110 -3 m 3 / mol . Ta'rifga ko'ra, bitta molda turli moddalar ga teng bo'lgan bir xil miqdordagi molekulalarni o'z ichiga oladi doimiy Avogadro:N A = 6,02210 23 mol -1 .
Dalton qonuni:
aralashmaning bosimi ideal gazlar qisman bosimlar yig'indisiga teng R 1 , R 2 , R 3 … R n, unga kiritilgan gazlar:
p = p 1 + p 2 + R 3 + …+ p n .
Qisman bosim – bu tarkibidagi gaz hosil qiladigan bosim gaz aralashmasi agar u faqat bir xil haroratda aralashmaning hajmiga teng hajmni egallagan bo'lsa.
Ideal gaz holati tenglamasi
(Klapeyron-Mendeleyev tenglamasi)
Harorat, hajm va bosim o'rtasida aniq bog'liqlik mavjud. Bu munosabat funksional qaramlik bilan ifodalanishi mumkin:
f(p, V, T)= 0.
O'z navbatida, o'zgaruvchilarning har biri ( p, v, t) boshqa ikkita o‘zgaruvchining funksiyasi. Moddaning har bir faza holatiga (qattiq, suyuq, gazsimon) funksional bog`liqlik turi eksperimental tarzda topiladi. Bu juda mashaqqatli jarayon bo'lib, holat tenglamasi faqat siyrak holatda bo'lgan gazlar uchun, ba'zi siqilgan gazlar uchun esa taxminiy shaklda tuzilgan. Gaz holatida bo'lmagan moddalar uchun bu muammo hali hal qilinmagan.
Fransuz fizigi B. Klapeyron keltirgan ideal gaz holati tenglamasi Boyl-Mariott, Gey-Lyusak, Charlz qonunlarini birlashtirib:
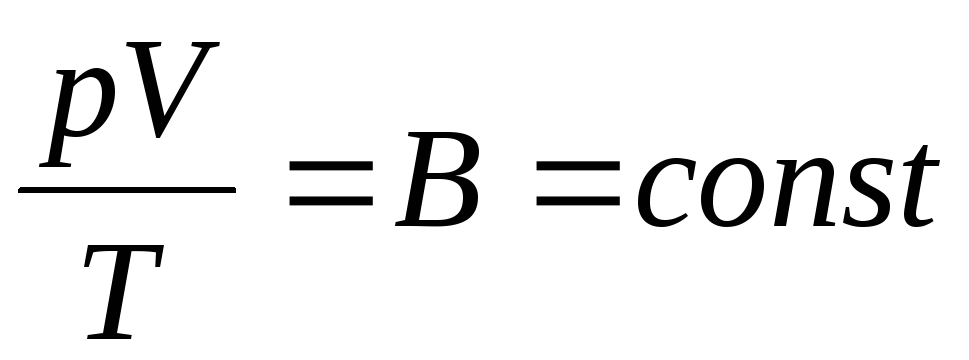 . (1.6)
. (1.6)
(1.6) ifoda Klapeyron tenglamasi, bu yerda DA gaz konstantasi hisoblanadi. Turli gazlar uchun u boshqacha.
DI. Mendeleyev Klapeyron tenglamasini Avogadro qonuni bilan birlashtirib, (1.6) tenglamani bir molga havola qildi va molyar hajmdan foydalangan. V. Avogadro qonuniga ko'ra, xuddi shunday R va T barcha gazlarning mollari bir xil molyar hajmni egallaydi V .
.
Shuning uchun doimiy DA barcha ideal gazlar uchun bir xil bo'ladi. Bu konstanta odatda belgilanadi R va teng R=
8,31
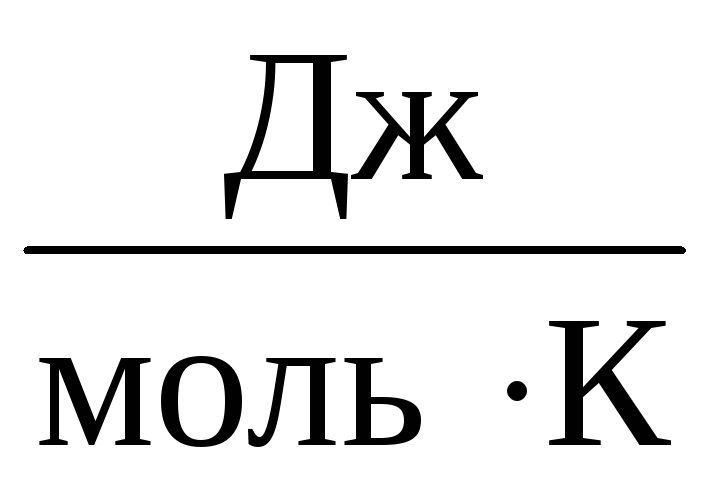 .
.
Klapeyron-Mendeleyev tenglamasi quyidagi shaklga ega:
p V . = R T.
(1.7) tenglamadan bir mol gazga borish mumkin gazning ixtiyoriy massasi uchun Klapeyron-Mendeleyev tenglamasiga:
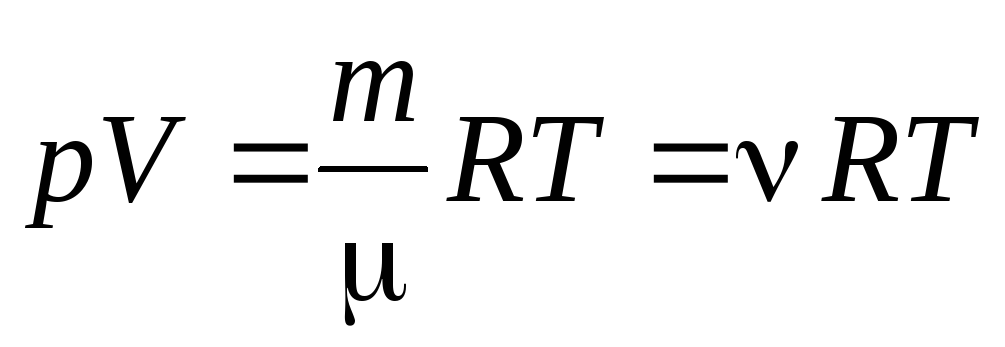 , (1.7)
, (1.7)
qayerda
–
molyar massa
(bir mol moddaning massasi, kg/mol); m
gaz massasi;
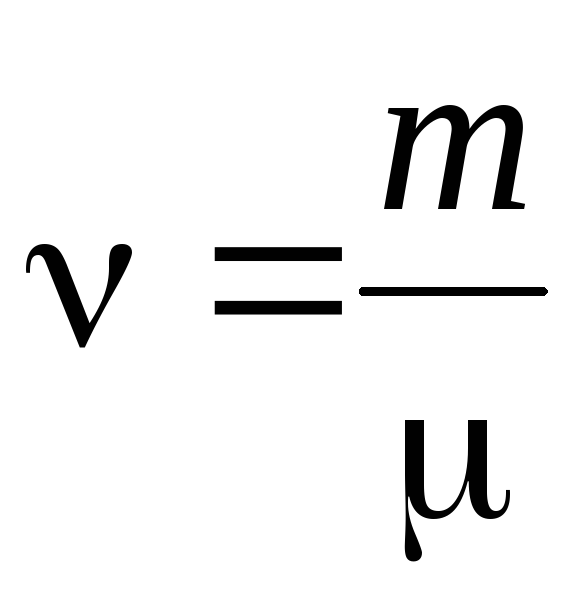 - materiya miqdori .
- materiya miqdori .
Ko'pincha ideal gaz holati tenglamasining yana bir shakli qo'llaniladi, bu esa joriy qilinadi Boltsman doimiysi: 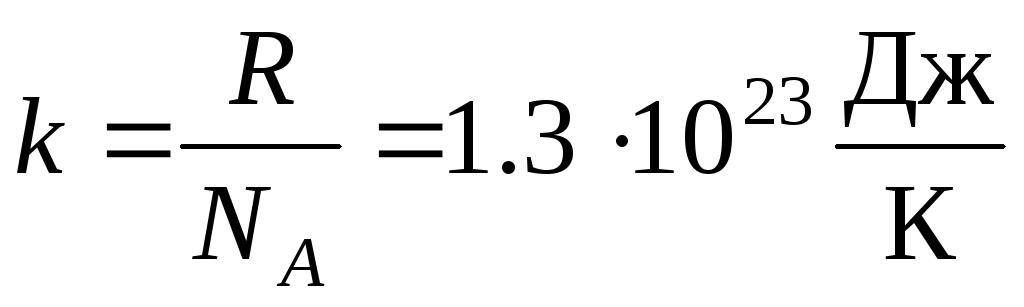 .
.
Keyin (1.7) tenglama quyidagicha ko'rinadi:
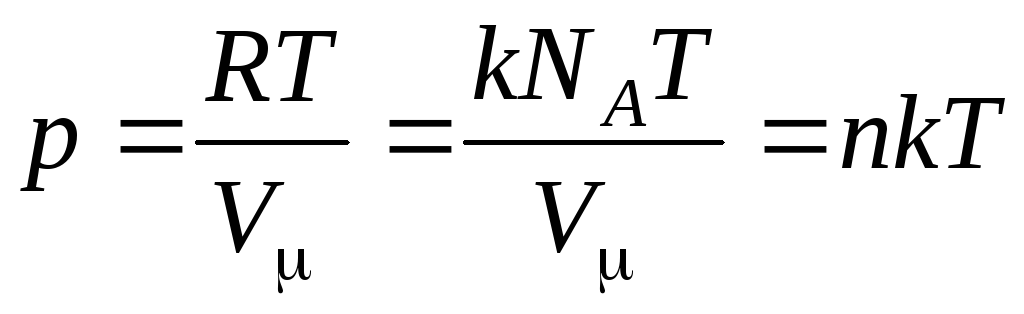 ,
(1.8)
,
(1.8)
qayerda
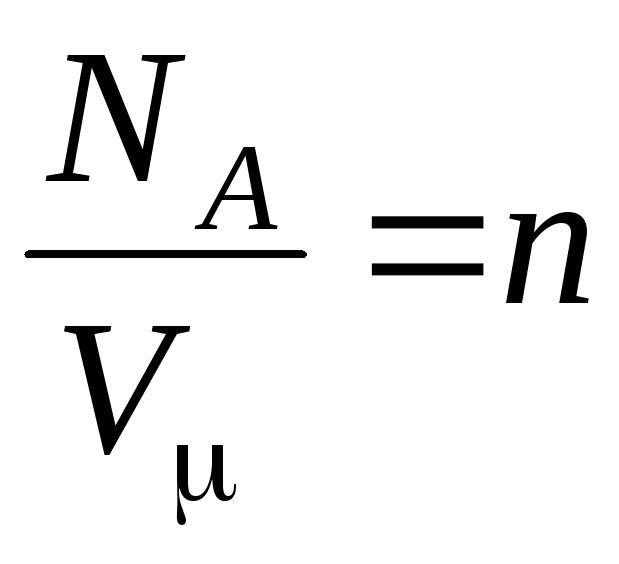 –
molekulalarning konsentratsiyasi (hajm birligidagi molekulalar soni). Bu ifodadan kelib chiqadiki, ideal gazning bosimi uning molekulalari kontsentratsiyasiga yoki gazning zichligiga to'g'ridan-to'g'ri proportsionaldir. Bir xil harorat va bosimlarda barcha gazlar hajmi birlik uchun bir xil miqdordagi molekulalarni o'z ichiga oladi. Oddiy sharoitlarda 1 m 3 dagi molekulalar soni deyiladi
Loshmidt raqami:
–
molekulalarning konsentratsiyasi (hajm birligidagi molekulalar soni). Bu ifodadan kelib chiqadiki, ideal gazning bosimi uning molekulalari kontsentratsiyasiga yoki gazning zichligiga to'g'ridan-to'g'ri proportsionaldir. Bir xil harorat va bosimlarda barcha gazlar hajmi birlik uchun bir xil miqdordagi molekulalarni o'z ichiga oladi. Oddiy sharoitlarda 1 m 3 dagi molekulalar soni deyiladi
Loshmidt raqami:
N L = 2,68 10 25 m -3.
Molekulyar kinetikning asosiy tenglamasi
ideal gazlar nazariyasi
Eng muhim vazifa Gazlarning kinetik nazariyasi ideal gaz bosimining nazariy hisobidir molekulyar kinetik tushunchalarga asoslanadi. Ideal gazlarning molekulyar kinetik nazariyasining asosiy tenglamasi yordamida olingan statistik usullar.
Gaz molekulalari tasodifiy harakat qiladi deb taxmin qilinadi, gaz molekulalari orasidagi o'zaro to'qnashuvlar soni idish devorlariga ta'sir qilish soniga nisbatan ahamiyatsiz va bu to'qnashuvlar mutlaqo elastikdir. Idishning devorida ba'zi elementar maydon S va gaz molekulalarining bu sohaga ta'sir qiladigan bosimini hisoblang.
Shuni hisobga olish kerakki, aslida molekulalar saytga turli burchaklarda harakat qilishlari va ega bo'lishlari mumkin. turli tezliklar, bundan tashqari, har bir to'qnashuv bilan o'zgarishi mumkin. Nazariy hisob-kitoblarda molekulalarning xaotik harakati ideallashtiriladi, ular uchta o'zaro perpendikulyar yo'nalish bo'yicha harakat bilan almashtiriladi.
Agar kub shaklida idishni ko'rib chiqsak, unda N gaz molekulalari oltita yo'nalishda bo'lsa, istalgan vaqtda barcha molekulalar sonining 1/3 qismi ularning har biri bo'ylab harakatlanishini va ularning yarmi (ya'ni barcha molekulalar sonining 1/6 qismi) harakatlanishini ko'rish oson. bir yo'nalishda, ikkinchi yarmi (shuningdek, 1/6) - teskari yo'nalishda. Har bir to'qnashuvda alohida molekula saytga perpendikulyar harakatlanib, aks ettiradi va unga impulsni uzatadi, shu bilan birga uning impulsi (momentum) miqdorga o'zgaradi.
R 1 =m 0 v – (– m 0 v) = 2 m 0 v.
Saytda ma'lum bir yo'nalishda harakatlanadigan molekulalarning ta'siri soni quyidagilarga teng bo'ladi: N = 1/6 n Svt. Platforma bilan to'qnashganda, bu molekulalar unga impuls o'tkazadi.
P= N P 1 =2 m 0 vnSvt=m 0 v 2 nSt,
qayerda n molekulalarning konsentratsiyasidir. Keyin gazning idish devoriga ta'sir qiladigan bosimi quyidagilarga teng bo'ladi:
p = 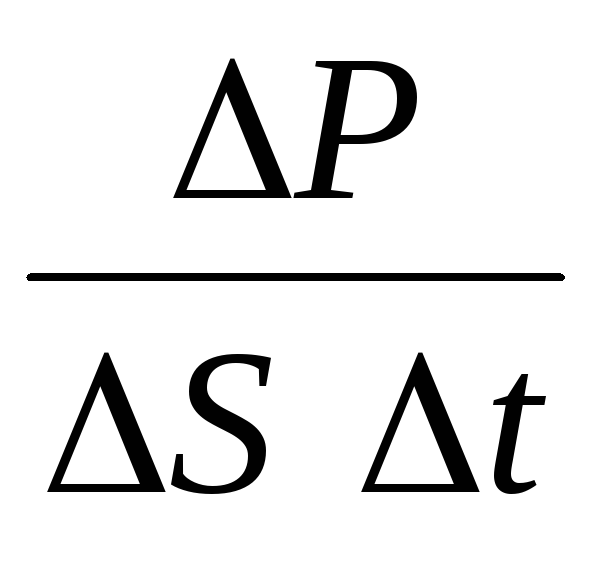 =
n m 0
v 2
.
(1.9)
=
n m 0
v 2
.
(1.9)
Biroq, gaz molekulalari turli tezliklarda harakat qiladi: v 1 , v 2 , …,v n, shuning uchun tezliklarni o'rtacha hisoblash kerak. Gaz molekulalarining tezligi kvadratlarining yig'indisi ularning soniga bo'linib, o'rtacha kvadrat tezlikni aniqlaydi:
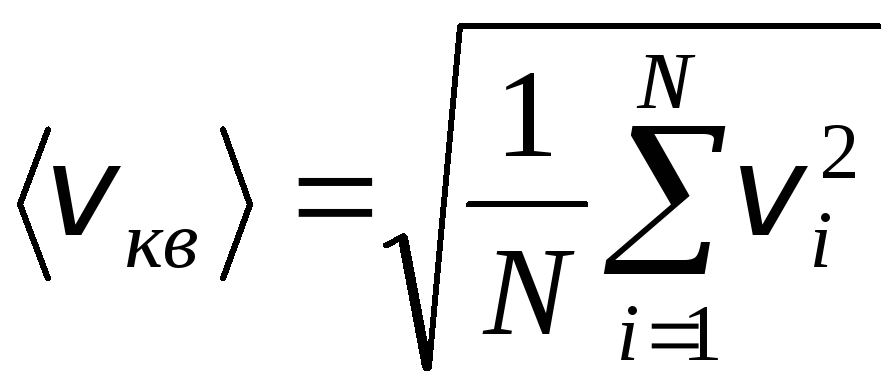 .
.
Tenglama (1.9) shaklni oladi:
![]() (1.10)
(1.10)
(1.10) ifoda deyiladi molekulyar kinetik nazariyaning asosiy tenglamasi ideal gazlar.
Sharti bilan; inobatga olgan holda 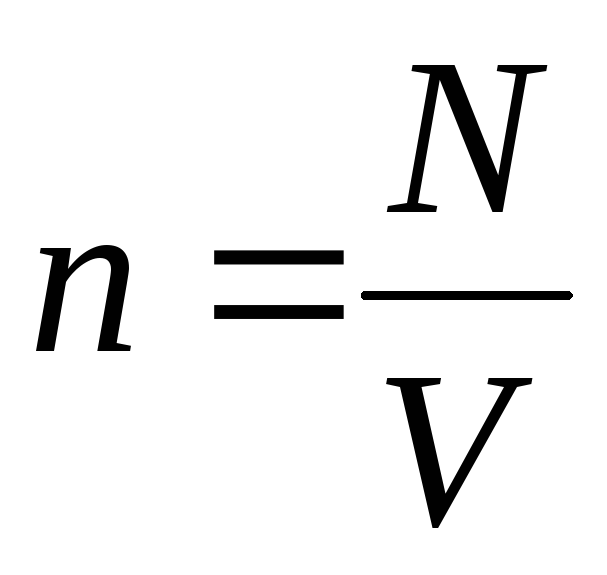 , biz olamiz:
, biz olamiz:
p V = N 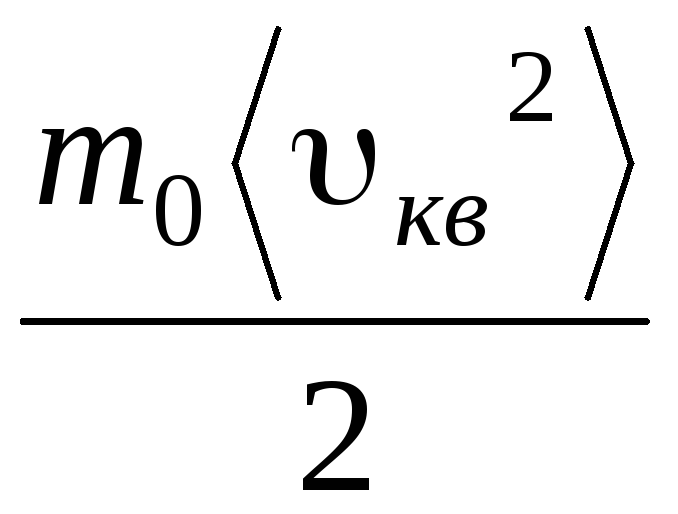 =E,
(1.11)
=E,
(1.11)
qayerda E barcha gaz molekulalarining translatsiya harakatining umumiy kinetik energiyasidir. Shuning uchun gaz bosimi gaz molekulalarining translatsiya harakatining kinetik energiyasiga to'g'ridan-to'g'ri proportsionaldir.
Bir mol gaz uchun m = va Klapeyron-Mendeleyev tenglamasi quyidagi ko'rinishga ega:
p V . = R T,
va (1.11) dan kelib chiqqanligi sababli p V . = v kv. 2, biz olamiz:
R.T.= v kv. 2 .
Demak, gaz molekulalarining o'rtacha kvadratik tezligi teng
v
kv.
=
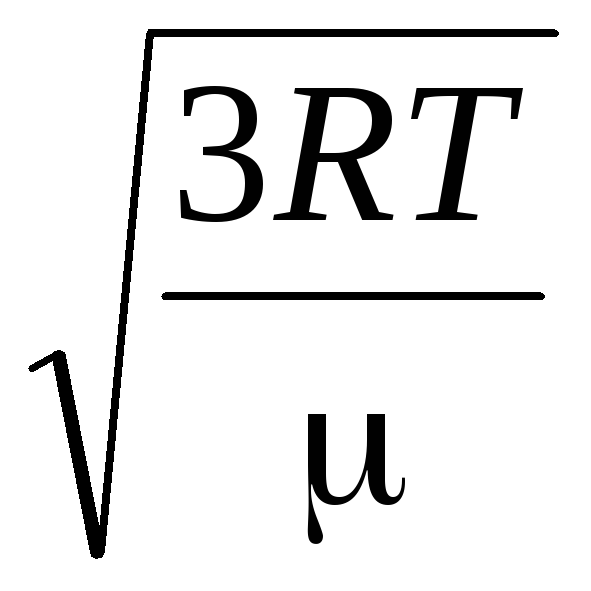 =
=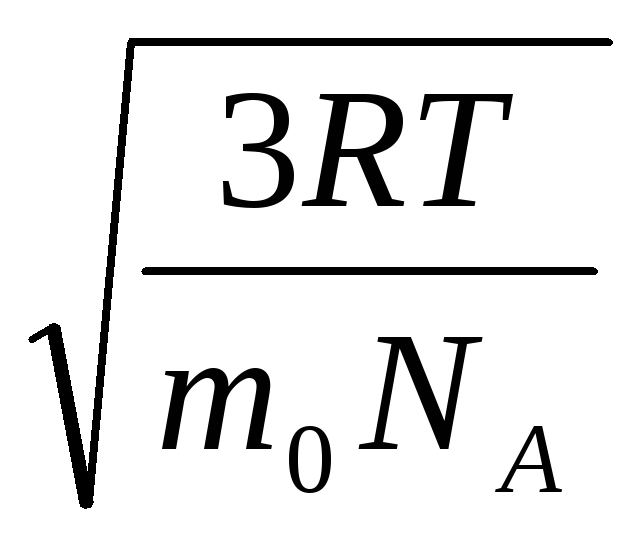 =
= ,
,
qayerda k = R/N A = 1,3810 -23 J/K – Boltsman doimiysi. Bu erdan xona haroratida kislorod molekulalarining o'rtacha kvadrat tezligini topishingiz mumkin - 480 m/s, vodorod - 1900 m/s.
Haroratning molekulyar-kinetik ma'nosi
Harorat - bu tananing qanchalik issiqligini ko'rsatadigan miqdoriy o'lchovdir. Mutlaq termodinamik haroratning fizik ma'nosini oydinlashtirish T Gazlarning molekulyar-kinetik nazariyasining asosiy tenglamasini (1.14) Klapeyron-Mendeleyev tenglamasi bilan solishtiramiz. p V = R.T.
Ushbu tenglamalarning to'g'ri qismlarini tenglashtirib, biz bir molekulaning kinetik energiyasining o'rtacha qiymatini topamiz 0 ( = N/N A , k=R/N A):
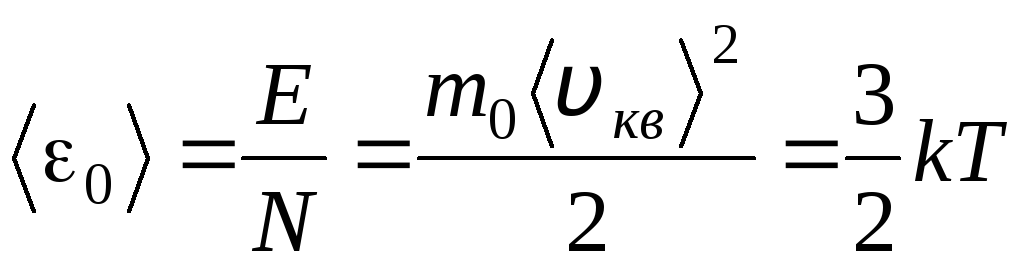 .
.
Molekulyar kinetik nazariyaning eng muhim xulosasi ushbu tenglamadan kelib chiqadi: ideal gazning bir molekulasining translatsiya harakatining o'rtacha kinetik energiyasi faqat haroratga bog'liq, bu esa termodinamik haroratga to'g'ridan-to'g'ri proportsionaldir. Shunday qilib, termodinamik harorat shkalasi to'g'ridan-to'g'ri jismoniy ma'noga ega bo'ladi: at T= 0 ideal gaz molekulalarining kinetik energiyasi nolga teng. Shuning uchun, bu nazariyaga asoslanib, gaz molekulalarining translatsiya harakati to'xtaydi va uning bosimi nolga teng bo'ladi.
Ideal gazning muvozanat xossalari nazariyasi
Molekulalarning erkinlik darajalari soni. Ideal gazlarning molekulyar-kinetik nazariyasi juda muhim oqibatlarga olib keladi: gaz molekulalari tasodifiy harakat qiladi va molekulaning tarjima harakatining o'rtacha kinetik energiyasi faqat harorat bilan belgilanadi.
Molekulyar harakatning kinetik energiyasi kinetik tomonidan tugamaydi oldinga harakatlanish energiyasi: u ham kinetikdan iborat energiyalar aylanish va tebranishlar molekulalar. Molekulyar harakatning barcha turlariga kiradigan energiyani hisoblash uchun uni aniqlash kerak erkinlik darajalari soni.
ostida erkinlik darajalari soni (i) tananing nazarda tutilgan tananing kosmosdagi holatini aniqlash uchun kiritilishi kerak bo'lgan mustaqil koordinatalar soni.
H  Masalan, moddiy nuqta uch erkinlik darajasiga ega, chunki uning fazodagi holati uchta koordinata bilan belgilanadi: x, y va z. Shuning uchun, bir atomli molekula uch darajali translatsiya harakati erkinligiga ega.
Masalan, moddiy nuqta uch erkinlik darajasiga ega, chunki uning fazodagi holati uchta koordinata bilan belgilanadi: x, y va z. Shuning uchun, bir atomli molekula uch darajali translatsiya harakati erkinligiga ega.
D 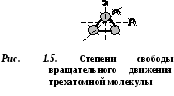 buxatomik molekula 5 erkinlik darajasiga ega (1.4-rasm): 3 darajali translatsiya harakati va 2 daraja aylanish harakati erkinligi.
buxatomik molekula 5 erkinlik darajasiga ega (1.4-rasm): 3 darajali translatsiya harakati va 2 daraja aylanish harakati erkinligi.
Uch yoki undan ortiq atomli molekulalar 6 erkinlik darajasiga ega: 3 darajali translatsiya harakati va 3 daraja aylanish harakati erkinligi (1.5-rasm).
Har bir gaz molekulasi ma'lum miqdordagi erkinlik darajalariga ega bo'lib, ulardan uchtasi uning translatsiya harakati bilan mos keladi.
Energiyani teng taqsimlash to'g'risidagi nizom
erkinlik darajalari bo'yicha
Gazlarning molekulyar-kinetik nazariyasining asosiy asosi molekulalar harakatining to'liq tasodifiyligi haqidagi farazdir. Bu faqat translyatsion emas, balki tebranish va aylanish harakatlariga ham tegishli. Gazdagi molekulalar harakatining barcha yo'nalishlari bir xil ehtimolga ega deb taxmin qilinadi. Shuning uchun, molekulaning har bir erkinlik darajasi uchun o'rtacha bir xil energiya miqdori mavjud deb taxmin qilish mumkin - bu energiyaning erkinlik darajalariga teng bo'linishi bo'yicha pozitsiya. Molekulaning bir erkinlik darajasidagi energiya:
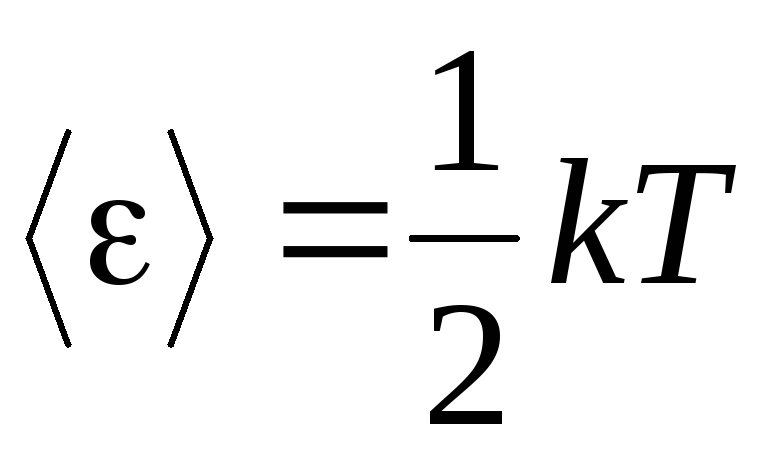 . (1.12)
. (1.12)
Agar molekula mavjud bo'lsa i erkinlik darajalari, keyin har bir erkinlik darajasi uchun o'rtacha:
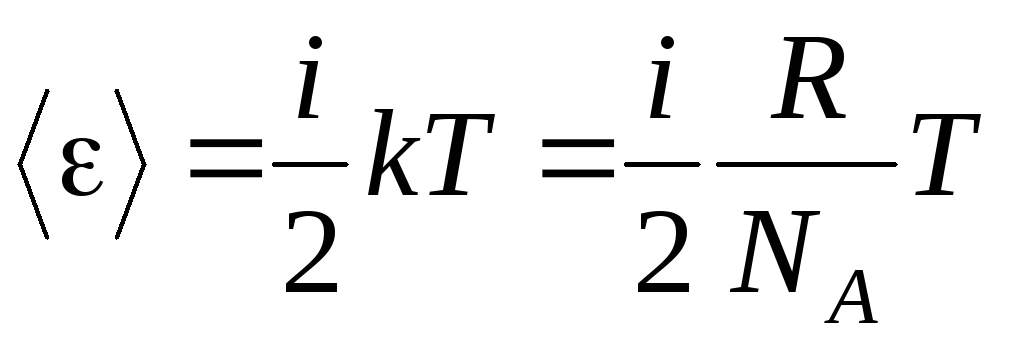 .
(1.13)
.
(1.13)
Ideal gazning ichki energiyasi
Agar gazning ichki energiyasining umumiy ta'minotini bir molga bog'lasak, uning qiymatini ni Avogadro soniga ko'paytirish orqali olamiz:
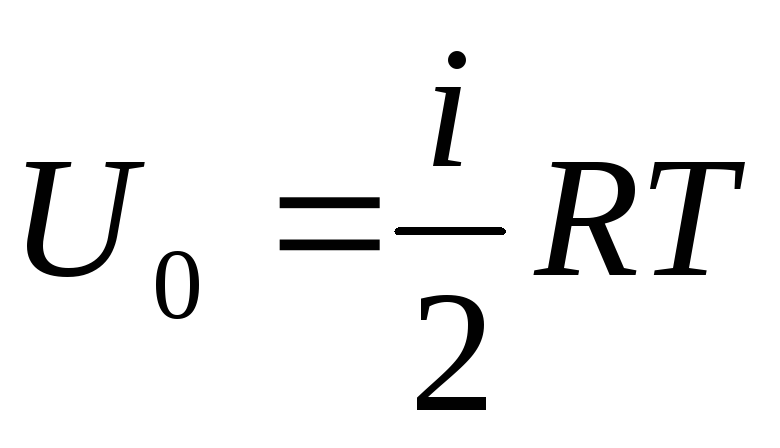 .
(1.14)
.
(1.14)
Bundan kelib chiqadiki, bir mol ideal gazning ichki energiyasi faqat haroratga va gaz molekulalarining erkinlik darajalari soniga bog'liq.
Maksvell va Boltsman taqsimoti
Ideal gaz molekulalarining issiqlik harakatining tezliklari va energiyalari bo'yicha taqsimlanishi (Maksvell taqsimoti). Doimiy gaz haroratida molekulyar harakatning barcha yo'nalishlari bir xil ehtimolli deb hisoblanadi. Bunday holda, har bir molekulaning o'rtacha kvadrat tezligi doimiy bo'lib qoladi va unga teng bo'ladi.
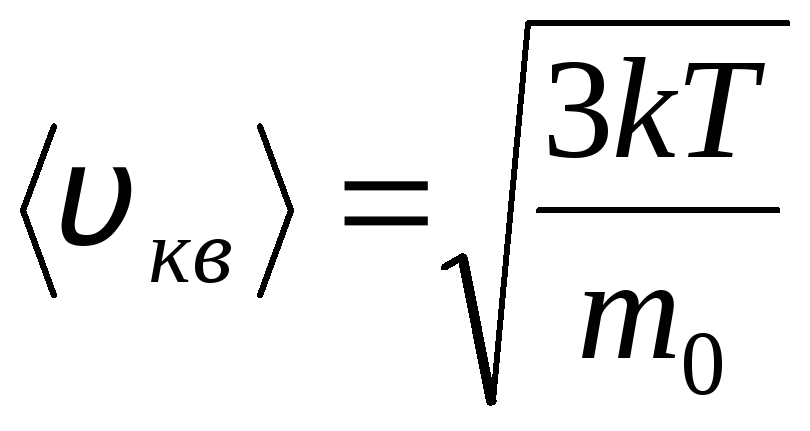 .
.
Bu muvozanat holatida bo'lgan ideal gazda vaqt o'tishi bilan o'zgarmaydigan molekulalarning ma'lum bir statsionar tezlik taqsimoti o'rnatilganligi bilan izohlanadi. bu taqsimot J. Maksvell tomonidan nazariy jihatdan olingan ma'lum bir statistik qonunga bo'ysunadi. Maksvell qonuni funksiya bilan tavsiflanadi
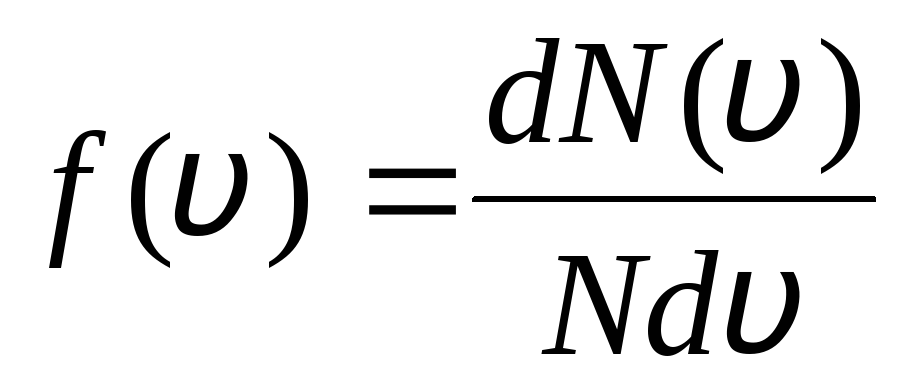 ,
,
bu funksiya f(v) molekulalarning nisbiy sonini aniqlaydi  dan oraliqda tezliklari yotadi v
oldin v+dv. Ehtimollar nazariyasi usullarini qo'llagan holda, Maksvell topdi Ideal gaz molekulalarining tezliklar bo'yicha taqsimlanish qonuni:
dan oraliqda tezliklari yotadi v
oldin v+dv. Ehtimollar nazariyasi usullarini qo'llagan holda, Maksvell topdi Ideal gaz molekulalarining tezliklar bo'yicha taqsimlanish qonuni:
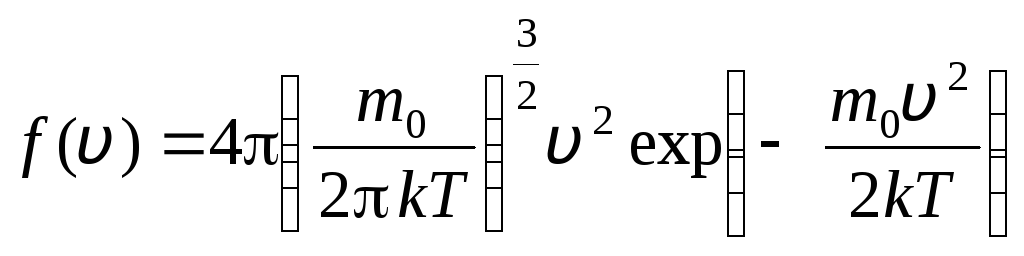 . (1.15)
. (1.15)
Tarqatish funktsiyasi rasmda grafik ko'rsatilgan. 1.6. Tarqatish egri chizig'i va x o'qi bilan chegaralangan maydon bittaga teng. Bu funktsiyani anglatadi f(v) normallashtirish shartini qanoatlantiradi:
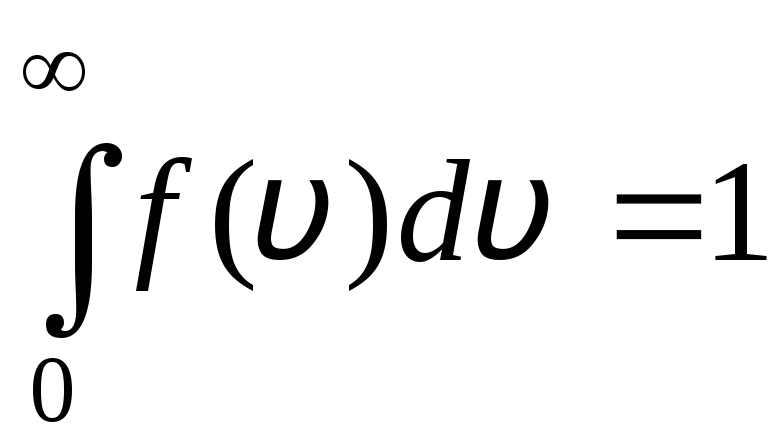 .
.
FROM  tezliklar bo'yicha ideal gaz molekulalarining taqsimlanish funksiyasi bajariladigan tezlik f(v) maksimal, deyiladi katta ehtimol bilan
tezlik
v B .
tezliklar bo'yicha ideal gaz molekulalarining taqsimlanish funksiyasi bajariladigan tezlik f(v) maksimal, deyiladi katta ehtimol bilan
tezlik
v B .
Qiymatlar v = 0 va v = ifoda minimaliga mos keladi (1.15). Eng mumkin bo'lgan tezlikni (1.23) ifodani farqlash va uni nolga tenglashtirish orqali topish mumkin:
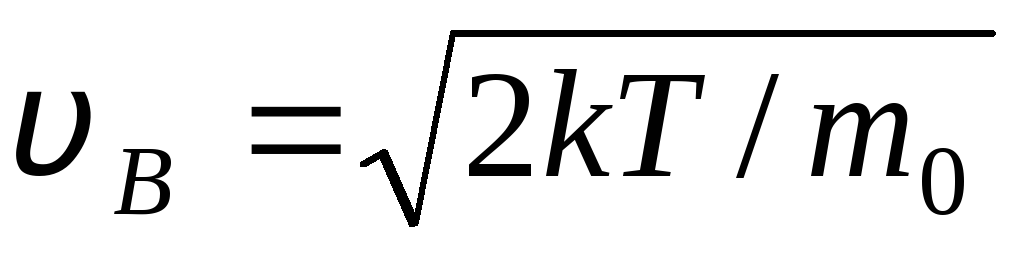 =
=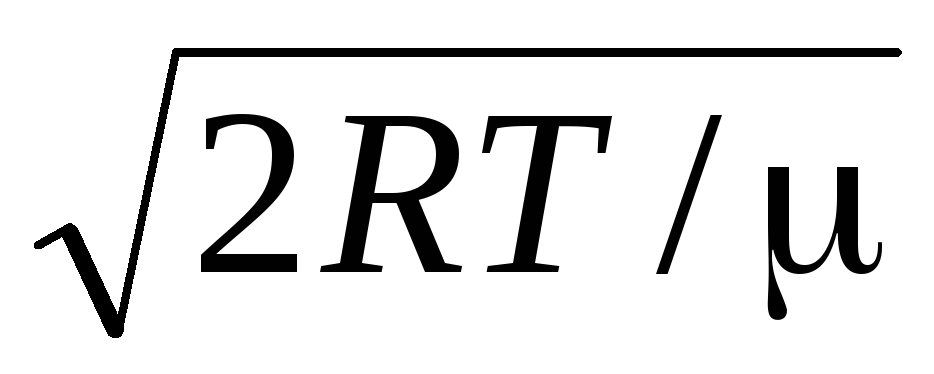 =
1,41
=
1,41
Haroratning oshishi bilan funktsiyaning maksimal qiymati o'ngga siljiydi (1.6-rasm), ya'ni haroratning oshishi bilan eng mumkin bo'lgan tezlik ham ortadi, ammo egri chiziq bilan chegaralangan maydon o'zgarishsiz qoladi. Shuni ta'kidlash kerakki, gazlarda va past haroratlarda doimo yuqori tezlikda harakatlanadigan kichik miqdordagi molekulalar mavjud. Bunday "issiq" molekulalarning mavjudligi katta ahamiyatga ega ko'p jarayonlar davomida.
O'rtacha arifmetik tezlik molekulalar formula bilan aniqlanadi
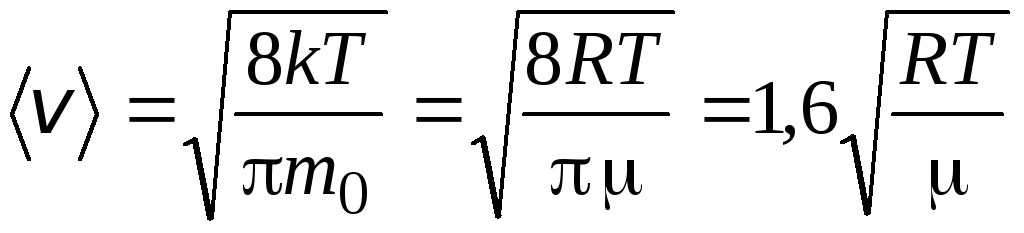 .
.
Ildiz o'rtacha kvadrat tezlik
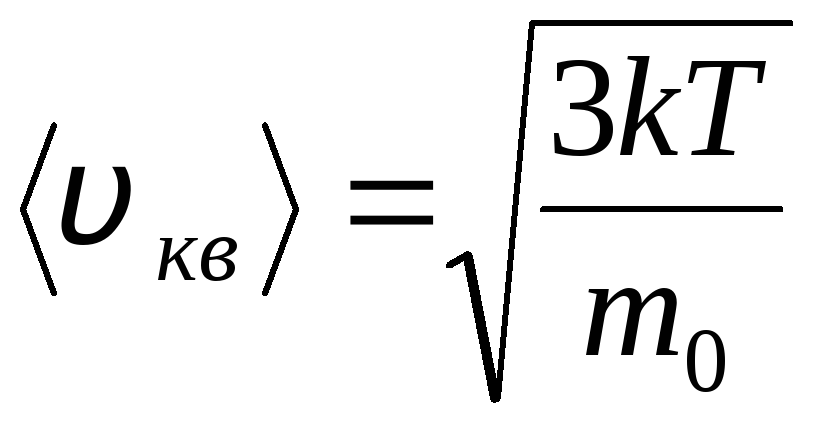 =
1,73
=
1,73 .
.
Ushbu tezliklarning nisbati haroratga yoki gaz turiga bog'liq emas.
Issiqlik harakati energiyalari bo'yicha molekulalarning taqsimlanish funktsiyasi. Bu funktsiyani molekulalarning taqsimot tenglamasiga (1.15) tezlik o‘rniga kinetik energiya qiymatini qo‘yish orqali olish mumkin:
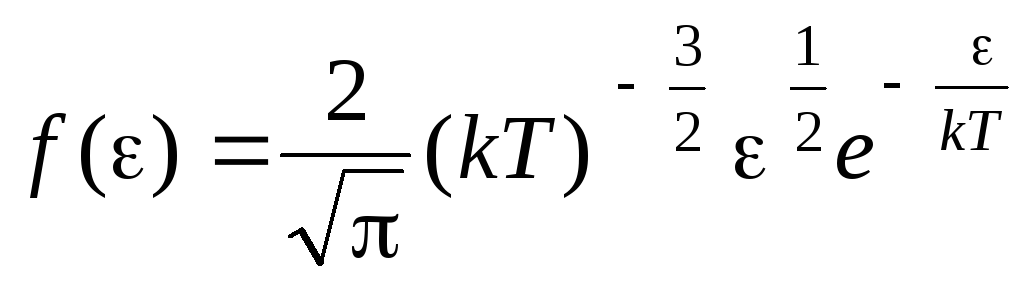 .
.
dan energiya qiymatlari ustidan ifodani birlashtirgan holda  oldin
oldin 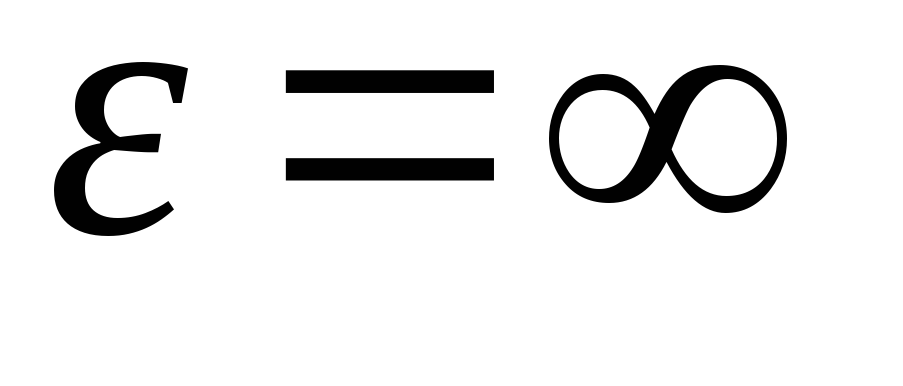
 , olamiz o'rtacha kinetik energiya ideal gaz molekulalari:
, olamiz o'rtacha kinetik energiya ideal gaz molekulalari:
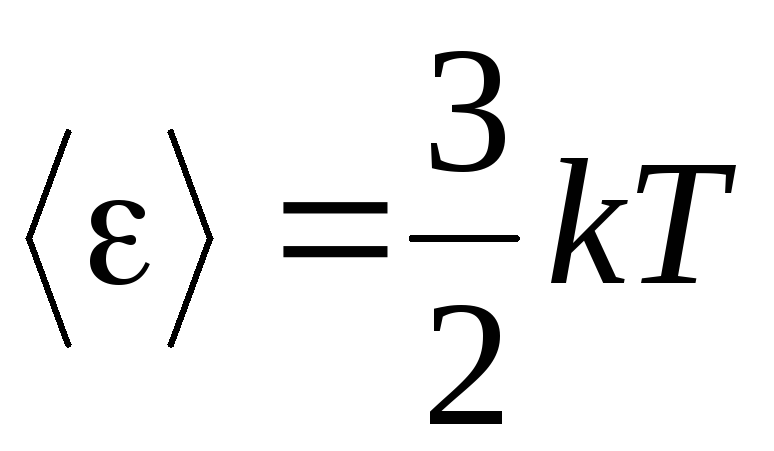 .
.
barometrik formula. Boltsmann taqsimoti. Gazlarning molekulyar-kinetik nazariyasi va molekulalarning Maksvell tomonidan tezliklar bo'yicha taqsimlanishining asosiy tenglamasini olishda ideal gaz molekulalariga tashqi kuchlar ta'sir qilmaydi, shuning uchun molekulalar butun hajm bo'ylab bir xilda taqsimlanadi deb taxmin qilingan. Biroq, har qanday gazning molekulalari Yerning tortishish maydonida. Bosimning balandlikka bog'liqligi qonunini chiqarishda tortishish maydoni bir xil, harorat doimiy va barcha molekulalarning massasi bir xil deb taxmin qilinadi:
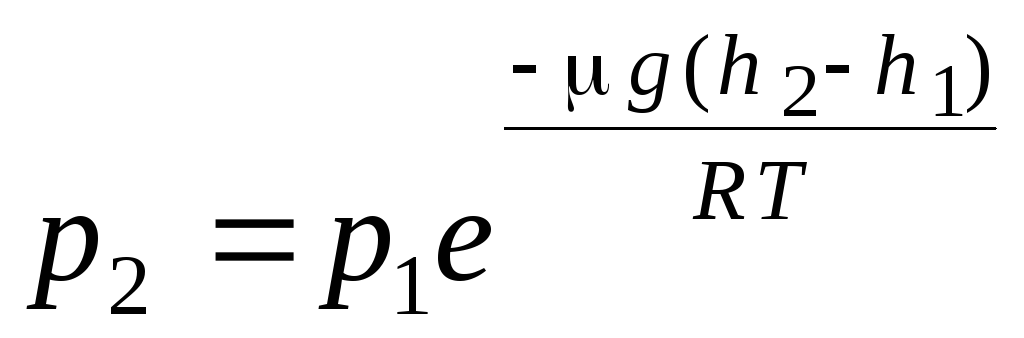 . (1.16)
. (1.16)
(1.16) ifoda deyiladi barometrik formula. Bu balandlikka qarab atmosfera bosimini topishga imkon beradi yoki bosimni o'lchash orqali siz balandlikni topishingiz mumkin. Chunki h 1 dengiz sathidan balandlik bo'lib, bu erda bosim normal deb hisoblanadi, u holda ifodani o'zgartirish mumkin:
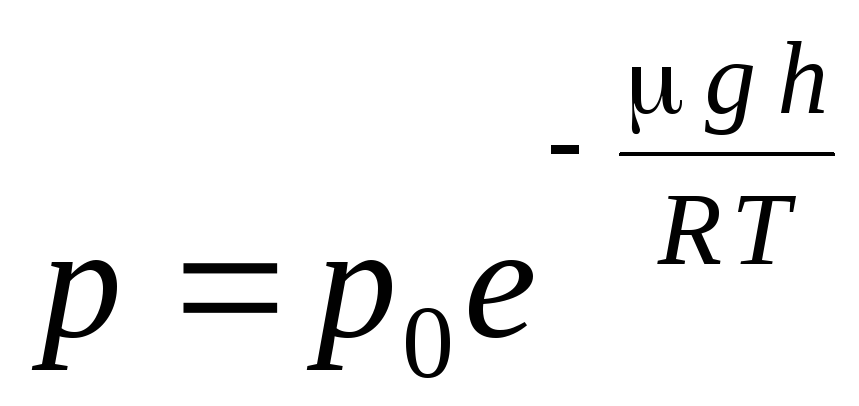 .
.
Barometrik formulani ifoda yordamida aylantirish mumkin p = nkT:
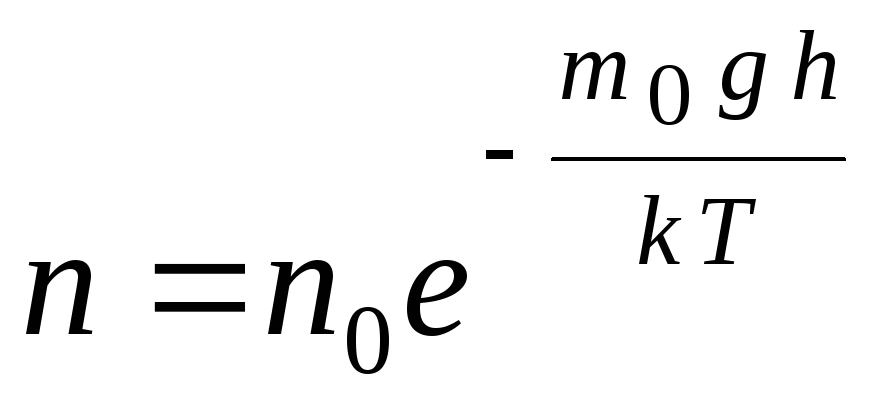 ,
,
G  de n
–
balandlikdagi molekulalarning kontsentratsiyasi h,
m 0
gh=P–
tortishish maydonidagi molekulaning potentsial energiyasi. Doimiy haroratda molekulaning potentsial energiyasi past bo'lgan joyda gazning zichligi katta bo'ladi. Grafik jihatdan, balandlik bilan hajm birligiga to'g'ri keladigan zarrachalar sonining kamayish qonuni rasmda ko'rsatilgandek ko'rinadi. 1.7.
de n
–
balandlikdagi molekulalarning kontsentratsiyasi h,
m 0
gh=P–
tortishish maydonidagi molekulaning potentsial energiyasi. Doimiy haroratda molekulaning potentsial energiyasi past bo'lgan joyda gazning zichligi katta bo'ladi. Grafik jihatdan, balandlik bilan hajm birligiga to'g'ri keladigan zarrachalar sonining kamayish qonuni rasmda ko'rsatilgandek ko'rinadi. 1.7.
Ixtiyoriy tashqi potentsial maydon uchun quyidagi umumiy ifodani yozamiz
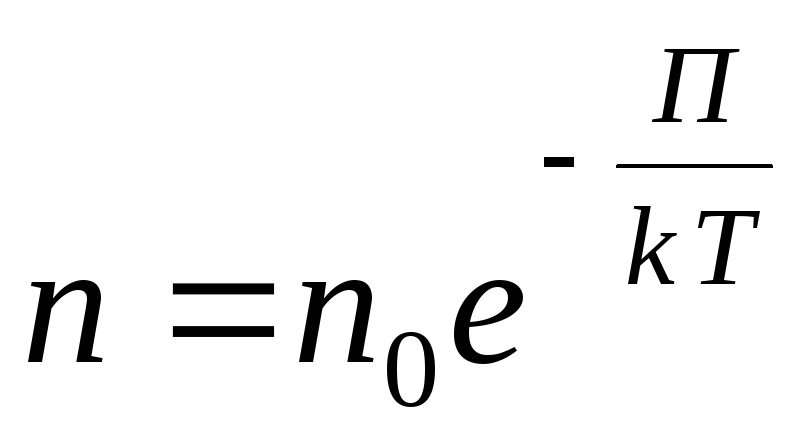 ,
,
