misturas de gases. Capacidade calorífica dos gases. Combustível, misturas de gases e capacidade de calor
1.3. Equação de estado do gás ideal
A forma das equações de estado (1.1) para substâncias reais é bastante complicada.
A este respeito, modelos físicos simplificados de corpos de trabalho são usados em termodinâmica.
Para fluidos de trabalho no estado gasoso, o mais simples e historicamente o primeiro modelo é gás ideal. Um gás ideal é um gás no qual as forças de interação intermolecular (atração e repulsão) estão ausentes e as próprias moléculas são consideradas como pontos materiais. Um gás ideal obedece a equação de Claiperon– Mendeleiev
Onde mé a massa de gás no sistema; μ é a massa molar do gás; Rμ = 8314 J/(kmol K) é a constante universal do gás, que não depende do tipo de gás ou das condições de sua existência. A equação de estado (1.2) é obtida combinando Leis Boyle-Mariotte e Gay Lussac levando em conta Lei de Avogadro.
Massa molar μ = m/n, kg/mol, é a massa de uma substância tomada na quantidade de um mol. 1 molé uma unidade da quantidade de uma substância que contém tantas partículas quanto 12 gramas de carbono. Quantidade de substância– n = N/N UMA, mol, onde Né o número de partículas (átomos, moléculas), N UMA ≈ 6,02 10 23 - o número de átomos em 12 gramas de carbono ( Número de Avogadro). Numericamente μ = Мr 10 -3 , onde Mr é o peso molecular relativo da substância ( aba. Mendeleiev) (por exemplo: =2 kg/kmol).
Em termos específicos (ou seja, para 1 kg de gás), a equação (1.2) terá a forma
Onde R– constante de gás específica, J/(kg K).
Vamos explicar o significado físico da constante de gás específica R. Para o primeiro estado a equação (1.2) será escrita como , para o segundo estado na mesma pressão - . Subtraia a primeira equação da segunda equação e encontre que , ou seja. A constante específica do gás é o trabalho realizado por 1 kg de gás quando é aquecido em 1 grau a pressão constante.
Dados experimentais mostram que um gás real é quanto mais próximo de um ideal, menor sua densidade. Em outras palavras, com uma diminuição no volume de uma determinada quantidade de gás, causada por um aumento na pressão ou uma diminuição na temperatura, qualquer gás dará mais e mais desvios das propriedades de um gás ideal. Assim, sob o conceito de “gás ideal” cabem todos os gases reais em altas temperaturas e baixas pressões.
1.4. Misturas gases ideais
Na prática, o fluido de trabalho é muitas vezes uma mistura de gases homogêneos (por exemplo, ar), cada um dos quais pode ser considerado ideal e que não entra em reações químicas.
Tal mistura também é um gás ideal e obedece à equação de estado (1.2) para a mistura
Onde R=R μ / μ é a constante de gás da mistura; μ é a massa molar média (aparente) da mistura(um valor condicional referente a um gás homogêneo representativo, em que o número de moléculas e a massa total são iguais ao número de moléculas e à massa da mistura).
A massa da mistura é igual à massa de todos os componentes constituintes
A principal lei que determina o comportamento de uma mistura gasosa é lei de Dalton:
cada gás individual se comporta em uma mistura gasosa como se ele sozinho, à temperatura da mistura, ocupasse todo o volume da mistura,
cada gás individual que entra na mistura gasosa tem a mesma pressão que teria se ocupasse sozinho todo o volume da mistura gasosa.
Daí o valor R(pressão absoluta da mistura) é definida como
Onde R eu – pressão parcial euª componente, ou seja. pressão que seria euª componente, se por si só ocupasse todo o volume da mistura à mesma temperatura ().
A composição da mistura é dada por frações mássicas ou molares dos componentes constituintes da mistura, bem como por frações volumétricas (concentrações).
Fração de massaé a razão entre a massa de cada gás e a massa total da mistura: .
A equação (1.3) implica que .
Fração de volumeé chamado de proporção volume parcial(o volume que o gás ocuparia se sua pressão e temperatura fossem iguais à pressão e temperatura da mistura gasosa, ou seja) ao volume total da mistura gasosa: . Das definições de pressão parcial e volume e a constância da temperatura, segue:
![]() (1.5)
(1.5)
Somando a última igualdade sobre todos os componentes da mistura, obtemos , ou seja. a soma dos volumes parciais dos gases que compõem a mistura é igual ao volume da mistura de gases.
A soma das frações de volume é igual a um: .
fração molar componente é chamado a razão entre a quantidade de substância de cada gás n eu à quantidade de substância da mistura de gases n. Das relações e e Lei de Avogadro(em volumes iguais de diferentes gases ideais às mesmas temperaturas e mesmas pressões, um número igual de moléculas são incluídos, ou seja) segue:
Essa. especificar uma mistura por frações molares é equivalente a especificar suas frações volumétricas.
As frações de massa e volume estão relacionadas pela razão:
![]() .
.
Se a mistura é dada por frações de massa g eu, então a constante de gás da mistura e a massa molar da mistura são calculadas da seguinte forma:
![]()
![]()
Se a mistura é dada por frações de volume r eu, então as fórmulas para calcular a massa molar da mistura e a constante de gás da mistura são as seguintes:
![]() (1.6)
(1.6)
As pressões parciais e os volumes de gases são determinados por lei de boyle–marriotte(a uma temperatura de gás constante, o produto da pressão do gás e seu volume é um valor constante, ou seja:):
![]() .
.
perguntas do teste
Sistema Internacional de Unidades (SI) e suas unidades de base.
Parâmetros termodinâmicos básicos e suas dimensões.
O que significa o estado de equilíbrio de um sistema termodinâmico?
O conceito de estados de equilíbrio e não-equilíbrio.
O que é a equação de estado de um sistema?
Interpretação geométrica do estado do sistema, processo termodinâmico.
O que é um gás ideal? Qual é a diferença entre um gás ideal e um real?
Qual é a constante do gás? O seu significado físico, dimensão e métodos de definição.
2. Capacidade de calor
A mensagem de calor para o corpo de trabalho em qualquer processo causa uma mudança em seu estado e, no caso geral, é acompanhada por uma mudança na temperatura. A mudança de temperatura, assim como qualquer outro parâmetro do estado do fluido de trabalho, não depende do tipo de processo, mas depende de seu ( 1 ) e final ( 2 ) afirma, ou seja, (para um processo elementar, a mudança em um parâmetro é substituída por seu diferencial).
A razão entre a quantidade de calor δ Q comunicado ao corpo para uma mudança na temperatura corporal dT em um processo termodinâmico elementar é chamado capacidade de calor realórgãos nesse processo:
O subscrito aqui indica o fato de que a capacidade calorífica, como o calor, depende da natureza do processo. Além disso, a capacidade calorífica depende da quantidade do corpo e do seu estado termodinâmico. Deve-se notar também que neste processo a composição química do corpo não muda, não há transição de uma substância de um estado de agregação para outro, não há dissolução de componentes, etc.
Dependendo da unidade de quantidade escolhida de uma substância, a massa, o volume e as capacidades de calor específico molar são distinguidas:
O conceito de capacidade de calor de massa é mais frequentemente usado na prática.
2.1. Capacidade de calor real e média
A capacidade calorífica de uma substância real não é um valor constante. Ele muda com a temperatura, e essa dependência pode ser muito significativa (Fig. 2.1).
A quantidade específica de calor de processo é calculada pela fórmula
Os seguintes métodos são usados para determinar esse valor:
de acordo com os resultados do experimento, a dependência da capacidade calorífica com a temperatura é representada como um polinômio de aproximação
onde são os coeficientes de aproximação. Esses coeficientes são dados na literatura de referência. Então
em cálculos práticos na faixa de temperatura t 1 , t 2 a capacidade calorífica é considerada um valor constante igual a
chamado capacidade de calor média neste intervalo, em contraste com a capacidade calorífica real introduzida em (2.1). Os dados de referência fornecem capacidades térmicas médias de 0 a temperatura fixa t obtido empiricamente, ou seja,
Capacidade calorífica média na faixa de temperatura t 1 , t 2 de acordo com esses dados de referência podem ser calculados pela fórmula
Então quantidade específica calor de processo é definido como
2.2. Capacidades térmicas isocóricas e isobáricas
são de grande importância na termodinâmica.
isocóricocapacidade de calor
igual à razão entre a quantidade de calor no processo a um volume constante para a mudança na temperatura do corpo,
isobáricocapacidade de calor
igual à razão entre a quantidade de calor no processo a pressão constante e a mudança na temperatura do corpo.
Nos cálculos termotécnicos, são usadas tabelas que mostram valores numéricos obtidos experimentalmente para capacidades térmicas isobáricas e isocóricas específicas para várias substâncias, dependendo da temperatura.
2.3. Capacidade calorífica de misturas gasosas
Nos cálculos, muitas vezes é necessário lidar com misturas de gases, e as capacidades caloríficas são fornecidas nas tabelas apenas para gases individuais.
Se a mistura de gases é dada por frações de massa g eu, então as capacidades de calor específico de massa da mistura são determinadas pelas fórmulas
![]()
Se a mistura de gases é dada por frações de volume r eu, então as capacidades caloríficas volumétricas específicas da mistura são determinadas pelas fórmulas
![]()
perguntas do teste
Anote as unidades de capacidade calorífica específica.
Como é introduzido o conceito de capacidade calorífica média?
3. A lei da conservação e transformação da energia
O conceito de energia está associado ao movimento da matéria.
A energia pode assumir muitas formas - trabalho mecânico, calor, energia química, energia de campos elétricos e magnéticos.
Em um processo termodinâmico, a interação do ambiente e um sistema termodinâmico fechado é realizada pela troca de energia na forma de calor e trabalho mecânico.
3.1. Energia interna
Qualquer ambiente tem alguma margem energia internavocê(J), que na termodinâmica técnica é representado como a soma das energias cinética e potencial das moléculas e átomos do meio. A energia cinética dessas partículas é determinada por sua velocidade e massa, enquanto a energia potencial é determinada pelas forças de interação entre elas, que dependem de sua posição relativa. A energia interna de um sistema é a energia contida no próprio sistema. Isso significa que a energia interna pode caracterizar o estado do corpo junto com as quantidades R, V, T.
A energia interna tem a propriedade de aditividade, ou seja, a energia interna de um sistema complexo é igual à soma das energias internas de suas partes constituintes:
A energia interna de 1 kg de uma substância é chamada energia interna específica você= você/ m (J/kg).
Para a maioria das aplicações técnicas da termodinâmica, não é o valor absoluto que importa você, e a mudança neste valor. Portanto, a definição quantitativa da energia interna de um sistema homogêneo é frequentemente determinada em relação a algum estado padrão convencionalmente escolhido.
3.2. Lei da conservação da energia em termodinâmica
Realizando um processo termodinâmico, um sistema fechado interage com o ambiente externo (corpos e campos externos), ou seja, troca energia. Na termodinâmica técnica, dois tipos de transferência de energia são considerados - transferindo calor e realizando trabalho mecânico.
A transferência de calor ocorre entre corpos de diferentes temperaturas e postos em contato, ou entre corpos de diferentes temperaturas, localizados à distância, por meio de ondas eletromagnéticas. radiação térmica). Transmissão cordialidade ocorre no nível molecular (microfísico) sem movimento visível dos corpos.
A transferência de energia na forma de trabalho ocorre com o movimento de todo o corpo ou parte dele no espaço. Com este método, o corpo se move em um campo de força ou altera seu volume sob a influência da pressão externa. Trabalharé uma forma macrofísica de transferência de energia.
Deve-se notar que calor e trabalho, diferentemente da energia de um corpo, não são funções de seu estado, mas dependem do tipo de processo, determinam esse processo, ou seja, são funções do próprio processo.
Numerosos experimentos e observações levaram à descoberta de uma lei fundamental da natureza - a lei da conservação da energia: energia na natureza não surge do nada e não desaparece, ou a quantidade de energia não muda, ela só muda de uma forma para outra, ou
Onde Qé o calor envolvido no processo; eu- o trabalho que está sendo feito; Δ Eé a variação de energia do sistema. Aqui e abaixo, concordamos em considerar:
trabalhar positivo se este trabalho for feito pelo corpo de trabalho, e negativo, se o trabalho for feito no corpo de trabalho do sistema;
calor fornecido ao corpo positivo, e o atribuído - negativo
além disso, uma mudança em qualquer parâmetro de estado no processo final será denotada pelo símbolo Δ (delta) e no processo elementar - d(diferencial do parâmetro correspondente). Para qualquer processo termodinâmico finito, a mudança no parâmetro de estado (pressão, temperatura, energia interna, entalpia, entropia, etc.) não depende do tipo de processo, mas é determinada pelos estados inicial e final.
Em geral, um sistema termodinâmico tem uma energia interna você, energia cinética (em termodinâmica, o sistema é considerado como um todo movendo-se a uma velocidade W) – mw 2/2, potencial - mgz (zé a altura na qual o sistema está localizado). Mudança na energia total no processo 1 –2 pode ser imaginado como:
O trabalho realizado neste processo é a soma do trabalho eu aproximadamente, associado a uma mudança no volume do fluido de trabalho do sistema (trabalho de deformação), trabalho eu dv sobre o movimento do sistema no espaço, trabalho técnico L aqueles (ao mover o sistema em vários dispositivos técnicos, por exemplo, em um motor, caldeira a vapor, compressor, etc.), trabalham contra forças de atrito eu tr:
L \u003d L sobre + L dv + L aqueles + L tr.
O calor envolvido no processo é a soma do calor Q externo, envolvido na troca com o meio externo, e o calor de atrito Q tr:
Q = Q externo + Q tr.
Dado que Q tr = eu tr (vários experimentos mostraram que o trabalho do fluxo gasto para superar o atrito é completamente convertido em calor percebido pelo fluxo), a lei de conservação de energia em termodinâmica para 1 kg de uma substância homogênea de trabalho (ou seja, em valores de massa específicos ) em um processo elementar pode ser escrito:
![]() , (3.1)
, (3.1)
(índice externo omitido como desnecessário).
Deve-se enfatizar que no lado direito de (3.1) sob o sinal do diferencial estão as funções de estado, e o restante são quantidades que dependem da natureza do processo termodinâmico. Como trabalho e calor são funções de processo, e não funções de estado, o sinal δ denota apenas o fato de que em um processo elementar as quantidades que o seguem são infinitesimais arbitrárias, e não incrementos de quaisquer funções específicas. Assim, δ q e δ eu-quantidades elementares (isto é, correspondentes a mudanças infinitesimais no estado do sistema) de calor e trabalho.
Se o sistema termodinâmico não muda sua posição no espaço e o único tipo de trabalho é o trabalho associado a uma mudança no volume do sistema, então a equação (3.1) assume uma forma mais simples:
Trabalho δ eu cerca de é realizado contra as forças da pressão externa e, então, o volume do fluido de trabalho se expande ou, inversamente, o ambiente externo realiza trabalho sobre o corpo, comprimindo-o. Para processos de equilíbrio, quando a pressão do meio é igual à pressão no fluido de trabalho, este trabalho é calculado como RDVD, Onde vé o volume específico da substância de trabalho.
A equação
chamado a primeira lei da termodinâmica: o calor fornecido a um sistema termodinâmico fechado em repouso é gasto na mudança da energia interna do sistema e no trabalho para alterar o volume do sistema. A relação de equilíbrio (3.2) também é chamada de palestras sobre literatura teórica. 1. Barroco: ...
L. A. Eliseeva © Instituição Orçamentária do Estado Federal de Ciência Biblioteca Pública Científica e Técnica do Ramo Siberiano da Academia Russa de Ciências, 2013
PonteiroCaminhadas aleatórias / A.N. Borodin, I. A. Ibragimov; sob... 241. Dorogokupets P.I. Termodinâmica minerais e equilíbrios minerais ... catálogos: compêndio palestras sobre curso "Referência ... estado técnico universidade. Series, Técnico Ciência. - ...
N. V. Basova [e outros]; ed. N. V. Basova. Rostov n/a: Phoenix, 2008
Livro didáticoCurso) Escrito D. T. Sinopse palestras sobre matemática superior [Texto]: ... Técnico termodinâmica Rudobashta, S.P. Engenharia do calor [Texto]: livro para estudantes. universidades estudando sobre... 2008. - 204 p. dez Borodin, I. F. Automação de processos tecnológicos...
Lista de trabalhos científicos do Tesouro para o período 2008 - 1 de junho de 2013 (1)
Documento... "métodos de raios-X de pesquisa" Palestras sobre oncologia clínica. Almaty... da segunda lei termodinâmica» 2-Internacional... e revisão de especialistas técnico equipando organizações de saúde ... Acadêmico da Academia Russa de Ciências Médicas Yu.I. Borodin, Bishkek, 2009, p. ...
Na prática da engenharia, muitas vezes temos que lidar não com gases homogêneos, mas com misturas de gases quimicamente não relacionados. Exemplos de misturas gasosas são: ar atmosférico, gás natural, produtos gasosos da combustão de combustíveis, etc.
Para misturas de gases, as seguintes disposições são válidas.
1. Cada gás que entra na mistura tem uma temperatura, igual a temperatura misturas.
2. Qualquer um dos gases incluídos na mistura é distribuído por todo o volume da mistura e, portanto, o volume de cada gás é igual ao volume de toda a mistura.
3. Cada um dos gases incluídos na mistura obedece à sua própria equação de estado.
4. A mistura como um todo é como um novo gás e obedece à sua própria equação de estado.
O estudo das misturas gasosas baseia-se na lei de Dalton, segundo a qual, a uma temperatura constante, a pressão da mistura é igual à soma das pressões parciais dos gases incluídos na mistura:
onde p cm é a pressão da mistura;
pi - pressão parcial do i-ésimo gás incluído na mistura;
n é o número de gases incluídos na mistura.
A pressão parcial é a pressão que o gás que entra na mistura exercerá se ele sozinho ocupar todo o volume da mistura na mesma temperatura.
Métodos para definir misturas de gases
A composição da mistura gasosa pode ser especificada por massa, volume e frações molares.
Frações de massa. A fração de massa de qualquer gás incluído na mistura é a razão entre a massa desse gás e a massa da mistura.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ..........; m n \u003d M n / M cm,
onde m 1 , m 2 , ..., m n - frações mássicas de gases;
M 1 , M 2 , ..., M n - massas de gases individuais;
M cm é a massa da mistura.
É fácil ver que  e
e  (100%).
(100%).
Ações de volume. A fração volumétrica de qualquer gás incluído na mistura é a razão entre o volume reduzido (parcial) desse gás e o volume da mistura.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
onde V 1 , V 2 , ..., V n - volumes reduzidos de gases;
V cm é o volume da mistura;
r 1 , r 2 , ..., r n - frações volumétricas de gases.
O volume reduzido é o volume de gás nas condições da mistura (à temperatura e pressão da mistura).
O volume reduzido pode ser representado da seguinte forma: se todos os gases, exceto um, forem removidos do recipiente que contém a mistura, e o gás restante for comprimido à pressão da mistura mantendo a temperatura, então seu volume será reduzido ou parcial.
Pode-se provar que o volume da mistura será igual à soma dos volumes reduzidos de gases.
 (100%).
(100%).
Frações molares. A fração molar de qualquer gás incluído em uma mistura é a razão entre o número de quilomoles desse gás e o número de quilomoles da mistura.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
onde r 1 , r 2 , ..., r n - frações molares de gases;
n cm é o número de quilomoles da mistura;
n 1 , n 2 , ..., n n é o número de quilomoles de gases.
Especificar uma mistura por frações molares é idêntico a especificar uma mistura por frações de volume, ou seja, frações molares e de volume têm os mesmos valores numéricos para cada gás incluído na mistura.
Constante de gás e peso molecular aparente (médio) da mistura. Para calcular a constante de mistura de gases dada por frações de massa, escrevemos as equações de estado:
para mistura
p cm × V cm = M cm R cm T; (1.9)
para gases
 .
(1.10)
.
(1.10)
Somamos as partes esquerda e direita das equações (1.10)
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Porque  ,
,
então p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1,11)
As equações (1.9) e (1.11) implicam que
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
ou  ,
(1.12)
,
(1.12)
onde R cm é a constante de gás da mistura.
Como a constante do gás do i-ésimo gás
Ri = 8314/mi,
então a equação (1.12) é reescrita da seguinte forma:
 .
(1.13)
.
(1.13)
Ao determinar os parâmetros de uma mistura gasosa, é conveniente usar um certo valor condicional chamado peso molecular aparente (médio) da mistura gasosa. O conceito de peso molecular aparente de uma mistura nos permite considerar convencionalmente a mistura como um gás homogêneo, o que simplifica bastante os cálculos.
Para um gás separado, a expressão
Por analogia, para uma mistura, podemos escrever
m cm R cm = 8314, (1,14)
onde m cm é o peso molecular aparente da mistura.
Da equação (1.14), usando as expressões (1.12) e (1.13), obtemos
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Argumentando desta forma, pode-se obter fórmulas para calcular R cm e m cm através de frações de volume, fórmulas para converter frações de massa em frações de volume e, inversamente, frações de volume em frações de massa, fórmulas para calcular o volume específico de uma mistura u cm e densidade de mistura r cm por meio de frações de massa e volume e, por fim, fórmulas para calcular as pressões parciais dos gases incluídos na mistura, por meio de frações de volume e de massa. Apresentamos essas fórmulas sem derivação na tabela.
Fórmulas para calcular misturas de gases
|
Definindo a composição da mistura |
Transferência de uma composição para outra |
Densidade e volume específico da mistura |
Peso molecular aparente da mistura |
Constante de mistura de gases |
Pressão parcial |
|
Frações de massa |
|
|
|
|
|
|
Frações de volume |
|
|
|
|
|
Capacidade calorífica dos gases
A capacidade calorífica de um corpo é a quantidade de calor necessária para aquecer ou resfriar o corpo em 1 K. A capacidade calorífica de uma quantidade unitária de uma substância é chamada de capacidade calorífica específica.
Assim, a capacidade calorífica específica de uma substância é a quantidade de calor que deve ser transmitida ou subtraída de uma unidade de uma substância para alterar sua temperatura em 1 K nesse processo.
Como apenas as capacidades caloríficas específicas serão consideradas a seguir, nos referiremos à capacidade calorífica específica simplesmente como capacidade calorífica.
A quantidade de gás pode ser dada por massa, volume e número de quilômetros. Deve-se notar que ao definir um volume de gás, este volume é levado às condições normais e medido em metros cúbicos normais (nm 3).
Dependendo do método de ajuste da quantidade de gás, as seguintes capacidades de calor são distinguidas:
c - capacidade calorífica da massa, J / (kg × K);
c¢ - capacidade calorífica volumétrica, J / (nm 3 × K);
c m - capacidade calorífica molar, J / (kmol × K).
Entre essas capacidades de calor existem as seguintes relações:
c = cm/m; com m = com × m;
с¢ = сm/22,4; com m = s¢ × 22,4,
daqui  ; s¢ = s × r n,
; s¢ = s × r n,
onde u n e r n - volume específico e densidade em condições normais.
Capacidades térmicas isocóricas e isobáricas
A quantidade de calor transmitida ao fluido de trabalho depende das características do processo termodinâmico. Dois tipos de capacidade calorífica são de importância prática dependendo do processo termodinâmico: isocórica e isobárica.
A capacidade calorífica em u = const é isocórica.
c u - capacidade de calor isocórico de massa,
c¢ vocêé a capacidade térmica isocórica volumétrica,
cm vocêé a capacidade térmica isocórica molar.
A capacidade calorífica em p = const é isobárica.
c p - capacidade de calor isobárico de massa,
c¢ р - capacidade térmica isobárica volumétrica,
c m p - capacidade calorífica isobárica molar.
Com a mesma mudança de temperatura no processo realizado em p = const, mais calor é consumido do que no processo em u = const. Isso é explicado pelo fato de que em u = const o calor cedido ao corpo é gasto apenas na mudança de sua energia interna, enquanto em p = const o calor é gasto tanto no aumento da energia interna quanto na realização do trabalho de expansão. A diferença entre as capacidades térmicas isobáricas de massa e isocóricas de massa de acordo com a equação de Mayer
cp - c você=R. (1.17)
Se os lados esquerdo e direito da equação (1.17) são multiplicados pela massa de quilomole m, então obtemos
c m p - c m você= 8314 J/(kmol×K) (1,18)
Na termodinâmica e suas aplicações, a razão das capacidades térmicas isobáricas e isocóricas é de grande importância:
 ,
(1.19)
,
(1.19)
onde k é o expoente adiabático.
Os cálculos mostram que para gases monoatômicos k » 1,67, gases diatômicos k » 1,4 e gases triatômicos k » 1,29.
É fácil ver que o valor para dependente da temperatura. De fato, segue das equações (1.17) e (1.19) que
 ,
(1.20)
,
(1.20)
e das equações (1.18) e (1.19)
 .
(1.21)
.
(1.21)
Como as capacidades caloríficas aumentam com o aumento da temperatura do gás, o valor de k diminui, aproximando-se da unidade, mas sempre permanece maior que ele.
Conhecendo o valor de k, pode-se determinar o valor da capacidade calorífica correspondente. Então, por exemplo, da equação (1.20) temos
 ,
(1.22)
,
(1.22)
e desde com p = k × s você, então obtemos
 .
(1.23)
.
(1.23)
Da mesma forma, para capacidades de calor molar, da equação (1.21) obtemos
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Capacidade de calor média e verdadeira
A capacidade calorífica dos gases depende da temperatura e, até certo ponto, da pressão. A dependência da capacidade calorífica da pressão é pequena e é desprezada na maioria dos cálculos. A dependência da capacidade calorífica com a temperatura é significativa e deve ser levada em consideração. Essa dependência é expressa com bastante precisão pela equação
c = a + dentro t + et 2 , (1,26)
onde um, dentro e e são valores que são constantes para um determinado gás.
Muitas vezes, em cálculos de engenharia térmica, a dependência não linear (1,26) é substituída por uma linear:
c = a + dentro t. (1,27)
|
Se construirmos graficamente a dependência da capacidade calorífica com a temperatura de acordo com a equação (1.26), então esta será uma dependência curvilínea (Fig. 1.4). Conforme mostrado na figura, cada valor de temperatura tem seu próprio valor de capacidade calorífica, que é comumente chamado de capacidade calorífica verdadeira. Matematicamente, a expressão para a capacidade calorífica verdadeira é escrita da seguinte forma:
|
|
|
|
Portanto, a verdadeira capacidade calorífica é a razão de uma quantidade infinitesimal de calor dq para uma mudança infinitesimal na temperatura dt. Em outras palavras, a capacidade calorífica verdadeira é a capacidade calorífica do gás a uma dada temperatura. Na fig. 1.4, a capacidade calorífica real a uma temperatura t 1 é indicada com t1 e é representada como um segmento 1-4, a uma temperatura t 2 - com t2 e é representada como um segmento 2-3. Da equação (1.28) obtemos dq=cdt. (1,29) Em cálculos práticos, sempre determinamos a quantidade de calor na mudança final |
temperatura. É óbvio que a quantidade de calor q, que é relatada a uma quantidade unitária de uma substância quando ela é aquecida de t 1 a t 2, pode ser encontrada integrando (1.29) de t 1 a t 2.
 .
(1.30)
.
(1.30)
Graficamente, a integral (1,30) é expressa pela área 4-1-2-3. Se na expressão (1.30) substituirmos o valor da capacidade calorífica verdadeira de acordo com a dependência linear (1.27), obtemos
 (1.31)
(1.31)
Onde  - capacidade calorífica média na faixa de temperatura de t 1 a t 2.
- capacidade calorífica média na faixa de temperatura de t 1 a t 2.
 ,
(1.32)
,
(1.32)
Portanto, a capacidade calorífica média é a razão entre a quantidade final de calor q e a mudança de temperatura final t 2 - t 1:
 .
(1.33)
.
(1.33)
Se, com base em 4-3 (Fig. 1.4), for construído um retângulo 4-1¢-2¢-3, de tamanho igual ao da figura 4-1-2-3, então a altura desse retângulo será ser igual à capacidade calorífica média, onde  está na faixa de temperatura t 1 - t 2 .
está na faixa de temperatura t 1 - t 2 .
Normalmente, os valores das capacidades térmicas médias são fornecidos em tabelas de propriedades termodinâmicas das substâncias. No entanto, para reduzir o volume dessas tabelas, elas fornecem os valores das capacidades caloríficas médias determinadas na faixa de temperatura de 0 ° C a t ° C.
Se for necessário calcular o valor da capacidade calorífica média em uma determinada faixa de temperatura t 1 - t 2, isso pode ser feito da seguinte maneira.
A área 0a14 sob a curva c \u003d f (t) (Fig. 1.4) corresponde à quantidade de calor q 1 necessária para aumentar a temperatura do gás de 0 ° C para t 1 ° C.

Da mesma forma, a área 0a23 corresponde a q 2 quando a temperatura sobe de 0 o C para t 2 o C:

Assim, q \u003d q 2 - q 1 (área 4123) pode ser representado como
![]() (1.34)
(1.34)
Substituindo o valor de q de acordo com (1.34) na expressão (1.33), obtemos a fórmula para a capacidade calorífica média em qualquer faixa de temperatura:
 .
(1.35)
.
(1.35)
Assim, a capacidade calorífica média pode ser calculada a partir das capacidades caloríficas médias tabulares usando a equação (1.35). Além disso, obtemos uma dependência não linear c = f(t). Você também pode encontrar a capacidade calorífica média usando a equação (1.32) usando uma relação linear. Valores a e dentro na equação (1.32) para vários gases são dados na literatura.
A quantidade de calor fornecida ou removida do fluido de trabalho pode ser calculada usando qualquer uma das equações:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
Onde 

 - respectivamente, a massa média, volume e capacidade calorífica molar; M é a massa de gás; n é o número de quilômetros de gás; V n - o volume de gás em condições normais.
- respectivamente, a massa média, volume e capacidade calorífica molar; M é a massa de gás; n é o número de quilômetros de gás; V n - o volume de gás em condições normais.
O volume de gás V n pode ser encontrado como segue. Tendo escrito a equação de estado para as condições dadas: pV = MRT e para condições normais: p n V n = MRT n, atribuímos a segunda equação à primeira:
 ,
,
daqui  .
(1.39)
.
(1.39)
Capacidade calorífica de misturas gasosas
A capacidade calorífica de uma mistura gasosa pode ser calculada se a composição da mistura for fornecida e as capacidades caloríficas dos componentes incluídos na mistura forem conhecidas.
Para aquecer uma mistura de massa M cm em 1 K, a temperatura de cada um dos componentes também deve ser aumentada em 1 K. Ao mesmo tempo, a quantidade de calor igual a c i M i é gasta no aquecimento do i-ésimo componente da mistura com massa М i . Para toda a mistura, a quantidade de calor  ,
,
onde c i e c cm são as capacidades caloríficas de massa do i-ésimo componente e da mistura.
Dividindo a última expressão por M cm, obtemos a fórmula de cálculo para a capacidade calorífica da massa da mistura:
 ,
(1.40)
,
(1.40)
onde m i é a fração de massa do i-ésimo componente.
Argumentando de forma semelhante, encontramos a capacidade calorífica volumétrica c¢ cm e a capacidade calorífica molar c m cm da mistura:
 (1.41)
(1.41)
onde c¢ i - capacidade calorífica volumétrica do i-ésimo componente, ri - fração de volume do i-ésimo componente,
 ,
(1.42)
,
(1.42)
onde c m i é a capacidade calorífica molar do i-ésimo componente,
r i - fração molar (volume) do i-ésimo componente.
Em motores térmicos (máquinas), o fluido de trabalho é uma mistura de vários gases. Se os componentes da mistura não entram em reações químicas entre si, e cada componente obedece à equação de estado de Claiperon, então tal mistura é considerada um gás ideal.
Para calcular a mistura, é necessário determinar μ cm - a massa molar média e R c m - a constante específica do gás da mistura. Para determiná-los, é necessário conhecer a composição da mistura, ou seja, quais componentes e em que quantidades formam essa mistura, quais parâmetros cada componente incluído na mistura possui.
Cada componente da mistura se comporta como se não houvesse outros gases na mistura, ocupa todo o volume disponível no qual a mistura está localizada, segue sua própria equação de estado e exerce sua chamada pressão parcial nas paredes, enquanto a temperatura de todos os componentes da mistura é a mesma e igual à temperatura da mistura.
De acordo com a lei de Dalton, a pressão da mistura P é igual à soma das pressões parciais dos componentes individuais incluídos na mistura:
onde n é o número de componentes da mistura.
De acordo com a lei de Amag, o volume da mistura V é igual à soma dos volumes parciais dos componentes individuais incluídos na mistura à temperatura e pressão da mistura:
 , (1.21)
, (1.21)
onde - volume parcial, m 3; V- volume da mistura, m 3
A composição da mistura é dada em volume (molar) ou frações de massa.
Fração de volume do i-ésimo componenteé a razão entre o volume parcial do componente e o volume da mistura, ou seja, então a soma das frações de volume dos componentes da mistura é 1, ou seja, . Se o valor for dado em %, então sua soma = 100%.
Fração molar do i-ésimo componente n ié a razão do número de quilomoles do componente N i para o número de quilomoles da mistura N, ou seja, onde ![]() , , ou seja, o número de quilomoles de cada componente e da mistura como um todo é igual à razão do componente correspondente e da mistura como um todo para o volume ocupado por um quilomol.
, , ou seja, o número de quilomoles de cada componente e da mistura como um todo é igual à razão do componente correspondente e da mistura como um todo para o volume ocupado por um quilomol.
Considerando que um gás ideal nas mesmas condições tem o mesmo volume de quilomole, então após a substituição obtemos:, ou seja, para gases ideais, as frações molar e volumétrica são numericamente iguais.
Fração de massa do i-ésimo componenteé a razão entre a massa do componente e a massa da mistura: , segue-se que a massa da mistura é igual à soma das massas dos componentes, e também a soma das frações de massa dos componentes é igual para 1 (ou 100%).
A conversão de frações de volume em frações de massa e vice-versa é baseada nas seguintes razões:
![]() ,
,
onde ρ = μ / 22,4, kg / m 3.
Daí resulta que a fração de massa da i-ésima componente será determinada a partir da relação:
 ,
,
onde é a densidade da mistura, kg/m 3, é a fração volumétrica do i-ésimo componente.
No futuro, pode ser determinado através de frações de volume.
 .
.
Densidade misturas para frações de volume é determinada a partir da razão
 , Onde
, Onde  , (1.22)
, (1.22)
 .
.
A pressão parcial é determinada pelas fórmulas:
![]() ou
ou  (1.23)
(1.23)
As equações de estado dos componentes e da mistura como um todo têm a forma:
![]() ;
;
![]() ,
,
de onde, após transformações, obtemos para maciço ações
 ,
,  . (1.24)
. (1.24)
Densidade e volume específico da mistura para maciço compartilhar:
;  . (1.25)
. (1.25)
Para calcular as pressões parciais, a fórmula é usada:
 . (1.26)
. (1.26)
A conversão de frações de massa em frações de volume é realizada de acordo com a fórmula:
 .
.
Ao determinar a capacidade calorífica de uma mistura de gases, assume-se que, para aquecer (resfriar) uma mistura de gases, é necessário aquecer (resfriar) cada um dos componentes da mistura
onde Q i =M i c i ∆t é o calor gasto na mudança da temperatura do i-ésimo componente da mistura, c i é a capacidade calorífica da massa do i-ésimo componente da mistura.
A capacidade calorífica da mistura é determinada a partir da razão (se a mistura for dada por frações de massa)
 , similarmente
, similarmente  . (1.28)
. (1.28)
As capacidades de calor molar e volumétrica para uma mistura dadas por frações de volume são determinadas por
 ;
;  ;
;
 ;
; 
Exemplo 1.5 O ar seco em massa consiste em g O2 \u003d 23,3% de oxigênio e g N 2 \u003d 76,6% de nitrogênio. Determine a composição do ar em volume (r O2 e r N2) e a constante gasosa da mistura.
Solução.
1. Na Tabela 1 encontramos kg/kmol e kg/kmol
2. Determine as frações volumétricas de oxigênio e nitrogênio:
1. A constante de gás do ar (mistura) é determinada pela fórmula:
 , J/kg K
, J/kg K
Exemplo 1.6. Determine a quantidade de calor necessária para aquecer uma mistura gasosa com uma massa de M = 2 kg em P = const, consistindo em % em peso: , , , , quando a temperatura muda de t 1 = 900 ° C para t 2 = 1200 °C.
Solução:
1. Determine a capacidade calorífica média de massa dos componentes que compõem a mistura gasosa em P=const e t 1 =900 o C (de P2):
1,0258 kJ/kg K; =1,1045 kJ/kg K;
1,1078 kJ/kgK; =2,1097 kJ/kg K;
2. Determinamos a capacidade calorífica média de massa dos componentes que compõem a mistura gasosa em P=const e t 1 =1200 o C (de P2):
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kgK; =2,2106 kJ/kg K;
3. Determinamos a capacidade de calor de massa média da mistura para a faixa de temperatura: t 2 \u003d 1200 ° C e t 1 \u003d 900 ° C:
4. A quantidade de calor para aquecer 2 kg da mistura em P=const:
Primeira lei da termodinâmica estabelece uma relação quantitativa entre a mudança na energia interna do sistema e o trabalho mecânico realizado contra as forças de pressão externa do ambiente como resultado do fornecimento de calor ao fluido de trabalho.
Para um sistema termodinâmico fechado, a equação da primeira lei tem a forma
O calor transmitido ao fluido de trabalho (ou sistema) é usado para aumentar sua energia interna (dU) devido ao aumento da temperatura corporal e para realizar trabalho externo (dL) devido à expansão do fluido de trabalho e um aumento em sua volume.
A primeira lei pode ser escrita como dH=dq+VdP=dq-dL 0 ,
onde dL 0 \u003d VdP - o trabalho elementar de mudança de pressão é chamado de trabalho externo útil (técnico).
dU é a variação da energia interna do fluido de trabalho (sistema), que inclui a energia do movimento térmico das moléculas (translacional, rotacional e vibracional) e a energia potencial da interação das moléculas.
Como a transição do sistema de um estado para outro ocorre como resultado do fornecimento de calor, o fluido de trabalho aquece e sua temperatura aumenta em dT e o volume aumenta em dV.
Um aumento na temperatura do corpo causa um aumento na energia cinética de suas partículas, e um aumento no volume do corpo leva a uma mudança na energia potencial das partículas. Como resultado, a energia interna do corpo aumenta em dU, então a energia interna U é uma função do estado do corpo e pode ser representada como uma função de dois parâmetros independentes U=f 1 (P,V); U=f2 (P,T), U=f3 (υ,T). A mudança na energia interna em um processo termodinâmico é determinada apenas pelos estados inicial (U 1) e final (U 2), ou seja,
Na forma diferencial, a variação da energia interna é escrita
a) em função do volume específico e da temperatura

b) em função da temperatura, uma vez que , então
Para cálculos práticos, nos quais é necessário levar em conta a variação de C v com a temperatura, existem fórmulas empíricas e tabelas de energia interna específica (muitas vezes molar). Para gases ideais, a energia interna molar da mistura U m é determinada pela fórmula
 , J/kmol
, J/kmol
Para uma mistura dada por frações de massa . Nesse caminho energia interna há propriedade do sistema e caracteriza o estado do sistema.
Entalpiaé a função de estado térmico introduzida por Kamerling-Onnes, (vencedor premio Nobel, 1913), que é a soma da energia interna do sistema U e o produto da pressão do sistema P e seu volume V.
Como as quantidades incluídas nele são funções de estado, portanto H também é uma função de estado, ou seja, H \u003d f 1 (P, V); H=f2 (V,T); H=f3 (P, T).
A variação da entalpia dH em qualquer processo termodinâmico é determinada pelos estados inicial H 1 e final H 2 e não depende da natureza do processo. Se o sistema contém 1 kg de uma substância, então a entalpia específica, J/kg, é aplicada.
Para um gás ideal, a equação diferencial tem a forma
consequentemente, a entalpia específica é determinada pela fórmula
A equação da primeira lei da termodinâmica é dq=dU+Pdυ, quando o único tipo de trabalho é o trabalho de expansão Pdυ=d(Pυ)-υdP, então dq=d(U+Pυ)-υdP, daí
Trabalho prático№ 2
Tema: Capacidade calorífica, entalpia, misturas de gases ideais, energia interna, trabalho, processos termodinâmicos.
O objetivo do trabalho: Consolidação dos conhecimentos adquiridos durante a formação teórica, aquisição de competências na execução de cálculos de engenharia térmica.
EU. Definições básicas, fórmulas e equações
1. Misturas de gases ideais
Uma mistura gasosa é uma mistura mecânica de vários gases que não interagem quimicamente uns com os outros. Cada um dos gases na mistura é chamado de componente gasoso; comporta-se como se não houvesse outros gases na mistura, ou seja, uniformemente distribuídos por toda a mistura. A pressão exercida por cada gás da mistura nas paredes do recipiente é chamada de pressão parcial. A lei básica para misturas de gases ideais é a lei de Dalton, segundo a qual a pressão da mistura é igual à soma das pressões parciais dos gases que formam a mistura:
2. Energia interna
A energia interna do corpo é uma combinação da energia cinética do movimento das micropartículas que compõem o corpo e sua energia potencial. interação definida. forças de atração ou repulsão mútua. É impossível determinar o valor absoluto da energia interna, portanto, nos cálculos termodinâmicos, não é o valor absoluto da energia interna que é calculado, mas sua mudança, ou seja,
![]() ou
ou ![]()
onde U 1 e U 2 - a energia interna do estado inicial e final do fluido de trabalho (gás);
u 1 e e 2 - batidas. energia interna do estado inicial e final do fluido de trabalho.
Segue-se disso que a mudança na energia interna não depende da natureza e do caminho do processo, mas é determinada pelo estado do fluido de trabalho no início e no final do processo de mudança.
Uma característica de um gás ideal é a ausência de forças de interações moleculares nele e, portanto, a ausência de energia potencial interna, ou seja, U n \u003d 0 e U „ \u003d 0. Portanto, a energia interna de um gás ideal:
U=U k =f(T) unu u=uk =f(T).
H. Trabalho de gás.
Em termodinâmica, qualquer mudança no estado do fluido de trabalho como resultado da troca de energia com meio Ambiente chamado de processo. Nesse caso, os principais parâmetros do corpo de trabalho são alterados:
A transformação de calor em trabalho mecânico está associada ao processo de mudança do estado do fluido de trabalho. Os processos de mudança do estado de um gás podem ser processos de expansão e contração. Para uma massa arbitrária de gás M (kg), o trabalho é igual a:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
onde l \u003d p (v 2 -v 1) J / kg é o trabalho de 1 kg de gás ou trabalho específico.
4. Entalpia do gás,
A entalpia é um parâmetro que caracteriza a energia potencial da conexão do fluido de trabalho (gás) com o meio ambiente. Entalpia e entalpia específica:
I \u003d U + pV, J e i i \u003d e + pv, J / kg.
5. Capacidade de calor.
A capacidade calorífica específica é a quantidade de calor que deve ser fornecida a 1 kg de gás para aquecê-lo em 1 ° C em uma determinada faixa de temperatura.
A capacidade de calor específico é massa, volumétrica e quilomol. Existe uma conexão entre as capacidades caloríficas de massa C, volume C e quilomol C:
 ;
; 
onde Vo 22,4 m 3 / kmol - batidas. volume de gás em condições normais.
Massa ud. capacidade calorífica da mistura gasosa:

Volumétrico calor específico mistura de gases:

Calor específico quilomolar da mistura gasosa:

6. Equação para determinar a quantidade de calor
A quantidade de calor liberada ou recebida pelo fluido de trabalho (gás) pode ser determinada pela equação:
Q \u003d M C m (t 2 -t 1), J ou Q \u003d VC (t-t), J, onde M e V são a quantidade de peso ou volume de gás, kg ou m 3;
t u t - temperatura do gás no final e no início do processo ° С;
C e C - batimentos médios de massa e volume. capacidade calorífica do gás
Em t cp \u003d J / kgK ou J / m 3 K
7. Primeira lei da termodinâmica
Esta lei considera as interconversões de calor e trabalho mecânico. De acordo com esta lei, o calor é convertido em trabalho mecânico e vice-versa, o trabalho mecânico em calor em quantidades estritamente equivalentes. A equação de equivalência para calor e trabalho tem a forma:
Levando em conta o princípio da equivalência de calor e trabalho, a equação de balanço de calor para uma massa arbitrária de gás:
Q \u003d U + L e q \u003d u + l \u003d u -u + l
Solução de problemasII
Tarefa #1 (#1)
O ar seco atmosférico tem a seguinte composição de massa aproximada: g 02 =23,2%, g N 2 =76,8%.
Determine a composição volumétrica do ar, sua constante gasosa, peso molecular aparente, pressão parcial de oxigênio e nitrogênio, se o ar é P = 101325 Pa usando um barômetro.
Eu determino a composição volumétrica do ar:
 ;
; ;
;
onde r é a fração de massa;
m é o peso molecular relativo;
g é a fração de volume.
m ar. =mO2rO2 +mN2rN2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
onde R 0 é a constante do gás.
Eu determino as pressões parciais de vários gases:
P O 2 \u003d P cm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
onde PO 2 , P N 2 - pressão parcial;
P cm é a pressão da mistura.
Tarefa #2 (#2)
O recipiente é dividido por uma divisória em 2 partes, cujos volumes são V 1 = 1,5 m 3 e V 2 = 1,0 m 3 . A primeira parte do volume V 1 contém CO 2 em P 1 =0,5 MPa et 1 =30°C; a segunda parte do volume V 2 contém O 2 em P 2 =0,2 MPa et 2 =57°C. Determine as frações de massa e volume de CO 2 e O 2, o peso molecular aparente da mistura e sua constante de gás depois que a partição é removida e o processo de mistura é concluído.
Eu determino constantes de gás individuais:
Para fazer isso, determino o peso molecular relativo: m (CO 2) \u003d 32 + 12 \u003d 44; m(O2)=32;

 ;
;
![]()
 ;
;
De acordo com a equação característica de Klaiperon, determino as massas dos gases:
 (kg);
(kg);
 (kg);
(kg);
Eu determino as frações de massa:


Eu determino as frações de volume:


Determine o peso molecular aparente do ar:
m ar. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 \u003d 41,48;
Eu determino a constante de gás individual para o ar (R):

 ;
;
Tarefa #3 (#6)
Em um recipiente com um volume de 300 l, há oxigênio a uma pressão P 1 \u003d 0,2 MPa e t 1 \u003d 20 0 C. Quanto calor deve ser fornecido para que a temperatura do oxigênio suba para t 2 \u003d 300 0 C ? Que pressão será estabelecida no vaso? Para cálculo, tome o calor específico volumétrico médio do oxigênio em n.o. C 02 \u003d 0,935 
De acordo com a lei de Charles, determino a pressão final do processo:
;  (Pa);
(Pa);
onde P, T são parâmetros de gás.
Eu determino a constante de gás individual para o oxigênio (R):

 ;
;
Como o processo é isocórico, determino a quantidade de calor que precisa ser fornecida de acordo com a fórmula apropriada: Q v \u003d M C cv (T 2 -T 1) para isso, de acordo com a equação característica de Claiperon, determino a massa de gás
 (kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
(kg); Q v \u003d M C cv (T 2 -T 1) \u003d 1,27 935 280 \u003d 332486 (J).
Tarefa #4 (#7)
Quanto calor deve ser gasto para aquecer 2m 3 de ar a uma sobrepressão constante P ex. \u003d 0,2 MPa de uma temperatura de 100 0 C a uma temperatura de 500 0 C. Que trabalho o ar fará neste caso? Para o cálculo, tome: pressão atmosférica P at. \u003d 0,1 MPa, capacidade de calor isobárico de massa média do ar C pm \u003d 1,022  ; calcule a constante do gás tendo em mente que o peso molecular aparente do ar M ar. =29.
; calcule a constante do gás tendo em mente que o peso molecular aparente do ar M ar. =29.
Eu determino a constante de gás individual para o ar:

 ;
;
A pressão absoluta é igual à soma do excesso e P=P est atmosférico. + P em. =0,1+0,2=0,3 MPa
 (kg);
(kg);
Como o processo é isobárico, determino Q e L de acordo com as fórmulas correspondentes:
de acordo com a lei de Gay-Lussac, determino o volume final:
 m3;
m3;
Q \u003d M C pm (T 2 -T 1) \u003d 5,56 1022 400 \u003d 2272928 (J);
L \u003d P (V 2 -V 1) \u003d 300000 2,15 \u003d 645000 (J).
Tarefa #5 (#8)
Há ar no cilindro a uma pressão P=0,5 MPa e uma temperatura t 1 =400 0 C. O calor é removido do ar em P=const de modo que no final do processo a temperatura t 2 =0 0 C é O volume do cilindro em que o ar V 1 \u003d 400 l.
Determine a quantidade de calor removida, o volume final, a variação da energia interna e o trabalho perfeito de compressão C pm = 1,028  .
.
Como o processo é isobárico, de acordo com a lei de Gay-Lussac, determino o volume final:
 m3;
m3;
De acordo com a equação característica de Klaiperon, determino a massa de gás:
Do problema anterior R=286,7 
 (kg);
(kg);
Eu determino a quantidade de calor que é liberada:
Q=M C pm (T2-T1)=1,03 1028 (273-673)=-423536 (J);
Eu determino a quantidade de trabalho gasto:
L=P (V 2 -V 1)= 500.000 (0,16-0,4)=-120.000 (J);
A partir da equação pela qual a quantidade total é determinada, determino a mudança na quantidade de energia interna:
![]() ; (J)
; (J)
Problema #6 (#9)
Ar com volume V 1 = 0,02 m3 a uma pressão P 1 = 1,1 MPa e t 1 = 25 s se expande em um cilindro com um pistão móvel até uma pressão P 2 = 0,11 MPa. Encontre o volume final V 2 , a temperatura final t 2 , o trabalho realizado pelo ar e o calor fornecido, se ocorrer a expansão no cilindro:
a) isotermicamente
b) adiabaticamente com expoente adiabático k=1,4
c) politrópico com índice politrópico n=1,3
Processo isotérmico:
P 1 / P 2 \u003d V 2 / V 1
V 2 \u003d 0,02 1,1 / 0,11 \u003d 0,2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1 10 6 0,02Ln(0,2/0,02)=22000 J
processo adiabático:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036M 3
T 2 /T 1 \u003d (P 2 /P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 298 \u003d 20,32k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1,4-1) (1,1 10 6 0,02 -0,11 10 6 0, 1)=2,0275 10 6 J
Processo politrópico:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118M 3
T 2 /T 1 \u003d (P 2 /P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 -P 2 V 2) \u003d (1 / (1,3-1)) (1,1 10 6 0,02 -0,11 10 6 0,118)=30000J
Q=(k-n/k-1) l M=((1,4-1,3)/(1,4-1)) 30000=7500J
Literatura:
1. Energia, Moscou, 1975.
2. Litvin A. M. "Fundamentos teóricos da engenharia de calor", editora "Energy", Moscou, 1969.
3. Tugunov P.I., Samsonov A.A., “Fundamentos de engenharia térmica, motores térmicos e instalações de energia a vapor”, editora Nedra, Moscou, 1970.
4. Krutov V.I., "Heat engineering", editora "Engineering", Moscou, 1986.
Misturas de gases. Capacidade calorífica dos gases
As misturas gasosas são entendidas como uma mistura mecânica de vários gases que não interagem quimicamente entre si. Uma mistura de gases ideais obedece a todas as leis relativas à gases ideais. A composição da mistura gasosa é determinada pela quantidade de cada um dos gases incluídos na mistura e pode ser especificada por frações de massa ou volume:
onde é a massa do -ésimo componente, é o volume do -ésimo componente e e são a massa e o volume de toda a mistura, respectivamente.
É óbvio que
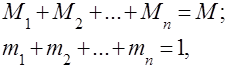
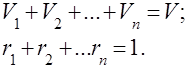
Para a conveniência de resolver problemas práticos com misturas de gases, é introduzido o conceito de peso molecular aparente de uma mistura de gases, que é a massa média dos pesos moleculares reais dos componentes individuais da mistura.
A equação de estado para uma mistura de gases tem a forma:
As misturas de gases estão sujeitas ao conceito de constante universal de gás
A relação entre a pressão de uma mistura gasosa e a pressão parcial dos componentes individuais incluídos na mistura é estabelecida pela lei de Dalton:
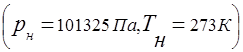
1 gás tem uma massa diferente dependendo da pressão e da temperatura. A este respeito, a capacidade calorífica volumétrica é sempre referida à massa de gás contida em 1 em condições normais. Nesse caso, o volume de 1 kmole de vários gases é 22,4 / kmol e a constante universal do gás é . Dependendo do método de fornecimento de calor ao gás, existem capacidades térmicas isobáricas e isocóricas. A razão dessas quantidades é chamada de expoente adiabático
As capacidades caloríficas e também estão relacionadas pela relação de Mayer
A quantidade de calor que deve ser gasta no processo de aquecimento de 1 kg de gás na faixa de temperatura de a é determinada pela fórmula:
onde e são, respectivamente, as capacidades caloríficas médias dentro de 0°- e 0°-.
Se (kg) ou () gás estiver envolvido no processo, então
A capacidade calorífica da mistura gasosa deve ser determinada pelas fórmulas:
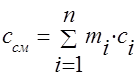
massa - ;
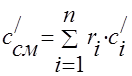
volumétrico -;
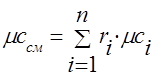
molares - .
Para aproveitar o calor dos gases que são produtos da combustão do combustível na unidade da caldeira, são instalados aquecedores de ar do ar necessário para a combustão do combustível nos dutos de gás desta última (Fig. 1). Os gases que saem da caldeira entram no aquecedor de ar com uma temperatura e são resfriados, liberando calor para o ar, até. No duto de gás da unidade da caldeira, sob a influência da operação do exaustor de fumaça, uma pressão é ajustada ligeiramente abaixo da atmosférica. O ar no aquecedor de ar é aquecido de temperatura para temperatura.
gases de combustão
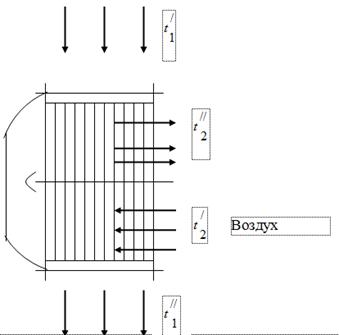
Ao testar a unidade da caldeira, foram obtidos os seguintes dados:
A temperatura dos gases na entrada do aquecedor de ar, = 450 °C.
A temperatura dos gases na saída do aquecedor de ar, = 150 ° C.
Temperatura do ar na entrada do aquecedor de ar, = 26 ° C.
Temperatura do ar na saída do aquecedor de ar, = 260 ° C.
Composição volumétrica dos gases de combustão - = 11,5%; = 6,5%; = 17,2%; = 64,8%
O consumo horário de gases é de 50 ·/h.
Vácuo no duto de gás - 15 mm de água. Arte.
Pressão barométrica 760 mm Hg. Arte.
Definir:
peso molecular aparente dos gases de combustão;
constante do gás de combustão;
frações de peso (massa) de componentes individuais que compõem os gases de combustão;
pressões parciais dos componentes:
fluxo de ar por hora.
Suponha que todo o calor liberado pelo gás seja absorvido pelo ar.
A dependência da capacidade calorífica com a temperatura é considerada curvilínea.
1. Peso molecular aparente dos gases de combustão
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Constante do gás de combustão
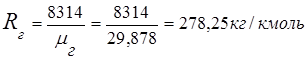
3. Frações de massa componentes de gás
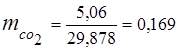
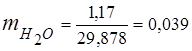
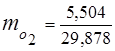
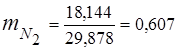
4. Pressões parciais dos componentes
Os resultados do cálculo serão inseridos na tabela
|
Opções |
mistura de gás |
|||
|
|
||||
|
|
||||
|
|
5. Consumo de ar por hora
O consumo de ar é determinado a partir da equação de balanço de calor do aquecedor de ar
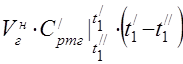
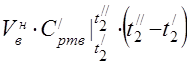
capacidade calorífica molar média a 450 °C
A capacidade de calor específico médio dos componentes na faixa de temperatura de 0 ... 450 ° C.













 .
(1.28)
.
(1.28)