gāzu maisījumi. Gāzu siltumietilpība. Degviela, gāzu maisījumi un siltuma jauda
1.3. Ideāls gāzes stāvokļa vienādojums
Stāvokļa vienādojumu (1.1) forma reālām vielām ir diezgan sarežģīta.
Šajā sakarā termodinamikā tiek izmantoti vienkāršoti darba ķermeņu fizikālie modeļi.
Darba šķidrumiem gāzveida stāvoklī ir vienkāršākais un vēsturiski pirmais modelis ideāla gāze. Ideāla gāze ir gāze, kurā nepastāv starpmolekulārās mijiedarbības (pievilkšanas un atgrūšanas) spēki, un pašas molekulas tiek uzskatītas par materiālie punkti. Ideāla gāze pakļaujas Klaiperona vienādojums– Mendeļejevs
kur m ir gāzes masa sistēmā; μ ir gāzes molārā masa; Rμ = 8314 J/(kmol K) ir universālā gāzes konstante, kas nav atkarīga no gāzes veida vai no tās pastāvēšanas apstākļiem. Stāvokļa vienādojumu (1.2) iegūst, apvienojot Boila-Mariotas likumi un Gejs Lussaksņemot vērā Avogadro likums.
Molārā masa μ = m/n, kg/mol, ir vielas masa, kas ņemta viena mola daudzumā. 1 mol ir vielas daudzuma vienība, kas satur tikpat daudz daļiņu kā 12 grami oglekļa. Vielas daudzums– n = N/N A, kurmis, kur N ir daļiņu (atomu, molekulu) skaits, N A ≈ 6,02 10 23 - atomu skaits 12 gramos oglekļa ( Avogadro numurs). Skaitliski μ = Мr 10 -3 , kur Mr ir vielas relatīvā molekulmasa ( cilne. Mendeļejevs) (piemēram: =2 kg/kmol).
Konkrētā izteiksmē (t.i., 1 kg gāzes) vienādojumam (1.2) būs šāda forma
kur R– īpatnējā gāzes konstante, J/(kg K).
Izskaidrosim konkrētās gāzes konstantes fizisko nozīmi R. Pirmā stāvokļa vienādojums (1.2) tiks uzrakstīts kā , otrajam stāvoklim pie tāda paša spiediena - . Atņemiet pirmo vienādojumu no otrā vienādojuma un atrodiet, ka , t.i. Īpatnējā gāzes konstante ir darbs, ko veic 1 kg gāzes, kad tā tiek uzkarsēta par 1 grādu nemainīgā spiedienā.
Eksperimentālie dati liecina, ka īsta gāze ir tuvāk ideālajai gāzei, jo mazāks ir tās blīvums. Citiem vārdiem sakot, samazinoties noteikta gāzes daudzuma tilpumam, ko izraisa spiediena palielināšanās vai temperatūras pazemināšanās, jebkura gāze radīs arvien vairāk novirzes no ideālās gāzes īpašībām. Tādējādi saskaņā ar jēdzienu "ideāla gāze" ir piemērotas visas reālās gāzes augstā temperatūrā un zemā spiedienā.
1.4. Maisījumi ideālās gāzes
Praksē darba šķidrums bieži ir viendabīgu gāzu (piemēram, gaisa) maisījums, no kurām katru var uzskatīt par ideālu un kuras neietilpst ķīmiskās reakcijas.
Šāds maisījums ir arī ideāla gāze un atbilst maisījuma stāvokļa (1.2) vienādojumam
kur R=R μ / μ ir maisījuma gāzes konstante; μ ir maisījuma vidējā (šķietamā) molārā masa(nosacīta vērtība, kas attiecas uz viendabīgu reprezentatīvu gāzi, kurā molekulu skaits un kopējā masa ir vienādi ar molekulu skaitu un maisījuma masu).
Maisījuma masa ir vienāda ar visu sastāvdaļu masu
Galvenais likums, kas nosaka gāzu maisījuma uzvedību, ir Daltona likums:
katra atsevišķa gāze gāzu maisījumā uzvedas tā, it kā tā viena pati maisījuma temperatūrā aizņemtu visu maisījuma tilpumu,
katrai atsevišķai gāzei, kas nonāk gāzu maisījumā, ir tāds pats spiediens, kāds tas būtu, ja tā viena pati aizņemtu visu gāzu maisījuma tilpumu.
Līdz ar to vērtība R(absolūtais maisījuma spiediens) ir definēts kā
kur R i – daļējs spiediens i th komponents, t.i. spiediens, kas būtu i komponents, ja tas viens pats aizņēma visu maisījuma tilpumu tajā pašā temperatūrā ().
Maisījuma sastāvu nosaka pēc maisījuma sastāvdaļu masas vai molu daļām, kā arī pēc tilpuma daļām (koncentrācijām).
Masas daļa ir katras gāzes masas attiecība pret kopējo maisījuma masu: .
Vienādojums (1.3) nozīmē, ka .
Tilpuma daļa sauc par attiecību daļējs apjoms(tilpums, ko gāze aizņemtu, ja tās spiediens un temperatūra būtu vienādi ar gāzu maisījuma spiedienu un temperatūru, t.i.) uz kopējo gāzu maisījuma tilpumu:. No daļējā spiediena un tilpuma un temperatūras noturības definīcijām izriet:
![]() (1.5)
(1.5)
Summējot pēdējo vienādību pār visām maisījuma sastāvdaļām, iegūstam , t.i. gāzu daļējo tilpumu summa, kas veido maisījumu, ir vienāda ar gāzu maisījuma tilpumu.
Tilpuma daļu summa ir vienāda ar vienu: .
molu daļa komponentu sauc par katras gāzes vielas daudzuma attiecību n i līdz vielas daudzumam gāzu maisījumā n. No attiecībām un un Avogadro likums(vienādos daudzumos dažādu ideālo gāzu vienādās temperatūrās un vienādos spiedienos ir ietverts vienāds skaits molekulu, t.i.) notiek šādi:
tie. maisījuma norādīšana pēc molu daļām ir līdzvērtīga tā tilpuma daļu norādīšanai.
Masas un tilpuma daļas ir saistītas ar attiecību:
![]() .
.
Ja maisījumu dod masas daļās g i, tad maisījuma gāzes konstanti un maisījuma molāro masu aprēķina šādi:
![]()
![]()
Ja maisījumu norāda tilpuma daļās r i, tad maisījuma molārās masas un maisījuma gāzes konstantes aprēķināšanas formulas ir šādas:
![]() (1.6)
(1.6)
Gāzu parciālo spiedienu un tilpumu nosaka ar Boiles likums–marriotte(pie nemainīgas gāzes temperatūras gāzes spiediena un tilpuma reizinājums ir nemainīga vērtība, t.i.):
![]() .
.
testa jautājumi
Starptautiskā mērvienību sistēma (SI) un tās pamatvienības.
Termodinamiskie pamatparametri un to izmēri.
Ko nozīmē termodinamiskās sistēmas līdzsvara stāvoklis?
Līdzsvara un nelīdzsvara stāvokļu jēdziens.
Kāds ir sistēmas stāvokļa vienādojums?
Sistēmas stāvokļa ģeometriskā interpretācija, termodinamiskais process.
Kas ir ideāla gāze? Kāda ir atšķirība starp ideālo gāzi un reālo?
Kāda ir gāzes konstante? Tās fiziskā nozīme, dimensija un definīcijas metodes.
2. Siltuma jauda
Siltuma vēstījums darba ķermenim jebkurā procesā izraisa tā stāvokļa izmaiņas, un parasti to pavada temperatūras izmaiņas. Temperatūras izmaiņas, kā arī jebkurš cits darba šķidruma stāvokļa parametrs nav atkarīgs no procesa veida, bet ir atkarīgs no tā sākuma ( 1 ) un pēdējais ( 2 ) valstis, t.i. (elementāram procesam parametra izmaiņas tiek aizstātas ar tā diferenciāli).
Siltuma daudzuma attiecība δ J informēts ķermenis līdz ķermeņa temperatūras izmaiņām dT elementārā termodinamiskā procesā sauc patiesā siltuma jaudaķermeņi šajā procesā:
Šeit esošais apakšindekss norāda uz faktu, ka siltuma jauda, tāpat kā siltums, ir atkarīga no procesa rakstura. Turklāt siltuma jauda ir atkarīga no ķermeņa daudzuma un tā termodinamiskā stāvokļa. Jāņem vērā arī tas, ka šajā procesā nemainās organisma ķīmiskais sastāvs, nenotiek vielas pāreja no viena agregācijas stāvokļa citā, nenotiek komponentu izšķīšana utt.
Atkarībā no izvēlētās vielas daudzuma vienības izšķir masas, tilpuma un molārās īpatnējās siltumietilpības:
Praksē visbiežāk tiek izmantots masu siltumietilpības jēdziens.
2.1. Patiesa un vidēja siltuma jauda
Reālas vielas siltumietilpība nav nemainīga vērtība. Tas mainās līdz ar temperatūru, un šī atkarība var būt ļoti nozīmīga (2.1. att.).
Konkrēto procesa siltuma daudzumu aprēķina pēc formulas
Šīs vērtības noteikšanai tiek izmantotas šādas metodes:
saskaņā ar eksperimenta rezultātiem siltumietilpības atkarība no temperatūras tiek attēlota kā tuvinājuma polinoms
kur ir aproksimācijas koeficienti. Šie koeficienti ir norādīti atsauces literatūrā. Tad
praktiskajos aprēķinos temperatūras diapazonā t 1 , t 2 siltuma jauda tiek uzskatīta par nemainīgu vērtību, kas vienāda ar
sauca vidējā siltuma jaudašajā intervālā, atšķirībā no patiesās siltuma jaudas, kas ieviesta (2.1). Atsauces dati norāda vidējo siltuma jaudu no 0 līdz fiksētai temperatūrai t iegūti empīriski, t.i.
Vidējā siltuma jauda temperatūras diapazonā t 1 , t 2 saskaņā ar šiem atsauces datiem var aprēķināt pēc formulas
Tad konkrēts daudzums procesa siltums ir definēts kā
2.2. Izohoriskās un izobariskās siltuma jaudas
tiem ir liela nozīme termodinamikā.
izohoriskssiltuma jauda
vienāds ar siltuma daudzuma attiecību procesā nemainīgā tilpumā pret ķermeņa temperatūras izmaiņām,
izobariskssiltuma jauda
vienāds ar siltuma daudzuma attiecību procesā pie nemainīga spiediena pret ķermeņa temperatūras izmaiņām.
Termotehniskajos aprēķinos tiek izmantotas tabulas, kas parāda skaitliskās vērtības, kas iegūtas eksperimentāli konkrētām izobariskām un izohoriskām siltuma kapacitātēm dažādām vielām atkarībā no temperatūras.
2.3. Gāzu maisījumu siltumietilpība
Aprēķinos bieži vien ir jārisina gāzu maisījumi, un siltumietilpības tabulās ir norādītas tikai atsevišķām gāzēm.
Ja gāzu maisījumu uzrāda masas daļās g i, tad maisījuma īpatnējās masas siltumietilpības nosaka pēc formulām
![]()
Ja gāzu maisījumu uzrāda tilpuma daļās r i, tad maisījuma īpatnējās tilpuma siltumietilpības nosaka pēc formulām
![]()
testa jautājumi
Pierakstiet īpatnējās siltumietilpības mērvienības.
Kā tiek ieviests vidējās siltumietilpības jēdziens?
3. Enerģijas nezūdamības un transformācijas likums
Enerģijas jēdziens ir saistīts ar matērijas kustību.
Enerģijai var būt dažādi veidi – mehāniskais darbs, siltums, ķīmiskā enerģija, elektrisko un magnētisko lauku enerģija.
Termodinamiskajā procesā vides un slēgtas termodinamiskās sistēmas mijiedarbība tiek veikta, apmainoties ar enerģiju siltuma un mehāniskā darba veidā.
3.1. Iekšējā enerģija
Jebkurai videi ir zināma rezerve iekšējā enerģijaU(J), kas tehniskajā termodinamikā tiek attēlota kā vides molekulu un atomu kinētiskās un potenciālās enerģijas summa. Šo daļiņu kinētisko enerģiju nosaka to ātrums un masa, savukārt potenciālo enerģiju nosaka to savstarpējās mijiedarbības spēki, kas ir atkarīgi no to relatīvā stāvokļa. Sistēmas iekšējā enerģija ir enerģija, kas atrodas pašā sistēmā. Tas nozīmē, ka iekšējā enerģija var raksturot ķermeņa stāvokli kopā ar daudzumiem R, V, T.
Iekšējai enerģijai piemīt aditivitātes īpašība, t.i. Sarežģītas sistēmas iekšējā enerģija ir vienāda ar tās sastāvdaļu iekšējo enerģiju summu:
Par 1 kg vielas iekšējo enerģiju sauc specifiska iekšējā enerģija u= U/ m (J/kg).
Lielākajai daļai termodinamikas tehnisko lietojumu absolūtā vērtība nav svarīga U, un šīs vērtības izmaiņas. Tāpēc viendabīgas sistēmas iekšējās enerģijas kvantitatīvā definīcija bieži tiek noteikta attiecībā uz kādu konvencionāli izvēlētu standarta stāvokli.
3.2. Enerģijas nezūdamības likums termodinamikā
Veicot termodinamisko procesu, slēgta sistēma mijiedarbojas ar ārējo vidi (ārējiem ķermeņiem un laukiem), t.i. apmainās ar enerģiju. Tehniskajā termodinamikā tiek aplūkoti divi enerģijas pārneses veidi - pārnesot siltumu un veicot mehānisko darbu.
Siltuma pārnese notiek starp dažādu temperatūru ķermeņiem, kas nonāk saskarē, vai starp ķermeņiem ar dažādu temperatūru, kas atrodas attālumā, izmantojot elektromagnētiskos viļņus ( termiskais starojums). Raidījums siltumu notiek molekulārā (mikrofizikālā) līmenī bez redzamas ķermeņu kustības.
Enerģijas pārnešana darba veidā notiek, visa ķermeņa vai tā daļas kustībā telpā. Ar šo metodi ķermenis vai nu pārvietojas spēka laukā, vai arī maina tilpumu ārējā spiediena ietekmē. Darbs ir makrofizikāls enerģijas pārneses veids.
Jāņem vērā, ka siltums un darbs atšķirībā no ķermeņa enerģijas nav tā stāvokļa funkcijas, bet ir atkarīgi no procesa veida, nosaka šo procesu, t.i. ir paša procesa funkcijas.
Daudzu eksperimentu un novērojumu rezultātā tika atklāts dabas pamatlikums - enerģijas nezūdamības likums: enerģija dabā nerodas no nekā un nepazūd, vai enerģijas daudzums nemainās, tas mainās tikai no vienas formas uz otru, vai
kur J ir procesā iesaistītais siltums; L- paveiktais darbs; Δ E ir sistēmas enerģijas izmaiņas. Šeit un tālāk mēs piekrītam apsvērt:
strādāt pozitīvs ja šo darbu veic darba iestāde, un negatīvs, ja tiek veikts darbs pie sistēmas darba korpusa;
ķermenim piegādāts siltums pozitīvs, un piešķirtais - negatīvs
turklāt jebkura stāvokļa parametra izmaiņas gala procesā tiks apzīmētas ar simbolu Δ (delta), un elementārajā procesā - d(attiecīgā parametra diferenciālis). Jebkuram galīgam termodinamiskam procesam stāvokļa parametra izmaiņas (spiediens, temperatūra, iekšējā enerģija, entalpija, entropija utt.) nav atkarīgas no procesa veida, bet tiek noteiktas pēc sākuma un beigu stāvokļiem.
Kopumā termodinamiskai sistēmai ir iekšējā enerģija U, kinētiskā enerģija (termodinamikā sistēma tiek uzskatīta par veselumu, kas kustas ar ātrumu w) – mw 2/2, potenciāls - mgz (z ir augstums, kādā sistēma atrodas). Kopējās enerģijas izmaiņas procesā 1 –2 var iedomāties šādi:
Šajā procesā paveiktais darbs ir darba summa L par, kas saistīts ar sistēmas darba šķidruma tilpuma izmaiņām (deformācijas darbs), darbs L dv par sistēmas kustību telpā, tehniskais darbs L tie (pārvietojot sistēmu dažādās tehniskās ierīcēs, piemēram, dzinējā, tvaika katlā, kompresorā utt.), darbojas pret berzes spēkiem L tr:
L \u003d L aptuveni + L dv + L tie + L tr.
Procesā iesaistītais siltums ir siltuma summa Jārējs, iesaistīts apmaiņā ar ārējo vidi, un berzes siltums J tr:
J = Jārējā + J tr.
Atsaucoties uz J tr = L tr (daudzi eksperimenti ir parādījuši, ka plūsmas darbs, kas tiek iztērēts berzes pārvarēšanai, pilnībā pārvēršas siltumā, ko uztver plūsma), enerģijas nezūdamības likums termodinamikā uz 1 kg strādājošas viendabīgas vielas (t.i., īpatnējās masas vērtībās). ) elementārā procesā var uzrakstīt:
![]() , (3.1)
, (3.1)
(ārējais indekss izlaists kā nevajadzīgs).
Jāuzsver, ka (3.1) labajā pusē zem diferenciāļa zīmes atrodas stāvokļa funkcijas, bet pārējās ir lielumi, kas ir atkarīgi no termodinamiskā procesa rakstura. Tā kā darbs un siltums ir procesa, nevis stāvokļa funkcijas, zīme δ apzīmē tikai to, ka elementārā procesā lielumi, kas seko tam, ir patvaļīgi bezgalīgi mazi, nevis kādu konkrētu funkciju pieaugumi. Tādējādi δ q un δ l-elementāri (t.i., kas atbilst bezgalīgi mazām sistēmas stāvokļa izmaiņām) siltuma un darba daudzumu.
Ja termodinamiskā sistēma nemaina savu pozīciju telpā un vienīgais darba veids ir darbs, kas saistīts ar sistēmas tilpuma izmaiņām, tad vienādojums (3.1) iegūst vienkāršāku formu:
Darbs δ l par tiek veikta vai nu pret ārējā spiediena spēkiem un pēc tam palielinās darba šķidruma tilpums, vai, gluži pretēji, ārējā vide veic darbu uz ķermeni, to saspiežot. Līdzsvara procesiem, kad vides spiediens ir vienāds ar spiedienu darba šķidrumā, šo darbu aprēķina kā Rdv, kur v ir darba vielas īpatnējais tilpums.
Vienādojums
sauca pirmais termodinamikas likums: siltums, kas tiek piegādāts slēgtai termodinamiskajai sistēmai miera stāvoklī, tiek tērēts, lai mainītu sistēmas iekšējo enerģiju un veiktu darbu, lai mainītu sistēmas tilpumu. Līdzsvara attiecību (3.2) sauc arī par lekcijām ieslēgts teorētiskā literatūra. 1. Baroks: ...
L. A. Elisejeva © Federālā valsts budžeta zinātnes iestāde Krievijas Zinātņu akadēmijas Sibīrijas filiāles valsts publiskā zinātniskā un tehniskā bibliotēka, 2013
RādītājsIzlases pastaigas / A.N. Borodins, I. A. Ibragimovs; zem... 241. Dorogokupets P.I. Termodinamika minerāli un minerālu līdzsvars ... katalogi: apkopojums lekcijas ieslēgts kurss "Atsauce ... valsts tehnisks universitāte. sērija, Tehnisks zinātne. - ...
N. V. Basova [un citi]; red. N. V. Basova. Rostova n/a: Fēnikss, 2008
Mācību grāmataKurss) Rakstisks D. T. Konspekts lekcijas ieslēgts augstākā matemātika [Teksts]: ... Tehnisks termodinamika Rudobašta, S.P. Siltumtehnika [Teksts]: mācību grāmata studentiem. universitātes, kas studē ieslēgts... 2008. - 204 lpp. desmit Borodins, I. F. Tehnoloģisko procesu automatizācija...
Valsts kases zinātnisko darbu saraksts laika posmam no 2008.gada līdz 2013.gada 1.jūnijam (1)
Dokuments... "pētījuma rentgena metodes" Lekcijas ieslēgts klīniskā onkoloģija. Almati... otrā likuma termodinamika» 2-Starptautiskie... un ekspertu apskats tehnisks veselības aprūpes organizāciju aprīkošana ... Krievijas Medicīnas zinātņu akadēmijas akadēmiķis Yu.I. Borodins, Biškeka, 2009, 1. lpp. ...
Inženierpraksē bieži nākas saskarties nevis ar viendabīgām gāzēm, bet ar ķīmiski nesaistītu gāzu maisījumiem. Gāzu maisījumu piemēri ir: atmosfēras gaiss, dabasgāze, gāzveida kurināmā sadegšanas produkti utt.
Gāzu maisījumiem ir spēkā šādi noteikumi.
1. Katrai gāzei, kas nonāk maisījumā, ir noteikta temperatūra, vienāds ar temperatūru maisījumi.
2. Jebkura no maisījumā iekļautajām gāzēm ir sadalīta visā maisījuma tilpumā un tāpēc katras gāzes tilpums ir vienāds ar visa maisījuma tilpumu.
3. Katra no maisījumā iekļautajām gāzēm pakļaujas savam stāvokļa vienādojumam.
4. Maisījums kopumā ir kā jauna gāze un pakļaujas savam stāvokļa vienādojumam.
Gāzu maisījumu izpēte balstās uz Daltona likumu, saskaņā ar kuru nemainīgā temperatūrā maisījuma spiediens ir vienāds ar maisījumā iekļauto gāzu parciālo spiedienu summu:
kur p cm ir maisījuma spiediens;
p i - maisījumā iekļautās i-tās gāzes daļējais spiediens;
n ir maisījumā iekļauto gāzu skaits.
Parciālais spiediens ir spiediens, ko gāze, kas nonāk maisījumā, radīs, ja tā viena pati aizņem visu maisījuma tilpumu tajā pašā temperatūrā.
Gāzu maisījumu iestatīšanas metodes
Gāzu maisījuma sastāvu var norādīt pēc masas, tilpuma un molu daļām.
Masas daļas. Jebkuras maisījumā iekļautās gāzes masas daļa ir šīs gāzes masas attiecība pret maisījuma masu.
m 1 \u003d M 1 / M cm; m 2 \u003d M 2 / M cm; ........; m n \u003d M n / M cm,
kur m 1 , m 2 , ..., m n - gāzu masas daļas;
M 1 , M 2 , ..., M n - atsevišķu gāzu masas;
M cm ir maisījuma masa.
To ir viegli redzēt  un
un  (100%).
(100%).
Apjoma daļas. Jebkuras maisījumā iekļautās gāzes tilpuma daļa ir šīs gāzes samazinātā (daļējā) tilpuma attiecība pret maisījuma tilpumu.
r 1 \u003d V 1 / V cm; r 2 \u003d V 2 / V cm; ........., r n = V n / V cm;
kur V 1 , V 2 , ..., V n - samazināti gāzu tilpumi;
V cm ir maisījuma tilpums;
r 1 , r 2 , ..., r n - gāzu tilpuma daļas.
Samazinātais tilpums ir gāzes tilpums maisījuma apstākļos (maisījuma temperatūrā un spiedienā).
Samazināto tilpumu var attēlot šādi: ja visas gāzes, izņemot vienu, tiek izņemtas no trauka, kurā ir maisījums, un atlikušo gāzi saspiež līdz maisījuma spiedienam, saglabājot temperatūru, tad tās tilpums tiks samazināts vai daļējs.
Var pierādīt, ka maisījuma tilpums būs vienāds ar samazināto gāzu tilpumu summu.
 (100%).
(100%).
Molu daļas. Jebkuras maisījumā iekļautās gāzes molu daļa ir šīs gāzes kilomolu skaita attiecība pret maisījuma kilomolu skaitu.
r 1 \u003d n 1 / n cm; r 2 \u003d n 2 / n cm; ........., r n \u003d n n / n cm,
kur r 1 , r 2 , ..., r n - gāzu molu daļas;
n cm ir maisījuma kilomolu skaits;
n 1 , n 2 , ..., n n ir gāzu kilomolu skaits.
Maisījuma norādīšana pēc molu daļām ir identiska maisījuma norādīšanai pēc tilpuma daļām, t.i. molārajām un tilpuma daļām ir vienādas skaitliskās vērtības katrai maisījumā iekļautajai gāzei.
Gāzes konstante un maisījuma šķietamā (vidējā) molekulmasa. Lai aprēķinātu gāzes maisījuma konstanti, ko dod masas daļas, mēs uzrakstām stāvokļa vienādojumus:
maisījumam
p cm × V cm = M cm R cm T; (1,9)
gāzēm
 .
(1.10)
.
(1.10)
Mēs summējam vienādojuma (1.10) kreiso un labo daļu
(p 1 + p 2 + .... + p n) V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
Jo  ,
,
tad p cm V cm = (M 1 R 1 + M 2 R 2 + ..... + M n R n) T. (1.11.)
Vienādojumi (1.9) un (1.11) norāda uz to
M cm R cm T \u003d (M 1 R 1 + M 2 R 2 + ..... + M n R n) T.
R cm \u003d M 1 / M cm R 1 + M 2 / M cm R 2 + ...... + M n / M cm R n \u003d
M 1 R 1 + m 2 R 2 + ...... + m n R n
vai  ,
(1.12)
,
(1.12)
kur R cm ir maisījuma gāzes konstante.
Tā kā i-tās gāzes gāzes konstante
R i = 8314 / m i ,
tad vienādojumu (1.12) pārraksta šādi:
 .
(1.13)
.
(1.13)
Nosakot gāzu maisījuma parametrus, ir ērti izmantot noteiktu nosacīto vērtību, ko sauc par gāzu maisījuma šķietamo (vidējo) molekulmasu. Maisījuma šķietamās molekulmasas jēdziens ļauj nosacīti uzskatīt maisījumu par viendabīgu gāzi, kas ievērojami vienkāršo aprēķinus.
Atsevišķai gāzei izteiksme
Pēc analoģijas mēs varam rakstīt par maisījumu
m cm R cm = 8314, (1,14)
kur m cm ir maisījuma šķietamā molekulmasa.
No (1.14) vienādojuma, izmantojot izteiksmes (1.12) un (1.13), iegūstam
 ,
(1.15)
,
(1.15)
 .
(1.16)
.
(1.16)
Tādā veidā argumentējot, var iegūt formulas R cm un m cm aprēķināšanai caur tilpuma daļām, formulas masas daļu pārvēršanai tilpuma daļās un, otrādi, tilpuma daļas masas daļās, formulas maisījuma īpatnējā tilpuma u cm aprēķināšanai un maisījuma blīvums r cm caur masas un tilpuma daļām un, visbeidzot, formulas maisījumā iekļauto gāzu parciālā spiediena aprēķināšanai pēc tilpuma un masas daļām. Mēs piedāvājam šīs formulas bez atvasināšanas tabulā.
Gāzu maisījumu aprēķināšanas formulas
|
Maisījuma sastāva iestatīšana |
Pāreja no vienas kompozīcijas uz citu |
Maisījuma blīvums un īpatnējais tilpums |
Maisījuma šķietamā molekulmasa |
Gāzes maisījuma konstante |
Daļējs spiediens |
|
Masas daļas |
|
|
|
|
|
|
Tilpuma daļas |
|
|
|
|
|
Gāzu siltumietilpība
Ķermeņa siltumietilpība ir siltuma daudzums, kas nepieciešams, lai uzsildītu vai atdzesētu ķermeni par 1 K. Vielas daudzuma vienības siltumietilpību sauc par īpatnējo siltumietilpību.
Tātad vielas īpatnējā siltumietilpība ir siltuma daudzums, kas jāpiešķir vai jāatņem no vielas vienības, lai šajā procesā mainītu tās temperatūru par 1 K.
Tā kā turpmāk tiks aplūkotas tikai īpatnējās siltumietilpības, tad īpatnējo siltumietilpību sauksim vienkārši kā siltuma jaudu.
Gāzes daudzumu var norādīt pēc masas, tilpuma un kilomolu skaita. Jāņem vērā, ka, iestatot gāzes tilpumu, šis tilpums tiek normalizēts un mērīts parastajos kubikmetros (nm 3).
Atkarībā no gāzes daudzuma iestatīšanas metodes izšķir šādas siltuma jaudas:
c - masas siltumietilpība, J / (kg × K);
c¢ - tilpuma siltumietilpība, J / (nm 3 × K);
c m - molārā siltuma jauda, J / (kmol × K).
Starp šīm siltuma jaudām pastāv šādas attiecības:
c = c m/m; ar m = ar × m;
с¢ = с m / 22,4; ar m = s¢ × 22,4,
no šejienes  ; s¢ = s × r n,
; s¢ = s × r n,
kur u n un r n - īpatnējais tilpums un blīvums normālos apstākļos.
Izohoriskās un izobariskās siltuma jaudas
Darba šķidrumam nodotā siltuma daudzums ir atkarīgs no termodinamiskā procesa īpatnībām. Atkarībā no termodinamiskā procesa praktiska nozīme ir divu veidu siltumietilpībai: izohoriskajai un izobariskajai.
Siltuma jauda pie u = const ir izohoriska.
c u - masas izohoriskā siltuma jauda,
c¢ u ir tilpuma izohoriskā siltuma jauda,
c m u ir molārā izohoriskā siltuma jauda.
Siltuma jauda pie p = const ir izobāriska.
c p - masas izobāriskā siltuma jauda,
c¢ р - tilpuma izobāriskā siltuma jauda,
c m p - molārā izobāriskā siltumietilpība.
Ar tādām pašām temperatūras izmaiņām procesā, ko veic pie p = const, tiek patērēts vairāk siltuma nekā procesā, kurā u = const. Tas izskaidrojams ar to, ka pie u = const ķermenim nodotais siltums tiek tērēts tikai tā iekšējās enerģijas maiņai, savukārt pie p = const siltums tiek tērēts gan iekšējās enerģijas palielināšanai, gan izplešanās darba veikšanai. Atšķirība starp masas izobarisko un masas izohorisko siltumietilpību saskaņā ar Maiera vienādojumu
c p - c u=R. (1,17)
Ja vienādojuma (1.17) kreiso un labo pusi reizina ar kilomola masu m, tad iegūstam
c m p - c m u= 8314 J/(kmol × K) (1,18)
Termodinamikā un tās pielietojumos liela nozīme ir izobarisko un izohorisko siltumietilpību attiecībai:
 ,
(1.19)
,
(1.19)
kur k ir adiabātiskais eksponents.
Aprēķini liecina, ka vienatomiskām gāzēm k » 1,67, divatomu gāzēm k » 1,4 un trīsatomiskām gāzēm k » 1,29.
Ir viegli redzēt, ka vērtība uz atkarīgi no temperatūras. Patiešām, no (1.17) un (1.19) vienādojumiem izriet, ka
 ,
(1.20)
,
(1.20)
un no vienādojumiem (1.18) un (1.19)
 .
(1.21)
.
(1.21)
Tā kā siltuma jaudas palielinās, palielinoties gāzes temperatūrai, k vērtība samazinās, tuvojoties vienībai, bet vienmēr paliek lielāka par to.
Zinot k vērtību, var noteikt atbilstošās siltumietilpības vērtību. Tā, piemēram, no vienādojuma (1.20) mums ir
 ,
(1.22)
,
(1.22)
un kopš tā laika ar p = k × s u, tad mēs saņemam
 .
(1.23)
.
(1.23)
Līdzīgi molārajām siltumietilpībām iegūstam no vienādojuma (1.21).
 .
(1.24)
.
(1.24)
 .
(1.25)
.
(1.25)
Vidējā un patiesā siltuma jauda
Gāzu siltumietilpība ir atkarīga no temperatūras un zināmā mērā no spiediena. Siltuma jaudas atkarība no spiediena ir maza, un lielākajā daļā aprēķinu tā netiek ņemta vērā. Siltuma jaudas atkarība no temperatūras ir būtiska, un tā ir jāņem vērā. Šo atkarību diezgan precīzi izsaka vienādojums
c = a + iekšā t + et 2, (1,26)
kur, iekšā un e ir vērtības, kas ir nemainīgas konkrētai gāzei.
Bieži siltumtehnikas aprēķinos nelineāro atkarību (1.26) aizstāj ar lineāru:
c = a + iekšā t. (1,27)
|
Ja grafiski konstruēsim siltumietilpības atkarību no temperatūras pēc vienādojuma (1.26), tad tā būs līknes atkarība (1.4. att.). Kā parādīts attēlā, katrai temperatūras vērtībai ir sava siltumietilpības vērtība, ko parasti sauc par patieso siltumietilpību. Matemātiski patiesās siltumietilpības izteiksme tiek uzrakstīta šādi:
|
|
|
|
Tāpēc patiesā siltumietilpība ir bezgalīgi maza siltuma daudzuma dq attiecība pret bezgalīgi mazām temperatūras izmaiņām dt. Citiem vārdiem sakot, patiesā siltumietilpība ir gāzes siltumietilpība noteiktā temperatūrā. Uz att. 1.4., patiesā siltumietilpība temperatūrā t 1 ir norādīta ar t1 un ir attēlota kā segments 1-4, temperatūrā t 2 - ar t2 un ir attēlota kā segments 2-3. No vienādojuma (1.28) iegūstam dq=cdt. (1,29) Praktiskajos aprēķinos mēs vienmēr nosakām siltuma daudzums pie pēdējās izmaiņas |
temperatūra. Ir skaidrs, ka siltuma daudzumu q, kas tiek uzrādīts vielas daudzuma vienībā, kad to karsē no t 1 līdz t 2, var atrast, integrējot (1.29) no t 1 uz t 2.
 .
(1.30)
.
(1.30)
Grafiski integrāli (1.30) izsaka ar apgabalu 4-1-2-3. Ja izteiksmē (1.30) aizvietojam patiesās siltumietilpības vērtību atbilstoši lineārajai atkarībai (1.27), tad iegūstam
 (1.31)
(1.31)
kur  - vidējā siltuma jauda temperatūras diapazonā no t 1 līdz t 2.
- vidējā siltuma jauda temperatūras diapazonā no t 1 līdz t 2.
 ,
(1.32)
,
(1.32)
Tāpēc vidējā siltuma jauda ir galīgā siltuma daudzuma q attiecība pret galīgajām temperatūras izmaiņām t 2 - t 1:
 .
(1.33)
.
(1.33)
Ja, pamatojoties uz 4-3 (1.4. att.), tiek izveidots taisnstūris 4-1¢-2¢-3, kura izmērs ir vienāds ar 4-1-2-3, tad šī taisnstūra augstums būs jābūt vienādam ar vidējo siltuma jaudu, kur  ir temperatūras diapazonā t 1 - t 2 .
ir temperatūras diapazonā t 1 - t 2 .
Parasti vidējo siltuma jaudu vērtības ir norādītas vielu termodinamisko īpašību tabulās. Tomēr, lai samazinātu šo tabulu apjomu, tajās ir norādītas vidējo siltumjaudu vērtības, kas noteiktas temperatūras diapazonā no 0 ° C līdz t ° C.
Ja ir nepieciešams aprēķināt vidējās siltumietilpības vērtību noteiktā temperatūras diapazonā t 1 - t 2, tad to var izdarīt šādi.
Laukums 0a14 zem līknes c \u003d f (t) (1.4. att.) atbilst siltuma daudzumam q 1, kas nepieciešams, lai palielinātu gāzes temperatūru no 0 ° C līdz t 1 ° C.

Līdzīgi laukums 0a23 atbilst q 2, kad temperatūra paaugstinās no 0 o C līdz t 2 o C:

Tādējādi q \u003d q 2 - q 1 (apgabals 4123) var tikt attēlots kā
![]() (1.34)
(1.34)
Aizvietojot q vērtību saskaņā ar (1.34) izteiksmē (1.33), iegūstam formulu vidējai siltumietilpībai jebkurā temperatūras diapazonā:
 .
(1.35)
.
(1.35)
Tādējādi vidējo siltumietilpību var aprēķināt no tabulas vidējām siltumietilpībām, izmantojot vienādojumu (1.35). Turklāt mēs iegūstam nelineāru atkarību c = f(t). Jūs varat arī atrast vidējo siltuma jaudu, izmantojot vienādojumu (1.32), izmantojot lineāro attiecību. Vērtības a un iekšā vienādojumā (1.32) dažādām gāzēm ir dotas literatūrā.
Siltuma daudzumu, kas tiek piegādāts vai izņemts no darba šķidruma, var aprēķināt, izmantojot jebkuru no vienādojumiem:
 (1.36)
(1.36)
 (1.37)
(1.37)
 ,
(1.38)
,
(1.38)
kur 

 - attiecīgi vidējā masa, tilpums un molārā siltumietilpība; M ir gāzes masa; n ir gāzes kilomolu skaits; V n - gāzes tilpums normālos apstākļos.
- attiecīgi vidējā masa, tilpums un molārā siltumietilpība; M ir gāzes masa; n ir gāzes kilomolu skaits; V n - gāzes tilpums normālos apstākļos.
Gāzes tilpumu V n var atrast šādi. Uzrakstījuši stāvokļa vienādojumu dotajiem nosacījumiem: pV = MRT un normāliem apstākļiem: p n V n = MRT n, otro vienādojumu attiecinām uz pirmo:
 ,
,
no šejienes  .
(1.39)
.
(1.39)
Gāzu maisījumu siltumietilpība
Gāzu maisījuma siltumietilpību var aprēķināt, ja ir norādīts maisījuma sastāvs un zināmas maisījumā iekļauto komponentu siltumietilpības.
Lai uzsildītu maisījumu ar masu M cm par 1 K, arī katras sastāvdaļas temperatūra jāpalielina par 1 K. Tajā pašā laikā siltuma daudzums, kas vienāds ar c i M i, tiek iztērēts maisījuma i-tās sastāvdaļas ar masu М i sildīšanai. Visam maisījumam siltuma daudzums  ,
,
kur c i un c cm ir i-tās sastāvdaļas un maisījuma masas siltumietilpības.
Pēdējo izteiksmi dalot ar M cm, iegūstam maisījuma masas siltumietilpības aprēķina formulu:
 ,
(1.40)
,
(1.40)
kur m i ir i-tā komponenta masas daļa.
Līdzīgi argumentējot, mēs atrodam maisījuma tilpuma siltumietilpību c¢ cm un molāro siltumietilpību c m cm:
 (1.41)
(1.41)
kur c¢ i - i-tās komponentes tilpuma siltumietilpība, r i - i-tās komponentes tilpuma daļa,
 ,
(1.42)
,
(1.42)
kur c m i ir i-tā komponenta molārā siltumietilpība,
r i - i-tās sastāvdaļas mola (tilpuma) daļa.
Siltumdzinējos (mašīnās) darba šķidrums ir dažādu gāzu maisījums. Ja maisījuma sastāvdaļas neiesaistās savā starpā ķīmiskās reakcijās un katra sastāvdaļa pakļaujas Klaperona stāvokļa vienādojumam, tad šādu maisījumu uzskata par ideālu gāzi.
Lai aprēķinātu maisījumu, ir jānosaka μ cm - vidējā molārā masa un R c m - maisījuma īpatnējā gāzes konstante. Lai tos noteiktu, ir jāzina maisījuma sastāvs, tas ir, kādi komponenti un kādos daudzumos veido šo maisījumu, kādi parametri ir katrai maisījumā iekļautajai sastāvdaļai.
Katra maisījuma sastāvdaļa uzvedas tā, it kā maisījumā nebūtu citu gāzu, aizņem visu pieejamo tilpumu, kurā atrodas maisījums, seko savam stāvokļa vienādojumam un izdara savu tā saukto daļējo spiedienu uz sienām, savukārt temperatūra no visām maisījuma sastāvdaļām ir vienāda un vienāda ar maisījuma temperatūru.
Saskaņā ar Daltona likumu maisījuma P spiediens ir vienāds ar maisījumā iekļauto atsevišķu sastāvdaļu daļējo spiedienu summu:
kur n ir maisījuma sastāvdaļu skaits.
Saskaņā ar Amaga likumu maisījuma tilpums V ir vienāds ar maisījumā iekļauto atsevišķu komponentu daļējo tilpumu summu maisījuma temperatūrā un spiedienā:
 , (1.21)
, (1.21)
kur - daļējais tilpums, m 3; V- maisījuma tilpums, m 3
Maisījuma sastāvu norāda tilpuma (molārās) vai masas daļās.
I-tā komponenta tilpuma daļa ir komponenta daļējā tilpuma attiecība pret maisījuma tilpumu, t.i., tad maisījuma sastāvdaļu tilpuma daļu summa ir 1, t.i. Ja vērtība ir norādīta %, tad to summa = 100%.
I-tā komponenta molārā daļa n i ir komponenta N i kilomolu skaita attiecība pret maisījuma N kilomolu skaitu, t.i., kur ![]() , , t.i., katras sastāvdaļas un maisījuma kilomolu skaits kopumā ir vienāds ar attiecīgās sastāvdaļas un maisījuma kā veseluma attiecību pret tilpumu, ko aizņem viens kilomols.
, , t.i., katras sastāvdaļas un maisījuma kilomolu skaits kopumā ir vienāds ar attiecīgās sastāvdaļas un maisījuma kā veseluma attiecību pret tilpumu, ko aizņem viens kilomols.
Ņemot vērā, ka ideālajai gāzei vienādos apstākļos ir vienāds kilomolu tilpums, tad pēc aizstāšanas iegūstam:, t.i., ideālām gāzēm molārās un tilpuma daļas ir skaitliski vienādas.
I-tā komponenta masas daļa ir komponenta masas attiecība pret maisījuma masu: , no tā izriet, ka maisījuma masa ir vienāda ar sastāvdaļu masu summu, kā arī komponentu masas daļu summa ir vienāda līdz 1 (vai 100%).
Tilpuma daļu pārvēršana masas daļās un otrādi balstās uz šādām attiecībām:
![]() ,
,
kur ρ = μ / 22,4, kg / m 3.
No tā izriet, ka i-tā komponenta masas daļa tiks noteikta no attiecības:
 ,
,
kur ir maisījuma blīvums, kg / m 3, ir i-tās sastāvdaļas tilpuma daļa.
Nākotnē to var noteikt, izmantojot tilpuma daļas.
 .
.
Blīvums maisījumus tilpuma daļām nosaka no attiecības
 , kur
, kur  , (1.22)
, (1.22)
 .
.
Parciālo spiedienu nosaka pēc formulas:
![]() vai
vai  (1.23)
(1.23)
Komponentu stāvokļa vienādojumiem un maisījumam kopumā ir šāda forma:
![]() ;
;
![]() ,
,
no kurienes pēc pārvērtībām iegūstam par masīvs akcijas
 ,
,  . (1.24)
. (1.24)
Maisījuma blīvums un īpatnējais tilpums masīvs dalīties:
;  . (1.25)
. (1.25)
Lai aprēķinātu daļēju spiedienu, tiek izmantota formula:
 . (1.26)
. (1.26)
Masas daļu pārvēršana tilpuma daļās tiek veikta pēc formulas:
 .
.
Nosakot gāzu maisījuma siltumietilpību, tiek pieņemts, ka, lai uzsildītu (dzesētu) gāzu maisījumu, ir nepieciešams sildīt (atdzesēt) katru no maisījuma komponentiem.
kur Q i =M i c i ∆t ir siltums, kas iztērēts maisījuma i-tās sastāvdaļas temperatūras maiņai, c i ir maisījuma i-tās sastāvdaļas masas siltumietilpība.
Maisījuma siltumietilpību nosaka pēc attiecības (ja maisījumu izsaka masas daļās)
 , līdzīgi
, līdzīgi  . (1.28)
. (1.28)
Maisījuma molārās un tilpuma siltumietilpības, kas izteiktas tilpuma daļās, nosaka ar
 ;
;  ;
;
 ;
; 
Piemērs 1.5 Sausais gaiss pēc masas sastāv no g O2 \u003d 23,3% skābekļa un g N 2 \u003d 76,6% slāpekļa. Noteikt gaisa sastāvu pēc tilpuma (r O2 un r N 2) un maisījuma gāzes konstanti.
Risinājums.
1. No 1. tabulas atrodam kg/kmol un kg/kmol
2. Nosakiet skābekļa un slāpekļa tilpuma daļas:
1. Gaisa (maisījuma) gāzes konstanti nosaka pēc formulas:
 , J/kg K
, J/kg K
Piemērs 1.6. Noteikt siltuma daudzumu, kas nepieciešams, lai uzsildītu gāzu maisījumu ar masu M = 2 kg pie P = const, kas sastāv masas %: , , , , temperatūrai mainoties no t 1 =900 °C uz t 2 = 1200 °C.
Risinājums:
1. Nosakiet gāzes maisījumu veidojošo komponentu vidējo masas siltumietilpību pie P=const un t 1 =900 o C (no P2):
1,0258 kJ/kg K; =1,1045 kJ/kg K;
1,1078 kJ/kg K; =2,1097 kJ/kg K;
2. Nosakām gāzes maisījumu veidojošo komponentu masas vidējo siltumietilpību pie P=const un t 1 =1200 o C (no P2):
1,0509 kJ/kg K; =1,153 kJ/kg K;
1,1359 kJ/kg K; =2,2106 kJ/kg K;
3. Mēs nosakām maisījuma vidējo masas siltumietilpību temperatūras diapazonam: t 2 \u003d 1200 ° C un t 1 \u003d 900 ° C:
4. Siltuma daudzums 2 kg maisījuma uzsildīšanai pie P=const:
Pirmais termodinamikas likums nosaka kvantitatīvu sakarību starp sistēmas iekšējās enerģijas izmaiņām un mehānisko darbu, kas tiek veikts pret vides ārējā spiediena spēkiem darba šķidruma siltuma padeves rezultātā.
Slēgtai termodinamiskajai sistēmai pirmā likuma vienādojumam ir forma
Siltums, kas tiek nodots darba šķidrumam (vai sistēmai), tiek izmantots, lai palielinātu tā iekšējo enerģiju (dU) ķermeņa temperatūras paaugstināšanās dēļ un veiktu ārējo darbu (dL) darba šķidruma izplešanās un tā palielināšanās dēļ. apjoms.
Pirmo likumu var uzrakstīt kā dH=dq+VdP=dq-dL 0,
kur dL 0 \u003d VdP - spiediena maiņas elementāru darbu sauc par noderīgu ārējo (tehnisko) darbu.
dU ir darba šķidruma (sistēmas) iekšējās enerģijas izmaiņas, kas ietver molekulu termiskās kustības enerģiju (translācijas, rotācijas un vibrācijas) un molekulu mijiedarbības potenciālo enerģiju.
Tā kā sistēmas pāreja no viena stāvokļa uz otru notiek siltuma padeves rezultātā, darba šķidrums uzsilst un tā temperatūra paaugstinās par dT un tilpums palielinās par dV.
Ķermeņa temperatūras paaugstināšanās izraisa tās daļiņu kinētiskās enerģijas pieaugumu, un ķermeņa tilpuma palielināšanās izraisa daļiņu potenciālās enerģijas izmaiņas. Rezultātā ķermeņa iekšējā enerģija palielinās par dU, tātad iekšējā enerģija U ir ķermeņa stāvokļa funkcija un to var attēlot kā divu neatkarīgu parametru funkciju U=f 1 (P,V); U = f 2 (P, T), U = f 3 (υ, T). Iekšējās enerģijas izmaiņas termodinamiskā procesā nosaka tikai sākuma (U 1) un beigu (U 2) stāvokļi, t.i.
Diferenciālā formā tiek ierakstītas iekšējās enerģijas izmaiņas
a) kā funkcija no specifiskā tilpuma un temperatūras

b) kā temperatūras funkcija, jo , tad
Praktiskiem aprēķiniem, kuros jāņem vērā C v izmaiņas ar temperatūru, ir empīriskas formulas un īpatnējās iekšējās enerģijas (bieži molāras) tabulas. Ideālām gāzēm maisījuma U m molāro iekšējo enerģiju nosaka pēc formulas
 , J/kmol
, J/kmol
Maisījumam, kas izteikts masas daļās. Pa šo ceļu iekšējā enerģija tur ir sistēmas īpašību un raksturo sistēmas stāvokli.
Entalpija ir termiskā stāvokļa funkcija, ko ieviesa Kamerling-Onnes (uzvarētājs Nobela prēmija, 1913), kas ir sistēmas U iekšējās enerģijas un sistēmas P spiediena un tās tilpuma V reizinājums.
Tā kā tajā iekļautie lielumi ir stāvokļa funkcijas, tāpēc H ir arī stāvokļa funkcija, t.i., H \u003d f 1 (P, V); H = f2 (V, T); H=f3 (P, T).
Entalpijas dH izmaiņas jebkurā termodinamiskajā procesā nosaka sākotnējais H 1 un beigu H 2 stāvoklis, un tas nav atkarīgs no procesa rakstura. Ja sistēma satur 1 kg vielas, tad piemēro īpatnējo entalpiju J/kg.
Ideālai gāzei diferenciālvienādojumam ir šāda forma
attiecīgi īpatnējo entalpiju nosaka pēc formulas
Termodinamikas pirmā likuma vienādojums ir dq=dU+Pdυ, kad vienīgais darba veids ir izplešanās darbs Pdυ=d(Pυ)-υdP, tad dq=d(U+Pυ)-υdP, no kurienes
Praktiskais darbs№ 2
Tēma: Siltuma jauda, entalpija, ideālo gāzu maisījumi, iekšējā enerģija, darbs, termodinamiskie procesi.
Darba mērķis: Teorētiskās apmācības laikā iegūto zināšanu nostiprināšana, iemaņu apgūšana siltumtehnikas aprēķinu īstenošanā.
es Pamatdefinīcijas, formulas un vienādojumi
1. Ideālu gāzu maisījumi
Gāzu maisījums ir vairāku gāzu mehānisks maisījums, kas savstarpēji ķīmiski nesadarbojas. Katru no maisījumā esošajām gāzēm sauc par gāzes sastāvdaļu; uzvedas tā, it kā maisījumā nebūtu citu gāzu, t.i. vienmērīgi sadalīts visā maisījumā. Spiedienu, ko katra maisījuma gāze rada uz trauka sienām, sauc par daļēju spiedienu. Ideālu gāzu maisījumu pamatlikums ir Daltona likums, saskaņā ar kuru maisījuma spiediens ir vienāds ar maisījumu veidojošo gāzu parciālo spiedienu summu:
2. Iekšējā enerģija
Ķermeņa iekšējā enerģija ir ķermeni veidojošo mikrodaļiņu kustības kinētiskās enerģijas un to potenciālās enerģijas kombinācija. definēta mijiedarbība. savstarpējas pievilkšanās vai atgrūšanas spēki. Iekšējās enerģijas absolūto vērtību noteikt nav iespējams, tāpēc termodinamiskajos aprēķinos tiek aprēķināta nevis iekšējās enerģijas absolūtā vērtība, bet gan tās izmaiņas, t.i.
![]() vai
vai ![]()
kur U 1 un U 2 - darba šķidruma (gāzes) sākotnējā un beigu stāvokļa iekšējā enerģija;
u 1 un un 2 - sitieni. darba šķidruma sākotnējā un beigu stāvokļa iekšējā enerģija.
No tā izriet, ka iekšējās enerģijas izmaiņas nav atkarīgas no procesa rakstura un ceļa, bet tās nosaka darba šķidruma stāvoklis pārmaiņu procesa sākumā un beigās.
Ideālas gāzes iezīme ir molekulārās mijiedarbības spēku trūkums tajā un līdz ar to iekšējās potenciālās enerģijas trūkums, t.i. U n \u003d 0 un U „ \u003d 0. Tāpēc ideālas gāzes iekšējā enerģija:
U=U k =f(T) unu u=uk =f(T).
H. Gāzes darbs.
Termodinamikā jebkuras darba šķidruma stāvokļa izmaiņas enerģijas apmaiņas rezultātā ar vidi sauc par procesu. Šajā gadījumā tiek mainīti galvenie darba ķermeņa parametri:
Siltuma pārvēršana mehāniskā darbā ir saistīta ar darba šķidruma stāvokļa maiņas procesu. Gāzes stāvokļa maiņas procesi var būt izplešanās un saraušanās procesi. Patvaļīgai gāzes masai M (kg) darbs ir vienāds ar:
L \u003d M l \u003d Mp (v 2 - v 1) \u003d, J
kur l \u003d p (v 2 -v 1) J / kg ir 1 kg gāzes darbs vai īpašs darbs.
4. Gāzes entalpija,
Entalpija ir parametrs, kas raksturo darba šķidruma (gāzes) savienojuma ar vidi potenciālo enerģiju. Entalpija un specifiskā entalpija:
I \u003d U + pV, J un i i \u003d un + pv, J / kg.
5. Siltuma jauda.
Īpatnējā siltumietilpība ir siltuma daudzums, kas jāpiegādā 1 kg gāzes, lai noteiktā temperatūras diapazonā to uzsildītu par 1 °C.
Īpatnējā siltumietilpība ir masa, tilpums un kilomoli. Pastāv saikne starp masas C, tilpuma C un kilomolu C siltumietilpībām:
 ;
; 
kur Vo 22,4 m 3 / kmol - sitieni. gāzes tilpums normālos apstākļos.
Masu ud. Gāzes maisījuma siltumietilpība:

Tilpuma īpašs karstums gāzes maisījums:

Gāzu maisījuma īpatnējais kilomolārs siltums:

6. Siltuma daudzuma noteikšanas vienādojums
Darba šķidruma (gāzes) izdalītā vai uzņemtā siltuma daudzumu var noteikt ar vienādojumu:
Q \u003d M C m (t 2 -t 1), J vai Q \u003d VC (t-t), J, kur M un V ir gāzes svars vai tilpums, kg vai m 3;
t u t - gāzes temperatūra procesa beigās un sākumā ° С;
C un C - masas un tilpuma vidējie sitieni. gāzes siltumietilpība
Pie t cp \u003d J / kgK vai J / m 3 K
7. Pirmais termodinamikas likums
Šis likums ņem vērā siltuma un mehāniskā darba savstarpējo pārveidi. Saskaņā ar šo likumu siltums tiek pārveidots mehāniskā darbā un otrādi, mehāniskais darbs siltumā stingri līdzvērtīgos daudzumos. Siltuma un darba ekvivalences vienādojumam ir šāda forma:
Ņemot vērā siltuma un darba līdzvērtības principu, siltuma bilances vienādojums patvaļīgai gāzes masai:
Q \u003d U + L un q \u003d u + l \u003d u -u + l
Problēmu risināšanaII
Uzdevums #1 (#1)
Atmosfēras sausajam gaisam ir šāds aptuvens masas sastāvs: g 02 =23,2%, g N 2 =76,8%.
Ar barometru nosaka gaisa tilpuma sastāvu, tā gāzes konstanti, šķietamo molekulmasu, skābekļa un slāpekļa parciālo spiedienu, ja gaiss ir P = 101325 Pa.
Es nosaku gaisa tilpuma sastāvu:
 ;
; ;
;
kur r ir masas daļa;
m ir relatīvā molekulmasa;
g ir tilpuma daļa.
m gaisa. =m O2 r O2 +m N2 r N2 = 32 0,209 + 28 0,7908=6,688+22,14=28,83;

 ;
;
kur R 0 ir gāzes konstante.
Nosaku dažādu gāzu daļējos spiedienus:
P O 2 \u003d P cm r O2 \u003d 101325 0,209 \u003d 21176,9 (Pa);
P N 2 \u003d P cm r N 2 \u003d 101325 0,7908 \u003d 80127,81 (Pa);
kur P O 2, P N 2 - daļējais spiediens;
P cm ir maisījuma spiediens.
Uzdevums #2 (#2)
Kuģis ar starpsienu sadalīts 2 daļās, kuru tilpumi ir V 1 =1,5 m 3 un V 2 =1,0 m 3 . Pirmā tilpuma daļa V 1 satur CO 2 pie P 1 =0,5 MPa un t 1 =30°C; tilpuma V 2 otrā daļa satur O 2 pie P 2 =0,2 MPa un t 2 =57°C. Nosaka CO 2 un O 2 masas un tilpuma daļas, maisījuma šķietamo molekulmasu un tā gāzes konstanti pēc starpsienu noņemšanas un sajaukšanas procesa pabeigšanas.
Es nosaku individuālās gāzes konstantes:
Lai to izdarītu, es nosaku relatīvo molekulmasu: m (CO 2) \u003d 32 + 12 \u003d 44; m(O2)=32;

 ;
;
![]()
 ;
;
Pēc Klaiperona raksturīgā vienādojuma es nosaku gāzu masas:
 (Kilograms);
(Kilograms);
 (Kilograms);
(Kilograms);
Es nosaku masas daļas:


Es nosaku tilpuma daļas:


Nosakiet gaisa šķietamo molekulmasu:
m gaisa. \u003d m O2 r O 2 + m CO2 r CO2 \u003d 32 0,21 + 44 0,79 \u003d 6,72 + 34,74 \u003d 41,48;
Es nosaku individuālo gāzes konstanti gaisam (R):

 ;
;
Uzdevums #3 (#6)
Tvertnē ar tilpumu 300 l ir skābeklis ar spiedienu P 1 \u003d 0,2 MPa un t 1 \u003d 20 0 C. Cik daudz siltuma jāpiegādā, lai skābekļa temperatūra paaugstinātos līdz t 2 \u003d 300 0 C ? Kāds spiediens tiks izveidots traukā? Aprēķiniem ņem skābekļa vidējo tilpuma īpatnējo siltumu pie n.o. C 02 \u003d 0,935 
Saskaņā ar Kārļa likumu es nosaku procesa galīgo spiedienu:
;  (Pa);
(Pa);
kur P, T ir gāzes parametri.
Es nosaku skābekļa individuālo gāzes konstanti (R):

 ;
;
Tā kā process ir izohorisks, es nosaku nepieciešamo siltuma daudzumu pēc atbilstošās formulas: Q v \u003d M C cv (T 2 -T 1) šim, saskaņā ar Klaiperona raksturīgo vienādojumu, es nosaku masu. no gāzes
 (Kilograms); Q v = M C cv (T 2 - T 1) \u003d 1,27 935 280 \u003d 332486 (J).
(Kilograms); Q v = M C cv (T 2 - T 1) \u003d 1,27 935 280 \u003d 332486 (J).
Uzdevums #4 (#7)
Cik daudz siltuma jāiztērē, lai uzsildītu 2m 3 gaisa pie pastāvīga pārspiediena P ex. \u003d 0,2 MPa no 100 0 C līdz 500 0 C temperatūrai. Kādu darbu šajā gadījumā veiks gaiss? Aprēķinam ņem: atmosfēras spiedienu P plkst. \u003d 0,1 MPa, gaisa vidējā masas izobāriskā siltumietilpība C pm \u003d 1,022  ; aprēķina gāzes konstanti, paturot prātā, ka šķietamā gaisa molekulmasa M gaisa. =29.
; aprēķina gāzes konstanti, paturot prātā, ka šķietamā gaisa molekulmasa M gaisa. =29.
Es nosaku individuālo gāzes konstanti gaisam:

 ;
;
Absolūtais spiediens ir vienāds ar pārpalikuma un atmosfēras P=P est summu. + P plkst. =0,1+0,2=0,3 MPa
 (Kilograms);
(Kilograms);
Tā kā process ir izobārs, Q un L nosaku pēc atbilstošajām formulām:
saskaņā ar Gay-Lussac likumu es nosaku galīgo apjomu:
 m 3;
m 3;
Q = M C pm (T 2 - T 1) \u003d 5,56 1022 400 \u003d 2272928 (J);
L = P (V 2 - V 1) = 300 000 2,15 \u003d 645 000 (J).
Uzdevums #5 (#8)
Balonā ir gaiss ar spiedienu P=0,5 MPa un temperatūru t 1 =400 0 C. Siltums tiek noņemts no gaisa pie P=const tā, lai procesa beigās temperatūra t 2 =0 0 C Cilindra tilpums, kurā gaiss V 1 \u003d 400l.
Nosakiet noņemtā siltuma daudzumu, galīgo tilpumu, iekšējās enerģijas izmaiņas un perfektu saspiešanas darbu C pm = 1,028  .
.
Tā kā process ir izobārs, tad saskaņā ar Gay-Lussac likumu es nosaku galīgo tilpumu:
 m 3;
m 3;
Pēc Klaiperona raksturīgā vienādojuma es nosaku gāzes masu:
No iepriekšējās problēmas R=286,7 
 (Kilograms);
(Kilograms);
Es nosaku izdalītā siltuma daudzumu:
Q = M C pm (T2-T 1) = 1,03 1028 (273-673) = -423536 (J);
Es nosaku iztērētā darba apjomu:
L=P (V 2 -V 1) = 500 000 (0,16-0,4) = -120 000 (J);
No vienādojuma, ar kuru nosaka kopējo daudzumu, es nosaku iekšējās enerģijas daudzuma izmaiņas:
![]() ; (J)
; (J)
6. problēma (9. problēma)
Gaiss ar tilpumu V 1 =0,02 m3 pie spiediena P 1 =1,1 MPa un t 1 =25 s izplešas cilindrā ar kustīgu virzuli līdz spiedienam P 2 =0,11 MPa. Atrodiet galīgo tilpumu V 2, galīgo temperatūru t 2, gaisa veikto darbu un piegādāto siltumu, ja notiek cilindra izplešanās:
a) izotermiski
b) adiabātiski ar adiabātisko eksponentu k=1,4
c) politropisks ar politropisko indeksu n=1,3
Izotermisks process:
P 1 / P 2 \u003d V 2 / V 1
V 2 = 0,02 1,1 / 0,11 \u003d 0,2 M 3
Q=L=RMT 1Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1) = 1,1 10 6 0,02 Ln (0,2/0,02) = 22000J
adiabātiskais process:
V 1 / V 2 \u003d (P 2 / P 1) 1 / k
V 2 \u003d V 1 / (P 2 / P 1) 1 / k \u003d 0,02 / (0,11 / 1,1) 1 / 1,4 \u003d 0,1036M 3
T 2 / T 1 \u003d (P 2 / P 1) k-1 / k
T 2 \u003d (P 2 / P 1) k-1 / k T 1 \u003d (0,11 / 1,1) 1,4-1 / 1,4 298 \u003d 20,32 k
C v \u003d 727,4 J / kg k
L \u003d 1 / k-1 (P 1 V 1 -P 2 V 2) \u003d (1 / 1,4-1) (1,1 10 6 0,02 -0,11 10 6 0, 1) = 2,0275 10 6 J
Politropiskais process:
V 1 / V 2 \u003d (P 2 / P 1) 1 / n
V 2 \u003d V 1 / (P 2 / P 1) 1 / n \u003d 0,02 / (0,11 / 1,1) 1 / 1,3 \u003d 0,118M 3
T 2 /T 1 \u003d (P 2 / P 1) n-1 / n
T 2 \u003d (P 2 / P 1) n-1 / n T 1 \u003d (0,11 / 1,1) 1,3-1 / 1,3 298 \u003d 175k
L \u003d 1 / n-1 (P 1 V 1 - P 2 V 2) \u003d (1 / (1,3-1)) (1,1 10 6 0,02 -0,11 10 6 0,118) = 30000J
Q=(k-n/k-1) l M=((1,4-1,3)/(1,4-1)) 30000=7500J
Literatūra:
1. Enerģētika, Maskava, 1975. gads.
2. Litvins A.M. "Siltumtehnikas teorētiskie pamati", izdevniecība "Enerģētika", Maskava, 1969.
3. Tugunovs P.I., Samsonovs A.A., “Siltumtehnikas pamati, siltummašīnas un tvaika enerģijas iekārtas”, izdevniecība Nedra, Maskava, 1970. gads.
4. Krutovs V.I., "Siltumtehnika", izdevniecība "Inženierzinātnes", Maskava, 1986. gads.
Gāzu maisījumi. Gāzu siltumietilpība
Gāzu maisījumi tiek saprasti kā vairāku gāzu mehānisks maisījums, kas savā starpā ķīmiski nesadarbojas. Ideālu gāzu maisījums atbilst visiem likumiem, kas attiecas uz ideālās gāzes. Gāzu maisījuma sastāvu nosaka katras maisījumā iekļautās gāzes daudzums, un to var norādīt pēc masas vai tilpuma daļām:
kur ir --tās sastāvdaļas masa, --tās sastāvdaļas tilpums un un ir attiecīgi visa maisījuma masa un tilpums.
Ir skaidrs, ka
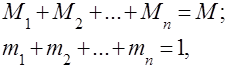
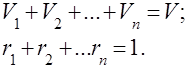
Praktisku problēmu risināšanas ērtībai ar gāzu maisījumiem tiek ieviests gāzu maisījuma šķietamās molekulmasas jēdziens, kas ir maisījuma atsevišķu komponentu faktisko molekulmasu vidējā masa.
Stāvokļa vienādojumam gāzu maisījumam ir šāda forma:
Uz gāzu maisījumiem attiecas universālās gāzes konstantes jēdziens
Attiecību starp gāzu maisījuma spiedienu un maisījumā iekļauto atsevišķu komponentu daļējo spiedienu nosaka Daltona likums:
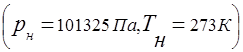
1 gāzei ir atšķirīga masa atkarībā no spiediena un temperatūras. Šajā sakarā tilpuma siltumietilpība vienmēr tiek attiecināta uz gāzes masu, kas normālos apstākļos ir ietverta 1. Šajā gadījumā dažādu gāzu 1 kmol tilpums ir 22,4 / kmol, un universālā gāzes konstante ir . Atkarībā no gāzes siltuma padeves metodes izšķir izobāriskās un izohoriskās siltuma jaudas. Šo lielumu attiecību sauc par adiabātisko eksponentu
Siltuma jaudas un ir saistītas arī ar Mayer attiecību
Siltuma daudzumu, kas jāiztērē 1 kg gāzes sildīšanas procesā temperatūras diapazonā no līdz, nosaka pēc formulas:
kur un ir attiecīgi vidējās siltuma jaudas 0°- un 0°- robežās.
Ja procesā ir iesaistīta (kg) vai () gāze, tad
Gāzes maisījuma siltumietilpība jānosaka pēc formulām:
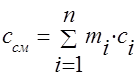
masa - ;
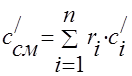
tilpuma -;
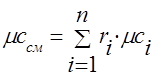
molārs - .
Lai izmantotu gāzu siltumu, kas ir kurināmā sadegšanas produkti katla blokā, tā gāzes kanālos ir uzstādīti kurināmā sadegšanai nepieciešamā gaisa gaisa sildītāji (1. att.). Gāzes, kas iziet no katla, nonāk gaisa sildītājā ar temperatūru un tiek atdzesētas, izdalot siltumu gaisā, līdz. Katla bloka gāzes kanālā dūmu nosūcēja darbības ietekmē tiek iestatīts spiediens nedaudz zem atmosfēras. Gaiss gaisa sildītājā tiek uzkarsēts no temperatūras līdz temperatūrai.
dūmgāzes
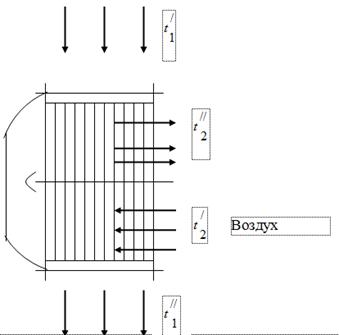
Pārbaudot katla bloku, tika iegūti šādi dati:
Gāzu temperatūra gaisa sildītāja ieplūdē = 450 °C.
Gāzu temperatūra pie gaisa sildītāja izejas, = 150 ° C.
Gaisa temperatūra pie gaisa sildītāja ieplūdes, = 26 ° C.
Gaisa temperatūra pie gaisa sildītāja izejas, = 260 ° C.
Dūmgāzu tilpuma sastāvs - = 11,5%; = 6,5%; = 17,2%; = 64,8%
Gāzu patēriņš stundā ir 50 ·/h.
Vakuums gāzes kanālā - 15 mm ūdens. Art.
Barometriskais spiediens 760 mm Hg. Art.
Definēt:
dūmgāzu šķietamā molekulmasa;
dūmgāzu konstante;
atsevišķu komponentu masas (masas) daļas, kas veido dūmgāzes;
komponentu daļējais spiediens:
stundas gaisa plūsma.
Pieņemsim, ka visu gāzes izdalīto siltumu uzņem gaiss.
Siltuma jaudas atkarība no temperatūras tiek uzskatīta par līklīniju.
1. Dūmgāzu šķietamā molekulmasa
0,115 44 + 0,065 18 + 0,172 32 + 0,648 28 =
5,06 + 1,17 + 5,504 + 18,144 = 29,878
2. Dūmgāzu konstante
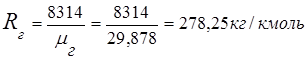
3. Masas daļas gāzes sastāvdaļas
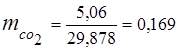
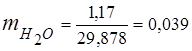
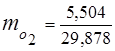
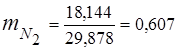
4. Komponentu daļējie spiedieni
Aprēķinu rezultāti tiks ievadīti tabulā
|
Iespējas |
gāzes maisījums |
|||
|
|
||||
|
|
||||
|
|
5. Gaisa patēriņš stundā
Gaisa patēriņu nosaka pēc gaisa sildītāja siltuma bilances vienādojuma
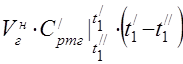
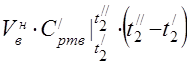
vidējā molārā siltumietilpība pie 450 °C
Komponentu vidējā īpatnējā siltumietilpība temperatūras diapazonā no 0 līdz 450 ° C.













 .
(1.28)
.
(1.28)